Summary
Hier presenteren we een combinatie benadering met behulp van hoge-resolutie microscopie, computationele tools, en single-cell etikettering in levende C. de embryo's van de neurologische om de enige cel dynamiek te begrijpen.
Abstract
Caenorhabditis (C.het is de enige organisme waarin de uitdaging van het begrijpen van de cellulaire oorsprong van een volledig zenuwstelsel kan worden waargenomen, met een enkele cel resolutie, in vivo. Hier presenteren we een geïntegreerd protocol voor het onderzoek van neurologische in C. de embryo's van de. Ons protocol combineert Imaging, lineaging en neuroanatomische tracering van enkelvoudige cellen in het ontwikkelen van embryo's. We bereiken op lange termijn, vier-dimensionale (4D) beeldvorming van levende C. de embryo's van de isotrope met bijna ruimtelijke resolutie door het gebruik van Dual-View omgekeerde selectieve vliegtuig verlichting microscopie (diSPIM). Kernen en neuronale structuren in de nematoden embryo's zijn afgebeeld en isotropically gesmolten om beelden te leveren met een resolutie van ~ 330 nm in alle drie de afmetingen. Deze miniem-door-minieme hoge resolutie 4D gegevensreeksen worden dan geanalyseerd om definitieve cel-Lineage identiteiten met gen uitdrukking en morfologische dynamica bij eencellige en subcellulaire niveaus van detail te correleren. Ons protocol is gestructureerd om modulaire uitvoering van elk van de beschreven stappen mogelijk te maken en studies over embryogenese, genexpressie of neurologische te verbeteren.
Introduction
C. het enige organisme waarin elke cel in het embryo kan worden waargenomen door neurologische. Met de hele cel-Lineage bekend en invariante1, en met de ontwikkeling van nieuwe instrumenten die het mogelijk maken etikettering en continue beeldvorming van enkele cellen in embryo's, biologen kunnen nu beginnen met het onderzoeken van verschillende stappen in de ontwikkeling van de nematode nerveus systeem vanuit alle hoeken-cel geboorte; migratie en differentiatie; neuriet vorming, gerichte uitgroei en Fasciculatie; Synaps vorming; en tuning van functionele schakelingen. Het vastleggen van neuronale uitgroei dynamiek in het C. het embryo, door stabiel uitgedrukte verslaggevers en fluorescentie microscopie te combineren, is waardevol voor de wetenschappelijke gemeenschap.
Ontwikkelingsstudies in C. de varianten maken vaak gebruik van de invariante cel-lineage en de cel-lot kaarten van deze soort om contextueel begrip te vergroten op de single-cell niveau binnen het intacte organisme1. Auto-lineaging analyse-met behulp van StarryNite2,3,4 en AceTree5,6,7,8 software-voordelen van hoog contrast, hoge resolutie beelden van fluorescente kernen. Om optimaal te kunnen werken, is StarryNite/AceTree ook afhankelijk van voorspelbare gespannen oriëntatie van afgebeelde embryo's tijdens de ontwikkeling. Confocale microscopie, gedaan in C. de embryo's die tussen twee-dekglaasjes zijn gecomprimeerd, is al meer dan tien jaar de standaard auto-lineaging microscopie methode, omdat het zowel een hoog contrast/hoge resolutie biedt als een voorspelbare beperkte oriëntatie van het embryo7,8. We hebben eerder beschreven de bouw en het gebruik van een nieuwe licht-Sheet-based Dual-View omgekeerde selectieve vliegtuig Illumination Microscoop (diSPIM) voor Live Sample Imaging zoals C. embryogenese9,10 , 11 , 12 , 13. de licht-blad microscopie, in het algemeen, verstrekt lage fototoxischheid, hoge snelheid, en op lange termijn beeldvorming van levende 3D specimens14,15. De diSPIM methode, in het bijzonder, produceert vier-dimensionale (4D) beelden met bijna isotrope ruimtelijke resolutie van ongeveer 330 nm9.
Vergeleken met confocale microscopie, diSPIM biedt hogere signaal-ruis en snelheid, meer isotrope ruimtelijke resolutie, en is meer geschikt voor lange termijn in vivo Imaging16. We hebben daarom gewerkt aan de aanpassing van diSPIM gegevens voor input in StarryNite/AceTree en onderzocht of dit de lineaging analyses zou verbeteren. Een belangrijke hindernis is dat de diSPIM specimens niet gemakkelijk door eierschaal-compressie kunnen worden beperkt om verwachte richtlijnen voor StarryNite/AceTree goed te keuren. Willekeurige oriëntatie van de cel posities in het volume wordt geanalyseerd degradeert de nauwkeurigheid van de auto-lineaging analyse.
Wij werkten daarom CytoSHOW, een kijker-geleide gebruikersinterface die gebruikers toestaat om nauwkeurige 3D richtlijn van embryo's tijdens pre-processing van diSPIM beelden te selecteren, opbrengend beeldgegevens die zowel kwaliteit-geoptimaliseerde als context-bewust voor input in StarryNite /AceTree. Bij de gebruiker-selectie van afgebeelde embryo's, CytoSHOW orkestreert een geautomatiseerde verwerking van gegevens pijpleiding. Bijgesneden en op de achtergrond afgetrokken embryo beelden worden opgeslagen in TIFF stack bestanden voor elke positie, timepoint en View. CytoSHOW dan iteratief roept het programma SpimFusion te co-register en gezamenlijk deconvolve de twee pre-processed views, met behulp van de Richardson-Lucy17,18 algoritme om isotrope hoge resolutie volumetrische beelden opleveren. Een diSPIM reeks parameters is geoptimaliseerd voor StarryNite om zijn gedrag tijdens beeld-segmentation en kern-volgt in isotropically gesmolten beelden te regeren. Gesmolten beelden en lineaging resultaten worden vervolgens bewerkt met behulp van AceTree, die gebruikers in staat stelt te identificeren en eventuele fouten in de auto-Lineage Trace gegenereerd door StarryNite vast te stellen. AceTree kan ook voorstellen Lineage-boom en 3D gemodelleerde renderings van bijgehouden kernen in het embryo. We vinden dat auto-lineaging snelheid en nauwkeurigheid zijn aanzienlijk verbeterd met behulp van isotropically gesmolten beelden, in vergelijking met RAW-beelden van een van beide SPIM camera. Ons protocol, geoptimaliseerd voor de C. -toepassing die hier wordt beschreven, kan in het algemeen worden aangepast voor auto-Lineaging van diSPIM gegevens die voor andere soorten of specimens worden geproduceerd. Als dit het beoogde gebruik van het protocol is, gelieve te noteren dat extra tuning van de StarryNite parameters waarschijnlijk vereist zal zijn voor nieuwe specimens, zoals beschreven in3,4.
Succesvolle implementatie van dit protocol resulteert in beelden met 4D-isotrope resolutie en stelt biologen in staat om cellen te traceren, terwijl het gelijktijdig identificeren en analyseren van neuronen in de ontwikkelingslanden C. het embryo. Bovendien, door het samenvoegen van verschillende post-processing algoritmen-met hardwareversnelling is de meest tijdrovende van deze-kunnen we nu analyseren zowel fijne subcellulaire Details en de cel-lineages en cel-lot van levende embryo's in wezen real-time. Dit nieuwe protocol staat nauwkeurige, geïnformeerde manipulatie en observatie van het gedrag van de cel toe tijdens bewijzende studies van differentiatie en morfogenese in vivo. In dit manuscript presenteren we een gedetailleerde uitleg van de verbeterde protocollen die we hebben ontwikkeld voor lineaging en Cell tracking in de ontwikkeling van C. de embryo's van de, om studies van embryogenese, genexpressie of neurologische te verbeteren.
Protocol
1. montage van de diSPIM staal Imaging kamer met poly-L-lysine gecoate dekglaasje
Opmerking: de onderstaande stappen zijn allemaal nodig voor het optimaliseren en automatiseren van de Lineage analyse van nematoden embryo's door StarryNite/AceTree. Verschillende opties (aangegeven door als zodanig) kunnen worden weggelaten voor experimenten die wel het traceren van C. de cellen van de lijn van de cel.
- Teken een kleine rechthoek (2mm x 5mm) in het midden van een schone rechthoekige dekglaasje (No. 1,5, 24 mm x 50 mm) met een Sharpie (of een soortgelijke pen).
- Flip de dekglaasje over naar de ongemarkeerde kant en plaats 10 l van poly-L-lysine (cat. no. P1524) over de gemarkeerde rechthoek.
Opmerking: Maak een werkende concentratie van 1 mg/mL poly-L-lysine opgelost in gefilterd water (of gelijkwaardig). Voor opslag op lange termijn, bereidt de hoeveelheid van 5 tot 10 mL en de opslag bij − 20 °C voor. Eenmaal ontdooid kunnen de fracties gedurende 3 – 4 weken bij kamertemperatuur (23 °C) worden opgeslagen. - Laat de poly-L-lysine de vacht van de dekglaasje gedurende 5 minuten (Figuur 1a). Poly-L-lysine wordt gebruikt voor coating glazen deksel slips waar de embryo's zullen worden gemonteerd, waardoor het embryo eierschaal vast te houden aan de dekglaasje, zelfs wanneer de doelstellingen zijn ondergedompeld in de beeldvorming medium.
- Plaats de poly-L-lysine gecoate dekglaasje in de onderste helft van de staal Imaging kamer.
- Plaats de bovenste helft van de staal Imaging kamer op de onderste helft met de dekglaasje en draai met de vier schroeven in verband met de kamer. Controleer visueel van de zijkant om te zorgen dat de bovenste helft gelijkmatig zit in de onderste helft (Figuur 1b).
- Vul de kamer met 7 – 8 mL M9 buffer19, een isotone buffer die helpt voorkomen dat vroege stadium embryo's bezwijken aan abnormale osmotische druk. 1-Cell, en zelfs 2-Cell embryo's zijn osmotisch gevoelig en kan abnormaal te ontwikkelen, zo niet in deze isotone buffer. Embryo's hebben ook de neiging om te arresteren in de 3-voudige fase als M9 wordt vervangen door water.
2. voorbereiding C. de embryo's monsters van
Opmerking: ongeveer 18 uur voorafgaand aan de beeldvorming, vijf jonge (1 dag sinds Final molt) volwassenen en tien larvale fase 4 (L4) C. wordt geplukt naar een nematode groeimedium (NGM) agar plaat gezaaid met E. coli stam OP50. De de draad oogsten worden van het platina gebruikt om larven en jong volwassen C. te bewegen zonder het dier te schaden19.
- Bereid een 1% methylcellulose (cat. no. H7509-25G) oplossing in M9 buffer.
Opmerking: methyl cellulose moet worden geroerd in warme M9 totdat deze is opgelost. Eenmaal voorbereid, kan deze oplossing worden opgeslagen bij kamertemperatuur. - Voeg 500 µ L van 1% methylcellulose-in-M9 oplossing in de depressie van een holle Microscoop dia. Deze viskeuze buffer zal in twee gevallen gebruikt worden: 1) bij het oogsten van vroege embryo's door dissectie van volwassen wormen en 2) bij het wassen van de late-stadium embryo's die rechtstreeks van een NGM plaat worden geplukt.
Opmerking: methyl cellulose wordt gebruikt om te voorkomen dat embryo's vasthouden aan de Microscoop glijbaan. - Voorbeeld vorming laat stadium embryo's, pick gelegd C. de embryo's van de (bij voorkeur van een NGM plaat met jonge volwassenen aanwezig) met behulp van een wimpers te plukken, en verplaats de embryo's naar de 1% methylcellulose op de concave Microscoop dia. De wimpers plukken helpt de kracht te verminderen en zo te minimaliseren stress of beschadiging van de embryo's tijdens de behandeling. De procedure om een wimper pick te maken is gedekt door hart20.
- Met een tweede wimpers plukken (in de tegenovergestelde hand), tik zachtjes beide wimpers samen om de embryo's in de methylcellulose op te schorten.
- Facultatief: als het van plan zijn om embryonale cellen met StarryNite te plannen, moet men 1-cel aan 4-cel embryo's opzetten. Om dit te doen, selecteert u eerst jonge volwassenen uit een NGM plaat en verplaats ze in de M9-methylcellulose oplossing op de concave Microscoop dia met behulp van een platinadraad te plukken.
- Optioneel: met de geslepen tips van injectienaalden (No. 18G x 1 ½), snijd het dier omgekeerd op het midden van het lichaam om 1-cel vrij te geven aan 4-cel embryo's.
3. de mond pipet: het assembleren van aspirator buis met microcapillaire pipet
Opmerking: we gebruiken een aspirator buis met een hand getrokken micro capillaire pipet ingevoegd in de rubberen pakking van de buis. Dit stelt ons in staat om embryo's overdracht van de dissectie dia naar de poly-L-lysine-gecoate oppervlak in de buffer gevulde Imaging kamer.
- Trek handmatig de microcapillaire pipet over een open vlam om twee helften te creëren met gestrekte uiteinden.
- Neem de ene helft van de microcapillaire pipet en steek het stompe uiteinde in de rubberen pakking van de aspirator buis (figuur 1c). Zet de andere helft van de microcapillaire pipet opzij voor gebruik later (indien nodig).
- Met de gemonteerde aspirator buis met microcapillaire Pipet, breek het uiteinde van de microcapillaire pipet voorzichtig en creëer een opening die ongeveer 1 – 2 twee embryo's zal passen (vanaf hier wordt dit instrument een "mond pipet" genoemd).
4. montage C. de embryo's van de poly-L-lysine met een laag bedekte dekglaasje
- Met de aspirator mondstuk voorzichtig tussen de tanden, Pre-Fill de microcapillaire pipet met 10 tot 15 µ L van M9 buffer en vervolgens zachtjes zuigen verschillende embryo's uit de concave dia in het capillair.
- Breng de embryo's naar de staal Imaging kamer gevuld met M9 buffer, het positioneren van de capillaire tip, zodat embryo's zullen vallen in de centrale rechthoek van de dekglaasje.
- Het vermijden van letsel aan de embryo's, beweeg ze voorzichtig met een wimpers te plukken of gebruik de mond pipet om de embryo's verticaal positie, om de embryo's te oriënteren, zodat de lange as van het embryo is loodrecht op de lange as van de dekglaasje (Figuur 1b inzet , onderste paneel).
Opmerking: het plaatsen van het embryo in deze oriëntatie minimaliseert het aantal segmenten tot beeld, waardoor de licht dosering en de verwerking van gegevens tijd, terwijl het verbeteren van de acquisitie snelheid. - Plaats de staal Imaging kamer in de steekproef houder op Microscoop fase (figuur 1d).
5. assemblage, softwareopstelling en laser optimalisering voor embryonale weergave gebruikend de diSPIM
- Zie stap-voor-stap instructies voor het monteren van de gehele vezel-gekoppelde diSPIM uit commercieel beschikbare onderdelen in Kumar et al.10,11 en op http://www.dispim.org. Een video-protocol voor het monteren van de diSPIM is ook beschikbaar op de ASI website (http://www.asiimaging.com).
Opmerking: instrument Setup voor dit protocol is identiek aan Kumar et al.10,11 diSPIM, die gebruik maakt van 40x 0.8 na water immersie lenzen voor Imaging. Het enige verschil tussen de Setup in dit protocol en Kumar et al.10,11 is de toevoeging van een dichroïde spiegel (splitsing op 560 Nm) en rode en groene band filters in een Imaging splitting Device (model A12801-01) geïnstalleerd op beide diSPIM Imaging armen. De toevoeging van beeld het verdelen optica staat gelijktijdige vangst van beelden van twee DISTINCT fluorophores toe-opgewekt door 561 nm en 488 nm-lasers-door de emissie banden op twee helften van de zelfde camera spaander te scheiden. - Na de assemblage van het instrument, Controleer de optische uitlijning van de diSPIM vóór beeldvorming.
Opmerking: om de diSPIM goed af te stemmen zie https://youtu.be/qnOrg30NNuE, en voor hardware informatie, http://dispim.org/hardware/objectives en http://www.asiimaging.com. - Gebruik de open-source platform Micro-Manager (https://micro-manager.org/)21, die is geoptimaliseerd voor het bedienen van lichte blad microscopen voor high-throughput cellulaire beeldvorming22. Wij raden het gebruik van de ASI diSPIM plugin voor multi-positie acquisitie, die gelijktijdige beeldvorming van maximaal 30 embryo's mogelijk zoals beschreven23.
- Met micro-manager open, vastgestelde Laser intensiteiten aan ~ 179 µW (0,5) voor 488 nm en ~ 79 µW (0,25) voor 561 nm (Figuur 2a, rode rechthoek).
Let op: Dit zijn de aanbevolen instellingen voor de lange termijn beeldvorming van C. van de embryo's met een interval van 1 minuut. Tijdens de lange termijn Dual-Color Imaging, de 561 nm laser wordt gebruikt om het imago van kernen (mCherry:: histone) tot embryo's zijn op Bean stadium, op welk punt de 488 nm laser wordt vervolgens ingeschakeld om ook het imago van de GFP-gelabelde neuronen. Deze beeldvormende voorwaarden zijn geoptimaliseerd voor het minimaliseren van fototoxischheid en het verzekeren van overleving en het uitbroeden van de embryo's terwijl het toelaten van langdurig (12-14 uren) ononderbroken verwerving van neurologische en lineaging gegevens. - In Micro-Manager, kies menu Plugins ≫ Device Control > ASI diSPIM om het ASI DiSPIM venster te openen (Figuur 2b). Kies het tabblad acquisitie . In de sectie instellingen voor gegevensopslag van dit tabblad (groene rechthoek), sectie volume-instellingen (blauw vierkant) en segment instellingen (oranje vierkant) moet u ervoor zorgen dat elke parameter is ingesteld zoals weergegeven in Figuur 2b.
Opmerking: onze beeldanalyse software CytoSHOW is aangepast om te werken met andere optionele output data formaten zoals bulk-aaneengeschakelde OME-TIFF file Series en TIFF-StackFile Series gemaakt na de acquisitie door het gebruik van een export functie ingebouwd in Micro-Manager. Typisch, de single-time-punt-stack gesorteerde OME-TIFF-bestand data formaat wordt gebruikt omdat het real-time bekijken en verwerken van beeld volume, zodra de ruwe gegevens worden verworven.
6. geoptimaliseerde autofocus parameters voor lange-termijn beeldvorming van C. de embryo's van de
- Stel Micro-Manager autofocus parameters om de instellingen geoptimaliseerd voor lange-termijn Lineage-kwaliteit diSPIM-Imaging van C. de embryo's. Klik in het venster ASI diSPIM op het tabblad autofocus (figuur 2c). In de algemene autofocus opties sectie (zwart vierkant) Specificeer parameters precies zoals getoond. Merk op dat de autofocus kanaal (rode vierkant) moet uw nucleaire kanaal fluorescentie kanaal te specificeren in lineaging experimenten.
Nota: als de maximum compensatie groter is dan 5 µm, neigen de beelden uit nadruk te drijven. - Klik, Plugins ≫ acquisitie tools > patroon overlay.
- Klik in het venster patroon overlay op raster weergeven.
- Klik in het venster ASI diSPIM op het tabblad Navigatie .
- Klik op selectievakjes voor balk en blad van pad A of B Klik vervolgens op Live. Beeldaanwinst begint. Er wordt een Live View-venster geopend. Selecteer de auto-focus analyse regio van het embryo door het tekenen van een doos rond het embryo op het geselecteerde kanaal van 6,1.
Opmerking: we vangen meestal 420 tijdpunten voor 10 embryo's per Imaging sessie. De ruwe data per beeld sessie zijn meestal 1,7 TB, terwijl deconvolved en StarryNite-verwerkte gegevens zijn 1,4 TB (zie stap 9 en 10). Wij raden het gebruik van grote capaciteit HDD (18 TB op ons huidige systeem) voorbeeld acquisitie, en Cloud platforms voorbeeld opslag. - Klik op Start acquisitie in het "acquisitie tabblad om op lange termijn multi-dimensionale beeldopname te beginnen (Figuur 2b).
7. opening RAW Micro-Manager beelden in CytoSHOW
- Download de software bundel van http://dispimlineage.wormguides.org.
Opmerking: de software bundel zal worden gedownload als een. zip-bestand en zal moeten worden geëxtraheerd naar de "C:\" Directory voor gebruik. Verdere Details voor de installatie worden gegeven op http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm. - Dubbelklik op het bestand C:\CytoSHOWextrasForC\CytoSHOW_APP.JNLP om te beginnen met CytoSHOW.
- Kies menu bestand > nieuwe ≫ DiSPIM monitor (Micro-Manager). Bepaal de plaats van de omslag van de wortel gegevensreeks waar de verwerving timepoint omslagen werden bewaard. Selecteer een timepoint map en klik op openen. Multidimensionale navigatievensters (de zogenaamde diSPIM monitor Vensters) worden automatisch geopend voor zowel SPIMA als SPIMB (Figuur 3a).
Nota: deze vensters zullen de omslag van de wortel gegevens voor onlangs opgeslagen ruwe timepoint stapels controleren (in het geval dat een specimen nog wordt geregistreerd). Na elke nieuwe timepoint is verworven, elk van de ramen de controle van de afzonderlijke SPIM armen en sample posities zal vernieuwen om de gehele multichannel 4D DataSet voor elk embryo weer te geven.
8. het genereren van Max projectie beelden met CytoSHOW
Zelfs voor dewinding, kunnen de ruwe gegevens snel worden verwerkt om de globale eigenschappen van het specimen te beoordelen.
- Klik op de Z-MIP knop aan de linkerkant van het beeldvenster (Figuur 3a, rode rechthoek) om maximale intensiteit projecties te maken door de volledige diepte en full-time cursus van een bepaalde positie of spim arm. Een Z-projectie hyperstack venster zal verschijnen.
- In het venster Z-projectie hyperstack stelt u het projectie type in op maximale intensiteit. Opgeven welke kanalen, segmenten en tijd-punt frames moeten worden verwerkt op basis van de gebruikersvoorkeur.
- Tikken okee wanneer volbracht.
- Selecteer de locatie van de map om de maximum intensiteits uitgangen op te slaan in het dialoogvenster bestand en klik vervolgens op OK. Laat enige tijd (15 tot 20 minuten, afhankelijk van de grootte van de dataset en de verwerking van de kracht van de computer) voor CytoSHOW om projectie beelden te genereren.
9. het analyseren van de cellen in isotrope High-Resolution volumetrische gegevens
- Optioneel: met de ruwe gegevens open via diSPIM monitor in CytoSHOW, selecteert u de veelhoek selectie tool (Figuur 3a, zwarte pijlen) en klik net buiten het embryo anterior, posterior, dorsale en buik randen (in die exacte volgorde) om Genereer een "bowtie" patroon over het embryo. Doen voor beide standpunten (SPIM-A en SPIM-B, Figuur 3a).
Opmerking: deze selectie specificeert de elliptische regio van belang (ROI) waarin het embryo is gecentreerd en registreert de voorste-posterior as van het embryo. De bowtie patroon cues CytoSHOW dat de gebruiker van plan om verder te specificeren een precieze rotatie van de uiteindelijke isotropically gesmolten volumes in een oriëntatie die optimaal is voor lineaging analyses door StarryNite/AceTree. In gevallen waarin StarryNite lineaging geen deel uitmaakt van het experimentele plan, kunnen andere selectiegereedschappen en-vormen worden gekozen om de ROI voorbeeld verwerking in te stellen. - Als meerdere embryo's gelijktijdig werden afgebeeld met behulp van de multi-positie acquisitie optie, open en Voer stap 9,1 voor alle embryo's. Dit zal parallelle uitvoering van toekomstige stappen voor alle embryo's in één zitting toelaten. Sluit de SIMA en SPIMB ramen voor alle embryo's die u niet wenst te verwerken.
- Klik op de diSPIM knop op het linker zijpaneel van diSPIM monitorvenster (Figuur 3a, gemarkeerd in geel). Dit onthult een subpanel van controles die specifiek zijn voor diSPIM verwerking.
- Lijn groene en rode kanalen voor elke SPIM arm. Omdat emissie kanaal splitters worden gebruikt om verschillende rode en groene beelden gelijktijdig vast te leggen op dezelfde camera, is het belangrijk om visueel uitlijnen van de exacte pixel registratie van deze twee fysiek aangrenzende afbeelding velden wanneer ze worden bedekt. Hergebruik van dezelfde uitlijning aanpassingen is meestal haalbaar gedurende vele opeenvolgende Imaging sessies, maar moet worden gecontroleerd (zoals in stappen 9.4.1-9.4.5).
- Te beginnen met de SPIMA paneel, selecteert u het rode kanaal door het verplaatsen van de cm schuifbalk naar links (Figuur 3a, oranje pijl, linker paneel).
- Met de x-, y-en z-regelaars (Figuur 3a, oranje vierkant) verschuift u het rode kanaal naar het groen.
- Klik op diSPIM knop (Figuur 3a, gemarkeerd in geel), om het subpaneel te sluiten en voortplanting van dezelfde verschuivingen trigger naar alle andere positie ramen.
- Bevestig dat de juiste uitlijning doorgegeven aan andere frames en tijdpunten door het verplaatsen van de "z" schuifbalk (Figuur 3a, blauwe pijl, linker paneel) en/of "t" schuifbalk (Figuur 3a, groene pijl, linkerdeelvenster). Als de acquisitie met meerdere posities werd uitgevoerd en verschillende embryo's werden afgebeeld (stap 5,3), zou de uitlijning ook aan die embryo's moeten worden gepropageerd. Bevestig door ook de aantallen voor x-, y-, en z-regelaars (Figuur 3a, oranje vierkant, die hetzelfde moet zijn voor de SPIMA paneel van alle embryo's) te onderzoeken.
- Herhaal stappen 9.4.1-9.4.4 voor de SPIMB diSPIM monitorvenster (Figuur 3a, rechter paneel).
- Klik op de "diSPIM" knop en vervolgens op de "fuse" knop (Figuur 3a, blauwe rechthoek) om een dialoogvenster te openen met de naam "Deconvolve/fuse DiSPIM RAW data volumes" (Figuur 3b). Set parameters zoals weergegeven in Figuur 3b. Deze parameters worden in de volgende substappen kort behandeld:
- Set Key registratie op kanaal 1 (488 nm laser) of 2 (561 nm laser). Selecteer het kanaal met een dichtere of meer alomtegenwoordige signaal. Voor lineaging experimenten Selecteer altijd het kanaal gebruikt om de alomtegenwoordige nucleaire histone fluorescentie beeld.
- Stel de relatieve oriëntatie van de invoervolumes in op + 1 of-1. De juiste oriëntatie-index is afhankelijk van een specifieke diSPIM camera plaatsingen (Figuur 4).
Opmerking: indien onzeker, test elke optie door het dupliceren van een enkele timepoint van zowel SPIM A en B diSPIM monitor venster, volgende stappen 9.1-9.12 en willekeurig kiezen van een input volumes relatieve oriëntatie te testen. Onjuiste oriëntaties zal opleveren wazige beelden met artefacten, terwijl de juiste oriëntaties zal opleveren duidelijke beelden. De relatieve oriëntatie waarde van de invoervolumes die het duidelijke beeld oplevert, kan vervolgens worden hergebruikt voor alle toekomstige gegevens van het gegeven diSPIM-instrument. - Kiezen of het gesmolten volume moet worden georiënteerd hetzelfde als de A-of B-ingangsvolume (op basis van de gebruiker voorkeur).
- Selecteer "Fresh registratie voor elk volume". Met deze optie bepaalt u hoe SpimFusion registratie matrices berekent voor elk volume paar op elke timepoint. De "verse" optie staat het algoritme toe om registratie adaptief bij elke timepoint te optimaliseren.
- Stel het aantal van de iteraties van de dekronkel tot 10. Dit aantal neigt om de gewenste hoge resolutie op een tijd-efficiënte manier betrouwbaar te leveren.
- Optioneel: als auto-lineaging gewenst is (sterk aanbevolen), controleer dan de auto-Launch StarryNite lineaging van gesmolten volumes. Deze optie zal StarryNite automatisch lanceren om cellen in de gebeelde volumes te segmenteren en te volgen die door SpimFusion worden geproduceerd.
- Optioneel: voor de hoogste nauwkeurigheid in geautomatiseerde lineaging, is het het beste om de isotropically gesmolten embryo volumes te verplaatsen naar de canonieke "ADL" (eennterior [x-West], Dorsael [y-Noord], links [z-near]) oriëntatie. Selecteer de optie volume uitvoerrichting in Voorvertoning definiëren om deze keuze aan te geven. CytoSHOW zal reageren door de verwerking van een eerste paar isotropically gesmolten volumes, waardoor de gebruiker nauw te observeren en de rotaties die nodig zijn om de ADL-registratie te bereiken specificeren.
- Klik op Ja zodra alle parameters zijn geselecteerd.
- Geef de output directory waarin de verwerkte bestanden op te slaan. Klik op OK.
- Optioneel: als de optie volume uitvoer instellen in Voorvertoning is geselecteerd, stelt u de t -schuifbalk (Figuur 3a, groene pijl, linkerpaneel) in de spim-een venster in op de vroege timepoint waarbij ABa en dierlijke cellen metafase hebben bereikt. Stel de t -schuifbalk in het venster spim-B in op de latere komma fase van ontwikkeling. Dit zal helpen bij het specificeren van ADL oriëntatie.
- Optioneel: Klik op OK als u klaar bent. Als de optie Voorvertoning in 9.5.7 hierboven is geselecteerd, worden slechts twee voorbeeld volumes isotropically samengevoegd voor de Timepoints die wordt aangegeven door de t-schuifregelaars van de SPIM-A en SPIM-B-afbeeldingsvensters. Deze twee preview Timepoints kunnen worden gebruikt om precieze herschikking van de output embryo volumes op de ADL-oriëntatie, zoals hieronder uiteengezet.
- Zoek de nieuw weergegeven 3DProjY_Decon-Fuse_.... Venster. Verplaats de t -schuifbalk naar tijdpunt 2 van dit voorbeeldvenster. Verplaats de Z-regelaar totdat de weergave direct onderaan de lange as van het embryo wordt weergegeven.
- Verplaats de t -schuifbalk terug naar tijdpunt 1 van de 3DProjY_Decon-Fuse_.... Venster. Kies de lijn-selectie tool en teken een lijnselectie uit de cel EMS (buik-de meeste ronde kern) door het vlak van de AB-cel metafase platen.
- Klik op de oranje diSPIM preview knop op de 3DProjY_Decon-Fuse_.... Venster. De fijne aanpassingen aan de oriëntatie van het beeld volume worden opgeslagen voor gebruik bij de verwerking van de volledige gegevensset.
- Optioneel: de Deconvolve/fuse DiSPIM RAW data volumes dialoog zal weer verschijnen, net als in stap 9,5 hierboven. Klik op Ja zonder de optie volume uitvoer instellen in voorvertoning te kiezen . Geef de output map voor de volledige verwerking van gegevens uit te voeren.
- Stel de t -schuifbalken (Figuur 3a, groene pijl, linker paneel) van de diSPIM monitor ramen aan de startende timepoint (SPIMA) en eindigt timepoint (SPIMB) van de volledige spanwijdte van de beelden te verwerken. Klik vervolgens op OK.
- Zoals SpimFusion vordert, CytoSHOW opent en vernieuwt een multidimensionale venster met de gesneden-4D isotrope gesmolten volume voor elk embryo, evenals twee ramen met roterende-4D Max-intensiteit projecties van de isotrope volume. Gedurende deze tijd, niet onderbreken of sluiten geen CytoSHOW venster tot isotrope Fusion en Lineage tracking zijn voltooid.
- Optioneel: zodra de StarryNite splash screen is verschenen en later verdwenen, is de volledige data-processing pijplijn is voltooid. Dit venster mag niet worden gesloten tijdens de verwerking of StarryNite zal worden onderbroken.
10. opening StarryNite Lineage Trace serie in AceTree (optioneel)
- Open de aangepaste versie van "AceTree_16BitCompat. jar" voorzien.
- Kies menu het bestand > Open configure file. Zoek uw output directory eerder aangegeven om CytoSHOW. Open de Decon_Fuse_... _Pos [n] submap voor embryo [n]. Selecteer aaa_edited. XML en Open.
- Gebruik het AceTree menu edit > Edit tools om de Edit track te openen en aan te passen of te verwijderen cellen ramen.
- Klik op de half gearceerde cirkel Figuur 5b, rode vierkant om de rode en groene intensiteiten aan te passen.
- Ga verder met Lineage visualisatie en Editing zoals eerder beschreven5,6,8 (manuscripten zijn ook opgenomen in onze Download bundel).
Representative Results
We hebben eerst de levensvatbaarheid van embryo's afgebeeld met behulp van de parameters van het protocol voor diSPIM acquisitie (secties 1-6) gevalideerd. Tien embryo's werden gelijktijdig afgebeeld bij 20 °C, één volume/embryo/minuut, van de 2-Cell fase tot de 2-voudige fase (7,5 uur, 451 volumes/embryo). Om te controleren cel divisies in embryogenese, gebruikten we stam BV514, die ubiquitously drukt de mCherry::histone reporter construeert uit de geïntegreerde transgene array ujIs11324. Figuur 6 toont een tijdlijn van deze eerste helft van de embryonale ontwikkeling voor een van de afgebeelde embryo's. Elke afbeelding vertegenwoordigt een projectie met een maximale intensiteit van één weergave (geproduceerd door stap 7-8) van het afbeeldings embryo. Wij vonden dat de geoptimaliseerde protocollen geen waarneembare fototoxischheid aan de embryo's veroorzaakten, zoals die door timing van celdeling (niet getoond) worden beoordeeld, tijd van het uitbroeden, en timing met betrekking tot ontwikkelings mijlpalen (Figuur 6 en verwijzingen1 , 25 , 26).
Vervolgens hebben we het protocol toegepast om de groeidynamiek van enkele neuronen in het ontwikkelen van embryo's te analyseren. We imaged DCR7692 (olaex4655), een transgene nematode stam die uitdrukt GFP uit de neuropeptide FLP-19 promotor in een subset van niet-geïdentificeerde cellen (DACR2819, PFLP-19 (3.6 KB):: Syn21:: GFP:: CAAX::p 10 3 ' UTR) . Naar aanleiding van de stappen van het protocol hier uiteengezet, hebben we vastgesteld dat de niet-geïdentificeerde cellen overeenkomen met motorische neuronen RMDDL en RMDDR, de uitscheidings Canal Cell, en twee spiercellen (Figuur 7). Vervolgens hebben we onderzocht en gekwantificeerd de uitgroei dynamiek van de RMDDL en RMDDR neuronen. We merkte op dat de RMDDL en RMDDR neuronen zijn schuin gevormd zo vroeg 360 minuten na de bevruchting, met de langere cellulaire as die de daaropvolgende as voor neuriet uitgroei (Figuur 7 en film S1). Met behulp van de "Simple neuriet tracing" plugin in FIJI en toe te passen op 3D reconstructies van isotropically gesmolten volumes, we vervolgens gekwantificeerd de stereotiepe uitgroei van de RMDDL en RMDDR neurites voor zes embryo's. We hebben vastgesteld dat de groeidynamiek werd gestereotypeerd voor RMDDL en RMDDR over embryo's (hierin genoemd RMDDs). Vanaf 385-410 minuten na de bevruchting, de RMDDs neurites Extended 6.0 ± 0,5 µm (mean ± SEM; n = 12 neurites) anterior van de cel lichamen (figuur 7b, C, I). Vanaf 415-445 minuten na de bevruchting, zowel neurites uit te breiden dorsaal in en rond de vermoedelijke zenuw ring (asterisk in figuur 7d). Gemiddeld, elke RMDD neuriet uitgebreid 11,0 ± 0,6 µm (mean ± SEM; n = 12 neurites) van het cel lichaam vóór synchroon het ontmoeten van zijn contralaterale tegenhanger bij de top van de ring (figuur 7I). Belangrijk is dat onze representatieve resultaten aantonen dat we in staat zijn te onderzoeken, te vergelijken en te kwantificeren neuronale ontwikkelings functies voor enkelvoudige identificeerbare cellen met behulp van onze geïntegreerde Protocol (Figuur 7 en Figuur 8).
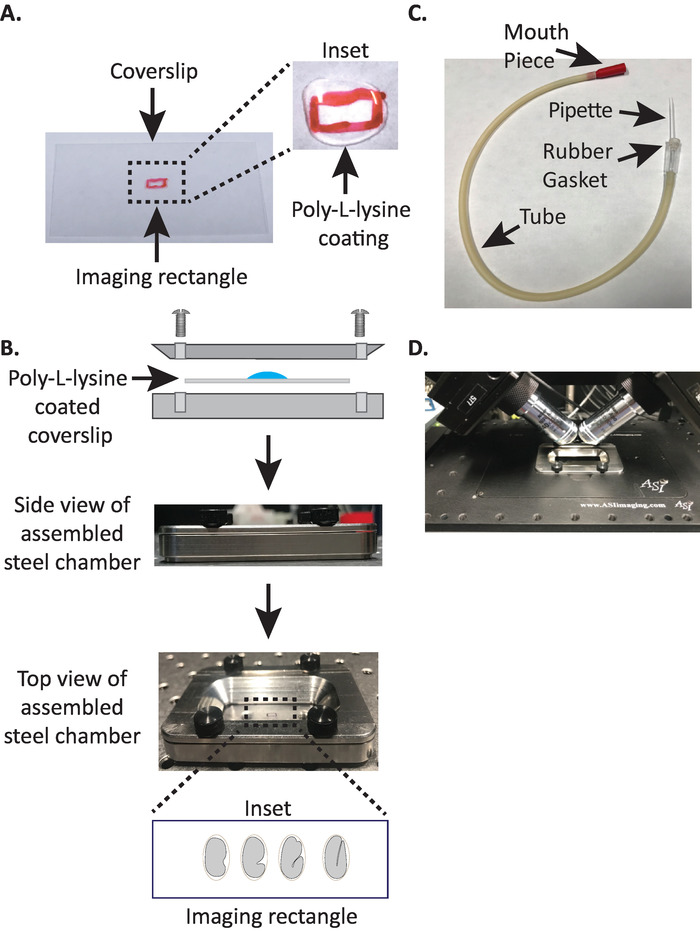
Figuur 1: diSPIM steekproef montage Setup. Avoorbereiding van dekglaasje met poly-L-lysine. In de inzet, 10 µ L van poly-L lysine werd gebruikt om de vacht van de dekglaasje voor 5 minuten. Poly-L-lysine kan het embryo eierschaal vast te houden aan de dekglaasje in de rechthoek. Bschematische weergave van de staal Imaging kamer en de gemonteerde kamer. In de inzet, representatieve embryo's zijn georiënteerd met de voorste-posterior as loodrecht op de lange as op de dekglaasje. (C) gemonteerde aspirator buis met microcapillaire pipet. (D) staal Imaging kamer gemonteerd in monsterhouder onder diSPIM 40x doelstellingen. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2: diSPIM Imaging Setup op lange termijn in Micro-Manager. (A) aanbevolen diSPIM Laser Power parameters (rode rechthoek) geoptimaliseerd voor langdurige beeldvorming, terwijl het verminderen van fototoxiciteit (zoals beoordeeld door hogere broed snelheid van C. de embryo's van de. Reeks 561 de laser van nm aan 79 µW (0,25) en 488 nm laser aan 179 µW (0,5). Merk op dat de exacte kalibratie van software-instellingen op laservermogen varieert tussen diSPIM installaties. Het wordt aanbevolen dat de gebruikers meten en kalibreren van de laservermogen om 79 µW (561 nm) en 179 µW (488 nm) laservermogen te bereiken. (B) diSPIM parameters voor het opslaan van gegevens (groene rechthoek), volume-instellingen (blauw vierkant), en slice-instellingen (oranje vierkant). (C) diSPIM autofocus parameters voor lange-termijn beeldvorming van C. embryogenese (Zie stappen 6.1-6.6). Klik hier om een grotere versie van dit cijfer te bekijken.

Afbeelding 3: beeld visualisatie en gegevensverwerkings instellingen met CytoSHOW. (A) RAW diSPIM beelden geopend door CytoSHOW. CytoSHOW is in staat om beelden te openen die door zowel camera wegen (SPIM A en B) worden gevangen. Deze ruwe beelden worden geopend in multidimensionale Vensters genoemd diSPIM monitor. In diSPIM monitorwordt een "bowtie patroon" gegenereerd om de voorste, achterste, dorsale en buik randen van het embryo te selecteren (zie stap 9,1). Bow-tie selecties geven het embryo oriëntatie voor dewinding en StarryNite-Assisted lineaging tracing. (B) geoptimaliseerde parameters gebruikt voor het genereren van isotrope beelden. Stel in het Deconvolved tijdens het verwerven van het venster de parameters in die zijn opgegeven in stappen 9.5.1-9.5.8. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 4: diSPIM cameraconfiguratie. (A) foto van diSPIM camera plaatsingen en oriëntaties. (B) voorstelling van + 90-graden rotaties van spim A om de verzamelde spim B-beelden te evenaren. (C) input volumes ten opzichte van oriëntatie-index + 1 op basis van onze diSPIM cameraconfiguratie (zie stap 9.5.2). Wij roteren SPIM een beeld (s) + 90 graden rond Y-as vóór registratie om SPIM B beeld (s) aan te passen. Schaal staven = 10 µm. beelden zijn representatieve Single-View, maximale intensiteit projecties en dewindion beelden van 1,5-voudige embryo met gelabelde kernen (561-nm, rood) en neuronen (488-nm, groen). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 5: curatie en bewerking C. de embryonale afstamming in AceTree. (A) we gebruiken AceTree om de lijn sporen van StarryNite te bewerken (zie referenties5,6,8; manuscripten zijn ook opgenomen in onze Download bundel). AceTree zal C. de systematische namen van elke kern (groene rechthoek) na voltooiing van stappen 10.1-10.2 tonen. Dit venster (a) geeft informatie (zwarte rechthoek) over elke cel in de Lineage trace (ABa, gemarkeerd in blauw) die gebruikers helpen begeleiden bij het bijhouden en bewerken van de Lineage sporen. Het wordt aanbevolen dat gebruikers te verifiëren en te vergelijken lineaged cellen en hun posities aan de C. de embryonale stamcel lijn die eerder door Sulston et al.1 is gerapporteerd bovendien, als gebruikers geïnteresseerd zijn in het lokaliseren van specifieke cellen in de deconvolved data-serie (zie hieronder, B) Voer de systematische naam C. -in in de zoekbalk (oranje rechthoek). (B) de deconvolved gegevensreeks van de gebruiker wordt ook automatisch geopend na voltooiing van de stappen 10.1-10.2. Hier weergegeven een isotropically gesmolten beeld van een vier-Cell fase embryo met kernen gelabeld in het rood. Tijdens het volgen van een kernen, moeten gebruikers veranderen de intensiteit van het beeld (rode vierkant) en navigeren door de tijd en z met behulp van de pijltjestoetsen op hun toetsenbord (tijd-links/rechts, z-up/down). (C) 3D Cartoon van de timepoint in (B) met bepaalde functionaliteiten (paarse rechthoek) die het mogelijk maakt draaibare 3D-visualisatie. Voor een overzicht van AceTree en zijn 3D functionaliteit, zie verwijzingen5,6,8. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 6: getimede ontwikkelingsdynamiek van C. de embryo's van de diSPIM. Bovenste paneel, diSPIM beelden die de eerste helft van de embryonale ontwikkeling voor een van de afgebeelde embryo's (stam BV514 ujIs11324). Embryo's werden voortdurend afgebeeld, elke minuut voor 7,5 uur (bij 20 ° c). De eerste twee beelden van het bovenste paneel vertegenwoordigen 4-en 8-cel embryo's met kernen (rood) en posities van polaire lichamen (dichte rode bollen, gemarkeerd met blauwe sterretjes). Elk beeld vertegenwoordigt een Single-View maximale intensiteit projectie van de afgebeelde embryo. Schaal staven = 10 µm. De chronologie (horizontale staaf) vertegenwoordigt notulen post bemesting (m.p.f.) van de ontwikkeling van C. de embryo's van de van de. Wij bevestigden dat de parameters van ons protocol voor diSPIM aanwinst geen waarneembare fototoxiciteit aan de afgebeelde embryo's veroorzaakten zoals die door levensvatbaarheid, timing van cel afdelingen, timing van het uitbroeden en timing van ontwikkelings mijlpalen worden beoordeeld (zie verwijzingen 1 , 25 , 26). we merken op dat de timing van de ontwikkelings-mijlpalen is reproduceerbaar over embryo's met onze imaging parameters (SEM ± 8,174 minuten voor 6,4 uur lange Imaging sessies; n = 10). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 7. Cellulaire identificatie en enkelvoudige cel karakterisering van neuriet ontgroei dynamiek in de ontwikkeling van C. de embryo's. Dual-Color beeldvorming van een stam gemaakt door kruising BV514 ujIs11324 (voor lineaging) en DCR7692 (olaex4655), een transgene nematode stam die uitdrukt GFP uit de neuropeptide FLP-19 promotor in een subset van niet-geïdentificeerde cellen. (a-H) Naar aanleiding van de stappen van het protocol hier uiteengezet, hebben we vastgesteld dat de niet-geïdentificeerde cellen overeenkomen met motorische neuronen RMDDL en RMDDR (gele pijlen), de uitscheidings Canal Cell (blauwe pijlen), en twee spiercellen (witte pijlen). (I) kwantificering van de uitgroei dynamiek van de RMDDL en RMDDR neuronen met behulp van Fiji plugin "Simple neuriet tracering" en toe te passen op 3D reconstructies van isotropically gesmolten volumes. Merk op hoe zowel RMDDL en RMDDR stereotype uitgroei dynamiek tonen, elk die synchroon voor een totale lengte van 11.0 ± 0.6 µm (gemiddelde ± SEM uitbreidt; n = 12 neurites) en vergadering bij de dorsale top van zenuw ring (Zie ook Movie S1). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 8: onderzoek van isotrope diSPIM beelden van neuronale morfologie in C. de embryo's van het type. Isotrope visualisatie van AVHL en AVHR neuronen (gele pijlen). Met behulp van de diSPIM, neuronale morfologie kan worden gevangen opleveren vier-dimensionale (4D) beelden met isotrope ruimtelijke resolutie van ongeveer 330 nm. De diSPIM staat gebruikers toe om beeld volumes met identieke resolutie in alle richtingen vrijwel te roteren. Beelden in A-D zijn maximale intensiteits prognoses van dezelfde isotropically gesmolten diSPIM beeld volume van verschillende rotaties rond de lange as van het embryo. Schaal staven = 5 µm. Klik hier om een grotere versie van dit cijfer te bekijken.
Supplementaire film S1: C. het embryo van de ontwikkeling van 280 tot 434 minuten post bemesting. Isotrope film van stam DCR7692 (olaex4655) het uitdrukken van UJIS113 ubiquitously met DACR2819 dun etikettering RMDD neurites (figuur 7A-D, gele pijlen). DACR2819 ook labels twee spiercellen (figuur 7A-d, witte pijlen) en uitscheidings Canal Cell (figuur 7A-d, blauwe pijl) tijdens de embryonale ontwikkeling (figuur 7A-d). Schaal staven = 10 µm. gelieve Klik hier om dit bestand te downloaden.
Discussion
C. het is de enige organisme met de laatste posities en connectiviteit van elke volwassen neuron bekend27. De ontwikkelingsdynamiek die leidt tot de organisatie van de werkkringen en netwerken die de C. connectome is, blijft echter onbekend. Gebaseerd op kansen die uit vooruitgang in lichte microscopie voortkomen, kunnen wij de posities van de cel, morfogenese, en neurogenese door C. de embryonale ontwikkeling van het gebied nu vangen en analyseren.
De procedure die we hebben beschreven en die we regelmatig gebruiken in het Lab levert 4D-isotrope beelden van gelabelde neuronen en kernen voor cel-lineaging in C. de embryo's. Nog belangrijker, we hebben geoptimaliseerd op lange termijn imaging voorwaarden met de diSPIM en gekoppeld semi-geautomatiseerde lineaging mogelijkheden met hoge-resolutie beelden om de snelheid en precisie van het analyseren van C. embryogenese te verbeteren. Dit geïntegreerde protocol zal gebruikers toelaten om cellen en quantitate drie-dimensionale eigenschappen zoals neuriet migratie en Axon Fasciculatie door begin van het vroege trillen te visualiseren en te identificeren. Deze procedure kan gemakkelijk worden aangepast in elke faciliteit met een ASI diSPIM systeem, en we raden dit systeem speciaal voor dit protocol. Andere SPIM formules die commercieel worden aangeboden kunnen afwijken van de ASI-configuratie in de sample kamer en optische eigenschappen. Gegevens die vanuit andere platforms worden geëxporteerd, kunnen echter ook via onze gegevens pijplijn worden ingevoerd. Daarom is de beoordeling van hun waarde in lineaging, een veeleisende test van beeldkwaliteit en stabiliteit van het instrument, haalbaar. Alhoewel we actief de diSPIM gebruiken om andere specimens (zoals fruitvlieg en zebravis embryo's) regelmatig te verbeelden, is de beschreven en uitgebreide lineaging analyse van embryo's momenteel nog beperkt tot de nematodensoorten. Voor grotere of dikke monsters, kiezen we voor fase-Scanning benaderingen, die de monsters scannen via een stationaire licht plaat. Kumar et al. hebben eerder aangetoond dat deze verbeterde diSPIM sectioning om beelden van hoge kwaliteit van dikke monsters opbrengst zonder extra wijzigingen aan de diSPIM10.
De kritieke stappen binnen het protocol omvatten het opzetten van C. de embryo's van de poly-L-lysine met een laag bedekte dekglaasje, gegevensaanwinst, en gegevens-verwerking. Oogsten en monteren C. de embryo's van de dekglaasje op het glas kunnen uitdagend zijn voor onervaren gebruikers, maar hier bieden we een gedetailleerd protocol van belangrijke stappen om het leren te vergemakkelijken. Als de lange termijn beeldvorming gewenst is, krijgen we de beste resultaten oogsten vier-cel of eerder embryo's van 8-10 jonge volwassenen28. Merk op dat oude volwassenen minder wenselijk zijn om vroege embryo's te oogsten omdat ze de neiging hebben om oudere embryo's in de baarmoeder en onbevruchte eieren te bevatten. Met betrekking tot de montage van embryo's kunnen problemen zoals verstopping in de geassembleerde aspirator (mond pipet) of een te grote opening in de microcapillaire pipet een goede montage en oriëntatie van embryo's voorkomen. Om voor te bereiden op een optimale beeldvorming, voeren we pre-acquisitie testen op vroege en late pre-twitching embryo's om de prestaties van de licht platen, camera's, doelstellingen en autofocus te controleren. We krijgen de beste resultaten wanneer al deze operaties worden getest en leveren beelden van hoge kwaliteit tijdens onze pre-acquisitie testen. Dit is met name relevant voor het genereren van beelden met isotrope ruimtelijke resolutie, waarvoor RAW-beelden verkregen uit beide opvattingen (doelstellingen) moet van hoge kwaliteit. Na overname worden de voor elke weergave verworven volumes verwerkt om isotrope beelden op te leveren. Het is belangrijk om een geschikte GPU-kaart (graphics processing unit) te gebruiken zoals beschreven in dit Protocol (zie hieronder). Dit verbetert de verwerkingssnelheid waarmee de isotropically gesmolten beelden worden gegenereerd, verkorting van de tijd tot data-analyses. Het is ook noodzakelijk dat de gebruikers de recentste versie van CytoSHOW in werking stellen en de parameters gebruiken die met onze Download bundel voor StarryNite auto-lineaging worden verstrekt. Als gebruikers geïnteresseerd zijn in het gebruik van auto-lineaging voor andere monsters (bijv. zebravis, fruitvliegje enz.) dan is extra optimalisatie van de parameters gebruikt in StarryNite nodig zal zijn (zie verwijzingen3,4).
Hoewel ons geïntegreerd protocol afbeeldingen en lineaging resultaten oplevert in het pre-twitching embryo, moeten gebruikers zich ervan bewust zijn dat geautomatiseerde lineaging in het post-twitching embryo momenteel niet haalbaar is: de kern posities veranderen in de volgorde van seconden in de post-twitching embryo, te snel om Lineage tracking mogelijk te maken. Nochtans, heeft diSPIM inderdaad een veelbelovend vermogen aangetoond om neurologische gebeurtenissen te vangen en sommige cel posities in de post-twitching stadia van embryogenese23,29te volgen. Als gebruikers geïnteresseerd zijn in het onderzoek van de post-twitching embryo, de diSPIM doet de snelheid te verkrijgen volumetrische snapshots en track fijne neurologische gebeurtenissen, zoals neuriet uitgroei, in snel bewegende embryo's.
Dit protocol zal worden fundament voor de cel-voor-cel voltooiing van de WormGUIDES Atlas30, want het zal een geïntegreerde aanpak met hoge resolutie isotrope beelden te identificeren en te vangen 3D-morfologie van het label neuronen tijdens de eerste 430 minuten van embryogenese. Zoals het er nu, het prototype WormGUIDES Atlas biedt nucleaire posities van cellen in het ontwikkelende embryo en is gericht op het vastleggen van de ontwikkelingsdynamiek van een subset van embryonale neuronen. Dit protocol zal een sleutel zijn voor de integratie van extra ontwikkelings neuronen in de WormGUIDES Atlas30.
Ons geïntegreerd protocol zal ook het verkennen van nieuwe genexpressie profielen in het C. het embryo van de genen vereenvoudigen. In transgene C., vele cel-specifieke promotors ruimte en tijdelijk controle transgene uitdrukking. Hoewel de expressie patronen van de meeste genen zijn uitgebreid gekenmerkt in het volwassen dier31,32,33,34, bijna allemaal nog te worden gekenmerkt in de ontwikkelingslanden (met name het late stadium) embryo. De C. promoterome is een nuttige bron voor de worm Gemeenschap om cel-specifieke transgene expressie te rijden, en om te bepalen of gene functie cel-autonoom of niet-autonoom is. Het vastleggen van isotrope hoge-resolutie en dynamische expressie patronen van genen, en nauwkeurig identificeren van uitdrukken cellen via lineaging zal waardevol zijn voor velen in de wetenschappelijke gemeenschap.
Embryogenese bestaat uit twee met elkaar verweven belangrijke processen, cellulaire differentiatie en weefsel morfogenese. Er is een groot deel bekend over de mechanismen en moleculen die verschillende typen cellen definiëren tijdens de ontwikkeling van C.. Er is echter weinig bekend over de mechanismen die belangrijk zijn voor cel migratie, cel adhesie, en cel vorm in de C. het embryo. Met de C. de onveranderlijke lijn van de cel van d. van de variant gekend, ons protocol laat ons gemakkelijk de gecatalogiseerde 3D-microanatomie van het embryo tijdens morfogenese op nieuwe niveaus van detail onderscheiden: b.v., axon Fasciculatie, synaptogenese, en neuronale activiteit. Ardiel et al. hebben eerder aangetoond dat de kracht van de diSPIM om calcium voorbijgaande aard vast te leggen op het niveau van een enkele neuronen in C. de embryo's van de. Vele andere aspecten van Ontwikkelingsfysiologie zijn rijp voor onderzoek door deze methodes.
Tot slot, dit protocol is grotendeels geautomatiseerd en systematisch vermindert de tijd die het kost om dewinding beelden te genereren en uit te voeren Cell-lineaging via StarryNite en Acetree. De software strategieën die worden gebruikt in dit protocol kunnen worden toegepast op veel vragen van de biologie ver van de zeer specifieke gebieden waarin we hebben aangetoond dat ze hier.
Details over software compatibiliteit en download toegang
Informatie over micro-manager en plugins voor diSPIM Imaging zijn beschikbaar op http://dispim.org/software/micro-manager en https://micro-manager.org/wiki/ASIdiSPIM_Plugin.
De gegevensverwerkings pijplijn vereist momenteel een Windows-besturingssysteem. Wij hebben één enkel archiefdossier gebundeld om installatie van alle vereiste gegevensverwerkende Programma's en steundossiers te vereenvoudigen. Het is beschikbaar voor download op http://dispimlineage.wormguides.org.
CytoSHOW (http://run.cytoshow.org/) is gebaseerd op de wijd gebruikte en open source image analyse platform, ImageJ (v1). Java moet worden geïnstalleerd en up-to-date op de computer te gebruiken CytoSHOW, en updates voor CytoSHOW worden automatisch geïmplementeerd via Java Web Start. Veel ImageJ functies van CytoSHOW zijn zoals beschreven en geïllustreerd op https://imagej.nih.gov/ij/docs/examples/index.html. CytoSHOW is aangepast om multidimensionale ruwe gegevens van de ASI diSPIM weer te geven, evenals andere imaging software die TIFF-uitgang creëert. In principe kunnen andere Multi-View SPIM imaging systemen worden ondersteund door kleine wijzigingen van CytoSHOW om dit protocol te laten uitvoeren op verschillende Microscoop systemen.
SpimFusion werd geschreven in CUDA/C++ met behulp van Visual Studio 2013 met CUDA Toolkit v 7.5. Running SpimFusion vereist specifieke computer hardware: een NVIDIA graphics processing unit (GPU) kaart met CUDA Compute Capability 1,0 of hoger en een minimum van 2 GB grafische kaart geheugen. Op het moment van publicatie van ons protocol, SpimFusion is ongepubliceerde (min Guo en Hari Shroff), maar beschikbaar in de software bundel archief hierboven vermeld.
Een speciaal gebouwde Command-Line gestuurde versie van StarryNite vereist dat de vrij beschikbare MATLAB compiler runtime is geïnstalleerd, maar vereist geen licentie voor commerciële MATLAB software. De MATLAB compiler runtime is opgenomen in de hierboven genoemde software bundel archief. De code voor StarryNite zoals gebruikt in dit protocol is hoofdzakelijk onveranderd van dat gebruikt voor confocale beelden6. Nochtans, zijn verscheidene operationele kwesties in de verwezenlijking van input beelden voor StarryNite verwerking en de behandeling van StarryNite resultaten hier behandeld door methodes in CytoSHOW die een ononderbroken gegevensverwerkings pijpleiding voor gesmolten isotrope toelaten diSPIM Volumes. Deze wijzigingen worden geautomatiseerd door CytoSHOW code die deze pre-en post-processing stappen verwerkt. CytoSHOW bewerkt ook een vooraf geoptimaliseerde diSPIM-specifieke sjabloon StarryNite parameter ingesteld om het segmentatie algoritme automatisch af te stemmen op de fluorescentie intensiteit van de kernen in de beeldgegevens. De unieke parameters gebruikt door StarryNite op elke diSPIM data set worden vervolgens opgeslagen in een bestand samen met de output image en lineaging gegevens.
Een aangepaste versie van AceTree die met 16-bits afbeeldingen werkt en compatibiliteit met Java3D-rendering onderhoudt, is het meest geschikt voor dit protocol. Het is ook opgenomen in de software bundel archief hierboven vermeld.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Wij danken John Murray voor geïntegreerde spanning, ujIs113, te genereren lineaging stam BV514; Brandon Harvey (NIBIB) voor hulp bij het testen van het Protocol; Jon Daniels en Gary Rondeau (toegepaste wetenschappelijke instrumentatie) voor hulp met Micro-Manager en diSPIM instrument; en Andrew York en Hank Eden voor hun kritische feedback op de diSPIM systeem. Wij danken ook het onderzoekscentrum voor minderheids instellingen programma en het Instituto de Neurobiología Jose del Castillo (Universidad de Puerto Rico) voor het verstrekken van een vergadering en brainstormen platform. Veel van dit werk werd uitgevoerd bij het mariene biologische laboratorium bij het gat van het hout door het programma van Whitman. Dit werk werd gesteund door de intramurale Onderzoeksprogramma's van het NIH Nationaal Instituut voor biomedische beeldvorming en Biotechniek en door NIH Grant No. U01-HD075602 en Nee. R24-OD016474. Mark W. Moyle werd ondersteund door F32-NS098616 en Leighton H. Duncan werd ondersteund door een diversiteit aanvulling op R24-OD016474.
Materials
| Name | Company | Catalog Number | Comments |
| Steps 1-4 | |||
| Concavity slides | ThermoFisher Scientific | 1519006 | 5-18mm diameter, 0.6-0.8mm deep, 1.2-1.5mm |
| Dissecting microscope with 10×–50× zoom range | Motic | SMZ-171 | |
| E. coli (OP50) | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Glass coverslips, no. 1.5, 24 × 50 mm | VWR International | 48393-241 | |
| M9 Buffer | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Methyl cellulose | Sigma-Aldrich | H7509-25G | |
| Microcapillary pipette aspirator tube | Sigma-Aldrich | A5177 | |
| Microcapillary pipettes, 0.4-mm i.d | Drummond Scientific | 1-000-800 | |
| Needle, no. 18G x 1 ½ (1.2mm x 40mm) | BD Precision Glide | 305196 | |
| NGM plates | prepared as described by Brenner (1974) | ||
| O-ring for imaging chamber | O-Rings West | M1.5X40 | |
| Pasteur pipette | Corning/Sigma-Aldrich | CLS7095D5X | |
| Platinum wire, 0.5-mm diameter | Sigma-Aldrich | 267201 | |
| Poly-L-lysine | Sigma-Aldrich | P1524 | |
| Stainless steel rectangular chamber (76.0 mm x 50.5 mm) | Applied Scientifics Instrumentations (ASI) | I2450 | |
| Worm Eyelash Pick | Hart, A. C. Behavior. WormBook. (2006). | ||
| Worm Pick | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Name | Company | Catalog Number | Comments |
| Steps 5-6 | |||
| 488 nm long-pass filter | Semrock | LP02-488 RU-2 | |
| 561-nm notch filter | Semrock | NF03-561E-25 | |
| BLP02-561R-25, quantity 2 | Semrock | 561 nm EdgeBasic best-value long-pass edge filter | |
| Control software for bottom camera | Jenoptik | ProgRes CapturePro | |
| diSIPM assembly video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/TAgbr6IrTqw ; http://www.asiimaging.com | |
| diSPIM alignment video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/qnOrg30NNuE | |
| diSPIM imaging PC | Intel | Intel Xeon CPU E5-2630 2.6GHz, 12 cores in total, 64 GB memory, Windows 7 | |
| FF01-525/45-25, quantity 2 | Semrock | 525/45 nm BrightLine single-band bandpass filter | |
| FF555-DI03-25X36, quantity 2 | Semrock | 555 nm edge BrightLine single-edge dichroic beamsplitter | |
| Imaging PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Kumar et al diSPIM Setup | Applied Scientifics Instrumentations (ASI) | Instrument setup for this protocol is identical to Kumar et al 10,11 diSPIM, which makes use of 40x 0.8NA water immersion lenses for imaging. (See steps 5.1 and note) | |
| Micro Manager | Micro-Manager | https://micro-manager.org/ | |
| Modifications to Kumar et al diSPIM Setup (see below) | |||
| Optical table with isolators, 4 feet × 6 feet × 12 inches | TMC | 784-651-02DR and 14-416-34 | |
| Name | Company | Catalog Number | Comments |
| Steps 7-10 | |||
| Analysis PC | Intel | Intel Core i7-8700K CPU 3.70GHz, 6 cores in total, 64 GB memory, Windows 10 | |
| Analysis PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Installation instructions | Software bundle | http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm | |
| Software bundle | Software bundle | http://dispimlineage.wormguides.org |
References
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Developmental Biology. 100 (1), 64-119 (1983).
- Bao, Z., et al. Automated cell lineage tracing in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 103 (8), 2707-2712 (2006).
- Santella, A., Du, Z., Bao, Z. A semi-local neighborhood-based framework for probabilistic cell lineage tracing. BMC Bioinformatics. 15, 217 (2014).
- Santella, A., Du, Z., Nowotschin, S., Hadjantonakis, A. K., Bao, Z. A hybrid blob-slice model for accurate and efficient detection of fluorescence labeled nuclei in 3D. BMC Bioinformatics. 11, 580 (2010).
- Boyle, T. J., Bao, Z., Murray, J. I., Araya, C. L., Waterston, R. H. AceTree: a tool for visual analysis of Caenorhabditis elegans embryogenesis. BMC Bioinformatics. 7, 275 (2006).
- Katzman, B., Tang, D., Santella, A., Bao, Z. AceTree: a major update and case study in the long term maintenance of open-source scientific software. BMC Bioinformatics. 19 (1), 121 (2018).
- Murray, J. I., et al. Automated analysis of embryonic gene expression with cellular resolution in C. elegans. Nature Methods. 5 (8), 703-709 (2008).
- Murray, J. I., Bao, Z., Boyle, T. J., Waterston, R. H. The lineaging of fluorescently-labeled Caenorhabditis elegans embryos with StarryNite and AceTree. Nature Protocols. 1 (3), 1468-1476 (2006).
- Wu, Y., et al. Spatially isotropic four-dimensional imaging with dual-view plane illumination microscopy. Nature Biotechnology. 31 (11), 1032-1038 (2013).
- Kumar, A., et al. Using Stage- and Slit-Scanning to Improve Contrast and Optical Sectioning in Dual-View Inverted Light Sheet Microscopy (diSPIM). The Biological Bulletin. 231 (1), 26-39 (2016).
- Kumar, A., et al. Dual-view plane illumination microscopy for rapid and spatially isotropic imaging. Nature Protocols. 9 (11), 2555-2573 (2014).
- Wu, Y., Christensen, R., Colon-Ramos, D., Shroff, H. Advanced optical imaging techniques for neurodevelopment. Current Opinion in Neurobiology. 23 (6), 1090-1097 (2013).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (43), 17708-17713 (2011).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136 (12), 1963-1975 (2009).
- Stelzer, E. H. Light-sheet fluorescence microscopy for quantitative biology. Nature Methods. 12 (1), 23-26 (2015).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Current Opinion in Chemical Biology. 20, 46-53 (2014).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. Astronomical Journal. 76 (6), 745-754 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. JOSA. 62 (1), 55-59 (1972).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Hart, A. C. Behavior. WormBook. , (2006).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using microManager. Current Protocols in Molecular Biology. Chapter 14, Unit14 20 (2010).
- Gualda, E. J., et al. SPIM-fluid: open source light-sheet based platform for high-throughput imaging. Biomedical Optics Express. 6 (11), 4447-4456 (2015).
- Ardiel, E. L., et al. Visualizing Calcium Flux in Freely Moving Nematode Embryos. Biophysical Journal. 112 (9), 1975-1983 (2017).
- Walton, T., et al. The Bicoid class homeodomain factors ceh-36/OTX and unc-30/PITX cooperate in C. elegans embryonic progenitor cells to regulate robust development. PLoS Genetics. 11 (3), e1005003 (2015).
- Altun, Z. F. WormAtlas. , (2002).
- Wood, W. B. Embryology: In the nematode C. elegans. Cold Spring Harbor Laboratory Press. Chapter 8, 215-241 (1988).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 314 (1165), (1986).
- Bao, Z., Murray, J. I. Mounting Caenorhabditis elegans embryos for live imaging of embryogenesis. Cold Spring Harb Protoc. (9), (2011).
- Christensen, R. P., et al. Untwisting the Caenorhabditis elegans embryo. eLife. 4, (2015).
- Santella, A., et al. WormGUIDES: an interactive single cell developmental atlas and tool for collaborative multidimensional data exploration. BMC Bioinformatics. 16, 189 (2015).
- Dupuy, D., et al. A first version of the Caenorhabditis elegans Promoterome. Genome Research. 14 (10B), 2169-2175 (2004).
- Reece-Hoyes, J. S., et al. Insight into transcription factor gene duplication from Caenorhabditis elegans Promoterome-driven expression patterns. BMC Genomics. 8 (27), (2007).
- WormBase. , Available from: https://www.wormbase.org (2019).
- Lee, R. Y. N., et al. WormBase 2017: molting into a new stage. Nucleic Acids Research. 46 (D1), D869-D874 (2018).



