Summary
Qui, presentiamo un approccio combinatorio utilizzando microscopia ad alta risoluzione, strumenti computazionali, e l'etichettatura a cella singola in vivente embrioni C. elegans per comprendere le singole dinamiche delle cellule durante il neurosviluppo.
Abstract
Caenorhabditis elegans (C. elegans) si distingue come l'unico organismo in cui si può osservare la sfida di comprendere le origini cellulari di un intero sistema nervoso, con una risoluzione a singola cellula, in vivo. Qui, presentiamo un protocollo integrato per l'esame del neurosviluppo negli embrioni di C. elegans . Il nostro protocollo combina Imaging, linearaggio e tracciamento neuroanatomico di singole cellule nello sviluppo di embrioni. Otteniamo immagini a lungo termine, a quattro dimensioni (4D), di embrioni viventi C. elegans con risoluzione spaziale quasi isotropica attraverso l'uso di microscopia a doppia vista invertita di illuminazione piana selettiva (dispim). I nuclei e le strutture neuronali negli embrioni di nematode sono iminvecchiati e fusi isotropicamente per produrre immagini con risoluzione di ~ 330 Nm in tutte e tre le dimensioni. Questi set di dati 4D ad alta risoluzione minuto per minuto vengono quindi analizzati per correlare le identità definitive di lignaggio delle cellule con l'espressione genica e le dinamiche morfologiche a livelli di dettaglio a cellule singole e subcellulari. Il nostro protocollo è strutturato per consentire l'implementazione modulare di ciascuno dei passaggi descritti e migliorare gli studi sull'embriogenesi, l'espressione genica o il neurosviluppo.
Introduction
C. elegans si distingue come l'unico organismo in cui ogni cellula dell'embrione può essere osservata durante tutto il neurosviluppo. Con l'intera cellula-lignaggio noto e invariante1, e con lo sviluppo di nuovi strumenti che consentono l'etichettatura e l'imaging continuo di singole cellule in embrioni, biologi possono ora iniziare a esaminare diversi passi nello sviluppo del nematode nervoso sistema da tutti gli angoli-nascita delle cellule; migrazione e differenziazione; Formazione di neurite, crescita mirata e fascicolazione; Formazione di sinapsi; e messa a punto dei circuiti funzionali. Catturare le dinamiche di conseguenza neuronale nell'embrione C. elegans , combinando i reporter espressi in modo stabile e la microscopia a fluorescenza, è prezioso per la comunità scientifica.
Gli studi sullo sviluppo in C. elegans spesso sfruttano il lignaggio delle cellule invarianti e le mappe del destino cellulare di questa specie per aumentare la comprensione contestuale a livello di singola cellula all'interno dell'organismo intatto1. Analisi di allineamento automatico-utilizzo di starrynite2,3,4 e acetree5,6,7,8 software-vantaggi da alto contrasto, alta risoluzione immagini di nuclei fluorescenti. Per lavorare in modo ottimale, StarryNite/AceTree dipende anche dall'orientamento vincolato prevedibile degli embrioni iminvecchiati durante lo sviluppo. Microscopia confocale, fatto in C. elegans embrioni compressi tra due coprioggetti, è stato il metodo di microscopia di auto-linearaggio standard per più di un decennio perché fornisce sia ad alto contrasto/alta risoluzione e una prevedibile vincolato orientamento dell'embrione7,8. In precedenza abbiamo descritto la costruzione e l'uso di un nuovo microscopio a doppia vista con illuminazione a doppio piano (dispim) per l'imaging di campioni vivi come l'embriogenesi C. elegans 9,10 , 11 il , 12 anni di , 13. la microscopia a foglio leggero, in generale, fornisce una bassa fototossicità, alta velocità e imaging a lungo termine di campioni 3D in diretta14,15. Il metodo diSPIM, in particolare, produce immagini quadridimensionale (4D) con una risoluzione spaziale quasi isotropica di circa 330 Nm9.
Rispetto alla microscopia confocale, diSPIM offre maggiore segnale-rumore e velocità, più risoluzione spaziale isotropica ed è più adatto per l'imaging a lungo termine in vivo 16. Abbiamo quindi lavorato per adattare i dati diSPIM per l'input in StarryNite/AceTree e abbiamo esaminato se ciò migliorasse le analisi di lineaging. Un ostacolo importante è che i campioni diSPIM non possono essere facilmente vincolati dalla compressione di guscio d'uovo per adottare gli orientamenti previsti per StarryNite/AceTree. L'orientamento casuale delle posizioni delle celle nel volume analizzato diminuisce la precisione dell'analisi di allineamento automatico.
Abbiamo quindi impiegato CytoSHOW, un'interfaccia utente guidata dagli spettatori che consente agli utenti di selezionare l'orientamento 3D preciso degli embrioni durante la pre-elaborazione delle immagini diSPIM, ottenendo dati di immagine che sono ottimizzati per la qualità e consapevoli del contesto per l'input in StarryNite /AceTree. Dopo la selezione degli embrioni iminvecchiati, CytoSHOW coordina una pipeline di elaborazione automatizzata dei dati. Le immagini embrionali ritagliate e in background vengono salvate all'interno dei file dello stack TIFF per ogni posizione, timepoint e vista. Cytoshow quindi chiama iterativamente il programma spimfusion per co-registrare e congiuntamente deconvolve le due viste pre-elaborate, utilizzando l'algoritmo Richardson-Lucy17,18 per produrre immagini volumetriche ad alta risoluzione isotropica. Un set di parametri specifico per diSPIM è stato ottimizzato per StarryNite per regolarne il comportamento durante la segmentazione dell'immagine e il tracciamento del nucleo in immagini fuse in modo isotropicale. Le immagini fuse e i risultati di lineaging vengono quindi modificati utilizzando AceTree, che consente agli utenti di identificare e correggere eventuali errori nella traccia di derivazione automatica generata da StarryNite. AceTree può anche presentare lignaggio albero e rendering 3D modellato di nuclei monitorati nell'embrione. Troviamo che la velocità e la precisione della linea automatica sono notevolmente migliorate utilizzando immagini fuse isotropicamente, se confrontate con immagini RAW da una telecamera SPIM. Il nostro protocollo, mentre ottimizzato per l'applicazione C. elegans descritta qui, potrebbe essere generalmente adattato per l'auto-linearaging dei dati dispim prodotti per altre specie o esemplari. Se questo è l'uso previsto del protocollo, si prega di notare che la sintonizzazione aggiuntiva dei parametri starrynite sarà probabilmente necessario per i nuovi esemplari, come descritto3,4.
L'implementazione riuscita di questo protocollo produce immagini con risoluzione 4D-isotropica e consente ai biologi di tracciare i lineages delle cellule, identificando e analizzando simultaneamente i neuroni nell'embrione C. elegans in via di sviluppo. Inoltre, unendo diversi algoritmi di post-elaborazione-con l'accelerazione hardware essendo il più dispendioso in termini di tempo di questi-possiamo ora analizzare sia i dettagli subcellulari fini e le cellule-lignaggi e cellule-destati di embrioni vivi in tempo essenzialmente reale. Questo nuovo protocollo consente una manipolazione precisa e informata e l'osservazione del comportamento delle cellule durante gli studi probativi di differenziazione e morfogenesi in vivo. In questo manoscritto, presentiamo una spiegazione dettagliata dei protocolli migliorati che abbiamo sviluppato per la lineaging e il monitoraggio delle cellule nello sviluppo di embrioni C. elegans , per migliorare gli studi di embriogenesi, espressione genica o neurosviluppo.
Protocol
1. assemblaggio della camera di imaging in acciaio diSPIM con vetrino rivestito in poli-L-lisina
Nota: i passaggi seguenti sono tutti necessari per ottimizzare e automatizzare l'analisi di lignaggio degli embrioni di nematode da parte di StarryNite/acetree. Diverse opzioni (indicate come tali) possono essere omesse per gli esperimenti che richiedono la tracciatura dei lineages delle celle C. elegans .
- Disegna un piccolo rettangolo (2mm x 5mm) al centro di un coprioggetto rettangolare pulito (n. 1,5, 24 x 50 mm) con una penna Sharpie (o simile).
- Capovolgere il vetrino coprioggetti verso il lato non marcato e posizionare 10 μL di poli-L-lisina (Cat. No. P1524) sul rettangolo contrassegnato.
Nota: fare una concentrazione di lavoro di 1 mg/mL Poly-L-lisina disciolto in acqua filtrata (o equivalente). Per lo stoccaggio a lungo termine, preparare 5 – 10 mL di aliquote e conservare a − 20 ° c. Una volta scongelati, le aliquote possono essere conservate a temperatura ambiente (23 ° c) per 3 – 4 settimane. - Consentire alla Poly-L-lisina di rivestire il vetrino coprioggetti per 5 minuti (Figura 1a). Poly-L-lisina è utilizzato per rivestire fogli di copertura in vetro dove gli embrioni saranno montati, permettendo l'embrione di uovo di attaccare saldamente al vetrino coprioggetti, anche quando gli obiettivi sono immersi nel mezzo di imaging.
- Posizionare il vetrino rivestito in poli-L-lisina nella metà inferiore della camera di imaging in acciaio.
- Posizionare la metà superiore della camera di imaging in acciaio sulla metà inferiore con il vetrino coprioggetti e serrare con le quattro viti associate alla camera. Controllare visivamente dal lato per assicurarsi che la metà superiore sia posizionata uniformemente nella metà inferiore (Figura 1B).
- Riempire la camera con 7 – 8 mL di M9 buffer19, un tampone isotonico che aiuta a prevenire gli embrioni in fase precoce di soccombere alla pressione osmotica anormale. gli embrioni a 1 cellula e anche a 2 cellule sono osmoticamente sensibili e possono svilupparsi anormalmente se non in questo tampone isotonico. Anche gli embrioni tendono ad arrestarlo a 3 volte se l'M9 viene sostituito con acqua.
2. preparazione di campioni di embrioni C. elegans per il montaggio
Nota: circa 18 ore prima dell'imaging, cinque giovani (1 giorno dopo la molt finale) adulti e dieci larvale Stage 4 (L4) C. elegans sono prelevati a un mezzo di crescita nematode (NGM) piatto agar seminati con E. coli ceppo OP50. Plettri di filo di platino sono utilizzati per spostare le larve e giovani adulti C. elegans senza danneggiare l'animale19.
- Preparare un 1% di metilcellulosa (Cat. No. H7509-25G) soluzione in tampone M9.
Nota: il metile cellulosa deve essere mescolato in M9 caldo fino a quando non viene sciolto. Una volta preparata, questa soluzione può essere conservata a temperatura ambiente. - Aggiungere 500 μL di soluzione di 1% metilcellulosa-in-M9 nella depressione di un vetrino concavo. Questo tampone viscose viene utilizzato in due occasioni: 1) quando si raccolgono embrioni precoci mediante dissezione di vermi adulti e 2) quando si lavano embrioni in fase tardiva prelevati direttamente da una piastra NGM.
Nota: il metil cellulosa viene utilizzato per evitare che gli embrioni si attacchino allo scivolo del microscopio. - Per l'imaging di embrioni in fase tardiva, prelevare gli embrioni di C. elegans (preferibilmente da una piastra NGM con giovani adulti presenti) utilizzando un plettro per ciglia e spostare gli embrioni all'1% di metilcellulosa sul vetrino concavo. Il plettro ciglia aiuta a ridurre la forza e quindi minimizzare lo stress o danni agli embrioni durante la manipolazione. La procedura per effettuare un prelievo ciglia è coperta da Hart20.
- Con un secondo pick ciglia (nella mano opposta), toccare delicatamente entrambe le ciglia insieme per sospendere gli embrioni in metilcellulosa.
- Facoltativo: se si pianifica di lignare le cellule embrionali con StarryNite, si deve montare embrioni da 1 cellula a 4 cellule. Per farlo, selezionare prima i giovani adulti da una placca NGM e spostarli nella soluzione di cellulosa M9-metile sulla slitta del microscopio concavo utilizzando un plettro di filo di platino.
- Facoltativo: con le punte affilate degli aghi ipodermici (n. 18G x 1 1/2), affettare l'animale trasversalmente al corpo centrale per rilasciare embrioni da 1 cellula a 4 cellule.
3. la pipetta della bocca: assemblaggio del tubo aspiratore con pipetta microcapillare
Nota: usiamo un tubo aspiratore con una pipetta microcapillare tirata a mano inserita nella guarnizione in gomma del tubo. Questo ci permette di trasferire embrioni dalla slitta dissezione alla superficie rivestita in poli-L-lisina nella camera di imaging riempita di buffer.
- Tirare manualmente la pipetta microcapillare su una fiamma aperta per creare due metà con punte allungate.
- Prendere una metà della pipetta microcapillare e inserire l'estremità smussata nella guarnizione in gomma del tubo dell'aspiratore (Figura 1C). Impostare l'altra metà della pipetta microcapillare da parte per l'uso in un secondo momento (se necessario).
- Con il tubo aspiratore assemblato dotato di pipetta microcapillare, rompere delicatamente la punta della pipetta microcapillare e creare un'apertura che si adatta a circa 1 – 2 due embrioni (da qui su questo strumento si chiama "pipetta a bocca").
4. montaggio di embrioni C. elegans su vetrino rivestito in poli-L-lisina
- Con il boccaglio aspiratore tenuto delicatamente tra i denti, pre-riempire la pipetta microcapillare con 10-15 μL di tampone M9 e poi aspirare delicatamente diversi embrioni dal vetrino concavo nel capillare.
- Trasferire gli embrioni nella camera di imaging in acciaio riempita con il tampone M9, posizionando la punta capillare in modo che gli embrioni cadano nel rettangolo centrale del vetrino coprioggetti.
- Evitando lesioni agli embrioni, spostarli delicatamente con un plettro per ciglia o utilizzare la pipetta per posizionare gli embrioni verticalmente, per orientare gli embrioni in modo che l'asse lungo dell'embrione sia perpendicolare all'asse lungo del vetrino coprioggetti (Figura 1B inserto , pannello inferiore).
Nota: il posizionamento dell'embrione in questo orientamento minimizza il numero di fette all'immagine, riducendo così il dosaggio della luce e il tempo di elaborazione dei dati migliorando la velocità di acquisizione. - Collocare la camera di imaging in acciaio nel supporto del campione sulla fase del microscopio (Figura 1D).
5. assemblaggio, configurazione del software e ottimizzazione laser per l'imaging embrionale utilizzando il diSPIM
- Vedere le istruzioni dettagliate su come assemblare l'intero diSPIM accoppiato in fibra da parti disponibili in commercio in Kumar et al.10,11 e a http://www.dispim.org. Un video-protocollo di come assemblare il diSPIM è disponibile anche sul sito ASI (http://www.asiimaging.com).
Nota: la configurazione dello strumento per questo protocollo è identica a Kumar et al.10,11 dispim, che fa uso di lenti a immersione in acqua 40x 0.8 na per l'imaging. L'unica differenza tra la configurazione in questo protocollo e Kumar et al.10,11 è l'aggiunta di uno specchio dicroico (divisione a 560 nm) e filtri passa-banda rosso e verde all'interno di un dispositivo di divisione di imaging (modello A12801-01) installato sul entrambi i bracci di imaging diSPIM. L'aggiunta di ottiche di suddivisione delle immagini consente la cattura simultanea di immagini da due fluorofori distinti – eccitati da 561 Nm e 488 nm laser – separando le bande di emissione su due metà dello stesso chip della telecamera. - Dopo l'assemblaggio dello strumento, controllare l'allineamento ottico del diSPIM prima dell'imaging.
Nota: per allineare correttamente il diSPIM, vedere https://youtu.be/qnOrg30NNuE e per informazioni sull'hardware, http://dispim.org/hardware/objectives e http://www.asiimaging.com. - Utilizza la piattaforma open-source Micro-Manager (https://micro-manager.org/)21, che è stata ottimizzata per il funzionamento dei microscopi per fogli leggeri per l'imaging cellulare ad alta produttività22. Si consiglia l'uso del plugin ASI diSPIM per l'acquisizione multi-posizione, che consente l'imaging simultaneo fino a 30 embrioni come descritto23.
- Con Micro-Manager aperto, impostare intensità laser a ~ 179 μW (0,5) per 488 nm e ~ 79 μW (0,25) per 561 Nm (Figura 2a, rettangolo rosso).
Nota: queste sono le impostazioni raccomandate per l'imaging a lungo termine degli embrioni C. elegans utilizzando intervalli di 1 minuto. Durante l'imaging a doppio colore a lungo termine, il laser a 561 Nm viene utilizzato per l'immagine dei nuclei (mCherry:: Histone) fino a quando gli embrioni sono in fase di fagiolo, a quel punto il laser 488 nm viene poi acceso per immagine anche i neuroni etichettati con GFP. Queste condizioni di imaging sono ottimizzate per minimizzare la fototossicità e garantire la sopravvivenza e la schiusa degli embrioni, consentendo nel contempo di prolungare (12 – 14 ore) l'acquisizione continua di dati di neurosviluppo e di linearizzazione. - In Micro-Manager, scegliere il menu Plugins ≫ controllo dispositivo > ASI dispim per aprire la finestra ASI dispim (Figura 2B). Scegliere la scheda acquisizione . Nella sezione impostazioni salvataggio dati di questa scheda (rettangolo verde), sezione Impostazioni volume (quadrato blu) e sezione Impostazioni Slice (quadrato arancione), assicurarsi che ogni parametro sia impostato come illustrato nella Figura 2B.
Nota: il nostro software di analisi delle immagini CytoSHOW è adattato per funzionare con altri formati di dati di output opzionali, come serie di file OME-TIFF concatenate in massa e serie di file TIFF-stack creati dopo l'acquisizione tramite l'uso di una funzione di esportazione integrata in Micro-Manager. In genere, il formato di dati del file OME-TIFF fascicolato a singolo punto è utilizzato perché consente la visualizzazione in tempo reale e l'elaborazione del volume dell'immagine non appena vengono acquisiti i dati grezzi.
6. parametri ottimizzati per l'autofocus per immagini a lungo termine di embrioni C. elegans
- Impostare i parametri di autofocus Micro-Manager per le impostazioni ottimizzate per la qualità di lignaggio a lungo termine di immagini diSPIM di embrioni C. elegans . Nella finestra ASI diSPIM, fare clic sulla scheda autofocus (Figura 2C). Nella sezione Opzioni generali di autofocus (quadrato nero) specificare i parametri esattamente come mostrato. Si noti che il canale autofocus (quadrato rosso) deve specificare il canale di fluorescenza del canale nucleare negli esperimenti di linea.
Nota: se l'offset massimo è superiore a 5 μm, le immagini tendono a uscire dalla messa a fuoco. - Click, Plugins > strumenti di acquisizione > sovrapposizione di pattern.
- Nella finestra sovrapposizione modello , fare clic su Mostra griglia.
- Nella finestra ASI diSPIM , fare clic sulla scheda navigazione .
- Fare clic su caselle di controllo per trave e foglio del tracciato A o B, quindi fare clic su Live. Inizia l'acquisizione delle immagini. Si apre una finestra vista dal vivo . Selezionare la regione di analisi della messa a fuoco automatica dell'embrione disegnando una casella intorno all'embrione sul canale selezionato da 6,1 a.
Nota: in genere catturiamo 420 punti temporali per 10 embrioni per sessione di imaging. I dati grezzi per sessione di immagine sono tipicamente 1.7 TB, mentre i dati elaborati da StarryNite e deconvolved sono 1,4 TB (vedere i passaggi 9 e 10). Si consiglia di utilizzare HDD di grande capacità (18TB sul nostro sistema attuale) per l'acquisizione di immagini e piattaforme cloud per l'archiviazione di immagini. - Fare clic su Avvia acquisizione nella schedaacquisizione per iniziare l'acquisizione di immagini multidimensionali a lungo termine (Figura 2B).
7. apertura di immagini Micro-Manager RAW in CytoSHOW
- Scarica il bundle software da http://dispimlineage.wormguides.org.
Nota: il bundle software verrà scaricato come file. zip e sarà necessario estrarli nella cartella "C:\" Directory prima dell'uso. Ulteriori dettagli per l'installazione sono forniti a http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm. - Fare doppio clic sul file C:\cytoshowextrasforc\cytoshow_app.jnlp per iniziare a eseguire cytoshow.
- Scegliere il file di menu > nuovo > Monitor Dispim (Micro-Manager). Individuare la cartella del set di dati radice in cui sono state salvate le cartelle dei timepoint di acquisizione. Selezionare una cartella di timepoint e fare clic su Apri. Le finestre di navigazione multidimensionali (denominate finestre del Monitor Dispim ) vengono aperte automaticamente sia per spima che per SPIMB (Figura 3A).
Nota: queste finestre monitoreranno la cartella dei dati radice per le pile di timepoint RAW appena salvate (nel caso in cui un campione venga ancora registrato). Dopo aver acquisito ogni nuovo timepoint, ciascuna delle finestre che monitorano i bracci e le posizioni dei campioni SPIM distinti si aggiornerà per visualizzare l'intero DataSet multicanale 4D per ogni embrione.
8. generazione di immagini di proiezione max con CytoSHOW
Anche prima della deconvoluzione, i dati grezzi possono essere elaborati rapidamente per valutare le caratteristiche globali del campione.
- Fare clic sul pulsante Z-MIP sul pannello laterale sinistro della finestra dell'immagine (Figura 3A, rettangolo rosso) per effettuare le proiezioni di massima intensità attraverso la profondità completa e il corso a tempo pieno di una determinata posizione o braccio SPIM. Apparirà una finestra di iperimpilamento Z-proiezione .
- Nella finestra di iperimpilamento Z-proiezione , impostare il tipo di proiezione su intensità massima. Specificare i canali, le sezioni e i fotogrammi del punto temporale da elaborare in base alle preferenze dell'utente.
- Fare clic su OK al termine.
- Selezionare la posizione della cartella in cui salvare gli output di intensità massima dalla finestra di dialogo file, quindi fare clic su OK. Consentire un certo tempo (15-20 minuti, a seconda delle dimensioni del DataSet e la potenza di elaborazione del computer) per CytoSHOW per generare immagini di proiezione.
9. analisi dei lignaggi delle cellule in dati volumetrici ad alta risoluzione isotropica
- Facoltativo: con i dati grezzi aperti tramite il Monitor Dispim in cytoshow, selezionare lo strumento di selezione poligono (Figura 3A, frecce nere) e fare clic appena fuori dai bordi anteriore, posteriore, dorsale e ventrale dell'embrione (in quell'ordine esatto) per generare un pattern "Bowtie" sull'embrione. Fare per entrambe le viste (SPIM-A e SPIM-B, Figura 3A).
Nota: questa selezione specifica la regione ellittica di interesse (ROI) in cui l'embrione è centrato e registra l'asse anteriore-posteriore dell'embrione. Il modello bowtie spunti CytoSHOW che l'utente prevede di specificare ulteriormente una rotazione precisa dei volumi fusi isotropicamente finali in un orientamento che è ottimale per le analisi di lineaging da StarryNite/AceTree. Nei casi in cui la lineaging StarryNite non fa parte del piano sperimentale, è possibile scegliere altri strumenti e forme di selezione per impostare il ROI per l'elaborazione delle immagini. - Se più embrioni sono stati simultaneamente iminvecchiati utilizzando l'opzione di acquisizione multi-posizione, aprire ed eseguire Step 9,1 per tutti gli embrioni. Ciò consentirà l'esecuzione parallela di passi futuri per tutti gli embrioni in una sessione. Chiudere le finestre SIMA e SPIMB per gli embrioni che non si desidera trattare.
- Fare clic sul pulsante dispim sul pannello laterale sinistro della finestra del monitor dispim (Figura 3A, evidenziata in giallo). In questo modo viene rivelato un sottopannello di controlli specifici per l'elaborazione diSPIM.
- Allineare i canali verde e rosso per ogni braccio SPIM. Poiché i separatori di canale di emissione vengono utilizzati per catturare simultaneamente immagini rosse e verdi distinte sulla stessa fotocamera, è importante allineare visivamente la registrazione esatta dei pixel di questi due campi immagine fisicamente adiacenti quando sono sovrapposte. Il riutilizzo delle stesse regolazioni di allineamento è in genere fattibile in molte sessioni di imaging consecutive, ma deve essere controllato (come nei passaggi 9.4.1 – 9.4.5).
- Partendo dal pannello SPIMA, selezionare il canale rosso spostando la barra di scorrimento cm a sinistra (Figura 3A, freccia arancione, pannello sinistro).
- Utilizzando i regolatori x, y e z (Figura 3A, quadrato arancione), spostare il canale rosso in corrispondenza del verde.
- Fare clic sul pulsante Dispim (Figura 3A, evidenziata in giallo), per chiudere il Sottopannello e attivare la propagazione degli stessi turni in tutte le altre finestre di posizione .
- Verificare che il corretto allineamento venga propagato ad altri fotogrammi e punti temporali spostando la barra di scorrimento "z" (Figura 3A, freccia blu, pannello sinistro) e/o barra di scorrimento "t" (Figura 3A, freccia verde, pannello sinistro). Se è stata eseguita l'acquisizione di più posizioni e sono stati imitati diversi embrioni (passo 5,3), l'allineamento dovrebbe essere anche propagato a quegli embrioni. Confermare esaminando anche i numeri per gli Aggiustatori x, y e z (Figura 3A, quadrato arancione, che dovrebbe essere lo stesso per il pannello spima di tutti gli embrioni).
- Ripetere i passaggi 9.4.1 – 9.4.4 per la finestra del monitor diSPIM SPIMB (Figura 3A, pannello destro).
- Fare clic sul pulsante "Dispim" e poi sul pulsante "fuse" (Figura 3A, rettangolo blu) per aprire una finestra di dialogo denominata "Deconvolve/fuse Dispim Raw Data Volumes" (Figura 3B). Impostare i parametri come illustrato nella Figura 3B. Questi parametri vengono brevemente risolti nei seguenti passaggi secondari:
- Impostare la registrazione dei tasti sul canale 1 (488 nm laser) o 2 (561 nm laser). Selezionare il canale con segnale più denso o più onnipresente. Per gli esperimenti di linearaggio selezionare sempre il canale utilizzato per l'immagine della fluorescenza dell'istone nucleare onnipresente.
- Impostare l' orientamento relativo dei volumi di input su + 1 o-1. L'indice di orientamento corretto dipende da uno specifico posizionamento della videocamera di diSPIM (Figura 4).
Nota: in caso di incertezza, testare ogni opzione duplicando un singolo punto temporale da entrambe le finestredel monitor SPIM a e B dispim , seguendo i passaggi 9.1 – 9.12 e scegliendo arbitrariamente un volume di input relativo all'orientamento da testare. Orientamenti errati produrranno immagini sfocate con artefatti, mentre gli orientamenti corretti produrranno immagini chiare. Il valore di orientamento relativo dei volumi di input che produce l'immagine nitida può quindi essere riutilizzato per tutti i dati futuri provenienti dallo strumento dispim specificato. - Scegliere se il volume fuso deve essere orientato come il volume di ingresso A o B (in base alle preferenze dell'utente).
- Selezionare "registrazione fresca per ogni volume". Questa opzione controlla come SpimFusion calcola le matrici di registrazione per ogni coppia di volumi in ogni timepoint. L'opzione "Fresh" consente all'algoritmo di ottimizzare la registrazione in modo adattivo ad ogni timepoint.
- Impostare il numero di iterazioni di deconvoluzione su 10. Questo numero tende a produrre in modo affidabile l'alta risoluzione desiderata in modo efficiente nel tempo.
- Facoltativo: se si desidera la lineatura automatica (consigliata), controllare auto-lanciare la linea StarryNite di volumi fusi. Questa opzione avvierà automaticamente starrynite per segmentare e tracciare le celle nei volumi immagine prodotti da spimfusion.
- Facoltativo: per la massima accuratezza nella linearizzazione automatizzata, è meglio riposizionare i volumi di embrioni fusi isotropicamente nell'orientamento canonico "ADL" (anamento [x-ovest], DOrsal [y-Nord], sinistra [z-near]). Selezionare l'opzione Definisci l'orientamento dell'output del volume in anteprima per indicare questa scelta. CytoSHOW risponderà elaborando una coppia iniziale di volumi fusi isotropicamente, permettendo all'utente di osservare attentamente e specificare le rotazioni necessarie per ottenere la registrazione ADL.
- Fare clic su Sì una volta selezionati tutti i parametri.
- Specificare la directory di output in cui salvare i file elaborati. Fare clic su OK.
- Facoltativo: se è stata selezionata l'opzione Definisci l'orientamento di uscita del volume in anteprima , impostare la barra di scorrimento t (Figura 3A, freccia verde, pannello sinistro) nella finestra SPIM-a fino al punto temporale iniziale in cui le celle ABA e ABP hanno raggiunto la metafase. Impostare la barra di scorrimento t nella finestra SPIM-B alla fase successiva di sviluppo. Questo aiuterà a specificare l'orientamento ADL.
- Facoltativo: fare clic su OK quando è pronto. Se è stata selezionata l'opzione Anteprima in 9.5.7 sopra, solo due volumi di anteprima saranno fusi isotropicamente per i timepoint indicati dai cursori a t delle finestre delle immagini SPIM-A e SPIM-B. Questi due timepoint di anteprima possono essere utilizzati per specificare un riallineamento preciso dei volumi degli embrioni in uscita all'orientamento ADL, come spiegato di seguito.
- Individuare la nuova visualizzazione 3DProjY_Decon-Fuse_.... finestra. Spostate la barra di scorrimento t sul punto 2 di questa finestra di anteprima. Spostare il cursore Z fino a visualizzare la vista direttamente verso il basso sull'asse lungo dell'embrione.
- Spostare la barra di scorrimento t indietro al punto 1 del 3DProjY_Decon-Fuse_.... finestra. Scegliere lo strumento di selezione della linea e tracciare una selezione della linea dalla cella EMS (nucleo più rotondo ventrale) attraverso il piano delle piastre di metafase AB-Cell.
- Fare clic sul pulsante Anteprima arancione diSPIM sul 3DProjY_Decon-Fuse_.... finestra. Le regolazioni di precisione per l'orientamento del volume visualizzato in anteprima verranno salvate per l'utilizzo nell'elaborazione del set di dati completo.
- Facoltativo: la finestra di dialogo Deconvolve/fuse diSPIM Raw Data Volumes riapparirà, proprio come nel passaggio 9,5 sopra. Fare clic su Sì senza scegliere l' orientamento di output del volume Definisci nell'opzione Anteprima . Specificare la cartella di output per l'esecuzione completa dell'elaborazione dei dati.
- Impostare le barre di scorrimento t (Figura 3A, freccia verde, pannello sinistro) delle finestre del monitor dispim sul TIMEPOINT iniziale (spima) e sul timepoint finale (spimb) dell'intero intervallo di immagini da elaborare. Quindi fare clic su OK.
- Mentre SpimFusion progredisce, CytoSHOW apre e aggiorna una finestra multidimensionale che mostra il volume fuso isotropico a fette-4D per ogni embrione, così come due finestre con proiezioni di intensità massima rotante-4D del volume isotropico. Durante questo periodo, non interrompere o chiudere alcuna finestra cytoshow fino a quando la fusione isotropica e il tracciamento lignaggio sono completi.
- Facoltativo: si noti che una volta che la schermata iniziale di StarryNite è apparsa e successivamente è scomparsa, la pipeline di elaborazione dei dati completa è stata completata. Questa finestra non deve essere chiusa durante l'elaborazione o StarryNite sarà interrotto.
10. apertura della serie di tracce di lignaggio StarryNite in AceTree (opzionale)
- Aprire la versione personalizzata di "AceTree_16BitCompat. jar" fornita.
- Scegliere il menu file > aprire Configura file. Individuare la directory di output precedentemente indicata per cytoshow. Aprire la sottocartella Decon_Fuse_... _ pos [n] per l'embrione [n]. Selezionare aaa_edited. XML e aprire.
- Utilizzare il menu di AceTree modifica > strumenti di modifica per aprire la traccia di modifica e regolare o eliminare le celle di Windows.
- Fare clic sul cerchio a metà ombreggiato Figura 5b, quadrato rosso per regolare le intensità rosso e verde.
- Procedi con la visualizzazione e la modifica del lignaggio come descritto in precedenza5,6,8 (i manoscritti sono inclusi anche nel nostro pacchetto di download).
Representative Results
Per prima cosa abbiamo convalidato la redditività degli embrioni iminvecchiati utilizzando i parametri del protocollo per l'acquisizione di diSPIM (sezioni 1-6). Dieci embrioni sono stati simultaneamente iminvecchiati a 20 ° c, un volume/embrione/minuto, dalla fase a 2 cellule fino allo stadio 2 volte (7,5 ore, 451 volumi/embrione). Per monitorare le divisioni cellulari in tutta l'embriogenesi, abbiamo usato il ceppo BV514, che esprime in modo onnipresente i costrutti reporter mCherry::Histone dall'array transgenico integrato ujIs11324. La Figura 6 Mostra una linea temporale di questa prima metà dello sviluppo embrionale per uno degli embrioni iminvecchiati. Ogni immagine rappresenta una proiezione ad intensità massima a vista singola (prodotta dai passaggi 7-8) dell'embrione immaturato. Abbiamo riscontrato che i protocolli ottimizzati non inducono alcuna fototossicità rilevabile agli embrioni, come valutato dalla tempistica delle divisioni cellulari (non mostrate), dal tempo di cova e dai tempi relativi alle tappe dello sviluppo (Figura 6 e riferimenti1 , 25 il , 26).
Abbiamo quindi applicato il protocollo per analizzare le dinamiche di conseguenza dei singoli neuroni nello sviluppo di embrioni. Abbiamo immagine DCR7692 (olaex4655), un ceppo di nematode transgenico che esprime GFP off il neuropeptide FLP-19 promoter in un sottoinsieme di cellule non identificate (DACR2819, PFLP-19 (3.6 KB):: Syn21:: GFP:: CAAX::p 10 3' UTR) . Seguendo le fasi del protocollo qui delineato, abbiamo stabilito che le cellule non identificate corrispondono ai motoneuroni RMDDL e RMDDR, alla cellula del canale escretore, e a due cellule muscolari (Figura 7). Abbiamo poi esaminato e quantificato le dinamiche di conseguenza dei neuroni rmddl e rmddr. Abbiamo osservato che i neuroni RMDDL e RMDDR sono sagomati obliquamente già 360 minuti dopo la fertilizzazione, con l'asse cellulare più lungo che rappresenta l'asse successivo per la crescita del neurite (Figura 7 e film S1). Utilizzando il plugin "semplice neurite tracing" in FIJI e applicandolo alle ricostruzioni 3D dei volumi isotropicali fusi, abbiamo quindi quantificato la crescita stereotipata dei neuriti RMDDL e RMDDR per sei embrioni. Abbiamo stabilito che le dinamiche di conseguenza sono state stereotipate per rmddl e rmddr attraverso gli embrioni (qui denominati rmdd). A partire da 385-410 minuti dopo la fertilizzazione, i neuriti Rmdd hanno esteso 6,0 ± 0,5 μm (media ± SEM; n = 12 neurites) anteriori dei corpi cellulari (Figura 7b, C, I). A partire da 415-445 minuti dopo la fertilizzazione, entrambi i neuriti si estendono all'interno e all'intorno dell'anello nervoso presuntivo (asterisco in Figura 7D). In media, ogni neurite RMDD estesa 11,0 ± 0,6 μm (media ± SEM; n = 12 neuriti) dal corpo cellulare prima di incontrare in modo sincrono la sua controparte controlaterale all'apice dell'anello (Figura 7i). È importante sottolineare che i nostri risultati rappresentativi dimostrano che siamo in grado di esaminare, confrontare e quantificare le caratteristiche di sviluppo neuronale per le singole cellule identificabili utilizzando il nostro protocollo integrato (Figura 7 e Figura 8).
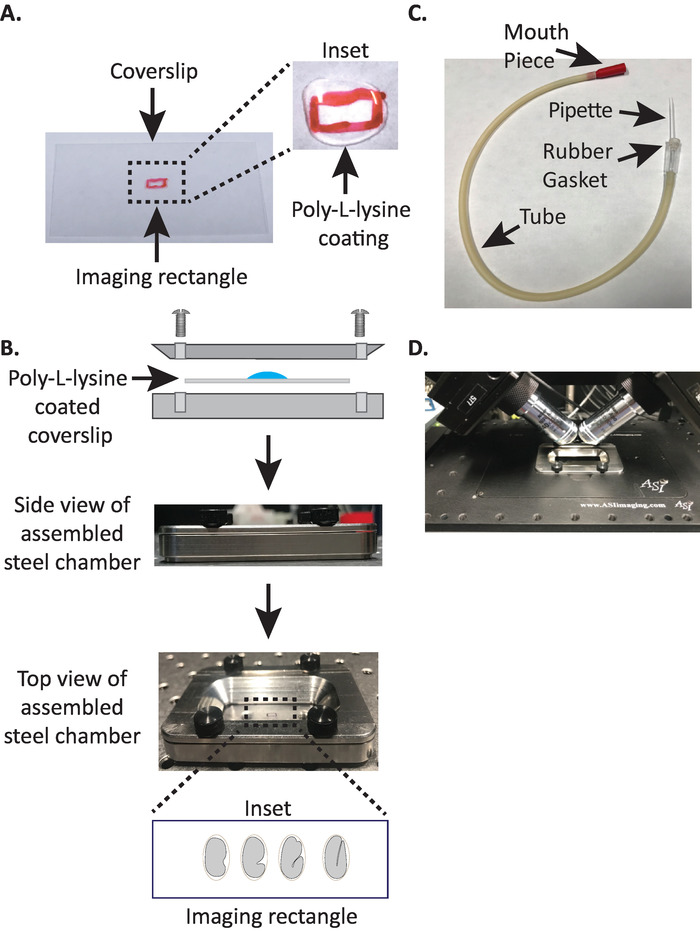
Figura 1: impostazione del montaggio del campione diSPIM. (A) preparazione del vetrino coprioggetti con poli-L-lisina. Nell'inserto, 10 μL di lisina Poly-L è stato utilizzato per rivestire il vetrino coprioggetti per 5 minuti. Poly-L-lisina permette l'embrione uovo di attaccare saldamente al vetrino coprioggetti nel rettangolo. B) schema della camera di imaging in acciaio e della camera assemblata. Negli inset, gli embrioni rappresentativi sono orientati con l'asse anteriore-posteriore perpendicolare all'asse lungo sul coprioggetto. C) tubo aspiratore assemblato con pipetta microcapillare. D) camera di imaging in acciaio montata nel supporto del campione secondo gli obiettivi dispim 40x. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 2: configurazione di imaging diSPIM a lungo termine in Micro-Manager. (A) parametri di potenza laser dispim consigliati (rettangolo rosso) ottimizzati per l'imaging prolungato, riducendo la fototossicità (come valutato con un tasso di cova più elevato di embrioni di C. elegans ). Impostare 561 nm laser a 79 μW (0,25) e 488 nm laser a 179 μW (0,5). Si noti che la calibrazione esatta delle impostazioni del software per la potenza laser varia tra le installazioni diSPIM. Si raccomanda agli utilizzatori di misurare e calibrare la potenza del laser al fine di ottenere 79 μW (561 Nm) e 179 μW (488 nm) di potenza laser. (B) parametri dispim per il salvataggio dei dati (rettangolo verde), le impostazioni del volume (quadrato blu) e le impostazioni di taglio (quadrato arancione). (C) parametri di messa a fuoco automatica dispim per immagini a lungo termine dell'embriogenesi C. elegans (vedere passaggi 6.1-6.6). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 3: visualizzazione delle immagini e impostazione dell'elaborazione dei dati tramite CytoSHOW. (A) immagini dispim RAW aperte da cytoshow. CytoSHOW è in grado di aprire le immagini catturate da entrambi i percorsi della telecamera (SPIM A e B). Queste immagini RAW vengono aperte in finestre multidimensionali chiamate Monitor Dispim. Nel Monitor Dispimviene generato un "pattern bowtie" per selezionare i bordi anteriori, posteriori, dorsali e ventrale dell'embrione (vedere il passo 9,1). Le selezioni di Papillon indicano l'orientamento dell'embrione per la deconvoluzione e la tracciatura di lineaging assistita da StarryNite. (B) parametri ottimizzati utilizzati per generare immagini isotropiche. Nella finestra Deconvolved durante l'acquisizione , impostare i parametri specificati nei passaggi 9.5.1-9.5.8. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 4: configurazione della telecamera diSPIM. (A) fotografia di posizionamenti e orientamenti della fotocamera dispim. (B) rappresentazione di + 90 rotazioni di grado di SPIM a per abbinare le immagini SPIM B raccolte. (C) volumi di input relativi all'indice di orientamento + 1 in base alla configurazione della fotocamera del dispim (vedere il passo 9.5.2). Ruotiamo SPIM un'immagine (s) + 90 gradi intorno asse Y prima della registrazione per abbinare SPIM B immagine (s). Barre di scala = 10 μm. le immagini sono rappresentative a vista singola, proiezioni di massima intensità e immagini deconvoluzione di embrione di 1,5 volte con nuclei etichettati (561-Nm, rosso) e neuroni (488-nm, verde). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 5: curation e modifica del lignaggio embrionale C. elegans in acetree. (A) usiamo acetree per modificare le tracce di lignaggio di starrynite (vedi riferimenti5,6,8; i manoscritti sono inclusi anche nel nostro pacchetto di download). AceTree visualizzerà C. elegans nomi sistematici per ogni nucleo (rettangolo verde) al completamento dei passaggi 10.1-10.2. Questa finestra (a) fornisce informazioni (rettangolo nero) su ogni cella nella traccia di derivazione (ABA, evidenziata in blu) che consentono di guidare gli utenti durante il rilevamento e la modifica delle tracce di derivazione. Si raccomanda agli utenti di verificare e confrontare le celle linearate e le loro posizioni al lignaggio di cellule embrionali C. elegans precedentemente segnalati da Sulston et al.1 inoltre, se gli utenti sono interessati a localizzare celle specifiche nel serie di dati deconvolved (Vedi sotto, B) immettere il nome sistematico C. elegans nella barra di ricerca (rettangolo arancione). (B) la serie di dati deconvolved dell'utente si apre automaticamente anche al completamento dei passaggi 10.1-10.2. Qui viene mostrata un'immagine isotropicamente fusa di un embrione a quattro celle con nuclei etichettati in rosso. Durante il tracciamento di un nucleo, gli utenti dovrebbero cambiare l'intensità dell'immagine (quadrato rosso) e navigare attraverso il tempo e z utilizzando i tasti freccia sulla loro tastiera (tempo-sinistra/destra, z-su/giù). (C) fumetto 3D del timepoint in (B) con alcune funzionalità (rettangolo viola) che consente la visualizzazione 3D ruotabile. Per una panoramica dell'acetree e della sua funzionalità 3D, vedere i riferimenti5,6,8. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 6: dinamiche evolutive cronometrate degli embrioni di C. elegans sul dispim. Pannello superiore, immagini diSPIM che mostrano la prima metà dello sviluppo embrionale per uno degli embrioni iminvecchiati (strain BV514 ujIs11324). Gli embrioni sono stati continuamente iminvecchiati, ogni minuto per 7,5 ore (a 20 ° c). Le prime due immagini del pannello superiore rappresentano embrioni a 4 e 8 celle con nuclei (rossi) e posizioni di corpi polari (sfere rosse dense, contrassegnate con asterischi blu). Ogni immagine rappresenta una proiezione ad intensità massima a vista singola dell'embrione immaturato. Barre di scala = 10 μm. La Timeline (barra orizzontale) rappresenta i minuti dopo la fertilizzazione (m.p.f.) dello sviluppo degli embrioni di C. elegans . Abbiamo convalidato che i parametri del nostro protocollo per l'acquisizione di diSPIM non inducesse alcuna fototossicità rilevabile agli embrioni iminvecchiati come valutati dalla vitalità, dalla tempistica delle divisioni cellulari, dalla tempistica della schiusa e dalla tempistica delle tappe di sviluppo (vedere riferimenti 1 il , 25 il , 26). notiamo che i tempi delle tappe dello sviluppo sono stati riproducibili attraverso gli embrioni con i nostri parametri di imaging (SEM ± 8,174 minuti per sessioni di imaging lunghe 6,4 ore; n = 10). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 7. Identificazione cellulare e caratterizzazione a cellula singola delle dinamiche di crescita del neurite nello sviluppo di embrioni di C. elegans . Imaging a doppio colore di una deformazione effettuata attraversando BV514 ujIs11324 (per la Lineage) e DCR7692 (olaex4655), un ceppo di nematode transgenico che esprime GFP al di fuori del promotore del neuropeptide FLP-19 in un sottoinsieme di cellule non identificate. (A-H) Seguendo le fasi del protocollo qui delineato, abbiamo stabilito che le cellule non identificate corrispondono ai motoneuroni RMDDL e RMDDR (frecce gialle), alla cellula del canale escretore (frecce blu), e a due cellule muscolari (frecce bianche). (I) quantificazione delle dinamiche di conseguenza dei neuroni rmddl e rmddr utilizzando il plugin Fiji "semplice rintracciamento del neurite" e applicandolo alle ricostruzioni 3D dei volumi fusi isotropicamente. Si noti che rmddl e rmddr mostrano dinamiche di conseguenza stereotipare, ognuna delle quali si estende in modo sincrono per una lunghezza totale di 11,0 ± 0,6 μm (media ± SEM; n = 12 neurites) e incontro all'apice dorsale dell'anello nervoso (vedere anche film S1). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 8: esame delle immagini diSPIM isotropiche delle morfologie neuronali negli embrioni di C. elegans . Visualizzazione isotropica dei neuroni AVHL e AVHR (frecce gialle). Utilizzando il diSPIM, le morfologie neuronali possono essere catturate producendo immagini quadridimensionali (4D) con risoluzione spaziale isotropica di circa 330 Nm. Il diSPIM consente agli utenti di ruotare virtualmente i volumi di immagine con risoluzione identica in tutte le direzioni. Le immagini in a-D sono proiezioni di massima intensità dello stesso volume di immagini dispim fusi isotropicamente da rotazioni distinte intorno all'asse lungo dell'embrione. Barre di scala = 5 μm. fare clic qui per visualizzare una versione più grande di questa figura.
Film integrativo S1: C. elegans sviluppo embrionale da 280 a 434 minuti dopo la fertilizzazione. Film isotropico del ceppo DCR7692 (olaex4655) che esprime ujIs113 ubiquamente con DACR2819 neurites rmdd etichettando scarsamente (Figura 7a-d, frecce gialle). DACR2819 anche etichettare due cellule muscolari (Figura 7a-d, frecce bianche) e la cellula del canale escretore (Figura 7a-d, freccia blu) durante lo sviluppo embrionale (Figura 7a-d). Barre di scala = 10 μm. Clicca qui per scaricare questo file.
Discussion
C. elegans si distingue come l'unico organismo con le posizioni finali e la connettività di ogni neurone adulto noto27. Tuttavia, le dinamiche evolutive che portano all'organizzazione dei circuiti di lavoro e delle reti che compongono il connettoma di C. elegans restano sconosciute. In base alle opportunità che emergono dai progressi nella microscopia leggera, possiamo ora catturare e analizzare le posizioni delle cellule, la morfogenesi e la neurogenesi in tutto lo sviluppo embrionale di C. elegans .
La procedura che abbiamo descritto e che ordinariamente usiamo in laboratorio produce immagini 4D-isotropiche di neuroni etichettati e nuclei per la linearazione delle cellule negli embrioni C. elegans . Ancora più importante, abbiamo ottimizzato le condizioni di imaging a lungo termine con il diSPIM e accoppiato semi-automatizzato capacità di linearizzazione con immagini ad alta risoluzione per migliorare la velocità e la precisione di analisi C. elegans embriogenesi. Questo protocollo integrato consentirà agli utenti di visualizzare e identificare le cellule e di quantificare le caratteristiche tridimensionali come la migrazione del neurite e la fascicolazione degli assoni attraverso l'insorgenza di spasmi precoci. Questa procedura può essere facilmente adattata in qualsiasi struttura con un sistema ASI diSPIM e raccomandiamo questo sistema in modo specifico per questo protocollo. Altre formulazioni SPIM offerte commercialmente possono differire dalla configurazione ASI nella camera di campionamento e le proprietà ottiche. Tuttavia, i dati esportati da altre piattaforme possono anche essere messi attraverso la nostra pipeline di dati. Pertanto, è fattibile la valutazione del loro valore in linea, un test impegnativo di qualità dell'immagine e stabilità dello strumento. Anche se usiamo attivamente il diSPIM per l'immagine periodica di altri esemplari (come la Drosophila e gli embrioni di pesce zebra), l'analisi di lignaggio descritta e completa degli embrioni è ancora attualmente limitata alle specie di nematode. Per i campioni più grandi o spessi, optiamo per utilizzare approcci di scansione dello stage, che scansionano i campioni attraverso un foglio luminoso stazionario. Hanno precedentemente dimostrato questo sezionamento di diSPIM migliorato per produrre immagini di alta qualità da campioni spessi senza ulteriori modifiche al diSPIM10.
I passaggi critici all'interno del protocollo includono il montaggio di embrioni C. elegans sul vetrino rivestito in poli-L-lisina, l'acquisizione dei dati e l'elaborazione dei dati. La raccolta e il montaggio di embrioni C. elegans sul vetrino coprivetrino può essere impegnativo per gli utenti inesperti, ma qui forniamo un protocollo dettagliato di passaggi chiave per facilitare l'apprendimento. Se si desidera l'imaging a lungo termine, otteniamo i migliori risultati raccogliendo quattro celle o embrioni precedenti da 8-10 giovani adulti28. Si noti che i vecchi adulti sono meno desiderabili di raccogliere embrioni in fase precoce perché tendono a contenere embrioni più vecchi nell'utero e uova non fertilizzate. Per quanto riguarda gli embrioni di montaggio, problemi quali il blocco nell'aspiratore assemblato (pipetta per bocca) o un troppo grande di un'apertura nella pipetta microcapillare possono impedire il corretto montaggio e l'orientamento degli embrioni. Per prepararsi all'imaging ottimale, eseguiamo test di pre-acquisizione su embrioni precoci e ritardanti per verificare le prestazioni dei fogli leggeri, delle fotocamere, degli obiettivi e dell'autofocus. Otteniamo i migliori risultati quando tutte queste operazioni vengono testate e producono immagini di alta qualità durante i test di pre-acquisizione. Ciò è particolarmente rilevante per la generazione di immagini con risoluzione spaziale isotropica, per cui le immagini raw acquisite da entrambe le viste (obiettivi) devono essere di alta qualità. Dopo l'acquisizione, i volumi acquisiti per ogni vista vengono elaborati per produrre immagini isotropiche. È importante utilizzare una scheda di elaborazione grafica (GPU) appropriata come descritto in questo protocollo (vedere di seguito). Ciò migliora la velocità di elaborazione alla quale vengono generate le immagini con fusibili isotropicali, abbreviando il tempo di analisi dei dati. È inoltre imperativo che gli utenti stiano eseguendo l'ultima versione di CytoSHOW e stiano utilizzando i parametri forniti con il nostro bundle di download per la linea automatica StarryNite. Se gli utenti sono interessati a utilizzare la linearizzazione automatica per altri campioni (ad esempio, zebrafish, Drosophila ecc.), sarà necessaria un'ulteriore ottimizzazione dei parametri utilizzati in starrynite (vedere riferimenti3,4).
Anche se il nostro protocollo integrato fornisce immagini e risultati di linearizzazione nell'embrione pre-spasmi, gli utenti devono essere consapevoli che la linearizzazione automatizzata nell'embrione post-spasmi non è attualmente fattibile: le posizioni nucleari cambiano nell'ordine dei secondi nel embrione post-contrazione, troppo rapidamente per consentire il tracciamento del lignaggio. Tuttavia, il dispim ha effettivamente dimostrato una capacità promettente per catturare eventi di sviluppo neurologico e tenere traccia di alcune posizioni cellulari nelle fasi post-contrazione dell'embriogenesi23,29. Se gli utenti sono interessati ad esaminare l'embrione post-spasmi, il diSPIM fornisce la velocità per ottenere istantanee volumetriche e tenere traccia di eventi neuroevolutivi fini, come la crescita del neurite, in embrioni in rapido movimento.
Questo protocollo sarà fondamentale per il completamento cellulare per cella del WormGUIDES Atlas30, in quanto fornirà un approccio integrato con immagini isotropiche ad alta risoluzione per identificare e catturare morfologie 3D di neuroni etichettati durante primi 430 minuti di embriogenesi. Così com'è, il prototipo di WormGUIDES Atlas fornisce posizioni nucleari di cellule nell'embrione in via di sviluppo e mira a catturare le dinamiche evolutive di un sottoinsieme di neuroni embrionali. Questo protocollo sarà una chiave per l'integrazione di ulteriori neuroni in via di sviluppo nell'Atlante WormGUIDES30.
Il nostro protocollo integrato semplificherà anche l'esplorazione di nuovi profili di espressione genica nell'embrione C. elegans . In C. eleganstransgenici, molti promotori specifici delle cellule controllano spazialmente e temporalmente l'espressione transgenica. Mentre i modelli di espressione della maggior parte dei geni sono stati ampiamente caratterizzati nell'animale adulto31,32,33,34, quasi tutti devono ancora essere caratterizzati nello sviluppo (soprattutto tardo stadio) embrionale. Il C. elegans promoterome è stata una risorsa utile per la comunità di worm per guidare l'espressione transgenica specifica delle cellule, così come determinare se la funzione genica è cellula-autonoma o non autonoma. Catturare i modelli isotropici ad alta risoluzione e di espressione dinamica dei geni, e identificare con precisione le cellule che esprimono attraverso la lineaging, sarà prezioso per molti nella comunità scientifica.
L'embriogenesi comprende due processi principali intrecciati, la differenziazione cellulare e la morfologenesi tissutale. Si conoscono molto i meccanismi e le molecole che definiscono i tipi di cellule distinti durante lo sviluppo di C. elegans. Tuttavia, si sa poco sui meccanismi importanti per la migrazione cellulare, l'adesione delle cellule e la forma delle cellule nell'embrione C. elegans . Con il lignaggio di cellule invarianti C. elegans conosciuto, il nostro protocollo ci permette di discernere facilmente la microanatomia 3D catalogata dell'embrione durante la morfogenesi a nuovi livelli di dettaglio: ad esempio, fascicolazione degli assoni, sinaptogogia e attività neuronale. Hanno precedentemente dimostrato la potenza del diSPIM per catturare i transienti di calcio a livello di un singolo neuroni in C. elegans embrioni23. Molti altri aspetti della fisiologia dello sviluppo sono maturi per l'inchiesta con questi metodi.
Infine, questo protocollo è in gran parte automatizzato e riduce sistematicamente il tempo necessario per generare immagini di deconvoluzione ed eseguire la linearizzazione delle cellule tramite StarryNite e Acetree. Le strategie software utilizzate in questo protocollo possono essere applicate a molte domande di biologia lontane dai campi molto specifici in cui li abbiamo dimostrati qui.
Dettagli sulla compatibilità del software e sull'accesso al download
Le informazioni su Micro-Manager e plugin per l'imaging diSPIM sono disponibili su http://dispim.org/software/micro-manager e https://micro-manager.org/wiki/ASIdiSPIM_Plugin.
La pipeline di elaborazione dei dati richiede attualmente un sistema operativo Windows. Abbiamo in bundle un unico file di archivio per semplificare l'installazione di tutti i programmi di elaborazione dati necessari e file di supporto. È disponibile per il download su http://dispimlineage.wormguides.org.
CytoSHOW (http://run.cytoshow.org/) si basa sulla piattaforma di analisi dell'immagine ampiamente utilizzata e open source, ImageJ (V1). Java deve essere installato e aggiornato sul computer per utilizzare CytoSHOW e gli aggiornamenti di CytoSHOW vengono distribuiti automaticamente tramite Java Web Start. Molte funzioni basate su ImageJ di CytoSHOW sono descritte e illustrate in https://imagej.nih.gov/ij/docs/examples/index.html. CytoSHOW è stato personalizzato per visualizzare dati grezzi multidimensionali da ASI diSPIM, così come altri software di imaging che crea l'output TIFF. In linea di principio, altri sistemi di imaging SPIM multi-vista potrebbero essere supportati da piccole modifiche di CytoSHOW per consentire che questo protocollo venga eseguito su diversi sistemi di microscopio.
SpimFusion è stato scritto in CUDA/C++ utilizzando Visual Studio 2013 con CUDA Toolkit v 7.5. L'esecuzione di SpimFusion richiede hardware specifico per computer: una scheda GPU con capacità di elaborazione CUDA 1,0 o superiore e un minimo di 2 GB di memoria della scheda grafica. Al momento della pubblicazione del nostro protocollo, SpimFusion non è pubblicata (min Guo e Hari Shroff) ma disponibile nell'archivio del bundle software menzionato sopra.
Una versione di StarryNite basata sulla riga di comando appositamente costruita richiede che il MATLAB Compiler Runtime sia disponibile gratuitamente, ma non richiede una licenza per il software MATLAB commerciale. MATLAB Compiler Runtime è incluso nell'archivio del bundle software menzionato sopra. Il codice per StarryNite utilizzato in questo protocollo è sostanzialmente invariato rispetto a quello utilizzato per le immagini confocali6. Tuttavia, diverse questioni operative nella creazione di immagini di input per l'elaborazione di StarryNite e la gestione dei risultati di StarryNite sono state affrontate qui da metodi in CytoSHOW che consentono una pipeline di elaborazione dati continua per diSPIM isotropico fuso Volumi. Queste modifiche sono automatizzate dal codice CytoSHOW che gestisce questi passaggi di pre e post-elaborazione. CytoSHOW modifica anche un set di parametri StarryNite preottimizzato specifico per il modello diSPIM per sintonizzare automaticamente l'algoritmo di segmentazione all'intensità di fluorescenza dei nuclei nei dati iminvecchiati. I parametri univoci utilizzati da StarryNite su ogni set di dati diSPIM vengono quindi salvati in un file insieme all'immagine di output e ai dati di linearaging.
Una versione personalizzata di AceTree che funziona con immagini a 16 bit e mantiene la compatibilità con il rendering Java3D è più adatto per questo protocollo. È anche incluso nell'archivio del bundle software menzionato sopra.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Ringraziamo John Murray per il ceppo integrato, ujIs113, per generare deformazione BV514 di linea; Brandon Harvey (NIBIB) per l'aiuto nel testare il protocollo; Jon Daniels e Gary Rondeau (Strumentazione scientifica applicata) per assistenza con Micro-Manager e strumento diSPIM; e Andrew York e Hank Eden per il loro feedback critico sul sistema diSPIM. Ringraziamo anche il programma centro di ricerca per le istituzioni minoritarie e l'Instituto de Neurobiología Jose del Castillo (Universidad de Puerto Rico) per la fornitura di una piattaforma di incontro e di brainstorming. Gran parte di questo lavoro è stato condotto presso il laboratorio biologico marino a Woods Hole attraverso il programma Whitman. Questo lavoro è stato sostenuto dai programmi di ricerca intramurale del NIH National Institute of Biomedical Imaging and Bioengineering e da NIH Grant No. U01-HD075602 e no. R24-OD016474. Mark W. Moyle è stato supportato da F32-NS098616 e Leighton H. Duncan è stato sostenuto da un integratore Diversity a R24-OD016474.
Materials
| Name | Company | Catalog Number | Comments |
| Steps 1-4 | |||
| Concavity slides | ThermoFisher Scientific | 1519006 | 5-18mm diameter, 0.6-0.8mm deep, 1.2-1.5mm |
| Dissecting microscope with 10×–50× zoom range | Motic | SMZ-171 | |
| E. coli (OP50) | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Glass coverslips, no. 1.5, 24 × 50 mm | VWR International | 48393-241 | |
| M9 Buffer | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Methyl cellulose | Sigma-Aldrich | H7509-25G | |
| Microcapillary pipette aspirator tube | Sigma-Aldrich | A5177 | |
| Microcapillary pipettes, 0.4-mm i.d | Drummond Scientific | 1-000-800 | |
| Needle, no. 18G x 1 ½ (1.2mm x 40mm) | BD Precision Glide | 305196 | |
| NGM plates | prepared as described by Brenner (1974) | ||
| O-ring for imaging chamber | O-Rings West | M1.5X40 | |
| Pasteur pipette | Corning/Sigma-Aldrich | CLS7095D5X | |
| Platinum wire, 0.5-mm diameter | Sigma-Aldrich | 267201 | |
| Poly-L-lysine | Sigma-Aldrich | P1524 | |
| Stainless steel rectangular chamber (76.0 mm x 50.5 mm) | Applied Scientifics Instrumentations (ASI) | I2450 | |
| Worm Eyelash Pick | Hart, A. C. Behavior. WormBook. (2006). | ||
| Worm Pick | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Name | Company | Catalog Number | Comments |
| Steps 5-6 | |||
| 488 nm long-pass filter | Semrock | LP02-488 RU-2 | |
| 561-nm notch filter | Semrock | NF03-561E-25 | |
| BLP02-561R-25, quantity 2 | Semrock | 561 nm EdgeBasic best-value long-pass edge filter | |
| Control software for bottom camera | Jenoptik | ProgRes CapturePro | |
| diSIPM assembly video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/TAgbr6IrTqw ; http://www.asiimaging.com | |
| diSPIM alignment video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/qnOrg30NNuE | |
| diSPIM imaging PC | Intel | Intel Xeon CPU E5-2630 2.6GHz, 12 cores in total, 64 GB memory, Windows 7 | |
| FF01-525/45-25, quantity 2 | Semrock | 525/45 nm BrightLine single-band bandpass filter | |
| FF555-DI03-25X36, quantity 2 | Semrock | 555 nm edge BrightLine single-edge dichroic beamsplitter | |
| Imaging PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Kumar et al diSPIM Setup | Applied Scientifics Instrumentations (ASI) | Instrument setup for this protocol is identical to Kumar et al 10,11 diSPIM, which makes use of 40x 0.8NA water immersion lenses for imaging. (See steps 5.1 and note) | |
| Micro Manager | Micro-Manager | https://micro-manager.org/ | |
| Modifications to Kumar et al diSPIM Setup (see below) | |||
| Optical table with isolators, 4 feet × 6 feet × 12 inches | TMC | 784-651-02DR and 14-416-34 | |
| Name | Company | Catalog Number | Comments |
| Steps 7-10 | |||
| Analysis PC | Intel | Intel Core i7-8700K CPU 3.70GHz, 6 cores in total, 64 GB memory, Windows 10 | |
| Analysis PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Installation instructions | Software bundle | http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm | |
| Software bundle | Software bundle | http://dispimlineage.wormguides.org |
References
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Developmental Biology. 100 (1), 64-119 (1983).
- Bao, Z., et al. Automated cell lineage tracing in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 103 (8), 2707-2712 (2006).
- Santella, A., Du, Z., Bao, Z. A semi-local neighborhood-based framework for probabilistic cell lineage tracing. BMC Bioinformatics. 15, 217 (2014).
- Santella, A., Du, Z., Nowotschin, S., Hadjantonakis, A. K., Bao, Z. A hybrid blob-slice model for accurate and efficient detection of fluorescence labeled nuclei in 3D. BMC Bioinformatics. 11, 580 (2010).
- Boyle, T. J., Bao, Z., Murray, J. I., Araya, C. L., Waterston, R. H. AceTree: a tool for visual analysis of Caenorhabditis elegans embryogenesis. BMC Bioinformatics. 7, 275 (2006).
- Katzman, B., Tang, D., Santella, A., Bao, Z. AceTree: a major update and case study in the long term maintenance of open-source scientific software. BMC Bioinformatics. 19 (1), 121 (2018).
- Murray, J. I., et al. Automated analysis of embryonic gene expression with cellular resolution in C. elegans. Nature Methods. 5 (8), 703-709 (2008).
- Murray, J. I., Bao, Z., Boyle, T. J., Waterston, R. H. The lineaging of fluorescently-labeled Caenorhabditis elegans embryos with StarryNite and AceTree. Nature Protocols. 1 (3), 1468-1476 (2006).
- Wu, Y., et al. Spatially isotropic four-dimensional imaging with dual-view plane illumination microscopy. Nature Biotechnology. 31 (11), 1032-1038 (2013).
- Kumar, A., et al. Using Stage- and Slit-Scanning to Improve Contrast and Optical Sectioning in Dual-View Inverted Light Sheet Microscopy (diSPIM). The Biological Bulletin. 231 (1), 26-39 (2016).
- Kumar, A., et al. Dual-view plane illumination microscopy for rapid and spatially isotropic imaging. Nature Protocols. 9 (11), 2555-2573 (2014).
- Wu, Y., Christensen, R., Colon-Ramos, D., Shroff, H. Advanced optical imaging techniques for neurodevelopment. Current Opinion in Neurobiology. 23 (6), 1090-1097 (2013).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (43), 17708-17713 (2011).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136 (12), 1963-1975 (2009).
- Stelzer, E. H. Light-sheet fluorescence microscopy for quantitative biology. Nature Methods. 12 (1), 23-26 (2015).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Current Opinion in Chemical Biology. 20, 46-53 (2014).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. Astronomical Journal. 76 (6), 745-754 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. JOSA. 62 (1), 55-59 (1972).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Hart, A. C. Behavior. WormBook. , (2006).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using microManager. Current Protocols in Molecular Biology. Chapter 14, Unit14 20 (2010).
- Gualda, E. J., et al. SPIM-fluid: open source light-sheet based platform for high-throughput imaging. Biomedical Optics Express. 6 (11), 4447-4456 (2015).
- Ardiel, E. L., et al. Visualizing Calcium Flux in Freely Moving Nematode Embryos. Biophysical Journal. 112 (9), 1975-1983 (2017).
- Walton, T., et al. The Bicoid class homeodomain factors ceh-36/OTX and unc-30/PITX cooperate in C. elegans embryonic progenitor cells to regulate robust development. PLoS Genetics. 11 (3), e1005003 (2015).
- Altun, Z. F. WormAtlas. , (2002).
- Wood, W. B. Embryology: In the nematode C. elegans. Cold Spring Harbor Laboratory Press. Chapter 8, 215-241 (1988).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 314 (1165), (1986).
- Bao, Z., Murray, J. I. Mounting Caenorhabditis elegans embryos for live imaging of embryogenesis. Cold Spring Harb Protoc. (9), (2011).
- Christensen, R. P., et al. Untwisting the Caenorhabditis elegans embryo. eLife. 4, (2015).
- Santella, A., et al. WormGUIDES: an interactive single cell developmental atlas and tool for collaborative multidimensional data exploration. BMC Bioinformatics. 16, 189 (2015).
- Dupuy, D., et al. A first version of the Caenorhabditis elegans Promoterome. Genome Research. 14 (10B), 2169-2175 (2004).
- Reece-Hoyes, J. S., et al. Insight into transcription factor gene duplication from Caenorhabditis elegans Promoterome-driven expression patterns. BMC Genomics. 8 (27), (2007).
- WormBase. , Available from: https://www.wormbase.org (2019).
- Lee, R. Y. N., et al. WormBase 2017: molting into a new stage. Nucleic Acids Research. 46 (D1), D869-D874 (2018).



