Summary
在这里, 我们提出了一个组合方法, 使用高分辨率显微镜, 计算工具, 和单细胞标记在活的线虫胚胎, 以了解单个细胞动力学在神经发育过程中。
Abstract
线虫(线虫) 是唯一能够在体内观察到了解整个神经系统细胞起源的挑战的生物, 只有单细胞分辨率。在这里, 我们提出了一个综合方案, 用于检查线虫胚胎的神经发育。我们的协议结合了成像, 线形和神经解剖追踪单个细胞在发育的胚胎。我们通过使用双视倒置选择性平面照明显微镜 (Ospim) 实现了对具有近各向同性空间分辨率的活的线虫胚胎的长期、四维 (4d) 成像。线虫胚胎中的核和神经元结构被成像并呈向异融合, 在所有三个维度中产生分辨率约为330纳米的图像。然后对这些分钟每分钟的高分辨率4D 数据集进行分析, 以便将确定的细胞谱系与单细胞和亚细胞详细级别的基因表达和形态动力学相关。我们的协议结构使每个描述的步骤都能模块化地实施, 并加强对胚胎发生、基因表达或神经发育的研究。
Introduction
线虫是胚胎中每一个细胞在整个神经发育过程中唯一可以观察到的生物。随着整个细胞谱系的已知和不变 1,以及新工具的开发, 允许在胚胎中的单个细胞标记和连续成像, 生物学家现在可以开始研究线虫神经发育的不同步骤从各个角度的系统-细胞诞生;迁徙和分化;神经元形成, 靶向生长和聚集;突触形成;和功能电路的调谐。结合稳定表达的记者和荧光显微镜, 捕获线虫胚胎中的神经元生长动力学, 对科学界具有重要意义。
线虫的发育研究通常利用该物种的不变细胞谱系和细胞命运图, 增强完整生物体内单细胞水平的上下文理解。自动线形分析-使用 StarryNite2,3 ,4和 acetree5,6, 7, 8 软件-具有高对比度、高分辨率的优势荧光原子核的图像。为了以最佳方式工作, staryniteectree 还依赖于在发育过程中对成像胚胎的可预测的受限取向。在两个盖板之间压缩的线虫胚胎中进行的共聚焦显微镜, 十多年来一直是标准的自动线形显微镜方法, 因为它提供了高对比度和可预测的受限胚胎的取向7,8。我们之前描述了一种新型的基于光片的双视图选择性平面照明显微镜 (ospim) 的构造和使用, 用于活样本成像, 如线虫胚胎发生9,10,11,12,13. 一般的光片显微镜可提供低光毒性、高速和长期成像的实时3d 样品 14,15.具体而言, Ospim 方法可生成几乎各向同性空间分辨率约为330纳米9的四维 (4d) 图像。
与共聚焦显微镜相比, Ospim 提供了更高的信噪比和速度, 更各向同性的空间分辨率, 更适合长期的体内成像16。因此, 我们努力将 Ospim 数据调整为输入 starryniteacetree, 并调查这是否会增强线形分析。一个主要的障碍是, 定免疫标本不能轻易受到蛋壳压缩的限制, 以采用预期的方向为 Starsynite/acetree。被分析的体积中单元格位置的随机方向降低了自动线型分析的准确性。
因此, 我们使用了 CytoSHOW, 这是一个由观众引导的用户界面, 它允许用户在 Dspim 图像预处理过程中选择精确的胚胎3D 方向, 从而生成质量优化且上下文感知的图像数据, 以便输入 Starlynite。在用户选择的成像胚胎后, CytoSHOW 协调了一个自动化的数据处理管道。裁剪和背景减去的胚胎图像保存在 TIFF 堆栈文件中的每个位置、时间点和视图。然后, cytoshow 迭代调用程序 spimfusion, 以共同注册和联合解压缩两个预处理视图, 使用 richardson-cycy 17,18算法产生各向同性高分辨率体积图像。针对 StarryNite, 对一系列 dispi 特特参数进行了优化, 以控制其在图像分割和原子融合图像核跟踪过程中的行为。然后使用 AceTree 编辑熔融图像和线形结果, 这样用户就可以识别并修复由 Starynite 生成的自动沿袭跟踪中的任何错误。AceTree 还可以呈现胚胎中被跟踪的细胞核的线形树和三维建模渲染。我们发现, 与任何一个 SPIM 相机的原始图像相比, 使用各向融合的图像, 自动线形速度和精度都得到了显著提高。我们的协议虽然针对此处描述的线虫应用进行了优化, 但一般可以适用于为其他物种或标本生成的 ospim 数据的自动线形化。如果这是协议的预期用途, 请注意, 如所述, 新样品可能需要对 starynite 参数进行额外调整, 如所述的 3、4.
该协议的成功实施产生了具有4d 各向同性分辨率的图像, 并使生物学家能够追踪细胞谱系, 同时识别和分析发育中的线虫胚胎中的神经元。此外, 通过合并几种后处理算法--硬件加速是其中最耗时的算法--我们现在可以实时分析精细的亚细胞细节以及活胚胎的细胞谱系和细胞命运。这一新的协议允许在体内分化和形态发生的证明研究中对细胞行为进行精确、知情的操纵和观察。在这篇手稿中, 我们提出了一个详细的解释, 我们已经开发了改进的协议, 为线化和细胞跟踪开发的线虫, 以加强胚胎发生, 基因表达或神经发育的研究。
Protocol
1. 用多 l-赖氨酸涂层盖板组装定为定钢成像室
注: 以下步骤都是优化和自动化线虫胚胎的谱系分析。对于需要追踪线虫细胞谱系的实验, 可以省略几个选项 (由此表示) 。
- 在干净的矩形盖板 (编号 1.5, 24 毫米 x 50 毫米) 的中心用一个鲨鱼 (或类似的笔) 绘制一个小矩形 (2mm x 5mm)。
- 将盖板翻转到无标记的一侧, 放置10μl 的聚 l-赖氨酸 (猫。P1524) 在标记的矩形上方。
注: 使工作浓度为 1 mgl 聚 l-赖氨酸溶解在过滤水 (或等效) 中。长期储存时, 请准备5-10 毫升的等价物, 并存放在-20°c。一旦解冻, 可以在室温 (23°c) 下储存3-4周。 - 让聚 l-赖氨酸覆盖盖 5分钟 (图 1a)。聚 l-赖氨酸用于涂覆玻璃盖滑块, 胚胎将被安装在那里, 使胚胎蛋壳牢固地粘附在覆盖片上, 即使目标浸入成像介质中。
- 将多-l-赖氨酸涂层盖板放置在钢成像室的下半部分。
- 将钢成像室的上半部分用盖板固定在下半部分, 并用与该室相关的四个螺钉拧紧。从侧面直观地检查, 以确保上半部分均匀地固定在下半部分 (图 1b)。
- 在室中填充 ML 缓冲液 19的7-8 毫升, 这是一种同位素缓冲液, 有助于防止早期胚胎屈服于异常的渗透压力。1细胞, 甚至2细胞胚胎是渗透敏感的, 如果不是在这种同位素缓冲液中, 也会异常发育。如果 M9 被水取代, 胚胎也往往会在3倍阶段被捕。
2.制备线虫胚胎样品进行安装
注: 成像前约 18小时, 5个幼小 (自最后成型后 1天) 成人和10个幼虫第4阶段 (L4) 线虫被选择为线虫生长介质 (ngm) 琼脂板种子 e. 大肠杆菌株op50 。白金丝选择被用来移动幼虫和幼民,而不会伤害动物19。
- 准备1% 的甲基纤维素 (猫没有。H7509-25G) m9 缓冲液中的解决方案。
注: 甲基纤维素必须在温暖的 M9 中搅拌, 直到溶解。一旦准备好, 这种溶液可以在室温下储存。 - 在凹面显微镜幻灯片的凹陷中加入500Μl 的1% 甲基纤维素-M9 溶液。这种粘性缓冲液将在两种情况下使用: 1) 通过解剖成虫收获早期胚胎; 2) 清洗直接从 NGM 板中提取的后期胚胎。
注: 甲基纤维素用于防止胚胎粘附在显微镜幻灯片上。 - 为了成像晚期胚胎, 使用睫毛选择, 选择奠定的线虫胚胎 (最好是从有年轻成年人在场的 NGM 板), 并将胚胎移动到凹面显微镜幻灯片上1% 的甲基纤维素。睫毛选择有助于减少力量, 从而最大限度地减少在处理过程中对胚胎的压力或损害。制作睫毛选择的程序是由哈特20 覆盖。
- 用第二个睫毛采摘 (在相反的手), 轻轻地点击两个睫毛在一起, 暂停在甲基纤维素的胚胎。
- 可选: 如果计划使用 Starynite 建立血统胚胎细胞, 则必须将1细胞安装到4个细胞的胚胎上。为此, 首先从 NGM 板中选择年轻成年人, 然后使用铂金线拾取将其移动到凹面显微镜幻灯片上的 M9-甲基纤维素溶液中。
- 可选: 用皮下注射针的锐尖 (不为 18G x 1 半), 在中部身体横向切片动物, 将1细胞释放到4个细胞的胚胎中。
3. 口移液器: 配有微毛细管移液器的组装吸气管
注: 我们使用的吸气管与手拉微毛细管移液器插入橡胶垫片的管。这使我们能够将胚胎从解剖滑梯转移到充满缓冲区的成像室中的多-l-裂解物涂层表面。
- 手动将微毛细管移液器拉过明火, 形成两个带有拉伸尖端的半部分。
- 取一半的微毛细管移液器, 并将钝器端插入吸气管的橡胶垫片 (图 1c)。将微毛细管移液器的另一半放在一边, 供以后使用 (如果需要)。
- 与组装的吸气管管安装微毛细管移液器, 轻轻地打破微细管移液器的尖端, 并创建一个开放, 将适合约1-2 两个胚胎 (从这里在这个仪器上被称为 "口移液器")。
4. 将线虫胚胎安装在多-l-赖氨酸涂层盖板上
- 用吸嘴的喉舌轻轻地固定在牙齿之间, 用10-15μl 的 M9 缓冲器预先填充微毛细管移液器, 然后轻轻地将几个胚胎从凹面滑块吸进毛细管。
- 将胚胎转移到充满 M9 缓冲器的钢成像室, 定位毛细管尖端, 使胚胎落入覆盖液的中央矩形。
- 避免对胚胎造成伤害, 用睫毛拾取或使用口移液器轻轻移动胚胎垂直位置, 使胚胎的长轴垂直于盖板的长轴 (图 1 b插入), 底部面板)。
注: 将胚胎定位在此方向可最大限度地减少图像切片的数量, 从而减少光剂量和数据处理时间, 同时提高采集速度。 - 将钢成像室放入显微镜下的样品支架中 (图 1d)。
5. 使用 Ospim 进行胚胎成像的组装、软件设置和激光优化
- 有关如何从 Kumar 等人10、11和 http://www.dispim.org 的商用部件组装整个光纤耦合1场会议的分步指导。关于如何组装 Ospim 的视频协议也可在 ASI 网站 (http://www.asiimaging.com) 上查阅。
注: 此协议的仪器设置与 Kumar 等人10,11 000万例相同, 后者使用 40x 0.8 na 水浸镜片进行成像。本协议中的设置与 Kumar 等人10、11之间的唯一区别是, 在安装在上的成像拆分装置 (型号 a12801-01) 内增加了一个双色反射镜 (以 560 nm 的分裂) 和红色和绿色的带通滤波器两个暗像成像臂。图像分割光学器件的添加允许同时捕获两个不同的荧光体的图像-由 561 nm 和488纳米激光激发-通过分离发射带到同一相机芯片的两个半。 - 仪器组装完成后, 在成像前检查 Dspim 的光学对齐情况。
注: 要正确对齐定 diSPIM, 请参阅 https://youtu.be/qnOrg30NNuE 以及硬件信息, http://dispim.org/hardware/objectives 和 http://www.asiimaging.com。 - 使用开源平台微管理器 (https://micro-manager.org/)21, 该平台已针对高吞吐量蜂窝成像的光片显微镜的操作进行了优化。我们建议使用 ASI Ospim 插件进行多位置采集, 它允许同时成像多达30个胚胎, 如所述的 23。
- 在微管理器打开的情况下, 将 488 nm 的激光强度设置为 ~ 179μw (0.5), 将 561 nm 的激光强度设置为 ~ 79μw (0.25) (图 2A,红色矩形)。
注: 这些是建议的设置, 用于使用1分钟的间隔对线虫胚胎进行长期成像。在长期双色成像过程中, 561 纳米激光用于成像细胞核(mcherry:: 组蛋白), 直到胚胎处于豆级, 此时 488 nm 激光也会打开图像 gfp 标记的神经元。这些成像条件经过优化, 可最大限度地减少光毒性, 确保胚胎的存活和孵化, 同时能够持续获取神经发育和线形数据。 - 在微管理器中, 选择 "插件 > 设备控制" ≫ ASI 吊前打开 asi 吊滑菜单 (图 2b). 选择 "采集" 选项卡。在此选项卡的"数据保存设置"部分 (绿色矩形)、 "卷设置"部分 (蓝色正方形) 和"切片设置"部分 (橙色正方形) 中, 确保设置每个参数, 如图 2b所示。
注: 我们的图像分析软件 CytoSHOW 适用于其他可选的输出数据格式, 如大容量连接 OME-TIFF 文件系列和 tiff 堆栈文件系列, 通过使用内置到微管理器中的导出功能在获取后创建。通常情况下, 使用单向堆栈校对的 OME-TIFF 文件数据格式, 因为它允许在获取原始数据后立即实时查看和处理图像卷。
6. 优化自聚焦参数, 用于线虫胚胎的长期成像
- 将微管理器自动对焦参数设置为针对线虫胚胎的长期线型质量的全 Spim-象像映像而优化的设置。在 asi 吊球窗口中, 单击 "自动对焦" 选项卡 (图 2)。在 "常规自动对焦选项" 部分 (黑色正方形) 中, 精确地指定参数, 如图所示。请注意, 在线形实验中, 自动对焦通道(红色方块) 应指定您的核通道荧光通道。
注: 如果最大偏移量大于 5μm, 图像往往会偏离焦点。 - 单击 "插件≫的获取工具>模式叠加"。
- 在 "模式叠加" 窗口中, 单击 "显示网格"。
- 在Asi 吊浦窗口中, 单击 "导航" 选项卡。
- 单击 "梁" 和 "路径 a" 或 " b" 的 "表" 复选框, 然后单击 "实时"。图像采集开始。将打开"实时视图" 窗口。通过在所选通道上的胚胎周围绘制一个盒子, 选择胚胎的自动聚焦分析区域。
注: 我们通常在每个成像过程中捕获10个胚胎的420个时间点。每个图像会话的原始数据通常为 1.7 tb, 而解码和 starynite 处理的数据为 1.4 tb (请参阅步骤9和 10)。我们建议使用大容量硬盘 (当前系统上的 18TB) 进行图像采集, 并使用云平台进行图像存储。 - 单击 "采集选项卡中的" 开始采集 " , 开始长期的多维图像捕获 (图 2b)。
7. 在细胞图中打开原始微管理器图像
- 从 http://dispimlineage.wormguides.org 下载软件包。
注: 软件包将作为. zip 文件下载, 需要提取到 "C:\"目录, 然后再使用。安装的更多细节见 http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm。 - 双击 C:\CytoSHOWextrasForC\CytoSHOW_APP.jnlp 的文件,开始运行 "细胞图"。
- 选择 "文件 ≫ 新>暗计监视器 (微管理器)"。找到保存采集时间点文件夹的根数据集文件夹。选择任何时间点文件夹, 然后单击 "打开"。为 SPIMA 和 SPIMB 自动打开多维导航窗口 (称为定数字监视窗口) (图 3 a)。
注: 这些窗口将监视新保存的原始时间点堆栈的根数据文件夹 (在仍在记录样本的情况下)。获取每个新时间点后, 监视不同 SPIM 臂和采样位置的每个窗口都将刷新, 以显示每个胚胎的整个多通道4D 数据集。
8. 使用细胞图生成最大投影图像
即使在反卷积之前, 也可以快速处理原始数据, 以评估样品的全局特征。
- 单击图像窗口左侧面板上的Z-mip按钮 (图 3 a, 红色矩形), 通过给定位置或 spim 臂的完整深度和全职过程进行最大强度投影。将出现 z投影超堆栈窗口。
- 在z 投影超堆栈窗口中, 将投影类型设置为"最大强度"。根据用户首选项指定要处理的通道、切片和时间点帧。
- 完成后, 单击 "确定" 。
- 从文件对话窗口中选择保存最大强度输出的文件夹位置, 然后单击 "确定"。为 CytoSHOW 生成投影图像留出一些时间 (15–20分钟, 具体取决于数据集的大小和计算机的处理能力)。
9. 分析各向同性高分辨率体积数据中的细胞谱系
- 可选: 通过 CytoSHOW 中的 ospim 监视器打开原始数据后, 选择多边形选择工具(图 3 a, 黑色箭头), 然后单击胚胎前、后、背和腹侧边缘外 (按确切顺序)在胚胎上形成一个 "保龄球" 图案同时适用于这两个视图 (SPIM-B 和 SPIM-B,图 3 a)。
注: 此选择指定感兴趣的椭圆区域 (ROI), 其中胚胎居中, 并记录胚胎的前后轴。保龄球图案提示细胞图, 用户计划进一步指定精确旋转的最终各向各向融合卷到一个方向, 这是最佳的线化分析由 Starlynite/acetree。在 Starynite 线形不属于实验计划的情况下, 可以选择其他选择工具和形状来设置图像处理的 ROI。 - 如果使用多位置采集选项同时对多个胚胎进行成像, 则对所有胚胎打开并执行步骤9.1。这将允许在一个会话中同时为所有胚胎执行未来的步骤。关闭您不希望处理的任何胚胎的 SIMA 和 SPIMB 窗口。
- 单击 Ospim 监视器窗口左侧面板上的ospim按钮 (图 3 a, 以黄色突出显示)。这揭示了特定于 Ospim 处理的控件的子面板。
- 对齐每个 SPIM 臂的绿色和红色通道。由于发射通道拆分器用于在同一相机上同时捕获不同的红色和绿色图像, 因此在覆盖这两个物理上相邻的图像字段时, 在视觉上对齐它们的确切像素配准非常重要。在许多连续的成像会话中, 重复使用相同的对齐调整通常是可行的, 但应检查 (如步骤9.4.1 – 9.4.5)。
- 从 SPIMA 面板开始, 通过向左移动cm滚动条选择红色通道 (图 3a, 橙色箭头, 左侧面板)。
- 使用 x、y 和 z 调节器 (图 3a, 橙色正方形), 将红色通道移位以匹配绿色。
- 单击"ospim " 按钮 (图 3a, 以黄色突出显示), 关闭子面板, 并触发相同班次的传播到所有其他"位置" 窗口。
- 通过移动 "z" 滚动条 (图 3 a, 蓝色箭头, 左面板) 和/或 "t" 滚动条 (图 3a, 绿色箭头, 左面板), 确认正确的对齐方式传播到其他帧和时间点。如果进行了多位置采集, 并对几个胚胎进行了成像 (步骤 5.3), 则对齐也应传播到这些胚胎上。通过检查 x、y 和 z 调节器的数字来确认 (图 3 a, 橙色正方形, 对于所有胚胎的 spima 面板应该是相同的)。
- 对 SPIMB Ospim 监视器窗口重复步骤9.4.1 – 9.4.4 (图 3 a, 右面板)。
- 单击 "ospim" 按钮, 然后单击 "保险丝" 按钮 (图 3a, 蓝色矩形)打开一个名为 "Deconvolve/Fuse ospim 原始数据量" 的对话框 (图 3A)。设置参数, 如图3B 所示。以下子步骤简要介绍了这些参数:
- 在通道 1 (488 nm 激光) 或 2 (561 nm 激光) 上设置密钥注册。选择信号密度更高或更普遍的通道。对于线形实验, 总是选择用于成像无处不在的核组蛋白荧光的通道。
- 将输入卷相对方向设置为 + 1 或-1。正确的方向索引取决于特定的 Ospim 相机位置 (图 4)。
注: 如果不确定, 请按照步骤9.1–9.12 并任意选择输入卷相对方向进行测试, 方法是复制 spim a和 b ospim 监视器窗口中的单个时间点, 并任意选择输入卷相对方向进行测试。不正确的方向将产生模糊的图像与工件, 而正确的方向将产生清晰的图像。然后, 可以将产生清晰图像的输入体积相对方向值重新用于给定 ospim 仪器的所有未来数据。 - 选择融合卷的方向是否应与 A 或 B 输入卷相同 (基于用户首选项)。
- 选择 "每个卷的全新注册"。此选项控制 spimfusion 如何计算每个时间点对的每个卷对的配准矩阵。"新鲜" 选项允许算法在每个时间点自适应地优化注册。
- 将反卷积迭代次数设置为10。这个数字往往以节省时间的方式可靠地产生所需的高分辨率。
- 可选: 如果需要自动线形 (强烈建议), 请检查熔融卷的自动启动 StarryNite 线形.此选项将自动启动 StarryNite, 以分割和跟踪 SpimFusion 生成的成像卷中的细胞。
- 可选: 为了在自动线形中获得最高的精度, 最好将同位素熔融的胚胎体积重新定位为规范的 "ADL" (ann窄 [x-west]、 d orsal [y-north]、左 [z 近]) 方向。选择 "在预览中定义卷输出方向" 选项以指示此选项。细胞展将通过处理一对初始的各向肩融合卷做出反应, 使用户能够密切观察和指定实现 ADL 注册所需的旋转。
- 选择所有参数后, 单击 "是"。
- 指定要在其中保存已处理文件的输出目录。单击"确定"。
- 可选: 如果选择了"在预览中定义卷输出方向" 选项, 请将 SPIM-A 窗口中的 t 滚动条 (图 3 a, 绿色箭头, 左侧面板) 设置为aba 和 abp 单元格达到中期的早期时间点。将 SPIM-B 窗口中的t滚动条设置为最新的逗号开发阶段。这将有助于指定 ADL 方向。
- 可选: 准备好后单击"确定" 。如果选择了上面9.5.7 中的预览选项, 则 SPIM-B 和 SPIM-B 图像窗口的 t 滑块指示的时间点将只对两个预览卷进行同位素融合。这两个预览时间点可用于指定输出胚胎体积与 ADL 方向的精确调整, 如下所述。
- 找到新显示的 3DProjY_Decon-fuse _..。窗口。将 t滚动条移动到此预览窗口的时间点2。移动 Z 滑块, 直到直接向下显示胚胎长轴的视图。
- 将 t滚动条移回3DProjY_Decon 的时间点 1-fuse _..。窗口。选择选线工具, 并通过 ab 细胞中期板的平面从 EMS 细胞 (腹侧最圆核) 中绘制行选择。
- 单击 3DProjY_Decon-fuse _..。窗口。将保存对预览成像卷方向的微调, 以便用于处理完整的数据集。
- 可选: "定义/fuse 必将原始数据卷" 对话框将重新出现, 就像上面的步骤9.5 所示。单击 "是",而不选择 "在预览中定义卷输出方向" 选项。指定完整数据处理运行的输出文件夹。
- 将 Ospim 监视器窗口的t滚动条 (图 3a, 绿色箭头, 左侧面板) 设置为要处理的整个图像的起始时间点 (spima) 和结束时间点 (spimb)。然后单击 "确定"。
- 随着 SpimFusion 的进展, CytoSHOW 打开并刷新一个多维窗口, 显示每个胚胎的切片-4d 各向同性融合体积, 以及两个具有旋转-4d 最大强度投影各向同性体积的窗口。在此期间,不要破坏或关闭任何细胞图窗口, 直到各向同性融合和血统跟踪完成。
- 可选: 请注意, 一旦 Starynite 初始屏幕出现, 后来消失, 完整的数据处理管道已经完成。此窗口在处理过程中不得关闭, 否则 Starynite 将被中断。
10. 在 AceTree 中打开 StarryNite 谱系痕迹系列 (可选)
- 打开提供的自定义版本的 "AceTree_16BitCompat.jar"。
- 选择 "文件 ≫ 打开配置文件" 菜单. 找到以前指示为 "细胞图" 的输出目录。打开胚胎的装饰 _ 保险丝 _... _ pos [n]子文件夹 [n]。选择aaa _ edited. xml 和打开。
- 使用 "电子树" 菜单"编辑" > 编辑工具打开"编辑跟踪" 和"调整或删除单元格" 窗口。
- 单击半阴影圆圈图5B, 红色正方形可调整红色和绿色强度。
- 按照前面所述的5、6、8 (手稿也包含在我们的下载包中) 继续进行沿袭可视化和编辑。
Representative Results
我们首先验证了使用该协议的参数进行 Ospim 采集的胚胎成像的可行性 (第1-6 节)。在20°c、1个体积胚胎/分钟同时成像了10个胚胎, 从2细胞阶段到2倍期 (7.5 小时, 451 体积胚胎)。为了监测整个胚胎发生过程中的细胞分裂, 我们使用了 BV514 菌株, 它无处不在地表达了Mcherry:组蛋白记者从集成的转基因阵列Ujis11324 构建。图 6显示了其中一个被成像胚胎的前半部分胚胎发育的时间表。每个图像表示成像胚胎的单视图最大强度投影 (由步骤7-8 生成)。我们发现, 优化后的协议并没有引起任何可检测到的光毒性对胚胎, 如评估细胞分裂的时间 (未显示), 孵化时间, 以及与发育里程碑相关的时间 (图 6和参考1 ),25,26)。
然后, 我们应用该协议来分析单个神经元在发育胚胎中的生长动力学。我们对 DCR7692 (olaex4655)进行了成像, 一种转基因线虫菌株, 表达 gfp 关闭神经肽flp-19启动子在一个子集的不明细胞 (DACR2819, pflp-19 (3.6 Kb):: SYN21:GFP: caax::p 10 ' utr).按照这里概述的协议步骤, 我们确定, 身份不明的细胞对应于运动神经元 RMDDL 和 RMDDR, 排泄管细胞, 和两个肌肉细胞 (图 7)。然后, 我们研究并量化了 RMDDL 和 RMDR 神经元的生长动力学。我们观察到, RMDDL 和 RMDR 神经元早在受精后360分钟就被斜形, 较长的细胞轴代表神经元外生长的后续轴 (图 7和电影 s1)。利用 FIJI 中的 "简单神经元追踪" 插件, 并将其应用于各向正融合卷的三维重构, 我们对6个胚胎的 RMDDL 和 RMDDR 神经元的定型结果进行了量化。我们确定了跨胚胎 (下称 Rmdd) 的 RMDL 和 RMDR 的生长动力学。从385-410分钟受精后, RMDDs 神经元延长 6.0±0.5μm (平均±sem;n = 12个神经元) 细胞体的前部 (图 7b, c, i)。从受精后的415-445 起, 两个神经元都在背侧延伸到推定的神经环及其周围 (图 7D中的星号)。平均而言, 每个 RMDD 神经元延长 11.0±0.6μm (平均±sem;n = 12个神经元) 从细胞体同步满足其对侧对应在环的顶端 (图 7i)。重要的是, 我们的代表性结果表明, 我们能够通过使用我们的集成协议来检查、比较和量化单个可识别细胞的神经元发育特征 (图 7和图 8)。
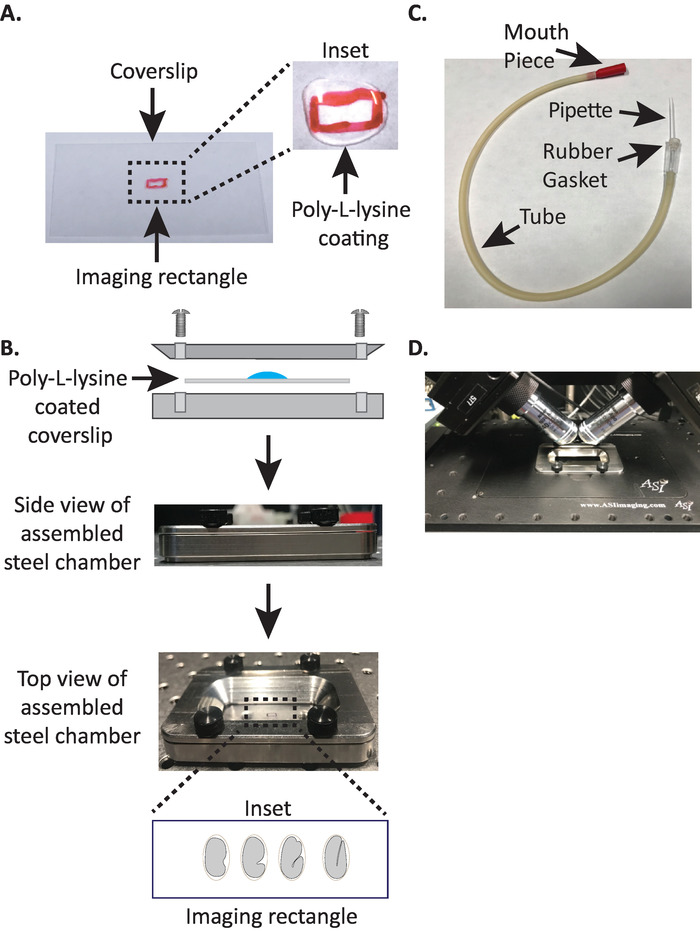
图 1: ospim 样品安装设置.(A) 用多-l-赖氨酸制备盖板。在插入物中, 用10μl 的聚 l 赖氨酸覆盖覆盖5分钟。聚 l-赖氨酸允许胚胎蛋壳牢牢地粘附在长方形中的盖板上。(B) 钢成像室和装配室的原理图。在内套中, 代表性胚胎的方向是与覆盖滑移上的长轴垂直的前后轴。(C) 将吸气管与微细毛细管移液器组装而成。(D) 钢成像室安装在样品支架下的 ospim 40x 目标。请点击这里查看此图的较大版本.

图 2: 微管理器中的长期 Dospim 成像设置.(A) 推荐的 dospim 激光功率参数 (红色矩形) 经过优化, 可用于长时间成像, 同时降低光毒性 (通过提高线虫胚胎的孵化率进行评估)。将561纳米激光设置为 79μw (0.25), 将 488 nm 激光设置为 179μw (0.5)。请注意, 在 Ospim 安装中, 软件设置对激光功率的精确校准各不相同。建议用户测量和校准激光功率, 以达到 79μw (561 nm) 和 179μw (488 nm) 激光功率。(B) 用于数据保存 (绿色矩形)、卷设置 (蓝色正方形) 和切片设置 (橙色正方形) 的空白。(C) 用于线虫胚胎发生长期成像的 dspim 自聚焦参数 (见步骤 6.1-6.6)。请点击这里查看此图的较大版本.

图 3: 使用细胞图进行图像可视化和数据处理设置.(A) 细胞炫耀打开的原始暗虫图像。细胞图能够打开由两个相机路径 (SPIM A 和 B) 捕获的图像。这些原始图像在称为ospim 监视器的多维窗口中打开。在ospim 监视器中, 生成一个 "弓形图案", 以选择胚胎的前、后、背和腹侧边缘 (参见步骤 9.1)。打条选择表示胚胎方向的反卷积和稳定氮辅助线形追踪。(B) 用于生成各向同性图像的优化参数。在获取窗口时的 "解光"中, 设置步骤 9.5.1-9.5.8 中指定的参数。请点击这里查看此图的较大版本.

图 4: Dspim 相机配置.(A) 暗置相机位置和方向照片。(B) 描述 + 90 度旋转的 spim a, 以匹配所收集的 spim b 图像。(C) 根据我们的 dispim 相机配置, 输入相对于方向索引 + 1 的卷 (请参阅步骤 9.5.2)。在注册之前, 我们围绕 y 轴旋转 SPIM A + 90度图像, 以匹配 SPIM B 图像。比例条 = 10μm. 图像是具有代表性的单视图、最大强度投影和反卷积图像的1.5倍胚胎与标记的细胞核 (561 纳米, 红色) 和神经元 (488 纳米, 绿色)。请点击这里查看此图的较大版本.

图 5: 在 AceTree 中对线虫胚胎谱系进行处理和编辑.(A) 我们使用 acetree 编辑 starynite 的血统痕迹 (见参考资料5、6、8; 手稿也包含在我们的下载包中)。步骤 10.1-10.2 完成后, acetree 将显示每个原子核 (绿色矩形) 的线虫系统名称。此窗口 (a) 提供有关沿袭跟踪中每个单元格 (aba, 以蓝色突出显示) 的信息 (黑色矩形), 以帮助指导用户跟踪和编辑沿袭跟踪。建议用户验证和比较血统细胞及其位置与苏尔斯顿等人先前报告的线虫胚胎细胞谱系.在搜索栏中输入 c . elegans系统名称 (橙色矩形). (B) 在步骤 10.1-10.2 完成后, 用户的去卷数据系列也会自动打开。这里展示了一个四细胞阶段胚胎的同位素融合图像, 其细胞核被标记为红色。在跟踪原子核的过程中, 用户应更改图像的强度 (红色正方形), 并使用键盘上的箭头键 (时间-左键, z 向上) 在时间和 z 中导航。(C) 具有某些功能 (紫色矩形) 的时间点的3d 卡通, 可实现可旋转的3d 可视化。有关 acetree 及其3d 功能的概述, 请参阅参考 5、6、8。请点击这里查看此图的较大版本.

图 6: dspim 上线虫胚胎的定时发育动力学.顶部面板, 永生图显示了其中一个成像胚胎 (应变 BV514 ujIs113 24)的前半部分胚胎发育。胚胎被连续成像, 每分钟7.5 小时 (20°c)。顶部面板的前两个图像代表4个和8个细胞的胚胎, 有原子核 (红色) 和极性体的位置 (密集的红色球体, 用蓝色星号标记)。每个图像表示成像胚胎的单视图最大强度投影。刻度柱 = 10μm。时间线 (水平条) 代表受精后的分钟 (m. p. f . ) 的发展的线虫胚胎。我们验证了我们的协议用于 Ospim 采集的参数并没有根据生存能力、细胞分裂的时间、孵化时间和发育里程碑的时间来评估, 从而对成像胚胎产生任何可检测到的光毒性 (见参考资料)1,25,26. 我们注意到, 通过我们的成像参数 (在6.4 小时的成像过程中, sem±8.174 分钟;n = 10)。请点击这里查看此图的较大版本.

图7。神经元外生长动力学在卵细胞胚胎发育过程中的细胞鉴定和单细胞表征.通过 BV514 Ujises11324 (用于线形) 和 dcr7692 (olaex4655) 制造的菌株的双色成像, 这是一种转基因线虫菌株, 表达了在不明细胞子集中的神经肽翻拍-19 启动子的 gfp。(A-H)按照这里概述的协议步骤, 我们确定, 身份不明的细胞对应于运动神经元 RMDDL 和 RMDDR (黄色箭头), 与排泄管状细胞 (蓝色箭头), 以及两个肌肉细胞 (白色箭头) 相对应。(I) 利用 fiji 插件 "简单神经元追踪" 对 RMDL 和 RMDDR 神经元的生长动力学进行量化, 并将其应用于同位素融合体积的三维重建。请注意 RMDDL 和 RMDDR 是如何显示定型的生长动力学的, 每个动态同步扩展, 总长度为 11.0±0.6μm (平均±sem;n = 12个神经元) 和会议在神经圈的背尖 (也参见电影 s1)。请点击这里查看此图的较大版本.

图 8:检测线虫胚胎中神经元形态的各向同性分 spim 图像.AVHL 和 AVHR 神经元 (黄色箭头) 的各向同性可视化。利用 Ospim, 可以捕获产生各向同性空间分辨率约为 330 nm 的四维 (4D) 图像的神经元形态。控数字允许用户在所有方向上以相同的分辨率虚拟旋转图像卷。A-d 中的图像是相同的各向同性融合的 dispim 图像体积的最大强度投影, 这些图像与胚胎长轴周围的不同旋转形成了不同的旋转。刻度条 = 5μm. 请点击这里查看此图的较大版本.
补充电影 S1:c.线虫胚胎在受精后从280分钟发展到 434分钟.应变 DCR7692 (olaex4655) 的各向同性电影表达 ujis113 无处不在与 DACR2819 稀疏标记的 Rmdd 神经元 (图 7a-d, 黄色箭头)。DACR2819 还在胚胎发育过程中标记了两个肌肉细胞 (图 7a-d, 白色箭头) 和排泄管细胞 (图 7a-d, 蓝色箭头) (图 7a-d)。刻度条 = 10μm. 请点击此处下载此文件.
Discussion
线虫是唯一具有已知的27个成年神经元的最终位置和连通性的生物.然而, 导致工作电路和网络的组织的发展动态, 构成了线虫的连接体仍然是未知的。基于光显微镜技术的发展所带来的机会, 我们现在可以在整个线虫胚胎发育过程中捕捉和分析细胞位置、形态发生和神经发生。
我们所描述的程序, 我们经常在实验室中使用产生 4-各向同性图像标记神经元和细胞核的细胞线形在c.线虫胚胎。更重要的是, 我们利用 Dospim 和耦合的半自动线形功能和高分辨率图像优化了长期成像条件, 以提高分析线虫胚胎发生的速度和精度。这个集成的协议将使用户能够可视化和识别细胞, 并通过早期抽搐的开始量化三维特征, 如神经元迁移和轴突簇。此过程可以很容易地适应任何设施与 ASI Ospim 系统, 我们建议此系统专门用于此协议。其他商业提供的 SPIM 配方可能不同于样品室中的 ASI 配置和光学特性。但是, 从其他平台导出的数据也可以通过我们的数据管道进行。因此, 评价它们在线形中的价值是可行的, 这是对图像质量和仪器稳定性的严格测试。尽管我们积极使用悬三宝定期对其他标本 (如果蝇和斑马鱼胚胎) 进行成像, 但所描述的全面的胚胎线形分析目前仍仅限于线虫物种。对于较大或较厚的样品, 我们选择使用阶段扫描方法, 通过固定的光片扫描样品。Kumar 等人先前已经演示了这种改进的 Dospim 切片, 以便在不对 Dspim 10 进行其他修改的情况下, 从厚样品中生成高质量的图像。
协议中的关键步骤包括将线虫胚胎安装在多 l-赖氨酸涂层盖板上、数据采集和数据处理。在玻璃盖板上收集和安装线虫胚胎对经验不足的用户来说可能是一个挑战, 但在这里, 我们提供了一个详细的关键步骤协议, 以促进学习。如果需要长期成像, 我们可以从8-10 名年龄的年轻人28中获得最好的结果, 收获四细胞或更早的胚胎。请注意, 老年人不太需要收获早期胚胎, 因为它们往往含有子宫中的较旧胚胎和未受精的卵子。在安装胚胎方面, 组装的吸尘器 (口移液器) 堵塞或微毛细管移液器中的开口太大等问题可能会妨碍胚胎的适当安装和定位。为了提供最佳成像准备, 我们对早期和后期的前抽搐胚胎进行采集前测试, 以检查光板、相机、目标和自动对焦的性能。当所有这些操作都经过测试并在采集前测试期间产生高质量的图像时, 我们会获得最佳结果。这对于生成具有各向同性空间分辨率的图像尤其重要, 因为从这两个视图 (目标) 获得的原始图像必须是高质量的。采集后, 为每个视图获取的卷将被处理以产生各向同性图像。按照本协议中的说明 (见下文), 使用适当的图形处理单元 (gpu) 卡非常重要。这提高了生成各向体融合图像的处理速度, 缩短了数据分析的时间。用户还必须运行最新版本的 CytoSHOW, 并使用我们的下载包提供的参数来进行 Starynite 自动线形。如果用户有兴趣对其他样品 (如斑马鱼、甜心鱼等) 使用自动线形, 则需要对 StarryNite 中使用的参数进行额外优化 (见参考资料 3,4)。
尽管我们的综合协议在抽搐前胚胎中提供图像和线形结果, 但用户应该意识到, 在抽搐后的胚胎中自动线形目前是不可行的: 在抽搐后的胚胎中, 核位置在秒的左右变化。抽搐后的胚胎, 太快, 不允许血统跟踪。然而, dspim 确实已经证明了一个很有希望的能力, 以捕捉神经发育事件, 并跟踪一些细胞的位置, 在抽搐后阶段的胚胎 23,29.如果用户有兴趣检查抽搐后的胚胎, 7日共确实提供了获得体积快照的速度, 并在快速移动的胚胎中跟踪良好的神经发育事件, 如神经元的生长。
该协议将是完成宗教指南地图集30的细胞逐单元的基础, 因为它将提供一种具有高分辨率各向同性图像的集成方法, 以识别和捕获标记神经元的3d 形态。胚胎发生的前43分钟从目前的情况看, 虫指南图集提供了发育中胚胎细胞的核位置, 旨在捕捉胚胎神经元子集的发育动力学。该协议将是将更多发育中的神经元集成到宗教指南地图集 30的关键。
我们的综合协议还将简化在线虫胚胎中探索新的基因表达谱。在转基因线虫中, 许多细胞特异性促进剂在空间和时间上控制转基因表达。虽然大多数基因的表达模式在成年动物中已经有了广泛的特征,但几乎所有的基因都还没有在发育过程中被描述出来 (特别是晚期) 胚胎。线虫促进剂已成为蠕虫群落推动细胞特异性转基因表达的有用资源, 并决定基因功能是细胞自主还是非自主的。捕获基因的各向同性高分辨率和动态表达模式, 并通过线型精确识别表达细胞, 对科学界的许多人来说都是有价值的。
胚胎发生包括两个交织在一起的主要过程, 细胞分化和组织形态发生。在线虫的发育过程中, 定义不同细胞类型的机制和分子有很多是已知的。然而,对线虫胚胎中细胞迁移、细胞粘附和细胞形态的重要机制了解甚少。随着线虫不变细胞谱系的已知, 我们的协议可以让我们很容易地识别分类3d 微解剖的胚胎在形态发生过程中在新的细节水平: 例如, 轴突簇, 突触发生, 和神经元活动。Adier 等人此前已经证明了定钙在线虫胚胎23中单个神经元水平捕获钙瞬变的力量.发展生理学的许多其他方面的研究已经成熟, 用这些方法。
最后, 该协议在很大程度上是自动化的, 并系统地减少了生成反卷积图像和通过 StarryNite 和 Acetree 执行细胞线形所需的时间。本协议中使用的软件策略可以应用于许多生物学问题, 远离我们在这里所演示的非常具体的领域。
有关软件兼容性和下载访问的详细信息
有关用于暗旋成像的微管理器和插件的信息可在 http://dispim.org/software/micro-manager 和 https://micro-manager.org/wiki/ASIdiSPIM_Plugin 上找到。
数据处理管道当前需要一个 Windows 操作系统。我们捆绑了一个单一的存档文件, 以简化所有必需的数据处理程序和支持文件的安装。可 http://dispimlineage.wormguides.org 下载。
细胞展示 (http://run.cytoshow.org/) 是基于广泛使用的开源图像分析平台 ImageJ (v1)。必须在计算机上安装 java 并使其成为最新版本, 才能使用 CytoSHOW, 并且对 CytoSHOW 的更新必须通过 Java Web Start 自动部署。细胞图的许多基于图像 j 的函数都是在 https://imagej.nih.gov/ij/docs/examples/index.html 中描述和说明的。CytoSHOW 已被定制为显示来自 ASI Ospim 的多维原始数据, 以及创建 TIFF 输出的其他成像软件。原则上, 其他多视图 SPIM 成像系统可以通过对细胞图进行小的修改来支持, 从而使这一协议能够在不同的显微镜系统上进行。
SpimFusion 是用 cuda 工具包 v7.5 使用 visual Studio 2013 在 cuda c++ 中编写的。运行 SpimFusion 需要特定的计算机硬件: NVIDIA 图形处理单元 (GPU) 卡, 具有 CUDA 计算能力1.0 或更高, 最小为 2 GB 图形卡内存。在我们的协议发布时, SpimFusion 尚未发布 (Min Guo 和 Hari Shroff), 但在上面提到的软件包归档中提供。
专门构建的命令行驱动版本 Starynite 要求安装免费可用的 MATLAB 编译器运行时, 但不需要商业 MATLAB 软件的许可证。MATLAB 编译器运行时包含在上面提到的软件包归档文件中。本协议中使用的 Starynite 代码与共聚焦图像所使用的代码基本相同。然而, 在创建用于 StarryNite 处理的输入图像和处理 StarryNite 结果的过程中, 通过 CytoSHOW 中的方法解决了几个操作问题, 这些方法支持融合各向同性分质的连续数据处理管道卷。这些更改通过 CytoSHOW 代码实现自动化, 代码处理这些预处理和后处理步骤。CytoSHOW 还编辑了一个预先优化的代谢 Imaged 特定模板 StarryNite 参数集, 以自动将分割算法调整为成像数据中原子核的荧光强度。然后, StarryNite 在每个 Ospim 数据集中使用的唯一参数与输出图像和线形数据一起保存在一个文件中。
使用16位图像并保持与 Java3D 呈现兼容性的 acetree 自定义版本最适合此协议。它还包含在上面提到的软件包归档文件中。
Disclosures
作者没有什么可透露的。
Acknowledgments
我们感谢约翰穆雷的综合应变, ujIs113, 产生线化应变 BV514;Brandon Harvey (NIBIB) 寻求测试协议的帮助;乔恩·丹尼尔斯和加里·隆多 (应用科学仪器) 为微管理器和 Ospim 仪器提供帮助;安德鲁·约克和汉克·伊登对定发系统的批评反馈我们还感谢少数群体机构研究中心方案和波多黎各大学神经生物学研究所提供了一个会议和集思广益平台。这项工作的大部分是通过惠特曼计划在伍兹霍尔的海洋生物实验室进行的。这项工作得到了国家卫生研究院国家生物医学成像和生物工程研究所的内部研究方案和国家卫生研究院第1号赠款的支持。U01-hd075602 和 No。R24-OD016474。Mark W. Moyle 得到 F32-NS098616 的支持, Leigton H. duncan 得到 R24-od2016474 多样性补编的支持。
Materials
| Name | Company | Catalog Number | Comments |
| Steps 1-4 | |||
| Concavity slides | ThermoFisher Scientific | 1519006 | 5-18mm diameter, 0.6-0.8mm deep, 1.2-1.5mm |
| Dissecting microscope with 10×–50× zoom range | Motic | SMZ-171 | |
| E. coli (OP50) | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Glass coverslips, no. 1.5, 24 × 50 mm | VWR International | 48393-241 | |
| M9 Buffer | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Methyl cellulose | Sigma-Aldrich | H7509-25G | |
| Microcapillary pipette aspirator tube | Sigma-Aldrich | A5177 | |
| Microcapillary pipettes, 0.4-mm i.d | Drummond Scientific | 1-000-800 | |
| Needle, no. 18G x 1 ½ (1.2mm x 40mm) | BD Precision Glide | 305196 | |
| NGM plates | prepared as described by Brenner (1974) | ||
| O-ring for imaging chamber | O-Rings West | M1.5X40 | |
| Pasteur pipette | Corning/Sigma-Aldrich | CLS7095D5X | |
| Platinum wire, 0.5-mm diameter | Sigma-Aldrich | 267201 | |
| Poly-L-lysine | Sigma-Aldrich | P1524 | |
| Stainless steel rectangular chamber (76.0 mm x 50.5 mm) | Applied Scientifics Instrumentations (ASI) | I2450 | |
| Worm Eyelash Pick | Hart, A. C. Behavior. WormBook. (2006). | ||
| Worm Pick | Stiernagle, T. Maintenance of C. elegans. WormBook. 1-11, doi:10.1895/wormbook.1.101.1, (2006). | ||
| Name | Company | Catalog Number | Comments |
| Steps 5-6 | |||
| 488 nm long-pass filter | Semrock | LP02-488 RU-2 | |
| 561-nm notch filter | Semrock | NF03-561E-25 | |
| BLP02-561R-25, quantity 2 | Semrock | 561 nm EdgeBasic best-value long-pass edge filter | |
| Control software for bottom camera | Jenoptik | ProgRes CapturePro | |
| diSIPM assembly video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/TAgbr6IrTqw ; http://www.asiimaging.com | |
| diSPIM alignment video | Applied Scientifics Instrumentations (ASI) | https://youtu.be/qnOrg30NNuE | |
| diSPIM imaging PC | Intel | Intel Xeon CPU E5-2630 2.6GHz, 12 cores in total, 64 GB memory, Windows 7 | |
| FF01-525/45-25, quantity 2 | Semrock | 525/45 nm BrightLine single-band bandpass filter | |
| FF555-DI03-25X36, quantity 2 | Semrock | 555 nm edge BrightLine single-edge dichroic beamsplitter | |
| Imaging PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Kumar et al diSPIM Setup | Applied Scientifics Instrumentations (ASI) | Instrument setup for this protocol is identical to Kumar et al 10,11 diSPIM, which makes use of 40x 0.8NA water immersion lenses for imaging. (See steps 5.1 and note) | |
| Micro Manager | Micro-Manager | https://micro-manager.org/ | |
| Modifications to Kumar et al diSPIM Setup (see below) | |||
| Optical table with isolators, 4 feet × 6 feet × 12 inches | TMC | 784-651-02DR and 14-416-34 | |
| Name | Company | Catalog Number | Comments |
| Steps 7-10 | |||
| Analysis PC | Intel | Intel Core i7-8700K CPU 3.70GHz, 6 cores in total, 64 GB memory, Windows 10 | |
| Analysis PC Graphics Card | NVIDIDA | NVIDIA GeForce GTX 1080 Ti graphics cards | |
| Installation instructions | Software bundle | http://dispimlineage.wormguides.org/diSPIMlineaging_InstallationInstructions.htm | |
| Software bundle | Software bundle | http://dispimlineage.wormguides.org |
References
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Developmental Biology. 100 (1), 64-119 (1983).
- Bao, Z., et al. Automated cell lineage tracing in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 103 (8), 2707-2712 (2006).
- Santella, A., Du, Z., Bao, Z. A semi-local neighborhood-based framework for probabilistic cell lineage tracing. BMC Bioinformatics. 15, 217 (2014).
- Santella, A., Du, Z., Nowotschin, S., Hadjantonakis, A. K., Bao, Z. A hybrid blob-slice model for accurate and efficient detection of fluorescence labeled nuclei in 3D. BMC Bioinformatics. 11, 580 (2010).
- Boyle, T. J., Bao, Z., Murray, J. I., Araya, C. L., Waterston, R. H. AceTree: a tool for visual analysis of Caenorhabditis elegans embryogenesis. BMC Bioinformatics. 7, 275 (2006).
- Katzman, B., Tang, D., Santella, A., Bao, Z. AceTree: a major update and case study in the long term maintenance of open-source scientific software. BMC Bioinformatics. 19 (1), 121 (2018).
- Murray, J. I., et al. Automated analysis of embryonic gene expression with cellular resolution in C. elegans. Nature Methods. 5 (8), 703-709 (2008).
- Murray, J. I., Bao, Z., Boyle, T. J., Waterston, R. H. The lineaging of fluorescently-labeled Caenorhabditis elegans embryos with StarryNite and AceTree. Nature Protocols. 1 (3), 1468-1476 (2006).
- Wu, Y., et al. Spatially isotropic four-dimensional imaging with dual-view plane illumination microscopy. Nature Biotechnology. 31 (11), 1032-1038 (2013).
- Kumar, A., et al. Using Stage- and Slit-Scanning to Improve Contrast and Optical Sectioning in Dual-View Inverted Light Sheet Microscopy (diSPIM). The Biological Bulletin. 231 (1), 26-39 (2016).
- Kumar, A., et al. Dual-view plane illumination microscopy for rapid and spatially isotropic imaging. Nature Protocols. 9 (11), 2555-2573 (2014).
- Wu, Y., Christensen, R., Colon-Ramos, D., Shroff, H. Advanced optical imaging techniques for neurodevelopment. Current Opinion in Neurobiology. 23 (6), 1090-1097 (2013).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (43), 17708-17713 (2011).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136 (12), 1963-1975 (2009).
- Stelzer, E. H. Light-sheet fluorescence microscopy for quantitative biology. Nature Methods. 12 (1), 23-26 (2015).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Current Opinion in Chemical Biology. 20, 46-53 (2014).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. Astronomical Journal. 76 (6), 745-754 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. JOSA. 62 (1), 55-59 (1972).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Hart, A. C. Behavior. WormBook. , (2006).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using microManager. Current Protocols in Molecular Biology. Chapter 14, Unit14 20 (2010).
- Gualda, E. J., et al. SPIM-fluid: open source light-sheet based platform for high-throughput imaging. Biomedical Optics Express. 6 (11), 4447-4456 (2015).
- Ardiel, E. L., et al. Visualizing Calcium Flux in Freely Moving Nematode Embryos. Biophysical Journal. 112 (9), 1975-1983 (2017).
- Walton, T., et al. The Bicoid class homeodomain factors ceh-36/OTX and unc-30/PITX cooperate in C. elegans embryonic progenitor cells to regulate robust development. PLoS Genetics. 11 (3), e1005003 (2015).
- Altun, Z. F. WormAtlas. , (2002).
- Wood, W. B. Embryology: In the nematode C. elegans. Cold Spring Harbor Laboratory Press. Chapter 8, 215-241 (1988).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 314 (1165), (1986).
- Bao, Z., Murray, J. I. Mounting Caenorhabditis elegans embryos for live imaging of embryogenesis. Cold Spring Harb Protoc. (9), (2011).
- Christensen, R. P., et al. Untwisting the Caenorhabditis elegans embryo. eLife. 4, (2015).
- Santella, A., et al. WormGUIDES: an interactive single cell developmental atlas and tool for collaborative multidimensional data exploration. BMC Bioinformatics. 16, 189 (2015).
- Dupuy, D., et al. A first version of the Caenorhabditis elegans Promoterome. Genome Research. 14 (10B), 2169-2175 (2004).
- Reece-Hoyes, J. S., et al. Insight into transcription factor gene duplication from Caenorhabditis elegans Promoterome-driven expression patterns. BMC Genomics. 8 (27), (2007).
- WormBase. , Available from: https://www.wormbase.org (2019).
- Lee, R. Y. N., et al. WormBase 2017: molting into a new stage. Nucleic Acids Research. 46 (D1), D869-D874 (2018).



