Summary
Presentiamo un protocollo per valutare in modo efficiente la perfusione di aneurisma e la patenza del recipiente dell'aneurisma laterale in ratti e conigli, utilizzando l'angiografia videoatologa (FVA) a fluorescenza a base di fluorescenza. Con un valore predittivo positivo del 92,6%, si tratta di un metodo semplice ma molto efficace ed economico senza attrezzature speciali richieste.
Abstract
Trattamento dell'aneurisma cerebrale si concentra sul raggiungimento di occlusione completa, così come preservare il flusso sanguigno nell'arteria genitore. Fluoresceina sodio e verde indocianina sono utilizzati per consentire l'osservazione del flusso sanguigno e lo stato di perfusione del vaso, rispettivamente. Lo scopo di questo studio è quello di applicare l'FVA per verificare il flusso sanguigno in tempo reale, lo stato di perfusione del vaso e l'occlusione degli aneurismi dopo l'induzione di aneurismi sidewall in conigli e ratti, nonché per convalidare la procedura in queste specie.
Venti aneurismi laterali sono stati creati in 10 conigli suturando un sacchetto del vaso arterioso decellularizzato sull'arteria carotide di un coniglio donatore. Inoltre, 48 aneurismi microchirurgici laterali sono stati creati in 48 ratti. Durante il follow-up ad un mese dopo la creazione, il complesso dell'arteria/aneurisma genitore è stato sezionato e l'FVA è stata eseguita utilizzando un'iniezione di fluoresceina endovenosa (10%, 1 mL) tramite cateterizzazione della vena dell'orecchio nei conigli e una catherizzazione della vena femorale nei ratti. Gli aneurismi sono stati poi raccolti, e la patenza è stata valutata macroscopicamente.
Macroscopicamente, 14 aneurismi su 16 nei conigli non indicavano alcuna perfusione di arteria madre residua con luminae totalmente occlusa, tuttavia 11 (79%) sono stati rilevati dall'FVA. Quattro aneurismi sono stati esclusi a causa di problemi tecnici. Nei ratti, la perfusione dell'aneurisma residuo è stata osservata macroscopicamente in 25 casi su 48. Dei 23 senza prove macroscopiche di perfusione, FVA ha confermato l'incidenza di 22 aneurismi (96%). Non ci sono stati eventi avversi associati all'FVA. La fluoresceina è facilmente applicabile e non è necessaria alcuna attrezzatura speciale. È un metodo sicuro ed estremamente efficace per valutare l'integrità dell'arteria genitore e la perfusione aneurisma/perfusione residua in un ambiente sperimentale con conigli e ratti. L'FVA che utilizza la fluoresceina come agente di contrasto sembra essere efficace nel controllare la patenza degli aneurismi e del recipiente sottostante e può anche essere adattata per bypassare la chirurgia.
Introduction
La prova dell'aneurisma completo e dell'integrità dell'arteria genitore è della massima importanza nella chirurgia dell'aneurisma. Ci sono diverse opzioni per confermare la patenza dell'arteria madre e l'occlusione dell'aneurisma, come la sonografia Doppler, l'angiografia cerebrale convenzionale (DSA), l'angiografia della tomografia computerizzata (CTA) o l'angiografia a risonanza magnetica (MRA)1, 2.Tuttavia, si tratta di metodi costosi e dispendiosi in termini di tempo che spesso non sono disponibili in laboratorio. Inoltre, possono avere effetti collaterali rilevanti come l'esposizione alle radiazioni o la necessità di una sedazione aggiuntiva di animali sperimentali per evitare il movimento artefatto.
Con l'emergere di un numero crescente di nuovi dispositivi endovascolari, è necessario testare in modo riservato tali dispositivi. Tuttavia, questi studi spesso si basano sull'analisi post-mortem (ad esempio, macro patologia e istologia) e mancano di informazioni sulla perfusione dinamica. Inoltre, per il ricercatore può essere fondamentale ottenere informazioni immediate e affidabili durante una procedura chirurgica sperimentale. L'angiografia della fluorescenza è una tecnica di visualizzazione conveniente e facile da eseguire1,3,4.
Come tale, l'angiografia videologica verde indocianina (ICG) è spesso utilizzata nelle procedure neurochirurgiche cliniche ed è stata ampiamente studiata5,6. L'angiografia video fluoresceina (FVA) è una tecnica alternativa, con l'ulteriore vantaggio di creare un segnale di fluorescenza che si trova all'interno della gamma di lunghezze d'onda della visione umana, e può quindi essere visto ad occhio nudo senza una telecamera a infrarossi a spettro esteso 7. L'angiografia video fluoresceina è meno spesso utilizzata nella chirurgia clinica cerebrovascolare e i rapporti sull'IEd in ambienti sperimentali sono scarsi1,4.
L'obiettivo di questa relazione è dimostrare la fattibilità e la portata delle applicazioni dell'IVA nella ricerca cerebrovascolare preclinica di ratti e conigli.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
I roditori sono stati alloggiati in un impianto di cura degli animali e gli esperimenti sono stati esaminati e approvati dal Comitato per il benessere degli animali presso l'Università di Berna, in Svizzera (BE 108/16) e (BE65/16). Tutti gli animali sono stati mantenuti su una dieta di laboratorio standard con libero accesso al cibo e all'acqua. Tutti gli esperimenti sugli animali sono stati condotti sotto un'attenta considerazione delle 3R (sostituzione, riduzione e raffinatezza). Sono stati inclusi dieci conigli bianchi neozelandesi e 48 topi Wistar maschi. Le linee guida DI ARRIVE sono state seguite rigorosamente8.
NOTA: Venti aneurismi di parete laterale sono stati creati in 10 conigli suturando una sacca decellularizzata del vaso arterioso sull'arteria carotide di un coniglio donatore. Inoltre, 48 aneurismi microchirurgici laterali sono stati creati in 48 ratti come descritto primadi 4,9. La procedura di imaging e l'analisi macroscopica sono state eseguite 4 settimane dopo la creazione dell'aneurisma.
1. Preparazione del materiale necessario per l'angiografia video fluoresceina
- Modificare la torcia toccando un filtro passabanda blu (vedere la Tabella dei Materiali), che funzionerà come filtro di eccitazione. La torcia dovrebbe quindi emettere solo luce blu. Utilizzare nastro nero per evitare perdite di luce non filtrata.
- Equipaggiare la fotocamera (ad esempio, attaccata al microscopio) con un filtro a banda verde (vedere la Tabella dei Materiali), che funzionerà come un filtro luminoso di emissione. Solo la luce verde dovrebbe ora essere in grado di passare attraverso.
2. Preparazione del luogo di lavoro e dei materiali
- Disinfettante lo spazio di lavoro con soluzione disinfettante.
- Coprire il tavolo con tende sterili per evitare contaminazioni.
- Utilizzare strumenti sterili per l'intervento chirurgico.
3. Preparazione di animali per l'intervento chirurgico
- Pesare gli animali.
- Indurre l'anestesia e regolare la dose in base al peso.
- Per i conigli, iniziare l'anestesia equilibrata. Proteggere gli occhi con una mano durante l'iniezione per ridurre la loro reazione spaventosa. Coprire la gabbia con un lenzuolo per aiutare a sedare gli animali.
- Anestesizzare i ratti in una camera a gas con il 4% di isoflurane e il 96% di ossigeno prima dell'iniezione.
- Monitorare la profondità dell'anestesia. Pizzicare tra le dita dei dati per assicurarsi che gli animali dormono.
- Riposiziona i conigli sulla schiena. Non dovrebbero reagire.
- Per i ratti,pizzicare la coda e assicurarsi che non si osservi alcuna reazione.
- Applicare unguento sugli occhi dei roditori per evitare la secchezza. Estrarre le lingue dei ratti per evitare qualsiasi possibilità di deglutizione.
- Inizia con la conservazione dell'anestesia.
- Per i conigli, cateterizzare (22 G catetere IV schermato con porta di iniezione, vedere la Tabella dei materiali) la vena dell'orecchio. Mantenere l'anestesia bilanciata. Utilizzare un stopcock a tre vie per consentire più iniezioni simultanee.
- Per i ratti, iniettare 50 mg/kg di cloridrato di chetamina e 0,5 mg/kg di idrocloruro medetominale per via intraperitamente. Monitorare l'anestesia con un pizzico nocivo durante l'intervento chirurgico. In caso di reazione, somministrare anestetico aggiuntivo.
- Nastro gli animali sulla scheda in posizione supina e radere strettamente la posizione di incisione. Disinfettare l'area con Betasettico.
- Per i conigli, disinfettare il collo, soprattutto intorno al muscolo sternocleidomastoide.
- Per i ratti, disinfettare l'area dalla vescica atransvers colon.
- Somministrare l'ossigeno attraverso una maschera durante l'intervento e mantenere la temperatura corporea con una piastra di riscaldamento.
4. Preparazione dell'arteria
- Per ottenere i migliori risultati, sezionare accuratamente il recipiente scelto dal tessuto circostante9,10.
- Per i ratti, identificare la vena della coda (meno invasiva, preferibilmente utilizzata per gli animali sopravvissuti) o sezionare una vena femorale per l'iniezione di fluoresceina4,11.
NOTA: Per i conigli, non è necessaria alcuna ulteriore dissezione dei vasi per l'iniezione di fluoresceina poiché la vena dell'orecchio è già utilizzata per l'anestesia.
- Per i ratti, identificare la vena della coda (meno invasiva, preferibilmente utilizzata per gli animali sopravvissuti) o sezionare una vena femorale per l'iniezione di fluoresceina4,11.
- Posizionare un tampone bianco sotto il recipiente scelto per aumentare il contrasto con il tessuto circostante.
- Mettere a fuoco la telecamera montata al microscopio sull'arteria sezionata.
5. Angiografia video fluoresceina
- Coprire la siringa da 5 mL ripiena di fluoresceina di sodio (100 mg/mL, vedere la tabella deimateriali) con un foglio di alluminio per proteggersi dall'esposizione della luce. Spegnere le luci (per quanto possibile) e iniettare fluoresceina di sodio per via endovenosa. Iniettare sotto l'oscurità per evitare il fotosbiancamento.
- Per iconigli, iniettare 0,3 mL/kg di fluoresceina di sodio attraverso il a tre vie nella vena auricolare cateterica.
- Per i ratti, iniettare 0,4 mL/kg di fluoresceina sodio nella vena femorale tramite un catetere o un ago 25 G.
- Sciacquare l'ago o il catetere con una soluzione salina da 0,5 ml per garantire che tutti i tincoli vengano iniettati.
- Illuminare il campo chirurgico con la torcia modificata.
- Iniziare le riprese con la fotocamera modificata. Il flusso sanguigno dovrebbe essere visibile pochi secondi dopo l'iniezione (Figura 1).
NOTA: In questo caso, abbiamo utilizzato la frequenza fotogrammi : 50 fotogrammi/s, lunghezza focale , 70 mm e F3,4.
6. Analisi macroscopica
- Resect the aneuriss e l'arteria madre complesse, e valutare la patrocinata patrizio di patenza aprendo l'arteria genitore con micro-forbici e valutare il lume dell'arteria genitore e l'orifizio dell'anerys (vedi Figura 1, 2)9. Misurare le dimensioni degli aneurismi. L'aneurisma-genitore-complesso può quindi essere conservato per ulteriori analisi (ad esempio, istologia).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La frequenza cardiaca e la pressione sanguigna sono state monitorate durante l'intervento chirurgico. La frequenza cardiaca media era 193/min nei conigli e 196/min nei ratti. Il peso corporeo dei conigli variava da 3,05-4,18 kg, e i ratti pesavano 335-690 g.
Siamo stati in grado di eseguire FVA in otto conigli su dieci (Figura 1). Quattro esami di aneurisma in due conigli non sono stati registrati con la telecamera a causa di difficoltà tecniche. Non sono state segnalate difficoltà tecniche riguardanti l'FAV nei ratti. Tuttavia, l'FVA non poteva essere eseguita in un ratto a causa di difficoltà che foravano la vena femorale.
Su 16 aneurismi in otto conigli, due aneurismi hanno mostrato una perfusione persistente dell'arteria madre (confermata macroscopicamente) (vedi tabella1) mentre l'FVA ha identificato cinque casi con perfusione residua. 14 aneurismi di coniglio non hanno mostrato perfusione residua macroscopicamente, tuttavia 11 (79%) sono stati successivamente rilevati mediante FVA. La perfusione residua è stata osservata macroscopicamente in 25 dei 48 ratti (Tabella 1) e gli altri 23 ratti non hanno mostrato segni macroscopici di perfusione residua (Figura 2). 22 di questi 23 aneurismi sono stati poi confermati utilizzando FVA (96%). Complessivamente, 25 casi su 27 potrebbero essere confermati, con un valore predittivo positivo del 92,6%, un tasso di sensibilità del 100% e una specificità del 94,1%. (Tabella 2).
In sintesi, 25 aneurismi hanno mostrato perfusione residua, 53 arterie genitori sono state brevettate e 11 sono state occluse come confermate macroscopicamente e su video angiografia. C'erano solo piccole complicazioni associate all'FVA nei conigli; come la perforazione della vena dell'orecchio marginale durante la cateterizzazione. Non sono stati sperimentati ulteriori eventi avversi. Non è stata riportata alcuna mortalità e nessuna morbilità a causa dell'AVAv.
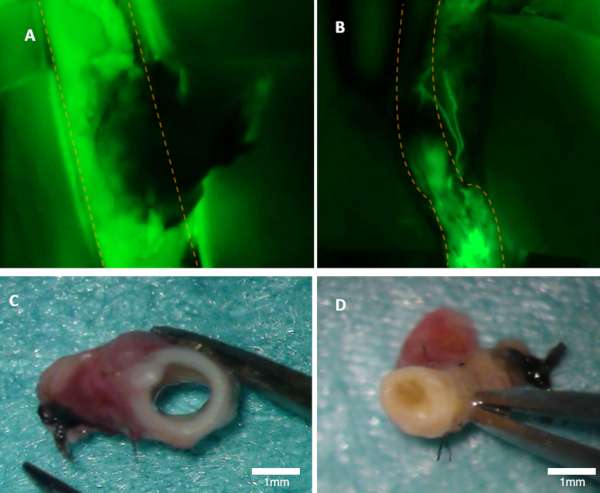
Figura 1 : Visualizzazione della pacienza in un coniglio. (A) La pacienza dell'arteria madre è chiaramente visibile sull'immagine a fluorescenza (si osserva l'emissione verde dalla fluoresceina). (B) Questa arteria è occlusa (immagine a fluorescenza). Entrambe le arterie sono state ispezionate macroscopicamente (C-D). Il pannello (C) mostra nell'arteria del pannello A; il lume è aperto. Panel (D) mostra l'arteria del pannello B dove l'occlusione può essere vista macroscopicamente. Le linee tratteggiate arancioni segnano i bordi dell'arteria padre. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2 : Visualizzazione della perfusione in un ratto. (A) Questo pannello mostra un aneurisma residualmente perfuso (la linea tratteggiata rossa segna la perfusione residua). (B) Non è possibile rilevare alcuna perfusione. Panel (C) mostra l'arteria del pannello A durante il controllo macroscopico; l'orifizio aneurisma è aperto. (D) Visione macroscopica della neointima su un aneurisma occluso. Le linee tratteggiate arancioni segnano l'arteria madre e la cupola dell'aneurisma. I pannelli (A) e (B) sono immagini solo a fluorescenza e il colore verde mostra l'emissione di fluoresceina. Fare clic qui per visualizzare una versione più grande di questa figura.
| Patency/Perfusione Residua | ||||
| Macroscopico | Macroscopica - | Fluoresceina | Fluoresceina - | |
| Conigli | 2 Il nome del sistema | 14 Del sistema | 5 Del numero 3( | 11 Del sistema di |
| Ratti | 23 del 23 o | 25 mi lato | 22 Milia | 21 Mieto |
| totale | 25 mi lato | 39 mila: l'altro | 27 mi lapiùdel | 32 Milia risse |
Tabella 1: test di papotenza. La patenza dell'arteria genitore è stata testata solo nei conigli ed è illustrata qui. La fluoresceina ha rilevato più patencie delle arterie dei genitori rispetto alla valutazione macroscopica. (Tutti i ratti in questo ambiente avevano un'arteria genitore aperta, come aneurismi sono stati suturati sull'aorta addominale.) La papotenza degli aneurismi è stata testata solo nei ratti. Ventidue delle 23 patencie macroscopicamente rilevate sono state confermate utilizzando l'FVA. Ventuno dei 25 non mostravano alcuna pacienza sull'AVV.
| Macroscopico positivo | Negativo macroscopico | totale | |
| Fluoresceina positiva | 25 mi lato | 2 Il nome del sistema | 27 mi lapiùdel |
| Fluoresceina negativa | 0 (in vie | 32 Milia risse | 32 Milia risse |
| totale | 25 mi lato | 34 Mi lasa |
Tabella 2: Tabella due per due utilizzata per calcolare la specificità e la sensibilità dell'ITF.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
L'FVA è un metodo promettente e semplice per esaminare le navi nei roditori e può essere eseguita con dispositivi commerciali e attrezzature pronte all'uso. L'FVA può essere implementato durante qualsiasi intervento chirurgico in cui è necessaria una valutazione intraoperatoria dell'integrità della nave, poiché i vasi necessitano prima di essere adeguata.
Gli autori hanno preferito l'iniezione venosa all'iniezione arteriosa a causa del minor rischio di eventi involontari come infezione, ischemia e sindrome del compartimento12. L'iniezione endovenosa consente una colorazione affidabile, limitata nello spazio, altamente concentrata, e richiede piccoli dosaggi di tintura13,14. Inoltre, l'iniezione venosa consente una rapida sgombero della fluoresceina14,15. Un metodo alternativo è quello di iniettare agente di contrasto direttamente nell'arteria scelta. Questo metodo non è stato utilizzato in questi esperimenti in quanto gli sperimentatori volevano prevenire la contaminazione del campo chirurgico con sangue e fluoresceina. Al fine di ridurre questo rischio, si raccomanda 13iniezione di agente di contrasto venoso periferico.
I vantaggi dell'FVA sono un contrasto elevato (facilmente rilevabile con l'occhio umano), un'elevata sensibilità come mostrato sopra (Tabella 2), basso costo e facile maneggevolezza16. Il sodio fluoresceino era l'agente di contrasto prescelto per esaminare la perfusione. La luce visibile da sola può essere utilizzata per l'eccitazione del colorno e l'emissione della tipica luce verde. Tuttavia, questo agente di contrasto funziona meglio con la luce blu (circa 480 nm) ed emette una forte luce verde (lunghezza d'onda di circa 530 nm)15. Secondo Yoshioka et al., fluoresceina colora l'arteria molto rapidamente14. Inoltre, il flusso di sangue arricchito di fluoresceina può essere osservato in tempo reale15,17. Il breve tempo necessario per FVA presenta un altro vantaggio; in questa serie ci sono voluti in media 2 min (1 min) per condurre un FVA.
Lo svantaggio dell'utilizzo della fluoresceina come agente di contrasto è che funziona bene con solo pareti arteriose sottili che richiedono una dissezione molto attenta. Ichikawa e altri hanno mostrato l'estinzione della tintura a causa dell'emissione di luce contrastata attraverso pareti più spesse da calcificazione o arterie non disloccate15. Dopo l'iniezione, la fluoresceina viene metabolizzata dalla glucuronide fluorescente nel fegato. Entro 30 min dopo l'iniezione, la concentrazione di fluorescein glucuronide supera la concentrazione di fluoresceina18. La fluoresceina richiede un lungo tempo di gioco. Un'iniezione immediata dopo l'iniezione endovenosa di fluoresceina non è raccomandata in quanto l'arteria e l'aneurisma sono già fluorescenti dalla prima iniezione17.
Il peso molecolare della fluoresceina è di soli 376 kDa che consente la fuoriuscita del tinri. La parete vascolare diventa anche fluorescente che potrebbe portare a valutazioni di flusso falsi positivi (aumentando con tempo dopo l'applicazione). Una colorazione irregolare della parete del vaso è stata osservata a partire da circa 5 min dopo l'iniezione di fluoresceina14. La colorazione macchiata, tuttavia, è stata osservata solo nelle arterie più grandi. Le arterie piccole e medie non hanno mostrato questa struttura di colorazione17. Si raccomanda di valutare immediatamente l'aneurisma al fine di rilevare il riempimento residuo.
Anche se c'è un rischio molto basso di tossicità, alcuni casi di fluoresceina che portano a reazioni cardiache e respiratorie sono stati descritti14. In questo studio non si è verificato alcun evento avverso grave; le uniche complicazioni erano 2 casi di perforazione della vena dell'orecchio. Secondo Lane et al., la fluoresceina di sodio non è dannosa anche se utilizzata negli esseri umani17. D'altra parte, la fluoresceina è abbastanza instabile e non deve essere esposta alla luce bianca16 - una fonte di luce rossa può essere utilizzata invece.
Al fine di scegliere la concentrazione di fluoresceina per i conigli, gli investigatori hanno iniziato con la dose di lavoro più bassa nota nei ratti (0,2 mL di 100 mg/mL di sodio fluoresceina) e l'hanno aumentata gradualmente a 1 mL. Un forte segnale di fluorescenza è stato registrato a quella dose. Il dosaggio è stato aumentato gradualmente per testare se la fluorescenza migliora - che non era il caso. Gli autori hanno deciso di continuare con 1 mL di 100 mg/mL fluoresceina13.
Un altro tintura disponibile per esaminare le navi intraoperatoriamente è ICG. La sua dimensione è 775 kDa e tale penetra a malapena i tessuti circostanti14. A causa delle sue lunghezze d'onda a emissione più lunghe, il tessuto è penetrato più facilmente perché i tessuti sono più trasparenti a 800 nm19 e le strutture più profonde diventano visibili14,16. La lunghezza d'onda di eccitazione all'interno dei 750-800 nm è richiesta16,20 e la lunghezza d'onda di emissione dall'agente di contrasto è di circa 800 nm16, rendendo entrambi invisibili all'occhio umano. A causa del suo breve tempo di emivita nel plasma sanguigno, il coloranti può essere iniettato e riutilizzato ripetutamente16. Limitazioni all'uso di questo coloranti includono problemi con arterie spesse a parete20 e la necessità di luce al di fuori dello spettro visibile13. Di conseguenza, ICG dipende da attrezzature costose e non è facilmente applicabile in ogni laboratorio.
In conclusione, FVA è un metodo veloce, economico e affidabile con alta sensibilità alla pacienza dello schermo di aneurismi e arterie genitore nei modelli di aneurisma roditore. È associato a praticamente nessuna morbilità e mortalità. Permette il monitoraggio del flusso sanguigno in tempo reale durante l'intervento chirurgico e il follow-up. Per migliorare la sua efficacia, l'iniezione deve essere effettuata al buio ed è meglio eseguita su vasi meticolosamente sezionati. Questo metodo può essere implementato in modo semplice e sicuro in un laboratorio cerebrovascolare e può ridurre al minimo i costi dell'esperimento.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Tutti gli autori non confermano conflitti di interesse.
Acknowledgments
Questo studio è stato sostenuto in parte da una sovvenzione di ricerca del Kantonsspital Aarau, Svizzera.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



