Summary
Vi presenterer en protokoll for å effektivt evaluere patency og fartøy som er av sidevegg blødning hos rotter og kaniner, ved hjelp av fluorescein fluorescens video angiografi (FVA). Med en positiv prediktiv verdi på 92,6% er det en enkel, men svært effektiv og økonomisk metode uten behov for spesialutstyr.
Abstract
Hjerneblødning behandling fokuserer på å oppnå fullstendig okklusjon, samt bevare blodstrøm i den overordnede arterien. Fluorescein natrium og indocyanine grønn brukes for å muliggjøre observasjon av henholdsvis blodstrøm og fartøy status. Målet med denne studien er å anvende FVA for å verifisere sanntids blodstrøm, fartøy status og okklusjon av aneurismer etter induksjon av sidevegg aneurismer hos kaniner og rotter, samt å validere prosedyren i disse artene.
Tjue sidevegg aneurismer ble opprettet i 10 kaniner ved å suturing en decellularized arteriell fartøy posen på hals puls arterien av en donor kanin. I tillegg ble 48 mikrokirurgisk sidevegg aneurismer opprettet i 48 rotter. Under oppfølgingen på en måned etter opprettelsen ble dissekert og FVA ble utført ved hjelp av en intravenøs fluorescein (10%, 1 mL) injeksjon via et øre vene catheterization i kaniner og en lår blodåre catherization i rotter. Aneurismer ble deretter høstet, og patency ble evaluert makroskopisk.
Makroskopisk, 14 av 16 aneurismer i kaniner indikerte ingen gjenværende forelder arterie blod med helt okkludert luminae, men 11 (79%) ble oppdaget av FVA. Fire aneurismer ble ekskludert på grunn av tekniske problemer. Hos rotter var rester av makroskopisk observert i 25 av 48 tilfeller. Av de 23 uten makroskopisk bevis, bekreftet FVA forekomsten av 22 aneurismer (96%). Det var ingen uønskede hendelser knyttet til FVA. Fluorescein er lett anvendelig og ingen spesialutstyr er nødvendig. Det er en trygg og ekstremt effektiv metode for evaluering av foreldre arterie integritet og patency/rester av blod i en eksperimentell setting med kaniner og rotter. FVA bruker fluorescein som en kontrast agent ser ut til å være effektive i å kontrollere patency av aneurismer og den underliggende fartøyet og kan også tilpasses til bypass kirurgi.
Introduction
Bevis for fullstendig utslettelse av blod og foreldrenes arterie integritet er av største betydning i operasjon av blødning. Det finnes flere alternativer for å bekrefte forelder arterie patency og hjerne okklusjon, som Doppler Sonography, konvensjonelle cerebral angiografi (DSA), beregnet tomografi angiografi (CTA) eller magnetisk resonans angiografi (MRA)1, 2. disse er imidlertid dyre og tidkrevende metoder som ofte ikke er tilgjengelige i et laboratoriemiljø. Videre kan de ha relevante bivirkninger som stråling eller behov for ytterligere sedasjon av eksperimentelle dyr for å unngå bevegelse gjenstand.
Med et økende antall nye endovaskulær enheter dukker opp, er det et påfølgende behov for prekliniske testing av slike enheter. Disse studiene er imidlertid ofte avhengige av en etter obduksjon-analyse (f.eks. makro patologi og histologi) og mangler informasjon om dynamisk bruk. Videre, for forskeren kan det være avgjørende å få umiddelbar og pålitelig informasjon under en eksperimentell kirurgisk prosedyre. Fluorescens angiografi er en kostnadseffektiv og enkel å utføre visualisering teknikk1,3,4.
Som sådan, indocyanine grønn (ICG) video angiografi er ofte anvendt inne klinisk nevrokirurgisk prosedyrer og har omfattende blitt studert5,6. Fluorescein video angiografi (FVA) er en alternativ teknikk, med den ekstra fordelen av å skape et fluorescens signal som er innenfor bølgelengdeområdet av menneskelig visjon, og kan dermed ses av det blotte øye uten et utvidet spektrum infrarødt kamera 7. Fluorescein video angiografi er mindre ofte brukt i klinisk cerebrovaskulær kirurgi og rapporter om FVA i eksperimentelle innstillinger er knappe1,4.
Målet med denne rapporten er å demonstrere gjennomførbarhet og omfang av anvendelser av FVA i rotte og kanin prekliniske cerebrovaskulær forskning.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Det gnagere var huset inne en dyr bekymre Letter og eksperimenter var anmelder og anerkjent av komiteen for dyr velferd for universitetet av Bern, Sveits (være 108/16) og (BE65/16). Alle dyrene ble opprettholdt på en standard laboratorie diett med fri tilgang til mat og vann. Alle dyr eksperimenter ble gjennomført under nøye overveielse av 3Rs (utskifting, reduksjon og raffinement). Ti kvinnelige New Zealand White kaniner og 48 mannlige Wistar rotter ble inkludert. ANKOM retningslinjene ble fulgt strengt8.
Merk: tjue sideveggen aneurismer ble opprettet i 10 kaniner ved å suturing en decellularized arteriell fartøy posen på hals puls arterien av en donor kanin. I tillegg ble 48 mikrokirurgisk sidevegg aneurismer opprettet i 48 rotter som beskrevet før4,9. Bildebehandlings prosedyren og makroskopisk analysen ble utført 4 uker etter at det ble skapt en blødning.
1. utarbeidelse av materiale som trengs for fluorescein video angiografi
- Endre lommelykten ved å tape på et blått båndpassfilter (se tabell over materialer), som vil fungere som et eksitasjon filter. Fakkelen skal da bare avgi blått lys. Bruk svart tape for å unngå lekkasje av ufiltrert lys.
- Utstyr kameraet (f.eks. festet til mikroskopet) med et grønt båndpassfilter (se tabell over materialer), som vil fungere som et utslipps lys filter. Bare grønt lys skal nå være i stand til å passere gjennom.
2. utarbeidelse av arbeidsplasser og materialer
- Desinfisere arbeidsområdet med desinfiserende løsning.
- Dekk bordet med sterile forheng for å hindre forurensning.
- Bruk sterile instrumenter for kirurgi.
3. utarbeidelse av dyr for kirurgi
- Veie dyrene.
- Indusere anestesi og justere dosen i henhold til vekten.
- For kaniner, start balansert anestesi. Shield øynene med én hånd under injeksjon for å redusere sin skrekk reaksjon. Dekk buret med et ark for å hjelpe sedate dyrene.
- Bedøve rotter i et gasskammer med 4% isoflurane og 96% oksygen før injeksjon.
- Overvåk dybden av anestesi. Knip mellom tærne for å sikre at dyrene sover.
- Omplasser kaniner på ryggen. De bør ikke reagere.
- For rotter, knip halen og sikre at ingen reaksjon er observert.
- Påfør salve på gnagere øyne for å hindre tørrhet. Trekk ut rottene ' tunger for å unngå noen sjanse til å svelge.
- Begynn med bevaring av anestesi.
- For kaniner, catheterize (22 G skjermet IV kateter med injeksjon port, se tabell over materialer) øret vene. Oppretthold balansert anestesi. Bruk en treveis stopcock for å aktivere flere samtidige injeksjoner.
- For rotter, Injiser 50 mg/kg ketamin hydrochloride og 0,5 mg/kg medetomidine hydrochloride intraperitonealt. Overvåk anestesi med en skadelig tå klype under operasjonen. I tilfelle av reaksjon, administrere ytterligere bedøvelse.
- Tape dyrene på brettet i en liggende posisjon og tett barbering snittet sted. Desinfisere området med Betaseptic.
- For kaniner, desinfisere nakken, spesielt rundt sternocleidomastoid muskel.
- For rotter, desinfisere området fra blæren til transvers kolon.
- Administrer oksygen gjennom en maske gjennom hele operasjonen og oppretthold kroppstemperaturen med en varmepute.
4. utarbeidelse av arterien
- For best resultater, grundig analysere valgt fartøy fra det omgivende tissue9,10.
- For rotter, Identifiser hale vene (mindre invasiv, fortrinnsvis brukt for overlevende dyr) eller analysere en lår blodåre for fluorescein injeksjon4,11.
Merk: for kaninerer det ikke nødvendig med ytterligere Disseksjon av fartøy for fluorescein injeksjon, da øre venen allerede brukes til anestesi.
- For rotter, Identifiser hale vene (mindre invasiv, fortrinnsvis brukt for overlevende dyr) eller analysere en lår blodåre for fluorescein injeksjon4,11.
- Plasser en hvit pute under valgt fartøy for å øke kontrasten med det omgivende vevet.
- Fokuser kameraet montert på mikroskopet på dissekert arterien.
5. Fluorescein video angiografi
- Dekk til sprøyten på 5 mL som er fylt med fluorescein natrium (100 mg/mL, se materialfortegnelsen) med aluminiumsfolie for å beskytte mot lys eksponering. Slå av lysene (så mye som mulig) og injisere fluorescein natrium intravenøst. Injiser under mørket for å unngå photobleaching.
- For kaniner, injisere 0,3 ml/kg fluorescein natrium gjennom de tre-veis-stopcock inn i kateteriseres øret vene.
- For rotter, Injiser 0,4 ml/kg fluorescein natrium i lår venen via et kateter eller en 25 G nål.
- Skyll nålen eller kateteret med 0,5 mL saltoppløsning for å sikre at alt fargestoff injiseres.
- Belyse operasjonsfeltet med den modifiserte lommelykten.
- Begynn å filme med det modifiserte kameraet. Blodstrømmen skal være synlig noen få sekunder etter injeksjon (figur 1).
Merk: her har vi brukt bildefrekvens = 50 rammer/s, brennvidde = 70 mm, og F 3.4.
6. makroskopisk analyse
- Resect den aneurismer og overordnede arterien kompleks, og evaluere patency makroskopisk ved å åpne den overordnede arterien med mikro-saks og evaluere lumen av den overordnede arterien og anerysm ' s munnstykket (se figur 1, 2)9. Målstørrelsen på aneurismer. Histologi kan deretter oppbevares for videre analyse (f. eks.).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Hjertefrekvens og blodtrykk ble overvåket under operasjonen. Gjennomsnittlighjertefrekvens var 193/min hos kaniner og 196/min hos rotter. Den kaniner ' kroppsvekt varierte 3.05-4.18 kg, og rottene veide 335-690 g.
Vi var i stand til å utføre FVA i åtte av ti kaniner (figur 1). Fire blødning i to kaniner ble ikke spilt inn med kameraet på grunn av tekniske problemer. Det ble ikke rapportert tekniske problemer med FVA hos rotter. Imidlertid, FVA kunne ikke være utført inne ettall rotten på grunn av vanskeligheter punktering det femur vene.
Av 16 aneurismer i åtte kaniner viste to aneurismer vedvarende blod av den overordnede arterien (bekreftet makroskopisk) (se tabell 1) mens FVA identifiserte fem tilfeller med rest blod. 14 kanin aneurismer viste ingen rester av makroskopisk, men 11 (79%) ble senere oppdaget ved hjelp av FVA. Det ble observert makroskopisk i 25 av 48 rotter (tabell 1), og de øvrige 23 rottene viste ingen makroskopisk tegn på gjenværende (figur 2). 22 av disse 23 aneurismer ble deretter bekreftet ved hjelp av FVA (96%). I alt kan 25 av 27 tilfeller bekreftes, noe som resulterer i en positiv prediktiv verdi på 92,6%, en følsomhet på 100% og spesifisitet på 94,1%. (Tabell 2).
I sammendraget viste 25 aneurismer rest blod, 53 foreldre arterier var patent og 11 ble okkludert som bekreftet makroskopisk og på video angiografi. Det var bare mindre komplikasjoner forbundet med FVA i kaniner; som perforering av marginale øret vene under catheterization. Ingen ytterligere uønskede hendelser ble opplevd. Ingen dødelighet og ingen sykelighet på grunn av FVA ble rapportert.
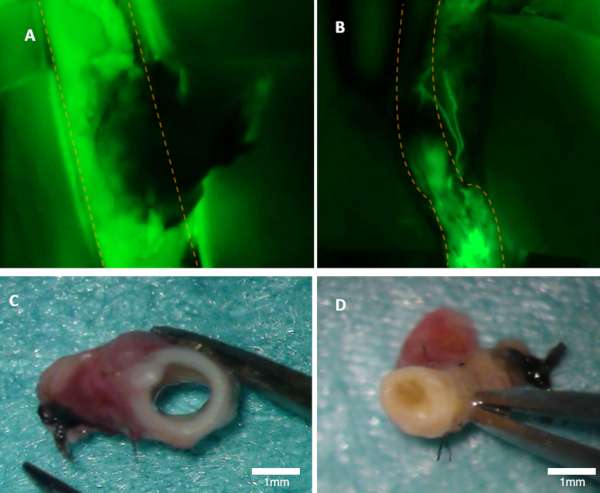
Figur 1 : Visualisering patency i en kanin. (A) patency av den overordnede arterien er godt synlig på fluorescens bildet (grønne utslipp fra fluorescein er sett). (B) denne arterien er okkludert (fluorescens bilde). Begge arteriene ble inspisert makroskopisk (C-D). Panel (C) viser i arterien fra panel A; lumen er åpen. Panel (D) viser arterie fra panel B hvor okklusjon kan sees makroskopisk. Orange stiplede linjer markere grensene av den overordnede arterien. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 2 : Visualisering av en rotte. (A) dette panelet viser en residually perfusert blødning (rød prikket linje markerer den gjenværende (B) det ikke kan oppdages noen Panel (C) viser arterien fra panel A under makroskopisk gransking; munnstykket er åpent. (D) makroskopisk syn på neointima på et okkludert blødning. Orange stiplede linjer markere den overordnede arterien og blødning kuppel. Paneler (A) og (B) er fluorescens bilder og den grønne fargen viser fluorescein utslipp. Vennligst klikk her for å se en større versjon av dette tallet.
| Patency/gjenværende | ||||
| Macroscopical + | Macroscopical - | Fluorescein + | Fluorescein | |
| Kaniner | 2 | 14 | 5 | 11 |
| Rotter | 23 | 25 | 22 | 21 |
| Totalt | 25 | 39 | 27 | 32 |
Tabell 1: patency testing. Patency av foreldrenes arterie var bare testet hos kaniner og er illustrert her. Fluorescein oppdaget flere patencies av foreldre arterier enn macroscopical evaluering. (Alle rotter i denne innstillingen hadde en åpen forelder arterie, som aneurismer ble sutured på abdominal aorta.) Patency av aneurismer ble kun testet hos rotter. Tjue-to av 23 makroskopisk oppdaget patencies ble bekreftet ved hjelp av FVA. Twenty-en av 25 viste ingen patency på FVA.
| Makroskopisk positive | Makroskopisk negativ | Totalt | |
| Fluorescein positive | 25 | 2 | 27 |
| Fluorescein negativ | 0 | 32 | 32 |
| Totalt | 25 | 34 |
Tabell 2: to-til-to-bord som brukes til å beregne spesifisitet og følsomhet for FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA er en lovende og ukomplisert metode for å undersøke fartøy i gnagere og kan utføres med kommersielle enheter og off-the-sokkel utstyr. FVA kan implementeres under enhver operasjon der intraoperativ evaluering av fartøyets integritet er nødvendig ettersom fartøyene trenger skikkelig disseksjon først.
Forfatterne foretrakk venøs injeksjon til arteriell injeksjon på grunn av lavere risiko for utilsiktede hendelser som infeksjon, iskemi og kupé syndrom12. Intravenøs injeksjon muliggjør pålitelig, romlig begrenset, svært konsentrert farging, og krever lite fargestoff doser13,14. I tillegg kan venøs injeksjon en rask klaring på fluorescein14,15. En alternativ metode er å injisere kontrastmiddel direkte inn i den valgte arterien. Denne metoden ble ikke brukt i disse eksperimentene som etterforskerne ønsket å hindre forurensende operasjonsfeltet med blod og fluorescein. For å redusere denne risikoen, er perifer venøs kontrast agent injeksjon anbefalt13.
Fordeler med FVA er høy kontrast (lett oppdages med det menneskelige øyet), høy følsomhet som vist ovenfor (tabell 2), lav pris og enkel håndtering16. Fluorescein natrium var det valgte kontrast middelet til å undersøke Synlig lys alene kan brukes til eksitasjon av fargestoff og utslipp av typisk grønt lys. Likevel fungerer denne kontrast agenten best med blått lys (ca. 480 NM) og avgir et sterkt grønt lys (bølgelengde ca. 530 NM)15. Ifølge Yoshioka et al., fluorescein farger arterien ekstremt raskt14. Videre kan flyten av fluorescein-beriket blod observeres i sanntid15,17. Den korte tiden som er nødvendig for FVA presenterer en annen fordel; i denne serien tok det i gjennomsnitt 2 min (± 1min) for å gjennomføre en FVA.
Ulempen med å bruke fluorescein som kontrastmiddel er at det fungerer godt med bare tynne arterie vegger som krever svært forsiktig disseksjon. Ichikawa et al. viste utryddelse av fargestoff på grunn av hindret utslipp av lys gjennom tykkere vegger av forkalkning eller undissected arterier15. Etter injeksjon metaboliseres fluorescein til fluorescerende fluorescein glukuronid i leveren. Innen 30 min etter injeksjon overstiger konsentrasjonen av fluorescein glukuronid konsentrasjonen av fluorescein18. Fluorescein krever en lang klaring tid. En umiddelbar reinjeksjon etter intravenøs injeksjon av fluorescein er ikke anbefalt som arterie og blødning er allerede fluorescerende fra første injeksjon17.
Molekylvekten av fluorescein er bare 376 kDa som tillater lekkasje av fargestoffet. Den vaskulære veggen blir også fluorescerende som kan føre til falske positive strømnings evalueringer (øker med tiden etter påføring). En usammenhengende farge av fartøy veggen ble observert starter ca 5 min etter injeksjon av fluorescein14. Den flekkete farge, men ble bare observert i større arterier. Små og mellom store arterier viste ikke denne farge strukturen17. Det anbefales å evaluere blødning umiddelbart for å oppdage rest fylling.
Selv om det er en svært lav risiko for toksisitet, har noen tilfeller av fluorescein som fører til hjerte-og respirasjons reaksjoner blitt beskrevet14. I denne studien skjedde det ingen alvorlige bivirkninger; den eneste komplikasjoner var 2 tilfeller av øret vene perforering. Ifølge Lane et al., er natrium fluorescein ikke skadelig selv når den brukes i mennesker17. På den annen side er fluorescein ganske ustabil og bør ikke utsettes for hvitt lys16 -en rød lyskilde kan brukes i stedet.
For å velge konsentrasjonen av fluorescein for kaniner, startet etterforskerne med lavest kjent arbeids dose hos rotter (0,2 mL 100 mg/mL fluorescein natrium) og økte den gradvis til 1 mL. Et sterkt fluorescens signal ble registrert ved denne dosen. Doseringen ble økt gradvis for å teste om fluorescens forbedrer-som ikke var tilfelle. Forfatterne besluttet å fortsette med 1 mL 100 mg/mL fluorescein natrium13.
Et annet fargestoff tilgjengelig for å undersøke fartøy intraoperatively er ICG. Størrelsen er 775 kDa og så vidt trenger de omkringliggende vev14. På grunn av sin lengre utslipp bølgelengder, er vev trengt lettere fordi vev er mer transparent på 800 NM19 og dypere strukturer blir synlig14,16. Eksitasjon bølgelengde innenfor 750-800 NM kreves16,20 og utslipps bølgelengde fra kontrast agenten er ca 800 NM16, noe som gjør både usynlig for det menneskelige øyet. På grunn av den korte halveringstiden i blodplasma, kan fargestoffet injiseres og gjenbrukes gjentatte ganger16. Begrensninger for å bruke dette fargestoffet inkluderer problemer med tykke vegger arterier20 og nødvendigheten av lys utenfor det synlige spekteret13. Som en konsekvens, ICG er avhengig av kostbart utstyr og ikke lett anvendelig i hvert laboratorium.
Avslutningsvis er FVA en rask, billig og pålitelig metode med høy følsomhet for skjermen patency av aneurismer og forelder arterier i gnagere blod modeller. Det er forbundet med nesten ingen sykelighet og dødelighet. Det tillater sanntids blodstrøm overvåking under kirurgi og oppfølging. For å forbedre sin effekt, bør injeksjonen utføres i mørket og er best utført på omhyggelig dissekert fartøy. Denne metoden kan enkelt og trygt implementeres i et cerebrovaskulær laboratorium, og kan minimere eksperiment kostnadene.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alle forfattere bekrefter ingen interessekonflikter.
Acknowledgments
Denne studien ble støttet delvis av et forskningsstipend fra Kantonsspital Aarau i Sveits.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



