Summary
我们使用基于荧光的荧光视频血管造影(FVA),提出一种方案,以有效评估大鼠和兔子的动脉灌注和侧壁动脉瘤的血管鉴口。阳性预测值为92.6%,是一种简单但非常有效、经济的方法,无需特殊设备。
Abstract
脑动脉瘤治疗的重点是实现完全闭塞,以及保持父母动脉的血流。氟西因钠和丁氰酸绿分别用于观察血流和血管灌注状态。本研究的目的是应用FVA来验证在兔子和大鼠诱导侧壁动脉瘤后实时血流、血管灌注和动脉瘤的闭塞,并验证这些物种的程序。
通过在捐赠兔的胡萝卜动脉上缝合一个去细胞化的动脉袋,在10只兔子身上制造了20个侧壁动脉瘤。此外,在48只大鼠中制造了48个显微外科侧壁动脉瘤。在创建后一个月的随访期间,对母动脉/动脉瘤复合物进行解剖,并使用静脉荧光管(10%,1 mL)注射,通过兔子的耳静脉导管插入和大鼠的股骨静脉催化进行FVA注射。动脉瘤随后被收获,并宏观评估。
从宏观上看,兔子16个动脉瘤中的14个表明没有残留的母动脉灌注,完全被遮挡的发光体,然而11(79%)被FVA检测到。由于技术问题,排除了四个动脉瘤。在大鼠中,在48例中,有25例在宏观上观察到残留动脉瘤灌注。在23个没有灌注宏观证据的病例中,FVA确认了22例动脉瘤的发病率(96%)。没有与FVA相关的不良事件。荧光辛易于应用,无需特殊设备。它是一种安全、极其有效的方法,用于评估在实验环境中与兔子和大鼠的动脉完整性和动脉瘤的亲动脉完整性/残留灌注。使用荧光辛作为造影剂的FVA似乎能有效控制动脉瘤和基础血管的锥度,甚至可以适应旁路手术。
Introduction
完全动脉瘤消解和母动脉完整性的证据在动脉瘤手术中至关重要。有几个选项来确认父动脉闭塞和动脉闭塞,如多普勒血管造影,常规脑血管造影(DSA),计算机断层扫描血管造影(CTA)或磁共振血管造影(MRA)1, 2.然而,这些方法既昂贵又耗时,在实验室环境中往往不可用。此外,它们可能有相关的副作用,如辐射暴露或需要额外的镇静实验动物,以避免运动艺术品。
随着越来越多的新的血管内设备出现,连续需要对此类设备进行临床前测试。然而,这些研究往往依赖于验尸分析(例如,宏观病理学和组织学),并且缺乏关于动态灌注的信息。此外,对于研究人员来说,在实验外科手术中获得即时可靠的信息可能至关重要。荧光血管造影是一种经济高效且易于执行可视化技术1,3,4。
因此,英青绿(ICG)视频血管造影术常用于临床神经外科手术,并已广泛研究5,6。荧光视频血管造影 (FVA) 是一种替代技术,其附加优势是创建荧光信号,该信号位于人类视觉的波长范围内,因此肉眼无需扩展光谱红外摄像机即可看到7.氟化物视频血管造影在临床脑血管手术中较少使用,在实验环境中关于FVA的报告很少1,4。
本报告旨在论证FVA在大鼠和兔前脑血管研究中的应用的可行性和范围。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
啮齿动物被安置在动物护理设施中,实验由瑞士伯尔尼大学动物福利委员会(BE 108/16)和(BE65/16)审查和批准。所有动物都按照标准实验室饮食,免费获得食物和水。所有动物实验都是在仔细考虑3R(替换、减少和优化)的情况下进行的。包括10只新西兰雌性白兔和48只雄性威斯塔鼠。已严格遵守了《到达准则》8。
注:在10只兔子身上,通过缝合供体兔子的胡萝卜动脉上的脱细胞动脉血管袋,在10只兔子身上制造了20个侧壁动脉瘤。此外,48个显微外科侧壁动脉瘤在48只大鼠中产生,如4、9之前所述。成像过程和宏观分析在动脉瘤产生4周后进行。
1. 荧光分析视频血管造影所需的材料的准备
- 通过贴在蓝色带通过滤器上(参见材料表)来修改手电筒,该过滤器将用作激励过滤器。然后,手电筒应只发出蓝光。使用黑色胶带,避免未过滤的光线泄漏。
- 为相机(例如,连接到显微镜)配备绿色带通过滤器(参见材料表),该过滤器将用作发射光过滤器。现在只有绿灯才能通过。
2. 工作场所和材料的准备
- 用消毒液对工作空间进行消毒。
- 用无菌窗帘盖住桌子,以防止污染。
- 使用无菌仪器进行手术。
3. 为手术准备动物
- 称量动物。
- 诱导麻醉,并根据重量调整剂量。
- 对于兔子,开始平衡麻醉。注射时用一只手遮住眼睛,以减少他们的反应。用床单盖住笼子,帮助动物们平静。
- 注射前,在气体室中用4%的子胶和96%的氧气对大鼠进行麻醉。
- 监测麻醉深度。捏合他们的脚趾,以确保动物睡着了。
- 把兔子放在它们的背上。他们不应该做出反应。
- 对于大鼠,捏住它们的尾巴,确保不观察到任何反应。
- 在啮齿动物的眼睛上涂抹涂膏,以防止干燥。拔掉老鼠的舌头,避免吞咽。
- 从麻醉保存开始。
- 对于兔子,导管(22G屏蔽IV导管注射口,见材料表)的耳静脉。保持平衡麻醉。使用三向止孔启用多次同时注射。
- 对于大鼠,注射50毫克/千克盐酸氯胺酮和0.5毫克/千克甲胺甲酸酯。在手术过程中用有害的脚趾捏监测麻醉。在反应的情况下,施用额外的麻醉剂。
- 将动物用胶带贴在板上,并密切地将切口位置切开。用消毒剂对区域进行消毒。
- 对于兔子,消毒颈部,特别是在胸腺肌肉周围。
- 对于大鼠,消毒从膀胱到横结肠的区域。
- 在整个手术过程中,通过面罩管理氧气,用加热垫保持体温。
4. 动脉的准备
- 为了获得最佳效果,从周围组织9,10彻底解剖选定的血管。
- 对于大鼠,识别尾静脉(侵入性较小,最好用于幸存的动物)或解剖股骨静脉,用于荧光注射4,11。
注:对于兔子来说,由于耳静脉已经用于麻醉,因此无需进一步解剖荧光辛注射血管。
- 对于大鼠,识别尾静脉(侵入性较小,最好用于幸存的动物)或解剖股骨静脉,用于荧光注射4,11。
- 将白色垫放在所选容器下方,以增加与周围组织的对比度。
- 将安装在显微镜上的相机对准解剖动脉。
5. 氟莱辛视频血管造影
- 用铝箔盖住装有荧光酸钠(100 mg/mL,见材料表)的5 mL注射器,以防止光线照射。关灯(尽可能)和静脉注射氟辛钠。在黑暗中注射,防止光漂白。
- 对于兔子,通过三向止血管将0.3 mL/kg荧光钠注射到导管耳静脉中。
- 对于大鼠,通过导管或25G针头将0.4mL/kg荧光钠注射到股骨静脉。
- 用 0.5 mL 盐水溶液冲洗针头或导管,以确保注入所有染料。
- 用改装的手电筒照亮手术场。
- 使用修改后的相机开始拍摄。注射后几秒钟内,血流量应可见(图1)。
注:这里,我们使用帧速率 = 50 帧/秒,焦距 = 70 mm,和 F3.4。
6. 宏观分析
- 切除动脉瘤和母动脉复合体,并通过用微剪刀打开母动脉从宏观角度评估母动脉,并评估母动脉和动脉动脉的流明(见图1,2)9。 测量动脉瘤的大小。然后,可以存储动脉-母动脉-复合物以进行进一步分析(例如,组织学)。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
在手术期间监测心率和血压。兔子的平均心率为193/分钟,大鼠为196/分钟。兔子的体重在3.05-4.18公斤,老鼠的体重为335-690克。
我们能够在十只兔子中的八只(图1)中执行FVA。由于技术困难,两只兔子的四次动脉瘤检查没有用相机记录下来。没有关于大鼠FVA的技术困难报告。然而,FVA不能在一只大鼠中执行,因为难以刺穿股骨静脉。
在8只兔子的16个动脉瘤中,2个动脉瘤显示父动脉持续灌注(确认为宏观)(见表1),而FVA发现5例残留灌注。14兔动脉瘤在宏观上无残留灌注,然而11(79%)随后使用 FVA 检测到。在48只大鼠中,有25只大鼠(表1)的余量灌注被宏观观察,其余23只大鼠没有残留灌注的宏观迹象(图2)。这23个动脉瘤中有22个随后使用FVA(96%)得到确认。在27例中,共有25例得到确认,预测值为92.6%,灵敏度为100%,特异性为94.1%。(表2)。
综上所述,25个动脉瘤显示残留灌注,53条母动脉获得专利,11条被隔离为确认的宏观和视频血管造影。只有与兔子的FVA相关的轻微并发症;如导管插入时边缘耳静脉穿孔。没有再发生不良事件。没有报告因FVA造成的死亡率和发病率。
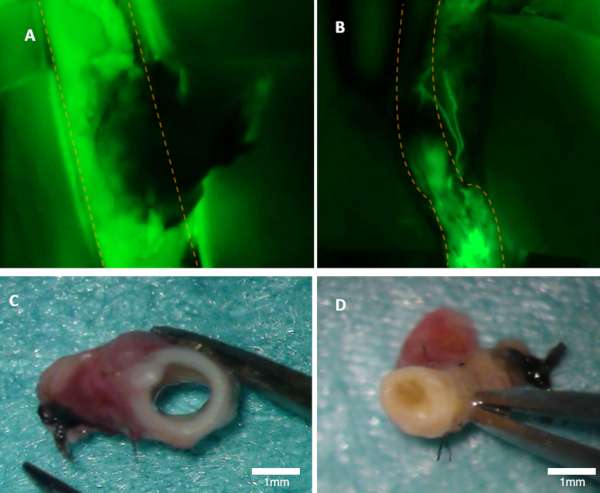
图 1:在兔子中可视化的拍子。(A) 在荧光图像上可以清晰可见母动脉的锥度(可见荧光源的绿色排放)。(B) 这条动脉被遮挡(荧光图像)。两条动脉均接受宏观检查 (C-D).面板 (C) 显示从面板 A 的动脉;流明是开放的。面板 (D) 显示面板 B 的动脉,从宏观上可以看到遮挡.橙色虚线标记父动脉的边界。请点击此处查看此图的较大版本。

图 2:在大鼠中进行可视化灌注。(A) 此面板显示残留灌注动脉瘤(红色虚线标记残余灌注)。(B) 不能检测到灌注.面板 (C) 在宏观检查期间显示面板 A 的动脉;动脉瘤孔是开放的。(D) 闭塞动脉瘤上新神经瘤的宏观视图.橙色虚线标记父动脉和动脉瘤圆顶。面板 (A) 和 (B) 是仅荧光图像,绿色显示荧光源发射。请点击此处查看此图的较大版本。
| 聚变/剩余灌注 | ||||
| 宏观 | | 宏观 - | 氟莱辛 | | 氟莱辛 - | |
| 兔 | 2 | 14 | 5 | 11 |
| 大 鼠 | 23 | 25 | 22 | 21 |
| 总 | 25 | 39 | 27 | 32 |
表1:爱国者测试。母动脉的亲子动脉的亲子关系只在兔子身上测试,并在这里说明。荧光蛋白检测到的母动脉比宏观评估更多的锥度。(在此环境中的所有大鼠都有一条开放的母动脉,因为动脉瘤在腹部主动脉上被缝合。动脉瘤的发分只在大鼠身上测试。在23个宏观检测的病毒中,有22个使用FVA得到确认。25个中,有21个对FVA没有一致性。
| 宏观阳性 | 宏观负 | 总 | |
| 荧光正 | 25 | 2 | 27 |
| 荧光片阴性 | 0 | 32 | 32 |
| 总 | 25 | 34 |
表2:用于计算FVA特异性和灵敏度的二乘表。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA 是一种有前途的简单方法,用于检测啮齿动物中的容器,并且可以使用商业设备和现成设备进行。FVA 可在任何需要手术中评估容器完整性的手术中实施,因为容器需要首先进行适当的解剖。
作者更喜欢静脉注射,而不是动脉注射,因为意外事件的风险较低,如感染,缺血症和隔间综合征12。静脉注射使可靠,空间有限,高度浓缩染色,并要求小染料剂量13,14。此外,静脉注射允许快速清除荧光14,15。另一种方法是将造影剂直接注入所选动脉。这种方法没有用于这些实验,因为研究人员希望防止用血液和荧光辛污染手术领域。为了降低这种风险,建议注射外周静脉造影剂13。
FVA的优点是高对比度(容易用人眼检测),高灵敏度,如上表2所示,成本低,易于操作16。荧光酸钠是检查灌注的选型造影剂。光可见光可用于激发染料和发射典型绿光。然而,这种造影剂最适合蓝光(约480nm),并发出强绿光(波长约530nm)15 。据吉冈等人介绍,荧光蛋白使动脉颜色极快。此外,可实时观察到富含氟辛的血液流15、17。FVA 所需的时间很短,这提供了另一个优势;在本系列中,执行一个 FVA 平均需要 2 分钟(± 1 分钟)。
使用荧光素作为造影剂的缺点是,它只与需要非常小心解剖的细动脉壁工作良好。Ichikawa等人显示,由于钙化或未分解的动脉15通过较厚的墙壁,光线被挫败,染料的灭绝。注射后,荧光素在肝脏中代谢为荧光荧光素葡绿曲宁。注射后30分钟内,氟素葡聚氰胺的浓度超过氟西辛18的浓度。荧光辛需要很长的间隙时间。静脉注射荧光后立即重新注射不建议,因为动脉和动脉瘤已经荧光从第一次注射17。
荧光成因的分子量仅为376 kDa,允许染料泄漏。血管壁也变成荧光,可能导致误阳性流动评估(应用后随时间而增加)。在注射荧光14后约5分钟,观察到血管壁的斑块着色。然而,斑斑色只在较大的动脉中观察到。中小动脉没有显示这种染色结构17。建议立即评估动脉瘤,以检测残留填充物。
虽然毒性风险很低,但一些导致心脏和呼吸道反应的荧光辛病例已经描述14。在这项研究中,没有发生严重的不良事件;唯一的并发症是2例耳静脉穿孔。根据Lane等人的说法,氟辛钠即使在人类身上使用也是无害的。另一方面,荧光蛋白相当不稳定,不应暴露在白光16下 - 可以使用红色光源。
为了选择兔子的氟辛浓度,研究人员从大鼠中已知的最低工作剂量(0.2 mL,100mg/mL荧光酸钠)开始,并逐渐增加到1 mL。该剂量上登记了强烈的荧光信号。剂量逐渐增加,以测试荧光是否改善 - 事实并非如此。作者决定继续使用1mL的100毫克/mL荧光钠13。
另一种可用于在手术中检查血管的染料是ICG。其大小是775 kDa,这样勉强穿透周围的组织14。由于其较长的发射波长,组织更容易穿透,因为组织在800nm19时更加透明,更深的结构变得可见14,16。750-800 nm内的激发波长需要16,20,造影剂的发射波长约为800nm16,使得人眼看不见。由于其在血浆中的半寿命短,染料可以反复注射和重复使用。使用这种染料的限制包括厚壁动脉20的问题和可见光谱13外光的必要性。因此,导航卫星委员会依赖昂贵的设备,并非容易适用于每个实验室。
总之,FVA是一种快速、廉价、可靠的方法,对啮齿动物动脉瘤模型中动脉瘤和母动脉的屏幕鉴别率具有高灵敏度。它几乎没有发病率和死亡率。它允许在手术和随访期间实时监测血液流动。为了提高其功效,注射应在黑暗中进行,最好在精心解剖的血管上进行。该方法可在脑血管实验室轻松、安全地实施,并最大限度降低实验成本。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
所有作者均确认没有利益冲突。
Acknowledgments
这项研究部分得到了瑞士坎顿斯皮特塔尔·阿劳的研究资助。
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



