Summary
We presenteren een protocol voor het efficiënt evalueren van aneurysma perfusie en vaar patroon van de zijwand aneurysma bij ratten en konijnen, met behulp van fluorescentie-gebaseerde fluorescentie video angiografie (FVA). Met een positieve voorspellende waarde van 92,6%, het is een eenvoudige maar zeer effectieve en economische methode zonder speciale apparatuur vereist.
Abstract
Brain aneurysma behandeling richt zich op het bereiken van volledige occlusie, evenals het behoud van de bloedtoevoer in de bovenliggende slagader. Fluorescein natrium en indocyanine groen worden gebruikt om respectievelijk de observatie van de bloedstroom en de perfusie status van het vat mogelijk te maken. Het doel van deze studie is om fva toe te passen om de real-time bloedstroom, de perfusie status van het vat en de occlusie van aneurysma na inductie van zijwand aneurysma bij konijnen en ratten te controleren, evenals om de procedure bij deze soorten te valideren.
Twintig zijwand aneurysma werden gemaakt in 10 konijnen door een decellularized arteriële vat Pouch op de halsslagader van een donor konijn. Daarnaast werden 48 microchirurgische zijwand aneurysmata gemaakt in 48 ratten. Tijdens de follow-up van een maand na de aanmaak werd de ouder slagader/aneurysma complex ontleed en fva uitgevoerd met behulp van een intraveneuze fluoresceïne (10%, 1 ml) injectie via een oorader katheterisatie bij konijnen en een femorale ader Catherization bij ratten. Aneurysmata werden vervolgens geoogst en de patentie werd macroscopisch geëvalueerd.
Macroscopisch bleek dat 14 van de 16 aneurysmata bij konijnen geen resterende ouder slagader perfusie met volledig verstopt luminae aangaven, maar 11 (79%) werden gedetecteerd door FVA. Vanwege technische problemen werden vier aneurysmata uitgesloten. Bij ratten werd de residuele aneurysma perfusie macroscopisch waargenomen in 25 van de 48 gevallen. Van de 23 zonder macroscopisch bewijs van perfusie bevestigde FVA de incidentie van 22 aneurysmata (96%). Er waren geen bijwerkingen geassocieerd met FVA. Fluorescein is gemakkelijk toepasbaar en er is geen speciale uitrusting nodig. Het is een veilige en uiterst effectieve methode voor het evalueren van de integriteit van de ouder slagader en aneurysma-patentie/residuele perfusie in een experimentele setting met konijnen en ratten. Fva het gebruik van fluoresceïne als contrastmiddel lijkt effectief te zijn bij het beheersen van de doorgankelijkheid van aneurysmata en het onderliggende vat en kan zelfs worden aangepast om een operatie te omzeilen.
Introduction
Bewijs van volledige aneurysma Obliteration en integriteit van de bovenliggende slagader is van het allergrootste belang bij aneurysma chirurgie. Er zijn verschillende opties voor het bevestigen van de ouder arteriedoorgankelijkheid en aneurysma occlusie, zoals Doppler-sonografie, conventionele cerebrale angiografie (DSA), computertomografie angiografie (CTA) of magnetische resonantie angiografie (MRA)1, 2. Dit zijn echter dure en tijdrovende methoden die vaak niet beschikbaar zijn in een laboratoriumomgeving. Bovendien kunnen zij relevante bijwerkingen hebben, zoals blootstelling aan straling of behoefte aan extra sedatie van proefdieren om bewegings artefact te voorkomen.
Met een toenemend aantal nieuwe endovasculaire apparaten in opkomst, is er een opeenvolgende behoefte aan preklinische testen van dergelijke apparaten. Deze studies zijn echter vaak afhankelijk van een postmortemanalyse (bijvoorbeeld macro pathologie en histologie) en hebben geen informatie over dynamische perfusie. Bovendien kan het voor de onderzoeker cruciaal zijn om onmiddellijk en betrouwbaar informatie te verkrijgen tijdens een experimentele chirurgische ingreep. Fluorescentie angiografie is een kosteneffectieve en gemakkelijk uit te voeren visualisatie techniek1,3,4.
Als zodanig wordt indocyanine Green (ICG) video angiografie vaak gebruikt in klinische neuro chirurgische ingrepen en is uitgebreid bestudeerd5,6. Fluorescein video angiografie (FVA) is een alternatieve techniek, met het extra voordeel van het creëren van een fluorescentie signaal dat binnen het golflengtebereik van menselijk zicht ligt, en kan dus worden gezien door het blote oog zonder een uitgebreide spectrum infraroodcamera 7. fluorescein video angiografie wordt minder vaak gebruikt in klinische cerebrovasculaire chirurgie en rapporten over fva in experimentele instellingen zijn schaars1,4.
Het doel van dit verslag is om de haalbaarheid en reikwijdte van de toepassingen van FVA in rat en konijn preklinisch cerebrovasculaire onderzoek aan te tonen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
De knaagdieren werden ondergebracht in een dierenverzorgings faciliteit en experimenten werden beoordeeld en goedgekeurd door het Comité voor dierenwelzijn aan de Universiteit van Bern, Zwitserland (BE 108/16) en (BE65/16). Alle dieren werden gehandhaafd op een standaard laboratorium dieet met gratis toegang tot voedsel en water. Alle dier experimenten werden uitgevoerd onder zorgvuldige afweging van de 3Rs (vervanging, vermindering en verfijning). Tien vrouwelijke Nieuw-Zeelandse witte konijnen en 48 mannelijke Wistar ratten waren inbegrepen. Richtlijnen voor aankomst werden strikt gevolgd8.
Opmerking: twintig zijwand aneurysma zijn gemaakt in 10 konijnen door een decellularized arteriële vat Pouch op de halsslagader van een donor konijn. Daarnaast werden 48 microchirurgische zijwand aneurysmata gemaakt in 48 ratten zoals beschreven vóór4,9. De beeldvormings procedure en macroscopische analyse werden 4 weken na de aanmaak van aneurysma uitgevoerd.
1. voorbereiding van het materiaal dat nodig is voor fluoresceïne video angiografie
- Wijzig de zaklamp door te tapen op een Blue band pass filter (Zie de tabel met materialen), die zal fungeren als een excitatie filter. De toorts moet dan alleen blauw licht uitzenden. Gebruik zwarte tape om lekkage van ongefilterd licht te voorkomen.
- Rust de camera uit (bijv. bevestigd aan de Microscoop) met een Green band pass filter (Zie de tabel met materialen), die zal functioneren als een emissie lichtfilter. Alleen groen licht zou nu kunnen passeren.
2. voorbereiding van werkplek en materialen
- Desinfecterende werkruimte met desinfecterende oplossing.
- Bedek de tafel met steriele gordijnen om verontreiniging te voorkomen.
- Gebruik steriele instrumenten voor de operatie.
3. bereiding van de dieren voor de operatie
- Weeg de dieren af.
- Induceren van anesthesie en de dosis aanpassen op basis van het gewicht.
- Voor konijnen, start gebalanceerde anesthesie. Bescherm hun ogen met één hand tijdens de injectie om hun schrik-reactie te verminderen. Bedek de kooi met een blad om de dieren te helpen.
- Anesthetiseer ratten in een gaskamer met 4% Isofluraan en 96% zuurstof vóór de injectie.
- Controleer de diepte van de anesthesie. Knijp tussen hun tenen om ervoor te zorgen dat de dieren in slaap vallen.
- Plaats de konijnen op hun rug. Ze moeten niet reageren.
- Voor ratten, knijp hun staarten en zorg ervoor dat er geen reactie wordt waargenomen.
- Breng zalf aan op de ogen van de knaagdieren om droogheid te voorkomen. Trek de tongen uit de ratten om elke kans op slikken te voorkomen.
- Beginnen met het behoud van anesthesie.
- Voor konijnen, dontische (22 G afgeschermde IV katheter met injectie poort, zie de tabel van de materialen) de oorader. Behoud van een evenwichtige anesthesie. Gebruik een drie-weg Kraantje om meerdere gelijktijdige injecties mogelijk te maken.
- Voor ratten, injecteren 50 mg/kg ketamine hydrochloride en 0,5 mg/kg Medetomidine hydrochloride intraperitoneally. Bewaak anesthesie met een noxieuze teen knijpen tijdens de operatie. In het geval van een reactie, het toedienen van extra verdoving.
- Plak de dieren in rugligging op het bord en Scheer de incisie locatie nauwkeurig. Desinfecteer het gebied met Betaseptic.
- Voor konijnendesinfecteren de nek, vooral rond sternocleidomastoïde spier.
- Desinfecteer voor rattenhet gebied van blaas tot transvers Colon.
- Beheer zuurstof via een masker gedurende de hele operatie en behoud de lichaamstemperatuur met een verwarmingskussen.
4. voorbereiding van de slagader
- Voor de beste resultaten, grondig ontleden het gekozen vat uit het omringende weefsel9,10.
- Voor ratten, Identificeer de staart ader (minder invasief, bij voorkeur gebruikt voor overlevende dieren) of ontleden een femorale ader voor fluoresceïne injectie4,11.
Opmerking: voor konijnenis geen verdere dissectie van de vaten nodig voor de fluoresceïne injectie, aangezien de oorader al wordt gebruikt voor anesthesie.
- Voor ratten, Identificeer de staart ader (minder invasief, bij voorkeur gebruikt voor overlevende dieren) of ontleden een femorale ader voor fluoresceïne injectie4,11.
- Plaats een wit kussentje onder het gekozen vat om het contrast met het omringende weefsel te vergroten.
- Concentreer de camera op de Microscoop op de ontkoppelde slagader.
5. fluorescein video angiografie
- Bedek de 5 ml spuit gevuld met fluoresceïne natrium (100 mg/ml, zie de tabel met materialen) met aluminiumfolie ter bescherming tegen blootstelling van licht. Zet de lichten uit (zoveel mogelijk) en Injecteer het natrium fluoratrium intraveneus. Injecteer onder de duisternis om fotobleaching te voorkomen.
- Voor konijnen, Injecteer 0,3 ml/kg fluoresceïne natrium via de drie-weg-stopcock in de gecatheteriseerd oor ader.
- Injecteer voor ratten0,4 ml/kg fluoresceïne natrium in de dijbeenader via een katheter of een 25 G naald.
- Spoel de naald of de katheter met 0,5 mL zoutoplossing om ervoor te zorgen dat alle kleurstof wordt geïnjecteerd.
- Verlicht het chirurgische veld met de gemodificeerde zaklamp.
- Begin met filmen met de gemodificeerde camera. De bloedtoevoer moet enkele seconden na de injectie zichtbaar zijn (Figuur 1).
Let op: hier gebruikten we de frame rate = 50 frames/s, brandpuntsafstand = 70 mm en F 3.4.
6. macroscopische analyse
- Resect het aneurysmata en het ouder slagader complex en evalueer de doorgankelijkheid macroscopisch door de hoofdslagader met micro-schaar te openen en het lumen van de ouder slagader en de opening van de anerysm te evalueren (Zie Figuur 1, 2)9. Meet de grootte van de aneurysmata. Aneurysma-ouder-slagader-complex kan vervolgens worden opgeslagen voor verdere analyse (bijvoorbeeld histologie).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Hartslag en bloeddruk werden gecontroleerd tijdens de operatie. De gemiddelde hartslag was 193/min bij konijnen en 196/min bij ratten. Het lichaamsgewicht van de konijnen varieerde 3,05-4.18 kg, en de ratten wogen 335-690 g.
We waren in staat om FVA uit te voeren in acht van de tien konijnen (Figuur 1). Vier aneurysma onderzoeken bij twee konijnen werden niet met de camera geregistreerd vanwege technische moeilijkheden. Er werden geen technische problemen met FVA bij ratten gemeld. Echter, FVA kon niet worden uitgevoerd in één rat als gevolg van moeilijkheden bij het prikken van de femorale ader.
Van 16 aneurysmata in acht konijnen toonde twee aneurysmata aanhoudende perfusie van de moeder slagader (bevestigd macroscopisch) (Zie tabel 1) terwijl fva vijf gevallen met een residuele perfusie identificeerde. 14 konijn aneurysmata toonde geen residuele perfusie macroscopisch, echter 11 (79%) werden vervolgens gedetecteerd met behulp van FVA. Residuele perfusie werd macroscopisch waargenomen bij 25 van 48 ratten (tabel 1), en de andere 23 ratten vertoonden geen macroscopische tekenen van residuele perfusie (Figuur 2). 22 van die 23 aneurysmata werden vervolgens bevestigd met behulp van FVA (96%). In totaal konden 25 van de 27 gevallen worden bevestigd, wat resulteerde in een positieve voorspellende waarde van 92,6%, een gevoeligheids percentage van 100% en specificiteit van 94,1%. (Tabel 2).
Samengevat, 25 aneurysma toonde resterende perfusie, 53 ouder slagaders waren octrooi en 11 werden verstopt als bevestigd macroscopisch en op video angiografie. Er waren slechts kleine complicaties geassocieerd met FVA bij konijnen; zoals perforatie van de marginale oorader tijdens de katheterisatie. Er werden geen verdere ongewenste voorvallen ervaren. Er werd geen sterfte en geen morbiditeit als gevolg van FVA gerapporteerd.
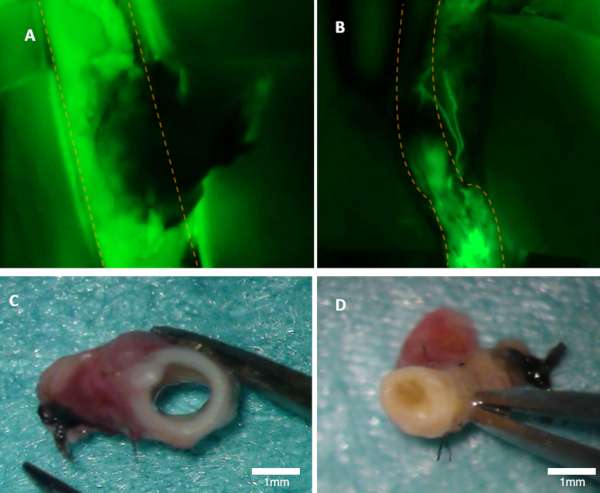
Figuur 1 : Het visualiseren van de patentie in een konijn. A) de doorgankelijkheid van de ouder slagader is duidelijk zichtbaar op het fluorescentie beeld (groene emissie van fluoresceïne wordt gezien). (B) deze slagader is verstopt (fluorescentie beeld). Beide slagaders werden macroscopisch geïnspecteerd (C-D). Panel (C) toont in de slagader van panel A; het lumen is open. Panel (D) toont slagader van panel B waar occlusie macroscopisch kan worden gezien. Oranje stippellijnen markeren de randen van de bovenliggende slagader. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2 : Het visualiseren van perfusie in een rat. (A) dit paneel toont een residueel perfgebruikt aneurysma (rode stippellijn markeert de resterende perfusie). (B) er kan geen perfusie worden gedetecteerd. Panel (C) toont de slagader van panel A tijdens macroscopische controle; de aneurysma opening is open. D) macroscopische weergave van de neointima op een verstopt aneurysma. Oranje gestippelde lijnen markeren de bovenliggende slagader en de aneurysma ' koepel. De panelen (A) en (B) zijn alleen fluorescentie beelden en de groene kleur toont fluoresceïne emissie. Klik hier om een grotere versie van dit cijfer te bekijken.
| Patentie/residuele perfusie | ||||
| Macroscopisch + | Macroscopisch- | Fluorescein + | Fluoresceïne | |
| Konijnen | 2 | 14 | 5 | 11 |
| Rats | 23 | 25 | 22 | 21 |
| Totale | 25 | 39 | 27 | 32 |
Tabel 1: testen van de tests. De doorgankelijkheid van de ouder slagader werd alleen getest bij konijnen en wordt hier geïllustreerd. Fluorescein ontdekte meer patenties van de ouder slagaders dan macroscopisch geëvalueerd. (Alle ratten in deze setting hadden een open ouder slagader, omdat aneurysmata op de abdominale aorta werden gehecht.) De doorgankelijkheid van aneurysmata werd alleen bij ratten getest. Tweeëntwintig van de 23 macroscopisch ontdekte patenties werden bevestigd met behulp van FVA. Twenty-One van 25 toonde geen patentie op FVA.
| Macroscopische positieve | Macroscopische negatieve | Totale | |
| Fluorescein positief | 25 | 2 | 27 |
| Fluorescein negatief | 0 | 32 | 32 |
| Totale | 25 | 34 |
Tabel 2: twee-bij-twee tabellen die worden gebruikt om specificiteit en gevoeligheid van FVA te berekenen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA is een veelbelovende en ongecompliceerde methode om schepen in knaagdieren te onderzoeken en kan worden uitgevoerd met commerciële apparaten en off-the-shelf apparatuur. FVA kan worden geïmplementeerd tijdens elke operatie waarbij intraoperatieve evaluatie van de integriteit van het vat nodig is, omdat de vaten eerst een goede dissectie nodig hebben.
De auteurs prefereren veneuze injectie aan arteriële injectie als gevolg van het lagere risico van onbedoelde gebeurtenissen zoals infectie, ischemie en compartiment syndroom12. Intraveneuze injectie maakt betrouwbare, ruimtelijk beperkte, sterk geconcentreerde kleuring mogelijk en vereist kleine kleurstof doseringen13,14. Bovendien, veneuze injectie maakt een snelle klaring van fluoresceïne14,15. Een alternatieve methode is het injecteren van contrastmiddel rechtstreeks in de gekozen slagader. Deze methode werd niet gebruikt in deze experimenten, omdat de onderzoekers wilden voorkomen dat het chirurgische veld met bloed en fluorescein werd vervumenteerd. Om dit risico te verminderen, wordt een perifeer veneuze contrastmiddel injectie aanbevolen13.
Voordelen van FVA zijn hoog contrast (gemakkelijk detecteerbaar met het menselijk oog), hoge gevoeligheid zoals hierboven weergegeven (tabel 2), lage kosten en eenvoudige hantering16. Fluorescein natrium was het gekozen contrastmiddel om perfusie te onderzoeken. Zichtbaar licht alleen kan worden gebruikt voor excitatie van de kleurstof en de uitstoot van het typische groene licht. Niettemin werkt dit contrastmiddel het beste met blauw licht (ongeveer 480 nm) en straalt het een sterk groen licht uit (golflengte ongeveer 530 nm)15. Volgens yoshioka et al., fluoresceïne kleuren de slagader zeer snel14. Bovendien kan de stroom van fluorescein verrijkt bloed in real-time15,17worden waargenomen. De korte tijd die nodig is voor FVA presenteert een ander voordeel; in deze serie duurde het gemiddeld 2 min (± 1min) om één FVA uit te voeren.
Het nadeel van het gebruik van fluoresceïne als contrastmiddel is dat het goed werkt met alleen dunne slagader wanden die zeer zorgvuldige dissectie eisen. Ichikawa et al. toonde het uitsterven van kleurstof als gevolg van de gedistonteerde licht emissie door dikkere wanden door verkalking of niet-ontleed slagaders15. Na de injectie wordt fluoresceïne gemetaboliseerd tot fluorescerende fluoresceïne glucuronide in de lever. Binnen 30 minuten na de injectie overschrijdt de concentratie van fluoresceïne glucuronide de concentratie van fluoresceïne18. Fluorescein vereist een lange klaring tijd. Een onmiddellijke herjectie na intraveneuze injectie van fluoresceïne wordt niet aanbevolen omdat de slagader en het aneurysma al zijn fluorescerend vanaf de eerste injectie17.
Het molecuulgewicht van fluoresceïne is slechts 376 kDa waardoor lekkage van de kleurstof mogelijk is. De vaatwand wordt ook fluorescerend, wat kan leiden tot vals-positieve stroom evaluaties (met tijd na toepassing). Een fragmentarische kleuring van de wand van het vat werd waargenomen vanaf ongeveer 5 min na de injectie van fluoresceïne14. De vlekkerige kleuring, echter, werd alleen waargenomen in grotere slagaders. Kleine en middelgrote slagaders tonen deze kleurings structuur niet17. Het wordt aanbevolen om het aneurysma onmiddellijk te evalueren om residuele vulling te detecteren.
Hoewel er een zeer laag risico op toxiciteit bestaat, zijn sommige gevallen van fluoresceïne die leiden tot cardiale en respiratoire reacties beschreven14. In deze studie heeft zich geen ernstige bijwerking voorgedaan; de enige complicaties waren 2 gevallen van oorader perforatie. Volgens Lane et al., natriumfluoresceïne is niet schadelijk, zelfs bij gebruik bij de mens17. Aan de andere kant, fluoresceïne is vrij onstabiel en mag niet worden blootgesteld aan wit licht16 -een rode lichtbron kan worden gebruikt in plaats daarvan.
Om de concentratie van fluoresceïne voor konijnen te kiezen, begonnen de onderzoekers met de laagste bekende werk dosis bij ratten (0,2 ml van 100 mg/ml fluoresceïne natrium) en verhoogden deze geleidelijk tot 1 ml. Bij die dosis werd een sterk fluorescentie signaal geregistreerd. De dosering werd geleidelijk verhoogd om te testen of de fluorescentie verbetert-wat niet het geval was. De auteurs besloten verder te gaan met 1 ml van 100 mg/ml fluoresceïne natrium13.
Een andere kleurstof beschikbaar om vaartuigen intra-operatief te onderzoeken is ICG. De grootte is 775 kDa en zo dringt nauwelijks de omringende weefsels14. Vanwege de langere emissie golflengten wordt het weefsel gemakkelijker gepenetreerd omdat weefsels transparanter zijn bij 800 nm19 en diepere structuren zichtbaar worden14,16. Excitatie golflengte binnen de 750-800 nm zijn vereist16,20 en de emissie golflengte van het contrastmiddel is ongeveer 800 nm16, waardoor beide onzichtbaar voor het menselijk oog. Vanwege de korte halfwaardetijd in bloed plasma, de kleurstof kan worden geïnjecteerd en hergebruikt herhaaldelijk16. Beperkingen op het gebruik van deze kleurstof omvatten problemen met dikke-ommuurde slagaders20 en de noodzaak van licht buiten het zichtbare spectrum13. Als gevolg hiervan is ICG afhankelijk van dure apparatuur en niet gemakkelijk toepasbaar in elk laboratorium.
Concluderend, FVA is een snelle, goedkope en betrouwbare methode met een hoge gevoeligheid voor screen-patentie van aneurysmata en ouder slagaders in knaagdieren aneurysma modellen. Het wordt geassocieerd met vrijwel geen morbiditeit en sterfte. Het maakt real-time bloedstroom bewaking tijdens chirurgie en follow-up. Om de werkzaamheid te verbeteren, moet de injectie in het donker worden uitgevoerd en kan het beste worden uitgevoerd op zorgvuldig ontleed vaten. Deze methode kan gemakkelijk en veilig worden geïmplementeerd in een cerebrovasculaire laboratorium, en kan de experiment kosten minimaliseren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alle auteurs bevestigen geen belangenconflicten.
Acknowledgments
Deze studie werd deels gesteund door een onderzoeksbeurs van de Kantonsspital Aarau, Zwitserland.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



