Summary
Wir präsentieren ein Protokoll zur effizienten Bewertung der Aneurysmenperfusion und der Gefäßdurchgängigkeit von Seitenwandaneurysmen bei Ratten und Kaninchen unter Verwendung von Fluorescein-basierter Fluoreszenz-Videoangiographie (FVA). Mit einem positiven Vorhersagewert von 92,6% ist es eine einfache, aber sehr effektive und wirtschaftliche Methode ohne spezielle Ausrüstung erforderlich.
Abstract
Die Behandlung des Gehirnaneurysm konzentriert sich auf die Erzielung einer vollständigen Okklusion sowie die Erhaltung des Blutflusses in der Elternarterie. Fluorescein-Natrium und Indocyaningrün werden verwendet, um die Beobachtung des Blutflusses bzw. des Gefäßperfusionsstatus zu ermöglichen. Ziel dieser Studie ist es, FVA anzuwenden, um den Blutfluss in Echtzeit, den Gefäßdurchblutungsstatus und die Okklusion von Aneurysmen nach Induktion von Seitenwandaneurysmen bei Kaninchen und Ratten zu überprüfen und das Verfahren bei diesen Arten zu validieren.
Zwanzig Sidewall-Aneurysmen wurden in 10 Kaninchen durch DasAsidieren eines dezellularisierten arteriellen Gefäßbeutels auf der Halsschlagader eines Spenderkaninchens geschaffen. Darüber hinaus wurden 48 mikrochirurgische Seitenwandaneurysmen bei 48 Ratten erstellt. Während der Nachbeobachtung nach einem Monat nach der Entstehung wurde der Elternarterien-/Aneurysmenkomplex seziert und FVA mit einer intravenösen Fluorescein-Injektion (10%, 1 ml) über eine Ohrvenenkatheterisierung bei Kaninchen und einer femoralen Venenkathhäreisierung bei Ratten durchgeführt. Aneurysmen wurden dann geerntet und die Durchgängigkeit makroskopisch ausgewertet.
Makroskopisch deuteten 14 von 16 Aneurysmen bei Kaninchen auf keine Restdurchlässigkeit der Elternarterie mit völlig verdeckter Leuchtdichte hin, jedoch 11 (79%) wurden von fvA erkannt. Vier Aneurysmen wurden wegen technischer Probleme ausgeschlossen. Bei Ratten wurde die Restaneurysmenperfusion in 25 von 48 Fällen makroskopisch beobachtet. Von den 23 ohne makroskopischen Nachweise einer Perfusion bestätigte die FVA die Inzidenz von 22 Aneurysmen (96%). Es gab keine unerwünschten Ereignisse im Zusammenhang mit FVA. Fluorescein ist leicht anwendbar und es wird keine spezielle Ausrüstung benötigt. Es ist eine sichere und äußerst effektive Methode zur Bewertung der Integrität der Elternarterie und der Aneurysmenkongoncy/Restperfusion in einer experimentellen Umgebung mit Kaninchen und Ratten. FVA mit Fluorescein als Kontrastmittel scheint bei der Kontrolle der Durchgängigkeit von Aneurysmen und dem darunter liegenden Gefäß wirksam zu sein und kann sogar an Bypass-Operationen angepasst werden.
Introduction
Der Nachweis einer vollständigen Auslöschung des Aneurysmus und der Arterienintegrität der Eltern ist bei der Aneurysmchirurgie von größter Bedeutung. Es gibt mehrere Möglichkeiten, Elternarterienkongierung und Aneurysmverschluss zu bestätigen, wie Doppler-Sonographie, konventionelle zerebrale Angiographie (DSA), Computertomographie-Angiographie (CTA) oder Magnetresonanz-Angiographie (MRA)1, 2. Es handelt sich jedoch um teure und zeitaufwändige Methoden, die im Labor oft nicht verfügbar sind. Darüber hinaus können sie relevante Nebenwirkungen wie Strahlenexposition oder die Notwendigkeit einer zusätzlichen Sedierung von Versuchstieren haben, um Bewegungsartefakt zu vermeiden.
Da immer mehr neue endovaskuläre Geräte entstehen, besteht ein ständiger Bedarf an präklinischen Tests solcher Geräte. Diese Studien stützen sich jedoch häufig auf postmortale Analysen (z. B. Makropathologie und Histologie) und es fehlen Informationen über dynamische Perfusion. Darüber hinaus kann es für den Forscher von entscheidender Bedeutung sein, während eines experimentellen chirurgischen Eingriffs sofortige und zuverlässige Informationen zu erhalten. Fluoreszenz-Angiographie ist eine kostengünstige und einfach durchzuführende Visualisierungstechnik1,3,4.
Als solche, Indocyaningrün (ICG) Video-Angiographie wird oft in klinischen neurochirurgischen Verfahren verwendet und wurde ausgiebig untersucht5,6. Fluorescein Video Angiography (FVA) ist eine alternative Technik, mit dem zusätzlichen Vorteil, ein Fluoreszenzsignal zu schaffen, das innerhalb des Wellenlängenbereichs des menschlichen Sehens liegt und somit mit bloßem Auge ohne erweiterte Infrarotkamera gesehen werden kann. 7. Fluorescein Video-Angiographie wird seltener in der klinischen zerebrovaskulären Chirurgie verwendet und Berichte über FVA in experimentellen Umgebungen sind knapp1,4.
Ziel dieses Berichts ist es, die Durchführbarkeit und den Umfang der Anwendung von FVA in der präklinischen zerebrovaskulären Forschung von Ratten und Kaninchen aufzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Die Nagetiere wurden in einer Tierpflegeeinrichtung untergebracht und Experimente wurden vom Tierschutzausschuss der Universität Bern (BE 108/16) und (BE65/16) geprüft und genehmigt. Alle Tiere wurden auf einer Standard-Labordiät mit freiem Zugang zu Nahrung und Wasser gehalten. Alle Tierversuche wurden unter sorgfältiger Berücksichtigung der 3Rs (Ersatz, Reduktion und Verfeinerung) durchgeführt. Zehn weibliche neuseeländische Weiße Kaninchen und 48 männliche Wistar-Ratten wurden aufgenommen. ARRIVE-Richtlinien wurden strikt befolgt8.
HINWEIS: Zwanzig Seitenwandaneurysmen wurden in 10 Kaninchen durch Dasasaatieren eines dezellularisierten arteriellen Gefäßbeutels auf der Halsschlagader eines Spenderkaninchens erstellt. Darüber hinaus entstanden 48 mikrochirurgische Seitenwandaneurysmen bei 48 Ratten, wie vor4,9beschrieben. Das bildgebende Verfahren und die makroskopische Analyse wurden 4 Wochen nach der Aneurysmerstellung durchgeführt.
1. Aufbereitung des für die Fluorescein-Videoangiographie benötigten Materials
- Ändern Sie die Taschenlampe, indem Sie auf einen blauen Bandpassfilter tippen (siehe Materialtabelle), der als Anregungsfilter fungiert. Die Fackel sollte dann nur blaues Licht aussenden. Verwenden Sie schwarzes Band, um ein Auslaufen von ungefiltertem Licht zu vermeiden.
- Statten Sie die Kamera (z. B. am Mikroskop befestigt) mit einem grünen Bandpassfilter aus (siehe Materialtabelle), der als Emissionslichtfilter fungiert. Nur grünes Licht sollte nun durchgehen können.
2. Vorbereitung von Arbeitsplatz und Materialien
- Desinfizieren Sie den Arbeitsbereich mit Desinfektionslösung.
- Bedecken Sie den Tisch mit sterilen Vorhängen, um eine Kontamination zu verhindern.
- Verwenden Sie sterile Instrumente für die Operation.
3. Vorbereitung der Tiere auf die Operation
- Wiegen Sie die Tiere.
- Induzieren Sie anästhesie und passen Sie die Dosis an das Gewicht an.
- Für Kaninchen, beginnen ausgewogene Anästhesie. Schützen Sie ihre Augen mit einer Hand während der Injektion, um ihre Angstreaktion zu reduzieren. Bedecken Sie den Käfig mit einem Blatt, um die Tiere zu beruhigen.
- Anästhesisieren Sie Ratten in einer Gaskammer mit 4% Isofluran und 96% Sauerstoff vor der Injektion.
- Überwachen Sie die Tiefe der Anästhesie. Pinch zwischen den Zehen, um sicherzustellen, dass die Tiere schlafen.
- Stellen Sie die Kaninchen auf den Rücken. Sie sollten nicht reagieren.
- Bei Ratten, kneifen ihre Schwänze und stellen Sie sicher, dass keine Reaktion beobachtet wird.
- Tragen Sie Salbe auf die Augen der Nagetiere auf, um Trockenheit zu verhindern. Ziehen Sie die Zungen der Ratten heraus, um jede Chance zu schlucken.
- Beginnen Sie mit der Erhaltung der Anästhesie.
- Für Kaninchen, Katheter (22 G abgeschirmt IV Katheter mit Injektionsanschluss, siehe Tabelle der Materialien) die Ohrvene. Bewahren Sie eine ausgewogene Anästhesie auf. Verwenden Sie einen Drei-Wege-Stopphahn, um mehrere gleichzeitige Injektionen zu ermöglichen.
- Bei Ratten50 mg/kg Ketaminhydrochlorid und 0,5 mg/kg Medetomidinhydrochlorid intraperitoneal injizieren. Überwachen Sie die Anästhesie mit einer schädlichen Zehenprise während der Operation. Im Falle einer Reaktion zusätzliche Betäubung verabreichen.
- Kleben Sie die Tiere in einer Supine-Position auf das Brett und rasieren Sie den Schnittort genau. Desinfizieren Sie den Bereich mit Betaseptic.
- Bei Kaninchen, desinfizieren Sie den Hals, vor allem um sternocleidomastoid Muskel.
- Für Ratten, desinfizieren Sie den Bereich von Blase zu Transvers Dickdarm.
- Verabreichen Sie Sauerstoff durch eine Maske während der gesamten Operation und halten Sie die Körpertemperatur mit einem Heizkissen.
4. Vorbereitung der Arterie
- Um optimale Ergebnisse zu erzielen, sezieren Sie das gewählte Gefäß gründlich aus dem umgebenden Gewebe9,10.
- Bei Rattendie Schwanzvene (weniger invasiv, vorzugsweise für überlebende Tiere) oder sezieren eine Femoralvene für die Fluorescein-Injektion4,11.
HINWEIS: Für Kaninchenist keine weitere Zerlegung der Gefäße für die Fluorescein-Injektion erforderlich, da die Ohrvene bereits zur Anästhesie verwendet wird.
- Bei Rattendie Schwanzvene (weniger invasiv, vorzugsweise für überlebende Tiere) oder sezieren eine Femoralvene für die Fluorescein-Injektion4,11.
- Positionieren Sie ein weißes Pad unter dem gewählten Gefäß, um den Kontrast zum umgebenden Gewebe zu erhöhen.
- Fokussieren Sie die am Mikroskop montierte Kamera auf die sezierte Arterie.
5. Fluorescein Video-Angiographie
- Bedecken Sie die mit Fluorescein-Natrium (100 mg/ml, siehe Materialtabelle)gefüllte 5 ml Spritze mit Aluminiumfolie, um sich vor Lichteinwirkung zu schützen. Schalten Sie das Licht aus (so viel wie möglich) und injizieren Sie Fluorescein-Natrium intravenös. Injizieren Sie bei Dunkelheit, um Photobleichungen zu verhindern.
- Bei Kaninchen0,3 ml/kg Fluorescein-Natrium durch den Drei-Wege-Stopphahn in die katheterisierte Ohrvene injizieren.
- Bei Ratten0,4 ml/kg Fluorescein-Natrium über einen Katheter oder eine 25 G-Nadel in die Femoralvene injizieren.
- Spülen Sie die Nadel oder den Katheter mit 0,5 ml Salinelösung, um sicherzustellen, dass der gesamte Farbstoff injiziert wird.
- Beleuchten Sie das Operationsfeld mit der modifizierten Taschenlampe.
- Beginnen Sie mit den Dreharbeiten mit der modifizierten Kamera. Der Blutfluss sollte einige Sekunden nach der Injektion sichtbar sein (Abbildung 1).
HINWEIS: Hier haben wir Bildrate = 50 Frames/s, Brennweite = 70 mm und F3.4 verwendet.
6. Makroskopische Analyse
- Resect die Aneurysmen und Elternarterienkomplex, und bewerten Sie die Durchgängigkeit makroskopisch durch Öffnen der Mutterarterie mit Mikroschere und bewerten Sie das Lumen der Mutterarterie und die Öffnung des Anerysmen (siehe Abbildung 1, 2)9. Messen Sie die Größe der Aneurysmen. Aneurysm-Eltern-Arterie-Komplex kann dann zur weiteren Analyse (z.B. Histologie) gespeichert werden.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Herzfrequenz und Blutdruck wurden während der Operation überwacht. Die durchschnittliche Herzfrequenz betrug 193/min bei Kaninchen und 196/min bei Ratten. Das Körpergewicht der Kaninchen betrug 3,05-4,18 kg, die Ratten 335-690 g.
Wir konnten FVA in acht von zehn Kaninchen durchführen (Abbildung 1). Vier Aneurysmusuntersuchungen an zwei Kaninchen wurden aufgrund technischer Schwierigkeiten nicht mit der Kamera aufgezeichnet. Es wurden keine technischen Schwierigkeiten mit FVA bei Ratten gemeldet. Allerdings konnte FVA nicht in einer Ratte durchgeführt werden, da die Oberschenkelvene Schwierigkeiten hatten.
Von 16 Aneurysmen bei acht Kaninchen zeigten zwei Aneurysmen eine anhaltende Durchblutung der Mutterarterie (makroskopisch bestätigt) (siehe Tabelle 1), während die FVA fünf Fälle mit Restperfusion identifizierte. 14 Kaninchenaneurysmen zeigten makroskopisch keine Restperfusion, jedoch 11 (79%) wurden anschließend mit FVA erkannt. Die Restperfusion wurde makroskopisch bei 25 von 48 Ratten beobachtet (Tabelle 1), und die anderen 23 Ratten zeigten keine makroskopischen Anzeichen einer Restperfusion (Abbildung 2). 22 dieser 23 Aneurysmen wurden dann mit FVA bestätigt (96%). Insgesamt konnten 25 von 27 Fällen bestätigt werden, was zu einem positiven Vorhersagewert von 92,6 %, einer Sensitivitätsrate von 100 % und einer Spezifität von 94,1 % führte. (Tabelle 2).
Zusammenfassend zeigten 25 Aneurysmen eine Restperfusion, 53 Elternarterien waren patentiert und 11 wurden makroskopisch und auf Video-Angiographie bestätigt. Es gab nur geringfügige Komplikationen im Zusammenhang mit FVA bei Kaninchen; wie perforation der marginalen Ohrvene während der Katheterisierung. Weitere unerwünschte Ereignisse wurden nicht erlebt. Es wurde keine Sterblichkeit und keine Morbidität aufgrund der FVA gemeldet.
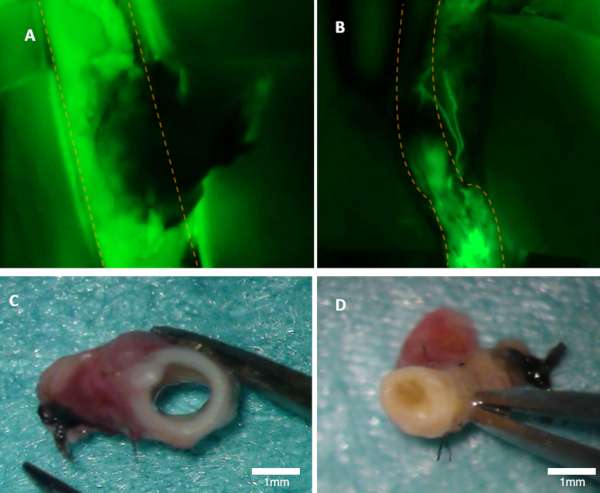
Abbildung 1 : Visualisierung der Durchgängigkeit bei einem Kaninchen. (A) Die Patenz der Mutterschlagader ist auf dem Fluoreszenzbild deutlich sichtbar (grüne Emission aus Fluorescein sind zu sehen). (B) Diese Arterie ist verschlossen (Fluoreszenzbild). Beide Arterien wurden makroskopisch inspiziert (C-D). Panel (C) zeigt in der Arterie von Panel A; das Lumen ist offen. Panel (D) zeigt Arterie aus Panel B, wo Okklusion makroskopisch zu sehen ist. Orange gepunktete Linien markieren die Ränder der übergeordneten Arterie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2 : Visualisierung der Perfusion in einer Ratte. (A) Dieses Panel zeigt ein restweise durchfundiertes Aneurysmus (rote gepunktete Linie markiert die Restperfusion). (B) Es kann keine Perfusion festgestellt werden. Panel (C) zeigt die Arterie von Panel A während der makroskopischen Prüfung; die Aneurysmusöffnung ist offen. (D) Makroskopische Ansicht der Neointima auf einem verschlossenen Aneurysm. Orange gepunktete Linien markieren die Elternarterie und die Kuppel des Aneurysmens. Panels (A) und (B) sind nur Fluoreszenzbilder und die grüne Farbe zeigt die Fluorescein-Emission. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Patenz/Restperfusion | ||||
| Makroskopisch + | Makroskopisch - | Fluorescein + | Fluorescein - | |
| Kaninchen | 2 | 14 | 5 | 11 |
| Ratten | 23 | 25 | 22 | 21 |
| gesamt | 25 | 39 | 27 | 32 |
Tabelle 1: Patenzprüfung. Die Patenz der Elternarterie wurde nur bei Kaninchen getestet und wird hier veranschaulicht. Fluorescein erkannte mehr Patezen der Elternarterien als makroskopische Auswertungen. (Alle Ratten in dieser Umgebung hatten eine offene Elternarterie, da Aneurysmen an der Bauchaorta vernäft wurden.) Die Durchgängigkeit von Aneurysmen wurde nur bei Ratten getestet. 22 von 23 makroskopisch erkannten Patezen wurden mit FVA bestätigt. 21 von 25 zeigten keine Durchgängigkeit auf FVA.
| Makroskopisch positiv | Makroskopisches Negativ | gesamt | |
| Fluorescein positiv | 25 | 2 | 27 |
| Fluorescein negativ | 0 | 32 | 32 |
| gesamt | 25 | 34 |
Tabelle 2: Zwei nach zwei Tabellen zur Berechnung der Spezifität und Empfindlichkeit der FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA ist eine vielversprechende und unkomplizierte Methode zur Untersuchung von Gefäßen bei Nagetieren und kann mit kommerziellen Geräten und Standardgeräten durchgeführt werden. FVA kann bei jeder Operation durchgeführt werden, bei der eine intraoperative Bewertung der Gefäßintegrität erforderlich ist, da die Gefäße zuerst eine ordnungsgemäße Zerlegung benötigen.
Die Autoren bevorzugten venöse Injektion zur arteriellen Injektion aufgrund des geringeren Risikos von unbeabsichtigten Ereignissen wie Infektion, Ischämie und Kompartiment-Syndrom12. Die intravenöse Injektion ermöglicht eine zuverlässige, räumlich begrenzte, hochkonzentrierte Färbung und erfordert kleine Farbstoffdosierungen13,14. Zusätzlich ermöglicht die venöse Injektion eine schnelle Clearance von Fluorescein14,15. Eine alternative Methode besteht darin, Kontrastmittel direkt in die gewählte Arterie zu injizieren. Diese Methode wurde in diesen Experimenten nicht verwendet, da die Forscher eine Kontamination des Operationsfeldes mit Blut und Fluorescein verhindern wollten. Um dieses Risiko zu reduzieren, wird eine periphere venöse Kontrastmittelinjektion empfohlen13.
Vorteile von FVA sind hoher Kontrast (leicht nachweisbar mit dem menschlichen Auge), hohe Empfindlichkeit wie oben gezeigt (Tabelle 2), niedrige Kosten und einfache Handhabung16. Fluorescein-Natrium war das gewählte Kontrastmittel zur Untersuchung der Perfusion. Sichtbares Licht allein kann zur Anregung des Farbstoffs und zur Emission des typischen grünen Lichts verwendet werden. Dennoch funktioniert dieses Kontrastmittel am besten mit blauem Licht (ca. 480 nm) und strahlt ein starkes grünes Licht (Wellenlänge ca. 530 nm)15aus. Nach Yoshioka et al., Fluorescein färbt die Arterie extrem schnell14. Darüber hinaus kann der Fluss von fluoresceinangereichertem Blut in Echtzeit beobachtet werden15,17. Die kurze Zeit, die für die FVA benötigt wird, stellt einen weiteren Vorteil dar; in dieser Serie dauerte es durchschnittlich 2 min, um eine FVA durchzuführen.
Der Nachteil der Verwendung von Fluorescein als Kontrastmittel ist, dass es gut mit nur dünnen Arterienwänden funktioniert, die eine sehr sorgfältige Zerlegung erfordern. Ichikawa et al. zeigten das Aussterben von Farbstoffen durch die vereitelte Emission von Licht durch dickere Wände durch Verkalkung oder nicht verunstkulssierte Arterien15. Nach der Injektion wird Fluorescein zu fluoreszierendem Fluoresceinglucuronid in der Leber metabolisiert. Innerhalb von 30 min nach der Injektion übersteigt die Konzentration von Fluoresceinglucuronid die Fluoresceinkonzentration18. Fluorescein benötigt eine lange Abstandszeit. Eine sofortige Reinjektion nach intravenöser Injektion von Fluorescein wird nicht empfohlen, da Arterie und Aneurysmus bereits ab der ersten Injektion fluoreszierend sind17.
Das Molekulargewicht von Fluorescein beträgt nur 376 kDa, was eine Leckage des Farbstoffs ermöglicht. Die Gefäßwand wird auch fluoreszierend, was zu falschen positiven Strömungsauswertungen führen kann (mit der Zeit nach der Anwendung zu erhöhen). Eine lückenhafte Färbung der Gefäßwand wurde ab ca. 5 min nach Injektion von Fluorescein14beobachtet. Die fleckige Färbung wurde jedoch nur in größeren Arterien beobachtet. Kleine und mittlere Arterien zeigten diese Färbestruktur nicht17. Es wird empfohlen, das Aneurysm sofort zu evaluieren, um Restfüllung zu erkennen.
Obwohl ein sehr geringes Toxizitätsrisiko besteht, wurden einige Fälle von Fluorescein, die zu Herz- und Atemreaktionen führen, beschrieben14. In dieser Studie trat kein schwerwiegendes unerwünschtes Ereignis auf; die einzigen Komplikationen waren 2 Fälle von Ohrvenenperforation. Nach Lane et al., Natriumfluorescein ist nicht schädlich, auch wenn beim Menschen verwendet17. Auf der anderen Seite ist Fluorescein ziemlich instabil und sollte nicht weißem Licht16 ausgesetzt werden - stattdessen kann eine rote Lichtquelle verwendet werden.
Um die Fluoresceinkonzentration bei Kaninchen zu wählen, begannen die Forscher mit der niedrigsten bekannten Arbeitsdosis bei Ratten (0,2 ml von 100 mg/ml Fluorescein-Natrium) und erhöhten diese schrittweise auf 1 ml. Bei dieser Dosis wurde ein starkes Fluoreszenzsignal registriert. Die Dosierung wurde schrittweise erhöht, um zu testen, ob sich die Fluoreszenz verbessert - was nicht der Fall war. Die Autoren beschlossen, mit 1 ml von 100 mg/ml Fluorescein-Natrium13fortzufahren.
Ein weiterer Farbstoff, der zur intraoperativen Untersuchung von Gefäßen zur Verfügung steht, ist ICG. Seine Größe ist 775 kDa und solche kaum dringt in die umgebenden Gewebe14. Aufgrund seiner längeren Emissionswellenlängen wird Gewebe leichter durchdrungen, da Gewebe bei 800 nm19 transparenter sind und tiefere Strukturen sichtbar werden14,16. Die Anregungswellenlänge innerhalb der 750-800 nm isterforderlich 16,20 und die Emissionswellenlänge aus dem Kontrastmittel beträgt ca. 800 nm16, was beide für das menschliche Auge unsichtbar macht. Aufgrund seiner kurzen Halbwertszeit im Blutplasma kann der Farbstoffinjiziert und wiederholt 16 wiederverwendet werden. Einschränkungen bei der Verwendung dieses Farbstoffs sind Probleme mit dickwandigen Arterien20 und die Notwendigkeit von Licht außerhalb des sichtbaren Spektrums13. Infolgedessen ist ICG auf teure Geräte angewiesen und nicht in jedem Labor ohne weiteres anwendbar.
Zusammenfassend ist FVA eine schnelle, kostengünstige und zuverlässige Methode mit hoher Empfindlichkeit gegenüber Derdurchszentraten von Aneurysmen und Elternarterien in Nagetieraneurysmenmodellen. Es ist mit praktisch keine Morbidität und Sterblichkeit verbunden. Es ermöglicht echtzeit-Blutflussüberwachung während der Operation und Nachsorge. Um seine Wirksamkeit zu verbessern, sollte die Injektion im Dunkeln durchgeführt werden und wird am besten auf sorgfältig sezierten Gefäßen durchgeführt. Diese Methode kann einfach und sicher in einem zerebrovaskulären Labor implementiert werden und kann die Versuchskosten minimieren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alle Autoren bestätigen keine Interessenkonflikte.
Acknowledgments
Diese Studie wurde teilweise durch ein Forschungsstipendium des Kantonsspitals Aarau, Schweiz, unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



