Summary
Presentamos un protocolo para evaluar eficientemente la perfusión del aneurisma y la patencia de los recipientes del aneurisma de las paredes laterales en ratas y conejos, utilizando la videoangiografía por fluorescencia a base de fluoresceína (FVA). Con un valor predictivo positivo del 92,6%, es un método simple pero muy eficaz y económico sin necesidad de equipos especiales.
Abstract
El tratamiento del aneurisma cerebral se centra en lograr la oclusión completa, así como en preservar el flujo sanguíneo en la arteria principal. Fluoresceina sódica y verde indocyanina se utilizan para permitir la observación del flujo sanguíneo y el estado de perfusión de los vasos, respectivamente. El objetivo de este estudio es aplicar FVA para verificar el flujo sanguíneo en tiempo real, el estado de perfusión de los vasos y la oclusión de los aneurismas después de la inducción de aneurismas laterales en conejos y ratas, así como para validar el procedimiento en estas especies.
Se crearon veinte aneurismas de las paredes laterales en 10 conejos suturando una bolsa descelularizada de los vasos arteriales en la arteria carótida de un conejo donante. Además, se crearon 48 aneurismas de paredes laterales microquirúrgicas en 48 ratas. Durante el seguimiento a los meses posteriores a la creación, se diseccionó el complejo de arteria/aneurisma principal y se realizó FVA utilizando una inyección intravenosa de fluoresceína (10%, 1 ml) a través de un cateterismo en venas de oído en conejos y una catroización venosa femoral en ratas. Luego se cosechaban aneurismas y la patencia se evaluó macroscópicamente.
Macroscópicamente, 14 de los 16 aneurismas en conejos indicaron que no había perfusión residual de arterias madre con luminas totalmente ocluidas, sin embargo 11 (79%) fueron detectados por FVA. Se excluyeron cuatro aneurismas debido a problemas técnicos. En ratas, la perfusión de aneurisma residual se observó macroscópicamente en 25 de los 48 casos. De los 23 sin evidencia macroscópica de perfusión, el FVA confirmó la incidencia de 22 aneurismas (96%). No hubo eventos adversos asociados con la FVA. La fluoresceína es fácilmente aplicable y no se necesita ningún equipo especial. Es un método seguro y extremadamente eficaz para evaluar la integridad de la arteria principal y la patencia del aneurisma/perfusión residual en un entorno experimental con conejos y ratas. FVA utilizando fluoresceína como agente de contraste parece ser eficaz en el control de la patencia de los aneurismas y el vaso subyacente e incluso se puede adaptar a la cirugía de bypass.
Introduction
La evidencia de la obliteración completa del aneurisma y la integridad de la arteria de los padres es de suma importancia en la cirugía de aneurisma. Existen varias opciones para confirmar la patencia de la arteria principal y la oclusión del aneurisma, como la ecografía Doppler, la angiografía cerebral convencional (DSA), la angiografía por tomografía computarizada (CTA) o la angiografía por resonancia magnética (MRA)1, 2. Sin embargo, se trata de métodos costosos y lentos que a menudo no están disponibles en un entorno de laboratorio. Además, pueden tener efectos secundarios relevantes, como la exposición a la radiación o la necesidad de sedación adicional de animales experimentales para evitar el artefacto del movimiento.
Con un número creciente de nuevos dispositivos endovasculares que están surgiendo, existe una necesidad consecutiva de pruebas preclínicas de tales dispositivos. Sin embargo, estos estudios a menudo se basan en el análisis post mortem (por ejemplo, macropatología e histología) y carecen de información sobre la perfusión dinámica. Además, para el investigador puede ser crucial obtener información inmediata y fiable durante un procedimiento quirúrgico experimental. La angiografía por fluorescencia es una técnica de visualización rentable y fácil de realizar1,3,4.
Como tal, la angiografía por videografía verde indocyanina (ICG) se utiliza a menudo en procedimientos neuroquirúrgicos clínicos y se ha estudiado extensamente5,6. La angiografía por videofluoresceína (FVA) es una técnica alternativa, con la ventaja adicional de crear una señal de fluorescencia que está dentro del rango de longitud de onda de la visión humana, y por lo tanto puede ser vista a simple vista sin una cámara infrarroja de espectro extendido 7. La angiografía por videofluoresceína se utiliza con menos frecuencia en la cirugía cerebrovascular clínica y los informes sobre La FVA en entornos experimentales son escasos1,4.
El objetivo de este informe es demostrar la viabilidad y el alcance de las aplicaciones de La FVA en la investigación cerebrovascular preclínica de ratas y conejos.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Los roedores fueron alojados en un centro de cuidado de animales y los experimentos fueron revisados y aprobados por el Comité de Bienestar Animal de la Universidad de Berna, Suiza (BE 108/16) y (BE65/16). Todos los animales se mantuvieron en una dieta de laboratorio estándar con acceso gratuito a alimentos y agua. Todos los experimentos con animales se llevaron a cabo bajo una cuidadosa consideración de las 3R (reemplazo, reducción y refinamiento). Diez hembras de conejos blancos de Nueva Zelanda y 48 ratas macho Wistar fueron incluidos. Las directrices de LA ARRIVE se siguieron estrictamente8.
NOTA: Se crearon veinte aneurismas de las paredes laterales en 10 conejos suturando una bolsa descelularizada de los vasos arteriales en la arteria carótida de un conejo donante. Además, se crearon 48 aneurismas microquirúrgicos de la pared lateral en 48 ratas como se describió antesde4,9. El procedimiento de diagnóstico por imágenes y el análisis macroscópico se realizaron 4 semanas después de la creación del aneurisma.
1. Preparación del material necesario para la angiografía por videofluoresceína
- Modifique la linterna pegando en un filtro de paso de banda azul (consulte la Tabla de materiales), que funcionará como un filtro de excitación. La antorcha sólo debe emitir luz azul. Utilice cinta negra para evitar cualquier fuga de luz sin filtrar.
- Equipar la cámara (por ejemplo, conectada al microscopio) con un filtro de paso de banda verde (ver la Tabla de Materiales), que funcionará como un filtro de luz de emisión. Ahora sólo la luz verde debería poder pasar.
2. Preparación del lugar de trabajo y los materiales
- Desinfectante el espacio de trabajo con solución desinfectante.
- Cubra la mesa con cortinas estériles para evitar la contaminación.
- Utilice instrumentos estériles para la cirugía.
3. Preparación de animales para la cirugía
- Pesar a los animales.
- Inducir la anestesia y ajustar la dosis de acuerdo con el peso.
- Para conejos,comience la anestesia equilibrada. Proteger sus ojos con una mano durante la inyección para reducir su reacción de miedo. Cubra la jaula con una sábana para ayudar a sedar a los animales.
- Anestetizar ratas en una cámara de gas con 4% de isoflurano y 96% de oxígeno antes de la inyección.
- Supervise la profundidad de la anestesia. Pellizca entre los dedos de los dedos de los dedos de los dedos de los dedos para asegurarte de que los animales estén dormidos.
- Vuelvan a colocar los conejos sobre sus espaldas. No deben reaccionar.
- Para lasratas, pellizque sus colas y asegúrese de que no se observe ninguna reacción.
- Aplicar pomada en los ojos de los roedores para evitar la sequedad. Saca las lenguas de las ratas para evitar cualquier posibilidad de tragar.
- Comience con la preservación de la anestesia.
- Para conejos,cateterismo (22 G catéter IV blindado con puerto de inyección, ver la Tabla de Materiales) la vena del oído. Mantener una anestesia equilibrada. Utilice un tapón de tres vías para habilitar varias inyecciones simultáneas.
- Para ratas, inyectar 50 mg/kg de clorhidrato de ketamina y 0,5 mg/kg de clorhidrato de medetomidina por vía intraperitoneal. Monitoree la anestesia con un pellizco nocivo durante la cirugía. En caso de reacción, administre anestesia adicional.
- Pegue los animales en el tablero en una posición supina y afiérase de cerca la ubicación de la incisión. Desinfectar el área con Betaseptic.
- Para conejos,desinfectar el cuello, especialmente alrededor del músculo esternocleidomastoideo.
- Para ratas, desinfecte el área de la vejiga a los transvers colon.
- Administrar oxígeno a través de una máscara durante toda la cirugía y mantener la temperatura corporal con una almohadilla de calentamiento.
4. Preparación de la arteria
- Para obtener mejores resultados, diseccione a fondo el recipiente elegido del tejido circundante9,10.
- Para ratas, identificar la vena de la cola (menos invasiva, preferiblemente utilizada para animales supervivientes) o diseccionar una vena femoral para la inyección de fluoresceína4,11.
NOTA: En el caso de los conejos,no se necesita más disección de vasos para la inyección de fluoresceína, ya que la vena del oído ya se está utilizando para la anestesia.
- Para ratas, identificar la vena de la cola (menos invasiva, preferiblemente utilizada para animales supervivientes) o diseccionar una vena femoral para la inyección de fluoresceína4,11.
- Coloque una almohadilla blanca debajo del recipiente elegido para aumentar el contraste con el tejido circundante.
- Enfoque la cámara montada en el microscopio en la arteria diseccionada.
5. Angiografía por videoesceína de fluoresceína
- Cubra la jeringa de 5 ml llena de fluoresceína sódica (100 mg/ml, ver la Tabla de Materiales)con papel de aluminio para proteger la exposición de la luz. Apague las luces (en la medida de lo posible) e inyecte fluoresceína sódica por vía intravenosa. Inyecte bajo la oscuridad para evitar el fotoblanqueo.
- En el caso de los conejos,inyecte 0,3 ml/kg de fluoresceína sódica a través de la tres vías en la vena del oído catecada.
- En elcaso de ratas, inyectar 0,4 ml/kg de fluoresceína sódica en la vena femoral a través de un catéter o una aguja de 25 G.
- Enjuague la aguja o el catéter con una solución salina de 0,5 ml para asegurarse de que se inyecta todo el tinte.
- Ilumina el campo quirúrgico con la linterna modificada.
- Comience a filmar con la cámara modificada. El flujo sanguíneo debe ser visible unos segundos después de la inyección (Figura1).
NOTA: Aquí, hemos utilizado la velocidad de fotogramas: 50 fotogramas/s, la distancia focal a 70 mm y la F3.4.
6. Análisis macroscópico
- Reseque los aneurismas y el complejo de la arteria principal, y evalúe la paciencia macroscópicamente abriendo la arteria padre con microtijeras y evalúe el lumen de la arteria padre y el orificio del anerisma (ver Figura 1, 2)9. Mida el tamaño de los aneurismas. Aneurysm-parent-artery-complex puede almacenarse para su posterior análisis (por ejemplo, histología).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Durante la cirugía se monitorizaron la frecuencia cardíaca y la presión arterial. La frecuencia cardíaca media fue de 193/min en conejos y 196/min en ratas. El peso corporal de los conejos osciló entre 3,05 y 4,18 kg, y las ratas pesaban 335-690 g.
Pudimos realizar FVA en ocho de cada diez conejos (Figura1). Cuatro exámenes de aneurisma en dos conejos no fueron grabados con la cámara debido a dificultades técnicas. No se notificaron dificultades técnicas relacionadas con el Vav en ratas. Sin embargo, la FVA no se pudo realizar en una rata debido a dificultades que saliñaban la vena femoral.
De 16 aneurismas en ocho conejos, dos aneurismas mostraron perfusión persistente de la arteria padre (confirmada macroscópicamente) (ver Tabla 1), mientras que el FVA identificó cinco casos con perfusión residual. 14 aneurismas de conejo no mostraron perfusión residual macroscópicamente, sin embargo 11 (79%) fueron posteriormente detectados usando FVA. La perfusión residual se observó macroscópicamenteen 25 de 48 ratas (Tabla 1), y las otras 23 ratas no mostraron signos macroscópicos de perfusión residual (Figura2). 22 de esos 23 aneurismas fueron confirmados entonces utilizando FVA (96%). En total, podrían confirmarse 25 de 27 casos, lo que dio como resultado un valor predictivo positivo del 92,6%, una tasa de sensibilidad del 100% y una especificidad del 94,1%. (Tabla 2).
En resumen, 25 aneurismas mostraron perfusión residual, 53 arterias parentales fueron patentes y 11 fueron ocluidas como macroscópicamente confirmadas y en video angiografía. Sólo hubo complicaciones menores asociadas con la FVA en conejos; como la perforación de la vena del oído marginal durante el cateterismo. No se experimentaron más acontecimientos adversos. No se notificó mortalidad ni morbilidad debido a la FVA.
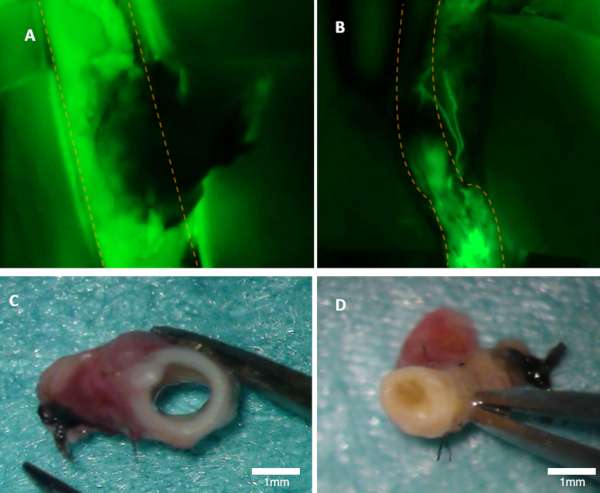
Figura 1 : Visualización de la patencia en unconejo. (A) La patencia de la arteria principal es claramente visible en la imagen de fluorescencia (se ve la emisión verde de fluoresceína). (B) Esta arteria está ocluida (imagen de fluorescencia). Ambas arterias fueron inspeccionadas macroscópicamente (C-D). Panel (C) se muestra en la arteria del panel A; el lumen está abierto. El panel (D) muestra la arteria del panel B donde la oclusión se puede ver macroscópicamente. Las líneas de puntos naranjas marcan los bordes de la arteria padre. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Visualización de la perfusión en una rata. (A) Este panel muestra un aneurisma perfundido residualmente (la línea de puntos roja marca la perfusión residual). (B) No se puede detectar ninguna perfusión. Panel (C) muestra la arteria del panel A durante el escrutinio macroscópico; el orificio del aneurisma está abierto. (D) Vista macroscópica de la neointima en un aneurisma ocluido. Las líneas de puntos naranjas marcan la arteria principal y la cúpula del aneurisma. Los paneles (A) y (B) son imágenes solo con fluorescencia y el color verde muestra la emisión de fluoresceína. Haga clic aquí para ver una versión más grande de esta figura.
| Patency/Perfusion residual | ||||
| Macroscótico + | Macroscótico - | Fluoresceína + | Fluoresceína - | |
| Conejos | 2 | 14 | 5 | 11 |
| Ratas | 23 | 25 | 22 | 21 |
| Total | 25 | 39 | 27 | 32 |
Tabla 1: Pruebas de paciencia. La paciencia de la arteria madre sólo se probó en conejos y se ilustra aquí. La fluoresceína detectó más patencias de las arterias de los padres que la evaluación macroscópica. (Todas las ratas en este entorno tenían una arteria primaria abierta, ya que los aneurismas fueron suturados en la aorta abdominal.) La patencia de los aneurismas se probó sólo en ratas. Veintidós de las 23 patencias detectadas macroscópicamente fueron confirmadas usando FVA. Veintiuno de 25 no mostraron ninguna latencia en FVA.
| Positivo macroscópico | Negativo macroscópico | Total | |
| Fluoresceína positiva | 25 | 2 | 27 |
| Fluoresceína negativa | 0 | 32 | 32 |
| Total | 25 | 34 |
Tabla 2: Tabla de dos por dos utilizada para calcular la especificidad y la sensibilidad de fVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA es un método prometedor y sin complicaciones para examinar los recipientes en roedores y se puede realizar con dispositivos comerciales y equipos listos para usar. La FVA se puede implementar durante cualquier cirugía donde se necesite una evaluación intraoperatoria de la integridad del vaso, ya que los vasos necesitan primero una disección adecuada.
Los autores prefirieron la inyección venosa a la inyección arterial debido al menor riesgo de eventos involuntarios como infección, isquemia y síndrome compartimental12. La inyección intravenosa permite una tinción confiable, espacialmente limitada y altamente concentrada, y requiere pequeñas dosis de tinte13,14. Además, la inyección venosa permite un rápido aclaramiento de fluoresceína14,15. Un método alternativo es inyectar agente de contraste directamente en la arteria elegida. Este método no se utilizó en estos experimentos, ya que los investigadores querían evitar contaminar el campo quirúrgico con sangre y fluoresceína. Para reducir este riesgo, se recomienda la inyección de agente de contraste venoso periférico13.
Las ventajas de FVA son de alto contraste (fácilmente detectablesin el ojo humano), alta sensibilidad como se muestra arriba (Tabla 2), bajo costo y fácil manejo16. La fluoresceína sódica fue el agente de contraste elegido para examinar la perfusión. La luz visible por sí sola se puede utilizar para la excitación del tinte y la emisión de la luz verde típica. Sin embargo, este agente de contraste funciona mejor con luz azul (aproximadamente 480 nm) y emite una luz verde fuerte (longitud de onda aproximadamente 530 nm)15. Según Yoshioka et al., fluoresceína colorea la arteria extremadamente rápidamente14. Además, el flujo de sangre enriquecida con fluoresceína se puede observar en tiempo real15,17. El corto tiempo necesario para FVA presenta otra ventaja; en esta serie se tardó un promedio de 2 min (1 min) para llevar a cabo un FVA.
La desventaja de utilizar fluoresceína como agente de contraste es que funciona bien con sólo paredes de arteria delgada que exigen una disección muy cuidadosa. Ichikawa et al. mostraron la extinción del tinte debido a la emisión frustrada de luz a través de paredes más gruesas por calcificación o arterias no diseccionadas15. Después de la inyección, la fluoresceína se metaboliza a glucurónido fluorescente de fluoresceína en el hígado. Dentro de los 30 minutos después de la inyección, la concentración de fluoresceína glucurónida supera la concentración de fluoresceína18. La fluoresceína requiere un largo tiempo de aclaramiento. No se recomienda una reinyección inmediata después de la inyección intravenosa de fluoresceína, ya que la arteria y el aneurisma ya son fluorescentes de la primera inyección17.
El peso molecular de la fluoresceína es de sólo 376 kDa que permite la fuga del tinte. La pared vascular también se vuelve fluorescente lo que podría conducir a evaluaciones de flujo falso positivo (aumentando con el tiempo después de la aplicación). Se observó una coloración irregular de la pared del vaso a partir de aproximadamente 5 minutos después de la inyección de fluoresceína14. La coloración manchada, sin embargo, sólo se observó en arterias más grandes. Las arterias pequeñas y medianas no mostraron esta estructura de tinción17. Se recomienda evaluar el aneurisma inmediatamente para detectar el llenado residual.
Aunque existe un riesgo muy bajo de toxicidad, se han descrito14algunos casos de fluoresceína que conducen a reacciones cardíacas y respiratorias. En este estudio no se produjo ningún evento adverso grave; las únicas complicaciones fueron 2 casos de perforación de venas del oído. Según Lane et al., fluoresceína de sodio no es perjudicial incluso cuando se utiliza en seres humanos17. Por otro lado, la fluoresceína es bastante inestable y no debe exponerse a la luz blanca16 - una fuente de luz roja se puede utilizar en su lugar.
Para elegir la concentración de fluoresceína para conejos, los investigadores comenzaron con la dosis de trabajo más baja conocida en ratas (0,2 ml de 100 mg/ml de fluoresceína sódica) y la aumentaron gradualmente a 1 ml. Se registró una fuerte señal de fluorescencia a esa dosis. La dosis se incrementó gradualmente para probar si la fluorescencia mejora - que no fue el caso. Los autores decidieron continuar con 1 ml de 100 mg/ml de fluoresceína sódica13.
Otro tinte disponible para examinar los vasos intraoperatoriamente es el ICG. Su tamaño es de 775 kDa y tal apenas penetra en los tejidos circundantes14. Debido a sus longitudes de onda de emisión más largas, el tejido se penetra más fácilmente porque los tejidos son más transparentes a 800 nm19 y las estructuras más profundas se vuelven visibles14,16. La longitud de onda de excitación dentro de los 750-800 nm se requieren16,20 y la longitud de onda de emisión del agente de contraste es de aproximadamente 800 nm16,haciendo ambos invisibles para el ojo humano. Debido a su corto tiempo de vida media en plasma sanguíneo, el tinte se puede inyectar y reutilizar repetidamente16. Las limitaciones al uso de este tinte incluyen problemas con las arterias de paredes gruesas20 y la necesidad de luz fuera del espectro visible13. Como consecuencia, el ICG depende de equipos costosos y no es fácilmente aplicable en todos los laboratorios.
En conclusión, FVA es un método rápido, económico y confiable con alta sensibilidad a la patencia de la pantalla de aneurismas y arterias principales en modelos de aneurisma de roedores. Se asocia con prácticamente ninguna morbilidad y mortalidad. Permite la monitorización del flujo sanguíneo en tiempo real durante la cirugía y el seguimiento. Para mejorar su eficacia, la inyección debe llevarse a cabo en la oscuridad y se realiza mejor en recipientes meticulosamente diseccionados. Este método se puede implementar de forma fácil y segura en un laboratorio cerebrovascular, y puede minimizar los costos del experimento.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Todos los autores confirman que no hay conflictos de intereses.
Acknowledgments
Este estudio fue apoyado en parte por una beca de investigación del Kantonsspital Aarau, Suiza.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



