Summary
Vi presenterar ett protokoll för att effektivt utvärdera aneurysm perfusion och kärl patency av sidovägg aneurysm hos råttor och kaniner, med hjälp av fluorescein-baserade fluorescensvideoangiografi (FVA). Med ett positivt prediktivt värde på 92,6%, är det en enkel men mycket effektiv och ekonomisk metod utan någon speciell utrustning som krävs.
Abstract
Brain aneurysm behandling fokuserar på att uppnå fullständig ocklusion, samt att bevara blodflödet i förälderns artär. Fluorescein natrium och indocyaningrönt grön används för att möjliggöra observation av blodflödet och kärl perfusion status, respektive. Syftet med denna studie är att tillämpa FVA för att verifiera realtid blodflödet, fartygets perfusion status och ocklusion av aneurysm efter induktion av sidovägg aneurysm i kaniner och råttor, samt att validera förfarandet i dessa arter.
Tjugo sidovägg aneurysmer skapades i 10 kaniner genom suturering en decellularized arteriell kärl påse på halspulsådern av en donator kanin. Dessutom, 48 mikrokirurgisk sidovägg aneurysmer skapades i 48 råttor. Under uppföljningen på en månad efter skapelsen, den förälder artär/aneurysm komplexet dissekeras och FVA utfördes med hjälp av en intravenös fluorescein (10%, 1 ml) injektion via en öron ven kateterisering hos kaniner och en lår bens ven katerisering hos råttor. Aneurysm skördades sedan, och patency utvärderades makroskopiskt.
Makroskopiskt, 14 av 16 aneurysm i kaniner indikerade ingen kvarvarande förälder artär perfusion med helt ockluderade luminae, men 11 (79%) upptäcktes av FVA. Fyra aneurysmer exkluderades på grund av tekniska problem. Hos råttor, restaneurysm perfusion var makroskopiskt observerades i 25 av 48 fall. Av de 23 utan makroskopiska bevis på perfusion, FVA bekräftade förekomsten av 22 aneurysm (96%). Det fanns inga oönskade händelser i samband med FVA. Fluorescein är lätt att tillämpas och ingen speciell utrustning behövs. Det är en säker och mycket effektiv metod för att utvärdera förälder artär integritet och aneurysm patency/resterande perfusion i en experimentell miljö med kaniner och råttor. FVA med fluorescein som kontrastmedel verkar vara effektiva i att kontrollera patency av aneurysm och det underliggande kärlet och kan även anpassas till bypass kirurgi.
Introduction
Bevis för fullständig aneurysm utplåning och förälder artär integritet är av yttersta vikt vid aneurysm kirurgi. Det finns flera alternativ för att bekräfta förälder artär patency och aneurysm ocklusion, såsom Doppler sonografi, konventionell cerebral angiografi (DSA), datortomografi angiografi (CTA) eller magnetisk resonans angiografi (MRA)1, 2. dessa är dock dyra och tidskrävande metoder som ofta inte finns tillgängliga i laboratoriemiljö. Dessutom kan de ha relevanta biverkningar såsom strålningsexponering eller behov av ytterligare sedering av försöksdjur för att undvika rörelse artefakt.
Med ett ökande antal nya endovaskulära produkter framväxande, det finns ett i rad behov av prekliniska tester av sådana enheter. Emellertid, dessa studier förlitar sig ofta på post-mortem analys (t. ex., makro patologi och histologi) och saknar information om dynamisk perfusion. För forskaren kan det dessutom vara avgörande att få omedelbar och tillförlitlig information under ett experimentellt kirurgiskt ingrepp. Fluorescensangiografi är en kostnadseffektiv och lätt att utföra visualiseringsteknik1,3,4.
Som sådan, indocyaningrönt Green (ICG) video angiografi används ofta i kliniska neurokirurgiska ingrepp och har i stor utsträckning studerats5,6. Fluorescein video angiografi (FVA) är en alternativ teknik, med den extra fördelen att skapa en fluorescenssignal som ligger inom våglängdsområdet för mänsklig vision, och kan därför ses av blotta ögat utan ett utökat spektrum infraröd kamera 7. fluorescein video angiografi är mindre ofta används i klinisk cerebrovaskulär kirurgi och rapporter om FVA i experimentella miljöerär knappa1,4.
Syftet med detta betänkande är att påvisa genomförbarheten och omfattningen av FVA-tillämpningar i preklinisk cerebrovaskulär forskning på råtta och kanin.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Gnagare var inhysta i en djurvård anläggning och experiment granskades och godkändes av kommittén för djurens välbefinnande vid universitetet i Bern, Schweiz (BE 108/16) och (BE65/16). Alla djur bibehölls på en vanlig laboratorie diet med fri tillgång till mat och vatten. Alla djurförsök utfördes under noggrann övervägande av 3Rs (ersättning, reduktion och förfining). Tio kvinnliga nya Zeeland vita kaniner och 48 manliga Wistar råttor ingick. ANKOMMA riktlinjer följdes strängt8.
Obs: tjugo sidovägg aneurysmer skapades i 10 kaniner genom suturering en decellularized arteriell kärl påse på halspulsådern av en donator kanin. Dessutom, 48 mikrokirurgisk sidovägg aneurysmer skapades i 48 råttor som beskrivs före4,9. Avbildnings proceduren och makroskopisk analys utfördes 4 veckor efter aneurysm skapande.
1. beredning av material som behövs för fluorescein video angiografi
- Ändra ficklampan genom att tejpar på ett blått bandpass filter (se tabellen av material), som kommer att fungera som en excitation filter. Brännaren ska då bara avge blått ljus. Använd svart tejp för att undvika läckage av ofiltrerat ljus.
- Utrusta kameran (t. ex. ansluten till mikroskopet) med ett grönt bandpass filter (se tabellen av material), som kommer att fungera som ett utsläpps ljusfilter. Endast grönt ljus ska nu kunna passera.
2. beredning av arbetsplats och material
- Desinficeringsmedel på arbetsplatsen med desinfektionslösning.
- Täck bordet med sterila draperier för att förhindra kontaminering.
- Använd sterila instrument för operationen.
3. beredning av djur för kirurgi
- Väg djuren.
- Inducera anestesi och justera dosen efter vikt.
- För kaniner, börja balanserad anestesi. Skydda ögonen med en hand under injektionen för att minska deras skrämsel reaktion. Täck buren med ett blad för att hjälpa stillsam djuren.
- Anesthetize råttor i en gaskammare med 4% isofluran och 96% syre före injektionen.
- Övervaka anestesidjupet. Nyp mellan tårna för att se till att djuren sover.
- Placera kaninerna på ryggen. De bör inte reagera.
- För råttor, nypa sina svansar och se till att ingen reaktion observeras.
- Applicera salva på gnagare ögon för att förhindra torrhet. Dra ut råttornas tungor för att undvika någon chans att svälja.
- Börja med att bevara anestesi.
- För kaniner, kateterize (22 G skärmad IV kateter med injektion port, se tabellen av material) örat ven. Upprätthålla en balanserad anestesi. Använd en trevägsstopcock för att aktivera flera samtidiga injektioner.
- För råttor, injicera 50 mg/kg ketaminhydroklorid och 0,5 mg/kg medetomidinhydroklorid intraperitonealt. Övervaka anestesi med en skadliga tå nypa under operationen. I händelse av reaktion, administrera ytterligare bedövningsmedel.
- Tejpa djuren på brädet i liggande ställning och nära raka snitt platsen. Desinficera området med Betaseptic.
- För kaniner, desinficera halsen, särskilt runt sternocleidomastoideus muskler.
- För råttor, desinficera området från urinblåsan till transvers brytskåra kolon.
- Administrera syre genom en mask under hela operationen och upprätthålla kroppstemperaturen med en värmedyna.
4. beredning av artären
- För bästa resultat, grundligt dissekera det valda kärlet från omgivande vävnad9,10.
- För råttor, identifiera svansen ven (mindre invasiva, företrädesvis används för överlevande djur) eller dissekera en lår bens ven för fluorescein injektion4,11.
Anmärkning: för kaninerbehövs ingen ytterligare dissektion av kärl för fluoresceininjektion eftersom öron venen redan används för anestesi.
- För råttor, identifiera svansen ven (mindre invasiva, företrädesvis används för överlevande djur) eller dissekera en lår bens ven för fluorescein injektion4,11.
- Placera en vit pad under valt fartyg för att öka kontrasten med den omgivande vävnaden.
- Fokusera kameran monterad på mikroskopet på dissekerade artären.
5. fluorescein video angiografi
- Täck den 5 mL spruta fylld med fluoresceinnatrium (100 mg/mL, se tabellen av material) med aluminiumfolie för att skydda mot exponering av ljus. Stäng av lamporna (så mycket som möjligt) och injicera fluorescein natrium intravenöst. Injicera under mörker för att förhindra foto blekning.
- För kaniner, injicera 0,3 ml/kg fluorescein natrium genom trevägsstopcock i den kateteriserade öron venen.
- För råttor, injicera 0,4 ml/kg fluorescein natrium i femorala venen via en kateter eller en 25 G nål.
- Spola nålen eller katetern med 0,5 mL saltlösning för att säkerställa att alla färgämnen injiceras.
- Lys upp det kirurgiska fältet med den modifierade ficklampan.
- Börja filma med den modifierade kameran. Blodflödet ska vara synligt några sekunder efter injektion (figur 1).
Obs: här använde vi bildfrekvens = 50 frames/s, brännvidd = 70 mm, och F 3.4.
6. makroskopisk analys
- Resect aneurysm och förälder artär komplex, och utvärdera patency makroskopiskt genom att öppna föräldern artär med mikro-sax och utvärdera lumen av den överordnade artären och anerysm s öppning (se figur 1, 2)9. Mät storleken på aneurysmer. Aneurysm-förälder-artär-komplex kan sedan lagras för ytterligare analys (t. ex., histologi).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Hjärtfrekvens och blodtryck övervakades under operationen. Genomsnittlig hjärtfrekvens var 193/min hos kaniner och 196/min hos råttor. Kaninerna kroppsvikt varierade 3.05-4.18 kg, och råttorna vägde 335-690 g.
Vi kunde utföra FVA i åtta av tio kaniner (figur 1). Fyra aneurysm undersökningar i två kaniner spelades inte in med kameran på grund av tekniska svårigheter. Inga tekniska problem med FVA hos råttor rapporterades. Emellertid, FVA kunde inte utföras i en råtta på grund av svårigheter punktera den femorala venen.
Av 16 aneurysm i åtta kaniner, två aneurysmer visade ihållande perfusion av föräldern artär (bekräftat makroskopiskt) (se tabell 1) medan FVA identifierade fem fall med kvarvarande perfusion. 14 kanin aneurysm visade ingen kvarvarande perfusion makroskopiskt, men 11 (79%) senare upptäcktes med FVA. Kvarvarande perfusion observerades makroskopiskt i 25 av 48 råttor (tabell 1), och de övriga 23 råttor visade inga makroskopiska tecken på kvarvarande perfusion (figur 2). 22 av dessa 23 aneurysmer bekräftades sedan med hjälp av FVA (96%). Sammanlagt kunde 25 av 27 fall bekräftas, vilket resulterade i ett positivt prediktivt värde på 92,6%, en känslighetsgrad på 100% och specificitet på 94,1%. (Tabell 2).
Sammanfattnings, 25 aneurysm visade kvarvarande perfusion, 53 förälder artärer var patent och 11 var ockluderade som bekräftat makroskopiskt och på video angiografi. Det fanns bara mindre komplikationer i samband med FVA hos kaniner; t. ex. perforering av marginell öron vener under kateterisering. Inga ytterligare biverkningar upplevdes. Ingen mortalitet och ingen sjuklighet orsakad av FVA rapporterades.
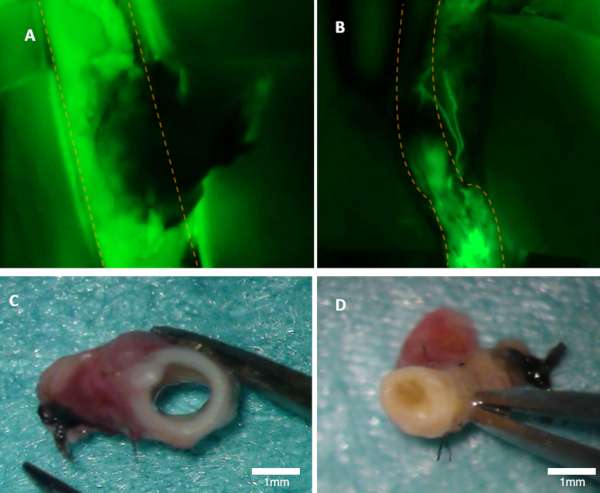
Figur 1 : Visualiserande patency i en kanin. (A) färdigheten hos moder artären syns tydligt på fluorescensbilden (grön emission från fluorescein ses). (B) Denna artär är ockluderad (fluorescens bild). Båda artärerna inspekterades makroskopiskt (C-D). Panel (C) visar i artären från panel A; lumen är öppen. Panel (D) visar artär från panel B där ocklusion kan ses makroskopiskt. Orange prickade linjer markerar gränserna för den överordnade artären. Vänligen klicka här för att se en större version av denna siffra.

Figur 2 : Visualiserande perfusion i en råtta. (A) denna panel visar ett residuellt parfymiserat aneurysm (röd streckad linje markerar den resterande perfusionen). B) ingen perfusion kan upptäckas. Panel (C) visar pulsådern från panel A under makroskopisk granskning; aneurysmet öppningen är öppen. Dmakroskopisk bild av neointima på en ockluderad aneurysm. Orange prickig linjer Markera förälder artär och aneurysmen ' Dome. Panelerna (A) och (B) är fluorescensbilder och den gröna färgen visar fluoresceinutsläpp. Vänligen klicka här för att se en större version av denna siffra.
| Patency/kvarvarande perfusion | ||||
| Macroscopical + | Macroscopical- | Fluorescein + | Fluorescein | |
| Kaniner | 2 | 14 | 5 | 11 |
| Råttor | 23 | 25 | 22 | 21 |
| Totala | 25 | 39 | 27 | 32 |
Tabell 1: testning av patency. Patency av förälder artär testades endast i kaniner och illustreras här. Fluorescein identifierade fler mönster i överordnade artärer än makroskopisk utvärdering. (Alla råttor i denna inställning hade en öppen förälder artär, som aneurysm var sys på bukaorta.) Den patency av aneurysm testades i råttor bara. Tjugotvå av 23 makroskopiskt upptäckta patenser bekräftades med FVA. Tjugoen av 25 visade ingen patency på FVA.
| Makroskopiskt positivt | Makroskopiska negativa | Totala | |
| Fluorescein positivt | 25 | 2 | 27 |
| Fluorescein negativt | 0 | 32 | 32 |
| Totala | 25 | 34 |
Tabell 2: två-för-två-tabeller som används för att beräkna specificitet och känslighet för FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA är en lovande och okomplicerad metod för att undersöka fartyg på gnagare och kan utföras med kommersiella anordningar och off-the-shelf utrustning. FVA kan implementeras under en operation där intraoperativ utvärdering av fartygets integritet behövs eftersom fartygen behöver ordentlig dissektion först.
Författarna föredrog venös injektion till arteriell injektion på grund av den lägre risken för ouppmärksama händelser såsom infektion, ischemi och compartmentsyndrom12. Intravenös injektion möjliggör pålitlig, rumsligt begränsad, starkt koncentrerad färgning, och kräver små färg doser13,14. Dessutom, venös injektion möjliggör en snabb clearance av fluorescein14,15. En alternativ metod är att injicera kontrastmedel direkt i den valda artären. Denna metod användes inte i dessa experiment som utredarna ville förhindra kontaminering av det kirurgiska området med blod och fluorescein. För att minska denna risk, perifer venös kontrastmedel injektion rekommenderas13.
Fördelar med FVA är hög kontrast (lätt att upptäcka med det mänskliga ögat), hög känslighet som visas ovan (tabell 2), låg kostnad och enkel hantering16. Fluorescein natrium var det valda kontrastmedlet för att undersöka perfusion. Synligt ljus ensamt kan användas för excitation av färgämnet och utsläpp av den typiska grönt ljus. Ändå fungerar detta kontrastmedel bäst med blått ljust (ungefärligt 480 nm) och avger ett starkt grönt ljust (våglängd ungefärligt 530 nm)15. Enligt Yoshioka et al., fluorescein färgar artären extremt snabbt14. Dessutom kan flödet av fluorescein-anrikat blod observeras i realtid15,17. Den korta tid som krävs för FVA innebär en annan fördel. i denna serie tog det i genomsnitt 2 min (± 1MIN) att genomföra en FVA.
Nackdelen med att använda fluorescein som kontrastmedel är att det fungerar bra med endast tunna artär väggar som kräver mycket noggrann dissektion. Ichikawa et al. visade utrotning av färg på grund av omintetgjorde utsläpp av ljus genom tjockare väggar av förkalkning eller undissekerade artärer15. Efter injektion metaboliseras fluorescein till fluorescerande fluorescein glukuronid i levern. Inom 30 minuter efter injektion överskrider koncentrationen av fluorescein glukuronid koncentrationen av fluorescein18. Fluorescein kräver en lång clearance tid. En omedelbar injektion efter intravenös injektion av fluorescein rekommenderas inte eftersom artären och aneurysmen redan är fluorescerande från den första injektionen17.
Molekylvikten för fluorescein är endast 376 kDa som tillåter läckage av färgämnet. Den vaskulära väggen blir också fluorescerande vilket kan leda till falskt positiva flödes utvärderingar (ökar med tiden efter applicering). En fläckig färgning av kärlväggen observerades med början ca 5 min efter injektion av fluorescein14. Den ojämn coloration, dock, observerades endast i större artärer. Små och medelstora artärer visade inte denna färgning struktur17. Det rekommenderas att utvärdera aneurysmet omedelbart för att upptäcka restfyllning.
Även om det finns en mycket låg risk för toxicitet, vissa fall av fluorescein leder till hjärt-och respiratoriska reaktioner har beskrivits14. I denna studie inträffade ingen allvarlig biverkning. de enda komplikationer var 2 fall av öron venen perforation. Enligt Lane et al., natrium fluorescein är inte skadligt även när det används i människor17. Å andra sidan är fluorescein ganska instabil och bör inte utsättas för vitt ljus16 -en röd ljuskälla kan användas i stället.
För att välja koncentrationen av fluorescein för kaniner, utredarna började med den lägsta kända arbets dosen hos råttor (0,2 mL av 100 mg/mL fluorescein natrium) och ökade den gradvis till 1 mL. En stark fluorescenssignal registrerades vid den dosen. Doseringen ökades gradvis för att testa om fluorescensen förbättras-vilket inte var fallet. Författarna bestämde sig för att fortsätta med 1 mL 100 mg/mL fluorescein natrium13.
Ett annat färgämne som är tillgängligt för att undersöka fartyg intraoperativt är ICG. Dess storlek är 775 kDa och så knappt tränger de omgivande vävnaderna14. På grund av dess längre utsläpp våglängder, är vävnad trängt lättare eftersom vävnader är mer transparent på 800 nm19 och djupare strukturer blir synliga14,16. Excitationvåglängd inom 750-800 nm krävs16,20 och emissionsvåglängden från kontrastmedlet är cirka 800 nm16, vilket gör både osynliga för det mänskliga ögat. På grund av sin korta halveringstid i blodplasma, kan färgen injiceras och återanvändas upprepade gånger16. Begränsningar för att använda detta färgämne inkluderar problem med tjockväggiga artärer20 och nödvändigheten av ljus utanför det synliga spektrumet13. Följaktligen är ICG beroende av dyr utrustning och inte lätt tillämpbar i varje laboratorium.
Sammanfattningsvis är FVA en snabb, billig och pålitlig metod med hög känslighet för skärm patency av aneurysm och förälder artärer i gnagare aneurysmen modeller. Det är förenat med praktiskt taget ingen sjuklighet och dödlighet. Det möjliggör blod flödes övervakning i realtid under kirurgi och uppföljning. För att förbättra dess effektivitet, injektionen bör utföras i mörker och är bäst utförs på minutiöst dissekerade fartyg. Denna metod kan enkelt och säkert genomföras i en cerebrovaskulär laboratorium, och kan minimera experiment kostnader.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alla författare bekräftar inga intressekonflikter.
Acknowledgments
Denna studie stöddes delvis av ett forskningsanslag från Kantonsspital Aarau, Schweiz.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



