Summary
Hier is een protocol voor een eencellige, epifluorescentie microscopie gebaseerde techniek om Graas percentages te kwantificeren in aquatische roofzuchtige eukaryoten met een hoge precisie en taxonomische resolutie.
Abstract
Elucidating trofische interacties, zoals predatie en de effecten ervan, is een frequente taak voor veel onderzoekers in de ecologie. De studie van microbiële gemeenschappen heeft vele beperkingen, en het bepalen van een roofdier, prooi, en roofzuchtige tarieven is vaak moeilijk. Hier is een geoptimaliseerde methode gebaseerd op de toevoeging van fluorescently gelabelde prooi als een Tracer, die een betrouwbare kwantificatie van de Graas percentages in aquatische roofzuchtige eukaryoten mogelijk maakt en een schatting van de overdracht van voedingsstoffen naar hogere trofische niveaus.
Introduction
Heterotrofische prokaryoten zijn een belangrijke biologische component in aquatische systemen en vormen een belangrijke fractie van de biomassa van het plankton1,2,3. Factoren die hun overvloed, diversiteit en activiteit beheersen, zijn cruciaal voor het begrijpen van hun rol in biogeochemische Cycling (d.w.z. het lot van organische koolstof en andere voedingsstoffen en stroom van energie van prokaryoten naar hogere trofische niveaus). Protozoan begrazing is een van deze belangrijke factoren. Bacterivory van heterotrofische nanoflagellates en ciliaten legt een sterke top-down controle over prokaryotische overvloed, Gemeenschap functie, structuur, diversiteit, en zelfs cellulaire morfologie en groeisnelheid van bepaalde bacteriële groepen4, 5,6. In sommige systemen dienen protisten als de belangrijkste oorzaak van bacteriële sterfte op6,7.
De standaardbenadering gebruikt om protozoeen bacterivory te beoordelen, die nu al enige tijd wordt gebruikt, omvat het gebruik van fluorescently gelabelde bacteriën (FLB) als prooi analogen en epifluorescentie microscopie. Celspecifieke opnamesnelheden kunnen worden bepaald door het aantal gelabelde prooi deeltjes in protistan voedsel vacuolen te kwantificeren over een geselecteerde tijd cursus8. Deze aanpak heeft een aantal voordelen. Tracer wordt toegevoegd aan natuurlijke monsters met natuurlijke roofdieren en prooi assemblages. Er is een minimale monster manipulatie voorafgaand aan incubatie, minimale monster wijziging door de toegevoegde FLB Tracer, en incubatie tijden zijn kort om goede resultaten te garanderen die onder de omstandigheden in situ zijn verkregen. Als alternatief kan in omgevingen met lage aantallen bacteriële protisten of zoöplankton (bv. offshore mariene systemen) de verdwijningen van FLB toegevoegd aan monsters in lage hoeveelheden (2%-3% Tracer) worden gedetecteerd via Flowcytometrie in lange termijn (12-24 h) incubatie experimenten. Vervolgens worden de nummers van de FLB aan het begin-en eindpunt (integratie van de impact van alle bacterieomen) gekwantificeerd door flowcytomeltry (zie vorige publicatie9voor meer informatie). Een dergelijke parameter vertegenwoordigt echter alleen de totale geaggregeerde bacterivory percentages die niet direct kunnen worden toegeschreven aan bepaalde protistan-en zoöplankton Grazer groepen of soorten.
Over het algemeen kan het een uitdaging zijn om de protistan soorten-of morphotype-specifieke bacteriële sterftecijfers in het aquatische milieu nauwkeurig en met ecologische betekenis te kwantificeren. Sommige protisten zijn selectieve grazers, en de grootte en de celvorm van de toegevoegde FLB Tracer kunnen de natuurlijke tarieven van prooi inname10,11verstoren. Bovendien zijn protistan activiteit en metabolisme zeer temperatuurgevoelig12; Daarom moet de hoeveelheid toegevoegde FLB Tracer zorgvuldig worden gemanipuleerd voor elk afzonderlijk monster type (niet alleen op basis van de natuurlijke overvloed, grootte, en morfologie van bacteriën en de heersende soorten bactervores, maar ook op temperatuur). De meeste studies richten zich op bulk protistan grazende activiteit; de bacterivory van specifieke protistan soorten heeft echter vaak een veel hogere informatiewaarde en kan de voorkeur hebben. In dit geval is de taxonomische kennis van de protist soorten die in een steekproef aanwezig zijn en het begrip van hun gedrag noodzakelijk. Vandaar dat er aanzienlijke hoeveelheden tijd en arbeid nodig zijn om goede resultaten te behalen op soortspecifieke tarieven van bacterivory die toe te schrijven zijn aan een bepaalde protistan groep of soort.
Ondanks deze moeilijkheden blijft deze aanpak het meest geschikte instrument dat momenteel beschikbaar is om protistan bacterivory in natuurlijke instellingen te beoordelen. Hier gepresenteerd is een uitgebreide, gemakkelijk te volgen methode voor het gebruik van FLB als een Tracer in aquatische microbiële ecologie studies. Alle genoemde problematische aspecten van de aanpak worden verantwoord en een verbeterde workflow wordt beschreven, met twee experimenten uit contrasterende omgevingen en contrasterende ciliate soorten als voorbeelden.
De eerste casestudy werd uitgevoerd in een epilimnetische omgeving van het mesotrofische Římov waterreservoir in de Tsjechische Republiek, dat Grazer en bacteriële Abundances vertoont die vergelijkbaar zijn met de meeste oppervlakte zoet waterlichamen (cf.5,7). De tweede casestudy werd uitgevoerd in de zeer specifieke omgeving binnen vallen van de aquatische vleesetende plant ,die een extreem hoge aantallen van beide grazende mixotrofische ciliaten (tetrahymena utaanariae) heeft. en bacteriële cellen. Berekeningen van de celspecifieke Graas percentages en bacteriële staande voorraden in beide soorten monsters worden weergegeven. Een reeks van ecologische interpretaties van de resultaten wordt dan besproken, en voorbeelden van mogelijke follow-up studies worden uiteindelijk voorgesteld.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. monsterverzameling
-
Inzameling van reservoir watermonster: de eerste casestudy (exp I; lagere natuurlijke in situ roofdier en prooi overvloed systeem)
- Verzamel watermonsters van de gewenste locatie op een geschikte diepte. Houd de monsters in een temperatuur geregelde koeler gevuld op in-situ temperatuur (Vermijd temperatuurschokken; opgemerkt moet worden dat de opnamepercentages van protisten afhankelijk zijn van de temperatuur) tijdens het transport naar het laboratorium.
Opmerking: onze bemonstering werd uitgevoerd in het Meso-eutrofe Canyon-vormige Římov reservoir (Zuid-Bohemen, volume 34,5 x 106 m3, maximale diepte 43 m, gemiddelde retentietijd 100 dagen, dimictic). De bemonsteringsplaats lag op een diepte van 30 meter, dicht bij de dam. Een gemengd monster op een diepte van 0,5 m werd verzameld door een 2-l Friedinger sampler. - Ga zo snel mogelijk naar paragraaf 1,2.
- Verzamel watermonsters van de gewenste locatie op een geschikte diepte. Houd de monsters in een temperatuur geregelde koeler gevuld op in-situ temperatuur (Vermijd temperatuurschokken; opgemerkt moet worden dat de opnamepercentages van protisten afhankelijk zijn van de temperatuur) tijdens het transport naar het laboratorium.
-
Het verzamelen van vloeistof uit de vallen van vleesetende, de planten: de tweede casestudy (exp II; een systeem met hoge roofdieren en prooi Abundances, extreem klein sample volume)
- Schud de planten voorzichtig onder water, haal ze uit de kweek container en plaats ze op absorberend materiaal om overtollig water te absorberen. Afhankelijk van de robuustheid van de planten en de grootte van de vallen, kies 8-10 planten individuen.
- Verdeel elke opname in ruwweg gelijke delen door blad knopen met Vang organen te tellen. Elk schiet segment zal dienen om gemengde monsters te verzamelen die jonge, middelbare en oude vallen vertegenwoordigen.
- Bevestig een dunne glazen capillaire en Eppendorf injectieflacon voor monsterafname aan een peristaltische pomp. Ga door om de capillaire punt in de opening van de trap te steken. Gebruik de vacuümpomp om alle vloeistof uit elke val te zuigen tot 900 ± 100 μL trap vloeistof wordt opgevangen voor elke leeftijdscategorie van de trap.
- Gebruik drievoud ondermonsters van 200 μL van de gepoolde trap vloeistof voor protistan grazende experimenten. Deze onmiddellijk te verwerken zoals beschreven in sectie 3. Bewaar de resterende ± 300 μL van het monster voor alle andere analyses van microbiële componenten die in de vloeistof leven, zoals hieronder beschreven (punt 2).
- Ga onmiddellijk naar paragraaf 2.
2. vastlegging van verzamelde monsters
- EXP I en II: Fix water/trap vloeistof sub-monsters voor bacteriële opsomming (sectie 4; ongeveer 20 mL en 0,3 mL, respectievelijk) met formaldehyde voor ten minste 1 h voor het verkrijgen van een 2% eindvolume: volume concentratie in elk monster.
Opmerking: handgreep formaldehyde uitsluitend in de afzuigkap, en draag handschoenen te allen tijde tijdens het manipuleren van monsters.
3. filtratie van monsters
- Monster verdunning (exp I): er is geen verdunning nodig voor het reservoir watermonsters. (Exp II): Verdun de trap vloeistofmonster 10x-100x met deeltjes vrij MQ-water om een geschikte verdeling van de doelmicroben op filter oppervlakken te bereiken alvorens te tellen via epifluorescentie microscopie.
- Filter 1-2 mL (exp I) van het reservoir water of 10-30 μL (exp II) van het submonster van de trap vloeistof voor bacteriële aftelling op zwarte filters van 0,2 μm met poriegrootte, met behulp van een filtratie trechter (diameter van 25 mm).
- Vlek de filters met DAPI (4 ', 6-diamidino-2'-phenylindole dihydrochloride, 0,2% eindconcentratie) gedurende 4 minuten.
Opmerking: Vermijd verontreiniging van de huid en het werkoppervlak en draag handschoenen. - Plaats het filter met geconcentreerde microben op een druppel Dompel olie (voor fluorescerende microscopie) op een Microscoop-dia. Plaats een andere olie druppel op het midden van het filter en dek af met een dekslip, zodat de olie gelijkmatig wordt verdeeld.
- Op dit punt, bij voorkeur onmiddellijk te verwerken monsters, of als alternatief, bewaar ze in de vriezer (-20 ° c) voor enkele weken tot maanden tot verdere analyse.
4. opsomming van bacteriële getallen op de filters
- Plaats de glijbaan onder de epifluorescentie Microscoop (met de Filterset die overeenkomt met de fluorchrome DAPI). Plaats een 10 x 10 tellings raster in een van de oculars. Verplaats de dia naar een willekeurige positie.
- Kwantificeer bacteriële cellen (blauwe fluorescentie) in het gebied van het telraster (onder de vergroting 1000x). Neem in de tellingen de cellen op die de linker-en de bovenste rand van het telraster overschrijden, zonder die zich aan de rechter-en onderrand te bevinden.
- Ga naar een andere willekeurige positie en herhaal de opsomming op ten minste 10-15 telrasters, ten bedrage van 500 cellen die in totaal zijn geteld.
- Stel een omrekeningsfactor in voor een bepaalde Microscoop en vergroting, op basis van de kennis van de verhouding van het gebied van een raster tot het totale effectieve filtratie gebied van het filter. Verdeel vervolgens het totale aantal cellen geteld door het aantal rasters geteld, wat een gemiddeld aantal bacteriën per raster oplevert.
- Vermenigvuldig de laatste parameter met de omrekeningsfactor die is vastgesteld en Normaliseer het resulterende aantal per mL van een monster (afhankelijk van het volume van het gefilterde monster) om de totale bacteriële overvloed per mL te verkrijgen.
5. de overvloed van protistan bepalen
- Repareer de submonsters van het watermonster (exp I) of trap vloeistof (exp II) met ofwel Glutaaraldehyde (1% eindconcentratie, meer geschikt voor monsters met de aanwezigheid van chlorofyl bevattende deeltjes die dagen tot weken na fixatie worden verwerkt) of met behulp van de hieronder beschreven methode voor de ontkleuring van formol-thiosulfaat.
Opmerking: beide conserveringstechnieken voorkomen de egestion van het opgenomen materiaal uit voedsel vacuolen van protisten8. - Voeg met betrekking tot de verkleurings techniek formol-thiosulfaat 100 μL/1 μL van de oplossing van Lugol toe aan 20 mL/200 μL van het submonster water/trap vloeistof (respectievelijk exp I/exp II).
- Volg onmiddellijk de toevoeging van 0,5 mL/50 μL boraatgebufferde formaline vervolgens 20 μL/2 μL 3% Natriumthiosulfaat (exp I/exp II).
Opmerking: het Natriumthiosulfaat decoloriseert de gele kleur van Lugol om de waarneming van cellen onder de epifluorescentie Microscoop8mogelijk te maken. - Filter een bekend volume van het monster (afhankelijk van het aantal doel protisten) op poriegrootte Zwart polycarbonaat filters van 1 μm.
- Schat het aantal van de protist soorten door ten minste 200 cellen onder vergroting 600x te tellen met behulp van het telraster (zie hierboven).
- Verminder het volume van het monster onder een vacuüm in de filtratie trechter met een laag vacuüm tot ongeveer 2 mL. Laat vervolgens de onderdruk los en voeg de DAPI fluorochrome (4 ', 6-diamidino-2-phenylindole dihydrochloride13, 0,2% eindconcentratie) gedurende 2 minuten toe.
6. bepalen van de communautaire structuur van ciliaten in plankton monsters
Opmerking: ciliate gemeenschappen in zoet water habitats zijn zeer divers14,15,16, 18, en hun microscopische vastberadenheid is uitdagend. Het sorteren van de ciliate groepen in functionele gilden10,14,16,17 zorgt voor een gedetailleerdere analyse van verschillende ciliate groepen als pelagische bactervores.
- Evalueer de communitystructuur van ciliate door het volgende te combineren:
- DAPI-gekleurd monsters in epifluorescentie microscopie (om de ciliate cellen te lokaliseren met een heldere fluorescentie van macro-en micro-kernen van verschillende groottes en morfologie) in combinatie met de opname van fluorescently gelabelde bacteriën (FLB8; voor details, Zie hieronder), het volgen van het vermogen van ciliaten om te voeden met bacteriën.
- Live monster observatie in geselecteerde gevallen17,19. Voor meer informatie over de bovenstaande benaderingen en criteria die worden gebruikt voor het groeperen van ciliaten in verschillende taxonomische categorieën, zie vorige publicaties16,17.
Opmerking: uit geciteerde studies is gebleken dat onder ciliates, omnivous soorten uit Stichotrichia (geslachten Halteria en pelagohalteria) en oligotrichia (namelijk rimostrombidium spp.) de belangrijkste pelagische verbruikers zijn van bacterioplankton in een overgrote meerderheid van de zoet water habitats10,17,18.
7. inschatten van de Graas snelheid van ciliaat
- Bereken de opnamesnelheden van ciliaten op bacteriën op basis van veranderingen in het gemiddelde aantal Tracer [d.w.z., FLB8 per ciliate gerelateerd aan de tijd van incubatie (5-15 min)] en Tracer hoeveelheid FLB toegevoegd, accounting maximaal voor 5%-15% van totale bacteriën.
- Om opnamepercentages te vergelijken tussen verschillende protistan soorten, Normaliseer de opnamepercentages als het aantal bacteriën per ciliate per uur, met berekeningen op basis van de werkelijke incubatietijd en het aandeel van de Tracer FLB toegevoegd.
Opmerking: de algemene opzet van de toepassing van de FLB-methode om zowel cel-als soortspecifieke en bulk bacterivory percentages in natuurlijke monsters te schatten, wordt afgebeeld in Figuur 1. - Bereiding van FLB van bacteriestammen inheems in een zoet watermilieu8
- Selecteer een geschikte maat (gemiddelde celvolume = MCV) en morfologie van bacteriën, zodat ze effectief de typische maten van bacterioplankton/bacteriële cellen in het aquatische systeem dat wordt onderzocht nabootsen.
Opmerking: voor exp I werd een mengsel van geïsoleerde stammen van de studie locatie van het geslacht Limnohabitans en polynucleobacter gebruikt (d.w.z. typisch, zeer overvloedig bacterioplankton in meren en vijvers)20. Voor meer informatie over de morfologie en de afmetingen van de stammen, zie vorige publicaties3,17,18,21. - Oogst bacteriële cellen uit de cultuur door centrifugeren (5.000 x g) gedurende 15 minuten in de vroege stationaire fase en meng ze met een numerieke verhouding die MCV ± SD van de cellen in het mengsel oplevert die overeenkomt met de typische MCV van bacteriën op de gekozen locatie.
- Suspendeer de pellets in 10 mL fosfaatgebufferde zoutoplossing (PBS; pH = 9).
- Voeg 2 mg van de geel-groene fluorescerende kleurstof 5-(4, 6-dichlorotriazin-2-yl) aminofluorescein (DTAF, bindt aan eiwitten) aan de celsuspensie in de fosfaat-zout buffer en inbroed in een waterbad van 60 °C voor 2 uur.
- Na de incubatie, centrifugeer de cellen, decanteren de DTAF-oplossing en was en centrifugeer 3x met PBS.
- Na de laatste wasbeurt, resuspendeer de cellen in 20 mL van de PPi-Saline buffer.
- Vortex de FLB-suspensie en Pipetteer 1,5 mL aliquots in 2 mL Cryo-flesjes en houd vervolgens bevroren (bij-20 °C) in PPi-Saline buffer tot het gebruik.
- Pre-filter PPi-Saline buffer door middel van een 0,2 μm polycarbonaat filter voor gebruik in de volgende stap.
- Om de FLB-concentratie te bepalen, breng een klein aliquot (gewoonlijk 20-40 μL) over in 2 mL deeltjes vrije PPi-zout buffer, sonicatie bij 30 W voor verschillende 2 s-uitbarstingen en filtreer op 0,2 μm polycarbonaat zwart filter voor inventarisatie via epifluorescentie microscopie (1, 000X vergroting) onder optische filterinstellingen voor DTAF (448 nm/520-540 nm).
- Selecteer een geschikte maat (gemiddelde celvolume = MCV) en morfologie van bacteriën, zodat ze effectief de typische maten van bacterioplankton/bacteriële cellen in het aquatische systeem dat wordt onderzocht nabootsen.
- Tracer techniek voor de schatting van ciliate bacterivory
- Voor grazende experimenten in natuurlijke plankton habitats, breng 300 mL monsters in goed gespoeld kolven van 1 L en inincuberen bij in-situ temperatuur gedurende 15 minuten (om protisten te laten herstellen van de handling shock).
- Voeg FLB tracers toe om 5%-15% van de totale bacteriën te vormen, met de toegevoegde hoeveelheden afhankelijk van het seizoen en de watertemperatuur.
Opmerking: er is een zeer breed, seizoen-afhankelijk spectrum in ciliate soortspecifieke opnamepercentages die verschillende orden van grootte beslaan (d.w.z. van 101-104 bacteriën ciliate-1 per uur)10,16, 17,18,22,23,24. - In perioden van verbeterd optreden van ciliaten met hoge opnamesnelheden (meestal tijdens de zomer), ook een parallelle incubatie met zeer lage FLB toevoegingen, vormen slechts 2%-4% van totale bacteriën om te voorkomen dat overmatige belasting van ciliate vacuolen door Tracer FLB (Zie voorbeelden in Figuur 2).
- Incubate ciliate/plankton monsters met FLB gedurende 5-15 min.
- Er zijn twee mogelijkheden voor monster fixatie ter voorkoming van egestion van het opgenomen materiaal uit voedsel vacuolen van protisten8. Beëindig de incubaties door toevoeging van 1% Glutaaraldehyde (uiteindelijke concentratie die geschikter is voor monsters met chlorofyl-bevattende deeltjes, zoals algen). U ook 100 μL/10 μL van de oplossing van Lugol gebruiken in een submonster van 20 mL/200 μL water/trap vloeistof, onmiddellijk gevolgd door toevoeging van 0,5 mL/10 μL boraat-gebufferde formaline, vervolgens 200 μL/2 μL van 3% Natriumthiosulfaat (exp I/exp II, respectievelijk).
- Na het toevoegen van de fixeer, laat de monsters rusten voor ten minste 1 h in het donker bij 4 ° c om te zorgen voor een grondige bewaring van ciliate cellen.
- Neem natuurlijke plankton ondermonsters van 4-30 mL/10-30 μL (respectievelijk exp I/exp II; het volume is afhankelijk van de abundantie van ciliate) en beits met DAPI (eindconcentratie 0,2% WT/vol; Zie voor meer informatie stap 3,2 hierboven).
- Passeren 1 μm zwarte filters en inspecteren via epifluorescentie microscopie te tellen ciliaten (600x vergroting) en inventariseren van het aantal FLB tracers ingenomen (meestal bij 1000x vergroting) zoals beschreven in eerdere publicaties2,17 . Inspecteer monsters binnen 7 dagen na bewaring.
- Om totale protozoan/species-specifieke beweiding te schatten, vermenigvuldigt u de gemiddelde opnamesnelheden van alle ciliates, of alleen de ciliate soorten zoals gedetecteerd door overvloed in situ.
- Voorbeeld van de berekening van de opnamepercentages per cel uit in-situ gegevens van het Římov-waterreservoir wordt als volgt beschreven:
- Stel dat de bacteriële concentratie is 3,55 x 106 bacteriën/ml en Tracer FLB toegevoegd is 0,25 x 106 FLB/ml, die resulteert in een som van 3,8 x 106 bacteriën/ml van totale bacteriële deeltjes (natuurlijke bacteriën + FLB = 100% van prooi deeltjes) beschikbaar voor phagotrofische protisten in het natuurlijke monster.
Opmerking: de toegevoegde FLB tracers vertegenwoordigen dus 6,58% (een project van 0,25/0.038) van totale bacteriële deeltjes. Het gemiddelde aantal FLB per Halteria SP. is 6,2 FLB in 5 minuten incubaties. - Om opname per uur te normaliseren, gebruikt u de volgende berekening: (6,2 x 12)/(6.58/100) = 1131 bacteriën per Halteria cel/h.
Opmerking: Zie Figuur 3voor meer voorbeelden van distributies van individuele opnamepercentages van halteria SP. gedetecteerd onder variabele watertemperaturen, hoeveelheden (als percents) van Tracer FLB en verschillende INCUBATIE tijden met FLB.
- Stel dat de bacteriële concentratie is 3,55 x 106 bacteriën/ml en Tracer FLB toegevoegd is 0,25 x 106 FLB/ml, die resulteert in een som van 3,8 x 106 bacteriën/ml van totale bacteriële deeltjes (natuurlijke bacteriën + FLB = 100% van prooi deeltjes) beschikbaar voor phagotrofische protisten in het natuurlijke monster.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Voorbeeld experiment ik werd gerund in Římov waterreservoir (Zuid-BOHEMEN, CZ), dat is een natuurlijke site met lagere natuurlijke in situ roofdier en prooi overvloed. Representatieve gegevens worden gerapporteerd voor de omnivous ciliate-soort halteria grandinella, een overvloedige en efficiënte Grazer van picoplankton (< 2 μm) deeltjes10,16,17,18 ,22. Figuur 3 toont de doos-en-whiskerplots van het aantal FLB per cel van halteria SP. van het Římov reservoir (Figuur 3A), dat werd herberekend tot een bacteriële opname per uur (Figuur 3B) gedetecteerd in vier individuele experimenten uitgevoerd in april, mei, augustus en september. Er was een hoge variabiliteit in de opnamesnelheden van ciliate, voornamelijk veroorzaakt door de temporele verschillen in watertemperatuur.
Opgemerkt dient te worden dat de Q10 parameter weerspiegelt het feit dat de microbiële processen ongeveer 2.5 x sneller draaien met een temperatuurstijging van 10 ° c12, die ook houdt voor ciliate opnamepercentages op bacteriën. Met deze fysiologische regel in het achterhoofd, werden aanzienlijk verschillende verhoudingen van FLB en incubatie tijden gebruikt voor verschillende seizoenen (Zie afbeelding 3A) voor meer informatie. Zo werd het verwachte temperatuur effect gecompenseerd, en de experimentele instelling leverde geoptimaliseerde gemiddelde en mediane waarden van de opnamepercentages op ongeveer tussen 5-10 FLB per ciliate cel. Over het algemeen zijn deze hoeveelheden opgenomen FLB gemakkelijk te aftelbare (zie voorbeelden in Figuur 2, twee linker Foto's), het genereren van precieze schattingen van de Tracer (meestal tussen 1-15 FLB per ciliate) opnamepercentages. Echter, als gevolg van gemodificeerde FLB Tracer toegevoegd (%) en verschillende tijdstippen van monster incubatie de absolute waarden (uitgedrukt als aantal bacteriën begraasd ciliate per uur) verschafden significant (p < 0,01, Kruskal-Wallis test; gevolgd door dunn's meervoudige vergelijkingstest, p < 0,05; Zie voorbeelden in afbeelding 3B) onder de experimenten. De gegevens illustreren ook de typische natuurlijke variabiliteit in absolute bacterivory percentages in de plankton populaties van Halteria grandinella, met een nauwe match van hun gemiddelde en gemiddelde waarden (Figuur 3).
In aanwezigheid van zeer efficiënte bacteriemeuze ciliaten in monsters, zoals peritrichous ciliaten, kunnen ze zwaar "over-gelabeld" worden door FLB in typische Tracer bedragen van 5%-10% van totale bacteriën (Zie rechterkant foto in Figuur 2). Dit kan de nauwkeurige kwantificering van opgenomen FLB sterk beperken. In dergelijke gevallen wordt voorgesteld om extra parallelle incubaties uit te voeren met slechts geringe hoeveelheden FLB voor slechts 1,5%-3% van de totale bacterie. Over het algemeen kunnen zowel de Tracer bedragen als de incubatie tijden echter worden gemanipuleerd om het aantal FLB per cel te optimaliseren (Figuur 2).
Voorbeeld experiment II: weergegeven is de gegevens van een systeem met grote roofdieren en prooien Abundances, waar slechts een extreem klein monstervolume beschikbaar is om experimenteel te schatten bacterivory tarieven van de Ciliate tetrahymena utdiariae 25. het is een gematigde bacteriële Grazer die in grote overvloed leeft, uitsluitend in vallen van vleesetende uter Aria reflexa -planten26,27. Figuur 4 toont de doos-en-whiskerplots van het aantal FLB per cel van T. utformuariae onder verschillende experimentele instellingen (Figuur 4A, B) die wordt herberekend in de mate van bacteriële opname per uur (Figuur 4 C, D) gedetecteerd in jonge, volwassen en oude vallen. Interessant is dat in vallen, chlooroplast-dragende populaties van de ciliate t. uttafariae werden gedetecteerd, terwijl apochlorische populaties van t. uttafariae werden geïsoleerd van vallen en gehandhaafd op gemengde bacteriële suspensie die groeit op tarwekorrels in het donker (zie afbeelding 1 in een eerdere publicatie26) voor meer informatie.
De chloroplast-dragende populaties leven in licht verlichte vallen; Zo kunnen de chloroplasten een extra organische koolstofbron en zuurstof leveren aan de ciliate-host. Een van de geteste hypotheses was dat de apochlorische ciliate populaties aanzienlijk sneller begraasd bacteriën, als de bacteriën vertegenwoordigen de enige deeltjes bron van organische koolstof beschikbaar voor donker geteelde geïsoleerde subpopulaties van de ciliate.
Hoewel er geen significante verschillen waren in de bacterivory percentages van de ciliaten die in jonge, volwassen en oude vallen van de utpost Aria reflexa leven (Figuur 4A, C), begraasd de apochlorische populaties van T. bacteriën significant (p < 0,01, Kruskal-Wallis test; gevolgd door dunn's multiple-vergelijkingstest, p < 0,05), ongeveer 3x sneller dan de chlooroplast-dragende ciliaten die in jonge, volwassen en oude vallen leven (Figuur 4C, D). Houd er rekening mee dat zowel de Tracer-bedragen als de incubatie tijden (Figuur 4A, B, top) zijn gewijzigd om het aantal FLB per cel te optimaliseren (meestal tussen 1-15), met gemiddelde en mediane waarden rond 5 FLB/ciliate. Deze getallen zijn te onderscheiden in ciliate voedsel vacuolen en toegestaan nauwkeurige Tracer telling. Echter, uitgedrukt in absolute aantallen bacteriën begraasd per uur, de chloroplast-lager en apochlorische populaties begraasd ongeveer 350 en 1.000 bacteriën ciliate per uur, respectievelijk. Deze experimentele opzet bracht nieuwe inzichten in de metabole en fysiologische eigenschappen van twee verschillende subpopulaties van dezelfde ciliate soorten die onder opvallend verschillende milieubeperkingen leven,25,26, 27.
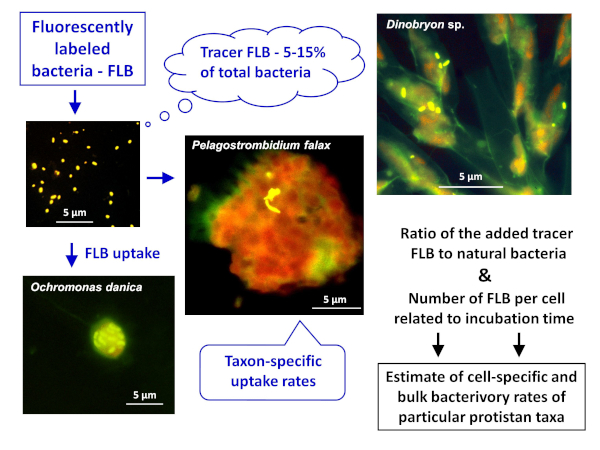
Figuur 1 : Workflow van het gebruik van fluorescently gelabelde bacteriën (FLB) om de cel-en soortspecifieke Graas percentages te ramen van de verhouding van de opgenomen Tracer FLB tot het totale aantal natuurlijke bacteriën in het monster. Zie sectie 7 van het protocol voor meer informatie. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2 : Voorbeelden van ciliate cellen uit plankton van een eutrofische visvijver. Voorbeelden worden weergegeven uit de vijver met aftelbare FLB in ciliate cellen (over het algemeen 1-10 Tracer FLB per cel, de linker twee microphotograps) in vergelijking met een peritrichous ciliate pelagovorticella natans (de rechterkant micro foto). Zelfs tijdens een korte incubatieperiode van 5 minuten werd het "over-gelabeld" door de Tracer FLB, waardoor kwantificering van de ingenam FLB onnauwkeurig of bijna onmogelijk was. In dit geval wordt voorgesteld om de Tracer bedrag te verlagen naar 1.5%-3% van totale bacteriën. Over het algemeen kunnen echter zowel de Tracer bedragen als de incubatie tijden worden gemanipuleerd om het aantal FLB dat per cel wordt ingenomen te optimaliseren. Zie sectie 7 van het protocol voor meer informatie. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 3 : Doos-en-whisker plots van aantallen FLB per cel van halteria SP. van het Římov reservoir (exp I) (A), herberekend naar de tarieven van bacteriële opname per uur (B). De gegevens werden gedetecteerd onder verschillende seizoensgebonden instellingen, vertegenwoordigd door vier voorbeelden van april tot september. De bovenkant van panel A toont informatie over de watertemperatuur, verschillende FLB tracers toegevoegd (%), en verschillende tijdstippen van monster incubatie. Opgemerkt moet worden dat de laatste twee parameters kunnen worden gewijzigd om te optimaliseren aantal FLB per cellen, met gemiddelde (volledige lijn) en mediaan (onderbroken lijn) waarden ongeveer tussen 5-10 FLB per ciliate cel (A). De staven tonen de 25e en 75e percentielen van alle gegevens (50-180 cellen geïnspecteerd) en snorharen staan voor het 1e en 99e percentielen. B) verschillende kleine letters duiden op significante verschillen in celspecifieke bacterivory percentages van halteria SP. tijdens de bestudeerde periode. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 4 : Doos-en-whisker-plots van aantallen FLB per cel. Plots worden aangetoond dat chlooroplast-dragende Tetrahymena-utafariae afkomstig zijn van drievoud behandelingen van jonge, volwassen en oude vallen van het gebruik van het medicijn (exp II) (A), herberekend tot de bacteriële opname per uur (C). De gegevens werden vergeleken met bacteriële opnamepercentages van de dubbele apochlorische populaties van T. utlosariae (B, D),geïsoleerd van vallen maar gehandhaafd op gemengde bacteriële suspensie die in het donker op tarwekorrels groeit. Boven op de panelen A en B zijn verschillende FLB-tracers toegevoegd (%) en verschillende tijdstippen van monster incubatie worden getoond. Opgemerkt moet worden dat de laatste twee parameters zijn gewijzigd om het aantal FLB per cel te optimaliseren, met een gemiddelde (volledige lijn) en mediaan (onderbroken lijn) waarden ongeveer tussen 5-10 FLB per ciliate Cell (A, B). De staven tonen de 5e en 95e percentielen van alle gegevens (50-100 cellen geïnspecteerd) en snorharen staan voor het 1e en 99e percentielen. Klik hier om een grotere versie van dit cijfer te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Deciphering trofische interactie in aquatische systemen is altijd uitdagend28, vooral op de nano-plankton schalen waarbij protisten en hun prooi, bacteriën. Als het gaat om nutriëntenopname trajecten en kwantificering, is de toepassing van methoden met succes gebruikt op hogere trofische niveaus minder mogelijk, vanwege de hoge complexiteit van biotische interacties. Deze omvatten, bijvoorbeeld, stabiele isotoop labeling benaderingen. Dit protocol toont de voordelen van het gebruik van epifluorescentie microscopie en fluorescerig gelabelde bacteriën als een Tracer om te volgen en semi-kwantificeren/schatten van de koolstof stroom (bacteriële prooi: diverse protistan grazers inclusief mixotrophic grazers29) paden door de basis van microbiële voedsel webben. Een van die voordelen is de hoge nauwkeurigheid van de eencellige benadering, en de andere is de ongekende resolutie over de structuur van de Grazer-Gemeenschap en het onderscheiden van verschillende functionele gilden, soorten (exp I) en zelfs subpopulaties van dezelfde soorten (exp II).
Kritieke stappen in het Protocol
Er zijn verschillende kritieke stappen in het Protocol, die ervoor kunnen zorgen dat de voordelen van de methodologie worden benut om hun volledige potentieel. Ten eerste is een basiskennis van de bestudeerde omgeving voorafgaand aan het begin van het experiment altijd gunstig. Dit omvat microscopische screening van de diversiteit en de overvloed van potentiële grazers aanwezig, bacteriële prooi groottes, en prooi verdeling beide 1) in de waterkolom (bijv. een verticaal Profiel van de epilimnion naar de Hypolimnion) en 2) in het geval van kloof vormige reservoirs, op de dam-inflow trans ect. Ten tweede zorgt een zorgvuldige manipulatie van de verzamelde monsters voor representatieve resultaten. Temperatuur is een uiterst belangrijke factor die de meeste microbiële processen12beïnvloedt, inclusief protistische Graas percentages (Figuur 3).
Ten derde zorgt het manipuleren van de hoeveelheid Tracer die is toegevoegd op basis van de kwantificering van bacteriële cellen of het type Grazer in het monster ervoor dat problemen met overlabeling (Figuur 2) worden geëlimineerd. Opgemerkt dient te worden dat er een zeer breed spectrum in ciliate soortspecifieke opnamepercentages (voor details, zie stap 7,2); om het protocol op de juiste wijze toe te passen, is voorkennis van belangrijke ciliate soorten met hun time-Course opnamepercentages dus essentieel. Het wordt sterk aangeraden om voorbereidende experimenten uit te voeren met verschillende Tracer bedragen om te voorkomen dat mogelijke ciliate onder-labeling (geen of te weinig FLB worden overgenomen per ciliate cel, statistisch ondeugdelijke gegevens opleveren) of over-labeling (verschijnt als grote aantallen FLB vorming van "condense FLB wolken" of koppels in ciliate voedsel vacuolen verpakt door de tracers, waardoor hun precieze kwantificering ernstig wordt beperkt; Zie rechtsboven voorbeeld in Figuur 2). Ook moet worden opgemerkt dat incubatie tijden met FLB over het algemeen korter zijn dan 30 min, omdat de gemiddelde verterings tijd van picoplankton door ciliaten rond 1,5 uur is en de spijsvertering begint (ingenomen picoplankton cellen verliest zijn typische vorm en kleur) ongeveer na 45-60 min30. Op dezelfde manier moet optimale verdunning en distributie van monsters op het filter voorafgaand aan microscopische weergave worden bereikt voor nauwkeurige resultaten.
Wijzigingen en probleemoplossing
De belangrijkste stappen, mogelijke wijzigingen en het oplossen van problemen met de techniek worden geïllustreerd in Figuur 1 en Figuur 2. Bovendien moet worden opgemerkt dat in gevallen van hoge concentraties van detrital deeltjes, fytoplankton cellen of hun kolonies in plankton, dergelijke monsters 1) dienovereenkomstig moeten worden verdund om een fase te bereiken waarin individuele Grazer cellen kunnen worden onderscheiden op het filteroppervlak en 2) worden onderworpen aan kwantificering van voedsel vacuole inhoud.
Beperkingen
De belangrijkste beperking voor een succesvolle toepassing van deze methode ligt in de aanwezigheid van verschillende organische afval of overvloedige anorganische/organische deeltjes met bijgevoegde bacteriën of aggregaten in hoeveelheden die duidelijke monster weergave onder de epifluorescentie te voorkomen Microscoop en precieze schatting van een Tracer bedrag toegevoegd. Opgemerkt moet worden dat de gepresenteerde Tracer techniek voornamelijk werkt met vrije (d.w.z., geschorste) bacteriën die niet aan deeltjes zijn gehecht. Echter, op basis van onze eigen ervaring en literatuur referenties (zie vorige publicaties2,4,8,10,16,18,21 ,26), is de gepresenteerde methodologie geschikt voor de meeste aquatische omgevingen. Er worden voorbeelden gegeven van twee natuurlijke, contrasterende systemen die verschillen in trofische status, afval-inhoud en Grazer-diversiteit en-getallen (Figuur 3 en Figuur 4).
Betekenis van de aanpak met betrekking tot bestaande methoden
Belangrijk, uit kennis van de overvloed van een taxon/taxa van bacteriën en hun soortspecifieke bacterivory tarieven, de bulk bacterivory tarief van de protistan taxon (of Total ciliate assemblage) kan worden berekend. Als deze benadering gelijktijdig wordt toegepast op natuurlijke plankton omgevingen voor zowel heterotrofische flagellaten als ciliaten (die de belangrijkste grazers van bacterioplankton2,6,7), de protistan beweiding-geïnduceerde omzet tijd van bacteriële populaties in een bepaalde omgeving kan worden geschat16,17,18,22. Dergelijke gegevens zijn van fundamenteel belang voor de schatting van de koolstof stroom dynamiek in microbiële voedsel webben.
Toekomstige toepassingen
Er zijn andere specifieke omgevingen waarin deze methode, met enkele wijzigingen, met succes kan worden gebruikt. Deze omvatten actieve slib systemen, pensecosystemen, aquatische sedimenten en hypertrofische visvijvers17. Echter, toepassing in deze nutriënt-en Microbes-rijke omgevingen vereist voorbereidende tests voor het optimaliseren van het protocol met betrekking tot de juiste grootte, morfologie, en nummers van Tracer FLB die de typische grootteverdeling en andere kenmerken kunnen nabootsen van prooi bacteriën die inherent zijn aan het milieu.
Momenteel is er een toenemende belangstelling om deze aanpak te combineren met de gekatalyseerde reporter depositie fluorescentie in situ hybridisatie (CARD-FISH), waarbij de identiteit van de Grazer cel (bijv. heterotrofische flagellate) wordt gedetecteerd met een specifieke FISH-probe en de opnamesnelheid is gebaseerd op FLB-gehalte in voedsel vacuolen van de flagellaatcel op dezelfde microscopische dia31. Een geavanceerde, nieuwe aanpak genaamd Double hybridisatie32 is een combinatie van visonen op het niveau van de Predator-cel en prooi bacteriën (die ook specifiek worden gelabeld door een fylogenetische stam, een bacteriële Lineage-specifieke vissonde). De aanpak is elegant, maar ook tijdrovend en vereist specifieke vaardigheden en ervaring31,32, terwijl de toepassing van verschillende FLB opname aanpak aanpassingen gemakkelijker kan worden aangenomen voor routine gebruik in laboratoria.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Deze studie werd gesteund door de Tsjechische Science Foundation onder de Research Grant 13-00243S en 19-16554S toegekend aan K. Š. en D. S., respectievelijk. Dit artikel werd ook gesteund door het project "Biomanipulation als een instrument voor het verbeteren van de waterkwaliteit van stuw reservoirs" (no CZ. 02.1.01/0.0/0.0/16_025/0007417), gefinancierd door het Europees Fonds voor regionale ontwikkeling, in het operationele programma onderzoek, ontwikkeling en onderwijs.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



