Summary
यहाँ प्रस्तुत एक एकल सेल के लिए एक प्रोटोकॉल है, epifluorscence माइक्रोस्कोपी आधारित तकनीक उच्च परिशुद्धता और वर्गीकरण संकल्प के साथ जलीय हिंसक यूकैरियोट में चराई दरों की मात्रा निर्धारित करने के लिए.
Abstract
इस तरह के predation और इसके प्रभाव के रूप में trophic बातचीत, स्पष्ट, पारिस्थितिकी में कई शोधकर्ताओं के लिए एक लगातार काम है. माइक्रोबियल समुदायों के अध्ययन की कई सीमाएं हैं, और एक शिकारी, शिकार, और हिंसक दरों का निर्धारण अक्सर मुश्किल होता है। यहाँ प्रस्तुत एक अनुकूलित विधि एक अनुरेखक के रूप में फ्लोरोसेंट लेबल शिकार के अलावा के आधार पर है, जो जलीय हिंसक यूकैरियोट में चराई दरों के विश्वसनीय परिमाण के लिए अनुमति देता है और उच्च trophic स्तर के लिए पोषक तत्व हस्तांतरण का आकलन.
Introduction
हेटरोट्रोफिक प्रोकैरियोट जलीय प्रणालियों में एक प्रमुख जैविक घटक है और प्लवक बायोमास1,2,3का एक महत्वपूर्ण अंश है . कारक है कि उनकी बहुतायत, विविधता, और गतिविधि को नियंत्रित biogeochemical साइकिल चालन में उनकी भूमिका को समझने के लिए महत्वपूर्ण हैं (यानी, कार्बनिक कार्बन और अन्य पोषक तत्वों और prokaryotes से उच्च ट्राफिक स्तर के लिए ऊर्जा का प्रवाह) के भाग्य. प्रोटोज़ोअन चराई इन महत्वपूर्ण कारकों में से एक है। विषमपोषी नैनोफ्लैगेलेट और पक्ष्माभी के जीवाणु प्रोकैरियोटिक बहुतायत, सामुदायिक कार्य, संरचना, विविधता, और यहां तक कि सेलुलर आकृति विज्ञान और विशेष जीवाणु समूहों की विकास दर4,पर एक मजबूत ऊपर से नीचे नियंत्रण लगाता है 5,6. कुछ प्रणालियों में प्रोटिस्ट जीवाणु मृत्यु का प्रमुख कारण6,7का कार्य करते हैं .
प्रोटोज़ोअन जीवाणु का आकलन करने के लिए इस्तेमाल किया जाने वाला मानक दृष्टिकोण, जिसका उपयोग कुछ समय से किया गया है, में शिकार एनालॉग और एपिफ्लोरेसेंस माइक्रोस्कोपी के रूप में फ्लोरोसेंट लेबल बैक्टीरिया (एफएलबी) का उपयोग शामिल है। सेल-विशिष्ट तेज दरों का निर्धारण चयनित समय पाठ्यक्रम8पर प्रोटिस्टेन खाद्य धानी में लेबल किए गए शिकार कणों की संख्या को निर्धारित करके किया जा सकता है। इस दृष्टिकोण के लिए कई फायदे हैं. अनुरेखक प्राकृतिक शिकारी और शिकार assembles के साथ प्राकृतिक नमूनों में जोड़ा जाता है. ऊष्मायन से पहले न्यूनतम नमूना हेरफेर है, जोड़ा FLB अनुरेखक द्वारा न्यूनतम नमूना परिवर्तन, और ऊष्मायन समय स्थिति में स्थिति के करीब प्राप्त ध्वनि परिणामों को सुनिश्चित करने के लिए कम कर रहे हैं। वैकल्पिक रूप से, बैक्टीवरीय protists या zooplankton (उदा., अपतटीय समुद्री प्रणालियों) की कम संख्या के साथ वातावरण में, FLB के गायब होने की दर कम मात्रा में नमूने के लिए जोड़ा (2%-3% अनुरेखक) लंबी अवधि में प्रवाह साइटोमिट्री के माध्यम से पता लगाया जा सकता है (12-24 ज) ऊष्मायन प्रयोग. फिर, शुरू और अंत बिंदुओं पर FLB की संख्या (सभी जीवाणुकेप्रभावों के प्रभाव को एकीकृत) प्रवाह साइटोमेट्री द्वारा निर्धारित कर रहे हैं (विवरण के लिए, पिछले प्रकाशन9देखें). हालांकि, इस तरह के एक पैरामीटर केवल कुल एकत्रित जीवाणु दर है कि सीधे किसी विशेष protistan और zooplankton grazer समूहों या प्रजातियों के लिए जिम्मेदार नहीं ठहराया जा सकता का प्रतिनिधित्व करता है.
कुल मिलाकर, जलीय पर्यावरण में प्रोटिस्टेन प्रजातियों- या मॉर्फोटाइप-विशिष्ट जीवाणु मृत्यु दर का सही और पारिस्थितिक अर्थ के साथ परिमाणीकरण चुनौतीपूर्ण हो सकता है। कुछ प्रोटिस्ट चयनात्मक ग्रेजर होते हैं और अतिरिक्त FLB ट्रेसर का आकार और कोशिका आकार शिकार घूस10,11की प्राकृतिक दरों को विकृत कर सकता है . इसके अलावा, प्रोटिस्टेन गतिविधि और चयापचय अत्यधिक तापमान के प्रति संवेदनशील12हैं; इसलिए, जोड़ा FLB अनुरेखक की मात्रा को ध्यान से प्रत्येक व्यक्ति नमूना प्रकार के लिए हेरफेर किया जाना चाहिए (न केवल प्राकृतिक बहुतायत, आकार, और बैक्टीरिया की आकृति विज्ञान और जीवाणु के प्रचलित प्रकार के आधार पर, लेकिन यह भी तापमान पर). अधिकांश अध्ययन थोक प्रोटिस्टान चराई गतिविधि पर ध्यान केंद्रित; हालांकि, विशिष्ट प्रोटिस्टान प्रजातियों के जीवाणु अक्सर एक बहुत अधिक जानकारी मूल्य रखती है और बेहतर हो सकता है। इस मामले में, एक नमूना और उनके व्यवहार की समझ में मौजूद प्रोटिस्ट प्रजातियों के वर्गीकरण ज्ञान की जरूरत है। इसलिए, समय और श्रम की काफी मात्रा में एक विशेष protistan समूह या प्रजातियों के कारण जीवाणु की प्रजातियों-विशिष्ट दरों पर ध्वनि परिणाम प्राप्त करने के लिए आवश्यक हैं।
इन कठिनाइयों के बावजूद, इस दृष्टिकोण सबसे उपयुक्त उपकरण वर्तमान में प्राकृतिक सेटिंग्स में protistan जीवाणु का आकलन करने के लिए उपलब्ध रहता है. यहाँ प्रस्तुत जलीय माइक्रोबियल पारिस्थितिकी अध्ययन में एक अनुरेखक के रूप में FLB का उपयोग करने के लिए एक व्यापक, आसान करने के लिए पालन विधि है. दृष्टिकोण के उल्लेख समस्याग्रस्त पहलुओं के सभी के लिए जिम्मेदार हैं और एक बेहतर कार्यप्रवाह का वर्णन किया गया है, विषम वातावरण से दो प्रयोगों के साथ ही उदाहरण के रूप में विषम पक्ष्माभ प्रजातियों.
पहले मामले का अध्ययन चेक गणराज्य में मेसोट्रॉफिक जेडमोव जल जलाशय से एक एपिलिम्नेटिक वातावरण में किया गया था, जो अधिकांश सतह मीठे पानी के निकायों (cf.5,7) के बराबर ग्रेजर और जीवाणु बहुतायत से पता चलता है। दूसरा केस स्टडी जलीय मांसाहारी पौधे यूट्रिकुलेरिया रिफ्लेक्सके जाल के अंदर अत्यधिक विशिष्ट वातावरण में किया गया था , जिसमें दोनों चराई मिक्सोट्रोफिक सिलिएट्स (टेट्राहाइमेना यूट्रिकुलेरिया) की अत्यधिक उच्च संख्या का आयोजन किया गया था . और जीवाणु कोशिकाओं. सेल-विशिष्ट चराई दरों और दोनों नमूना प्रकार में जीवाणु खड़े स्टॉक की गणना दिखाया गया है. परिणामों की पारिस्थितिक व्याख्याओं की एक श्रृंखला तो चर्चा की है, और संभव अनुवर्ती अध्ययन के उदाहरण अंत में सुझाव दिया है.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. नमूना संग्रह
-
जलाशय के पानी के नमूने का संग्रह:पहला मामला अध्ययन (एक्सप I; कम प्राकृतिक में सीटू शिकारी और शिकार बहुतायत प्रणाली)
- एक उपयुक्त गहराई पर वांछित स्थान से पानी के नमूने ले लीजिए. नमूनों को तापमान-नियंत्रित तापमान में भरे हुए तापमान में रखें (तापमान सदमे से बचना; यह ध्यान दिया जाना चाहिए कि प्रयोगशाला में परिवहन के दौरान प्रोटिस्टों की तेज दर तापमान पर निर्भर होती है)।
नोट: हमारे नमूने मेसो-यूट्रोफिक घाटी के आकार का [मोव जलाशय में आयोजित किया गया था (दक्षिण बोहेमिया, मात्रा 34.5 x 106 मीटर3, अधिकतम गहराई 43 मीटर, मतलब प्रतिधारण समय 100 दिन, dimictic). नमूना स्थल बांध के करीब 30 मीटर गहराई पर स्थित था। 0.5 मीटर गहराई पर एक मिश्रित नमूना एक 2-l फ्राइडिंगर पारखी द्वारा एकत्र किया गया था। - अनुभाग 1.2 के रूप में जल्द से जल्द जारी रखें.
- एक उपयुक्त गहराई पर वांछित स्थान से पानी के नमूने ले लीजिए. नमूनों को तापमान-नियंत्रित तापमान में भरे हुए तापमान में रखें (तापमान सदमे से बचना; यह ध्यान दिया जाना चाहिए कि प्रयोगशाला में परिवहन के दौरान प्रोटिस्टों की तेज दर तापमान पर निर्भर होती है)।
-
मांसाहारी Utricularia पलटा पौधों के जाल से तरल पदार्थ का संग्रह: दूसरा मामला अध्ययन (Exp द्वितीय; उच्च शिकारी और शिकार बहुतायत के साथ एक प्रणाली, अत्यंत छोटे नमूना मात्रा)
- धीरे पौधों को पानी के नीचे हिला, खेती कंटेनर से हटा दें, और अतिरिक्त पानी को अवशोषित करने के लिए शोषक सामग्री पर उन्हें जगह है। पौधों की मजबूती और जाल के आकार पर निर्भर करता है, 8-10 संयंत्र व्यक्तियों का चयन करें.
- प्रत्येक शूट को ट्रैपिंग अंगों वाले पत्ती नोड्स की गणना करके मोटे तौर पर बराबर भागों में विभाजित करें। प्रत्येक शूट सेगमेंट युवा, मध्यम आयु वर्ग और पुराने जाल का प्रतिनिधित्व करने वाले मिश्रित नमूने एकत्र करने की सेवा करेगा।
- एक peristaltic पंप करने के लिए नमूना संग्रह के लिए एक पतली गिलास केशिका और Eppendorf शीशी संलग्न. जाल खोलने में केशिका टिप डालने के लिए आगे बढ़ें। वैक्यूम पंप का उपयोग करना, प्रत्येक जाल से सभी तरल पदार्थ बाहर चूसना जब तक 900 - जाल तरल पदार्थ के 100 डिग्री एल प्रत्येक जाल आयु वर्ग के लिए एकत्र किया जाता है.
- प्रोटिस्टेन चराई प्रयोगों के लिए जमा जाल तरल पदार्थ के 200 डिग्री सेल्सियस के त्रिफला उप-नमूने का उपयोग करें। धारा 3 में विस्तृत रूप में इन्हें तुरंत संसाधित करें। तरल पदार्थ में रहने वाले माइक्रोबियल घटकों के अन्य सभी विश्लेषणों के लिए नमूने के शेष $300 $L को सुरक्षित रखें, जैसा कि नीचे विस्तृत (अनुभाग 2)।
- अनुभाग 2 के लिए तुरंत आगे बढ़ें।
2. एकत्र नमूनों का निर्धारण
- Exp I और II: जीवाणु गणन के लिए पानी/ट्रैप तरल उप-नमूने ठीक करें (खंड 4; लगभग 20 एमएल और 0.3 एमएल, क्रमशः) को 2% अंतिम मात्रा प्राप्त करने के लिए कम से कम 1 h के लिए फॉर्मेल्डिहाइड के साथ: प्रत्येक नमूने में मात्रा एकाग्रता।
नोट: धूआं हुड में विशेष रूप से formaldehyde संभाल, और नमूने जोड़ तोड़ करते समय हर समय दस्ताने पहनते हैं।
3. नमूना निस्पंदन
- नमूना कमजोर पड़ने (Exp I): जलाशय के पानी के नमूनों के लिए कोई कमजोर पड़ने की आवश्यकता नहीं है। (Exp II): एपिफ्लोरेसेंस माइक्रोस्कोपी के माध्यम से गणना करने से पहले फिल्टर सतहों पर लक्ष्य रोगाणुओं के एक उपयुक्त वितरण को प्राप्त करने के लिए कण-मुक्त एमक्यू पानी के साथ ट्रैप तरल नमूना 10x-100x को पतला करें।
- जलाशय के पानी के 1-2 एमएल (एक्सप I) को फ़िल्टर करें या एक निस्पंदन कीप (25 मिमी व्यास) का उपयोग करते हुए, काले 0.2 मीटर pores-आकार फिल्टर पर जीवाणु गिनती के लिए ट्रैप तरल पदार्थ के उप-नमूना के 1-2 एमएल (एक्सप I) को फ़िल्टर करें।
- 4 मिनट के लिए डीएपीआई (4',6-diamidino-2'-फेनिलिनोल डाइहाइड्रोक्लोराइड, 0.2% अंतिम एकाग्रता) के साथ फिल्टर दाग।
नोट: त्वचा और काम कर रहे सतह संदूषण से बचें, और दस्ताने पहनते हैं। - एक माइक्रोस्कोप स्लाइड पर विसर्जन तेल की एक बूंद पर केंद्रित रोगाणुओं के साथ फिल्टर प्लेस (फ्लोरोसेंट माइक्रोस्कोपी के लिए)। फिल्टर के केंद्र पर एक और तेल ड्रॉप प्लेस और एक coverslip के साथ कवर, सुनिश्चित करें कि तेल समान रूप से वितरित किया जाता है.
- इस बिंदु पर, अधिमानतः तुरंत नमूने की प्रक्रिया, या वैकल्पिक रूप से, उन्हें फ्रीजर में स्टोर (-20 डिग्री सेल्सियस) आगे विश्लेषण तक महीनों के लिए कई हफ्तों के लिए.
4. फिल्टर पर जीवाणु संख्या की गणना
- एपिफ्लोरेसी माइक्रोस्कोप के नीचे स्लाइड रखें (फ्लोरोक्रोम डीएपीआई के लिए इसी फिल्टर सेट के साथ)। एक नेत्र में से एक में एक 10 x 10 गिनती ग्रिड रखें. स्लाइड को यादृच्छिक स्थिति पर ले जाएँ.
- गिनती ग्रिड के क्षेत्र में जीवाणु कोशिकाओं (नीले फ्लोरोसेंट) मात्रा (आवर्धन 1000x के तहत)। गिनती में, गिनती ग्रिड के बाएँ और ऊपरी किनारों को पार करने वाली कोशिकाओं को शामिल करें, जबकि दाएं और निचले किनारों पर स्थित लोगों को छोड़कर।
- एक और यादृच्छिक स्थिति में ले जाएँ और कम से कम 10-15 गिनती ग्रिड पर गणना दोहराने, कुल में गिना 500 कोशिकाओं की राशि.
- किसी दिए गए सूक्ष्मदर्शी और आवर्धन के लिए एक रूपांतरण कारक की स्थापना, फिल्टर के कुल प्रभावी निस्पंदन क्षेत्र के लिए एक ग्रिड के क्षेत्र के अनुपात के ज्ञान के आधार पर. फिर, गिना ग्रिड की संख्या से गिना कोशिकाओं की कुल संख्या विभाजित, प्रति ग्रिड बैक्टीरिया की एक औसत संख्या उपज.
- स्थापित रूपांतरण कारक द्वारा बाद पैरामीटर गुणा और एक नमूना के प्रति एमएल जिसके परिणामस्वरूप संख्या सामान्यीकृत (प्रति एमएल कुल जीवाणु बहुतायत प्राप्त करने के लिए नमूना की मात्रा के आधार पर)।
5. प्रोटिस्टन बहुतायत का निर्धारण
- पानी का नमूना (Exp I) या जाल तरल पदार्थ (Exp II) या तो glutaraldehyde के साथ subsamples (1% अंतिम एकाग्रता, क्लोरोफिल युक्त कणों की उपस्थिति के साथ नमूने के लिए अधिक उपयुक्त निर्धारण के बाद सप्ताह के लिए दिन संसाधित किया जा करने के लिए) या का उपयोग formol-thiosulfate decolorization तकनीक नीचे निर्दिष्ट.
नोट: दोनों संरक्षण तकनीकprotists8के खाद्य धानी से ingested सामग्री के egestion को रोकने के. - Formol-thiosulfate decolorization तकनीक के संबंध में, पानी/ट्रैप तरल उप-प्रतिदर्श (एक्सपी I/Exp II, क्रमशः) के 20 एमएल/200 डिग्री एल में लुगोल के समाधान के 100 $L/1 डिग्री एल जोड़ें।
- बोरेट-बफर फॉर्मेलिन के 0.5 एमएल/50 एल के अतिरिक्त तुरंत अनुसरण करें, फिर 3% सोडियम थायोसल्फेट (एक्सप I/एक्सप II, क्रमशः) के 20 $L/2 L का पालन करें।
नोट: सोडियम थायोसल्फेट लुगोल के पीले रंग को डिकेरेजाइज करता है ताकि एपिफ्लोरेसी माइक्रोस्कोप 8 के तहत कोशिकाओं का अवलोकनकिया जा सके। - 1 डिग्री मीटर pores-आकार काले पॉली कार्बोनेट फिल्टर पर नमूना (लक्ष्य protists की संख्या पर निर्भर करता है) की एक ज्ञात मात्रा फ़िल्टर करें।
- प्रोटिस्ट प्रजातियों की संख्या का अनुमान है आवर्धन 600x के तहत कम से कम 200 कोशिकाओं की गिनती द्वारा गिनती ग्रिड का उपयोग कर (ऊपर देखें).
- लगभग 2 एमएल करने के लिए कम वैक्यूम द्वारा निस्पंदन कीप में एक वैक्यूम के तहत नमूने की मात्रा को कम करें। फिर, दबाव के तहत जारी है और 2 मिनट के लिए DAPI फ्लोरोक्रोम (4',6-diamidino-2-फेनिलिन्डोल dihydroide13, 0.2% अंतिम एकाग्रता) जोड़ें।
6. प्लवक नमूनों में ciliates के समुदाय संरचना का निर्धारण
नोट: मीठे पानी के आवास में सिलिएट समुदाय अत्यधिक विविध14,15,16 ,18, और उनके सूक्ष्म दृढ़ संकल्प चुनौतीपूर्ण है. पक्ष्माभी समूहों को क्रियात्मकसमाजों मेंसॉर्ट करना 10,14,16,17 विभिन्न पक्ष्माभी समूहों के अधिक विस्तृत विश्लेषण के लिए पेलाजिक जीवाणु के रूप में अनुमति देता है।
- निम्नलिखित के संयोजन से पक्ष्माइन समुदाय संरचना का मूल्यांकन करें:
- एपिफ्लोरेसेंस माइक्रोस्कोपी में डीएपीआई-सनाहुआ नमूने (विभिन्न आकारों और आकृति विज्ञान के मैक्रो- और सूक्ष्म न्यूक्लिय के उज्ज्वल फ्लोरोसेंट के साथ ciliate कोशिकाओं को स्थानीयकृत करने के लिए) फ्लोरोसेंट लेबल बैक्टीरिया के तेज के साथ संयुक्त (FLB8; विवरण के लिए, नीचे देखें), बैक्टीरिया पर फ़ीड करने के लिए ciliates की क्षमता पर नज़र रखने.
- चयनित मामलों में लाइव नमूना अवलोकन17,19. विभिन्न वर्गीकरण श्रेणियों में पक्ष्माभों को समूहीकृत करने के लिए उपयोग किए जाने वाले उपरोक्त उप-पहुँचओं और मानदंडों के अधिक विवरण के लिए, पिछले प्रकाशन16,17देखें.
नोट: उद्धृत अध्ययनों से पता चला है कि पक्ष्माभियों में, स्टिकोट्राइकिया (जेनेरा हैलटेरिया और पेलागोहल्रिया) और ओलिगोट्राइकिया (नामत: रिमोस्टरोमबिडियम एसपी) से सर्वाहारी प्रजातियां सबसे महत्वपूर्ण पेलैजिक उपभोक्ता हैं। अधिकांश मीठे पानी में जीवाणुप्लवक10,17,18.
7. अनुमान पक्ष्माभी चराई दर
- अनुरेखक की औसत संख्या में परिवर्तन के आधार पर बैक्टीरिया पर ciliates की तेजी दरों की गणना [यानी, FLB8 प्रति ciliate ऊष्मायन के समय से संबंधित (5-15 मिनट)] और FLB की अनुरेखक राशि जोड़ा, कुल बैक्टीरिया के 5%-15% के लिए सबसे अधिक लेखांकन.
- विभिन्न protistan प्रजातियों के बीच तेजी दरों की तुलना करने के लिए, प्रति घंटे ciliate प्रति बैक्टीरिया की संख्या के रूप में तेजी दर ों सामान्य, वास्तविक ऊष्मायन समय और अनुरेखक FLB के अनुपात के आधार पर गणना के साथ जोड़ा.
नोट: प्राकृतिक नमूनों में कोशिका या प्रजातियों-विशिष्ट और थोक जीवाणु दर दोनों का अनुमान लगाने के लिए FLB विधि अनुप्रयोग की सामान्य योजना चित्र 1 में दर्शायागया है। - एक मीठे पानी के वातावरण के लिए स्वदेशी जीवाणु उपभेदों से FLB की तैयारी8
- एक उपयुक्त आकार (मतलब कोशिका मात्रा ] एमसीवी) और बैक्टीरिया की आकृति विज्ञान का चयन करें ताकि वे प्रभावी रूप से जांच की जा रही जलीय प्रणाली में बैक्टीरियोप्लैंकटन/बैक्टीरिया कोशिकाओं के विशिष्ट आकार की नकल कर सकें।
नोट: एक्सप I के लिए, लिमोबिफाटन और पॉलीन्यूक्लिओबैक्टर के अध्ययन स्थान से अलग-अलग उपभेदों का मिश्रण इस्तेमाल किया गया था (यानी, झीलों और तालाबों में विशिष्ट, अत्यधिक प्रचुर मात्रा में बैक्टीरियोप्लैंकटन)20। आकारिकी और उपभेदों के आकार के बारे में विवरण के लिए, पिछले प्रकाशनों3,17,18,21देखें . - जल्दी स्थिर चरण में 15 मिनट के लिए सेंट्रीफ्यूगेशन (5,000 x ग्राम) द्वारा संस्कृति से जीवाणु कोशिकाओं को फसलन और उन्हें एक संख्यात्मक अनुपात में मिलाएं जो एमसीवी की पैदावार करता है - चयनित स्थान पर बैक्टीरिया के विशिष्ट एमसीवी के अनुरूप मिश्रण में कोशिकाओं की एसडी।
- फॉस्फेट-बफर नमकीन के 10 एमएल में छर्रों को निलंबित करें (पीबीएस; पीएच जेड 9)।
- जोड़ें 2 मिलीग्राम पीले-हरे fluorescing डाई 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (डीटीएएफ, प्रोटीन के लिए बांधता है) फॉस्फेट-सेलिन बफर में सेल निलंबन के लिए, और 2 एच के लिए एक 60 डिग्री सेल्सियस पानी के स्नान में इनक्यूबे।
- ऊष्मायन के बाद, कोशिकाओं को नीचे अपकेंद्रण करें, डीटीएएफ समाधान को कम करें, और पीबीएस के साथ धोने और अपकेंद्रित्र 3x।
- अंतिम धोने के बाद, पीपीi-saline बफर के 20 एमएल में कोशिकाओं को फिर से निलंबित.
- 2 एमएल क्रायो-विज़ल्स में FLB निलंबन और पिपेट 1.5 एमएल एलिकोट्स भंवर, फिर उपयोग होने तक पीपीi-saline बफर में (-20 डिग्री सेल्सियस) जमे हुए रखें।
- अगले चरण में उपयोग के लिए 0.2 मीटर पॉलीकार्बोनेट फ़िल्टर के माध्यम से प्री-फिल्टर पीपीi-saline बफर.
- FLB एकाग्रता निर्धारित करने के लिए, कण मुक्त पीपीi-saline बफर के 2 एमएल करने के लिए एक छोटे से alicot हस्तांतरण, कई 2 s फटने के लिए 30 डब्ल्यू पर sonicate, और 0.2 पर फिल्टर 0.2 डिग्री पॉली कार्बोनेट ब्लैक फिल्टर epifluorscence के माध्यम से गणना के लिए माइक्रोस्कोपी (1,000X आवर्धन) डीटीएएफ के लिए ऑप्टिकल फिल्टर सेटिंग्स के तहत (448 एनएम/
- एक उपयुक्त आकार (मतलब कोशिका मात्रा ] एमसीवी) और बैक्टीरिया की आकृति विज्ञान का चयन करें ताकि वे प्रभावी रूप से जांच की जा रही जलीय प्रणाली में बैक्टीरियोप्लैंकटन/बैक्टीरिया कोशिकाओं के विशिष्ट आकार की नकल कर सकें।
- पक्ष्माभी जीवाणु के आकलन के लिए अनुरेखक तकनीक
- प्राकृतिक प्लैंक्टोनिक आवासों में प्रयोगों को चराने के लिए, 300 एमएल नमूनों को अच्छी तरह से रस्में तने हुए 1 एल फ्लास्क में वितरित करें और 15 मिनट के लिए सीटू तापमान पर इनक्यूबेट करें (प्रोटिस्टों को हैंडलिंग सदमे से उबरने की अनुमति देने के लिए)।
- कुल बैक्टीरिया का 5%-15% का गठन करने के लिए FLB ट्रेसर जोड़ें, मौसम और पानी के तापमान के आधार पर जोड़ा मात्रा के साथ।
नोट: वहाँ एक बहुत व्यापक है, पक्ष्माभ प्रजातियों में मौसम पर निर्भर स्पेक्ट्रम-विशिष्ट तेज दर परिमाण के कई आदेश फैले (यानी, से 101-104 बैक्टीरिया ciliate-1 प्रति घंटा)10,16, 17,18,22,23,24. - उच्च तेज दरों के साथ ciliates की बढ़ी हुई घटना की अवधि में (आमतौर पर गर्मियों के दौरान), यह भी बहुत कम FLB परिवर्धन के साथ एक समानांतर ऊष्मायन चलाने के लिए, कुल बैक्टीरिया का केवल 2%-4% का गठन ट्रेसर FLB द्वारा ciliate धानी की अत्यधिक लोडिंग से बचने के लिए (देखें चित्र 2में उदाहरण ।
- 5-15 मिनट के लिए FLB के साथ इनक्यूबेट ciliate / प्लवक नमूने।
- प्रोटिस्ट8के खाद्य धानी से खाने वाली सामग्री के उत्सर्जन को रोकने के लिए नमूना निर्धारण की दो संभावनाएं हैं . 1% ग्लूटारैल्डिहाइड (अंतिम सांद्रता जो क्लोरोफिल युक्त कणों, जैसे शैवाल के साथ नमूनों के लिए अधिक उपयुक्त है) के अलावा ऊष्मायन को समाप्त करें। वैकल्पिक रूप से, लुगोल के विलयन के 100 डिग्री सेल्सियल/10 डिग्री सेल्सियस का उपयोग 20 एमएल/200 डिग्री सेल्सियस जल/ट्रैप तरल उप-नमूना में करें, इसके तुरंत बाद इसके बाद बोरेट-बफर्ड फॉर्मेलिन के 0.5 एमएल/10 एल/2 एल 3% सोडियम थायोसल्फेट (एक्सप आई/एक्सप II) का उपयोग करें।
- स्थिर जोड़ने के बाद, नमूनों को 4 डिग्री सेल्सियस पर अंधेरे में कम से कम 1 एच के लिए आराम करने दें ताकि पक्ष्माभ कोशिकाओं का पूरी तरह से संरक्षण सुनिश्चित किया जा सके।
- प्राकृतिक प्लवक उप-नमूने 4-30 एमएल/10-30 डिग्री सेल्सियस (एक्सप I/एक्सप II, क्रमशः; मात्रा पक्ष्माच बहुतायत पर निर्भर करती है) और डीएपीआई के साथ दाग (अंतिम सांद्रता 0.2% wt/vol; विवरण के लिए, ऊपर चरण 3.2 देखें)।
- 1 डिग्री मीटर काले फिल्टर के माध्यम से गुजरती हैं और पक्ष्माभ (600x आवर्धन) गिनती करने के लिए एपिफ्लोरेसी माइक्रोस्कोपी के माध्यम से निरीक्षण और FLB ट्रेसर की संख्या ingested की संख्या की गणना (ज्यादातर 1000x आवर्धन पर) के रूप में पिछले प्रकाशनों में विस्तृत के रूप में2,17 . संरक्षण के बाद 7 दिनों के भीतर नमूनों का निरीक्षण करें।
- कुल प्रोटोजोअन/जाति-विशिष्ट चराई का अनुमान लगाने के लिए, सभी पक्ष्माभीों की औसत तेज दरों, या केवल पक्ष्माभी प्रजातियों की वृद्धि करना जो कि सीटू बहुतायत में पता चलता है।
- $mov जल जलाशय से situ डेटा से प्रति-सेल तेज दरों की गणना का उदाहरण इस प्रकार है:
- मान लें कि जीवाणु सांद्रता 3.55 x 106 बैक्टीरिया/एमएल और ट्रेसर FLB जोड़ा गया है 0.25 x 106 FLB/mL, जो कुल जीवाणु कणों की 3.8 x 106 बैक्टीरिया /एमएल की राशि पैदावार (प्राकृतिक बैक्टीरिया + FLB $ 100% शिकार कणों की) प्राकृतिक नमूने में फागोट्रोफिक प्रोटिस्ट के लिए उपलब्ध है।
नोट: FLB अनुरेखक इस प्रकार कुल जीवाणु कणों की 6.58% (0.25/0.038 की एक परियोजना) का प्रतिनिधित्व करते हैं. 5 मिनट की इनक्यूबेशन में हैलटेरिया एसपी में FLB की औसत संख्या 6.2 FLB है। - प्रति घंटे तेज उठाने को सामान्य करने के लिए, निम्न गणना का उपयोग करें: (6.2 x 12)/(6.58/100) - 1131 बैक्टीरिया प्रति Halteria सेल/
नोट: चर पानी के तापमान के तहत पाया Halteria sp. के व्यक्तिगत तेज दरों के वितरण के अधिक उदाहरण के लिए, ट्रेसर FLB की मात्रा (प्रतिशत के रूप में) जोड़ा गया, और FLB के साथ विभिन्न ऊष्मायन समय, चित्र 3देखें।
- मान लें कि जीवाणु सांद्रता 3.55 x 106 बैक्टीरिया/एमएल और ट्रेसर FLB जोड़ा गया है 0.25 x 106 FLB/mL, जो कुल जीवाणु कणों की 3.8 x 106 बैक्टीरिया /एमएल की राशि पैदावार (प्राकृतिक बैक्टीरिया + FLB $ 100% शिकार कणों की) प्राकृतिक नमूने में फागोट्रोफिक प्रोटिस्ट के लिए उपलब्ध है।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
उदाहरण के प्रयोग मैं में चलाया गया था $mov जल जलाशय (दक्षिण बोहेमिया, सीजेड), जो कम प्राकृतिक के साथ एक प्राकृतिक साइट है situ शिकारी और शिकार बहुतायत में. प्रतिनिधि डेटा सर्वभक्षी पक्षीय प्रजातियों Halteria grandinellaके लिए सूचना दी है, जो पिकोप्लैंकटन (और lt;2 m) कणों10,16,17,18 की एक प्रचुर मात्रा में और कुशल grazer है ,22. चित्र 3 से पता चलता है बॉक्स-और-व्हिसर प्लाटों की संख्या FLB की संख्या है Halteria sp. से $mov जलाशय (चित्र 3ए), जो प्रति घंटे जीवाणु तेज की दरों के लिए recalculated किया गया था (चित्र 3ख) अप्रैल, मई, अगस्त और सितंबर में किए गए चार अलग-अलग प्रयोगों में पता चला। वहाँ ciliate तेज दरों में उच्च परिवर्तनशीलता थी, मोटे तौर पर पानी के तापमान में अस्थायी मतभेद के कारण.
यह ध्यान दिया जाना चाहिए कि क्यू10 पैरामीटर इस तथ्य को दर्शाता है कि माइक्रोबियल प्रक्रियाएं 10 डिग्री सेल्सियस12के तापमान में वृद्धि के साथ लगभग 2.5x तेजी से चलरही हैं , जो बैक्टीरिया पर पक्षीय तेज दरों के लिए भी रखती है। इस शारीरिक नियम को ध्यान में रखते हुए, FLB और ऊष्मायन समय के काफी अलग अनुपात का उपयोग विभिन्न मौसमों के लिए किया गया था (विवरण के लिए, चित्र 3एदेखें)। इस प्रकार, अपेक्षित तापमान प्रभाव के लिए मुआवजा दिया गया था, और प्रयोगात्मक सेटिंग अनुकूलित औसत और तेजी दरों के औसत मूल्यों लगभग 5-10 FLB प्रति ciliate सेल के बीच मिले. आम तौर पर, ingested FLB की इन मात्रा ओंठी की इन मात्रा आसानी से गणनीय हैं (चित्र 2में उदाहरण देखें , दो बाएँ तस्वीरें), अनुरेखक के सटीक अनुमान पैदा (ज्यादातर के बीच जा रहा है 1-15 FLB प्रति ciliate) तेज दर. हालांकि, संशोधित FLB अनुरेखक के कारण जोड़ा (%) और नमूना ऊष्मायन के विभिन्न समय निरपेक्ष मानों (प्रति घंटे बैक्टीरिया grazed ciliate की संख्या के रूप में व्यक्त) काफी भिन्न (पी एंड एलटी; 0.01, Kruskal-Wallis परीक्षण; डन के बहु-तुलना परीक्षण के बाद, p और lt; 0.05; चित्रा में उदाहरण देखें 3B) प्रयोगों के बीच. यह आंकड़ा हाल्टेरिया ग्रान्डिनेलाकी प्लेन्टोनिक आबादी में पूर्ण जीवाणुवरी दरों में विशिष्ट प्राकृतिक परिवर्तनशीलता को भी दर्शाता है, जो उनके माध्य और मध्यम मूल्यों के निकट मिलान के साथ होता है (चित्र 3) ।
नमूनों में अत्यधिक कुशल बैक्टीरियोरस पक्षीय पक्षीय की उपस्थिति में, जैसे पेरिट्रिचस पक्षीय, वे कुल बैक्टीरिया के 5%-10% की विशिष्ट अनुरेखक मात्रा में FLB द्वारा भारी "ओवर-लेबल" बन सकते हैं (चित्रा 2में दाईं ओर फोटोग्राफ देखें)। यह दृढ़ता से ingested FLB की सटीक परिमाणीकरण सीमित हो सकता है. ऐसे मामलों में, यह केवल FLB की कम मात्रा के साथ अतिरिक्त समानांतर ऊष्मायन चलाने के लिए सुझाव दिया है कुल बैक्टीरिया का केवल 1.5%-3% के लिए लेखांकन. तथापि, सामान्यतः अनुरेखक मात्रा के साथ-साथ ऊष्मायन समय को प्रति सेल FLB की संख्या को अनुकूलित करने के लिए हेरफेर किया जा सकता है (चित्र 2)।
उदाहरण प्रयोग II:प्रदर्शित बड़े शिकारी और शिकार बहुतायत के साथ एक प्रणाली से डेटा है, जहां केवल एक अत्यंत छोटे नमूना मात्रा ciliate Tetrahymena utriculariae के बैक्टीरियोरी दरों का अनुमान करने के लिए प्रयोगात्मक रूप से उपलब्ध है 25. यह एक मध्यम जीवाणु चरक है जो विशेष रूप से मांसाहारी उट्रिकुलेरिया रिफ्लेक्स पौधों26,27के जाल में उच्च बहुतायत में रहता है . चित्र 4 विभिन्न प्रायोगिक सेटिंग्स के अंतर्गत टी यूट्रिकुलेरिया के प्रति सेल FLB की संख्या के बॉक्स-और-व्हिकर प्लॉट्स (चित्र 4A,B) जिसे प्रति घंटे जीवाणु तेज की दरों में पुनः परिकलित किया जाता है (चित्र 4 4 सी, डी) युवा, परिपक्व, और पुराने जाल में पाया. जाल में दिलचस्प है, ciliate टी utriculariae के क्लोरोप्लास्ट असर आबादी का पता चला, जबकि टी utriculariae के apochloric आबादी जाल से अलग कर रहे थे और मिश्रित जीवाणु निलंबन पर बढ़ रहा है पर बनाए रखा अंधेरे में गेहूं के दाने (विवरण के लिए, पिछले प्रकाशन26में चित्र 1 देखें)।
क्लोरोप्लास्ट असर आबादी प्रकाश रोशन जाल में रहते हैं; इस प्रकार, क्लोरोप्लास्ट पक्ष्माभी परिमंडल को एक अतिरिक्त कार्बनिक कार्बन स्रोत और ऑक्सीजन प्रदान कर सकते हैं। एक hypotheses परीक्षण किया गया था कि apochloric ciliate आबादी काफी तेजी से बैक्टीरिया grazed, के रूप में बैक्टीरिया ciliate के अंधेरे विकसित अलग subpopulations के लिए उपलब्ध कार्बनिक कार्बन का केवल कण स्रोत का प्रतिनिधित्व करते हैं.
वास्तव में, जबकि यूट्रिकुलेरिया रिफ्लेक्सा के युवा, परिपक्व और पुराने जाल में रहने वाले पक्ष्माभियों की जीवाणु दरों में कोई महत्वपूर्ण अंतर नहीं था (चित्र 4ए, सी), टी यूट्रिकुलेरिया की एपोक्लोरिक आबादी चरित बैक्टीरिया काफी (पी एंड एलटी; 0.01, Kruskal-Wallis परीक्षण; डन के बहु-तुलना परीक्षण, पी एंड एलटी; 0.05) के बाद, लगभग 3x युवा, परिपक्व, और पुराने जाल में रहने वाले क्लोरोप्लास्ट असर ciliates की तुलना में तेजी से (चित्र 4सी, डी) ध्यान दें कि फिर से, दोनों अनुरेखक मात्रा के साथ ही ऊष्मायन समय (चित्र 4ए, बी,शीर्ष) प्रति सेल FLB की संख्या का अनुकूलन करने के लिए संशोधित किया गया (आम तौर पर 1-15 के बीच), औसत और औसत मूल्यों के साथ चारों ओर 5 FLB / इन नंबरों ciliate खाद्य धानी में भेद कर रहे हैं और सही अनुरेखक गिनती की अनुमति दी. हालांकि, प्रति घंटे grazed बैक्टीरिया की पूर्ण संख्या में व्यक्त, क्लोरोप्लास्ट असर और apochloric आबादी क्रमशः लगभग 350 और 1,000 बैक्टीरिया ciliate प्रति घंटे, grazed. इस प्रयोगात्मक सेट अप आश्चर्यजनक रूप से विभिन्न पर्यावरणीय बाधाओं के तहत रहने वाले एक ही ciliate प्रजातियों के दो अलग subpopulations के चयापचय और शारीरिक लक्षण में नई अंतर्दृष्टि लाया25,26, 27.
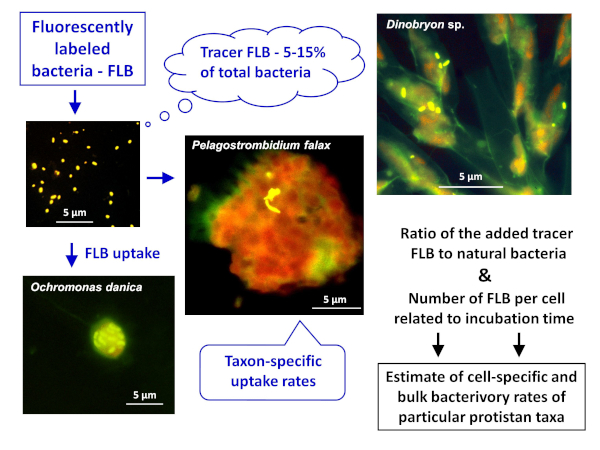
चित्र 1 : नमूने में प्राकृतिक बैक्टीरिया की कुल संख्या के लिए inested अनुरेखक FLB के अनुपात से सेल और प्रजातियों-विशिष्ट चराई दरों का अनुमान लगाने के लिए फ्लोरोसेंट लेबल बैक्टीरिया (FLB) का उपयोग करने का कार्यप्रवाह। अधिक विवरण के लिए, प्रोटोकॉल के अनुभाग 7 देखें. कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 2 : यूट्रॉफिक फिशपॉन्ड के प्लवक से पक्ष्माभी कोशिकाओं के उदाहरण। उदाहरण पक्ष्माभी कोशिकाओं में गणनीय FLB के साथ तालाब से दिखाए जाते हैं (आम तौर पर 1-10 अनुरेखक FLB प्रति सेल, बाएँ दो microphotograps) एक peritrichous ciliate Pelagovorticella natans (सही पक्ष microphotograph) की तुलना में. यहां तक कि एक छोटी, 5 मिनट ऊष्मायन अवधि के दौरान, यह ट्रेसर FLB द्वारा "ओवर-लेबल" बन गया, जिससे ingested FLB की मात्रा गलत या लगभगअसंभव हो गई। इस मामले में, यह ट्रेसर राशि को कम करने के लिए सुझाव दिया है 1.5%-3% कुल बैक्टीरिया का. हालांकि, आम तौर पर दोनों अनुरेखक मात्रा और ऊष्मायन समय प्रति सेल ingested FLB की संख्या का अनुकूलन करने के लिए हेरफेर किया जा सकता है। अधिक विवरण के लिए, प्रोटोकॉल के अनुभाग 7 देखें. कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 3 : हलटेरिया एसपी के प्रति सेल FLB की संख्या के बॉक्स और-व्हिकर प्लॉट्स , जो कि प्रति घंटे (बी) जीवाणु तेज की दरों के लिए पुनर्परिकलित किए जाते हैं। डेटा विभिन्न मौसमी सेटिंग्स के तहत पाया गया, अप्रैल से सितंबर तक चार उदाहरण द्वारा प्रतिनिधित्व किया. पैनल ए के शीर्ष पानी के तापमान के बारे में जानकारी से पता चलता है, विभिन्न FLB अनुरेखक जोड़ा (%), और नमूना ऊष्मायन के विभिन्न समय. यह ध्यान दिया जाना चाहिए कि बाद के दो मापदंडों को प्रति कोशिकाओं FLB की संख्या का अनुकूलन करने के लिए संशोधित किया जा सकता है, औसत (पूर्ण रेखा) और औसत (डैश्ड लाइन) मान ों के बीच लगभग 5-10 FLB प्रति ciliate सेल(A). सलाखों के सभी डेटा (50-180 कोशिकाओं का निरीक्षण) के 25 वें और 75 प्रतिशत दिखाने के लिए और मूंछ 1 और 99 प्रतिशत के लिए खड़े हो जाओ. (छ)विभिन्न छोटे अक्षर अध्ययन अवधि के दौरान हलटेरिया एसपी की कोशिका-विशिष्ट जीवाणु दरों में महत्वपूर्ण अंतर दर्शाते हैं। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 4 : बॉक्स और सेल प्रति FLB की संख्या के whisker भूखंडों. प्लॉट्स को क्लोरोप्लास्ट-धारी टेट्राहाइमेना यूट्रिकुलेरिया के युवा, परिपक्व, और यूट्रिकुलेरिया रिफ्लेक्सा (एक्सपी II)(ए)के पुराने जालों से दिखाया गया है , जो प्रति घंटे जीवाणु तेज की दरों के लिए पुन: गणना की जाती है। इन आंकड़ों की तुलना टी यूट्रिकुलेरिया (बी, डी)की डुप्लिकेट एपोक्लोरिक आबादी की जीवाणु वृद्धि दरों की तुलना में की गई थी, लेकिन अंधेरे में गेहूं के अनाज पर बढ़ते मिश्रित जीवाणु निलंबन पर बनाए रखा गया था। पैनल ए और बी के शीर्ष पर, विभिन्न FLB अनुरेखक जोड़ा (%) और नमूना ऊष्मायन के विभिन्न समय दिखाए जाते हैं। यह ध्यान दिया जाना चाहिए कि बाद के दो मापदंडों को प्रति कोशिकाओं FLB की संख्या का अनुकूलन करने के लिए संशोधित किया गया था, औसत (पूर्ण रेखा) और औसत (डैश्ड लाइन) मान ों के साथ लगभग 5-10 FLB प्रति ciliate सेल(ए, बी)। सलाखों के सभी डेटा (50-100 कोशिकाओं का निरीक्षण किया) के 5 वीं और 95 प्रतिशत दिखाने के लिए, और मूंछ 1 और 99 प्रतिशत के लिए खड़े हो जाओ. कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
जलीय प्रणालियों में ट्राफिक अन्योन्यक्रिया को परिभाषित करना हमेशा28को चुनौती देता है, विशेष रूप से नैनो प्लवक तराजू पर जिसमें प्रोटिस्ट और उनके शिकार, बैक्टीरिया शामिल होते हैं। जब यह पोषक तत्व तेज रास्ते और परिमाणीकरण की बात आती है, तरीकों के आवेदन सफलतापूर्वक उच्च पोषी स्तर पर इस्तेमाल किया, जैविक बातचीत की उच्च जटिलता के कारण कम संभव है. इनमें शामिल हैं, उदाहरण के लिए, स्थिर आइसोटोप लेबलिंग दृष्टिकोण. इस प्रोटोकॉल को ट्रैक करने के लिए एक अनुरेखक के रूप में एपिफ्लोरेसेंस माइक्रोस्कोपी और फ्लोरोसेंट लेबल बैक्टीरिया का उपयोग करने के फायदे से पता चलता है और अर्द्ध मात्रा में कार्बन प्रवाह (बैक्टीरियल शिकार: विभिन्न प्रोटिस्टान grazers सहित मिश्रणोट्रोफिक grazers29) माइक्रोबियल खाद्य जाले के आधार के माध्यम से रास्ते. ऐसा ही एक लाभ एकल सेल दृष्टिकोण के उच्च सटीकता है, और अन्य grazer समुदाय संरचना के बारे में अभूतपूर्व संकल्प है और विभिन्न कार्यात्मक guilds, प्रजातियों (Exp I) के बीच भेद, और यहां तक कि एक ही subpopulations प्रजातियों (एक्सप द्वितीय)।
प्रोटोकॉल में महत्वपूर्ण कदम
प्रोटोकॉल में कई महत्वपूर्ण कदम हैं, जो यह सुनिश्चित कर सकते हैं कि पद्धति के लाभ अपनी पूरी क्षमता के लिए उपयोग किए जाते हैं। सबसे पहले, प्रयोग के प्रारंभ से पहले अध्ययन किए गए पर्यावरण की बुनियादी समझ हमेशा फायदेमंद होती है। यह विविधता और संभावित grazers वर्तमान की बहुतायत की सूक्ष्म स्क्रीनिंग भी शामिल है, जीवाणु शिकार आकार, और शिकार वितरण दोनों 1) पानी स्तंभ में (जैसे, epilimnion से hypolimnion के लिए एक ऊर्ध्वाधर प्रोफ़ाइल) और 2) के मामले में घाटी के आकार के जलाशयों, बांध-प्रवाह ट्रांसेक्ट पर। दूसरा, एकत्र नमूनों के साथ सावधान हेरफेर प्रतिनिधि परिणाम सुनिश्चित करेगा. ताप एक अत्यंत महत्वपूर्ण कारक है जो सर्वाधिक माइक्रोबियल प्रक्रियाओंकोप्रभावित करता है , जिसमें प्रोटिस्ट चराई दर भी शामिल है (चित्र 3) .
तीसरा, नमूने में जीवाणु कोशिकाओं या ग्रेजर के प्रकार के परिमाणीकरण के आधार पर जोड़े गए ट्रेसर की मात्रा में हेरफेर करने से यह सुनिश्चित होगा कि अधिक लेबल के साथ समस्याओं को समाप्त कर दिया जाता है (चित्र 2) । यह ध्यान दिया जाना चाहिए कि ciliate प्रजातियों में एक बहुत व्यापक स्पेक्ट्रम है-विशिष्ट तेज दरों (विवरण के लिए, चरण 7.2 देखें); इस प्रकार, प्रोटोकॉल को उचित रूप से लागू करने के लिए, उनके समय-पाठ्यक्रम तेज दरों के साथ प्रमुख पक्ष्माभ प्रजातियों का पूर्व ज्ञान आवश्यक है। यह दृढ़ता से विभिन्न अनुरेखक मात्रा के साथ प्रारंभिक प्रयोगों को चलाने के लिए संभव ciliate के तहत लेबलिंग से बचने के लिए सलाह दी जाती है (कोई नहीं या बहुत कम FLB ciliate सेल प्रति लिया जाता है, सांख्यिकीय unsound डेटा उपज) या अधिक लेबलिंग (FLB की बड़ी संख्या के रूप में प्रकट होता है बनाने "संक्षिप्त FLB बादल" या ट्रेसर द्वारा पैक ciliate खाद्य धानी में झुंड, इस प्रकार गंभीर रूप से उनके सटीक परिमाणीकरण सीमित; चित्र 2में ऊपरी दाएँ उदाहरण देखें। यह भी ध्यान दिया जाना चाहिए कि FLB के साथ ऊष्मायन समय आम तौर पर 30 मिनट से कम होता है, क्योंकि पक्ष्माभ द्वारा पिकोप्लैंकटन का औसत पाचन समय लगभग 1.5 एच है, और पाचन शुरू होता है (इनेस्टपिप्लैंकटन कोशिकाओं ने अपने विशिष्ट आकार और रंग खो दिया है) लगभग के बाद 45-60 मिनट30| इसी तरह, सूक्ष्म देखने से पहले फिल्टर पर नमूनों के इष्टतम कमजोर पड़ने और वितरण सटीक परिणाम के लिए प्राप्त करने की आवश्यकता है।
संशोधन और समस्या निवारण
तकनीक के प्रमुख कदम, संभावित संशोधन और समस्या निवारण संशोधन चित्र 1 और चित्र 2में दर्शाए गए हैं। इसके अतिरिक्त, यह ध्यान दिया जाना चाहिए कि detrital कणों, फाइटोप्लैंकटन कोशिकाओं, या प्लवक में उनकी कालोनियों के उच्च सांद्रता के मामलों में, इस तरह के नमूने 1) इसी तरह एक चरण है जिस पर व्यक्तिगत grazer कोशिकाओं हो सकता है प्राप्त करने के लिए पतला किया जाना चाहिए फिल्टर सतह पर प्रतिष्ठित और 2) खाद्य धानी की सामग्री के परिमाणीकरण के अधीन किया जाना चाहिए.
सीमाओं
इस विधि के सफल अनुप्रयोग के लिए मुख्य सीमा विभिन्न कार्बनिक detritus या संलग्न बैक्टीरिया या मात्रा में समुच्चय के साथ प्रचुर मात्रा में अकार्बनिक / सूक्ष्मदर्शी और एक अनुरेखक राशि का सटीक आकलन जोड़ा गया. यह ध्यान दिया जाना चाहिए कि प्रस्तुत अनुरेखक तकनीक मुख्य रूप से मुक्त (यानी निलंबित) बैक्टीरिया है कि कणों से जुड़े नहीं हैं के साथ काम करता है. हालांकि, हमारे अपने अनुभव और साहित्य संदर्भों के आधार पर (पिछले प्रकाशन2,4,8,10,16,18,21 देखें ,26), प्रस्तुत पद्धति सबसे जलीय वातावरण के लिए उपयुक्त है. दो प्राकृतिक, विषम प्रणालियों के उदाहरण, जो ट्राफिक स्थिति, अपरद सामग्री, और ग्गारर विविधता और संख्याओं में भिन्न होते हैं(चित्र 3 और चित्र 4)।
मौजूदा तरीकों के संबंध में दृष्टिकोण का महत्व
महत्वपूर्ण बात यह है कि जीवाणुजीवी के कर/टैक्सा की बहुतायत के ज्ञान से और उनकी प्रजातियों-विशिष्ट जीवाणु दरों, प्रोटिस्टेन टैक्सॉन (या कुल पक्षीय समुच्चय) की थोक जीवाणु दर की गणना की जा सकती है। यदि यह दृष्टिकोण प्राकृतिक प्लवक वातावरण के लिए संगत रूप से दोनों विषमपोषी ध्वजाऔर पक्षीयों के लिए लागू किया जाता है (बैक्टीरियोप्लैंकटन2,6,7) के प्रमुख grazers का प्रतिनिधित्व करते हुए , प्रोटिस्टेन किसी दिए गए वातावरण में जीवाणु की आबादी के चराई प्रेरित कारोबार समय का अनुमान लगाया जा सकता है16,17,18,22. इस तरह के डेटा माइक्रोबियल खाद्य जाले में कार्बन प्रवाह गतिशीलता के आकलन के लिए मौलिक महत्व रखते हैं।
भविष्य अनुप्रयोगों
अन्य विशिष्ट वातावरण जिसमें इस विधि, कुछ संशोधनों के साथ, सफलतापूर्वक उपयोग किया जा सकता है। इनमें सक्रिय कीचड़ प्रणालियां, रूमेन पारिस्थितिक तंत्र, जलीय तलछट तथा हाइपरट्रॉफिक फिशपोंड17शामिल हैं। हालांकि, इन पोषक तत्वों और रोगाणुओं से भरपूर वातावरण में आवेदन के लिए प्रारंभिक परीक्षणों की आवश्यकता होती है ताकि उचित आकार, आकृति विज्ञान, और अनुरेखक FLB की संख्या के बारे में प्रोटोकॉल का अनुकूलन किया जा सके जो विशिष्ट आकार वितरण और अन्य विशेषताओं की नकल कर सकते हैं पर्यावरण के लिए निहित शिकार बैक्टीरिया की.
वर्तमान में, इस दृष्टिकोण को स्टू हाइब्रिडाइजेशन (कार्ड-फिश) में उत्प्रेरित रिपोर्टर निक्षेपण फ्लोरोसेंट के साथ संयोजित करने में रुचि बढ़ रही है, जिसमें ग्रेजर सेल की पहचान (उदा., विषमपोषी ध्वज) एक विशिष्ट के साथ पाई जाती है। FISH-probe और तेज दर एक ही सूक्ष्म स्लाइड31पर flagellate सेल के खाद्य धानी में FLB सामग्री पर आधारित है. एक परिष्कृत, नए दृष्टिकोण डबल संकरीकरण32 कहा जाता है शिकारी सेल और शिकार बैक्टीरिया के स्तर पर FISH जांच का एक संयोजन है (कि भी एक phylogenetic तनाव, एक जीवाणु वंश विशेष FISH जांच द्वारा विशेष रूप से लेबल कर रहे हैं). दृष्टिकोण सुरुचिपूर्ण है, लेकिन यह भी समय लेने वाली और विशिष्ट कौशल और अनुभव की आवश्यकताहै 31,32,जबकि विभिन्न FLB तेज दृष्टिकोण संशोधनों के आवेदन और अधिक आसानी से प्रयोगशालाओं में नियमित उपयोग के लिए अपनाया जा सकता है.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों को खुलासा करने के लिए कुछ भी नहीं है.
Acknowledgments
इस अध्ययन के अनुसंधान अनुदान के तहत चेक विज्ञान फाउंडेशन द्वारा समर्थित किया गया था 13-00243S और 19-16554S के लिए सम्मानित किया K. और डी एस, क्रमशः. इस अनुच्छेद को भी परियोजना द्वारा समर्थित किया गया था "बायोमैनीपुलेशन बांध जलाशयों की जल गुणवत्ता में सुधार के लिए एक उपकरण के रूप में" (कोई C$.02.1.01/0.0.0/16 $025/0007417), परिचालन कार्यक्रम अनुसंधान, विकास में यूरोपीय क्षेत्रीय विकास कोष द्वारा वित्त पोषित और शिक्षा.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



