Summary
Presentato qui è un protocollo per una tecnica a singola cellula, basata sulla microscopia a epifluorescenza per quantificare i tassi di pascolo negli eucarioti predatori acquatici con alta precisione e risoluzione tassonomica.
Abstract
Chiarire le interazioni trofiche, come la predazione e i suoi effetti, è un compito frequente per molti ricercatori in ecologia. Lo studio delle comunità microbiche ha molte limitazioni, e determinare un predatore, preda, e tassi predatori è spesso difficile. Presentato qui è un metodo ottimizzato basato sull'aggiunta di prede fluorescenti etichettate come tracciante, che consente una quantificazione affidabile dei tassi di pascolo negli eucarioti predatori acquatici e la stima del trasferimento di nutrienti a livelli trofici più elevati.
Introduction
I prokaryote eterotrofici sono una componente biologica chiave nei sistemi acquatici e rappresentano una frazione significativa di plancton biomassa1,2,3. I fattori che controllano la loro abbondanza, diversità e attività sono cruciali per comprendere il loro ruolo nel ciclismo biogeochimico (cioè il destino del carbonio organico e di altri nutrienti e il flusso di energia dai procarioti ai livelli più alti del trofico). Il pascolo protozoo è uno di questi fattori importanti. Bacterivoryo di nanoflagellati e ciliati eterotrofici impone un forte controllo dall'alto verso il basso sull'abbondanza procaritmica, funzione della comunità, struttura, diversità, e anche morfologia cellulare e tasso di crescita di particolari gruppi batterici4, 5,6. In alcuni sistemi, i protisti servono come la principale causa di mortalità batterica6,7.
L'approccio standard utilizzato per valutare il batterio protozoo, che è stato utilizzato da qualche tempo, prevede l'uso di batteri etichettati fluorescentmente (FLB) come analoghi prede e microscopia epifluorescenza. I tassi di assorbimento specifici delle cellule possono essere determinati quantificando il numero di particelle di prede etichettate nei vacuoli alimentari del Prozistan in un corso temporale selezionato8. Questo approccio presenta diversi vantaggi. Tracer viene aggiunto a campioni naturali con assemblaggi di predatori naturali e prede. C'è una manipolazione minima del campione prima dell'incubazione, un'alterazione minima del campione da parte del tracciante FLB aggiunto e i tempi di incubazione sono brevi per garantire risultati sonori ottenuti in condizioni vicine alle condizioni in situ. In alternativa, in ambienti con un basso numero di protisti batteriosi o zooplancton (ad esempio, sistemi marini offshore), i tassi di scomparsa di FLB aggiunti a campioni in quantità basse (2%-3% tracciante) possono essere rilevati tramite citometria di flusso a lungo termine (12-24 h) esperimenti di incubazione. Quindi, i numeri di FLB all'inizio e all'estremità (integrando l'impatto di tutti i batteri) sono quantificati dalla citometria di flusso (per i dettagli, vedi la precedente pubblicazione9). Tuttavia, tale parametro rappresenta solo i tassi totali di bacterivory aggregati che non possono essere direttamente attribuiti a particolari gruppi di pascoli o specie di protistan e zooplancton.
Nel complesso, quantificare con precisione e con significato ecologico i tassi di mortalità batterica specifici delle specie di prozie o del morfotipo nell'ambiente acquatico può essere difficile. Alcuni protisti sono pascoli selettivi, e la dimensione e la forma cellulare del tracciante FLB aggiunto può distorcere i tassi naturali di ingestione delle prede10,11. Inoltre, l'attività e il metabolismo del prozistan sono altamente sensibili alla temperatura12; pertanto, la quantità di tracciante FLB aggiunto deve essere attentamente manipolata per ogni singolo tipo di campione (non solo in base all'abbondanza naturale, alle dimensioni e alla morfologia dei batteri e ai tipi prevalenti di batteri, ma anche sulla temperatura). La maggior parte degli studi si concentrano sull'attività di pascolo del protistan di massa; tuttavia, il batterio di specifiche specie protivazie spesso ha un valore informativo molto più elevato e può essere preferibile. In questo caso, è necessaria la conoscenza tassonomica delle specie protistiche presenti in un campione e la comprensione del loro comportamento. Di conseguenza, sono necessarie notevoli quantità di tempo e manodopera per ottenere risultati sonori su tassi specifici di batterio attribuibili a un particolare gruppo o specie di protistan.
Nonostante queste difficoltà, questo approccio rimane lo strumento più adatto attualmente disponibile per valutare il protivo in ambienti naturali. Presentato qui è un metodo completo e facile da seguire per l'utilizzo di FLB come tracciante negli studi di ecologia microbica acquatica. Tutti gli aspetti problematici menzionati dell'approccio sono presi in considerazione e viene descritto un flusso di lavoro migliorato, con due esperimenti da ambienti contrastanti e specie di ciliato a contrasto come esempi.
Il primo caso di studio è stato condotto in un ambiente epiliminico dal serbatoio di acqua mesotrofica di zmov nella Repubblica Ceca, che mostra abbondanze di pascolo e batteri comparabili alla maggior parte dei corpi d'acqua dolce di superficie (cfr5,7). Il secondo caso di studio è stato condotto nell'ambiente altamente specifico all'interno di trappole della pianta carnivora acquatica Utricularia reflexa, che ospita un numero estremamente elevato di entrambi i ciliati mixotrofici al pascolo (Tetrahymena utriculariae) cellule batteriche. Vengono mostrati i calcoli dei tassi di pascolo specifici delle cellule e delle scorte permanenti batteriche in entrambi i tipi di campione. Viene quindi discussa una serie di interpretazioni ecologiche dei risultati e vengono infine suggeriti esempi di possibili studi di follow-up.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Raccolta di campioni
-
Raccolta del campione di acqua del serbatoio: il primo caso di studio (Exp I; basso ambiente in situ predatore e sistema di abbondanza di prede)
- Raccogliere i campioni d'acqua dalla posizione desiderata ad una profondità adeguata. Conservare i campioni in un dispositivo di raffreddamento a temperatura controllata riempito a temperatura situ (evitando lo shock della temperatura; va notato che i tassi di assorbimento dei protisti sono dipendenti dalla temperatura) durante il trasporto in laboratorio.
NOTA: Il nostro campionamento è stato condotto nel serbatoio di zourov a forma di canyon meso-eutrofica (Boemia meridionale, volume 34,5 x 106 m3, profondità massima 43 m, tempo medio di ritenzione 100 giorni, dimictico). Il sito di campionamento era situato ad una profondità di 30 m, vicino alla diga. Un campione misto a una profondità di 0,5 m è stato raccolto da un campionatore Friedinger 2-l. - Proseguire fino alla sezione 1.2 il prima possibile.
- Raccogliere i campioni d'acqua dalla posizione desiderata ad una profondità adeguata. Conservare i campioni in un dispositivo di raffreddamento a temperatura controllata riempito a temperatura situ (evitando lo shock della temperatura; va notato che i tassi di assorbimento dei protisti sono dipendenti dalla temperatura) durante il trasporto in laboratorio.
-
Raccolta di liquidi dalle trappole delle piante carnivore Utricularia reflexa: il secondo caso di studio (Exp II; un sistema con elevata abbondanza di predatori e prede, volume campione estremamente ridotto)
- Scuotere delicatamente le piante sott'acqua, togliere dal contenitore di coltivazione e metterle su materiale assorbente per assorbire l'acqua in eccesso. A seconda della robustezza delle piante e delle dimensioni delle trappole, scegli 8-10 individui vegetali.
- Dividere ogni tiro in parti approssimativamente uguali contando nodi foglia cuscinetto organi intrappolamento. Ogni segmento di tiro servirà a raccogliere campioni misti che rappresentano trappole giovani, di mezza età e vecchie.
- Attaccare una sottile fiala di vetro e una fiala Eppendorf per la raccolta dei campioni in una pompa peristaltica. Procedere per inserire la punta capillare nell'apertura della trappola. Utilizzando la pompa a vuoto, aspirare tutto il fluido da ogni trappola fino a 900 x 100 l di fluido trappola viene raccolto per ogni categoria di età trappola.
- Utilizzare sottocampioni triplicati di 200 gradi l del fluido trappola raggruppato per esperimenti di pascolo protistan. Elaborarli immediatamente come descritto nella sezione 3. Conservare i restanti 300 l. del campione per tutte le altre analisi dei componenti microbici che vivono nel fluido, come descritto di seguito (sezione 2).
- Procedere immediatamente alla sezione 2.
2. Fissazione dei campioni raccolti
- Exp I e II: fissare sottocampioni di acqua/fluido trap per l'enumerazione batterica (sezione 4; circa 20 mL e 0,3 mL, rispettivamente) con formaldeide per almeno 1 h per ottenere una concentrazione di volume:volume finale del 2% in ogni campione.
NOTA: Maneggiare la formaldeide esclusivamente nella cappa dei fumi e indossare i guanti in ogni momento manipolando i campioni.
3. Filtrazione del campione
- Diluizione del campione (Exp I): non è necessaria alcuna diluizione per i campioni di acqua del serbatoio. (Exp II): diluire il campione di fluido di trappola 10x-100x con acqua MQ priva di particelle per ottenere una distribuzione adeguata dei microbi bersaglio sulle superfici filtranti prima del conteggio tramite microscopia epifluorescenza.
- Filtrare 1-2 mL (Exp I) dell'acqua del serbatoio o 10-30 -L (Exp II) del sottocampione del fluido trappola per il conteggio batterico su filtri neri da 0,2 m a dimensione dei pori, utilizzando un imbuto di filtrazione (diametro di 25 mm).
- Macchiare i filtri con DAPI (4',6-diamidino-2'-phenylindole dihydrochlor, 0.2% concentrazione finale) per 4 min.
NOTA: Evitare la contaminazione della pelle e della superficie di lavoro e indossare guanti. - Posizionare il filtro con microbi concentrati su una goccia di olio di immersione (per la microscopia fluorescente) su un vetrino del microscopio. Posizionare un'altra goccia d'olio al centro del filtro e coprire con un coperchio, assicurandosi che l'olio sia distribuito uniformemente.
- A questo punto, preferibilmente i campioni di processo immediatamente, o in alternativa, conservarli in freezer (-20 gradi centigradi) per diverse settimane o mesi fino a ulteriori analisi.
4. Enumerazione dei numeri batterici sui filtri
- Posizionare il vetrino al microscopio dell'epifluorescenza (con il filtro impostato corrispondente al DAPI fluorocro). Inserire una griglia di conteggio 10 x 10 in uno degli oculari. Spostare la diapositiva in una posizione casuale.
- Quantificare le cellule batteriche (fluorescenza blu) nell'area della griglia di conteggio (sotto l'ingrandimento 1000x). Nei conteggi, includere le celle che attraversano i bordi sinistro e superiore della griglia di conteggio, escludendo quelle situate sui bordi destro e inferiore.
- Passare a un'altra posizione casuale e ripetere l'enumerazione su almeno 10-15 griglie di conteggio, pari a 500 celle contate in totale.
- Stabilire un fattore di conversione per un determinato microscopio e ingrandimento, basato sulla conoscenza del rapporto tra l'area di una griglia e l'area di filtrazione effettiva totale del filtro. Quindi, dividere il numero totale di cellule contate per il numero di griglie contate, producendo un numero medio di batteri per griglia.
- Moltiplicare quest'ultimo parametro per il fattore di conversione stabilito e normalizzare il numero risultante per mL di un campione (a seconda del volume del campione filtrato) per ottenere l'abbondanza batterica totale per mL.
5. Determinazione dell'abbondanza del prozieno
- Fissare il campione d'acqua (Exp I) o i sottocampioni del fluido trap (Exp II) con glutaraldeide (1% di concentrazione finale, più adatto per i campioni con presenza di particelle contenenti clorofilla da trattare giorni a settimane dopo la fissazione) o utilizzando il tecnica di decolorazione formol-thiosulfate specificata di seguito.
NOTA: Entrambe le tecniche di conservazione impediscono l'egestione del materiale ingerito dai vacuoli alimentari dei protisti8. - Per quanto riguarda la tecnica di decolorazione formol-thiosulfate, aggiungete 100 l/1 di soluzione di Lugol in 20 mL/200 L del sottocampione del fluido acqua/trappola (rispettivamente Exp I/Exp II).
- Seguire immediatamente con l'aggiunta di 0,5 mL/50 l di formalina con buffer borate, quindi 20 l/2 l del 3% di sodio thiosulphate (rispettivamente Exp I/Exp II).
NOTA: Il tiosulfato di sodio decolora il colore giallo di Lugol per consentire l'osservazione delle cellule al microscopio a epifluorescenza8. - Filtrare un volume noto di campione (a seconda del numero di protisti bersaglio) su filtri in policarbonato nero di dimensioni di pori di 1 m.
- Stimare il numero delle specie protistiche contando almeno 200 cellule sotto ingrandimento 600x utilizzando la griglia di conteggio (vedi sopra).
- Ridurre il volume del campione sotto vuoto nell'imbuto di filtrazione con vuoto basso a circa 2 mL. Quindi, rilasciare la sottopressione e aggiungere il fluorocro DAPI (4',6-diamidino-2-phenylindole dihydrochlor13, 0.2% concentrazione finale) per 2 min.
6. Determinazione della struttura comunitaria dei ciliati in campioni di plancton
NOTA: le comunità di ciliate in habitat d'acqua dolce sono molto diverse14,15, 16,18, e la loro determinazione microscopica è impegnativo. Ordinare i gruppi di ciliati in gilde funzionali10,14,16,17 consente un'analisi più dettagliata di diversi gruppi di ciliati come batteriativori pelagici.
- Valutare la struttura della comunità ciliate combinando quanto segue:
- Campioni macchiati DAPI nella microscopia a epifluorescenza (per localizzare le cellule ciliato con fluorescenza luminosa di macro e micronuclei di diverse dimensioni e morfologia) combinate con l'assorbimento di batteri fluorescenti etichettati (FLB8; per i dettagli, vedere sotto), tracciando la capacità dei ciliati di nutrirsi di batteri.
- Osservazione del campione dal vivo in casi selezionati17,19. Per ulteriori dettagli sugli approcci e sui criteri di cui sopra utilizzati per raggruppare i ciliati in diverse categorie tassonomiche, vedere le pubblicazioni precedenti16,17.
NOTA: Studi citati hanno indicato che tra i ciliati, le specie onnivore della Sticofia (generazioni Halteria e Pelagohalteria)e Oligotrichia (vale a dire Rimostrombidium spp.) sono i più importanti consumatori pelagici di batterioplancton in una stragrande maggioranza degli habitat d'acqua dolce10,17,18.
7. Stima dei tassi di pascolo delle ciliati
- Calcolare i tassi di assorbimento dei ciliati sui batteri in base alle variazioni del numero medio di traccianti [cioè, FLB8 per ciliato relativo al tempo di incubazione (5-15 min)] e alla quantità di tracciante di FLB aggiunto, che rappresenta al massimo il 5%-15% dei batteri totali.
- Per confrontare i tassi di assorbimento tra le diverse specie protivedi, normalizzare i tassi di assorbimento come il numero di batteri per ciliato all'ora, con calcoli basati sul tempo effettivo di incubazione e sulla proporzione del tracciante FLB aggiunto.
NOTA: Lo schema generale dell'applicazione del metodo FLB per stimare sia i tassi di bacteridi di bacterivory specifici delle cellule o specie che quelli di bacteridi di massa in campioni naturali è illustrato nella Figura 1. - Preparazione di FLB da ceppi batterici indigeni in un ambiente d'acqua dolce8
- Selezionare una dimensione adatta (volume medio delle cellule e morfologia dei batteri) e la morfologia dei batteri in modo da imitare efficacemente le dimensioni tipiche delle cellule batterioplancton/batteriche nel sistema acquatico in fase di studio.
NOTA: Per Exp I è stata utilizzata una miscela di ceppi isolati dalla posizione di studio del genere Limnohabitans e Polynucleobacter (cioè, tipico, batterioplancton altamente abbondante in laghi e laghetti)20. Per informazioni dettagliate sulla morfologia e sulle dimensioni dei ceppi, vedere le pubblicazioni precedenti3,17,18,21. - Raccogliere le cellule batteriche dalla coltura per centrifugazione (5.000 x g) per 15 min nella prima fase stazionaria e mescolarle ad un rapporto numerico che produce MCV - SD delle cellule nella miscela corrispondente al tipico MCV dei batteri nella posizione scelta.
- Sospendere i pellet in 10 mL di salina con buffer fosfato (PBS; pH - 9).
- Aggiungere 2 mg del colorante fluorescing giallo-verde 5-(4,6-dichlorotriazin-2-yl) aminofluoresceina (DTAF, si lega alle proteine) alla sospensione cellulare nel tamponamento fosfato-salina, e incubare in un bagno d'acqua di 60 gradi centigradi per 2 h.
- Dopo l'incubazione, centrificare le cellule verso il basso, denegare la soluzione DTAF e lavare e centrifugare 3x con PBS.
- Dopo il lavaggio finale, sospendere nuovamente le cellulein 20 mL del tampone PP i-saline.
- Vorticare le sospensioni FLB e pipetta 1,5 mL aliquote in 2 mL crio-flacone, quindi mantenere congelati (a -20 ) in PPi-saline buffer fino all'uso.
- Pre-filtro PPi-saline buffer attraverso un filtro in policarbonato da 0,2 m da utilizzare nella fase successiva.
- Per determinare la concentrazione di FLB, trasferire un piccolo aliquota (di solito 20-40 L) a 2 mL di buffer PPi-saline privo di particelle, sonicare a 30 W per diversi 2 s raffiche e filtrare su uno 0,2 m di filtro nero policarbonato per l'enumerazione tramite epifluorescenza microscopia (ingrandimento 1.000X) con le impostazioni del filtro ottico per DTAF (448 nm/520-540 nm).
- Selezionare una dimensione adatta (volume medio delle cellule e morfologia dei batteri) e la morfologia dei batteri in modo da imitare efficacemente le dimensioni tipiche delle cellule batterioplancton/batteriche nel sistema acquatico in fase di studio.
- Tecnica di tracciamento per la stima del bacterivory di ciliato
- Per gli esperimenti di pascolo in habitat planctonici naturali, erogare campioni da 300 mL in flaconi da 1 L ben risciacquati e incubare a temperatura in situ per 15 min (per consentire ai protisti di riprendersi dallo shock di movimentazione).
- Aggiungere i traccianti FLB per costituire il 5%-15% dei batteri totali, con le quantità aggiunte a seconda della stagione e della temperatura dell'acqua.
NOTA: C'è uno spettro molto ampio, dipendente dalla stagione nei tassi di assorbimento specifici delle specie di ciliato che coprono diversi ordini di grandezza (cioè, da 101-104 batteri ciliati-1 all'ora)10,16, 17,18,22,23,24. - Nei periodi di maggiore occorrenza di ciliati con alti tassi di assorbimento (di solito durante l'estate), eseguire anche un'incubazione parallela con aggiunte FLB molto basse, costituendo solo il 2%-4% dei batteri totali per evitare un carico eccessivo di vacuoli di ciliato da parte del tracciante FLB (vedi esempi nella Figura 2).
- Incubare campioni di ciliato/plancton con FLB per 5-15 min.
- Ci sono due possibilità per la fissazione del campione per prevenire l'egestione del materiale ingerito da vacuoli alimentari dei protisti8. Terminare le incubazioni con l'aggiunta dell'1% di glutaraldeide (concentrazione finale che è più adatta per campioni con particelle contenenti clorofilla, come le alghe). In alternativa, utilizzare 100 l/10 l della soluzione di Lugol in un sottocampione di 20 mL/200 L di acqua/fluido trap, seguito immediatamente dall'aggiunta di 0,5 mL/10 l di formalina con tampone di borate, quindi 200 l/2 l del 3% di sodio thiosulphate (Exp I/Exp II).
- Dopo aver aggiunto il fissativo, lasciare riposare i campioni per almeno 1 h al buio a 4 gradi centigradi per garantire una conservazione accurata delle cellule ciliate.
- Prendiamo i sottocampioni naturali del plancton da 4-30 mL/10-30 -L (rispettivamente Exp I/Exp II; il volume dipende dall'abbondanza di ciliati) e macchia con DAPI (concentrazione finale dello 0,2% wt/vol; per i dettagli, vedi il passo 3.2 sopra).
- Passare attraverso 1 filtri neri m e ispezionare tramite microscopia epifluorescenza per contare ciliati (ingrandimento 600x) ed enumerare il numero di traccianti FLB ingeriti (per lo più a ingrandimento 1000x) come descritto nelle pubblicazioni precedenti2,17 . Ispezionare i campioni entro 7 giorni dalla conservazione.
- Per stimare il pascolo totale protozoo/specie specifico, moltiplicare i tassi medi di assorbimento di tutti i ciliati, o solo delle specie di ciliati rilevate dall'abbondanza in situ.
- L'esempio del calcolo dei tassi di assorbimento per cellula da dati in situ provenienti dal serbatoio dell'acqua di zmov è descritto come segue:
- Si supponga che la concentrazione batterica sia 3,55 x 106 batteri/mL e il tracciante FLB aggiunto sia 0,25 x 106 FLB/mL, che produce una somma di 3,8 x 106 batteri/mL delle particelle batteriche totali (batteri naturali - FLB - 100% di particelle di preda) disponibile per i protisti fagotrofi nel campione naturale.
NOTA: I traccianti FLB aggiunti rappresentano quindi il 6,58% (un progetto di 0,25/0,038) di particelle batteriche totali. Il numero medio di FLB per Halteria sp. è di 6,2 FLB in incubazioni di 5 min. - Per normalizzare l'assorbimento all'ora, utilizzare il seguente calcolo: (6,2 x 12)/(6,58/100) - 1131 batteri per cellula Halteria/h.
NOTA: per ulteriori esempi di distribuzioni dei singoli tassi di assorbimento di Halteria sp. rilevati sotto temperature variabili dell'acqua, quantità (come percentuali) di tracciante FLB aggiunto e diversi tempi di incubazione con FLB, vedere figura 3.
- Si supponga che la concentrazione batterica sia 3,55 x 106 batteri/mL e il tracciante FLB aggiunto sia 0,25 x 106 FLB/mL, che produce una somma di 3,8 x 106 batteri/mL delle particelle batteriche totali (batteri naturali - FLB - 100% di particelle di preda) disponibile per i protisti fagotrofi nel campione naturale.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Esempio di esperimento che ho eseguito nel bacino idrico di Omov (Boemia meridionale, in C), che è un sito naturale con un predatore in situ in situ inferiore e abbondanza di prede. I dati rappresentativi sono riportati per la specie onnivora di ciliato Halteria grandinella, che è un pascolo abbondante ed efficiente di picoplancton (<2 zm) particelle10,16,17,18 ,22. La figura 3 mostra trame box-and-whisker di numeri di FLB per cella di Halteria sp. dal serbatoio di zmov(Figura 3A), che è stato ricalcolato a tassi di assorbimento batterico all'ora (Figura 3B) quattro esperimenti individuali condotti in aprile, maggio, agosto e settembre. C'era un'elevata variabilità nei tassi di assorbimento delle ciliari, in gran parte causata dalle differenze temporali nella temperatura dell'acqua.
Va notato che il parametro Q10 riflette il fatto che i processi microbici funzionano circa 2,5 volte più velocemente con un aumento della temperatura di 10 C12, che vale anche per i tassi di assorbimento di ciliato sui batteri. Tenendo presente questa regola fisiologica, proporzioni notevolmente diverse di FLB e tempi di incubazione sono state utilizzate per diverse stagioni (per i dettagli, vedere la figura 3A). Così, l'effetto di temperatura previsto è stato compensato, e l'impostazione sperimentale ha prodotto ottimizzati valori medi e mediani dei tassi di assorbimento approssimativamente tra 5-10 FLB per cella ciliate. In generale, queste quantità di FLB ingerito sono facilmente numerabili (vedi esempi in Figura 2,due fotografie a sinistra), generando stime precise del tracciante (per lo più tra 1-15 FLB per ciliato) tassi di assorbimento. Tuttavia, a causa dell'aggiunta di un tracciante FLB modificato (%) e diverse volte di incubazione del campione i valori assoluti (espressi come numero di batteri pascolati ciliato all'ora) differivano in modo significativo (p < 0.01, test Kruskal-Wallis; seguito dal test di confronto multiplo di Dunn, p < 0,05; vedi esempi in Figura 3B) tra gli esperimenti. I dati illustrano anche la tipica variabilità naturale nei tassi di batterio assoluti nelle popolazioni planctoniche di Halteria grandinella, con una stretta corrispondenza dei loro valori medi e medi (Figura 3).
In presenza di ciliati batterivori altamente efficienti in campioni, come i ciliati peritrichosi, possono diventare pesantemente "sovraetichettati" da FLB in quantità di traccianti tipiche del 5%-10% dei batteri totali (vedi foto a destra nella figura 2). Ciò può limitare fortemente la quantificazione accurata della FLB ingerita. In questi casi, si consiglia di eseguire ulteriori incubazioni parallele con solo basse quantità di FLB che rappresentano solo l'1,5%-3% del totale dei batteri. Tuttavia, in genere sia gli importi del tracciante che i tempi di incubazione possono essere manipolati per ottimizzare il numero di FLB per cella (Figura 2).
Esempio di esperimento II: Sono visualizzati i dati di un sistema con grandi abbondanze di predatori e prede, in cui solo un volume di campione estremamente piccolo è disponibile per stimare sperimentalmente i tassi di bacteridio del citrahymena utriculariaee 25. È un pascolo batterico moderato che vive in grande abbondanza esclusivamente in trappole di carnivoro Utricularia reflexa piante 26,27. La figura 4 mostra i grafici box-and-whisker del numero di FLB per cella di T. utriculariae in diverse impostazioni sperimentali (Figura 4A,B) che vengono ricalcolati in tassi di assorbimento batterico all'ora(Figura 4 C,D) scoperte nelle trappole giovani, mature e vecchie. È interessante notare che nelle trappole sono state rilevate popolazioni di cloroplasti del ciliato T. utriculariae, mentre le popolazioni apocloriche di T. utriculariae sono state isolate dalle trappole e mantenute su sospensioni batteriche miste in crescita grani di grano al buio (per i dettagli, vedere la figura 1 in una precedente pubblicazione26).
Le popolazioni al cloroplasto vivono in trappole illuminate dalla luce; così, i cloroplasti possono fornire un'ulteriore fonte di carbonio organico e ossigeno all'ospite ciliato. Una delle ipotesi testate era che le popolazioni di ciliati apoclorico pascolavano i batteri molto più velocemente, poiché i batteri rappresentano l'unica fonte di particolato di carbonio organico disponibile per le sottopopolazioni isolate di crescita scura del ciliato.
Infatti, mentre non c'erano differenze significative nei tassi di batterio dei ciliati che vivono in giovani, mature e vecchie trappole di Utricularia reflexa (Figura 4A,C), le popolazioni apoclorica di T. utriculariae pascolavano batteri in modo significativo (p < 0.01, test Kruskal-Wallis; seguito dal test di confronto multiplo di Dunn, p < 0,05), circa 3 volte più veloce dei ciliati cuscinetto cloroplasto che vivono in trappole giovani, mature e vecchie (Figura 4C,D). Si noti che ancora una volta, sia gli importi del tracciante che i tempi di incubazione (Figura 4A,B,top) sono stati modificati per ottimizzare il numero di FLB per cella (generalmente tra 1-15), con valori medi e mediani intorno a 5 FLB/ciliati. Questi numeri sono distinguibili nei vacuoli alimentari ciliati e hanno permesso un conteggio accurato dei traccianti. Tuttavia, espressa in un numero assoluto di batteri pascolavano all'ora, le popolazioni di cloroplasti e apoclorici pascolavano rispettivamente circa 350 e 1.000 batteri all'ora. Questo allestimento sperimentale ha portato nuove intuizioni sui tratti metabolici e fisiologici di due distinte sottopopolazioni delle stesse specie di ciliati che vivono sotto vincoli ambientali sorprendentemente diversi25,26, 27.
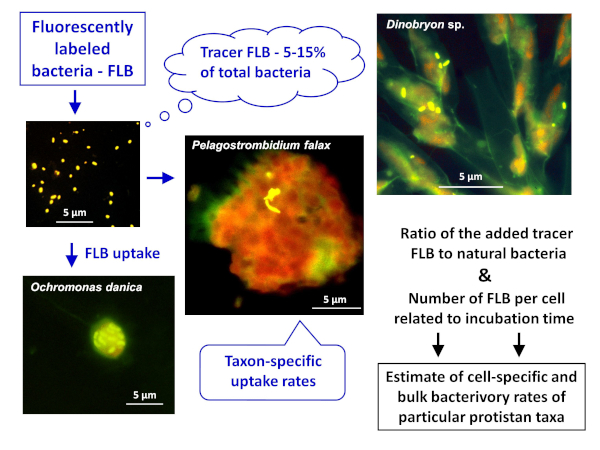
Figura 1 : Flusso di lavoro dell'utilizzo di batteri fluorescenti etichettati (FLB) per stimare i tassi di pascolo specifici delle cellule e delle specie dal rapporto tra FLB del tracciante ingerito e numero totale di batteri naturali nel campione. Per ulteriori dettagli, vedere la sezione 7 del protocollo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2 : Esempi di cellule di ciliate dal plancton di un bacino di pesce eutrofico. Esempi sono mostrati dallo stagno con FLB numerabile in cellule ciliati (generalmente 1-10 tracciatore FLB per cellula, i due microfotogri a sinistra) rispetto a un peritrichoso ciliato Pelagovorticellans (la microfotografia lato destro). Anche durante un breve periodo di incubazione di 5 min, è diventato "sovraetichettato" dal tracciante FLB, rendendo la quantificazione dell'FLB ingerito impreciso o quasi impossibile. In questo caso, si consiglia di diminuire la quantità di tracciante a 1.5%-3% del totale dei batteri. Tuttavia, in genere sia gli importi del tracciante che i tempi di incubazione possono essere manipolati per ottimizzare il numero di FLB ingeriti per cellula. Per ulteriori dettagli, vedere la sezione 7 del protocollo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3 : Appezzamenti box-and-whisker di numeri di FLB per cella di Halteria sp. dal serbatoio di zmov (Exp I) (A), ricalcolati a tassi di assorbimento batterico all'ora (B). I dati sono stati rilevati in diversi contesti stagionali, rappresentati da quattro esempi da aprile a settembre. La parte superiore del pannello A mostra informazioni sulla temperatura dell'acqua, diversi traccianti FLB aggiunti (%) e diversi momenti di incubazione del campione. Va notato che gli ultimi due parametri possono essere modificati per ottimizzare il numero di FLB per cella, con valori medi (linea completa) e mediana (linea tratteggiata) approssimativamente tra 5-10 FLB per cella ciliate (A). Le barre mostrano il 25o e il 75o percentile di tutti i dati (50-180 cellule ispezionate) e i baffi stanno per il decimo e il 99o percentile. (B) Diverse lettere piccole indicano differenze significative nei tassi di bacterivory specifici delle cellule di Halteria sp. durante il periodo studiato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4 : grafici box-and-whisker di numeri di FLB per cella. Sono mostrati appezzamenti di tetrahymena utriculariae porta-cloroda da trattamenti triplicati di giovani, maturi e vecchi trappole di Utricularia reflexa (Exp II) (A), ricalcolati a tassi di assorbimento batterico all'ora (C). I dati sono stati confrontati con i tassi di assorbimento batterico delle popolazioni di apocchireriche duplicate di T. utriculariae (B,D) isolate dalle trappole ma mantenute in sospensioni batteriche miste che crescono su cereali di grano al buio. Nella parte superiore dei pannelli A e B, sono stati aggiunti diversi traccianti FLB (%) e diversi momenti di incubazione del campione. Va notato che gli ultimi due parametri sono stati modificati per ottimizzare il numero di FLB per cella, con valori medi (linea intera) e mediana (linea tratteggiata) approssimativamente tra 5-10 FLB per cella ciliate (A,B). Le barre mostrano il quinto e il 95o percentile di tutti i dati (50-100 cellule ispezionate), e i baffi stanno per il decimo e il 99esimo percentile. Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Decifrare l'interazione trofica nei sistemi acquatici è sempre impegnativo28, soprattutto nelle scale nano-plancton che coinvolgono protisti e le loro prede, batteri. Quando si tratta di percorsi di assorbimento dei nutrienti e quantificazione, l'applicazione di metodi utilizzati con successo a livelli trofici più elevati è meno possibile, a causa dell'elevata complessità delle interazioni biotiche. Questi includono, ad esempio, approcci stabili di etichettatura degli isotopi. Questo protocollo mostra i vantaggi dell'uso della microscopia epifluorescenza e dei batteri fluorescenti etichettati come tracciatore per tracciare e semi-quantificare/stimare il flusso di carbonio (prede batteriche: vari pascoli del Prozistan tra cui pascoli mixotrofici29) attraverso la base di ragnatele microbiche. Uno di questi vantaggi è l'elevata precisione dell'approccio a una singola cellula, e l'altro è la risoluzione senza precedenti per quanto riguarda la struttura della comunità del pascolo e la distinzione tra diverse gilde funzionali, specie (Exp I), e anche sottopopolazioni dello stesso specie (Exp II).
Passaggi critici nel protocollo
Ci sono diversi passaggi critici nel protocollo, che possono garantire che i vantaggi della metodologia siano utilizzati al loro pieno potenziale. In primo luogo, una comprensione di base dell'ambiente studiato prima dell'inizio dell'esperimento è sempre vantaggiosa. Ciò include lo screening microscopico della diversità e dell'abbondanza dei potenziali pascoli presenti, delle dimensioni delle prede batteriche e della distribuzione delle prede sia 1) nella colonna d'acqua (ad esempio, un profilo verticale dall'epilimion all'ippolimini) e 2) nel caso di bacini a forma di canyon, sul transect di diga-inflow. In secondo luogo, un'attenta manipolazione con i campioni raccolti garantirà risultati rappresentativi. La temperatura è un fattore estremamente importante che colpisce la maggior parte dei processi microbici12, compresi i tassi di pascolo protista (Figura 3).
In terzo luogo, la manipolazione della quantità di tracciante aggiunto in base alla quantificazione delle cellule batteriche o al tipo di pascolo nel campione garantirà che i problemi di sovraetichettatura (Figura 2) vengano eliminati. Va notato che c'è uno spettro molto ampio nei tassi di assorbimento specifici delle specie di ciliato (per i dettagli, vedi il punto 7.2); pertanto, per applicare il protocollo in modo appropriato, è essenziale una conoscenza preventiva delle principali specie di ciliati con i loro tassi di assorbimento dei corsi temporali. Si consiglia vivamente di eseguire esperimenti preliminari con diversi tracer per evitare possibili sottoetichettature dei ciliati (nessuna o troppo poche FLB sono occupate per cellula ciliate, producendo dati statisticamente non validi) o sovraetichettatura (appare come un gran numero di FLB formando "nuvole di FLB condensata" o stormi in vacuoli alimentari ciliati confezionati dai traccianti, limitando così gravemente la loro precisa quantificazione; vedere l'esempio in alto a destra in Figura 2). Va anche notato che i tempi di incubazione con FLB sono generalmente più brevi di 30 min, poiché il tempo medio di digestione del picoplancton da ciliati è di circa 1,5 h, e inizia la digestione (le cellule di picoplancton ingerite perdono la sua forma e il colore tipici) circa dopo 45-60 min30. Allo stesso modo, la diluizione ottimale e la distribuzione dei campioni sul filtro prima della visualizzazione microscopica devono essere ottenute per risultati accurati.
Modifiche e risoluzione dei problemi
I passaggi principali, le possibili modifiche e le modifiche alla risoluzione dei problemi della tecnica sono illustrati nella Figura 1 e Nella Figura 2. Inoltre, va notato che nei casi di alte concentrazioni di particelle detritiche, cellule fitoplancton o loro colonie nel plancton, tali campioni 1) dovrebbero essere diluiti di conseguenza per ottenere uno stadio in cui le singole cellule di pascolo possono essere sulla superficie del filtro e 2) essere sottoposti a quantificazione del contenuto di vacuolo alimentare.
Limitazioni
La limitazione principale per una corretta applicazione di questo metodo risiede nella presenza di vari detriti organici o abbondanti particelle inorganiche/organiche con batteri collegati o aggregati in quantità che impediscono una chiara visualizzazione del campione sotto l'epifluorescenza microscopio e stima precisa di una quantità di tracciante aggiunto. Va notato che la tecnica di tracciamento presentata funziona principalmente con batteri liberi (cioè sospesi) che non sono attaccati alle particelle. Tuttavia, sulla base della nostra esperienza e riferimenti letterari (vedi le pubblicazioni precedenti2,4,8,10,16,18,21 ,26), la metodologia presentata è adatta alla maggior parte degli ambienti acquatici. Esempi di due sistemi naturali e contrastanti differiscono per stato trofico, contenuto detrito e diversità e numeri di pascolo(Figura 3 e Figura 4).
Significato dell'approccio rispetto ai metodi esistenti
È importante sottolineare che, dalla conoscenza dell'abbondanza di un taxon/taxa di batteri e dei loro tassi di bacterivoryo specifici per specie, è possibile calcolare il tasso di bacterivoryo alla rinfusa del taxon del protistan (o assemblaggio totale di ciliati). Se questo approccio viene applicato agli ambienti plancton naturali concomitanti sia per flagellati eterofi che per ciliati (che rappresentano i principali pascoli del batterioplancton2,6,7), il prozione tempo di ricambio indotto dal pascolo delle popolazioni batteriche in un dato ambiente può essere stimato16,17,18,22. Tali dati hanno un'importanza fondamentale per la stima delle dinamiche del flusso di carbonio nelle nate alimentari microbiche.
Applicazioni future
Esistono altri ambienti specifici in cui questo metodo, con alcune modifiche, può essere utilizzato correttamente. Questi includono sistemi di fanghi attivati, ecosistemi rumeni, sedimenti acquatici e pesci ipertrofici17. Tuttavia, l'applicazione in questi ambienti ricchi di sostanze nutritive e microbi richiede test preliminari per ottimizzare il protocollo per quanto riguarda le dimensioni corrette, la morfologia e il numero di traccianti FLB che possono imitare la distribuzione tipica delle dimensioni e altre caratteristiche batteri delle prede inerenti all'ambiente.
Attualmente, vi è un crescente interesse a combinare questo approccio con il catalizzato reporter deposizione fluorescenza in situ ibridazione (CARD-FISH), in cui l'identità della cellula pascolo (ad esempio, flagelattico etetrotrofico) viene rilevata con uno specifico FISH-probe e il tasso di assorbimento si basa sul contenuto di FLB nei vacuoli alimentari della cellula flagellata sulla stessa diapositiva microscopica31. Un sofisticato, nuovo approccio chiamato doppia ibridazione32 è una combinazione di sonde FISH ai livelli delle cellule predatori e batteri preda (che sono anche etichettati specificamente da un ceppo filogenetico, una sonda FISH specifica per il lignaggio batterico). L'approccio è elegante ma richiede anche tempo e richiede competenze ed esperienza specifiche31,32, mentre l'applicazione di varie modifiche di approccio di acconto FLB può essere più facilmente adottato per l'uso di routine nei laboratori.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Questo studio è stato sostenuto dalla Fondazione scientifica ceca nell'ambito della sovvenzione di ricerca 13-00243S e 19-16554S assegnata rispettivamente a K. e D. S. Questo articolo è stato sostenuto anche dal progetto "Biomanipulation as a tool to improving water quality of dim reservoirs" (No C.02.1.01/0.0/0.0/16_025/0007417), finanziato dal Fondo europeo di sviluppo regionale, nel programma operativo Ricerca, Sviluppo e l'istruzione.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



