Summary
Представлено здесь протокол для одноклеточных, эпифлюоресцентных микроскопических основе техники для количественной оценки выпаса в водных хищных эукариот с высокой точностью и таксономическим разрешением.
Abstract
Выяснение трофических взаимодействий, таких как хиртация и его последствия, является частой задачей для многих исследователей в области экологии. Изучение микробных сообществ имеет много ограничений, и определение хищника, добычи и хищнических ставок часто бывает трудно. Представленный здесь оптимизированный метод, основанный на добавлении флуоресцентно обозначенной добычи в качестве трассировщика, что позволяет надежно квадализировать показатели выпаса у водных хищных эукариот и оценку переноса питательных веществ на более высокие трофические уровни.
Introduction
Гетеротрофные прокариоты являются ключевым биологическим компонентом в водных системах и составляют значительную долю биомассы планктона1,2,3. Факторы, контролирующие их изобилие, разнообразие и активность, имеют решающее значение для понимания их роли в биогеохимическом велоспорте (т.е. судьбе органического углерода и других питательных веществ и притока энергии от прокариот до более высоких трофических уровней). Простейшие выпаса является одним из этих важных факторов. Бактериальная бактерия гетеротрофных нанофлагеллетов и цилиатов налагает сильный сверху вниз контроль над прокариотическим изобилием, функцией сообщества, структурой, разнообразием и даже клеточной морфологией и темпами роста конкретных бактериальных групп4, 5,6. В некоторых системах, протисты служат основной причиной бактериальной смертности6,7.
Стандартный подход, используемый для оценки простейшие бактерии, которая используется в течение некоторого времени, включает в себя использование флуоресцентно помеченных бактерий (FLB) в качестве аналогов добычи и эпифлюоресценции микроскопии. Cell-специфические тарифы поглощения можно обусловить путем количественной оценки числа помеченных частиц добычи в вакуолах протистановых пищевых продуктов в течение выбранного курса8. Этот подход имеет ряд преимуществ. Tracer добавляется в естественные образцы с естественными сборками хищника и добычи. Существует минимальная манипуляция образца до инкубации, минимальное изменение образца добавленным трассировщиком FLB, и время инкубации короткие, чтобы обеспечить звуковые результаты, полученные при близких к условиям initu. Кроме того, в условиях с низким числом бактериораилистов или зоопланктона (например, морских морских систем) показатели исчезновений FLB, добавленных в образцы в небольших количествах (2%-3% трассировки), могут быть обнаружены с помощью цитометрии потока в долгосрочной перспективе (12-24 ч) инкубационные эксперименты. Затем, номера FLB в начале и конечных точках (интеграция воздействия всех бактериофоров) количественно поток цитометрии (для деталей, см. предыдущую публикацию9). Однако такой параметр представляет собой только общий агрегированный уровень бактериори, который не может быть непосредственно отнесен к какой-либо конкретной протистанской и зоопланктонных групп или видов.
В целом, количественная оценка протистана видов или морфотипа конкретных бактериальных показателей смертности в водной среде точно и с экологическим значением может быть сложной задачей. Некоторые протеисты селективных grazers, и размер и форма клетки добавил FLB трассировщик может исказить естественные темпы усвоения добычи10,11. Кроме того, протистановская активность и обмен веществ являются высокочувствительными к температуре12; поэтому количество добавленного трассировщика FLB необходимо тщательно манипулировать для каждого отдельного типа выборки (не только на основе естественного изобилия, размера и морфологии бактерий и преобладающих типов бактериора, но и на температуре). Большинство исследований сосредоточено на массовой пастбищной деятельности протистана; однако, бактериам охарактериции конкретных видов протистана часто имеет гораздо более высокое информационное значение и может быть предпочтительнее. В этом случае необходимы таксономические знания протеистических видов, присутствующих в образце, и понимание их поведения. Таким образом, значительное количество времени и труда требуется для получения хороших результатов по конкретным видам ставки бактериори, связанные с конкретной группы протистана или видов.
Несмотря на эти трудности, этот подход остается наиболее подходящим инструментом, доступным в настоящее время для оценки протистана бактерии в естественных условиях. Представлено здесь всеобъемлющий, простой в последующей метод для использования FLB в качестве трассировщика в водных микробных исследований экологии. Учитываются все упомянутые проблемные аспекты подхода и описан улучшенный рабочий процесс, в качестве примеров можно привести два эксперимента из контрастных сред, а также контрастные виды цилиат.
Первое тематическое исследование было проведено в эпилимонтической среде из мезотрофического зоохранилища Чёмов в Чешской Республике, которое показывает, что пасерс и бактериальное изобилие сравнимо с большинством поверхностных пресноводных тел (ср.5,7). Второй тематический исследование было проведено в узкоспецифической среде внутри ловушек водного плотоядного растения Utricularia reflexa, в котором содержится чрезвычайно большое количество обоих выпаса миксотрофических цилиатов (Tetrahymena utriculariae) и бактериальных клеток. Показаны расчеты клеточных коэффициентов выпаса и бактериальных постоянных запасов в обоих типах образцов. Затем обсуждается ряд экологических толкований результатов, и, наконец, предлагаются примеры возможных последующих исследований.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Коллекция образцов
-
Сбор образца воды резервуара: первое исследование случая (Exp I; более низкая естественная в situ система хищника и изобилия добычи)
- Собирайте пробы воды из нужного места на подходящую глубину. Храните образцы в контролируемом температурой охладителе, заполненном при температуре на месте (избегая температурного шока; следует отметить, что показатели поглощения протистов зависят от температуры) во время транспортировки в лабораторию.
ПРИМЕЧАНИЕ: Наша проба была проведена в мезо-эвтрофическом каньоне-образном Зимовском водохранилище (южная Чехия, объем 34,5 х 106 м3, максимальная глубина 43 м, среднее время удержания 100 дней, димиктический). Место отбора проб было расположено на глубине 30 м, недалеко от плотины. Смешанный образец на глубине 0,5 м был собран 2-л сэмплером Friedinger. - Продолжить раздел 1.2 как можно скорее.
- Собирайте пробы воды из нужного места на подходящую глубину. Храните образцы в контролируемом температурой охладителе, заполненном при температуре на месте (избегая температурного шока; следует отметить, что показатели поглощения протистов зависят от температуры) во время транспортировки в лабораторию.
-
Сбор жидкости из ловушек плотоядных растений Utricularia reflexa: второе тематическое исследование (Exp II; система с высоким изобилием хищника и добычи, крайне небольшой объем образца)
- Аккуратно встряхните растения под водой, удалите из контейнера для выращивания и поместите их на абсорбционный материал, чтобы поглотить избыток воды. В зависимости от надежности растений и размера ловушек, выбирайте 8-10 растений.
- Разделите каждый побег на примерно равные части, считая лист узлов подшипника захвата органов. Каждый сегмент съемки будет служить для сбора смешанных образцов, представляющих молодых, среднего возраста, и старые ловушки.
- Прикрепите тонкий стеклянный капилляр и флакон Eppendorf для сбора образцов к перистальтике насоса. Приступить к вставить капиллярный наконечник в отверстие ловушки. Используя вакуумный насос, высосать всю жидкость из каждой ловушки до 900 и 100 л ловушки жидкости собирается для каждой возрастной категории ловушки.
- Используйте тройные подобразцы из 200 л объединенной жидкости ловушки для экспериментов по выпасу протистана. Обработайте их немедленно, как подробно описано в разделе 3. Сохранить оставшиеся 300 евро образца для всех других анализов микробных компонентов, живущих в жидкости, как описано ниже (раздел 2).
- Немедленно приступай к разделу 2.
2. Фиксация собранных образцов
- Exp I и II: исправить воды / ловушки жидкости подобразцов для бактериального перечисления (раздел 4; примерно 20 мл и 0,3 мл, соответственно) с формальдегидом, по крайней мере 1 ч, чтобы получить 2% окончательный объем: объем концентрации в каждом образце.
ПРИМЕЧАНИЕ: Ручка формальдегида исключительно в дым капот, и носить перчатки во все времена при манипулировании образцами.
3. Фильтрация образцов
- Пробное разбавление (Exp I): для проб воды резервуара не требуется разбавления. (Exp II): разбавить образец жидкости ловушки 10x-100x с частицами свободной воды МЗ для достижения подходящего распределения целевых микробов на поверхностях фильтра до подсчета с помощью эпифлюоресценции микроскопии.
- Фильтр 1-2 мл (Exp I) воды резервуара или 10-30 л (Exp II) подобразца люка для бактериального подсчета на черные 0,2 мкм пор-размера фильтров, используя фильтрационную воронку (25 мм в диаметре).
- Пятно фильтры с DAPI (4',6-диамидино-2'-фенилдольндол дигидрохлорид, 0,2% конечной концентрации) в течение 4 мин.
ПРИМЕЧАНИЕ: Избегайте загрязнения кожи и рабочей поверхности, и носить перчатки. - Поместите фильтр с концентрированными микробами на каплю масла погружения (для флуоресцентной микроскопии) на слайде микроскопа. Поместите еще одну падение масла на центр фильтра и накройте крышкой, убедившись, что масло распределяется равномерно.
- На этом этапе предпочтительно обрабатывать образцы немедленно, или же, хранить их в морозильной камере (-20 градусов по Цельсию) в течение нескольких недель до нескольких месяцев до дальнейшего анализа.
4. Перечисление бактериальных чисел на фильтрах
- Поместите слайд под эпифлюоресцентный микроскоп (с набором фильтра, соответствующим флюорохрому DAPI). Поместите сетку подсчета 10 x 10 в один из глаз. Переместите слайд в случайное положение.
- Количественная бактериальная клетка (синяя флуоресценция) в области счетной сетки (под увеличением 1000x). В графы включают ячейки, пересекающие левый и верхний края сетки подсчета, исключая те, которые расположены по правому и нижнему краям.
- Перейдите в другое случайное положение и повторите перечисление по крайней мере 10-15 подсчитывающих сеток, насчитывающих в общей сложности 500 ячеек.
- Установить коэффициент конверсии для данного микроскопа и увеличения, основываясь на знании соотношения площади одной сетки к общей эффективной области фильтрации фильтра. Затем разделите общее количество клеток, подсчитанных по количеству подсчитанных сеток, что дает среднее количество бактерий на сетку.
- Умножьте последний параметр на установленный коэффициент преобразования и нормализуйте полученное число на мл образца (в зависимости от объема фильтрованного образца) для получения общего бактериального изобилия на мл.
5. Определение протистана изобилия
- Исправить образец воды (Exp I) или ловушки жидкости (Exp II) подобразцы либо с глутаральдегидом (1% конечной концентрации, более подходит для образцов с наличием хлорофилла, содержащих частицы, которые будут обработаны дней до нескольких недель после фиксации) или с использованием техника деколонации формол-тиосульфата, указанная ниже.
ПРИМЕЧАНИЕ: Оба метода сохранения предотвратить поглощение проглатываетматериал из пищевых vacuoles протеистов8. - Что касается техники деколования формол-тиосульфата, добавьте 100 л/1 л раствора Лугола в 20 мл/200 л подобразца жидкости для воды/ловушки (Exp I/Exp II, соответственно).
- Следуйте немедленно с добавлением 0,5 мл/50 л борате-буферизированного формалина, то 20 Л/2 Л 3% тиосульфата натрия (Exp I/Exp II, соответственно).
ПРИМЕЧАНИЕ: тиосульфат натрия деколоризирует желтый цвет Лугола, чтобы можно было наблюдать за клетками под эпифлюоресцентным микроскопом8. - Фильтр известный объем выборки (в зависимости от числа целевых протеистов) на 1 мкм пор размера черных поликарбонатных фильтров.
- Оцените количество видов протеист, подсчитывая не менее 200 клеток под увеличением 600x с помощью сетки подсчета (см. выше).
- Уменьшите объем образца под вакуумом в фильтрационной воронке при низком вакууме примерно до 2 мл. Затем отпустите под давлением и добавьте dAPI фторхром (4',6-диамидино-2-фенилдольнол дигидрохлорид13, 0,2% конечная концентрация) в течение 2 мин.
6. Определение общинной структуры цилиатов в образцах планктона
ПРИМЕЧАНИЕ: Ciliate общин в пресноводных средах обитания очень разнообразны14,15,16,18, и их микроскопическое определение является сложной задачей. Сортировка групп цилиата в функциональные гильдии10,14,16,17 позволяет более детальный анализ различных групп цилиатов как пелагические бактериора.
- Оцените структуру сообщества цилиата, объединив следующее:
- DAPI-окрашенные образцы в эпифлуоресцентной микроскопии (для локализации цилиатовых клеток с яркой флуоресценцией макро- и микро-ядер различных размеров и морфологии) в сочетании с поглощением флуоресцентно маркированных бактерий (FLB8; для деталей, см. ниже), отслеживание способности цилиатов питаться бактериями.
- Наблюдение выборки в выбранных случаях17,19. Для получения более подробной информации о вышеуказанных подходов и критериях, используемых для группировки цилиатов в различные таксономическиекатегории,см.
ПРИМЕЧАНИЕ: Цитируемые исследования показали, что среди цилиатов, всеядные виды из Stichotrichia (род Халтерия и Пелагохалтерия) и Oligotrichia (а именно Rimostrombidium spp.) являются наиболее важными пелагическими потребителями бактериопланктона в подавляющем большинстве пресноводных мест обитания10,17,18.
7. Оценка показателей выпаса цилиатов
- Рассчитайте скорость поглощения цилиатов на бактериях на основе изменений в среднем количестве трассировщика (т.е. FLB8 на цилиат, связанный со временем инкубации (5-15 мин)» и tracer количество FLB добавил, что составляет не более 5%-15% от общего числа бактерий.
- Чтобы сравнить показатели поглощения между различными видами протистана, нормализовать показатели поглощения, как количество бактерий на цилиат в час, с расчетами, основанными на фактическом времени инкубации и пропорции трассировщик FLB добавил.
ПРИМЕЧАНИЕ: Общая схема применения метода FLB для оценки как клеток или видов конкретных и объемных бактериовидов в естественных образцах, изображена на рисунке 1. - Подготовка FLB из бактериальных штаммов коренных к пресноводным средам8
- Выберите подходящий размер (средний объем клеток - MCV) и морфологию бактерий, чтобы они эффективно имитировали типичные размеры бактериопланктона/бактериальных клеток в исследуемой водной системе.
ПРИМЕЧАНИЕ: Для Exp I, смесь изолированных штаммов из исследования место положения рода Лимнохабиваны и Polynucleobacter был использован (т.е., типичный, очень обильные бактериопланктона в озерах и прудах)20. Подробнее о морфологии и размерах штаммов смотрите предыдущие публикации3,17,18,21. - Урожай бактериальных клеток из культуры центрифугации (5000 х г)в течение 15 минут на ранней стационарной фазе и смешивать их в численном соотношении, которое дает MCV SD клеток в смеси, соответствующей типичным MCV бактерий в выбранном месте.
- Приостановить гранулы в 10 мл фосфат-буферного сосудистого раствора (PBS; рН No 9).
- Добавьте 2 мг желто-зеленого флуоресцентирующего красителя 5-(4,6-дихлоротриазина-2-ил) аминофлуорезеина (DTAF, связывается с белками) к клеточной подвеске в фосфатно-салиновой буфере и инкубировать в водяной ванне 60 градусов по Цельсию в течение 2 ч.
- После инкубации, центрифуга клетки вниз, decant раствор DTAF, и мыть и центрифуги 3x с PBS.
- После окончательной стирки повторно прикрепляем клеткив 20 мл буфера PP i-saline.
- Vortex подвески FLB и пипетка 1,5 мл aliquots в 2 мл крио-флаконы, а затем держать замороженные (при -20 градусов по Цельсию) в PP i-saline буфера до использования.
- Предварительный фильтрPP i-saline буфер через 0,2 мкм поликарбонатный фильтр для использования в следующем шаге.
- Чтобы определить концентрацию FLB, перенесите небольшой аликот (обычно 20-40 л) на 2 мл безвемного PP i-saline буфера, sonicate на 30 Вт в течение нескольких 2 s очередей, и фильтр на 0,2 мкм поликарбонатный черный фильтр для перечисления через эпифлюресценцию микроскопия (1000X увеличение) под оптическими настройками фильтра для DTAF (448 нм/520-540 нм).
- Выберите подходящий размер (средний объем клеток - MCV) и морфологию бактерий, чтобы они эффективно имитировали типичные размеры бактериопланктона/бактериальных клеток в исследуемой водной системе.
- Техника Tracer для оценки килиатной бактерии
- Для выпаса экспериментов в естественных планктонных средах обитания, обойтись 300 мл образцов в хорошо промытые 1 л колбы и инкубировать при температуре на месте в течение 15 минут (чтобы протеисты, чтобы оправиться от обработки шок).
- Добавьте трассизаторы FLB на 5%-15% от общего количества бактерий, при этом суммы добавляются в зависимости от сезона и температуры воды.
ПРИМЕЧАНИЕ: Существует очень широкий, сезон-зависимый спектр в цилиат видов конкретных темпов поглощения, охватывающих несколько порядков величины (т.е., от 101-104 бактерий цилиат-1 в час)10,16, 17,18,22,23,24. - В периоды повышенного возникновения цилиатов с высокими показателями поглощения (обычно в течение лета), также запустить параллельную инкубацию с очень низкими flB дополнения, составляющие только 2%-4% от общего числа бактерий, чтобы избежать чрезмерной загрузки цилиат vacuoles трассировки FLB (см. примеры на рисунке 2).
- Инкубировать образцы цилиата/планктона с FLB в течение 5-15 мин.
- Есть две возможности для фиксации образца для предотвращения поглощения проглатывает материал из пищевых вакуол протеистов8. Упраздните инкубации путем добавления 1% глютаральдегида (окончательная концентрация, которая больше подходит для образцов с хлорофилл-содержащими частицами, такими как водоросли). Кроме того, используйте 100 л/10 л раствора Лугола в 20 мл/200 л воды/ловушки жидкости субобразца, а затем сразу же добавление 0,5 мл/10 Л борат-буферизированного формалина, то 200 л/2 л 3% тиосульфата натрия (Exp I/Exp II, соответственно).
- После добавления фиксатора, пусть образцы отдыха, по крайней мере 1 ч в темноте при 4 градусах по Цельсию, чтобы обеспечить тщательное сохранение клеток цилиата.
- Возьмите натуральные субобразцы планктона от 4-30 мл/10-30 л (Exp I/Exp II, соответственно; объем зависит от изобилия цилиата) и пятно с DAPI (окончательная концентрация 0,2% wt/vol; для деталей, см. шаг 3.2 выше).
- Пройдите через 1 мкм черные фильтры и проверить с помощью эпифлюоресценции микроскопии для подсчета цилиатов (600x увеличение) и перечислить количество FLB трассеров попадает (в основном на 1000x увеличение), как подробно описано в предыдущих публикациях2,17 . Осмотрите образцы в течение 7 дней после консервации.
- Для оценки общего пастбища, специфичных для видов видов, умножьте средние показатели поглощения всех цилиатов или только видов цилиатов, обнаруженных в изобилии на месте.
- Пример расчета коэффициентов поглощения на ячейку из данных на месте из Зымовского водохранилища описывается следующим образом:
- Предположим, что концентрация бактерий составляет 3,55 х 106 бактерий/ мл и трассировщик FLB добавил 0,25 х 106 FLB/mL, который дает сумму 3,8 х 106 бактерий / мл от общего числа бактериальных частиц (естественные бактерии - FLB - 100% частиц добычи) доступны для фаготрофических протеистов в естественном образце.
ПРИМЕЧАНИЕ: FLB трассировки добавил таким образом представляют 6.58% (проект 0.25/0.038) от общего бактериальных частиц. Среднее число FLB в Halteria sp. составляет 6,2 FLB в 5 мин инкубаций. - Для нормализации поглощения в час используйте следующие расчеты: (6,2 х 12)/(6,58/100) - 1131 бактерия на клетку Халтерия/ч.
ПРИМЕЧАНИЕ: Для более примеров распределения индивидуальных показателей поглощения Halteria sp. обнаружены при переменных температурах воды, количествах (в процентах) трассировщика FLB добавлено, и различные времена инкубации с FLB, см. Рисунок 3.
- Предположим, что концентрация бактерий составляет 3,55 х 106 бактерий/ мл и трассировщик FLB добавил 0,25 х 106 FLB/mL, который дает сумму 3,8 х 106 бактерий / мл от общего числа бактериальных частиц (естественные бактерии - FLB - 100% частиц добычи) доступны для фаготрофических протеистов в естественном образце.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Пример эксперимента я был запущен в Зимовском водохранилище (южная Чехия, СЗ), который является природным местом с более низким природным на месте хищника и добычи изобилия. Представленные представительные данные сообщается для всеядных цилиат видов Halteria grandinella, который является обильным и эффективным grazer из пикопланктона (Яlt;2 мкм) частиц10,16,17,18 ,22. На рисунке 3 показаны участки в ящиках и висахи чисел FLB на клетку Halteria sp. из Зимовского водохранилища(рисунок 3А),который был пересчитан до уровня бактериального поглощения в час(рисунок 3B) обнаружены в четырех отдельных экспериментах, проведенных в апреле, мае, августе и сентябре. Существовала высокая изменчивость показателей поглощения цилиата, в значительной степени вызванного временными различиями в температуре воды.
Следует отметить, что параметр No10 отражает тот факт, что микробные процессы работают примерно в 2,5 раза быстрее с повышением температуры на 10 градусов по Цельсию12, который также имеет место для темпов поглощения цилиата на бактериях. С этим физиологическим правилом в виду, значительно различные пропорции FLB и время инкубации были использованы для различных сезонов (для деталей, см. Рисунок 3A). Таким образом, ожидаемый температурный эффект был компенсирован, и экспериментальная настройка дала оптимизированные средние и средние значения коэффициентов поглощения примерно между 5-10 FLB на цилиатную ячейку. Как правило, эти количества попадает FLB легко подсчитывается (см. примеры на рисунке 2, две левые фотографии), генерации точных оценок трассировщик (в основном между 1-15 FLB на цилиат) поглощения ставок. Однако, из-за модифицированного FLB трассировщик добавил (%) и разное время инкубации образца абсолютные значения (выраженные как количество бактерий пасутся цилиат в час) значительно отличались (р-эт-л; 0,01, тест Крускал-Валлис; затем тест Данна на несколько сравнений, стр. 3B) среди экспериментов. Данные также иллюстрируют типичную естественную изменчивость в абсолютных бактериальных ставок в планктонных популяциях Halteria grandinella, с близким соответствием их средних и средних значений(рисунок 3).
При наличии высокоэффективных бактериорационных цилиатов в образцах, таких как перитричные цилиаты, они могут стать сильно "перемаркированы" FLB в типичных количествах трассировщика 5%-10% от общего количества бактерий (см. правую сторону фотографию на рисунке 2). Это может сильно ограничить точную количественную оценку попадает FLB. В таких случаях предлагается проводить дополнительные параллельные инкубации с лишь низким количеством FLB, на долю которых приходится лишь 1,5%-3% от общего числа бактерий. Однако, как правило, как трассировщик суммы, а также время инкубации можно манипулировать, чтобы оптимизировать количество FLB на ячейку (Рисунок 2).
Пример эксперимента II: Отображается данные из системы с крупным хищником и добычей изобилия, где только очень небольшой объем выборки доступен экспериментально оценить бактериали ставки цилиат Tetrahymena utriculariae 25. Это умеренный бактериальный grazer, живущих в высоком изобилии исключительно в ловушках плотоядных растений Utricularia рефлекс 26,27. Рисунок 4 показывает, коробка и вискер участков числа FLB на клетку T. utriculariae под различными экспериментальными настройками (Рисунок 4A,B), который пересчитывается в скорость бактериального поглощения в час (Рисунок 4 C,D) обнаружены в молодых, зрелых и старых ловушках. Интересно, что в ловушках были обнаружены хлоропластоносные популяции цилиата T. utriculariae, в то время как апохлорические популяции T. utriculariae были изолированы от ловушек и поддерживаются на смешанной бактериальной подвеске, растущей на пшеничные зерна в темноте (для деталей, см. Рисунок 1 в предыдущей публикации26).
Популяции хлоропластовых людей живут в легкоосвещенных ловушках; таким образом, хлоропласты могут обеспечить дополнительный органический источник углерода и кислорода к цилиату хосту. Одна из проверенных гипотез заключалась в том, что популяции апохлорических цилиатов пасутся бактериями значительно быстрее, так как бактерии представляют собой единственный источник твердых частиц органического углерода, доступный для выращенных в темное время году изолированных субпопуляций цилиата.
Действительно, в то время как не было никаких значительных различий в бактериали стихов цилиатов, живущих в молодых, зрелых и старых ловушек Utricularia рефлексы (Рисунок 4A, C), апохлорические популяции T. utriculariae пасутся бактерии значительно (p qlt; 0.01, Тест Крускал-Валлис; затем тест Данна на несколько сравнений, р-л/ 0,05), примерно в 3 раза быстрее, чем хлоропластоносные цилиаты, живущие в молодых, зрелых и старых ловушках(рисунок 4C,D). Обратите внимание, что опять же, как трассировщик суммы, а также время инкубации (Рисунок 4A,B, сверху) были изменены для оптимизации числа FLB на ячейку (как правило, между 1-15), со средними и средними значениями около 5 FLB/ цилиат. Эти цифры различимы в цилиатных пищевых вакуол и позволяют точное подсчета трассировщиков. Однако, выраженные в абсолютном количестве бактерий пасутся в час, хлоропластовых и апохлорических популяций паслись около 350 и 1000 бактерий цилиат в час, соответственно. Эта экспериментальная установка принесла новые идеи в метаболических и физиологических черт двух различных субпопуляций же цилиат видов, живущих под поразительно различных экологических ограничений25,26, 27.
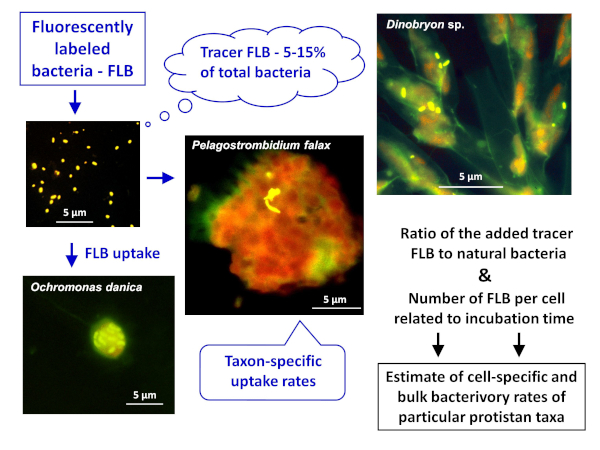
Рисунок 1 : Рабочий процесс использования флуоресцентно маркированных бактерий (FLB) для оценки клеток и видов конкретных темпов выпаса от соотношения попадает трассировщик FLB к общему числу природных бактерий в выборке. Для получения более подробной информации см. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2 : Примеры клеток цилиата из планктона эвтрофического пруда. Примеры показаны из пруда с подсчитываемыми FLB в клетках цилиата (обычно 1-10 трассировщик FLB в клетку, левые 2 microphotograps) сравнено к peritrichous ciliate Pelagovorticella natans (правая сторона microphotograph). Даже в течение короткого, 5 мин инкубационного периода, он стал "чрезмерно помечены" по трассировщик FLB, что делает количественную оценку попадает FLB неточным или почти невозможно. В этом случае предлагается уменьшить количество трассировщика до 1,5%-3% от общего количества бактерий. Однако, как правило, как трассирующие количества и время инкубации можно манипулировать, чтобы оптимизировать количество FLB попадает на одну ячейку. Для получения более подробной информации см. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 : Box-and-whisker участки числа FLB на ячейку Halteria sp. из Зимовского водохранилища (Exp I) (A), пересчитаны до уровня бактериального поглощения в час (B). Данные были обнаружены в различных сезонных условиях, представленных четырьмя примерами с апреля по сентябрь. В верхней части панели А показана информация о температуре воды, добавлены различные трассаторы FLB (%), а также разное время инкубации образцов. Следует отметить, что последние два параметра могут быть изменены для оптимизации количества FLB на клетки, со средним (полная линия) и медиана (dashed line) значения примерно между 5-10 FLB на цилиат ячейки (A). Бары показывают 25-й и 75-й процентилы всех данных (50-180 проверенных ячеек) и усы стоят для 1-го и 99-го процентилей. (B) Различные мелкие буквы указывают на значительные различия в клеточной бактерии ставки Halteria sp. в течение исследуемого периода. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4 : Box-and-whisker участки чисел FLB на ячейку. Сюжеты показаны хлоропластоносного Tetrahymena utriculariae от тройных процедур молодых, зрелых и старых ловушек рефлекса утрикулярии (Exp II) (A),пересчитанном до уровня бактериального поглощения в час(C). Данные были сопоставлены с бактериальной скоростью поглощения дубликатов апохлорических популяций T. utriculariae (B,D) изолированы от ловушек, но поддерживается на смешанной бактериальной подвески растет на зернах пшеницы в темноте. В верхней части панелей A и B добавлены различные трассы FLB (%) и показано разное время инкубации образцов. Следует отметить, что последние два параметра были изменены для оптимизации количества FLB на ячейки, со средним (полная линия) и медиана (dashed line) значения примерно между 5-10 FLB на цилиат ячейки (A, B). Бары показывают 5-й и 95-й процентилы всех данных (50-100 проверенных ячеек), а усы стоят за 1-й и 99-й процентилы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Расшифровка трофического взаимодействия в водных системах всегда бросает вызов28,особенно в нано-планктонных масштабах с участием протеистов и их добычи, бактерий. Когда дело доходит до усвоения питательных веществ пути и количественной оценки, применение методов, успешно используемых на более высоких трофических уровнях менее возможно, из-за высокой сложности биотических взаимодействий. К ним относятся, например, стабильные подходы к маркировке изотопов. Этот протокол показывает преимущества использования эпифлюоресцентной микроскопии и флуоресцентно помеченных бактерий в качестве трассировщика для отслеживания и полуколичественной/оценки углеродного потока (бактериальная добыча: различные протистановые гразеры, включая миксотрофные грастеры29) пути через основание микробных пищевых сетей. Одним из таких преимуществ является высокая точность одноклеточного подхода, а другим является беспрецедентное разрешение в отношении структуры сообщества grazer и различения между различными функциональными гильдиями, видами (Exp I) и даже субпопуляциями одного и того же видов (Exp II).
Критические шаги в протоколе
В протоколе есть несколько важных шагов, которые могут обеспечить использование преимуществ методологии в полной мере. Во-первых, базовое понимание исследуемой среды до начала эксперимента всегда полезно. Это включает в себя микроскопический скрининг разнообразия и изобилия потенциальных пассеров, размеры бактериальной добычи и распределение добычи как 1) в колонке воды (например, вертикальный профиль от эпилимниона до гиполимона) и 2) в случае каньонообразных водохранилищ, на трансекте плотины. Во-вторых, тщательная манипуляция с собранными образцами обеспечит репрезентативные результаты. Температура является чрезвычайно важным фактором, влияющим на большинство микробных процессов12, в том числе протеист выпаса ставок(рисунок 3).
В-третьих, манипулирование количеством трассировщика, добавленного на основе количественной оценки бактериальных клеток или типа пастыря в выборке, гарантирует устранение проблем с перемаркировкой(рисунок 2). Следует отметить, что в темпах поглощения цилиатных видов существует весьма широкий спектр (для деталей см. шаг 7.2); таким образом, для надлежащего применения протокола необходимо предварительное знание основных видов цилиат с коэффициентами их поглощения по времени. Настоятельно рекомендуется проводить предварительные эксперименты с различными суммами трассировщика, чтобы избежать возможного подмаркировки цилиатов (ни один или слишком немногие FLB не берутся за цилиатную ячейку, принося статистически необоснованные данные) или перемаркировку (появляется как большое количество FLB формирование "конденсированных облаков FLB" или стай в цилиатных пищевых вакуолах, упакованных трассирующими, тем самым серьезно ограничивая их точную количественную оценку; см. верхний правый пример на рисунке 2). Следует также отметить, что инкубационные сроки с FLB, как правило, короче, чем 30 мин, так как среднее время пищеварения пикопланктона цилиатами составляет около 1,5 ч, и начинается пищеварение (попадает picoplankton клетки теряет свою типичную форму и цвет) примерно после 45-60 мин30. Аналогичным образом, для получения точных результатов необходимо достичь оптимального разбавления и распределения образцов на фильтре до микроскопического просмотра.
Модификации и устранение неполадок
Основные шаги, возможные изменения и устранение неполадок изменения техники иллюстрируются на рисунке 1 и рисунке 2. Кроме того, следует отметить, что в случаях высокой концентрации деттриальных частиц, фитопланктонных клеток или их колоний в планктоне, такие образцы 1) должны быть соответственно разбавлены для достижения стадии, на которой отдельные клетки grazer могут быть различаются на поверхности фильтра и 2) подвергаться количественной оценке содержания вакуол пищевых продуктов.
Ограничения
Основное ограничение для успешного применения этого метода заключается в наличии различных органических детритов или обильных неорганических/органических частиц с прикрепленными бактериями или агрегатами в количествах, которые препятствуют четкому просмотру образцов под эпифлюоресценцией микроскоп и точная оценка суммы трассировщика добавлены. Следует отметить, что представленный метод трассировщика работает в первую очередь со свободными (т.е. взвешенными) бактериями, которые не прикреплены к частицам. Однако, основываясь на нашем собственном опыте и литературных ссылках (см. предыдущие публикации2,4,8,10,16,18,21 ,26), представленная методология подходит для большинства водных сред. Приведены примеры двух естественных, контрастных систем, отличающихся по трофическому статусу, содержанию детритуса, разнообразию и численности гразеров(рисунок 3 и рисунок 4).
Значение подхода к существующим методам
Важно отметить, что из знания обилия таксон / такса бактериоров и их видов конкретных бактериих ставки, объем бактериативый курс протистана таксон (или общей сборки цилиата) могут быть рассчитаны. Если этот подход применяется к природным средам планктона одновременно как для гетеротрофных флагеллетов, так и для цилиатов (представляющих основные гразеры бактериопланктона2,6,7), протистан время выпаса вызванных оборотом бактериальных популяций в данной среде можно оценить16,17,18,22. Такие данные имеют основополагающее значение для оценки динамики углеродного потока в микробных пищевых свеях.
Будущие приложения
Существуют и другие специфические среды, в которых этот метод, с некоторыми изменениями, может быть успешно использован. К ним относятся активированные системы шлама, рубенные экосистемы, водные отложения и гипертрофические пруды17. Тем не менее, применение в этих богатых питательными веществами и микробами средах требует предварительных тестов для оптимизации протокола относительно надлежащего размера, морфологии и количества трассировщика FLB, которые могут имитировать типичное распределение размеров и другие характеристики хищных бактерий, присущих окружающей среде.
В настоящее время растет интерес к сочетанию этого подхода с катализированным репортером осаждения флуоресценции на месте гибридизации (CARD-FISH), в которой личность клетки grazer (например, гетеротрофный флагеллат) обнаруживается с конкретным FISH-зонд и скорость поглощения основана на содержании FLB в пищевых вакуолах из плевеллатской клетки на том же микроскопическом слайде31. Сложный, новый подход, называемый двойной гибридизации32 представляет собой сочетание FISH зондов на уровнях клетки хищника и хищных бактерий (которые также помечены специально филогенетического штамма, бактериальной линии конкретных FISH зонд). Этот подход является элегантным, но и трудоемким и требует конкретных навыков и опыта31,32, в то время как применение различных изменений подхода FLB поглощения может быть более легко приняты для регулярного использования в лабораториях.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторам нечего раскрывать.
Acknowledgments
Это исследование было поддержано Чешским научным фондом в рамках научно-исследовательского гранта 13-00243S и 19-16554S, присуждаемого К. З. и Д.С., соответственно. Эта статья была также поддержана проектом "Биоманипуляция как инструмент для улучшения качества воды в водохранилищах плотин" (No C.02.1.01/0.0/0.0/16-025/0007417), финансируемый Европейским фондом регионального развития, в оперативных программах исследований, разработок и образования.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



