Summary
Burada sunulan yüksek hassasiyet ve taksonomik çözünürlük ile sucul yırtıcı ökaryotlar otlatma oranları ölçmek için tek hücreli, epifloresan mikroskobik tabanlı teknik için bir protokoldür.
Abstract
Predasyon ve etkileri gibi trofik etkileşimlerin aydınlatılması ekoloji alanında birçok araştırmacının sık rastlanan bir görevidir. Mikrobiyal toplulukların incelenmesi birçok sınırlamaları vardır ve bir yırtıcı, av ve yırtıcı oranları belirlemek genellikle zordur. Burada sunulan bir tracer olarak floresan etiketli av eklenmesine dayalı optimize edilmiş bir yöntemdir, hangi suda yırtıcı ökaryotlar da otlatma oranları güvenilir quantitation ve daha yüksek trofik seviyelere besin transferi tahmini sağlar.
Introduction
Heterotrofik prokaryotlar su sistemlerinde önemli bir biyolojik bileşendir ve planktonbiyokütlesininönemli bir kısmını 1,2,3. Onların bolluk, çeşitlilik ve aktivite kontrol faktörler biyojeokimyasal bisiklet rollerini anlamak için çok önemlidir (yani, organik karbon ve diğer besin ve prokaryotlardan daha yüksek trofik seviyelere enerji akışı kaderi). Protozoon otlatma bu önemli faktörlerden biridir. Heterotrofik nanoflagellates ve silyates Bacterivory prokaryotik bolluk üzerinde güçlü bir yukarıdan aşağıya kontrol empoze, toplum fonksiyonu, yapısı, çeşitlilik, ve hatta hücresel morfoloji ve belirli bakteri gruplarının büyüme hızı4, 5,6. Bazı sistemlerde, protistler bakteriyel mortalitenin başlıca nedeni olarak hizmet6,7.
Bir süredir kullanılan protozoan bakteritomutaminin değerlendirilmesinde kullanılan standart yaklaşım, floresan olarak etiketlenmiş bakterilerin (FLB) av analogları ve epifloresan mikroskopisi olarak kullanılmasını içerir. Hücreye özgü alım oranları, protistan gıda vakuollerinde etiketlenmiş av partiküllerinin sayısının seçili bir zaman rotası8üzerinden ölçülmesi ile belirlenebilir. Bu yaklaşımın çeşitli avantajları vardır. Tracer doğal yırtıcı ve av toplulukları ile doğal örneklere eklenir. Kuluçkadan önce minimum numune manipülasyonu, ilave FLB izleyicisi tarafından minimum numune değişimi vardır ve inkübasyon süreleri, yerinde koşullara yakın koşullarda elde edilen sağlam sonuçları sağlamak için kısadır. Alternatif olarak, düşük sayıda bakteriyvorous protistveya zooplankton (örneğin, offshore deniz sistemleri) olan ortamlarda, flb'nin kaybolma oranları düşük miktarlarda ki numunelere eklenebilir (%2-3 izleyici) uzun vadede akış sitometrisi ile tespit edilebilir (12-24 saat) kuluçka deneyleri. Daha sonra, başlangıç ve bitiş noktalarındaki FLB sayıları (tüm bakterivorların etkisini entegre etmek) akış sitometrisi ile ölçülür (ayrıntılar için, önceki yayına bakın9). Ancak, böyle bir parametre sadece doğrudan herhangi bir protistan ve zooplankton otlatma grupları veya türlerine atfedilemez toplam toplam bakteriyon oranları temsil eder.
Genel olarak, protistan türlerinin veya morfotipe özgü bakteriyel mortalite oranlarının doğru ve ekolojik anlamla ölçülmesi zor olabilir. Bazı protistler seçici otlatıcılar, ve boyutu ve eklenen FLB tracer hücre şekli av alım Doğal oranları bozabilir10,11. Ayrıca, protistan aktivitesi ve metabolizması yüksek ısıya duyarlı12; bu nedenle, eklenen FLB izleyici miktarı dikkatle her bir örnek türü için manipüle edilmesi gerekir (sadece doğal bolluk dayalı, boyut, ve bakteriroriorların morfolojisi ve bakterivores hakim türleri, ama aynı zamanda sıcaklık). Çoğu çalışma toplu protistan otlatma aktivitesi üzerinde duruluyor; ancak, belirli protistan türlerinin bakteriyonu genellikle çok daha yüksek bir bilgi değerine sahiptir ve tercih edilebilir. Bu durumda protist türlerin taksonomik bilgisine bir örnekte mevcut ve davranışlarının anlaşılması gerekmektedir. Bu nedenle, belirli bir protistan grubu veya türüne atfedilen türe özgü bakteriton oranları hakkında sağlam sonuçlar elde etmek için önemli miktarda zaman ve emek gereklidir.
Tüm bu zorluklara rağmen, bu yaklaşım doğal ortamlarda protistan bakteritoru değerlendirmek için mevcut en uygun araç olmaya devam etmektedir. Burada sunulan sumikrobiyal ekoloji çalışmalarında bir izleyici olarak FLB kullanmak için kapsamlı, kolay takip yöntemidir. Yaklaşımın bahsedilen tüm sorunlu yönleri hesaba katılır ve daha iyi bir iş akışı açıklanır, zıt ortamlardan iki deney ve karşıt silikat türleri örnek olarak tanımlanır.
İlk vaka çalışması, Çek Cumhuriyeti'ndeki mezotrofik Římov su rezervuarından epilimnetik bir ortamda yapılmıştır ve bu da çoğu yüzey tatlı su cismiyle karşılaştırılabilir otlatıcı ve bakteriyel bolluklar gösterir (cf.5,7). İkinci vaka çalışması sucul etobur bitki Utricularia reflexatuzakları içinde son derece özel bir ortamda yapılmıştır , her iki otlatma mikofrofik siliates son derece yüksek sayıda barındıran (Tetrahymena utriculariae) ve bakteri hücreleri. Her iki numune türünde hücreye özgü otlatma oranları ve bakteriyel duran stokların hesaplamaları gösterilmiştir. Sonuçların bir dizi ekolojik yorumu tartışılır ve olası takip çalışmalarının örnekleri nihayet önerilmektedir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Örnek toplama
-
Rezervuar su numunesi toplama: ilk vaka çalışması (Exp I; düşük doğal in situ yırtıcı ve av bolluk sistemi)
- Uygun bir derinlikte istenilen yerden su örnekleri toplayın. Numuneleri laboratuvara taşıma sırasında sıcaklık kontrollü bir soğutucuda yerinde sıcaklıkta (sıcaklık şokundan kaçınarak; protistlerin alım oranlarının ısıya bağlı olduğu unutulmamalıdır) olarak saklayın.
NOT: Örneklememiz mezo-ötrofik kanyon şeklindeki Římov rezervuarında (Güney Bohemya, hacim 34.5 x 106 m3,maksimal derinlik 43 m, ortalama bekletme süresi 100 gün, dimiktik) yapılmıştır. Örnekleme alanı 30 m derinlikte, baraja yakın bir yerde bulunuyordu. 0,5 m derinlikte karışık bir numune 2-l Friedinger örnekleyici tarafından toplandı. - Bölüm 1.2'ye mümkün olan en kısa sürede devam edin.
- Uygun bir derinlikte istenilen yerden su örnekleri toplayın. Numuneleri laboratuvara taşıma sırasında sıcaklık kontrollü bir soğutucuda yerinde sıcaklıkta (sıcaklık şokundan kaçınarak; protistlerin alım oranlarının ısıya bağlı olduğu unutulmamalıdır) olarak saklayın.
-
Etobur Utricularia refleksa bitkilerin tuzaklarından sıvı toplama: ikinci vaka çalışması (Exp II; yüksek yırtıcı ve av bollukları, son derece küçük örnek hacmi ile bir sistem)
- Yavaşça su altında bitkiler sallamak, yetiştirme kabından kaldırmak ve aşırı su emmek için emici malzeme üzerine yerleştirin. Bitkilerin sağlamlığına ve tuzakların büyüklüğüne bağlı olarak, 8-10 bitki bireyleri seçin.
- Her çekimi, bindirme organlarını taşıyan yaprak düğümlerini sayarak kabaca eşit parçalara bölün. Her çekim segmenti genç, orta yaşlı ve eski tuzakları temsil eden karışık örnekleri toplamak için hizmet edecektir.
- Peristaltik bir pompaya numune almak için ince bir cam kılcal damar ve Eppendorf flakon takın. Kılcal damar ucunu kapan ın açılmasına takın. Vakum pompası kullanarak, her tuzak yaş kategorisi için 900 ± 100 μL tuzak sıvısı toplanana kadar her kapandaki tüm sıvıyı emdirin.
- Protistan otlatma deneyleri için havuzlu kapan sıvısının 200 μL'lik trilye alt örneklerini kullanın. Bunları bölüm 3'te ayrıntılı olarak belirtildiği şekilde hemen işle. Numunenin kalan ±300 μL'sini, aşağıda açıklandığı gibi, sıvıda yaşayan mikrobiyal bileşenlerin diğer tüm analizleri için saklar (bölüm 2).
- Hemen bölüm 2'ye gidin.
2. Toplanan numunelerin fiksasyonu
- Exp I ve II: bakteriyel numaralandırma için su/tuzak sıvı alt numunelerini (sırasıyla bölüm 4; yaklaşık 20 mL ve 0,3 mL) formaldehit ile en az 1 saat boyunca düzelterek %2 nihai hacim elde edin: her numunede hacim konsantrasyonu.
NOT: Formaldehiti sadece duman kaputunda kullanın ve numuneleri manipüle ederken her zaman eldiven takın.
3. Numune filtrasyonu
- Numune seyreltme (Exp I): rezervuar su numuneleri için seyreltme gerekmez. (Exp II): epifloresan mikroskopi ile sayma dan önce filtre yüzeylerinde hedef mikropların uygun bir dağılım elde etmek için parçacıksız MQ su ile tuzak sıvı örnek 10x-100x seyreltmek.
- Filtre 1-2 mL (Exp I) rezervuar su veya 10-30 μL (Exp II) siyah 0,2 μm gözenek boyutu filtreler üzerine bakteriyel sayma için tuzak sıvıalt örnek, bir filtrasyon hunisi (25 mm çapı) kullanarak.
- 4 dakika boyunca DAPI (4',6-diamidino-2'-fenilindole dihidroklorür, %0.2 son konsantrasyon) ile filtreleri lekeleyin.
NOT: Cilt ve çalışma yüzeyi kontaminasyonundan kaçının ve eldiven giyin. - Mikroskop slaytÜzerinde bir damla daldırma yağı (floresan mikroskop için) üzerine konsantre mikroplar ile filtre yerleştirin. Filtrenin ortasına başka bir yağ damlası yerleştirin ve bir kapak ile kaplayın, yağ eşit olarak dağıtılır emin olun.
- Bu noktada, tercihen numuneleri hemen veya alternatif olarak, daha fazla analiz edilinceye kadar birkaç hafta ile aylarca dondurucuda (-20 °C) saklayın.
4. Filtrelerde bakteri numaralarının numaralandırması
- Slaytı epifloresan mikroskobun altına yerleştirin (florokrom DAPI'ye karşılık gelen filtre seti ile). Oküler birine 10 x 10 sayma ızgarası yerleştirin. Slaydını rasgele bir konuma taşıyın.
- Sayma ızgarası alanında bakteri hücrelerini (mavi floresan) ölçün (büyütme 1000x altında). Sayımlarda, sayma ızgarasının sol ve üst kenarlarından geçen hücreleri içerirken, sağ ve alt kenarlarda bulunanhücreleri hariç tkar.
- Başka bir rasgele konuma taşıyın ve toplam sayılan 500 hücretutarında en az 10-15 sayma ızgaraları üzerinde numaralandırmatekrarlayın.
- Belirli bir mikroskop ve büyütme için, bir ızgara alanının filtrenin toplam etkin filtrasyon alanına oranı bilgisine dayalı bir dönüşüm faktörü belirleyin. Daha sonra, sayılan şebeke sayısına göre sayılan toplam hücre sayısını bölün ve ızgara başına ortalama bakteri sayısı elde edin.
- İkinci parametreyi kurulan dönüşüm faktörüyle çarpın ve mL başına toplam bakteri bolluğunu elde etmek için bir numunenin mL başına elde edilen sayıyı (filtrelenen numunenin hacmine bağlı olarak) normalleştirin.
5. Protistan bolluğunun belirlenmesi
- Su örneğini (Exp I) veya trap sıvı (Exp II) alt numunelerini glutaraldehit (%1 nihai konsantrasyon, fiksasyondan haftalar sonra işlenecek parçacıklar içeren klorofil varlığı olan numuneler için daha uygun) veya formol-tiyosülfat decolorization tekniği aşağıda belirtilmiştir.
NOT: Her iki koruma tekniği de protistlerin gıda vakuollerinden yutulan malzemenin egesini önler8. - Formol-tiyosülfat renklendirme tekniği ile ilgili olarak, Lugol çözeltisinin 100 μL/1 μL'lik kısmını su/tuzak sıvı alt numunesinin 20 mL/200 μL'sine (Sırasıyla Exp I/Exp II) ekleyin.
- 0.5 mL/50 μL borat tamponlu formalin ilavesi ile hemen takip edin ve sırasıyla %3 sodyum tiyosülfat (Exp I/Exp II) 20 μL/2l'yi takip edin.
NOT: Sodyum tiyosülfat, lugol sarı rengini renkten arındırarak epifloresan mikroskobu altında hücrelerin gözlemlemesini sağlar8. - 1 μm gözenek boyutundaki siyah polikarbonat filtrelere bilinen bir numune hacmini (hedef protist sayısına bağlı olarak) filtreleyin.
- Protist türlerin sayısını tahmin etmek, sayma ızgarasını kullanarak büyütme 600x altında en az 200 hücre sayarak (yukarıya bakın).
- Filtreleme hunisindeki vakum altındaki numunenin hacmini düşük vakum la yaklaşık 2 mL'ye düşürün. Sonra, under-pressure bırakın ve DAPI florokrom ekleyin (4',6-diamidino-2-fenilindole dihidroklorür13, 0.2% son konsantrasyon) için 2 dakika.
6. Plankton örneklerinde sitiatların topluluk yapısının belirlenmesi
NOT: Tatlı su habitatlarındaki ciliate toplulukları çok çeşitlidir14,15,16,18, ve mikroskobik tayinleri zordur. Silikat gruplarının fonksiyonel loncalar10,14,16,17 olarak sıralanması, pelajik bakterivorlar olarak farklı silikat gruplarının daha ayrıntılı analizini sağlar.
- Aşağıdakileri birleştirerek toplumsal yapıyı değerlendirin:
- Epifloresan mikroskopisi DAPI lekeli örnekler (farklı boyutlarda ve morfolojide makro ve mikro çekirdeklerin parlak floresanile silyat hücreleri lokalize etmek için) floresan etiketli bakterilerin alımı ile birlikte (FLB8; ayrıntılar için, aşağıya bakınız), bakterilerle beslenme yeteneğini izleyin.
- Seçili vakalarda canlı örnek gözlem17,19. Yukarıdaki yaklaşımlar ve kriterler farklı taksonomik kategorilere siliates gruplandırma için kullanılan daha fazla bilgi için, önceki yayınlar16,17bakın.
NOT: Atıf yapılan çalışmalar, stichotrichia (Halteria ve Pelagohalteriacinsi) ve Oligotrichia (yani Rimostrombidium spp.) gelen omnivor türler arasında en önemli pelajik tüketiciler olduğunu göstermiştir tatlı su habitatlarının büyük bir çoğunluğunda bacterioplankton10,17,18.
7. Silikat otlatma oranlarının tahmin
- Ortalama izleyici sayısındaki değişikliklere göre bakterilerüzerindeki siliatların alım oranlarını hesaplayın [yani, kuluçka süresine bağlı olarak flb8 (5-15 dakika)] ve toplam bakterilerin en fazla %5-15'ini oluşturan FLB'nin izleyici miktarı.
- Farklı protistan türleri arasında alım oranlarını karşılaştırmak için, gerçek kuluçka süresi ve tracer FLB oranına dayalı hesaplamalar ile, saatte siliat başına bakteri sayısı olarak alım oranlarını normalleştirmek ekledi.
NOT: Doğal örneklerde hem hücre hem de türe özgü ve toplu bakterilasyon oranlarını tahmin etmek için FLB yöntemi uygulamasının genel şeması Şekil 1'degösterilmiştir. - FlB'nin bakteriyel suşlardan tatlı su ortamına hazırlanması8
- Araştırılan su sistemindeki bakteriplankton/bakteri hücrelerinin tipik boyutlarını etkili bir şekilde taklit etmek için uygun bir boyut (ortalama hücre hacmi = MCV) ve bakterilerin morfolojisini seçin.
NOT: Exp I için, cins Limnohabitans ve Polynucleobacter çalışma yerinden izole suşların bir karışımı kullanılmıştır (yani, göller ve göletlerde son derece bol bakteritoplankton)20. Morfoloji ve suşların boyutları hakkında ayrıntılı bilgi için, öncekiyayınlar3,17,18,21bakın . - Erken sabit fazda 15 dakika boyunca kültürden bakteri hücrelerini (5.000 x g)hasat edin ve seçilen yerde tipik MCV bakteri mcv'sine karşılık gelen karışımdaki hücrelerin MCV ± SD'sini veren sayısal bir oranda karıştırın.
- 10 mL fosfat tamponlu salin (PBS; pH = 9) peletleri askıya alın.
- Sarı-yeşil floresan boya 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF, proteinlere bağlanır) fosfat-tuzlu tampon hücre süspansiyon ve 2 saat için 60 ° C su banyosu kuluçka 2 mg ekleyin.
- Kuluçkadan sonra hücreleri aşağı santrifüj edin, DTAF çözeltisini dekantın ve PBS ile 3x yıkayın ve santrifüj edin.
- Son yıkamadan sonra PPi-tuzlu arabelleğin 20 mL'lik hücrelerini yeniden askıya alın.
- FlB süspansiyon ve pipet 1,5 mL aliquots içine 2 mL kriyo-şişeler, sonra dondurulmuş tutmak (at -20 °C) PPi-tuzlu tampon kullanım akadar.
- Ön filtre PPi-tuzlu tampon bir sonraki adımda kullanılmak üzere 0,2 μm polikarbonat filtre ile.
- FLB konsantrasyonu belirlemek için, küçük bir aliquot (genellikle 20-40 μL) parçacıksız PPi-tuzlu tampon 2 mL, birkaç 2 s patlamalar için 30 W sonicate ve epifloresans yoluyla numaralandırma için 0,2 μm polikarbonat siyah filtre üzerine filtre aktarın mikroskopisi (1.000X büyütme) DTAF (448 nm/520-540 nm) için optik filtre ayarları altında.
- Araştırılan su sistemindeki bakteriplankton/bakteri hücrelerinin tipik boyutlarını etkili bir şekilde taklit etmek için uygun bir boyut (ortalama hücre hacmi = MCV) ve bakterilerin morfolojisini seçin.
- Siliate bakterisivory tahmini için tracer tekniği
- Doğal planktonik habitatlarda otlatma deneyleri için, 300 mL numuneyi iyi durulanmış 1 L şişeye dağıtın ve 15 dakika boyunca yerinde sıcaklıkta kuluçkaya yatırın (protistlerin taşıma şokundan kurtulmalarını sağlamak için).
- Toplam bakterilerin %5-15'ini oluşturmak için FLB izleyicileri ekleyin ve mevsime ve su sıcaklığına bağlı olarak eklenen miktarlar.
NOT: Silyate türlerine özgü alım oranlarında çok geniş, mevsime bağlı bir spektrum vardır (örneğin, 101-104 bakteri siliat-1 saatte)10,16, 17,18,22,23,24. - Yüksek alım oranları (genellikle yaz aylarında) ile siliates gelişmiş oluşum dönemlerinde, aynı zamanda çok düşük FLB eklemeler ile paralel bir kuluçka çalıştırmak, izleyici FLB tarafından siliate vakuollerin aşırı yüklenmesi önlemek için toplam bakterilerin sadece% 2-4 oluşturan (bkz. örnekler Şekil 2'de).
- 5-15 dakika FLB ile inkübat silikate / plankton örnekleri.
- Protistlerin 8 gıda vakuollerinden yutulan malzemenin egestion önlemek için örnekfiksasyon için iki olasılık vardır. %1 glutaraldehit (yosun gibi klorofil içeren partiküllere sahip numuneler için daha uygun olan son konsantrasyon) ekleyerek kuluçkaları sonlandırın. Alternatif olarak, Lugol çözeltisinin 100 μL/10 μL'sini 20 mL/200 μL su/tuzak sıvıalt numunesine kullanın ve hemen ardından 0,5 mL/10 μL borat tamponlu formalin ilave edilir ve ardından %3 sodyum tiyosülfat (I/Exp II, sırasıyla).
- Fiksatif ekledikten sonra, silikat hücrelerinin tam olarak korunmasını sağlamak için numuneler 4 °C'de karanlıkta en az 1 saat dinlendirin.
- 4-30 mL/10-30 μL (Exp I/Exp II, sırasıyla; hacim silikat bolluğuna bağlıdır) ve DAPI ile leke (son konsantrasyon% 0.2 wt/vol; ayrıntılar için, yukarıdaki adım 3.2 bakınız) doğal plankton alt örnekleri alın.
- 1 μm siyah filtreler den geçirin ve siliates (600x büyütme) saymak ve önceki yayınlarda ayrıntılı olarak (çoğunlukla 1000x büyütme) yutulan FLB izleyicilerin sayısını numaralandırmak için epifloresan mikroskobu ile inceleyin2,17 . Numuneleri muhafazadan sonraki 7 gün içinde inceleyin.
- Toplam protozoon/türe özgü otlatma tahmin etmek için, tüm situ'ların ortalama alım oranlarını veya sadece situ bolluk tarafından tespit edilen situ türlerini çarpın.
- Římov su deposundan in situ verilerinden hücre başına alım oranlarının hesaplanmasına örnek olarak aşağıdaki gibi açıklanmıştır:
- Bakteri konsantrasyonunun 3.55 x 106 bakteri/mL ve tracer FLB'nin 0.25 x 106 FLB/mL olduğunu varsayalım, bu da toplam bakteri partiküllerinin toplamı olan 3.8 x 106 bakteri/mL'dir (doğal bakteri + FLB = av partiküllerinin %100'ü) doğal örnekte fagotrofik protistler için kullanılabilir.
NOT: Böylece eklenen FLB izleyicileri toplam bakteri partiküllerinin %6,58'ini (0.25/0.038'lik bir proje) temsil eder. Halteria başına flb ortalama sayısı 5 dk kuluçka 6.2 FLB olduğunu. - Saat başına alımı normalleştirmek için aşağıdaki hesaplamayı kullanın: (6,2 x 12)/(6,58/100) = Halteria hücre/saat başına 1131 bakteri.
NOT: Değişken su sıcaklıkları altında tespit edilen Halteria sp. bireysel alım oranlarının dağılımları, flb'nin eklenen izleme miktarı (yüzde olarak) ve FLB ile farklı kuluçka süreleri için Şekil 3'ebakınız.
- Bakteri konsantrasyonunun 3.55 x 106 bakteri/mL ve tracer FLB'nin 0.25 x 106 FLB/mL olduğunu varsayalım, bu da toplam bakteri partiküllerinin toplamı olan 3.8 x 106 bakteri/mL'dir (doğal bakteri + FLB = av partiküllerinin %100'ü) doğal örnekte fagotrofik protistler için kullanılabilir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Örnek deney Ben Římov su rezervuar (Güney Bohemya, CZ), hangi yerinde yırtıcı ve av bolluğu düşük doğal bir site çalıştırıldı. Temsili veriler omnivor siliate türleri Halteria grandinellaiçin rapor edilir , picoplankton bol ve verimli bir otlatma olduğunu (<2 μm) parçacıklar10,16,17,18 ,22. Şekil 3, Saatte bakteriyel alım oranlarına göre yeniden hesaplanan Halteria sp. hücresinden(Şekil 3A)hücre başına FLB sayısının kutu ve bıyık çizimlerini gösterir (Şekil 3B) Nisan, Mayıs, Ağustos ve Eylül aylarında yapılan dört ayrı deneyde tespit edilmiştir. Silyate alım oranlarında yüksek değişkenlik vardı, büyük ölçüde su sıcaklığındaki zamansal farklılıklardan kaynaklanıyordu.
Q10 parametresi, mikrobiyal proseslerin 10 °C12sıcaklık artışı yla yaklaşık 2,5 kat daha hızlı çalışmasını yansıttığı nı ve bu da bakterilerin silikate alım oranlarını da karşıladığını belirtmek gerekir. Bu fizyolojik kural göz önünde bulundurularak, flb ve kuluçka sürelerinin önemli ölçüde farklı oranlarda farklı mevsimler için kullanılmıştır (ayrıntılar için Bkz. Şekil 3A). Böylece, beklenen sıcaklık etkisi telafi edildi ve deneysel ayar silikat hücre başına yaklaşık 5-10 FLB arasında alım oranları optimize ortalama ve medyan değerleri verdi. Genellikle, yutulan FLB bu miktarlar kolayca sayılabilir (Şekil 2örneklere bakın , iki sol fotoğraf), izleyici kesin tahminler üreten (çoğunlukla ciliate başına 1-15 FLB arasında olmak) alım oranları. Ancak, modifiye FLB tracer eklendi nedeniyle (%) ve örnek kuluçka farklı zamanlarda mutlak değerleri (saat başına silyat otlatılmış bakteri sayısı olarak ifade) önemli ölçüde farklı (p < 0.01, Kruskal-Wallis testi; dunn çoklu karşılaştırma testi takip, p < 0.05; Şekil örneklere bakın 3B) deneyler arasında. Veriler ayrıca Halteria grandinellaplanktonik popülasyonlarda mutlak bakteritonik oranlarında tipik doğal değişkenlik göstermektedir , onların ortalama ve orta değerleri yakın bir maç ile(Şekil 3).
Peritrichous silikates gibi örneklerde yüksek verimli bakteriyvoysal silikatların varlığında, toplam bakterilerin %5-10'u tipik izleyici miktarlarında FLB tarafından ağır bir şekilde "aşırı etiketli" hale gelebilirler (Şekil 2'dekisağ yan fotoğrafa bakınız). Bu, yutulan FLB'nin doğru niceliğini kuvvetle sınırlayabilir. Bu gibi durumlarda, toplam bakterilerin sadece%1.5-3'ünü oluşturan flb sadece düşük miktarlarda ek paralel kuluçka çalıştırmak için önerilmektedir. Ancak, genellikle hem izleyici miktarları hem de kuluçka süreleri hücre başına FLB sayısını optimize etmek için manipüle edilebilir(Şekil 2).
Örnek deney II: Görüntülenme, siliat Tetrahymena utriculariae'nin bakteriyon oranlarını deneysel olarak tahmin etmek için yalnızca çok küçük bir örnek hacminin mevcut olduğu büyük yırtıcı ve av bolluklarına sahip bir sistemden elde edilen verilerdir. 25. Bu etobur Utricularia refleksa bitkilerin tuzakları sadece yüksek bolluk yaşayan ılımlı bir bakteriyel otlatma26,27. Şekil 4, t. utriculariae'nin hücre başına flb sayısının kutu ve bıyık çizimlerini farklı deneysel ayarlar altında(Şekil 4A,B)gösterir ve saatte bakteriyel alım oranlarına yeniden hesaplanır (Şekil 4 C,D) genç, olgun ve yaşlı tuzaklarda tespit edilir. İlginçtir tuzaklarda, siliat T. utriculariae kloroplast taşıyan popülasyonlar tespit edildi, T. utriculariae apochloric popülasyonları tuzaklardan izole edildi ve karışık bakteriyel süspansiyon üzerinde sürdürüldü karanlıkta buğday taneleri (ayrıntılar için, bir önceki yayında Şekil 1'e bakın26).
Kloroplast taşıyan popülasyonlar ışık lı tuzaklarda yaşarlar; böylece, kloroplastlar siliat ekine ek bir organik karbon kaynağı ve oksijen sağlayabilir. Test edilen hipotezlerden biri, apoklorik silikat popülasyonlarının bakterileri önemli ölçüde daha hızlı otlatmasıydı, çünkü bakteriler silyatın karanlık olarak yetişen izole alt popülasyonları için mevcut tek partikül organik karbon kaynağını temsil ediyordu.
Gerçekten de, Utricularia refleksasının genç, olgun ve eski tuzaklarında yaşayan silyatların bakteritolü oranlarında anlamlı bir fark bulunmamakla birlikte(Şekil 4A,C), T. utriculariae'nin apoklorik popülasyonları sıyrılmış bakteriler önemli ölçüde (p < 0.01, Kruskal-Wallis testi; ardından Dunn'ın çoklu karşılaştırma testi, p < 0.05), genç, olgun ve eski tuzaklarda yaşayan kloroplast taşıyan siliatlardan yaklaşık 3 kat daha hızlıdır(Şekil 4C,D). Yine, hem izleyici miktarlarının hem de kuluçka sürelerinin(Şekil 4A,B, üst) hücre başına FLB sayısını optimize etmek için (genellikle 1-15 arasında) değiştirildiğini ve ortalama ve ortanca değerlerin 5 FLB/siliat e civarında olduğunu unutmayın. Bu sayılar siliate gıda vakuolleri ayırt edilebilir ve doğru tracer sayma izin. Ancak, saatte otlanan bakterilerin mutlak sayıda ifade, kloroplast taşıyan ve apochloric popülasyonları yaklaşık 350 ve 1.000 bakteri saatte siliate, sırasıyla. Bu deneysel kurulum çarpıcı farklı çevresel kısıtlamalar altında yaşayan aynı siliat türlerinin iki ayrı alt popülasyonların metabolik ve fizyolojik özellikleri içine yeni anlayışlar getirdi25,26, 27. yıl.
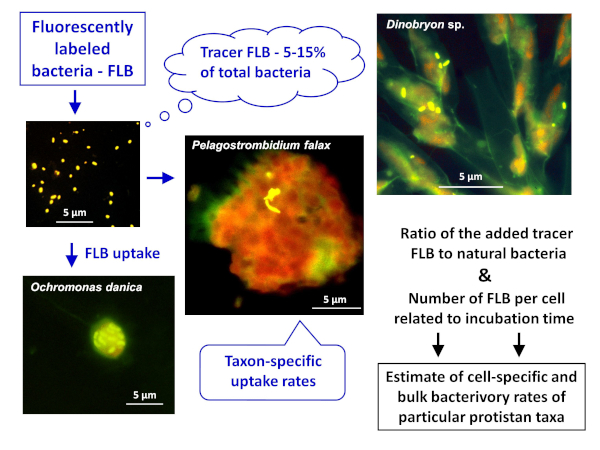
Şekil 1 : Floresan etiketli bakterilerin (FLB) hücre ve türe özgü otlatma oranlarını, yutulan tracer FLB oranından numunedeki toplam doğal bakteri sayısınagöre tahmin etmek için kullanma nın iş akışı. Daha fazla bilgi için protokolün 7. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2 : Ötrofik fishpond plankton hücreleri örnekleri. Örnekler siliat hücreleri (genellikle hücre başına 1-10 tracer FLB, sol iki mikrofotograps) peritrichous ciliat Pelagovorticella natans (sağ tarafı mikrofotoğraf) ile karşılaştırıldığında sayılabilir FLB ile gölet gösterilir. Kısa, 5 dk kuluçka döneminde bile, bu "aşırı etiketli" tracer FLB tarafından, yutulan FLB quantitation yanlış veya neredeyse imkansız haleoldu. Bu durumda, toplam bakterilerin %1.5-3'üne kadar izleyici miktarının azaltılması önerilmektedir. Ancak, genellikle hem izleyici miktarları hem de kuluçka süreleri hücre başına yutulan FLB sayısını optimize etmek için manipüle edilebilir. Daha fazla bilgi için protokolün 7. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3 : Římov rezervuar (Exp I) (A) dan Halteria sp. hücre başına FLB sayısı kutu ve bıyık çizimleri, saat başına bakteriyel alım oranları yeniden hesaplanır (B). Veriler, Nisan'dan Eylül'e kadar dört örnekle temsil edilen farklı mevsimsel ayarlar altında algılandı. Panel A'nın üst kısmında su sıcaklığı, farklı FLB izleyicileri (%) ve farklı numune kuluçka süreleri hakkında bilgi gösterir. Bu son iki parametre hücre başına FLB sayısını optimize etmek için değiştirilebilir unutulmamalıdır, ortalama (tam çizgi) ve medyan (kesik çizgi) değerleri yaklaşık arasında 5-10 FLB siliat hücre başına(A). Barlar tüm verilerin 25 ve 75 yüzdelik (50-180 hücreleri incelenmiş) ve bıyık1 ve 99 yüzdelik için standı göstermektedir. (B) Farklı küçük harfler, incelenen dönemde Halteria sp. hücreye özgü bakteritoivory oranlarında önemli farklılıklar göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4 : Hücre başına FLB sayısının kutu ve bıyık çizimleri. Plots kloroplast taşıyan Tetrahymena utriculariae genç, olgun ve Utricularia refleksa (Exp II) (Exp II)(A),saat başına bakteriyel alım oranları(C)olarak yeniden hesaplanan eski tuzakları triplicate tedaviler gösterilir. Veriler, tuzaklardan izole edilmiş ancak karanlıkta buğday taneleri üzerinde yetişen karışık bakteriyel süspansiyonda muhafaza edilen T. utriculariae (B,D)yinelenen apoklorik popülasyonlarının bakteriyel alım oranlarıile karşılaştırıldı. A ve B panellerinin üst kısmında farklı FLB izleyicileri eklendi (%) ve örnek kuluçka farklı kez gösterilir. Bu son iki parametre hücre başına FLB sayısını optimize etmek için modifiye olduğunu belirtmek gerekir, ortalama (tam çizgi) ve medyan (kesik çizgi) değerleri yaklaşık arasında 5-10 FLB siliat hücre başına(A,B). Çubuklar tüm verilerin 5 ve 95 yüzdelik (50-100 hücreleri incelenmiş) gösterir ve bıyıklar 1 ve 99 yüzdelik için standı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Sucul sistemlerde trofik etkileşimi çözmek her zaman zordur28, özellikle protistler ve av, bakterileriçeren nano-plankton ölçeklerde. Besin alımı yolları ve niceleme söz konusu olduğunda, biyotik etkileşimlerin yüksek karmaşıklığı nedeniyle, daha yüksek trofik seviyelerde başarıyla kullanılan yöntemlerin uygulanması daha az mümkündür. Bunlar, örneğin, kararlı izotop etiketleme yaklaşımları içerir. Bu protokol, karbon akışını izlemek ve yarı ölçmek/tahmin etmek için epifloresan mikroskobu ve floresan olarak etiketlenmiş bakterileri kullanmanın avantajlarını gösterir (bakteriyel av: miksotrotrofik otlatçılar dahil olmak üzere çeşitli protistan otlatıcılar29) mikrobiyal gıda ağları nın tabanından geçen yollar. Böyle bir avantajı tek hücreli yaklaşımın yüksek doğruluk, ve diğer otlayıcı toplum yapısı ile ilgili benzeri görülmemiş bir çözüm ve farklı fonksiyonel loncalar arasında ayrım, türler (Exp I) ve hatta aynı alt popülasyonlar türler (Exp II).
Protokoldeki kritik adımlar
Protokolde, metodolojinin avantajlarının tam potansiyellerine kullanılmasını sağlayacak birkaç kritik adım vardır. İlk olarak, deney başlamadan önce çalışılan ortamın temel bir anlayış her zaman yararlıdır. Bu, su sütununda (örn. epilimniyondan hipolimnion'a dikey profil) ve 2) mevcut potansiyel otlayıcıların çeşitliliğinin ve bolluğunun mikroskobik taramasını, bakteriyel av büyüklüklerini ve av dağılımını içerir. kanyon şeklindeki rezervuarlar, baraj giriş transect üzerinde. İkinci olarak, toplanan numunelerle dikkatli manipülasyon temsili sonuçlar sağlayacaktır. Sıcaklık, protist otlatma oranları da dahil olmak üzere en mikrobiyal süreçleri etkileyen son derece önemli bir faktördür12(Şekil 3).
Üçüncü olarak, bakteri hücrelerinin niceliklerine veya numunedeki otlayıcı tipine göre eklenen izleyici miktarının manipüle edilebilmesi, aşırı etiketleme ile ilgili sorunların(Şekil 2)ortadan kaldırılmasını sağlayacaktır. Silyate türlerine özgü alım oranlarında çok geniş bir spektrum olduğu unutulmamalıdır (ayrıntılar için, bkz. adım 7.2); bu nedenle protokolün uygun şekilde uygulanabilmek için, ana silikat türlerinin zaman-kurs alım oranları ile önceden bilinmesi esastır. Olası silyate alt etiketleme (hiçbiri veya çok az FLB silikat hücre başına alınır, istatistiksel olarak sağlıksız veri verim) veya aşırı etiketleme (FLB çok sayıda olarak görünür) önlemek için farklı tracer miktarları ile ön deneyler çalıştırmak için şiddetle tavsiye edilir "Yoğunlaştırılmış FLB bulutları" veya izleyiciler tarafından paketlenmiş siliate gıda vakuolleri sürüleri oluşturarak, böylece ciddi onların hassas nicelik sınırlayan; bkz. Şekil 2'dekisağ üst örnek ). Ayrıca flb ile kuluçka süreleri genellikle 30 dakika daha kısa olduğu unutulmamalıdır, siliates tarafından pikoplankton ortalama sindirim süresi yaklaşık 1.5 h olduğundan, ve sindirim başlar (yutulan picoplankton hücreleri tipik şekil ve renk kaybeder) yaklaşık 45-60 dksonra 30. Benzer şekilde, doğru sonuçlar için mikroskobik görüntüleme den önce filtrede numunelerin optimum seyreltilmesi ve dağıtımı nın sağlanması gerekir.
Değişiklikler ve sorun giderme
Tekniğin önemli adımları, olası modifikasyonları ve sorun giderme modifikasyonları Şekil 1 ve Şekil 2'degösterilmiştir. Ayrıca, detrital partiküller, fitoplankton hücreleri veya plankton kolonilerinin yüksek konsantrasyonlarda durumlarda, bu tür örnekler 1) buna karşılık bireysel otlatma hücreleri olabilir bir aşama elde etmek için seyreltilmiş olması gerektiği unutulmamalıdır filtre yüzeyinde ayırt ve 2) gıda vacuolle içeriğinin nicelik tabi tutulmalıdır.
Sınırlama
Bu yöntemin başarılı bir şekilde uygulanması için temel sınırlama epifloresans altında net numune görüntüleme önlemek miktarlarda bağlı bakteri veya agregalar ile çeşitli organik döküntü veya bol inorganik / organik parçacıkların varlığında yatıyor mikroskop ve bir izleyici miktarının kesin tahmini eklendi. Bu sunulan tracer tekniği öncelikle parçacıklara bağlı olmayan serbest (yani, askıda) bakteriler ile çalışır unutulmamalıdır. Ancak, kendi deneyim ve edebiyat referansları dayalı (bkz. önceki yayınlar2,4,8,10,16,18,21 ,26), sunulan metodoloji çoğu su ortamları için uygundur. Trofik durum, döküntü içeriği ve otlayıcı çeşitliliği ve sayıları açısından farklılık gösteren iki doğal, zıt sistem örnekleri verilmiştir(Şekil 3 ve Şekil 4).
Mevcut yöntemlere göre yaklaşımın önemi
Daha da önemlisi, bakterivorların takson/takson larının bolluğu ve bunların türe özgü bakteritorit oranlarının bilinmesinden, protistan taksonunun (veya toplam ciliate montajının) toplu bakteritomu oranı hesaplanabilir. Bu yaklaşım hem heterotrofik kamelatlar hem de silyatlar için doğal plankton ortamlarına birlikte uygulanırsa (bacterioplankton2,6,7)ana otlayıcıları temsil eden protistan belirli bir ortamda bakteri popülasyonlarının otlatma kaynaklı ciro süresi tahmin edilebilir16,17,18,22. Bu tür veriler mikrobiyal gıda ağlarında karbon akışı dinamiklerinin tahmini için temel öneme sahiptir.
Gelecekteki uygulamalar
Bu yöntemin, bazı değişikliklerle birlikte başarıyla kullanılabildiği başka özel ortamlar da vardır. Bunlar arasında aktif çamur sistemleri, rumen ekosistemleri, sucul çökeltiler ve hipertrofik balık havuzları17bulunmaktadır. Ancak, bu besin ve mikrop açısından zengin ortamlarda uygulama, tipik boyut dağılımı ve diğer özellikleri taklit edebilir tracer FLB uygun boyutu, morfolojisi ve sayıları ile ilgili protokolü optimize etmek için ön testler gerektirir çevreye doğal av bakterilerin.
Şu anda, otlatma hücresinin kimliğinin (örn. heterotrofik kamtrat) belirli bir şekilde tespit edildiği, situ hibridizasyonda (CARD-FISH) katalize edilmiş muhabir birikimi floresanı ile bu yaklaşımın birleştirilmesine olan ilgi giderek artmaktadır. FISH-prob ve alım oranı aynı mikroskobik slayt üzerinde kamçı hücresinin gıda vakuollerinde FLB içeriğine dayanmaktadır31. Çift melezizasyon32 olarak adlandırılan sofistike, yeni bir yaklaşım yırtıcı hücre ve av bakterilerin (aynı zamanda bir filogenetik zorlanma, bir bakteri soy özgü FISH prob ile özel olarak etiketlenir) düzeylerinde FISH probları bir kombinasyonudur. Yaklaşım zarif ama aynı zamanda zaman alıcı ve belirli beceri ve deneyim gerektirir31,32, çeşitli FLB alımı yaklaşım değişiklikleri uygulama daha kolay laboratuvarlarda rutin kullanım için kabul edilebilir iken.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarların açıklayacak bir şeyi yok.
Acknowledgments
Bu çalışma Çek Bilim Vakfı tarafından sırasıyla K. Š. ve D. S.'ye verilen 13-00243S ve 19-16554S araştırma hibesi kapsamında desteklenmiştir. Bu makale aynı zamanda Avrupa Bölgesel Kalkınma Fonu tarafından finanse edilen "Baraj rezervuarlarının su kalitesini artırmak için bir araç olarak biyomanipülasyon" (No CZ.02.1.01/0.0/0.0/16_025/0007417) projesi tarafından desteklenmiştir. ve Eğitim.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



