Summary
이 프로토콜은 G6PI 혼합 펩티드를 사용하여 CD4+ T 세포 및 사이토카인에서 인간 류마티스 관절염에 가까운 류마티스 관절염 모델을 구성합니다. 고순도 불변 성 천연 킬러 T 세포 (주로 iNKT2) 특정 표현형 및 기능을 가진 채택 면역 요법에 대한 생체 내 유도 및 체외 정제에 의해 수득되었다.
Abstract
류마치스성 관절염 (RA)는 복잡한 만성 선동적인 자기 면역 질병입니다. 질병의 병인은 불변 자연 살인자 T (iNKT) 세포와 관련이 있습니다. 활성 RA를 가진 환자는 Th1의 더 적은 iNKT 세포, 불완전한 세포 기능 및 과도한 편광을 제시합니다. 본 연구에서, RA 동물 모델은 hGPI325-339 및 hGPI469-483 펩티드의 혼합물을 사용하여 확립되었다. iNKT 세포는 생체 내 유도 및 체외 정제에 의해 수득되었고, 이어서 입양 면역 요법을 위해 RA 마우스내로 주입하였다. 생체 내 이미징 시스템(IVIS) 추적은 iNKT 세포가 주로 비장과 간에서 분포되었다는 것을 밝혔다. 세포 치료 후 12일째에, 질병 진행이 현저히 둔화되고, 임상 증상이 완화되었고, 흉선내 iNKT1 세포의 풍부도가 증가하고, 흉선에서 iNKT1의 비율이 감소하고, TNF-α, IFN-γ 및 IL-6의 수준이 감소하였다. 혈청이 감소했습니다. iNKT 세포의 입양 면역 요법은 면역 세포의 균형을 회복시키고 신체의 과도한 염증을 교정했습니다.
Introduction
류마치스성 관절염 (RA)는 0.5-1% 부각1,2를가진 만성, 진보적인 침략을 특징으로 하는 자기 면역 질병입니다. 기본 병인은 자가 반응성 CD4+ 및 CD8+ T 세포의 비정상적인 증식에 기인하며, CD4+IFN-γ+ 및 CD4+IL-17A+ T 세포의 비율의 증가에 의해 나타나며, CD4+IL-4+ 및 CD4 + CD25+FoxP3+T 세포의 감소 된 수에 기인한다. 따라서 염증성 사이토카인의 분비가 증가하고 과도한 염증 반응이 신체의 면역 계통의 기본 균형과 내성 기능을 파괴합니다. 더욱이, 조인을 관통하는 도우미 T 림프구(Th) 1 세포는 염증 반응 및 관절 손상을 악화시다. 따라서 과도한 염증 반응의 억제와 면역 내성 및 면역 균형의 회복은 RA3,4의치료에 핵심이다.
iNKT 세포는 NK 세포 및 T 세포 기능 및 특성을 모두 갖는다. iNKT 세포는 제한된 TCR β 사슬 레퍼토리5를 가진 뚜렷한 불변 T 세포 수용체(TCR) α 사슬을 항원 제시 세포의 표면에 주요 조직 적합성 복합체(MHC) 클래스 I 분자 CD1에 의해 제시된 글리콜리파이드 항원을 인식한다. 미츠오 외6은 RA를 포함한 많은 자가면역 질환에서 다수의 iNKT 세포 및 기능적 결함을 검출하였다. Aurore등. 7은 iNKT 세포가 자가면역 내성을 유지하는 데 긍정적인 영향을 미치고 iNKT 세포의 수와 기능이 회복되면 질병이 완화된다는 것을 입증했다. 또한, Miellot-Gafsou 외8 iNKT 세포는 질병을 폐지할 뿐만 아니라 질병의 진행을 증가시키는 것을 발견하였다. 이러한 모순된 결과는 iNKT 세포가 이기종 T 세포이며, 상이한 서브세트의 기능이 역전될 수 있음을 시사한다. RA의 임상 연구에서, iNKT 세포의 빈도는 질병 활성의 점수와 상관관계가있다 9. 결과는 또한 RA 환자에서 iNKT의 빈도가 감소하였고, CD4+IFN-γ+ T 세포 서브세트의 수가 증가하고, 염증성 사이토카인 IFN-γ 및 TNF-α의 분비 수준이 10,11증가함을 확인하였다. 또한, 샤리프 외12형 당뇨병(T1D)을 조사하고 iNKT 세포의 선택적 주입이 염증성 사이토카인 IL-4의 발현을 업테비제, 면역 내성을 유지하고, 제1형 당뇨병의 발병을 방지한 것으로 나타났다. 따라서, 특정 iNKT 세포의 채택 주입 또는 iNKT 세포의 표적화 활성화는 RA 환자에서 iNKT 세포의 수준을 증가시켜, 이는 RA 치료에서 돌파구가 될 수 있다.
세포 면역 요법은 현재 큰 관심사이며 암 치료에 널리 사용되어 왔습니다. 그러나, iNKT 세포는 희소하고 이기종 면역 조절 세포(총 PBMC 수의 0.3%에불과)(13)로잠재적임상 적용을 제한한다. 이들 세포는 주로 3개의 소집단으로 나뉜다: 1) iNKT1 세포, 이는 골수성 백혈병 아연 핑거 단백질(PLZF) 및 T-박스 전사 인자(T-bet)의 높은 발현을 갖는다; 2) PLZF 및 GATA 결합 단백질 3(GATA3)의 중간 발현을 가진 iNKT2 세포; 3) PLZF 및 레티노이드 관련 고아 핵 수용체(ROR)-γt의 발현이 낮은 iNKT17 세포는 IFN-γ, IL-4 및 IL-1714를분비한다. 활성화된 iNKT 세포는 iNKT세포(15)의상이한 면역조절 효과를 결정하는 Th1, Th2 및 Th17 유사 사이토카인을 분비한다. iNKT 세포의 다양한 하위 집단의 특정 활성화의 면역 조절 및 면역 치료 효과는 상이하다. 따라서, 신체의 면역 반응을 조절하는 항염증 기능을 가진 iNKT 세포(주로 iNKT2)의 특정 표현형의 선택은 RA에서의 면역 불균형 및 면역 장애를 교정할 수 있다.
이상적인 동물 모델의 확립은 RA 병인의 치료 및 연구에 큰 의미가 있다. 현재, 가장 일반적으로 사용되고 성숙한 동물 모델은 콜라겐 유도 관절염, 보조 관절염, 자이모산 유도 관절염, 및 다당류 유도 관절염 을 포함한다16–17. 그러나 인간 RA의 모든 기능을 완전히 시뮬레이션할 수 있는 모델은 없습니다. 타입 II 콜라겐 유도 관절염 (CIA)는 고전적인 관절염 모델입니다. CIA는 이 질병 모델의 항체 의존성을 반영하는 타입 II 콜라겐 특이적 단일클론 항체를 가진 마우스의 면역화에 의해 유도된다. Benurs 등은 글루코스-6-인산염 이소머라아제(G6PI)에 대한 전신 면역 반응을 가진 모델을 기술하였는데, 이는 영향을 받기 쉬운 마우스 균주18,19에서말초 대칭 다발성 관절염을 유도한다. 이 모델에서 관절염의 발달은 T 세포, B 세포 및 선천성 면역18,19,20에달려 있습니다. 호리코시21은 G6PI 폴리펩티드 단편을 가진 DBA/1 마우스의 면역화로 인한 RA 모델이 CIA 모델보다CD4+ T 세포 및 사이토카인(즉, IL-6 및 TNF-α)의 관점에서 인간 RA와 더 유사하다는 것을 발견하였다. TCR 인식 부위에 대한 자극 효과를 높이기 위해, G6PI(hGPI325-339 및 hGPI469-483)의 혼합 폴리펩티드 단편을 사용하여 RA 마우스 모델을 구성하기 위해 DBA/1 마우스를 면역화하였다. hGPI325-339 및 hGPI469-483이 I-A q 제한 T 세포 반응에 대한 면역 지배적이기 때문에 이러한 접근법의 성공률은 높을 수 있다. 따라서, 이 모델은 RA 환자22에서CD4+ T 세포 및 iNKT 세포 결함의 과확산을 시뮬레이션할 수 있다. RA 면역 병리학의 기초 연구는 우리의 추가 심층적인 조사를 위한 기초를 놓았습니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
모든 실험 마우스(총 150마리)는 건강한 수컷 DBA/1 마우스, 6-8주 령(20.0±1.5 g)으로, 특정 병원균이 없는(SPF) 환경에서 사육하였다. 모델링 하기 전에 특별한 처리가 없습니다. 실험은 건강한 대조군(15마우스), 모델 대조군(15마우스), 세포치료군(55마우스)으로 나누었다. 이 연구는 허베이 대학의 동물 복지 및 윤리위원회에 의해 승인되었습니다.
1. 질병 모델 구축
- RA 동물 모델 복제
- hG6PI 325-339 및 hG6PI 469-483 파편 모두 1.75 mg의 무게를 측정하고 4 °C의 5.25 mL의 삼중 증류수에 용해시면 됩니다.
- 50°C 수조에 완전한 Freund의 보조제(CFA)를 녹이고, 5.25 mL를 다른 10mL 원심분리기 튜브에 넣고 식힙니다.
- 두 개의 유리 주사기가 연결된 인공 유화 장치에 hG6PI 용액과 CFA 용액의 혼합물을 넣습니다.
- 주사기를 분당 10-20x의 일정한 속도와 주파수로 밀어 혼합 펩타이드 용액과 CFA 용액을 완전히 유화합니다. 얼음 욕조에서 작업을 수행하고 분산하지 않고 유화 완료 후 10 분 동안 물에 에멀젼 방울을 유지합니다.
- 유화 hG6PIs 150 μL을 마우스의 꼬리 뿌리에 피하로 주입합니다.
- hG6PI 주입 후 0 시간 및 48 시간에서 복강 내 로 200 mg의 인후 염 독소를 주입하십시오.
- RA 모델의 실험 검증
- 버니어 캘리퍼스(하루 2회)로 마우스 발의 두께를 측정합니다.
- 발의 발적정도를 관찰하고 표시한다. 다음 점수 기준을 사용: 1) 가벼운 붓기와 발가락; 2) 맑은 빨간 붓기와 도르섬 페디스와 발 패드; 3) 빨간 붓기와 발목.
- 1% 나트륨 펜토바르비탈 (50 mg/kg 체중)의 복강 내 주입에 의해 깊은 마취하에 마우스를 안락사시키고 HE 염색을 위해 발을 제거한 후 14일 후에.
- 제조자의 프로토콜에 따라 상업적세포측정 비드 어레이(CBA)를 사용하여 혈청 IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α 및 IFN-γ의 분비 수준을 결정한다.
2. 입양 세포 치료로 iNKT 세포 획득
- iNKT 세포의 지향성 유도
- α-GalCer (체중 0.1 mg/kg)로 정상 마우스를 복강 내 주사하십시오.
- iNKT 세포의 격리
- 모델링 후 3 일, 마취를 위해 1 % 펜토 바르 비탈 (체중 50 mg / kg)으로 마우스를 복강 내 주사하십시오. 적당하게 마취된 마우스는 발가락 핀치에 대한 뒷발 철수 반응을 나타내지 않는다.
- α-GalCer로 복강 내 주사 후 DBA/1 마우스의 비장을 분리합니다. 200 메쉬 체로 비장을 절단하고 분쇄하여 단일 셀 현탁액을 준비합니다.
- 전지 현탁액을 PBS로 세척하고 원심분리기를 200 x g에서 5분 동안 세척하고 상한액을 폐기합니다. 반복.
- 전혈 및 조직 희석 액의 1 mL로 세포를 다시 중단하십시오. 3 mL의 마우스 림프구 분리 매체를 추가한 다음 실온에서 300 x g에서 20 분 동안 세포를 원심 분리합니다.
- 유백색 림프구층(즉, 위쪽에서 두 번째 층)을 수집하고, PBS로 2배 씻고, 자동 셀 카운터로 계산합니다.
- iNKT 세포 정제를 위한 자기 활성화 세포 선별(MACS) 양성 선택 전략
참고: CD1d 테트라머의 전처리를 위해 α-Galcer 1 mg/mL을 200 μg/mL로 200 μg/mL로 트웬-20 및 NaCl의 0.9%로 희석하고, 생성된 용액의 5 μL을 CD1d 테트라머 용액의 100 μL에 첨가하였다. 혼합물을 실온에서 12시간 동안 배양하고 사용하기 위해 4°C에서 두었다. TCR β를 탈이온수로 80배 희석시켰다. 다른 모든 항체는 스톡 용액으로서 사용되었다.- 4 °C PBS의 100 μL로 107 개의 세포를 다시 중단하고 α-GalCer로드 CD1d Tetramer-PE 10 μL을 추가하고 어둠 속에서 15 분 동안 4 °C에서 배양하십시오.
- 세포를 PBS로 2x 세척하고 PBS의 80 μL에서 다시 중단하십시오.
- 20 μL의 안티 PE-마이크로 비드를 추가하고 어둠 속에서 20 분 동안 4 °C에서 배양하십시오.
- PBS로 2x 세척하고 PBS 500 μL로 세포를 다시 일시 중단합니다.
- MACS 선별기의 자기장에 선별 컬럼을 놓고 PBS 500 μL로 헹구습니다.
- 2.3.4단계에서 셀 서스펜션을 정렬 컬럼에 추가하고 흐름을 수집하고 PBS 버퍼로 3x 헹구습니다.
- 자기장을 제거하고 정렬 열에서 셀을 수집합니다. 이 시점에서, 선별 컬럼에 1 mL의 PBS 버퍼를 추가하고, 표지된 세포를 수집 튜브로 구동하고 정제된 iNKT 세포를 얻기 위해 일정한 압력으로 플런저를 빠르게 밀어넣습니다. 자동화된 셀 카운터로 계산합니다.
- iNKT 세포 표현형의 식별
- 각각 2.2.5 단계와 2.3.7 단계에서 1 x 106 셀을 취하고 PBS의 50 μL에서 다시 일시 중단하십시오.
- 항체 배양: 음성 대조군 튜브에 항체를 첨가하지 말고, α-GalCer-PE-CD1d 테트라머의 0.5 μL 또는 단일 양성 대조군 튜브에 FITC-TCR β의 10 μL을 추가한다. α-GalCer-PE-CD1d 테트라머 0.5 μL과 샘플 튜브에 FITC-TCR β 10 μL을 추가합니다. 어둠 속에서 30 분 동안 4 °C에서 배양하십시오.
- PBS에서 세포를 씻은 다음 200 x g에서 원심 분리기를 5 분 동안 씻습니다.
- 상한체를 버리고, Foxp3 Foxation/Permeabilization 작업 용액 1 mL을 추가하고, 어둠 속에서 4 °C에서 45 분 동안 세포를 배양하십시오.
- 1 mL의 투과 버퍼 작동 용액을 추가하고 실온에서 500 x g의 세포를 5 분 동안 원심 분리합니다.
- 상급제는 버리십시오. 알렉사 플루어 647 마우스 안티 PLZF 1 μL을 추가하고 PerCP-Cy 5.5 마우스 안티 T-bet (또는 PerCP-Cy 5.5 마우스 안티 ROR...)의 1 μL을 어둠 속에서 실온에서 30 분 동안 추가하십시오.
- 청소를 위한 2mL의 퍼메빌화 버퍼 작동 솔루션을 추가합니다.
- 상급자를 버리고, PBS의 500 μL에서 세포를 다시 중단하고, 유세포 측정에 의해 측정한다.
- iNKT 세포의 기능적 식별
- 단계 2.3.7에서 3 x 106 iNKT 세포를 가져 와서 RPMI-1640 불완전한 배지 (즉, 혈청없이)의 1.5 mL로 12 개의 웰 플레이트에서 다시 중단하십시오.
- 포르볼 에스테르 (PMA, 50 ng/mL) 및 이오노마이신 칼슘 (IO, 1 μg / mL)을 추가하고CO2 인큐베이터에 24 시간 동안 놓습니다.
- 제조자의 프로토콜에 따라 상용 CBA 분석기를 사용하여 상층세포를 수집하고 IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ 및 IL-10의 분비 수준을 검출한다.
- RA 마우스에 있는 iNKT 세포의 이동 통로에 실험적인 연구 결과
- DMSO에서 DiR 염료(2.5 mg/mL)를 용해시.
- RPMI-1640 불완전한 배지로 6개의 웰 플레이트에 iNKT 세포를 다시 일시 중단합니다. 밀도는 1 × 106 셀 / mL입니다.
- DiR (5 μg / mL) 용액을 추가하고CO2 인큐베이터에 25 분 동안 배양하십시오.
- PBS로 세척하고 DiR 표지된 iNKT 세포(DiR-iNKT)를 얻기 위해 세포(3 x 10 6/300 μL)를 다시 중단한다.
- 1% 나트륨 펜토바르비탈 (50 mg/kg 체중)을 복강 내 로 주입하여 마우스를 마취시다. 적당하게 마취된 마우스는 발가락 핀치에 뒷발 철수를 보여주지 않습니다. 이미징을 위해 마취 상태에서 건조를 방지하기 위해 마우스 눈에 수의 연고를 적용하십시오.
- DIR-iNKT 세포를 8일 동안 RA 모델로 꼬리 정맥에 마우스당 3 x 106을 주입합니다. 마우스 사후 주입에서 iNKT 세포를 0분, 10분, 30분, 60분, 및 0일째(3시간 이후), 1, 3, 6, 12, 26, 34, 38, 및 42일 동안 생체내 이미징 시스템(IVIS)을 사용하여 모니터링한다. 사용된 여기 파장은 748 nm였고, 방출 파장이 780 nm였고, 노출 시간은 자동이었다.
- 각 마우스를 각 관찰 후 별도의 케이지에 놓고 흉골 의 힘을 유지합니다. 마취에서 회복 될 때까지 관찰하십시오.
3. iNKT 세포를 가진 RA 마우스의 입양 면역 요법의 평가
- RA 마우스를 위한 iNKT 세포 입양 면역 요법
- 꼬리 정맥을 통해 마우스 당 3 x 106 세포 iNKT 세포를 주입합니다. 무작위로 8일 전에 모델링된 15마리의 마우스를 선택하고 꼬리 정맥 주입에 의해 단계 2.3.7로부터 DiR 라벨링 없이 iNKT 세포를 얻었다.
- iNKT 세포에 대한 입양 면역 요법의 효능을 평가합니다.
- 마우스의 발의 두께를 측정하고, 발목 관절의 팽윤을 정량화하고, 단계 1.2.1-1.2.2에 기재된 바와 같이 iNKT 세포를 주입한 후 체계적으로 점수를 매겨 보세요.
- 1.2.3단계에서 기재된 바와 같이 마우스 관절의 염증성 세포 침투 및 관절 변화를 관찰한다.
- 단계 1.2.4에 기재된 바와 같이 IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α 및 IFN-γ의 분비 수준을 결정한다.
- iNKT 셀 및 하위 집합의 빈도를 확인합니다.
- 마우스 흉선분리및 단일 세포 현탁액을 준비한다.
- 림프구를 림프구 분리 액으로 분리하십시오.
- 단계 2.4에 기재된 바와 같이 iNKT 세포 주파수 및 하위 군 주파수를 결정한다.
- 통계 분석
참고: 모든 데이터는 평균 ± SD값으로 제시되고 P< 0.05는 통계적으로 유의한 것으로 간주되었다.- 분산(ANOVA)의 일자 분석을 사용합니다. 분산이 충족되면 LSD 테스트를 사용하여 추가 비교를 수행합니다.
- 분산이 균일하지 않은 경우 비매개 테스트를 사용합니다. 추가 비교를 위해 크루스칼-월리스 H 테스트를 사용 하 여31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
관절염 지수 점수 및 발 두께 모델링 후 증가. 대조군과 비교하여, RA 모델 그룹의 발가락은 모델링 후 6일 동안 점진적인 악화와 함께 붉은 부종을 보이기 시작했다. 14 일, 발목 관절의 붉은 붓기가 절정에 이르렀고 점진적인 완화가 뒤따랐습니다. 발의 두께도 비슷하게변경되었습니다(P < 0.05)(그림1).
염증성 세포 침투는 모델링 후 현저하게 증가했습니다. 병리학적 결과는 RA 모델 마우스의 발목 활액 조직에서 염증 세포의 침투 정도가 상이한 단계에서 상이한 것으로 나타났다. 피크 염증은 14 일 포스트 모델링(그림 2)에발생했습니다.
염증성 사이토카인이 증가하고 항 염증 성 사이토 카인이 혈청에서 감소했습니다. RA 모델 그룹에서, 염증성 사이토카인(TNF-α, IFN-γ 및 IL-6)의 혈청 수치가 크게 증가한 반면(P< 0.05), 항염증성 사이토카인(IL-4 및 IL-10)은 현저히 감소하였다(P< 0.05)(그림 3).
생체 내 유도 및 체외 정제에 의해 얻어진 iNKT 세포는 주로 항염증성 사이토카인을 분비하는 iNKT2 세포 서브세트로 구성되었다. α-GalCer의 복강 내 주사는 바디에 있는 iNKT 세포의 주파수를, 주로 iNKT2 소군 증가했습니다. 정상 DBA/1 마우스에서 비장 iNKT 세포의 빈도는 림프구의 약 2%였으며,(iNKT2는 약 5%, iNKT1 약 15%, iNKT17 약 10%)이었다. α-GalCer의 복강 내 주사 후 3일, iNKT 세포의 빈도는 림프구의 약 6%였으며,(iNKT2는 약 82%, iNKT1약 1.5%, iNKT1은 약 0.5%)이었다. MACS에 의한 정제 후, iNKT 세포의 순도는 85% 이상이었으며, 그 중 iNKT2는 약 92%, iNKT1은약 0.4%, iNKT17은 약 0.2%(도 4)였다.
수확된 iNKT 세포는 더 많은 항염증성 사이토카인과 적은 염증성 사이토카인을 분비하였다. iNKT 세포를 정상 마우스의 비장으로부터 분리하고 α-GalCer를 3일 후 α-GalCer(α-GalCer group)로 주입하고 세포 배양에서 사이토카인 수준을 상수로 조사하였다. 대조군과 비교하여, α-GalCer 군의 염증성 사이토카인(IL-17A, TNF-α, IFN-γ 및 IL-6)은 현저히감소(P< 0.05), 및 항염증성 사이토카인 IL-4 수준(P< 0.05)이 유의하게 증가하였다(P< 0.05). IL-10(P> 0.05)에는 큰 차이가 없었다. IFN-γ/IL-4 비율은 현저히 감소(P < 0.05)(그림 5).
IVIS 추적은 DiR-iNKT 세포가 RA 마우스에 채택적으로 주입되었고 즉시 폐 주입 후 나타났다는 것을 확인하였다. 형광은 간에서 10분 에서 60분(도6AI, 6AII, 6AIII)에서비장에서 검출되었다. 고립된 장기에서는 1시간 이내에 흉선과 인과 림프절에 형광이 없었으며, 0분에서 폐에서 형광이 검출되었고, 형광 강도는 10분에서 가장 크고, 그 후 점차 약해졌다. 0 분에서 간에서 약한 형광이 있었고 점차적으로 증가했습니다. 비장에서형광을 30분에서 검출한 후 서서히 증가하였다(도6AIV, 6C).
DIR-iNKT 세포를 RA 마우스에 주입한 후, 형광은 주로 간 및 비장(도6BI, 6BII, 6BIII)에집중되었으나 흉선 및 인과 림프절에는 형광이 없었다. 비장과 간은 세포 주입 후 1 일째에 가장 높은 형광 강도를 보였지만 점차 약화되었습니다. 34일째되던 날, 표면형광이 사라졌다. 42 일째에는 고립 된 장기의 형광이 사라졌습니다. 세포 주입 후 간평균 형광 신호 강도는 비장의 그보다높았다(도 6BIV, 6D).
RA 마우스에 iNKT 세포를 채택하는 것은 질병 진행을 완화하고 임상 증상을 향상시킬 수 있습니다. iNKT 세포는 입양 주입 후 RA 마우스의 임상 증상을 개선하였다. 치료되지 않은 RA 모델 그룹과 비교하여, 발목 관절의 부종은 세포 치료 군에서 완화되었고, 점수는 10일째부터 20일째까지 크게 감소하였다. 세포 치료군에서 같은 기간에, 활액 상 에서의 염증성 세포 침투는 RA 모델 군에 비해 감소되었다(도2).
흉선 iNKT 세포의 성공률은 크게 증가(P < 0.05). 건강한 대조군과 비교하여, RA 모델 군에서 흉선 내의 iNKT 세포의 비율은 진행(일째 11), 피크(14일째), 및 회복(20일째) 단계에서 감소하였다. 피크 염증에서, 이러한 값은 최소 하 고 완화 단계에서 반등. 세포 치료군은 RA 모델군(P< 0.05)과 비교하여 피크(14일째) 및 회복(20일째) 단계에서 iNKT 세포의 비율을 현저히 증가시보였다(그림7).
iNKT 세포 주입 후, 흉선에서iNKT1 및 iNKT17의 성공률은 감소하고 iNKT2는 증가하였다. 대조군에 비해, 11일째에 RA 모델 군에서 iNKT1 및 iNKT17에서 흉선에서 유의하게 증가(P< 0.05), 및 iNKT2(P< 0.05)가 현저히 감소하였다. 14일, 흉선에서 iNKT1 및 iNKT2는 크게 증가(P< 0.05) 및 iNKT17 크게 감소(P< 0.05). 20일째에, 흉선에서 iNKT1은 크게 증가(P < 0.05), iNKT2는 크게 변경되지 않았다(P > 0.05), 및 iNKT17 크게 감소(P < 0.05). iNKT1/iNKT2 비율은 세단계(P< 0.05)에서 크게 증가했습니다.
RA 모델 군에 비해, 11일째α-GalCer 및 세포 치료군에서, iNKT1 및 iNKT17은 현저히 낮았다(P< 0.05) 및 iNKT2(P< 0.05). 14일째에 α-GalCer 군 iNKT1 및 iNKT17에서 현저히 감소(P< 0.05), iNKT2는 크게 변화하지않았다(P> 0.05); 세포치료군에서는 iNKT1 및 iNKT17이 현저히 감소(P< 0.05) 및 iNKT2가 현저히 증가하였다(P< 0.05). 20일, α-GalCer 그룹에서 iNKT1은 크게 감소(P < 0.05), iNKT2크게 변경되지 않았다(P > 0.05), 및 iNKT17 크게 증가(P < 0.05); 세포치료군에서는 iNKT1 및 iNKT17이 현저히 감소(P< 0.05) 및 iNKT2가 현저히 증가하였다(P< 0.05). iNKT1/iNKT2의 비율은 세단계(P< 0.05)(그림 7)에서크게 감소하였다.
염증성 사이토카인의 수준은 혈청에서 증가되었고 iNKT 세포 주입 후 항염증성 사이토카인이 감소하였다. RA 모델 군에서, TNF-α, IFN-γ 및 IL-6in 혈청의 수준은 크게증가(P< 0.05), IL-4 및 IL-10은 대조군과 비교하여 현저하게 감소된양(P< 0.05)을 보였다. iNKT 세포 치료군에서, 혈청내 TNF-α, IFN-γ 및 IL-6의 수준은 염증의 진행 및 피크 단계에서 현저히감소(P< 0.05), IL-4 및 IL-10은 RA 모델 군과 비교하여 유의하여증가(P< 0.05).
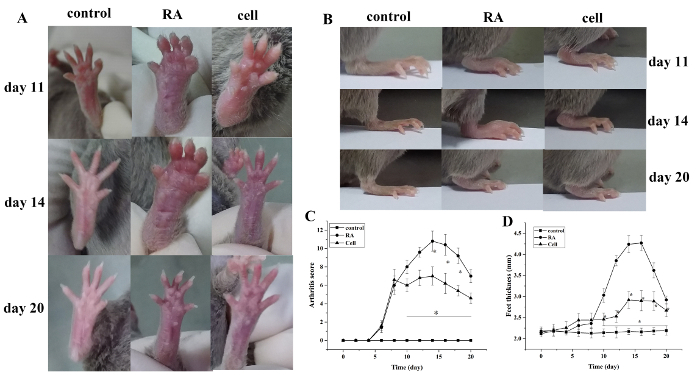
도 1: 마우스의 관절 부종 점수 및 발 두께 변화. (A)마우스에서 발목 관절의 붓기. (B, D) 다른 그룹의 발 두께. (C)다른 그룹에서 임상 점수 변경. 마우스 관절염 점수 및 발 두께는 모델링 후 10-20일(즉, 치료 후 2-12일) 세포 치료 군에서 현저히 감소하였다. *P < 0.05 대 제어, **P < 0.05 대 RA. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 발목 관절의 조직 병리학 적 변화. 염증세포의 침윤은 세포치료군에서 현저히 감소되었고, 14일째에 RA군에서 유의히 증가하였다. ◊ = 염증 성 세포. (A)100 x(B)400 배. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 각 군의 혈청 사이토카인의 수준. (A)모델링 후 11일째에 마우스에서 혈청 사이토카인 수준(pg/mL)을 나타낸다. (B)모델링 후 14일째에 마우스에서 혈청 사이토카인 수준(pg/mL). TNF-α, IFN-γ 및 IL-6의 수준은 현저히 감소하였고, IL-4 및 IL-10의 수준은 세포 치료 군에서 유의하여 증가하였다. P < 0.05 대 제어. bP < 0.05 vs. RA. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: iNKT 세포의 비율 및 iNKT 세포 서브세트의 비율. (A, B, C) 정상 마우스에서 iNKT2의 비율은 ~5%이다. (D, E, F)) iNKT2의 비율은 생체 내 유도 후 약 82%이다. (G, H, I) iNKT2의 비율은 MACS 정제 후 92 % 이상입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5: 마우스 비장 유래 iNKT 세포의 배양 상급어에서 사이토카인 수준. IL-4의 수준은 크게 증가하고, IL-17A, TNF-α, IFN-γ 및 IL-6의 수준이 현저히 감소하였다. P < 0.05 대 제어. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 6: 캘리퍼스 IVIS 루미나 II에 의해 추적된 iNKT 세포의 분포 및 대사. (A, B) iNKT 셀의 마이그레이션 경로입니다. (C)비장, 간 및 폐의 평균 형광 신호 강도의 변화. (D)비장과 간에서의 평균 형광 신호 강도의 변화. 형광은 0 분에서 폐와 간에서 검출된 다음 점차적으로 증가했습니다. 형광 강도는 폐에서 10 분에서 가장 강하고 감소하였다. 비장의 형광은 30 분에서 검출 된 다음 점차적으로 증가했습니다. 모든 장기의 형광은 42 일째에 사라졌습니다. 간장의 평균 형광 신호 강도는 세포 주입 후 비장보다 높다 (I: supine; II: 측면 거짓말; III: 경향이; IV: 단리 조직; a: 대조군; b: 세포 주입 그룹; 1, 2, 3, 4, 5는 흉선, 비장, 간, 인과 림프절, 폐). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 마우스 흉선에서 iNKT 및 그 하위 집합의 비율. (A)모델링 후 11일, 14일 및 20일에서 iNKT 셀의 비율. (B)iNKT1/iNKT2의 비율입니다. (C, D, E) iNKT1, iNKT2 및 iNKT17의 비율입니다. 11일, 14일 및 20일(세포치료 후 3일, 6일 및 12일)에, iNKT 세포의 비율이 현저히 증가하였고, 흉선i의 iNKT1 및 iNKT17은 세포치료군에서 현저히 감소하였고, iNKT2는 현저히 증가하였다. P < 0.05 대 제어. bP < 0.05 vs RA. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT 세포는 선천적이고 적응성 면역을 연결하는 특별한 T 세포이며 주로 CD4++/ CD8+ 흉선 세포에서 개발됩니다. iNKT 세포는 다양한 면역 조절 기능을 가지며 상이한 사이토카인2 3의직접 접촉 및 분비에 의해 다른 면역 세포와 상호작용하며, 수지상세포(DC), 대식세포, 호중구, B세포, T세포 및 NK세포 분화 및개발24에영향을 미친다. α-GalCer는 스폰지에서 추출된 고전적인 iNKT 세포 특이적 활성제입니다. 여러 연구에 따르면 비장 iNKT 세포 주파수는 α-GalCer의 단일 복강 주사 후 3일25일동안 피크에 도달한다는 것을 나타냅니다. 우리의 실험 결과는 주로 항염증성 사이토카인 IL-4 및 IL-10을 분비하는 α-GalCer의 복강 내 주사 후 3 일 동안 마우스 비장에서 iNKT2 서브세트의 우세를 입증했다. 우리는 또한 iNKT2 세포의 풍부가 감소하고 iNKT1 및 iNKT17 세포의 것이 염증 상 동안 RA 모델 마우스에서 증가한다는 것을 발견했다. 따라서, α-GalCer의 복강 내 주사에 의해 마우스 비장의 iNKT 세포를 3일 동안 분리하였다. 이들은 RA 모델 마우스를 치료하는 데 사용되었다. iNKT2 서브세트의 비율은 생체 내 유도 후 82%였다. MACS에 의한 정제 후, iNKT2의 비율은 92%를 초과하였다.
iNKT 세포의 특이적 활성화는 RA에 대한 신규한 생물학적 치료제로서 사용된다. 호리코시 외21은 CD4+ T 세포의 수를 현저하게 억제함으로써 GPI 펩티드 유도 관절염을 억제한 α-GalCer의 상피성 주사를 입증하였다. 치바 외26은 합성 iNKT2 선택적 활성제 OCH의 반복 주사가 CIA를 억제하는 반면 α-GalCer는 약간의 억제 효과를 보였다. 우리는 RA 모델 마우스에 비장 유래 iNKT를 주입하고, 결과는 세포 치료 그룹에서 발목 관절의 팽윤 정도와 관절에 침투염증 세포의 수가 감소된 것으로 나타났다. 혈청 항염증성 사이토카인(예를 들어, IL-4 및 IL-10)의 수준이 증가하고, 프로-염증성 사이토카인(예를 들어, IFN-γ 및 TNF-α)의 분비가 감소하였다. iNKT 세포의 표적 활성화는 RA의 진행을 완화시키고 염증 반응을 억제할 수 있었다. 또한, 흉선에서 iNKT의 빈도를 검출하고 RA 모델 군에서 iNKT 세포의 수가 현저히 감소된 반면, 흉선내의 빈도는 iNKT 세포의 주입 후 증가하였다는 것을 발견하였다. 혈액-흉선 장벽 시스템의 존재로 인해, 우리는 이후 실험에서 확인된 흉선에서 iNKT 의 수준에서 채택적으로 주입된 증가를 고려하지 않았다. 흉선에서 iNKT 세포의 하위 집단의 추가 검출은 건강한 대조군에 비해, RA 모델 군의 iNKT1 세포 수가 염증의 피크 동안 염증의 3단계 동안 현저하게 증가하고, 반면 iNKT2 서브세트의 비율은 염증의 정점에 증가하기 시작했다는 것을 밝혔다. 특히, iNKT1 서브세트는 RA의 초기 염증에 관여할 수 있고, iNKT2 서브세트는 염증을 억제하는데 중요한 역할을 할 수 있다. RA 모델 군에 비해, 세포 치료 군에서의 iNKT1 서브세트는 염증 단계 동안 유의하게 감소하였고, iNKT2 서브세트는 염증의 초기 및 완화 단계에서 유의하게 증가하였다. 이러한 결과는 특정 표현형 및 기능성 iNKT 세포의 채택 주입이 RA에서 iNKT 세포의 빈도를 현저하게 증가시키고 iNKT 세포 서브세트의 비율을 변화시켰다는 것을 나타냈다.
우리는 입양 주입 후에 마우스에 있는 iNKT 세포의 분포를 관찰하기 위하여 IVIS를 이용하고 주입 후에 폐에 있는 가장 높은 형광 강렬을 10 분, 점차적으로 퇴색하는 찾아냈습니다. 간은 약한 형광을 보였으며, 이는 점차적으로 증가하고 2 일 후에 점차적으로 감소했습니다. 형광은 30 분에서 비장에서 검출되었으며, 이는 2 일 후에 점차적으로 증가하고 감소했습니다. 간장의 평균 형광 강도는 비장의 그것보다 더 강했다. 그러나 흉선과 인과 림프절에서 형광이 발견되지 않았습니다. 폐에 있는 형광의 검출은 꼬리 정맥으로 iNKT 세포의 주입에 기인할 지도 모릅니다. 이 세포는 혈액으로 폐로 순환됩니다. 간은 비장보다 일찍 형광되며, 간장의 평균 형광 강도는 비장의 비장보다 강하다. iNKT 세포의 이러한 우대적 축적은 주요 대사 기관인 간에서 풍부한 혈관에 기인할 수 있다. 흉선에서 형광이 검출되지 않았습니다. 이것은 iNKT 세포의 입력을 방해할 수 있던 혈액학 장벽 때문일지도 모릅니다. 형광은 인과 림프절에서 결코 검출되지 않았는데, 아마도 더 적은 iNKT 세포가 림프절에 들어갔고 최소 검출 수준에 도달하지 않았기 때문일 것입니다. 또한 꼬리 정맥에 주입 된 iNKT 세포가 림프절에 들어가지 않을 수 있다고 추측 할 수 있습니다. 따라서, 우리는 흉선에 있는 iNKT 세포의 발달 그리고 분화가 마우스로 입양 주입 후에 사이토카인 통로를 통해 통제될 지도 모르다는 것을 가설합니다. 이것은 더 해명 될 필요가있다.
GPI는 대부분의 RA 환자의 혈청 및 활액에 존재하며 임상 RA 진단2 7에일반적으로 사용되는 시험이다. 브런즈 외28 GPI 서열로부터 상이한 길이의 펩티드를 사용하고 6개의 면역지배적 T 세포 에피토프를 확인하기 위해 DBA/1 마우스를 면역화하였다. 이 중 3개는 관절성이었다. 관절염의 >95% 발생률이 있는 펩티드는 hGPI 325-339 및 hGPI469-483입니다. 우리의 이전 연구는 RA 모델을 확립하기 위해 두 펩티드의 혼합물의 사용이 단일 펩티드보다 낫다는 것을 입증했다. 결과 RA 모델에서, 마우스의 발가락과 관절은 6 일째에 빨간색으로 나타나기 시작하여 14 일째에 염증의 절정에 도달했습니다. 염증성 세포 침윤은 관절의 활액 조직에서 조직 증식을 수반하였고, 염증세포 침윤은 14일째에 가장 심했다. iNKT 세포의 수는 염증의 정점에 있는 흉선에서 유의하였고, 이는 RA 환자29에서iNKT 세포의 추세와 일치하였다. iNKT 세포 서브세트의 추가 검출은 흉선에서 iNKT1 및 iNKT17의 빈도가 증가하고 염증의 진행 동안 iNKT2의 빈도가 감소한다는 것을 밝혔다(11일째). 또한, 혈청 사이토카인 IFN-γ 및 IL-17A의 수치가 진행(11일째) 및 염증의 피크(일째 14)동안 증가하였고, RA 모델마우스(30)에서Th1 및 Th17 하위군의 유사한 편광을 시사한다. 따라서, hGPI325-339 및 hGPI469-483 혼합 폴리펩티드 단편에 의해 유도된 RA 마우스 모델은CD4+ T 세포 과증식 및 iNKT 세포 결함의 특성을 나타내었으며, 이는 RA 환자의 것과 유사했으며, RA 세포의 면역을 조사하기 위한 이상적인 동물 모델로 사용될 수 있었다. 이러한 결과는 이전 연구에서 얻은 것들과 일치하고 hGPI 유도 RA 모델31의안정성을 입증했다.
일반적으로, 혼합 G6PI 펩티드에 의해 유도된 RA 마우스 모델은 RA 환자에서CD4+ T 세포, iNKT 세포 및 관련 사이토카인의 변화를 시뮬레이션할 수 있다. 이는 RA에 대한 심층 조사에 적합한 모델을 제공합니다. 연속적으로, iNKT(주로 iNKT2)는 α-GalCer의 복강 내 주사에 의해 유도되고 시험관내에서 정제되어 RA의 치료에 사용하였다. Th 서브세트의 비정상적인 증식에 의해 야기되는 면역 불균형을 교정하고, RA의 진행을 완화시키고, 미래에 RA의 임상적 치료를 위한 새로운 방법을 제공할 수 있다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 자금 이나 이해 의 충돌을 선언 하지 않습니다.
Acknowledgments
우리의 연구는 중국 국립 자연 과학 재단 (NSFC) (81771755), 허베이성의 대학 및 대학의 과학 기술 핵심 연구 프로젝트 (ZD2017009) 및 허베이 대학의 의학 실험 센터의 동물 연구소에 의해 지원되었다. 우리는 그들의 지원에 감사드립니다.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



