Summary
Denne protokol bruger G6PI blandede peptider til at konstruere leddegigt modeller, der er tættere på den menneskelige leddegigt i CD4+ T celler og cytokiner. Høj renhed invariant naturlige dræber T-celler (hovedsagelig iNKT2) med specifikke fænotyper og funktioner blev opnået ved in vivo induktion og in vitro rensning for adoptivimmunterapi.
Abstract
Leddegigt (RA) er en kompleks kronisk inflammatorisk autoimmun sygdom. Sygdommens patogenese er relateret til invariant naturlige dræber T (iNKT) celler. Patienter med aktiv RA præsentere færre iNKT celler, defekt celle funktion, og overdreven polarisering af Th1. I denne undersøgelse blev der etableret en RA-dyremodel ved hjælp af en blanding af hGPI325-339 og hGPI469-483 peptider. INKT-cellerne blev fremstillet ved in vivo induktion og in vitrorensning efterfulgt af infusion i RA-mus til adoptivimmunterapi. In vivo imaging system (IVIS) sporing viste, at iNKT celler var hovedsageligt fordelt i milten og leveren. På dag 12 efter celleterapi, sygdomsprogression bremset betydeligt, de kliniske symptomer blev lindret, forekomsten af iNKT celler i thymus steget, andelen af iNKT1 i thymus faldt, og niveauet af TNF-α, IFN-γ, og IL-6 i serum faldt. Adoptivimmunterapi af iNKT-celler genoprettede balancen mellem immunceller og korrigerede den overdrevne betændelse i kroppen.
Introduction
Leddegigt (RA) er en autoimmun sygdom karakteriseret ved kronisk, progressiv invasiv med 0,5-1% incidens1,2. Den underliggende patogenese tilskrives den unormale spredning af autoreaktive CD4+ og CD8+ T-celler, manifesteret ved en stigning i andelen af CD4+IFN-γ+ og CD4+IL-17A+ T-celler og det reducerede antal CD4+IL-4+ og CD4+CD25+FoxP3+ T-celler. Derfor øges udskillelse af inflammatoriske cytokiner, og en overdreven inflammatorisk reaktion ødelægger den indfødte balance og tolerancefunktion i kroppens immunsystem. Desuden hjælperen T lymfocyt (Th) 1 celler, der trænger ind i leddet forværre inflammatoriske respons og ledskader. Derfor er hæmningaf overdreven inflammatorisk respons og genskabelse af immuntolerance og immunbalance nøglen til behandling af RA3,4.
INKT-cellerne har både NK-celle- og T-cellefunktioner og -egenskaber. INKT-cellerne har en særskilt, invariant T-cellereceptor (TCR) α-kæde med begrænsede TCR β-kæderepertoirer5 og genkender glycolipidantigenet, der præsenteres af det store histokompatibilitetskompleks (MHC) klasse I molekyle CD1d på overfladen af de antigenpræsenterende celler. Mitsuo et al.6 opdaget et stort antal iNKT celler og funktionelle defekter i mange autoimmune sygdomme, herunder RA. Aurore et al.7 viste, at iNKT-celler har en positiv effekt på opretholdelsen af autoimmun tolerance, og at sygdommen afhjælpes, når antallet og funktionen af iNKT-celler genoprettes. Desuden fandt Miellot-Gafsou et al.8, at iNKT-celler ikke kun ophævede sygdommen, men også øgede sygdommens progression. Disse modstridende resultater tyder på, at iNKT-celler er heterogene T-celler, og funktionen af forskellige undersæt kan vendes. I en klinisk undersøgelse af RA korrelerer hyppigheden af iNKT-celler med scoren for sygdomsaktiviteten9. Resultaterne bekræftede også, at hyppigheden af iNKT blev nedsat hos RA-patienter, antallet af CD4+IFN-γ+ T-celleundersæt steg, og de sekretoiniske niveauer af inflammatoriske cytokiner IFN-γ og TNF-α steg10,11. Desuden undersøgte Sharif et al.12 type 1-diabetes (T1D) og fandt ud af, at selektiv infusion af iNKT-celler opregulerede ekspressionen af den inflammatoriske cytokin IL-4, opretholdt immuntolerance og forhindrede udviklingen af type 1-diabetes. Derfor øger adoptivinfusion af specifikke iNKT-celler eller målrettet aktivering af iNKT-celler niveauet af iNKT-celler hos RA-patienter, hvilket kan være et gennembrud i RA-behandling.
Cellulære immunterapi er i øjeblikket af stor interesse og har været meget udbredt i kræftbehandling. INKT-celler er imidlertid sjældne, heterogene immunregulerende celler (kun 0,3 % af det samlede antal PbMC'er)13, hvilket begrænser potentielle kliniske anvendelser. Disse celler er hovedsageligt opdelt i tre delpopulationer: 1) iNKT1 celler, som har et højt udtryk for promyelocytisk leukæmi zink-finger protein (PLZF) og T-box transskription faktor (T-bet); 2) iNKT2 celler med mellemliggende udtryk for PLZF og GATA bindende protein 3 (GATA3); 3) iNKT17 celler med lavt udtryk for PLZF og retinoid-relaterede forældreløse nukleare receptor (ROR)-γt at udskille IFN-γ, IL-4, og IL-1714. Aktiverede iNKT celler udskiller Th1, Th2, og Th17-lignende cytokiner, som bestemmer de forskellige immunmodulerende virkninger af iNKT celler15. De immunmodulerende og immunoterapeutiske virkninger af specifik aktivering af forskellige delpopulationer af iNKT-celler er forskellige. Derfor kan udvælgelsen af specifikke fænotyper af iNKT-celler (hovedsagelig iNKT2) med antiinflammatoriske funktioner til at regulere kroppens immunrespons korrigere immunubalancen og immunlidelserne hos RA.
Etableringen af en ideel dyremodel er af stor betydning for behandling og undersøgelse af RA patogenese. I øjeblikket, de mest almindeligt anvendte og modne dyremodeller omfatter kollagen-induceret arthritis, adjuverende arthritis, zymosan-induceret arthritis, og polysaccharid-induceret arthritis16–17. Men der er ingen model, der fuldt ud kan simulere alle funktionerne i menneskelige RA. Type II kollagen-induceret arthritis (CIA) er en klassisk arthritis model. CIA er induceret af immunisering af mus med type II kollagen-specifikke monoklonale antistoffer, der afspejler antistof afhængighed af denne sygdom model. Benurs et al. beskrev en model med en systemisk immunrespons på glukose-6-fosfat isomerase (G6PI), som inducerer perifer symmetrisk polyarthritis hos modtagelige musestammer18,19. I denne model, udviklingen af gigt afhænger af T-celler, B-celler, og medfødte immunitet18,19,20. Horikoshi21 fandt, at RA modeller som følge af immunisering af DBA/1 mus med G6PI polypeptid fragmenter ligner mere menneskelige RA i form af CD4+ T celler og cytokiner (dvs. IL-6 og TNF-α) end CIA modeller. For at øge den stimulerende virkning på TCR anerkendelse site, blandet polypeptid fragmenter af G6PI (hGPI325-339 og hGPI469-483) blev brugt til at immunisere DBA/1 mus til at konstruere RA musemodel. Succesraten for denne fremgangsmåde kan høj, fordi hGPI325-339 og hGPI469-483 er immundominerende for I-A q-begrænsede T-cellereaktioner. Derfor kan denne model simulere overproliferation af CD4+ T-celler og iNKT-cellefejl hos RA-patienter22. Grundforskningen i RA immunpatologi lagde grunden til vores videre dybdegående undersøgelse.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle eksperimentelle mus (150 i alt) var raske mandlige DBA/1 mus, 6-8 uger gamle (20,0 ± 1,5 g), opdrættet i et specifikt patogenfrit (SPF) miljø. Der er ingen særbehandling før modellering. Forsøget blev opdelt i en sund kontrolgruppe (15 mus), en modelkontrolgruppe (15 mus) og en celleterapigruppe (55 mus). Denne undersøgelse blev godkendt af Hebei Universitys dyrevelfærds- og etiske udvalg.
1. Konstruktion af sygdomsmodellen
- Duplikere RA dyremodel
- 1,75 mg både hG6PI 325-339 og hG6PI 469-483 fragmenter og opløses i 5,25 ml 4 °C tredobbelt destilleret vand.
- Udløs hele Freunds adjuverende (CFA) i et vandbad på 50 °C, træk 5,25 ml i et andet 10 ml centrifugerør, og det afkøles til brug.
- Sæt blandingen af hG6PI-opløsning og CFA-opløsning i en kunstig emulgeringsenhed med to glassprøjter tilsluttet.
- Sprøjten skubbes med en konstant hastighed og frekvens på 10-20 x pr. min. for helt at emulgere den blandede peptidopløsning og CFA-opløsning. Udfør operationen i et isbad, og hold emulsiondråberne i vandet i 10 minutter efter afslutningen af emulgeringen uden spredning.
- Injicer 150 μL emulgeret hG6PI'er i musens halerod subkutant.
- Injicer 200 mg Pertussistoksin i musen intraperitonealt ved 0 h og 48 timer efter hG6PI injektionen.
- Eksperimentel verifikation af RA-modellen
- Mål tykkelsen af musens pote med en Vernier kaliper (2x om dagen).
- Overhold og markér graden af rødme og hævelse af foden. Brug følgende scoringskriterier: 1) tæer med mild hævelse; 2) dorsum pedis og fodpude med klar rød hævelse; 3) ankel med rød hævelse.
- Aflivning musene under dyb anæstesi ved intraperitoneal injektion af 1% natriumpentobarbital (50 mg/kg kropsvægt) 14 dage efter modellering og fjerne poterne for HE farvning.
- Bestem sekreionsniveauerne for serum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α og IFN-γ ved hjælp af en kommerciel cytometrisk perlematrix (CBA) i henhold til producentens protokol.
2. Opnåelse af iNKT-celler med adoptivcelleterapi
- Retningsbestemt induktion af iNKT-celler
- Injicer normale mus intraperitonealt med α-GalCer (0,1 mg/kg kropsvægt).
- Isolering af iNKT-celler
- Tre dage efter modellering injiceres mus intraperitonealt med 1% natriumpentobarbital (50 mg/kg kropsvægt) til anæstesiisering. Tilstrækkeligt bestøvet mus viser ikke en hind pote tilbagetrækning reaktion på en tå knivspids.
- Isoler milten af en DBA/1 mus efter injektion den intraperitonealt med α-GalCer. Forbered en enkelt celle suspension ved at skære og slibning milten i en 200 mesh sigte.
- Celleaffjedringen vaskes med PBS, centrifugeres ved 200 x g i 5 min. og kassér supernatantet. Gentag.
- Ophæng cellerne igen med 1 ml fuldblod s- og vævsfortyndingsopløsning. Tilsæt 3 ml muselymhocytseparationsmedium, og centrifugeres derefter cellerne i 20 min ved 300 x g ved stuetemperatur.
- Saml lag af mælkehvide lymfocytter (dvs. det andet lag fra toppen), vask det 2x med PBS, og tælle med en automatiseret celle tæller.
- Magnetisk aktiveret cellesortering (MACS)positiv udvælgelsesstrategi for rensning af iNKT-celler
BEMÆRK: Til forbehandling af CD1d tetramers blev 1 mg/ml α-Galcer fortyndet til 200 μg/ml med 0,5 % af Tween-20 og 0,9 % af NaCl, og 5 μL af den resulterende opløsning blev tilsat 100 μL af CD1d tetrameropløsningen. Blandingen blev inkuberet i 12 timer ved stuetemperatur og anbragt ved 4 °C til brug. TCR β blev fortyndet 80x med deioniseret vand. Alle andre antistoffer blev brugt som en lageropløsning.- Ophæng 107 celler med 100 μL 4 °C PBS, tilsættes 10 μL α-GalCer-loaded CD1d Tetramer-PE og inkuberes ved 4 °C i 15 minutter i mørke.
- Cellerne vaskes 2x med PBS, og de skal ophænges igen i 80 μL PBS.
- Der tilsættes 20 μL anti-PE-MicroBeads og inkuber esved 4 °C i 20 minutter i mørke.
- Vask dem 2x med PBS og opslæm cellerne igen med 500 μL PBS.
- Sorteringskolonnen anbringes i MACS-sorteringssorteringssorteringssorteringssorteringsens magnetfelt, og den skylles med 500 μL PBS.
- Føj celleaffjedringen fra trin 2.3.4 til sorteringskolonnen, opsaml gennemstrømningen og skyl 3x med PBS-buffer.
- Fjern magnetfeltet, og saml cellerne fra sorteringskolonnen. På dette tidspunkt skal du tilføje 1 ml PBS-buffer til sorteringskolonnen og hurtigt skubbe stemplet ved et konstant tryk for at drive de mærkede celler til opsamlingsrøret og opnå rensede iNKT-celler. Tæl med en automatiseret celletæller.
- Identifikation af iNKT-cellefænotypen
- Tag 1 x 106 celler fra trin 2.2.5 og 2.3.7, og resuspendering dem i 50 μL af PBS.
- Antistofinkubation: Tilsæt ikke antistoffet til det negative kontrolrør, tilsæt 0,5 μL α-GalCer-PE-CD1d Tetramer eller 10 μL FITC-TCR β i det ene positive kontrolrør. Der tilsættes 0,5 μL α-GalCer-PE-CD1d tetramer og 10 μL FITC-TCR β i prøverøret. Inkuber dem ved 4 °C i 30 minutter i mørke.
- Cellerne vaskes i PBS og centrifugeres derefter ved 200 x g i 5 min.
- Kassér supernatanten, tilsæt 1 ml Foxp3 Ræve-/permeabiliseringsarbejdsløsning, og cellerne inkuberes i 45 min ved 4 °C i mørke.
- Der tilsættes 1 ml 1x Permeabilisering Buffer arbejdsløsning, og cellerne centrifugeres ved stuetemperatur i 500 x g ved stuetemperatur i 5 min.
- Kassér supernatanten. Der tilsættes 1 μL Alexa Fluor 647 mus Anti-PLZF og 1 μL PerCP-Cy 5,5 mus anti-T-bet (eller 1 μL PerCP-Cy 5,5 mus anti-RORΥt) i 30 min ved stuetemperatur i mørke.
- Tilføj til 2 ml permeabiliseringsbuffer arbejdsløsning til rengøring.
- Kassér supernatanten, ophæng cellerne igen i 500 μL PBS, og mål ved flowcytometri.
- Funktionel identifikation af iNKT-celler
- Tag 3 x 106 iNKT celler fra trin 2.3.7 og genophæng dem i 12 brøndplader med 1,5 ml RPMI-1640 ufuldstændigt medium (dvs. uden serum).
- Tilsættes phorbolester (PMA, 50 ng/ml) og ionomycincalcium (IO, 1 μg/ml) og placeres i en CO 2-inkubator i 24 timer.
- Saml cellen supernatant og detekter sekretorierne af IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ og IL-10 ved hjælp af en kommerciel CBA-analyse i henhold til producentens protokol.
- Eksperimentel undersøgelse af iNKT-cellernes migrationsvej i RA-mus
- DiR-farvestof (2,5 mg/ml) opløses i DMSO.
- Resuspendering iNKT celler i 6 godt plader med RPMI-1640 ufuldstændigmedium. Tætheden er 1 × 106 celler/ml.
- Der tilsættes DiR -opløsning (5 μg/ml) og inkuberes i en CO 2-inkubator i 25 min.
- Vask med PBS og ophæng cellerne (3 x 106/300 μL) for at opnå DiR-mærkede iNKT-celler (DiR-iNKT).
- Injicer 1% natriumpentobarbital (50 mg/kg kropsvægt) intraperitonealt for at bedøve musene. Tilstrækkeligt bestøvet mus viser ikke en hind pote tilbagetrækning til tå knivspids. Påfør veterinær salve på musens øjne for at forhindre tørhed, mens under anæstesi til billeddannelse.
- Injicer DiR-iNKT-celler 3 x 106 pr. mus i halvenen med RA-modellen i 8 dage. Overvåg iNKT-cellerne i mus efter injektion i 0 min, 10 min, 30 min, 60 min og dag 0 (efter 3 timer), 1, 3, 6, 12, 26, 34, 38 og 42 dage ved hjælp af et lille system til in vivo-billedbehandling (IVIS). Den anvendte excitationbølgelængde var 748 nm, emissionsbølgelængden var 780 nm, og eksponeringstiden var automatisk.
- Placer hver mus i et separat bur efter hver observation og opretholde sternal recumbency. Overhold indtil inddrivelse fra anæstesi.
3. Evaluering af adoptivimmunterapi af RA-mus med iNKT-celler
- iNKT celle adoptivimmunterapi for RA mus
- Injicer 3 x 106 celler iNKT celler pr mus gennem halvenen. Vælg tilfældigt 15 mus, der var modelleret 8 dage før, og få iNKT-celler uden DiR-mærkning fra trin 2.3.7 ved infusion af halevenen.
- Vurder effekten af adoptivimmunterapi for iNKT-celler.
- Mål tykkelsen af musens pote, kvantificer hævede ankelleddet, og systematisk score efter infusion af iNKT celler som beskrevet i trin 1.2.1-1.2.2.
- Overhold den inflammatoriske celleinfiltration og fælles ændringer i museleddene som beskrevet i trin 1.2.3.
- Bestem sekreionsniveauerne for IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α og IFN-γ som beskrevet i trin 1.2.4.
- Bestemme hyppigheden af iNKT-celler og undersæt.
- Isoler musen thymus og forberede en enkelt celle suspension.
- Adskil lymfocytter med lymfocyt separationvæske.
- Bestem iNKT-cellefrekvensen og undergruppefrekvensen som beskrevet i trin 2.4.
- Statistisk analyse
BEMÆRK: Alle data præsenteres som middelværdi ± SD. Værdier p < 0,05 blev anset for statistisk signifikante.- Brug enfaktoranalyse af varians (ANOVA). Hvis variansen er opfyldt, skal du bruge LSD-testen til yderligere sammenligning.
- Hvis variansen ikke er ensartet, skal du bruge den nonparametriske test. Brug Kruskal-Wallis H-testen til yderligere sammenligning31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Den arthritis indeks score og pote tykkelse steg efter modellering. Sammenlignet med kontrolgruppen begyndte tæerne i RA-modelgruppen at vise rød hævelse ved 6 dage efter modellering, med gradvis forværring. På 14 dage, den røde hævelse i ankelleddet toppede, efterfulgt af gradvis lindring. Tykkelsen af poten ændret på samme måde (P < 0,05) (Figur 1).
Den inflammatoriske celle infiltration steg betydeligt efter modellering. De patologiske resultater viste, at infiltrationgraden af inflammatoriske celler i ankelvævet i RA-modelmusene var forskellig på forskellige stadier. Peak inflammation opstod på dag 14 efter modellering(Figur 2).
Inflammatoriske cytokiner steg og anti-inflammatoriske cytokiner faldt i serummet. I RA-modelgruppen steg serumniveauerne af proinflammatoriske cytokiner (TNF-α, IFN-γ og IL-6) betydeligt (P < 0,05), mens antiinflammatoriske cytokiner (IL-4 og IL-10) faldt betydeligt (P < 0,05) (Figur 3).
De iNKT-celler, der blev fremstillet ved in vivo induktion og in vitrorensning, bestod hovedsagelig af iNKT2-celleundersæt, som udskiller antiinflammatoriske cytokiner. Intraperitoneal injektion af α-GalCer øgede hyppigheden af iNKT-celler i kroppen, hovedsagelig iNKT2-undergruppen. Hyppigheden af milt iNKT-celler i normale DBA/1-mus var ca. 2% af lymfocytterne (iNKT2 var omkring 5%, iNKT1 omkring 15%, iNKT17 omkring 10%). Tre dage efter den intraperitoneale injektion af α-GalCer var hyppigheden af iNKT-celler ca. 6% af lymfocytterne (iNKT2 var ca. 82%, iNKT1 ca. 1,5%, og iNKT17 ca. 0,5%). Efter rensning af MACS var renheden af iNKT-celler over 85 %, hvoraf iNKT2 var på ca. 92 %, iNKT1 på ca. 0,4 %, og iNKT17 ca. 0,2 %(figur 4).
De høstede iNKT-celler udskilles mere antiinflammatoriske cytokiner og færre inflammatoriske cytokiner. INKT-cellerne blev isoleret fra milten af normale mus og intravenøst injiceret med α-GalCer 3 dage efter musemilten (α-GalCer-gruppen), og cytokinniveauerne i cellekulturens supernatant blev undersøgt. Sammenlignet med kontrolgruppen faldt de inflammatoriske cytokiner (IL-17A, TNF-α, IFN-γ og IL-6) i α-GalCer-gruppen signifikant (P < 0,05) og det antiinflammatoriske cytokinil IL-4-niveau steg betydeligt (P < 0,05). Der var ingen signifikant forskel i IL-10(P > 0,05). IFN-γ/IL-4-forholdet faldt betydeligt (P < 0,05) (figur 5).
IVIS-sporingbekræftede, at DiR-iNKT-celler blev adoptivt infunderes i RA-mus og straks dukkede op i lungerne efter injektionen. Fluorescens blev påvist i leveren ved 10 min og i milten ved 60 min (figur 6AI, 6AII, 6AIII). I de isolerede organer var der ingen fluorescens i thymus og lyskelymfeknuder inden for 1 time. Fluorescens blev påvist i lungerne ved 0 min, fluorescensintensiteten var den største ved 10 min og derefter gradvist svækket. Der var svag fluorescens i leveren på 0 min, og så er det gradvist steget. Fluorescensen i milten blev påvist ved 30 min og derefter gradvist øget (figur 6AIV, 6C).
Efter infusionen af DiR-iNKT-celler i RA-mus var fluorescens hovedsagelig koncentreret i leveren og milten (figur 6BI, 6BII, 6BIII), men der var ingen fluorescens i thymus- og lymfeknuderne. Milten og leveren havde den højeste fluorescensintensitet på dag 1 efter celleinfusion, men det blev gradvist svækket. På dag 34 forsvandt overfladenfluorescens. På dag 42 forsvandt fluorescensen af de isolerede organer. Den gennemsnitlige fluorescenssignalintensitet for leveren efter celleinfusionen var højere end miltens (figur 6BIV, 6D).
Adoptivinfusion af iNKT-celler i RA-mus kan lindre sygdomsprogression og forbedre kliniske symptomer. INKT-cellerne forbedrede de kliniske symptomer på RA-mus efter infusion af adoptiv. Sammenlignet med den ubehandlede RA model gruppe, hævelse af ankelleddet blev lettet i cellebehandling gruppe, og scoren faldt betydeligt fra dag 10 til dag 20 postinjektion. I samme periode i cellebehandlingsgruppen blev inflammatorisk celleinfiltration i synovialvævet reduceret i forhold til RA-modelgruppen (figur 2).
Succesraten for thymus iNKT-celler steg betydeligt (P < 0,05). Sammenlignet med den sunde kontrolgruppe faldt satserne for iNKT-celler i thymus i RA-modelgruppen ved udviklingen (dag 11), toppen (dag 14) og restitutionsfaserne (dag 20). Ved peak inflammation, disse værdier var minimal og rebounded i remission fase. Celleterapigruppen viste signifikant øgede iNKT-celler på toppen (dag 14) og genvinding (dag 20) i forhold til RA-modelgruppen (P < 0,05) (figur 7).
Efter iNKT-celleinfusion faldt succesraten for iNKT1 og iNKT17 i thymus, og iNKT2 steg. Sammenlignet med kontrolgruppen steg i RA-modelgruppen på dag 11 iNKT1 og iNKT17 i thymus signifikant (P < 0,05) og iNKT2 faldt betydeligt (P < 0,05). På dag 14 steg iNKT1 og iNKT2 i thymus markant (P< 0,05) og iNKT17 faldt betydeligt (P< 0,05). På dag 20 steg iNKT1 i thymus betydeligt (P < 0,05), iNKT2 ændrede sig ikke væsentligt(P > 0,05) og iNKT17 faldt betydeligt(P < 0,05). INKT1/iNKT2-forholdet steg betydeligt i alle tre faser(P < 0,05).
Sammenlignet med RA-modelgruppen var iNKT1 og iNKT17 på dag 11 i α-GalCer- og celleterapigrupperne betydeligt lavere (P < 0,05) og iNKT2 signifikant øget (P < 0,05). På dag 14 faldt i α-GalCer-koncernen iNKT1 og iNKT17 betydeligt(P < 0,05), og iNKT2 ændrede sig ikke væsentligt (P > 0,05). i celleterapigruppen iNKT1 og iNKT17 faldt betydeligt(P < 0,05) og iNKT2 signifikant steg (P < 0,05). På dag 20 faldt iNKT1 i α-GalCer-koncernen betydeligt (P < 0,05), iNKT2 ændrede sig ikke væsentligt (P > 0,05) og iNKT17 steg betydeligt (P < 0,05); i celleterapigruppen iNKT1 og iNKT17 faldt betydeligt(P < 0,05) og iNKT2 signifikant steg (P < 0,05). Forholdet mellem iNKT1/iNKT2 faldt betydeligt i alle tre faser(P < 0,05) (figur 7).
Niveauerne af inflammatoriske cytokiner blev øget i serum, og de antiinflammatoriske cytokiner blev nedsat efter iNKT-celleinfusion. I RA-modelgruppen steg niveauerne af TNF-α, IFN-γ og IL-6in serum betydeligt (P < 0,05), mens IL-4 og IL-10 viste markant reducerede mængder(P < 0,05) sammenlignet med kontrolgruppen. I iNKT-celleterapigruppen faldt niveauet af TNF-α, IFN-γ og IL-6 i serum betydeligt ved frem- og topstadierne af inflammation (P < 0,05), mens IL-4 og IL-10 steg betydeligt(P < 0,05) sammenlignet med RA-modelgruppen (Figur 3).
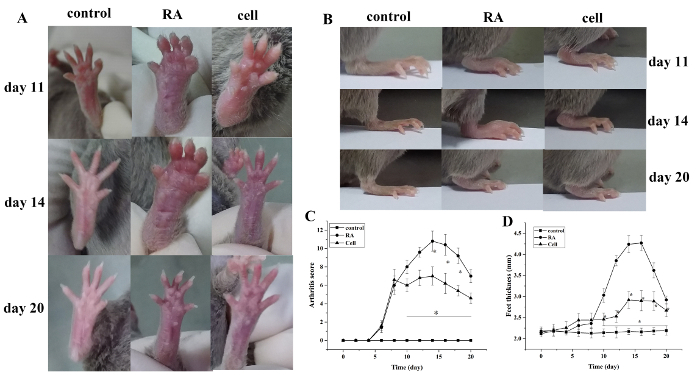
Figur 1: Den fælles hævelse score og pote tykkelse ændring i mus. (A) Hævelse af ankelleddet i mus. (B,D) Paw tykkelse i forskellige grupper. (C) Klinisk score ændringer i forskellige grupper. Musen arthritis score og tykkelsen af poten blev væsentligt reduceret i celleterapi gruppe på dage 10-20 (dvs. 2-12 dage efter behandling) efter modellering. *P < 0,05 vs. kontrol, **P < 0,05 vs. RA. Klik her for at se en større version af denne figur.

Figur 2: Histopatologiske ændringer af ankelleddet. Infiltrationen af inflammatoriske celler blev reduceret betydeligt i celleterapigruppen og blev signifikant øget i RA-gruppen på dag 14. ▲ = inflammatoriske celler. A) 100x(B) 400x. Klik her for at se en større version af denne figur.

Figur 3: Niveauet af serumcytokiner i hver gruppe. (A) Serum cytokiner niveauer i mus på dag 11 efter modellering (pg / ml). B) Serumcytokiner niveauer i mus på dag 14 efter modellering (pg /mL). Niveauerne tnf-α, IFN-γ og IL-6 faldt betydeligt, og niveauet af IL-4 og IL-10 steg betydeligt i celleterapigruppen. enP < 0,05 vs. kontrol. bP < 0,05 vs. RA. Klik her for at se en større version af denne figur.

Figur 4: Satserne for iNKT-celler og andelen af iNKT-celleundersæt. (A,B,C) Antallet af iNKT2 i normale mus er ~5%. (D,E,F) Satsen for iNKT2 er omkring 82% efter in vivo induktion. (G, H, I) Satsen for iNKT2 er mere end 92% efter MACS rensning. Klik her for at se en større version af denne figur.

Figur 5: Cytokinniveauer i kultursupernatant af musemiltafledte iNKT-celler. Niveauet af IL-4 steg betydeligt, og niveauet af IL-17A, TNF-α, IFN-γ og IL-6 faldt betydeligt. enP < 0,05 vs. kontrol. Klik her for at se en større version af denne figur.

Figur 6: Fordeling og metabolisme af iNKT-celler, der spores af caliper IVIS lumina II. (A,B) Overflytningssti for iNKT-celler. (C) Ændringen af den gennemsnitlige fluorescenssignalintensitet i milten, leveren og lungerne. (D) Ændringen af den gennemsnitlige fluorescenssignalintensitet i milten og leveren. Fluorescensblev påvist i lungerne og leveren ved 0 min, og derefter gradvist øget. Fluorescensintensiteten var stærkest ved 10 min i lungerne og faldt derefter. Splemens fluorescens blev påvist ved 30 min. Fluorescensen af alle organer forsvandt på dag 42. Den gennemsnitlige fluorescenssignalintensitet for leveren er højere end milten efter celleinfusion (I: liggende; II: lateral liggende; III: udsat; IV: isoleret væv; a: kontrolgruppe b: celleinfusionsgruppe 1, 2, 3, 4, 5 er thymus, milt, lever, lyinle lymfeknuder, lunger). Klik her for at se en større version af denne figur.

Figur 7: Satserne for iNKT og dens undersæt i musen thymus. (A) Satserne for iNKT-celler ved 11, 14 og 20 dage efter modellering. B) Forholdet mellem iNKT1/iNKT2. (C,D,E) Satsen for iNKT1, iNKT2 og iNKT17. På dag 11, 14 og 20 (dag 3, 6 og 12 efter celleterapi), steg iNKT1- og iNKT17-instifikserne betydeligt i celleterapigruppen, og iNKT2 blev signifikant forøget. enP < 0,05 vs Kontrol. bP < 0,05 vs RA. Klik her for at se en større version af denne figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT celler er særlige T-celler, bro medfødte og adaptive immunitet og er hovedsageligt udviklet fra CD4++/ CD8+ thymocytter. iNKT celler har forskellige immunreguleringsfunktioner og interagere med andre immunceller ved direkte kontakt og sekretorer af forskellige cytokiner23, påvirker dendritiske celler (DC' er), makrofager, neutrofiler, B-celler, T-celler, og NK celle differentiering og udvikling24. α-GalCer er en klassisk iNKT cellespecifik aktivator udvundet af svampe. Flere undersøgelser viser, at miltiNKT-cellefrekvensen når et højdepunkt efter en enkelt intraperitoneal injektion af α-GalCer i 3 dage25. Vores eksperimentelle resultater viste overvægten af iNKT2-delsættet i mus milt i 3 dage efter en intraperitoneal injektion af α-GalCer, som primært udskiller antiinflammatoriske cytokiner IL-4 og IL-10. Vi fandt også, at forekomsten af iNKT2 celler faldt, og at iNKT1 og iNKT17 celler steg i RA model mus i den inflammatoriske fase. Derfor isolerede vi iNKT-cellerne i musemilten ved intraperitoneal injektion af α-GalCer i 3 dage. Disse blev brugt til behandling af RA model mus. Satsen for iNKT2-delsættet var 82% efter induktion i vivo. Efter rensning af MACS oversteg iNKT2 92%.
Den specifikke aktivering af iNKT-celler anvendes som en ny biologisk behandling for RA. Horikoshi et al.21 viste, at intradermal injektion af α-GalCer hæmmede GPI peptid-induceret arthritis ved at hæmme antallet af CD4+ T-celler betydeligt. Chiba et al.26 viste, at gentagne injektioner af den syntetiske iNKT2 selektive aktivator OCH hæmmede CIA, mens α-GalCer viste en let hæmmende virkning. Vi injicerede milt-afledt iNKT i RA model mus, og resultaterne viste, at graden af hævelse af ankelleddene i celleterapi gruppen og antallet af inflammatoriske celler infiltrere rileden blev reduceret. Niveauet af serumantiinflammatoriske cytokiner (f.eks. IL-4 og IL-10) steg, og udskillelse af proinflammatoriske cytokiner (f.eks. den målrettede aktivering af iNKT-celler var i stand til at lindre udviklingen af RA og hæmme det inflammatoriske respons. Derudover opdagede vi hyppigheden af iNKT i thymus og fandt, at antallet af iNKT-celler i RA-modelgruppen blev reduceret betydeligt, mens hyppigheden i thymus steg efter infusion af iNKT-cellerne. På grund af tilstedeværelsen af blod-thymus barriere system, vi ikke overveje adoptivly infunderes stigning i niveauet af iNKT i thymus, der blev bekræftet i senere forsøg. Yderligere påvisning af delpopulationer af iNKT-celler i thymus viste, at sammenlignet med den sunde kontrolgruppe steg antallet af iNKT1-celler i RA-modelgruppen betydeligt i de tre stadier af inflammation og maksimalt under inflammationens højdepunkt, mens andelen af iNKT2-delsættet begyndte at stige på toppen af inflammation. Især iNKT1 delmængde kan være involveret i tidlig betændelse i RA, og iNKT2 delmængde kan spille en vigtig rolle i at hæmme betændelse. Sammenlignet med RA modelgruppen, iNKT1 delmængde i celleterapi gruppen faldt betydeligt i den inflammatoriske fase, og iNKT2 delsættet steg betydeligt i den tidlige og remission fase af inflammation. Disse resultater viste, at adoptivinfusion af specifikke fænotyper og funktionelle iNKT-celler øgede hyppigheden af iNKT-celler i RA betydeligt og ændrede andelen af iNKT-celleundersæt.
Vi brugte IVIS til at observere fordelingen af iNKT-celler i mus efter adoptivinfusion og fandt den højeste fluorescensintensitet i lungerne 10 minutter efter infusion, som falmede gradvist. Leveren viste svag fluorescens, som steg gradvist og faldt gradvist efter 2 dage. Fluorescens blev påvist i milten ved 30 min. Den gennemsnitlige fluorescensintensitet i leveren var stærkere end miltens. Der blev dog ikke påvist fluorescens i thymus- og lymfeknuderne. Påvisning af fluorescens i lungerne kan tilskrives infusion af iNKT-celler i halevenen. Disse celler cirkuleres til lungerne med blodet. Leverfluorescerende tidligere end milten, og den gennemsnitlige fluorescensintensitet i leveren er stærkere end miltens. Denne præferenceakkumulering af iNKT-cellerne kan skyldes de rigelige blodkar i leveren, det vigtigste metaboliske organ. Fluorescens blev ikke opdaget i thymus. Dette kan skyldes den hæmatologiske barriere, som kan hindre indtrængning af iNKT celler. Fluorescens blev aldrig opdaget i lymfeknuderne, måske fordi færre iNKT-celler kom ind i lymfeknuderne og ikke nåede det mindste detektionsniveau. Det kunne også spekuleres i, at iNKT-cellerne infunderes i halvenen måske ikke kommer ind i lymfeknuderne. Derfor er vi hypotesen om, at udviklingen og differentieringen af iNKT-celler i thymus kan reguleres gennem cytokinveje efter adoptivinfusion i musene. Dette skal belyses yderligere.
GPI er til stede i serum og synovial væske af de fleste RA patienter og er en almindeligt anvendt test for klinisk RA diagnose27. Bruns et al.28 brugte peptider af forskellig længde end GPI-sekvensen og immuniserede DBA/1-musene for at identificere seks immunodominerende T-celleepitoper. Af disse var tre arthritogenic. Peptiderne med >95% forekomst af gigt er hGPI 325-339 og hGPI469-483. Vores tidligere undersøgelser viste, at brugen af en blanding af de to peptider til at etablere en RA-model er bedre end et enkelt peptid. I de resulterende RA modeller, tæer og led af musene begyndte at dukke rødt på dag 6 og nåede et højdepunkt af betændelse på dag 14. Den inflammatoriske celle infiltration blev ledsaget af væv hyperplasi i synovial væv i leddene, og den inflammatoriske celle infiltration var mest alvorlige på dag 14. Antallet af iNKT-celler faldt betydeligt i thymus på toppen af inflammation, hvilket var i overensstemmelse med tendensen hos iNKT-celler hos RA-patienter29. Yderligere påvisning af iNKT-celleundersæt viste, at hyppigheden af iNKT1 og iNKT17 i thymus steg, og hyppigheden af iNKT2 faldt under udviklingen af inflammation (dag 11). Desuden steg niveauet af serum cytokiner IFN-γ og IL-17A under progression (dag 11) og toppen af inflammation (dag 14), hvilket tyder på en lignende polarisering af Th1 og Th17 undergrupperne i RA model mus30. Derfor udviste RA-musemodellen, der var fremkaldt af hGPI325-339 og hGPI469-483 blandede polypeptidfragmenter, egenskaberne ved CD4+ T-cellehyperproliferation og iNKT-celledefekter, som svarede til RA-patienternes, og som kunne anvendes som en ideel dyremodel til undersøgelse af RA-cellernes immunitet. Disse resultater var enige med resultaterne fra vores tidligere undersøgelser og viste stabiliteten af den hcioniske RA-model31.
Generelt kan RA musemodellen induceret af de blandede G6PI peptider simulere ændringerne i CD4+ T-celler, iNKT-celler og relaterede cytokiner hos RA-patienter. Dette giver en god model for tilbundsgående undersøgelse af RA. Fortløbende blev iNKT (hovedsagelig iNKT2), der blev induceret ved intraperitoneal injektion af α-GalCer og renset in vitro, anvendt til behandling af RA. Det kan korrigere immunubalance forårsaget af unormal spredning af Th delmængder, lindre progression af RA, og i fremtiden kan give nye metoder til klinisk behandling af RA.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen finansiering eller interessekonflikter.
Acknowledgments
Vores undersøgelse blev støttet af National Natural Science Foundation of China (NSFC) (81771755), Colleges og universitetets videnskab og teknologi centrale forskningsprojekt i Hebei-provinsen (ZD2017009) og Animal Lab of Medical Experiment Center, Hebei University. Vi er taknemmelige for deres støtte.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



