Summary
Questo protocollo utilizza peptidi misti G6PI per costruire modelli di artrite reumatoide che sono più vicini a quello dell'artrite reumatoide umana in CD4- cellule T e citochine. Cellule T killer naturali ad alta purezza (principalmente iNKT2) con fenotipi e funzioni specifiche sono state ottenute mediante induzione e purificazione in vitro per l'immunoterapia adottiva.
Abstract
L'artrite reumatoide (RA) è una malattia autoimmune infiammatoria cronica complessa. La patogenesi della malattia è correlata alle cellule T (iNKT) killer naturali invarianti. I pazienti con RA attiva presentano meno cellule iNKT, funzione cellulare difettosa e polarizzazione eccessiva di Th1. In questo studio, è stato stabilito un modello animale RA utilizzando una miscela di peptidi hGPI325-339 e hGPI469-483. Le cellule iNKT sono state ottenute mediante induzione e purificazione in vitro, seguite da infusione nei topi RA per immunoterapia adottiva. Il monitoraggio del sistema di imaging in vivo (IVIS) ha rivelato che le cellule iNKT sono state distribuite principalmente nella milza e nel fegato. Il giorno 12 dopo la terapia cellulare, la progressione della malattia ha rallentato in modo significativo, i sintomi clinici sono stati alleviati, l'abbondanza di cellule iNKT nel timo è aumentata, la proporzione di iNKT1 nel timo è diminuita e i livelli di TNF-z, IFN-e IL-6 in il siero è diminuito. L'immunoterapia adottiva delle cellule iNKT ha ripristinato l'equilibrio delle cellule immunitarie e corretto l'eccessiva infiammazione del corpo.
Introduction
L'artrite reumatoide (RA) è una malattia autoimmune caratterizzata da invasività cronica e progressiva con incidenza dello 0,5-1%1,2. La patogenesi di fondo è attribuita alla proliferazione anomala di celluleCD4 autoattive e CD8, manifestata da un aumento della proporzione di celluleT cd4, IFN-eCD4, IL-17A, e al numero ridotto di cellule TCD4- IL-4e CD4- CD25 - FoxP3 . Pertanto, la secrezione di citochine infiammatorie è aumentata e una reazione infiammatoria eccessiva distrugge l'equilibrio nativo e la funzione di tolleranza del sistema immunitario del corpo. Inoltre, le cellule helper del linfocito T (Th) 1 che penetrano nell'articolazione aggravano la risposta infiammatoria e i danni articolari. Pertanto, l'inibizione dell'eccessiva risposta infiammatoria e il ripristino della tolleranza immunitaria e dell'equilibrio immunitario sono fondamentali per il trattamento dell'RA3,4.
Le celle iNKT hanno funzioni e caratteristiche sia della cellula NK che di cellule T. Le cellule iNKT ospitano una catena di z distinta e invarianti con repertori a catena TCRlimitati 5 e riconoscono l'antigene glicolipido presentato dalla principale molecola CD1d del complesso di istocompatibilità (MHC) sulla superficie delle cellule che presentano l'antigene. Mitsuo et al.6 ha rilevato un gran numero di cellule iNKT e difetti funzionali in molte malattie autoimmuni, tra cui ra. Aurore et al.7 ha dimostrato che le cellule iNKT hanno un effetto positivo sul mantenimento della tolleranza autoimmune e che quando il numero e la funzione delle cellule iNKT vengono ripristinate, la malattia viene alleviata. Inoltre, Miellot-Gafsou et al.8 ha scoperto che le cellule iNKT non solo abrogavano la malattia, ma aumentavano anche la progressione della malattia. Questi risultati contraddittori suggeriscono che le cellule iNKT sono cellule T eterogenee e la funzione di diversi sottoinsiemi può essere invertita. In uno studio clinico di RA, la frequenza delle cellule iNKT è correlata al punteggio dell'attività della malattia9. I risultati hanno anche confermato che la frequenza di iNKT è stata diminuita nei pazienti affetti da rappare, il numero di sottoinsiemi di cellule TCD4- IFN-z-s è aumentato, e i livelli secretorici di citochine infiammatorie IFN-e TNF-aumentati di10,11. Inoltre, Sharif et al.12 ha studiato il diabete di tipo 1 (T1D) e ha scoperto che l'infusione selettiva di cellule iNKT regolava l'espressione della citochina infiammatoria IL-4, manteneva la tolleranza immunitaria e impediva lo sviluppo del diabete di tipo 1. Pertanto, l'infusione adottiva di specifiche cellule iNKT o l'attivazione mirata di cellule iNKT aumenta il livello delle cellule iNKT nei pazienti affetti da RA, che può essere una svolta nel trattamento dell'AR.
L'immunoterapia cellulare è attualmente di grande interesse ed è stata ampiamente utilizzata nella terapia del cancro. Tuttavia, le cellule iNKT sono cellule immunoregolatorie rare ed eterogenee (solo lo 0,3% del numero totale di PBMC)13, il che limita le potenziali applicazioni cliniche. Queste cellule sono principalmente suddivise in tre sottopopolazioni: 1) cellule iNKT1, che hanno un'alta espressione di proteina leucemia promielocitica zinco-dita (PL-F) e fattore di trascrizione T-box (T-bet); 2) cellule iNKT2 con espressione intermedia della proteina legante PL-F e GATA 3 (GATA3); 3) cellule iNKT17 con bassa espressione di PL-F e recettore orfano legato ai retinoidi (ROR) - che secernono IFN-z, IL-4, e IL-1714. Le cellule iNKT attivate secernono Th1, Th2 e Th17-come citochine, che determinano i diversi effetti immunomodulatori delle cellule iNKT15. Gli effetti immunomodulatori e immunoterapeutici dell'attivazione specifica di varie sottopopolazioni di cellule iNKT sono diversi. Pertanto, la selezione di fenotipi specifici delle cellule iNKT (principalmente iNKT2) con funzioni antinfiammatorie per regolare la risposta immunitaria del corpo può correggere lo squilibrio immunitario e i disturbi immunitari nell'AR.
L'istituzione di un modello animale ideale è di grande importanza per il trattamento e lo studio della patogenesi ra. Attualmente, i modelli animali più comunemente utilizzati e maturi includono artrite indotta dal collagene, artrite adiuvante, artrite indotta da zymiosan e artrite indotta dal polisaccoro16–17. Tuttavia, non esiste un modello in grado di simulare completamente tutte le caratteristiche dell'AR umana. L'artrite indotta dal collagene di tipo II (CIA) è un modello classico di artrite. La CIA è indotta dall'immunizzazione dei topi con anticorpi monoclonali specifici del collagene di tipo II, che riflettono la dipendenza da anticorpi di questo modello di malattia. Benurs et al. ha descritto un modello con una risposta immunitaria sistemica all'isomerassia del glucosio-6-fosfato (G6PI), che induce la poliartrite simmetrica periferica nei ceppi di topo sensibili18,19. In questo modello, lo sviluppo dell'artrite dipende dalle cellule T, cellule B e dall'immunità innata18,19,20. Horikoshi21 ha scoperto che i modelli RA risultanti dall'immunizzazione dei topi DBA/1 con frammenti di polipeptide G6PI sono più simili all'AR umana in termini di CD4- cellule T e citochine (cioè IL-6 e TNF-z) rispetto ai modelli della CIA. Al fine di aumentare l'effetto stimolante sul sito di riconoscimento TCR, i frammenti misti di polipeptide di G6PI (hGPI325-339 e hGPI469-483) sono stati utilizzati per immunizzare i topi DBA/1 per costruire il modello murino RA. Il tasso di successo di questo approccio può essere elevato perché hGPI325-339 e hGPI469-483 sono immunodominanti per le risposte delle cellule T con restrizioni I-A q. Pertanto, questo modello può simulare la proliferazione di CD4- cellule T e difetti cellulari iNKT nei pazienti RA22. La ricerca di base dell'immunopatologia dell'AR ha gettato le basi per la nostra ulteriore indagine approfondita.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutti i topi sperimentali (150 in totale) erano maschi sani di tipo DBA/1 topi, di 6-8 settimane (20,0 x 1,5 g), allevati in uno specifico ambiente privo di agenti patogeni (SPF). Non esiste un trattamento speciale prima della modellazione. L'esperimento è stato diviso in un gruppo di controllo sano (15 topi), un gruppo di controllo del modello (15 topi) e un gruppo di terapia cellulare (55 topi). Questo studio è stato approvato dall'Animal Welfare and Ethical Committee dell'Università di Hebei.
1. Costruzione del modello di malattia
- Duplicazione del modello animale RA
- Pesare 1,75 mg di entrambi hG6PI 325-339 e hG6PI 469-483 frammenti e scioglierli in 5,25 mL di 4 gradi centigradi di acqua distillata.
- Sciogliere l'adiuvante completo di Freund (CFA) in un bagno d'acqua a 50 gradi centigradi, disegnare 5,25 mL in un altro tubo centrifuga da 10 mL e raffreddarlo per l'uso.
- Mettere la miscela di soluzione hG6PI e soluzione CFA in un'unità di emulsione artificiale con due siringhe di vetro collegate.
- Spingere la siringa a una velocità costante e una frequenza di 10-20 volte al min per emulsionare completamente la soluzione mista di peptidi e la soluzione CFA. Eseguire l'operazione in un bagno di ghiaccio e conservare le goccioline di emulsione in acqua per 10 min dopo il completamento dell'emulsificazione senza disperdere.
- Iniettare 150 l di hG6Pi emulsionati nella radice di coda del mouse sottocutaneamente.
- Iniettare 200 mg di tossina pertosse nel topo intraperitonelmente a 0 h e 48 h dopo l'iniezione di hG6PI.
- Verifica sperimentale del modello RA
- Misurare lo spessore della zampa del mouse con una pinza Vernier (2 volte al giorno).
- Osservare e contrassegnare il grado di arrossamento e gonfiore del piede. Utilizzare i seguenti criteri di punteggio: 1) le ditiondate con gonfiore lieve; 2) dorsum pedis e foot pad con gonfiore rosso chiaro; 3) caviglia con gonfiore rosso.
- Eutanasia dei topi in anestesia profonda per iniezione intraperitoneale di 1% pentobarbital di sodio (50 mg/kg peso corporeo) 14 giorni dopo la modellazione e rimuovere le zampe per la colorazione HE.
- Determinare i livelli di secrezione del siero IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-z, e IFN-z utilizzando un saggio commerciale di perline citometriche (CBA) secondo il protocollo del produttore.
2. Ottenere cellule iNKT con terapia cellulare adottiva
- Induzione direzionale delle cellule iNKT
- Iniettare i topi normali intraperitamente con la z-GalCer (0,1 mg/kg di peso corporeo).
- Isolamento delle cellule iNKT
- Tre giorni dopo la modellazione, iniettare i topi intraperitonealmente con 1% pentobarbital di sodio (50 mg/kg di peso corporeo) per l'anestesizzazione. I topi adeguatamente anestesizzati non mostrano una risposta di ritiro della zampa posteriore a un pizzico di punta.
- Isolare la milza di un topo DBA/1 dopo averlo iniettato intraperitoneally con la z-GalCer. Preparare una sospensione a cella singola tagliando e macinando la milza in un setaccio a maglia 200.
- Lavare la sospensione cellulare con PBS, centrifugare a 200 x g per 5 min, e scartare il supernatante. Ripetere.
- Risospendere le cellule con 1 mL di soluzione di diluizione del sangue intero e dei tessuti. Aggiungere 3 mL di mezzo di separazione dei linfociti murini, quindi centrificare le cellule per 20 min a 300 x g a temperatura ambiente.
- Raccogliere lo strato di linfociti bianchi lattiginosi (cioè il secondo strato dall'alto), lavarlo 2x con PBS e contare con un contatore cellulare automatizzato.
- Strategia di selezione delle celle magnetiche attivate (MACS)positiva per la purificazione delle cellule iNKT
NOTA: Per il pretrattamento dei tetrameri CD1d, 1 mg/mL di z-Galcer è stato diluito a 200 g/mL con lo 0,5% di Tween-20 e lo 0,9% di NaCl, e 5 l della soluzione risultante è stata aggiunta a 100 gradi l della soluzione tetramero CD1d. La miscela è stata incubata per 12 h a temperatura ambiente e posta a 4 gradi centigradi per l'uso. Il TCR è stato diluito 80 volte con acqua deionizzata. Tutti gli altri anticorpi sono stati utilizzati come soluzione di riserva.- Risospendere 107 celle con 100 o L di 4 gradi centigradi PBS, aggiungere 10 L di CD1d Tetramer-PE caricato da z galCer e incubarle a 4 gradi centigradi per 15 min al buio.
- Lavare le celle 2x con PBS e sospenderle nuovamente in 80 gradi di PBS.
- Aggiungete 20 -L di anti-PE-MicroBeads e incubateli a 4 gradi centigradi per 20 min al buio.
- Lavarli 2x con PBS e risospendere le cellule con 500 .L di PBS.
- Posizionare la colonna di smistamento nel campo magnetico della selezionatrice MACS e risciacquare con 500 l- L di PBS.
- Aggiungere la sospensione della cella dal passaggio 2.3.4 alla colonna di ordinamento, raccogliere il flowthrough e risciacquare 3x con buffer PBS.
- Rimuovere il campo magnetico e raccogliere le celle dalla colonna di ordinamento. A questo punto, aggiungere 1 mL di buffer PBS alla colonna di ordinamento e spingere rapidamente lo stantuffo a una pressione costante per guidare le celle etichettate al tubo di raccolta e ottenere celle iNKT purificate. Contare con un contatore cellulare automatizzato.
- Identificazione del fenotipo della cellula iNKT
- Prendere 1 x 106 celle dai passi 2.2.5 e 2.3.7, rispettivamente, e rinvila di nuovo in 50 -L di PBS.
- Incubazione anticorpale: Non aggiungere l'anticorpo al tubo di controllo negativo, aggiungere 0,5 l di Tetramer z-GalCer-PE-CD1d o 10 -L di FITC-TCR - nel singolo tubo di controllo positivo. Aggiungete 0,5 di tetramero z-GalCer-PE-CD1d e 10 -L di FITC-TCR nel tubo campione. Incubarli a 4 gradi centigradi per 30 min al buio.
- Lavare le cellule in PBS e quindi centrifugare a 200 x g per 5 min.
- Scartare il supernatante, aggiungere 1 mL di Foxp3 Foxation/Permeabilization working solution, e incubare le cellule per 45 min a 4 gradi centigradi al buio.
- Aggiungere 1 mL di 1x Soluzione di lavoro permeabilizzazione Buffer e centrifugare le cellule a temperatura ambiente per 500 x g a temperatura ambiente per 5 min.
- Scartare il super-attardato. Aggiungete 1 l di Alexa Fluor 647 mouse Anti-PL-F e 1 L di PerCP-Cy 5.5 mouse anti-T-bet (o 1 L di PerCP-Cy 5.5 mouse anti-ROR)) per 30 min a temperatura ambiente al buio.
- Aggiungere a 2 mL di Permeabilization Buffer soluzione di lavoro per la pulizia.
- Scartare il supernatante, sospendere nuovamente le cellule in 500 - L di PBS e misurare per citometria di flusso.
- Identificazione funzionale delle cellule iNKT
- Prendere 3 x 106 celle iNKT dal passo 2.3.7 e risospende in 12 piastre ben con 1,5 mL di RPMI-1640 mezzo incompleto (cioè, senza siero).
- Aggiungere phorbol ester (PMA, 50 ng/mL) e calcio ionomycin (IO, 1 g/mL) e mettere in un'incubatrice di CO2 per 24 h.
- Raccogliere il supernatante cellulare e rilevare i livelli di secrezione di IL-2, IL-17A, TNF-z, IL-6, IL-4, IFN-e IL-10 utilizzando un saggio CBA commerciale secondo il protocollo del produttore.
- Studio sperimentale sul percorso di migrazione delle cellule iNKT nei topi RA
- Sciogliere il tinrito DiR (2,5 mg/mL) in DMSO.
- Risospendere le cellule iNKT in 6 piastre di pozzo con RPMI-1640 mezzo incompleto. La densità è di 1 x 106 celle/mL.
- Aggiungere la soluzione DiR (5 g/mL) e incubare in un'incubatrice di CO2 per 25 min.
- Lavare con PBS e risospendere nuovamente le celle (3 x 106/300 ) per ottenere celle iNKT con etichetta DiR (DiR-iNKT).
- Iniettare 1% pentobarbital di sodio (50 mg/kg di peso corporeo) intraperitinalmente per anestizzare i topi. I topi adeguatamente anestesizzati non mostrano un ritiro della zampa posteriore al pizzico. Applicare unguento veterinario agli occhi del mouse per evitare la secchezza durante l'anestesia per l'imaging.
- Iniettare le cellule DiR-iNKT 3 x 106 per mouse nella vena posteriore con il modello RA per 8 giorni. Monitorare le cellule iNKT nei topi dopo l'iniezione per 0 min, 10 min, 30 min, 60 min, e giorno 0 (dopo 3 h), 1, 3, 6, 12, 26, 34, 38, e 42 giorni utilizzando un piccolo animale in vivo sistema di imaging (IVIS). La lunghezza d'onda di eccitazione utilizzata era di 748 nm, la lunghezza d'onda di emissione di 780 nm e il tempo di esposizione era automatico.
- Posizionare ogni topo in una gabbia separata dopo ogni osservazione e mantenere la recumbency sternale. Osservare fino al recupero dall'anestesia.
3. Valutazione dell'immunoterapia adottiva dei topi RA con cellule iNKT
- immunoterapia adottiva cellulare iNKT per topi RA
- Iniettare 3 x 106 cellule cellule iNKT cellule per mouse attraverso la vena posteriore. Selezionare casualmente 15 topi che sono stati modellati 8 giorni prima e ottenere cellule iNKT senza etichettatura DiR dal passo 2.3.7 dall'infusione della vena della coda.
- Valutare l'efficacia dell'immunoterapia adottiva per le cellule iNKT.
- Misurare lo spessore della zampa del topo, quantificare il gonfiore dell'articolazione della caviglia e ottenere sistematicamente il punteggio dopo l'infusione di cellule iNKT come descritto nei passaggi 1.2.1–1.2.2.
- Osservare l'infiltrazione infiammatoria delle cellule e i cambiamenti articolari delle articolazioni del topo come descritto nel passaggio 1.2.3.
- Determinare i livelli di secrezione di IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-z, e IFN-z-4 come descritto nel passaggio 1.2.4.
- Determinare la frequenza delle celle e dei sottoinsiemi iNKT.
- Isolare il timo del topo e preparare una singola sospensione cellulare.
- Separare i linfociti con il liquido di separazione dei linfociti.
- Determinare la frequenza delle celle iNKT e la frequenza del sottogruppo come descritto nel passaggio 2.4.
- Analisi statistica
NOTA: Tutti i dati sono presentati come media : i valori SD. di P < 0,05 sono stati considerati statisticamente significativi.- Utilizzare l'analisi a un fattore della varianza (ANOVA). Se la varianza è soddisfatta, utilizzare il test LSD per un ulteriore confronto.
- Se la varianza non è uniforme, utilizzare il test non parametrico. Utilizzare il test Kruskal-Wallis H per un ulteriore confronto31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Il punteggio dell'indice di artrite e lo spessore della zampa sono aumentati dopo la modellazione. Rispetto al gruppo di controllo, le dite del gruppo di modelli RA hanno cominciato a mostrare gonfiore rosso a 6 giorni dopo la modellazione, con graduale aggravamento. A 14 giorni, il gonfiore rosso nell'articolazione della caviglia ha raggiunto il picco, seguito da un graduale sollievo. Lo spessore della zampa è cambiato in modo analogo (P < 0,05) (Figura 1).
L'infiltrazione infiammatoria delle cellule è aumentata in modo significativo dopo la modellazione. I risultati patologici hanno mostrato che il grado di infiltrazione delle cellule infiammatorie nel tessuto sinoviale della caviglia dei topi modello RA era diverso in diverse fasi. L'infiammazione di picco si è verificata il giorno 14 post modellazione (Figura 2).
Le citochine infiammatorie sono aumentate e le citochine antinfiammatorie sono diminuite nel siero. Nel gruppo modello RA, i livelli di siero delle citochine pro-infiammatorie (TNF-z, IFN-z, e IL-6) sono aumentati significativamente (P < 0,05), mentre le citochine antinfiammatorie (IL-4 e IL-10) sono diminuite significativamente (P < 0,05) (Figura 3).
Le cellule iNKT ottenute mediante induzione in vivo e purificazione in vitro consistevano principalmente in sottoinsiemi cellulari di iNKT2, che secernono citochine antinfiammatorie. L'iniezione intraperitale di z-GalCer ha aumentato la frequenza delle cellule iNKT nel corpo, prevalentemente il sottogruppo iNKT2. La frequenza delle cellule iNKT di milza nei topi DBA/1 normali era di circa il 2% dei linfociti (iNKT2 era di circa il 5%, iNKT1 circa il 15%, iNKT17 circa il 10%). Tre giorni dopo l'iniezione intraperitale di z-GalCer, la frequenza delle cellule iNKT era di circa il 6% dei linfociti( Dopo la purificazione da parte di MACS, la purezza delle cellule iNKT era superiore all'85%, di cui iNKT2 era di circa il 92%, iNKT1 circa lo 0,4% e iNKT17 circa lo 0,2% (Figura 4).
Le cellule iNKT raccolte secernevano citochine più antinfiammatorie e meno citochine infiammatorie. Le cellule iNKT sono state isolate dalle milze dei topi normali e intraperite iniettate incongelate con s-GalCer 3 giorni dopo la milza del topo e i livelli di citochina nel supernatante della coltura cellulare sono stati esaminati. Rispetto al gruppo di controllo, le citochine infiammatorie (IL-17A, TNF-z, IFN-z, e IL-6) del gruppo z-GalCer sono diminuite significativamente (P < 0,05), e il livello di CItochina antinfiammatoria IL-4 è aumentato significativamente (P < 0,05). Non c'è stata alcuna differenza significativa in IL-10 (P > 0,05). Il rapporto IFN-z/IL-4 è diminuito significativamente (P < 0,05) (Figura 5).
IVIS tracing ha confermato che le cellule DiR-iNKT erano infuse adottivamente nei topi RA e sono apparse immediatamente nei polmoni dopo l'iniezione. La fluorescenza è stata rilevata nel fegato a 10 min e nella milza a 60 min (Figura 6AI, 6AII, 6AIII). Negli organi isolati, non c'era fluorescenza nel timo e nei linfonodi inguinali entro 1 h. Fluorescenza è stata rilevata nei polmoni a 0 min, l'intensità della fluorescenza è stata la più grande a 10 min, e poi gradualmente indebolita. C'era una debole fluorescenza nel fegato a 0 min, e poi gradualmente aumentato. La fluorescenza nella milza è stata rilevata a 30 min e poi gradualmente aumentata (Figura 6AIV, 6C).
Dopo l'infusione di cellule DiR-iNKT nei topi RA, la fluorescenza si è concentrata principalmente nel fegato e nella milza (Figura 6BI, 6BIII, 6BIII), ma non c'era fluorescenza nel timo e nei linfonodi inguinali. La milza e il fegato avevano la più alta intensità di fluorescenza il giorno 1 dopo l'infusione cellulare, ma si indebolirono gradualmente. Il giorno 34, la fluorescenza superficiale scomparve. Il giorno 42, la fluorescenza degli organi isolati scomparve. L'intensità media del segnale di fluorescenza del fegato dopo l'infusione cellulare era superiore a quella della milza (Figura 6BIV, 6D).
L'infusione adottiva di cellule iNKT nei topi RA può alleviare la progressione della malattia e migliorare i sintomi clinici. Le cellule iNKT hanno migliorato i sintomi clinici dei topi RA dopo l'infusione adottiva. Rispetto al gruppo di modelli RA non trattato, il gonfiore dell'articolazione della caviglia è stato alleviato nel gruppo di trattamento cellulare e i punteggi sono diminuiti significativamente dal giorno 10 al giorno 20 post-iniezione. Nello stesso periodo nel gruppo di trattamento cellulare, l'infiltrazione cellulare infiammatoria nel tessuto sinoviale è stata ridotta rispetto al gruppo modello RA (Figura 2).
I tassi di successo delle cellule timo iNKT sono aumentati in modo significativo (P < 0,05). Rispetto al gruppo di controllo sano, nel gruppo modello RA i tassi di cellule iNKT nel timo sono diminuiti al progresso (giorno 11), al picco (giorno 14) e alle fasi di recupero (giorno 20). Al massimo dell'infiammazione, questi valori erano minimi e rimbalzati nella fase di remissione. Il gruppo di terapia cellulare ha mostrato tassi significativamente aumentati di cellule iNKT alle fasi di picco (giorno 14) e recupero (giorno 20) rispetto al gruppo modello RA (P < 0.05) (Figura 7).
Dopo l'infusione di cellule iNKT, il tasso di successo di iNKT1 e iNKT17 nel timo è diminuito e iNKT2 è aumentato. Rispetto al gruppo di controllo, nel gruppo di modelli RA del giorno 11 iNKT1 e iNKT17 nel timo sono notevolmente aumentati (P < 0,05) e iNKT2 sono diminuiti in modo significativo (P < 0,05). Il giorno 14, iNKT1 e iNKT2 nel timo sono aumentati in modo significativo (P< 0,05) e iNKT17 sono diminuiti in modo significativo (P< 0,05). Il giorno 20, iNKT1 nel timo è aumentato in modo significativo (P < 0.05), iNKT2 non è cambiato in modo significativo (P > 0,05) e iNKT17 è diminuito in modo significativo (P < 0,05). Il rapporto iNKT1/iNKT2 è aumentato in modo significativo durante tutte e tre le fasi (P < 0,05).
Rispetto al gruppo di modelli RA, il giorno 11 nei gruppi di terapia cellulare e z-GalCer, iNKT1 e iNKT17 erano significativamente inferiori (P < 0.05) e iNKT2 significativamente aumentati (P < 0.05). Il giorno 14, nei gruppi iNKT1 e iNKT17 sono diminuiti in modo significativo (P < 0,05) e iNKT2 non sono cambiati in modo significativo (P > 0.05); nei gruppi di terapia cellulare iNKT1 e iNKT17 sono diminuiti in modo significativo (P < 0,05) e iNKT2 sono aumentati in modo significativo (P < 0,05). Il giorno 20, nel gruppo iNKT1 è diminuito in modo significativo l'iNKT1 (P < 0,05), iNKT2 non è stato modificato in modo significativo (P > 0,05) e iNKT17 è aumentato in modo significativo (P < 0,05); nei gruppi di terapia cellulare iNKT1 e iNKT17 sono diminuiti in modo significativo (P < 0,05) e iNKT2 sono aumentati in modo significativo (P < 0,05). Il rapporto tra iNKT1/iNKT2 è diminuito significativamente durante tutte e tre le fasi (P < 0,05) (Figura 7).
I livelli di citochine infiammatorie sono stati aumentati nel siero e le citochine antinfiammatorie sono diminuite dopo l'infusione di cellule iNKT. Nel gruppo di modelli ra, i livelli di siero TNF-z, IFN-z e IL-6in sono aumentati significativamente (P < 0,05), mentre IL-4 e IL-10 hanno mostrato quantità nettamente diminuite (P < 0,05) rispetto al gruppo di controllo. Nel gruppo di terapia cellulare iNKT, i livelli di TNF-z, IFN-z, e IL-6 nel siero sono diminuiti significativamente nelle fasi di avanzamento e picco dell'infiammazione (P < 0,05), mentre IL-4 e IL-10 sono aumentati in modo significativo (P < 0,05) rispetto al gruppo modello RA (Figura 3).
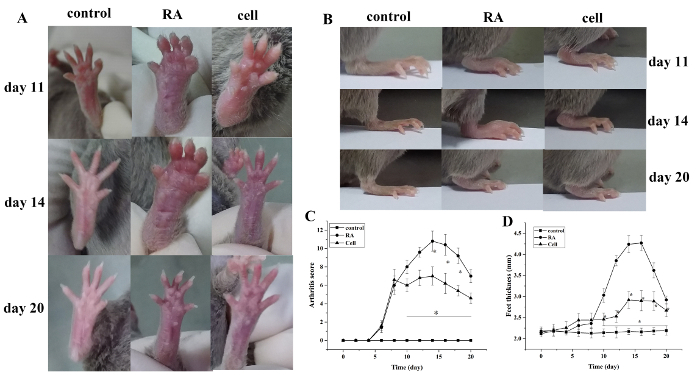
Figura 1: Il punteggio di gonfiore articolare e il cambiamento di spessore della zampa nei topi. (A) Gonfiore dell'articolazione della caviglia nei topi. (B, D) Spessore della zampa in gruppi diversi. (C) Cambiamenti clinici di punteggio in gruppi diversi. Il punteggio dell'artrite del topo e lo spessore della zampa sono stati significativamente ridotti nel gruppo di terapia cellulare nei giorni 10-20 (cioè, 2-12 giorni dopo il trattamento) dopo la modellazione. P< 0,05 rispetto al controllo, aP < 0,05 e a RA. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Cambiamenti istopatologici dell'articolazione della caviglia. L'infiltrazione delle cellule infiammatorie è stata significativamente ridotta nel gruppo di terapia cellulare ed è stata significativamente aumentata nel gruppo RA il giorno 14. - Cellule infiammatorie. (A) 100x (B) 400x. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: I livelli di citochine del siero in ogni gruppo. (A) I livelli di citochine del siero nei topi il giorno 11 dopo la modellazione (pg/mL). (B) Livelli di citochine del siero nei topi il giorno 14 dopo la modellazione (pg/mL). I livelli di TNF-z, IFN-z e IL-6 diminuirono significativamente, e i livelli di IL-4 e IL-10 aumentarono significativamente nel gruppo di terapia cellulare. unp < 0.05 rispetto al controllo. bP < 0,05 rispetto a RA. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Le frequenze delle celle iNKT e la proporzione dei sottoinsiemi di celle iNKT. (A,B,C) Il tasso di iNKT2 nei topi normali è del 5%. (D,E,F) Il tasso di iNKT2 è di circa l'82% dopo l'induzione in vivo. (G, H, I) Il tasso di iNKT2 è superiore al 92% dopo la purificazione MACS. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Livelli di citochina nella coltura supernatante delle cellule iNKT derivate dalla milza del topo. Il livello di IL-4 aumentò significativamente, e i livelli di IL-17A, TNF-z, IFN-z e IL-6 diminuirono significativamente. unp < 0.05 rispetto al controllo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Distribuzione e metabolismo delle cellule iNKT tracciate dalla pinza IVIS lumina II. (A,B) Percorso di migrazione delle celle iNKT. (C) Il cambiamento dell'intensità media del segnale di fluorescenza nella milza, nel fegato e nei polmoni. (D) Il cambiamento dell'intensità media del segnale di fluorescenza nella milza e nel fegato. La fluorescenza è stata rilevata nei polmoni e nel fegato a 0 min, e poi gradualmente aumentata. L'intensità di fluorescenza era più forte a 10 minuti nei polmoni e poi diminuita. La fluorescenza della milza è stata rilevata a 30 min, quindi gradualmente aumentata. La fluorescenza di tutti gli organi scomparve il giorno 42. L'intensità media del segnale di fluorescenza del fegato è superiore alla milza dopo l'infusione cellulare (I: supina; II: sdraiatità laterale; III: incline; IV: tessuto isolato; a: gruppo di controllo; b: gruppo di infusione cellulare; 1, 2, 3, 4, 5 sono timo, milza, fegato, linfonodi inguinali, polmoni). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: I tassi di iNKT e i suoi sottoinsiemi nel tiromus del topo. (A) I tassi di celle iNKT a 11, 14 e 20 giorni dopo la modellazione. (B) Il rapporto tra iNKT1/iNKT2. (C,D,E) Frequenza di iNKT1, iNKT2 e iNKT17. Nei giorni 11, 14 e 20 (giorni 3, 6 e 12 dopo la terapia cellulare), i tassi di cellule iNKT sono aumentati in modo significativo, l'iNKT1 e l'NKT17 del timo sono diminuiti significativamente nel gruppo di terapia cellulare e iNKT2 sono stati significativamente aumentati. aP < 0.05 vs Control. bP < 0,05 vs RA. Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le cellule iNKT sono cellule T speciali che colmano l'immunità innata e adattiva e sono sviluppate principalmente a partire daCD4/CD8e timociti. Le cellule iNKT hanno diverse funzioni immunoregolatorie e interagiscono con altre cellule immunitarie per contatto diretto e secrezione di diverse citochine23, che interessano le cellule dendritiche (DC), macrofagi, neutrofili, cellule B, cellule T e differenziazione e sviluppo delle cellule NK24. Il sistema è un classico attivatore specifico per le cellule iNKT estratto dalle spugne. Diversi studi indicano che la frequenza cellulare iNKT milza raggiunge un picco dopo una singola iniezione intraperitoneale di z-GalCer per 3 giorni25. I nostri risultati sperimentali hanno dimostrato la predominanza del sottoinsieme iNKT2 nella milza di topi per 3 giorni dopo un'iniezione intraperitoneale di z-GalCer, che secerne principalmente citochine antinfiammatorie IL-4 e IL-10. Abbiamo anche scoperto che l'abbondanza di cellule iNKT2 è diminuita e quella delle cellule iNKT1 e iNKT17 è aumentata nei topi modello RA durante la fase infiammatoria. Pertanto, abbiamo isolato le cellule iNKT della milza del topo per iniezione intraperitoneale di z-GalCer per 3 giorni. Questi sono stati utilizzati per trattare i topi modello RA. Il tasso del sottoinsieme iNKT2 era dell'82% dopo l'induzione in vivo. Dopo la purificazione da parte di MACS, il tasso di iNKT2 ha superato il 92%.
L'attivazione specifica delle cellule iNKT viene impiegata come nuovo trattamento biologico per l'AR. Horikoshi et al.21 ha dimostrato che l'iniezione intradermica di z-GalCer ha inibito l'artrite indotta da peptidi gpidi inibendo in modo significativo il numero di celluleT CD4 e T. Chiba et al.26 ha mostrato che le ripetute iniezioni dell'attivatore selettivo iNKT2 sintetico OCH inibivano la CIA, mentre il z-GalCer ha mostrato un leggero effetto inibitorio. Abbiamo iniettato iNKT derivato dalla milza nei topi modello RA, e i risultati hanno mostrato che il grado di gonfiore delle articolazioni della caviglia nel gruppo di terapia cellulare e il numero di cellule infiammatorie infiltrate nelle articolazioni è stato ridotto. Il livello delle citochine antinfiammatorie del siero (ad esempio, IL-4 e IL-10) è aumentato e la secrezione di citochine pro-infiammatorie (ad es. IFN-e TNF-z) è diminuito. l'attivazione mirata delle cellule iNKT è stata in grado di alleviare la progressione dell'AR e inibire la risposta infiammatoria. Inoltre, abbiamo rilevato la frequenza di iNKT nel timo e abbiamo scoperto che il numero di cellule iNKT nel gruppo modello RA era significativamente ridotto, mentre la frequenza nel timo è aumentata dopo l'infusione delle cellule iNKT. A causa della presenza del sistema di barriera sangue-timo, non abbiamo considerato l'aumento adottivamente infuso del livello di iNKT nel timo che è stato confermato negli esperimenti successivi. Un'ulteriore rilevazione delle sottopopolazioni di cellule iNKT nel timo ha rivelato che, rispetto al gruppo di controllo sano, il numero di cellule iNKT1 nel gruppo modello RA è aumentato in modo significativo durante le tre fasi di infiammazione e al massimo durante il picco di infiammazione, mentre la proporzione del sottoinsieme iNKT2 ha cominciato ad aumentare al picco di infiammazione. In particolare, il sottoinsieme iNKT1 potrebbe essere coinvolto nella infiammazione precoce di RA, e il sottoinsieme iNKT2 può svolgere un ruolo importante nell'inibire l'infiammazione. Rispetto al gruppo modello RA, il sottoinsieme iNKT1 nel gruppo di terapia cellulare è diminuito significativamente durante la fase infiammatoria e il sottoinsieme iNKT2 è aumentato significativamente nella fase iniziale e di remissione dell'infiammazione. Questi risultati hanno indicato che l'infusione adottiva di fenotipi specifici e cellule iNKT funzionali ha aumentato significativamente la frequenza delle cellule iNKT nell'AR e ha alterato la proporzione dei sottoinsiemi di cellule iNKT.
Abbiamo usato IVIS per osservare la distribuzione delle cellule iNKT nei topi dopo l'infusione adottiva e abbiamo trovato la più alta intensità di fluorescenza nei polmoni 10 minuti dopo l'infusione, che è sbiadita gradualmente. Il fegato ha mostrato una debole fluorescenza, che è aumentata gradualmente e è diminuita gradualmente dopo 2 giorni. La fluorescenza è stata rilevata nella milza a 30 min, che è aumentata gradualmente e diminuita dopo 2 giorni. L'intensità media di fluorescenza del fegato era più forte di quella della milza. Tuttavia, non è stata rilevata alcuna fluorescenza nel timo e nei linfonodi inguinali. La rilevazione della fluorescenza nei polmoni potrebbe essere attribuita all'infusione di cellule iNKT nella vena della coda. Queste cellule sono circolate ai polmoni con il sangue. Il fegato fluoresce prima della milza e l'intensità media di fluorescenza del fegato è più forte di quella della milza. Questo accumulo preferenziale delle cellule iNKT può essere dovuto ai vasi sanguigni abbondanti nel fegato, l'organo metabolico principale. La fluorescenza non è stata rilevata nel timo. Ciò potrebbe essere dovuto alla barriera ematologica, che potrebbe ostacolare l'ingresso delle cellule iNKT. La fluorescenza non è mai stata rilevata nei linfonodi inguinali, forse perché meno cellule iNKT sono entrate nei linfonodi e non hanno raggiunto il livello minimo di rilevamento. Inoltre, si potrebbe ipotizzare che le cellule iNKT infuse nella vena posteriore potrebbero non entrare nei linfonodi. Pertanto, ipotizziamo che lo sviluppo e la differenziazione delle cellule iNKT nel timo potrebbero essere regolati attraverso percorsi citochine dopo l'infusione adottiva nei topi. Questo deve essere ulteriormente chiarito.
La GPI è presente nel siero e nel fluido sinoviale della maggior parte dei pazienti affetti da ART ed è un test comunemente usato per la diagnosi clinica di RA27. Bruns et al.28 usato peptidi di diverse lunghezze dalla sequenza GPI e immunizzato i topi DBA/1 per identificare sei epitopi immunodominanti a cellule T. Di questi, tre erano artritogenici. I peptidi con >95% di incidenza di artrite sono hGPI 325-339 e hGPI469-483. I nostri studi precedenti hanno dimostrato che l'uso di una miscela dei due peptidi per stabilire un modello RA è meglio di un singolo peptide. Nei modelli RA risultanti, le punta e le articolazioni dei topi cominciarono ad apparire rosse il giorno 6 e raggiunsero un picco di infiammazione il giorno 14. L'infiltrazione delle cellule infiammatorie è stata accompagnata da iperplasia tissutale nel tessuto sinoviale delle articolazioni, e l'infiltrazione delle cellule infiammatorie è stata più grave al giorno 14. Il numero di cellule iNKT è diminuito in modo significativo nel timo al picco di infiammazione, che era coerente con la tendenza delle cellule iNKT nei pazienti RA29. Un'ulteriore rilevazione dei sottoinsiemi cellulari iNKT ha rivelato che la frequenza di iNKT1 e iNKT17 nel timo è aumentata e la frequenza di iNKT2 è diminuita durante la progressione dell'infiammazione (giorno 11). Inoltre, i livelli di siero citochine IFN-z e IL-17A sono aumentati durante la progressione (giorno 11) e il picco di infiammazione (giorno 14), suggerendo una polarizzazione simile dei sottogruppi Th1 e Th17 neitopi modelloRA 30 . Pertanto, il modello murino RA indotto da hGPI325-339 e hGPI469-483 frammenti di polipeptide misti ha mostrato le caratteristiche di CD4- iperproliferazione delle cellule T e difetti cellulari iNKT, che era simile a quello dei pazienti RA, e potrebbe essere utilizzato come modello animale ideale per studiare l'immunità delle cellule RA. Questi risultati erano in accordo con quelli dei nostri studi precedenti e hanno dimostrato la stabilità del modello RA31indotto da hGPIs.
In generale, il modello murino RA indotto dai peptidi misti G6PI può simulare i cambiamenti nelle cellule CD4: cellule T, cellule iNKT e citochine correlate nei pazienti affetti da RA. Ciò fornisce un buon modello per un'analisi approfondita dell'AR. Consecutivamente, iNKT (principalmente iNKT2) indotto dall'iniezione intraperitoneale di z-GalCer e purificato in vitro è stato utilizzato nel trattamento dell'AR. Può correggere lo squilibrio immunitario causato dalla proliferazione anormale di sottoinsiemi Th, alleviare la progressione dell'AR, e in futuro può fornire nuovi metodi per il trattamento clinico dell'AR.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non dichiarano alcun finanziamento o conflitto di interesse.
Acknowledgments
Il nostro studio è stato sostenuto dalla National Natural Science Foundation of China (NSFC) (81771755), Colleges e progetto di ricerca chiave di scienza e tecnologia dell'università della provincia di Hebei (D2017009) e l'Animal Lab del Medical Experiment Center, Hebei University. Siamo grati per il loro sostegno.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



