Summary
Ce protocole utilise des peptides mixtes G6PI pour construire des modèles de polyarthrite rhumatoïde qui sont plus proches de celui de la polyarthrite rhumatoïde humaine dans les cellulesT CD4 et cytokines. Des lymphocytes T tueurs naturels invariants de haute pureté (principalement iNKT2) avec des phénotypes et des fonctions spécifiques ont été obtenus par induction in vivo et purification in vitro pour l'immunothérapie adoptive.
Abstract
La polyarthrite rhumatoïde (PR) est une maladie auto-immune inflammatoire chronique complexe. La pathogénie de la maladie est liée aux cellules tueuses naturelles invariantes De T (iNKT). Les patients présentant la RA active présentent moins de cellules iNKT, fonction cellulaire défectueuse, et polarisation excessive de Th1. Dans cette étude, un modèle animal de RA a été établi utilisant un mélange de hGPI325-339 et de peptides de hGPI469-483. Les cellules d'iNKT ont été obtenues par induction in vivo et purification in vitro, suivies de l'infusion dans des souris de RA pour l'immunothérapie adoptive. Le suivi du système d'imagerie in vivo (IVIS) a révélé que les cellules iNKT étaient principalement distribuées dans la rate et le foie. Le jour 12 après la thérapie cellulaire, la progression de la maladie a ralenti de manière significative, les symptômes cliniques ont été allégés, l'abondance des cellules iNKT dans le thymus a augmenté, la proportion d'iNKT1 dans le thymus a diminué, et les niveaux de TNF-, IFN-, et IL-6 dans le sérum a diminué. L'immunothérapie adoptive des cellules iNKT a rétabli l'équilibre des cellules immunitaires et a corrigé l'inflammation excessive du corps.
Introduction
La polyarthrite rhumatoïde (PR) est une maladie auto-immune caractérisée par une invasivité chronique et progressive avec une incidence de 0,5 à 1 %1,2. La pathogénie sous-jacente est attribuée à la prolifération anormale des cellules CD4 et CD8 et T autoréactives, qui se manifeste par une augmentation de la proportion de CD4, IFNet CD4, IL-17A, et par la réduction du nombre de cD4, il il-4 et CD4, CD25, FoxP3et T. Par conséquent, la sécrétion des cytokines inflammatoires est augmentée, et une réaction inflammatoire excessive détruit l'équilibre indigène et la fonction de tolérance du système immunitaire du corps. En outre, le lymphocyte T aide (Th) 1 cellules qui pénètrent dans l'articulation aggravent la réponse inflammatoire et les dommages articulaires. Par conséquent, l'inhibition de la réponse inflammatoire excessive et le rétablissement de la tolérance immunitaire et l'équilibre immunitaire sont essentiels au traitement de la RA3,4.
Les cellules iNKT ont à la fois des fonctions et des caractéristiques des cellules NK et des lymphocytes T. Les cellules iNKT abritent un récepteur de cellules T (TCR) distinct et invariant avec des répertoires limités de chaîne TCR5 et reconnaissent l'antigène glycolipidique présenté par la molécule majeure de classe I du complexe d'histocompatibilité (MHC) CD1d à la surface des cellules présentant des antigènes. Mitsuo et coll.6 ont détecté un grand nombre de cellules iNKT et de défauts fonctionnels dans de nombreuses maladies auto-immunes, y compris la polyarthrite rhumatoïde. Aurore et coll.7 ont démontré que les cellules iNKT ont un effet positif sur le maintien de la tolérance auto-immune et que lorsque le nombre et la fonction des cellules iNKT sont restaurés, la maladie est atténuée. En outre, Miellot-Gafsou et coll.8 ont constaté que les cellules iNKT non seulement abrogé la maladie, mais aussi augmenté la progression de la maladie. Ces résultats contradictoires suggèrent que les cellules iNKT sont des lymphocytes T hétérogènes, et la fonction de différents sous-ensembles peut être inversée. Dans une étude clinique de la POLY, la fréquence des cellules iNKT corrélée avec le score de l'activité de la maladie9. Les résultats ont également confirmé que la fréquence de l'iNKT a été diminuée chez les patients atteints de polyarthrite rhumatoïde, que le nombre de sous-ensembles de cellulesT CD4et IFN a augmenté, et que les niveaux sécréteurs de cytokines inflammatoires IFN et TNF-MD ont augmenté de10,11. En outre, Sharif et coll.12 ont étudié le diabète de type 1 (T1D) et ont constaté que l'infusion sélective de cellules iNKT régulait l'expression de la cytokine inflammatoire IL-4, maintenait la tolérance immunitaire et empêchait le développement du diabète de type 1. Par conséquent, l'infusion adoptive de cellules spécifiques d'iNKT ou l'activation ciblée des cellules d'iNKT augmente le niveau des cellules d'iNKT dans les patients de RA, qui peut être une percée dans le traitement de RA.
L'immunothérapie cellulaire est actuellement d'un grand intérêt et a été largement utilisé dans la thérapie contre le cancer. Cependant, les cellules iNKT sont rares, les cellules immunorégulatrices hétérogènes (seulement 0,3% du nombre total de PBMC)13, ce qui limite les applications cliniques potentielles. Ces cellules sont principalement divisées en trois sous-populations : 1) les cellules iNKT1, qui ont une forte expression de la leucémie promyélolocytique de la protéine zinc-doigt (PLZF) et du facteur de transcription de la boîte T (T-bet); 2) cellules iNKT2 avec expression intermédiaire de PLZF et gatA protéine de liaison 3 (GATA3); 3) cellules iNKT17 avec une faible expression de PLZF et rétinoïde-connexe récepteur nucléaire orphelin (ROR)-t qui sécrètent IFN-, IL-4, et IL-1714. Les cellules iNKT activées sécrètent des cytokines de type Th1, Th2 et Th17, qui déterminent les différents effets immunomodulatoires des cellules iNKT15. Les effets immunomodulatoires et immunothérapeutiques de l'activation spécifique de diverses sous-populations de cellules iNKT sont différents. Par conséquent, la sélection de phénotypes spécifiques de cellules iNKT (principalement iNKT2) avec des fonctions anti-inflammatoires pour réguler la réponse immunitaire de l'organisme peut corriger le déséquilibre immunitaire et les troubles immunitaires dans la PR.
L'établissement d'un modèle animal idéal est d'une grande importance pour le traitement et l'étude de la pathogénie de RA. À l'heure actuelle, les modèles animaux les plus couramment utilisés et matures comprennent l'arthrite induite par le collagène, l'arthrite adjuvante, l'arthrite induite par les zymosans et l'arthrite induite par le polysaccharide16à17. Cependant, il n'existe aucun modèle qui puisse simuler pleinement toutes les caractéristiques de la POLY humaine. L'arthrite induite par le collagène de type II (CIA) est un modèle classique de l'arthrite. La CIA est induite par la vaccination des souris avec des anticorps monoclonaux de type II spécifiques au collagène, reflétant la dépendance d'anticorps de ce modèle de maladie. Benurs et coll. ont décrit un modèle avec une réponse immunitaire systémique à l'isomérase glucose-6-phosphate (G6PI), qui induit la polyarthrite symétrique périphérique dans les souches sensibles de souris18,19. Dans ce modèle, le développement de l'arthrite dépend des lymphocytes T, des cellules B et de l'immunité innée18,19,20. Horikoshi21 a constaté que les modèles de RA résultant de la vaccination des souris DBA/1 avec des fragments de polypeptide G6PI sont plus semblables à la RA humaine en termes de CD4- lymphocytes T et cytokines (c.-à-d., IL-6 et TNF-) que les modèles de la CIA. Afin d'augmenter l'effet stimulant sur le site de reconnaissance TCR, les fragments mixtes de polypeptide de G6PI (hGPI325-339 et hGPI469-483) ont été utilisés pour immuniser les souris DBA/1 pour construire le modèle de souris RA. Le taux de réussite de cette approche peut être élevé parce que hGPI325-339 et hGPI469-483 sont immunodominants pour les réponses de lymphocytes T I-A q-restricted. Par conséquent, ce modèle peut simuler la surprolifération des cellules CD4t et des défauts de cellules iNKT chez les patients atteints de POLY22. La recherche fondamentale de l'immunopathologie de RA a jeté les bases de notre recherche plus approfondie.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les souris expérimentales (150 au total) étaient des souris mâles en bonne santé DBA/1, âgées de 6 à 8 semaines (20,0 à 1,5 g), dans un environnement spécifique exempt d'agents pathogènes (FPS). Il n'y a pas de traitement spécial avant la modélisation. L'expérience a été divisée en un groupe témoin sain (15 souris), un groupe témoin modèle (15 souris) et un groupe de thérapie cellulaire (55 souris). Cette étude a été approuvée par le Comité du bien-être animal et de l'éthique de l'Université Hebei.
1. Construire le modèle de la maladie
- Dupliquer le modèle animal RA
- Peser 1,75 mg de fragments de hG6PI 325-339 et de hG6PI 469-483 et les dissoudre dans 5,25 ml d'eau triple distillée de 4 oC.
- Dissoudre l'adjuvant complet de Freund (CFA) dans un bain d'eau de 50 oC, dessiner 5,25 ml dans un autre tube de centrifugeuse de 10 ml, et le refroidir pour une utilisation.
- Mettez le mélange de solution hG6PI et de solution CFA dans une unité d'émulsification artificielle avec deux seringues en verre connectées.
- Poussez la seringue à une vitesse et une fréquence constantes de 10 à 20x par min pour émulsionner complètement la solution mixte peptide et la solution CFA. Effectuer l'opération dans un bain de glace, et garder les gouttelettes d'émulsion dans l'eau pendant 10 min après l'achèvement de l'émulsification sans se dissiper.
- Injecter 150 L d'hG6PIs émulsifiés dans la racine de la queue de la souris sous-cutané.
- Injecter 200 mg de toxine de pertussis dans la souris par voie intrapéritone à 0 h et 48 h après l'injection de hG6PI.
- Vérification expérimentale du modèle RA
- Mesurer l'épaisseur de la patte de la souris avec un étrier Vernier (2x par jour).
- Observez et marquez le degré de rougeur et d'enflure du pied. Utiliser les critères de notation suivants : 1) orteils légèrement enflés; 2) pedis dorsum et garniture de pied avec le gonflement rouge clair ; 3) cheville avec gonflement rouge.
- Euthanasier les souris sous anesthésie profonde par injection intrapéritonéale de 1% de pentobarbital de sodium (50 mg/kg de poids corporel) 14 jours après la modélisation et enlever les pattes pour la coloration HE.
- Déterminez les niveaux de sécrétion de sérum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-MD et IFN-MD à l'aide d'un tableau de perles cytométriques commerciales (CBA) selon le protocole du fabricant.
2. Obtenir des cellules iNKT avec thérapie cellulaire adoptive
- Induction directionnelle des cellules iNKT
- Injecter des souris normales par voie intrapéritone avec un '-GalCer'(0,1 mg/kg de poids corporel).
- Isolement des cellules iNKT
- Trois jours après la modélisation, injectez des souris par voie intrapéritone avec 1 % de pentobarbital de sodium (50 mg/kg de poids corporel) pour l'anesthésie. Les souris suffisamment anesthésiées ne montrent pas une réponse de retrait de patte arrière à une pincée d'orteil.
- Isolez la rate d'une souris DBA/1 après l'avoir injectée par voie intrapéritone avec le '-GalCer. Préparer une suspension à cellule unique en coupant et broyant la rate dans un tamis de 200 mailles.
- Laver la suspension cellulaire avec du PBS, centrifugeuse à 200 x g pendant 5 min, et jeter le supernatant. Répéter.
- Resuspendre les cellules avec 1 ml de sang entier et solution de dilution tissulaire. Ajouter 3 ml de milieu de séparation des lymphocytes de souris, puis centrifuger les cellules pendant 20 min à 300 x g à température ambiante.
- Recueillir la couche de lymphocytes blancs laiteux (c.-à-d., la deuxième couche à partir du haut), la laver 2x avec PBS, et compter avec un compteur cellulaire automatisé.
- Stratégie de sélection activée magnétique des cellules (MACS) pour la purification des cellules iNKT
REMARQUE : Pour le prétraitement des tétratiers CD1d, 1 mg/mL de Galcer a été dilué à 200 g/mL avec 0,5 % de Tween-20 et 0,9 % de NaCl, et 5 l de la solution résultante a été ajoutée à 100 oL de la solution de tétramer CD1d. Le mélange a été incubé pendant 12 h à température ambiante et placé à 4 oC pour une utilisation. Le TCR A été dilué 80x avec de l'eau déionisée. Tous les autres anticorps ont été utilisés comme solution de stock.- Resuspendre 107 cellules avec 100 oL de 4 oC DE PBS, ajouter 10 OL de Tetramer-PE CD1d chargé par GalCer, et les incuber à 4 oC pendant 15 min dans l'obscurité.
- Laver les cellules 2x avec du PBS et les suspendre à nouveau dans 80 L de PBS.
- Ajouter 20 l d'anti-PE-MicroBeads et les incuber à 4 oC pendant 20 min dans l'obscurité.
- Lavez-les 2x avec pbS et resuspendre les cellules avec 500 L de PBS.
- Placez la colonne de tri dans le champ magnétique du trieur MACS et rincez à 500 l de PBS.
- Ajouter la suspension cellulaire de l'étape 2.3.4 à la colonne de tri, recueillir le flux et rincer 3x avec le tampon PBS.
- Retirez le champ magnétique et collectez les cellules de la colonne de tri. À ce stade, ajouter 1 mL de tampon PBS à la colonne de tri, et pousser rapidement le piston à une pression constante pour conduire les cellules étiquetées au tube de collecte et d'obtenir des cellules iNKT purifiées. Comptez avec un compteur cellulaire automatisé.
- Identification du phénotype des cellules iNKT
- Prenez 1 x 106 cellules des étapes 2.2.5 et 2.3.7, respectivement, et resuspendez-les dans 50 'L de PBS.
- Incubation des anticorps : N'ajoutez pas l'anticorps au tube de contrôle négatif, ajoutez 0,5 L de Tetramer à -GalCer-PE-CD1d ou 10 'L de FITC-TCR' dans le tube de contrôle positif unique. Ajouter 0,5 L de tétramère de l'échantillon de 10 euros.GalCer-PE-CD1d et 10 OL de FITC-TCR. Incuber à 4 oC pendant 30 min dans l'obscurité.
- Laver les cellules en PBS, puis centrifuger à 200 x g pendant 5 min.
- Jeter le supernatant, ajouter 1 ml de Foxp3 Foxation/Permeabilization solution de travail, et incuber les cellules pendant 45 min à 4 oC dans l'obscurité.
- Ajouter 1 ml de 1x Perméabilization Solution de travail tampon et centrifuger les cellules à température ambiante pour 500 x g à température ambiante pendant 5 min.
- Jetez le supernatant. Ajouter 1 'L d'Alexa Fluor 647 souris Anti-PLZF et 1 'L de PerCP-Cy 5.5 souris anti-T-bet (ou 1 'L de PerCP-Cy 5.5 souris anti-ROR't) pendant 30 min à température ambiante dans l'obscurité.
- Ajouter à 2 ml de solution de travail de perméabilisation tampon pour le nettoyage.
- Jeter le supernatant, resuspendre les cellules dans 500 L de PBS, et mesurer par cytométrie de flux.
- Identification fonctionnelle des cellules iNKT
- Prenez 3 x 106 cellules iNKT de l'étape 2.3.7 et resuspendez-les dans 12 plaques de puits avec 1,5 ml de milieu incomplet RPMI-1640 (c.-à-d., sans sérum).
- Ajouter l'ester phorbol (PMA, 50 ng/mL) et le calcium ionomycine (IO, 1 g/mL) et placer dans un incubateur co2 pendant 24 h.
- Recueillir le supernatant cellulaire et détecter les niveaux de sécrétion de l'IL-2, IL-17A, TNF-MD, IL-6, IL-4, IFN-MD et IL-10 à l'aide d'un analyse commerciale de l'ABC selon le protocole du fabricant.
- Étude expérimentale sur la voie de migration des cellules iNKT chez les souris PR
- Dissoudre le colorant DiR (2,5 mg/mL) dans le DMSO.
- Resuspendre les cellules iNKT dans 6 plaques de puits avec RPMI-1640 milieu incomplet. La densité est de 1 à 106 cellules/mL.
- Ajouter la solution DiR (5 g/mL) et incuber dans un incubateurco2 pendant 25 min.
- Laver avec du PBS et resuspendre les cellules (3 x 106/300 l) pour obtenir des cellules iNKT étiquetées DiR (DiR-iNKT).
- Injecter 1 % de pentobarbital de sodium (50 mg/kg de poids corporel) par voie intrapéritone pour anesthésier les souris. Les souris suffisamment anesthésiées ne montrent pas un retrait de patte arrière à pincer les orteils. Appliquer la pommade vétérinaire sur les yeux de la souris pour prévenir la sécheresse pendant l'anesthésie pour l'imagerie.
- Injecter des cellules DiR-iNKT 3 x 106 par souris dans la veine de la queue avec le modèle RA pendant 8 jours. Surveiller les cellules iNKT chez les souris post-injection pendant 0 min, 10 min, 30 min, 60 min, et le jour 0 (après 3 h), 1, 3, 6, 12, 26, 34, 38 et 42 jours à l'aide d'un petit animal in vivo système d'imagerie (IVIS). La longueur d'onde d'excitation utilisée était de 748 nm, la longueur d'onde d'émission était de 780 nm et le temps d'exposition était automatique.
- Placez chaque souris dans une cage séparée après chaque observation et maintenez la charge sternale. Observez jusqu'à la récupération de l'anesthésie.
3. Évaluation de l'immunothérapie adoptive des souris de RA avec des cellules iNKT
- immunothérapie adoptive cellulaire iNKT pour les souris PR
- Injecter 3 x 106 cellules iNKT cellules par souris à travers la veine de la queue. Sélectionnez au hasard 15 souris qui ont été modélisées 8 jours avant et obtenir des cellules iNKT sans étiquetage DiR à partir de l'étape 2.3.7 par l'infusion de veine de queue.
- Évaluer l'efficacité de l'immunothérapie adoptive pour les cellules iNKT.
- Mesurez l'épaisseur de la patte de la souris, quantifiez l'enflure de l'articulation de la cheville et marquez systématiquement après l'infusion de cellules iNKT décrites dans les étapes 1.2.1-1.2.2.2.
- Observez l'infiltration inflammatoire des cellules et les changements articulaires des articulations de la souris tels que décrits à l'étape 1.2.3.
- Déterminez les niveaux de sécrétion de l'IL-2, de l'IL-4, de l'IL-6, de l'IL-10, de l'IL-17A, du TNF et de l'IFN, tels que décrits à l'étape 1.2.4.
- Déterminer la fréquence des cellules et des sous-ensembles iNKT.
- Isoler la souris thymus et préparer une suspension à cellule unique.
- Séparez les lymphocytes avec le fluide de séparation de lymphocyte.
- Déterminer la fréquence des cellules iNKT et la fréquence des sous-groupes décrites à l'étape 2.4.
- Analyse statistique
REMARQUE : Toutes les données sont présentées comme étant moyennes à la SD. Les valeurs de P et de 0,05 ont été considérées comme statistiquement significatives.- Utiliser une analyse d'un facteur de la variance (ANOVA). Si la variance est satisfaite, utilisez le test de LSD pour une comparaison plus approfondie.
- Si la variance n'est pas uniforme, utilisez le test non paramétrique. Utilisez le test Kruskal-Wallis H pour une comparaison plus approfondie31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Le score de l'indice d'arthrite et l'épaisseur de la patte ont augmenté après la modélisation. Comparé au groupe témoin, les orteils du groupe modèle de RA ont commencé à montrer le gonflement rouge à 6 jours après modélisation, avec l'aggravation progressive. À 14 jours, l'enflure rouge dans l'articulation de cheville a culminé, suivie du soulagement progressif. L'épaisseur de la patte a changé de la même façon(P et lt; 0,05) (Figure 1).
L'infiltration inflammatoire de cellules a augmenté de manière significative après modélisation. Les résultats pathologiques ont prouvé que le degré d'infiltration des cellules inflammatoires dans le tissu synovial de cheville des souris modèles de RA était différent à différents stades. L'inflammation maximale s'est produite le jour 14 après la modélisation (figure 2).
Les cytokines inflammatoires ont augmenté et les cytokines anti-inflammatoires ont diminué dans le sérum. Dans le groupe modèle de RA, les niveaux de sérum des cytokines pro-inflammatoires (TNF-, IFN-, et IL-6) ont sensiblement augmenté(P et lt ; 0,05), tandis que les cytokines anti-inflammatoires (IL-4 et IL-10) ont sensiblement diminué (P lt; 0.05) (figure 3).
Les cellules iNKT obtenues par induction in vivo et la purification in vitro se composaient principalement de sous-ensembles cellulaires iNKT2, qui sécrètent des cytokines anti-inflammatoires. L'injection intrapéritonéale de '-GalCer a augmenté la fréquence des cellules iNKT dans le corps, principalement le sous-groupe iNKT2. La fréquence des cellules iNKT de rate chez les souris Normales de DBA/1 était d'environ 2% des lymphocytes, (iNKT2 était environ 5%, iNKT1 environ 15%, iNKT17 environ 10%). Trois jours après l'injection intrapéritonéale de '-GalCer, la fréquence des cellules iNKT était d'environ 6% des lymphocytes, (iNKT2 était d'environ 82%, iNKT1 environ 1,5%, et iNKT17 environ 0,5%). Après la purification par MACS, la pureté des cellules iNKT était de plus de 85%, dont iNKT2 était d'environ 92%, iNKT1 environ 0,4%, et iNKT17 environ 0,2% (Figure 4).
Les cellules iNKT récoltées sécrétaient plus de cytokines anti-inflammatoires et moins de cytokines inflammatoires. Les cellules d'iNKT ont été isolées des rates des souris normales et intraperitoneally injectées avec le 'GalCer 3 jours après que la rate de souris (groupe de 'GalCer) et les niveaux de cytokine dans le supernatant de culture cellulaire aient été examinés. Comparé au groupe témoin, les cytokines inflammatoires (IL-17A, TNF-MD, IFN-, et IL-6) du groupe de 'GalCer ont sensiblement diminué(P 'lt ; 0.05), et le niveau anti-inflammatoire de cytokine IL-4 a sensiblement augmenté (P lt ; 0.05). Il n'y avait pas de différence significative dans IL-10 (P 'gt; 0.05). Le ratio IFN---IL-4 a considérablement diminué(P et lt; 0,05) (figure 5).
Le traçage d'IVIS a confirmé que les cellules de DiR-iNKT ont été adoptivement infusées dans des souris de RA et sont immédiatement apparues dans les poumons postinjection. La fluorescence a été détectée dans le foie à 10 min et dans la rate à 60 min (Figure 6AI, 6AII, 6AIII). Dans les organes isolés, il n'y avait aucune fluorescence dans le thymus et les ganglions lymphatiques inguinaux dans un délai de 1 h. La fluorescence a été détectée dans les poumons à 0 min, l'intensité de fluorescence était la plus grande à 10 min, puis s'est affaiblie graduellement. Il y avait la fluorescence faible dans le foie à 0 min, et puis il a graduellement augmenté. La fluorescence de la rate a été détectée à 30 min, puis a augmenté progressivement (Figure 6AIV, 6C).
Après l'infusion de cellules DiR-iNKT chez les souris DEr, la fluorescence était principalement concentrée dans le foie et la rate(Figure 6BI, 6BII, 6BIII), mais il n'y avait pas de fluorescence dans le thymus et les ganglions lymphatiques inguinaux. La rate et le foie avaient la plus forte intensité de fluorescence le jour 1 après l'infusion cellulaire, mais elle s'est progressivement affaiblie. Le jour 34, la fluorescence de surface a disparu. Le jour 42, la fluorescence des organes isolés a disparu. L'intensité moyenne du signal de fluorescence du foie après l'infusion cellulaire était supérieure à celle de la rate (Figure 6BIV, 6D).
L'infusion adoptive de cellules iNKT chez les souris de RA peut alléger la progression de la maladie et améliorer les symptômes cliniques. Les cellules d'iNKT ont amélioré les symptômes cliniques des souris de RA après perfusion adoptive. Comparé au groupe modèle non traité de RA, le gonflement de l'articulation de cheville a été soulagé dans le groupe de traitement cellulaire, et les scores ont sensiblement diminué du jour 10 au jour 20 postinjection. Au cours de la même période dans le groupe de traitement cellulaire, l'infiltration de cellules inflammatoires dans le tissu synovial a été réduite par rapport au groupe modèle de PR (figure 2).
Les taux de réussite des cellules thymus iNKT ont augmenté de manière significative(P et lt; 0,05). Par rapport au groupe témoin sain, dans le groupe modèle de RA les taux des cellules d'iNKT dans le thymus ont diminué aux étapes de progression (jour 11), de crête (jour 14), et de rétablissement (jour 20). Au maximum de l'inflammation, ces valeurs étaient minimes et rebondi dans la phase de rémission. Le groupe de thérapie cellulaire a montré des taux sensiblement accrus de cellules iNKT aux étapes de pointe (jour 14) et de récupération (jour 20) par rapport au groupe modèle de RA(P lt; 0,05) (figure 7).
Après l'infusion de cellules iNKT, le taux de réussite d'iNKT1 et d'iNKT17 dans le thymus a diminué et iNKT2 a augmenté. Par rapport au groupe témoin, dans le groupe modèle RA le jour 11 iNKT1 et iNKT17 dans le thymus significativement augmenté (P lt; 0,05), et iNKT2 significativement diminué (P lt; 0,05). Le jour 14, iNKT1 et iNKT2 dans le thymus ont augmenté de manière significative(Plt; 0.05) et iNKT17 sensiblement diminué(P-lt; 0.05). Le jour 20, iNKT1 dans le thymus a augmenté de manière significative(P lt; 0.05), iNKT2 n'a pas changé de manière significative (P 'gt; 0.05), et iNKT17 significativement diminué (P 'lt; 0.05). Le ratio iNKT1/iNKT2 a considérablement augmenté au cours des trois étapes(P et lt; 0,05).
Par rapport au groupe modèle de rathérapie, le jour 11 dans les groupes de thérapie cellulaire et de type , iNKT1 et iNKT17 ont été significativement plus faibles(P et lt; 0,05) et iNKT2 ont considérablement augmenté(P et lt; 0,05). Le jour 14, dans le groupe iNKT1 et iNKT17 de l'iNKT1 et de l'iNKT17, il a considérablement diminué(P et 0,05), et iNKT2 n'a pas beaucoup changé(P -gt; 0,05); dans le groupe de thérapie cellulaire iNKT1 et iNKT17 sensiblement diminué(P lt; 0.05) et iNKT2 sensiblement augmenté (P lt ; 0.05). Le jour 20, dans le groupe de 'GalCer l'iNKT1 a sensiblement diminué (P 'lt; 0.05), iNKT2 n'a pas changé de manière significative (P 'gt; 0.05), et iNKT17 sensiblement augmenté (P 'lt; 0.05); dans le groupe de thérapie cellulaire iNKT1 et iNKT17 sensiblement diminué(P lt; 0.05) et iNKT2 sensiblement augmenté (P lt ; 0.05). Le ratio d'iNKT1/iNKT2 a considérablement diminué au cours des trois étapes(P et lt; 0,05) (Figure 7).
Les niveaux des cytokines inflammatoires ont été augmentés dans le sérum et les cytokines anti-inflammatoires ont été diminués après l'infusion de cellules d'iNKT. Dans le groupe modèle DE RA, les niveaux de sérum de TNF-- , D'IFN-, et d'IL-6in ont sensiblement augmenté (P lt ; 0.05), alors que les IL-4 et IL-10 ont montré des quantités nettement diminuées(P lt; 0.05) par rapport au groupe témoin. Dans le groupe de thérapie cellulaire iNKT, les niveaux de TNF-MD, D'IFN et d'IL-6 dans le sérum ont considérablement diminué aux stades de progression et de pointe de l'inflammation(P et lt; 0,05), tandis que l'IL-4 et l'IL-10 ont considérablement augmenté (P lt; 0,05) par rapport au groupe modèle RA (figure 3).
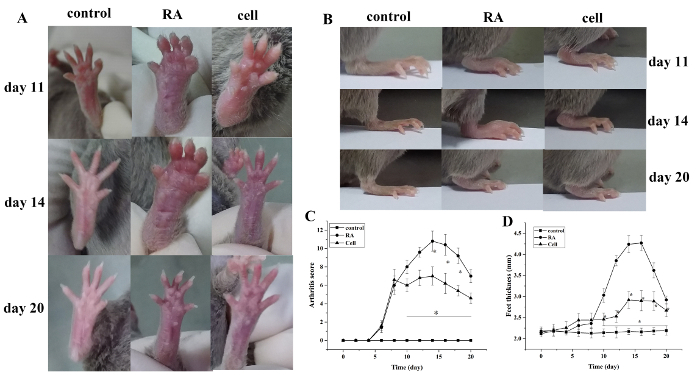
Figure 1 : Le score d'enflure des articulations et l'épaisseur de la patte changent chez les souris. (A) Enflure de l'articulation de la cheville chez la souris. (B,D) Épaisseur de patte dans différents groupes. (C) Changements de score clinique dans différents groupes. Le score d'arthrite de souris et l'épaisseur de la patte ont été sensiblement réduits dans le groupe de thérapie cellulaire les jours 10-20 (c.-à-d., 2-12 jours après traitement) après modélisation. P lt; 0,05 vs contrôle,P 'lt; 0.05 vs RA. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Changements histopathologiques de l'articulation de la cheville. L'infiltration des cellules inflammatoires a été sensiblement réduite dans le groupe de thérapie cellulaire et a été sensiblement augmentée dans le groupe de RA le jour 14. Les cellules inflammatoires. (A) 100x (B) 400x. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Les niveaux de cytokines sériques dans chaque groupe. (A) Niveaux de cytokines de sérum chez les souris le jour 11 après modélisation (pg/mL). (B) Niveaux de cytokines de sérum chez les souris le jour 14 après modélisation (pg/mL). Les niveaux de TNF-MD, d'IFN-MD et d'IL-6 ont diminué de façon significative, et les niveaux d'IL-4 et d'IL-10 ont augmenté de manière significative dans le groupe de thérapie cellulaire. unP et lt; 0,05 vs contrôle. bP et lt; 0,05 vs RA. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Taux de cellules iNKT et proportion de sous-ensembles cellulaires iNKT. (A,B,C) Le taux d'iNKT2 chez les souris normales est de 5 %. (D,E,F) Le taux d'iNKT2 est d'environ 82% après induction in vivo. (G, H, I) Le taux d'iNKT2 est de plus de 92% après la purification MACS. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Niveaux de cytokine dans le supernatant de culture des cellules iNKT de la rate de souris. Le niveau d'IL-4 a sensiblement augmenté, et les niveaux de IL-17A, de TNF-MD, d'IFN-et d'IL-6 ont sensiblement diminué. unP et lt; 0,05 vs contrôle. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Distribution et métabolisme des cellules iNKT tracées par l'étrier IVIS lumina II. (A,B) Chemin de migration des cellules iNKT. (C) Le changement de l'intensité moyenne du signal de fluorescence dans la rate, le foie et le poumon. (D) Le changement de l'intensité moyenne du signal de fluorescence dans la rate et le foie. La fluorescence a été détectée dans les poumons et le foie à 0 min, puis a augmenté progressivement. L'intensité de fluorescence était la plus forte à 10 min dans les poumons, puis a diminué. La fluorescence de la rate a été détectée à 30 min, puis progressivement augmentée. La fluorescence de tous les organes a disparu le jour 42. L'intensité moyenne du signal de fluorescence du foie est plus élevée que la rate après l'infusion cellulaire (I : supine; II: mensonge latéral; III: enclin; IV : tissu isolé; a : groupe témoin; b : groupe d'infusion cellulaire; 1, 2, 3, 4, 5 sont thymus, rate, foie, ganglions lymphatiques inguinaux, poumons). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Les taux d'iNKT et de ses sous-ensembles dans le thymus de souris. (A) Les taux de cellules iNKT à 11, 14 et 20 jours après la modélisation. (B) Le ratio d'iNKT1/iNKT2. (C,D,E) Le taux d'iNKT1, iNKT2 et iNKT17. Les jours 11, 14 et 20 (jours 3, 6 et 12 après thérapie cellulaire), les taux de cellules iNKT ont augmenté de manière significative, l'iNKT1 et l'iNKT17 du thymus ont diminué de manière significative dans le groupe de thérapie cellulaire, et iNKT2 a été sensiblement augmenté. aP 'lt; 0.05 vs Control. bP et lt; 0,05 vs RA. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Les cellules iNKT sont des lymphocytes T spéciaux qui comblent l'immunité innée et adaptative et sont principalement développés à partir de CD4etde thymocytes CD8. Les cellules iNKT ont diverses fonctions immunorégulatrices et interagissent avec d'autres cellules immunitaires par contact direct et sécrétion de différentes cytokines23, affectant les cellules dendritiques (DC), les macrophages, les neutrophiles, les cellules B, les lymphocytes T, et la différenciation et le développement des cellules NK24. -GalCer est un activateur classique iNKT spécifique aux cellules extrait d'éponges. Plusieurs études indiquent que la fréquence des cellules iNKT de la rate atteint un sommet après une seule injection intrapéritonéale de '-GalCer pendant 3 jours25. Nos résultats expérimentaux ont démontré la prédominance du sous-ensemble iNKT2 chez les souris rate pendant 3 jours après une injection intrapéritonéale de '-GalCer, qui sécrète principalement les cytokines anti-inflammatoires IL-4 et IL-10. Nous avons également constaté que l'abondance des cellules iNKT2 a diminué et que celle des cellules iNKT1 et iNKT17 a augmenté chez les souris modèle RA pendant la phase inflammatoire. Par conséquent, nous avons isolé les cellules iNKT de la rate de souris par injection intrapéritonéale de '-GalCer pendant 3 jours. Ceux-ci ont été employés pour traiter les souris de modèle de RA. Le taux du sous-ensemble iNKT2 était de 82% après induction in vivo. Après purification par MACS, le taux d'iNKT2 a dépassé 92%.
L'activation spécifique des cellules iNKT est utilisée comme un nouveau traitement biologique pour la polyarthrite rhumatoïde. Horikoshi et coll.21 ont démontré que l'injection intradermique d'arthrite induite par le peptide par GPI inhibait de façon significative le nombre de lymphocytesT CD4. Chiba et coll.26 ont montré que les injections répétées de l'activateur sélectif synthétique iNKT2 OCH inhibaient la CIA, tandis que le '-GalCer a montré un léger effet inhibiteur. Nous avons injecté l'iNKT dérivé de la rate dans les souris modèles de RA, et les résultats ont prouvé que le degré de gonflement des joints de cheville dans le groupe de thérapie cellulaire et le nombre de cellules inflammatoires infiltrant dans les joints a été réduit. Le niveau de cytokines anti-inflammatoires sériques (p. ex. IL-4 et IL-10) a augmenté, et la sécrétion de cytokines pro-inflammatoires (p. ex. IFN-MD et TNF-MD) a diminué. l'activation ciblée des cellules d'iNKT a pu alléger la progression de LA Etien et inhiber la réponse inflammatoire. En outre, nous avons détecté la fréquence de l'iNKT dans le thymus et avons constaté que le nombre de cellules iNKT dans le groupe modèle de RA a été sensiblement réduit, alors que la fréquence dans le thymus a augmenté après l'infusion des cellules iNKT. En raison de la présence du système de barrière de sang-thymus, nous n'avons pas considéré l'augmentation adoptive infusée du niveau d'iNKT dans le thymus qui a été confirmée dans des expériences postérieures. Une détection plus poussée des sous-populations de cellules iNKT dans le thymus a révélé que, par rapport au groupe témoin sain, le nombre de cellules iNKT1 dans le groupe modèle de RA a augmenté de manière significative pendant les trois étapes de l'inflammation et au maximum pendant le pic de l'inflammation, tandis que la proportion du sous-ensemble iNKT2 a commencé à augmenter au plus haut de l'inflammation. Notamment, le sous-ensemble iNKT1 pourrait être impliqué dans l'inflammation tôt de LA RA, et le sous-ensemble iNKT2 peut jouer un rôle important en inhibant l'inflammation. Comparé au groupe modèle de RA, le sous-ensemble iNKT1 dans le groupe de thérapie cellulaire a sensiblement diminué pendant la phase inflammatoire, et le sous-ensemble d'iNKT2 a sensiblement augmenté dans le stade tôt et de remise de l'inflammation. Ces résultats ont indiqué que l'infusion adoptive de phénotypes spécifiques et de cellules iNKT fonctionnelles augmentait considérablement la fréquence des cellules iNKT dans la PR et modifiait la proportion de sous-ensembles cellulaires iNKT.
Nous avons utilisé IVIS pour observer la distribution des cellules iNKT chez les souris après l'infusion adoptive et avons trouvé l'intensité de fluorescence la plus élevée dans les poumons 10 min après perfusion, qui s'est fanée graduellement. Le foie a montré la fluorescence faible, qui a augmenté graduellement et a diminué graduellement après 2 jours. La fluorescence a été détectée dans la rate à 30 min, qui a augmenté graduellement et a diminué après 2 jours. L'intensité moyenne de fluorescence du foie était plus forte que celle de la rate. Cependant, aucune fluorescence n'a été détectée dans le thymus et les ganglions lymphatiques inguinaux. La détection de la fluorescence dans les poumons pourrait être attribuée à l'infusion de cellules iNKT dans la veine de la queue. Ces cellules sont distribuées aux poumons avec le sang. Les fluoresces hépatiques plus tôt que la rate, et l'intensité moyenne de fluorescence du foie est plus forte que celle de la rate. Cette accumulation préférentielle des cellules iNKT peut être due aux vaisseaux sanguins abondants dans le foie, le principal organe métabolique. La fluorescence n'a pas été détectée dans le thymus. Cela pourrait être dû à la barrière hématologique, qui pourrait entraver l'entrée des cellules iNKT. La fluorescence n'a jamais été détectée dans les ganglions lymphatiques inguinaux, peut-être parce que moins de cellules iNKT sont entrées dans les ganglions lymphatiques et n'ont pas atteint le niveau minimum de détection. En outre, on pourrait supposer que les cellules iNKT infusées dans la veine de queue pourraient ne pas entrer dans les ganglions lymphatiques. Par conséquent, nous émettons l'hypothèse que le développement et la différenciation des cellules d'iNKT dans le thymus pourraient être réglés par des voies de cytokine après infusion adoptive dans les souris. Cela doit être encore élucidé.
GPI est présent dans le sérique et le liquide synovial de la plupart des patients de RA et est un essai couramment employé pour le diagnostic clinique de RA27. Bruns et coll.28 ont utilisé des peptides de différentes longueurs de la séquence de GPI et ont immunisé les souris DBA/1 pour identifier six épitopes immunodominants de cellules T. De ce nombre, trois étaient arthritogéniques. Les peptides avec l'incidence de l'arthrite sont hGPI 325-339 et hGPI469-483. Nos études précédentes ont démontré que l'utilisation d'un mélange des deux peptides pour établir un modèle de RA est meilleure qu'un seul peptide. Dans les modèles de RA résultants, les orteils et les articulations des souris ont commencé à apparaître rouge le jour 6 et ont atteint un pic d'inflammation le jour 14. L'infiltration inflammatoire de cellules a été accompagnée de l'hyperplasie de tissu dans le tissu synovial des joints, et l'infiltration inflammatoire de cellules était la plus grave au jour 14. Le nombre de cellules iNKT a été diminué de manière significative dans le thymus au plus fort de l'inflammation, ce qui était compatible avec la tendance des cellules iNKT chez les patients atteints de PR29. La détection plus poussée des sous-ensembles de cellules d'iNKT a indiqué que la fréquence d'iNKT1 et d'iNKT17 dans le thymus a augmenté et la fréquence de iNKT2 a diminué pendant la progression de l'inflammation (jour 11). En outre, les niveaux de cytokines sériques IFN-et IL-17A ont augmenté au cours de la progression (jour 11) et le pic de l'inflammation (jour 14), suggérant une polarisation similaire des sous-groupes Th1 et Th17 chez les souris modèle RA30. Par conséquent, le modèle de souris de RA induit par hGPI325-339 et hGPI469-483 fragments mélangés de polypeptide a montré les caractéristiques de CD4- hyperprolifération de cellule T et défauts de cellules d'iNKT, qui était semblable à cela des patients de RA, et pourrait être employé comme modèle animal idéal pour étudier l'immunité des cellules de RA. Ces résultats étaient en accord avec ceux de nos études précédentes et démontraient la stabilité du modèle31de RA induit par les HGPI.
En général, le modèle de souris RA induit par les peptides mixtes G6PI peut simuler les changements dans les cellules CD4T, les cellules iNKT, et les cytokines connexes chez les patients atteints de POLY. Ceci fournit un bon modèle pour l'étude en profondeur de RA. Consécutivement, iNKT (principalement iNKT2) induit par injection intrapéritonéale de '-GalCer et purifié in vitro a été utilisé dans le traitement de la polyarthrite rhumatoïde. Il peut corriger le déséquilibre immunitaire causé par la prolifération anormale des sous-ensembles de Th, soulager la progression de la PR, et à l'avenir peut fournir de nouvelles méthodes pour le traitement clinique de la polyarthrite rhumatoïde.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs ne déclarent aucun financement ou conflit d'intérêts.
Acknowledgments
Notre étude a été soutenue par la National Natural Science Foundation of China (NSFC) (81771755), les collèges et le projet de recherche scientifique et technologique de la province du Hebei (ZD2017009) et le Animal Lab of Medical Experiment Center de l'Université Hebei. Nous leur sommes reconnaissants de leur soutien.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



