Summary
该协议使用G6PI混合肽构建类风湿关节炎模型,更接近CD4+T细胞和细胞因子中的人类类风湿性关节炎模型。高纯度不变天然杀伤性T细胞(主要是iNKT2),具有特定的表型和功能,通过体内诱导和体外纯化获得,用于采用免疫治疗。
Abstract
风湿性关节炎(RA)是一种复杂的慢性炎症性自身免疫性疾病。这种疾病的发病机制与不变的自然杀手T(iNKT)细胞有关。活性RA的患者存在较少的iNKT细胞,有缺陷的细胞功能,和Th1的极化过度。在这项研究中,使用hGPI325-339和hGPI469-483肽的混合物建立了RA动物模型。iNKT细胞通过体内诱导和体外纯化获得,然后输入RA小鼠进行采用免疫治疗。体内成像系统(IVIS)跟踪显示,iNKT细胞主要分布在脾脏和肝脏中。细胞治疗后的第12天,病情进展明显减缓,临床症状得到缓解,胸腺中iNKT细胞的丰度增加,胸腺中iNKT1的比例下降,TNF-α、IFN-α和IL-6水平下降。血清减少。iNKT细胞的接受免疫疗法恢复了免疫细胞的平衡,纠正了身体的过度炎症。
Introduction
风湿性关节炎(RA)是一种自身免疫性疾病,其特征是慢性、渐进性侵入性,发病率为0.5-1%,发病率为1,2。潜在的发病机制归因于自动反应CD4+和CD8+T细胞的异常增殖,表现为CD4+IFN++和CD4+IL-17A+T细胞比例增加,CD4+IL-4+CD4+CD4+CD25+FoxP3+T细胞比例增加。 因此,炎症细胞因子的分泌增加,过度的炎症反应破坏人体免疫系统的本生平衡和耐受功能。此外,穿透关节的助剂T淋巴细胞(Th)1细胞会加重炎症反应和关节损伤。因此,抑制过度的炎症反应和恢复免疫耐受性和免疫平衡是治疗RA3,4的关键。
iNKT细胞同时具有NK细胞和T细胞的功能和特性。iNKT细胞具有独特的、不变的T细胞受体(TCR)+链,具有有限的TCR+链表5,并识别抗原呈现细胞表面的主要组织相容性复合物(MHC)I类分子CD1d呈现的糖脂抗原。三三等人6日检测出大量iNKT细胞和功能缺陷,包括RA在内的许多自身免疫性疾病。Aurore等人7表明,iNKT细胞对维持自身免疫耐受性有积极作用,当iNKT细胞的数量和功能恢复时,疾病得到缓解。此外,Miellot-Gafsou等人8日发现,iNKT细胞不仅可使疾病发生,而且增加了疾病的进展。这些相互矛盾的结果表明,iNKT细胞是异质T细胞,不同子集的功能可能逆转。在RA的临床研究中,iNKT细胞的频率与疾病活性9的分数相关。结果还证实,在RA患者中,iNKT的频率降低,CD4+IFN-α+T细胞子集数量增加,炎症细胞因子IFN-α和TNF-α的分泌水平增加10,11。此外,Sharif等人12日调查了1型糖尿病(T1D),发现INKT细胞的选择性输注能调节炎症细胞因子IL-4的表达,保持免疫耐受性,并防止1型糖尿病的发展。因此,采用特定iNKT细胞的输注或针对iNKT细胞的活化可增加RA患者的iNKT细胞水平,这在RA治疗中是一个突破。
细胞免疫疗法目前备受关注,已广泛应用于癌症治疗。然而,iNKT细胞是罕见的,异质免疫调节细胞(只占PBMC总数的0.3%)13,这限制了潜在的临床应用。这些细胞主要分为三个亚群:1)iNKT1细胞,具有高表达的原发性白血病锌指蛋白(PLZF)和T-盒转录因子(T-bet);2) 具有PLZF和GATA结合蛋白3(GATA3)中间表达的iNKT2细胞;3)iNKT17细胞,具有PLZF和视网膜相关孤立核受体(ROR)的低表达,即分泌IFN-*、IL-4和IL-17 14。激活的iNKT细胞分泌Th1、Th2和Th17样细胞因子,这些细胞因子决定了iNKT细胞15的不同免疫调节作用。iNKT细胞各亚群特异性活化的免疫调节和免疫治疗效果不同。因此,选择具有抗炎功能的iNKT细胞(主要是iNKT2)的特定表型,以调节人体的免疫反应,可以纠正RA的免疫不平衡和免疫障碍。
建立理想的动物模型对RA发病机制的治疗和研究具有重要意义。目前,最常用的和成熟的动物模型包括胶原蛋白引起的关节炎,辅助性关节炎,酶性关节炎,和多糖引起的关节炎16-17。然而,没有一个模型可以完全模拟人类RA的所有特征。II型胶原蛋白诱发关节炎(CIA)是一种经典的关节炎模型。CIA是通过对II型胶原蛋白特异性单克隆抗体的小鼠进行免疫接种,反映该疾病模型的抗体依赖性。Benurs等人描述了一个对葡萄糖-6-磷酸异构酶(G6PI)有全身免疫反应的模型,该模型在易感小鼠菌株18、19中诱导外周对称多关节炎。在这个模型中,关节炎的发展依赖于T细胞、B细胞和先天免疫18、19、20。Horikoshi21发现,在 CD4+ T 细胞和细胞因子(即 IL-6 和 TNF-α)方面,通过免疫 DBA/1 小鼠的 G6PI 多肽片段产生的 RA 模型比 CIA 模型更类似于人类 RA。为了增加对TCR识别部位的刺激作用,利用G6PI(hGPI325-339和hGPI469-483)的混合多肽片段对DBA/1小鼠进行免疫,以构建RA小鼠模型。这种方法的成功率可以很高,因为hGPI325-339和hGPI469-483是I-A q受限T细胞反应的免疫主导。因此,该模型可以模拟RA患者22的CD4+T细胞和iNKT细胞缺陷的增殖。RA免疫病理学的基础研究为我国进一步深入研究奠定了基础。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
所有实验小鼠(共150只)为健康的雄性DBA/1小鼠,6~8周大(20.0~1.5克),在特定的无病原体(SPF)环境中饲养。建模前没有特殊处理。实验分为健康对照组(15只小鼠)、模型对照组(15只小鼠)和细胞治疗组(55只小鼠)。这项研究得到了河北大学动物福利伦理委员会的批准。
1. 构建疾病模型
- 复制 RA 动物模型
- 重量为1.75毫克的hG6PI 325-339和hG6PI 469-483碎片,并将其溶解在5.25 mL的4°C三蒸馏水中。
- 将完整的Freund的佐剂(CFA)溶解在50°C的水浴中,将5.25 mL抽到另一根10mL的离心管中,并冷却使用。
- 将hG6PI溶液和CFA溶液的混合物放入人工乳化单元中,连接两个玻璃注射器。
- 以每分钟10~20倍的恒定速度和频率推动注射器,完全乳化混合肽溶液和CFA溶液。在冰浴中执行操作,在乳化完成后将乳液滴在水中保持 10 分钟,而不会分散。
- 将150 μL乳化hG6PIs注射到小鼠的尾部根皮下。
- 在hG6PI注射后0小时和48小时后,将200毫克百日霉毒素注射到小鼠体内。
- RA模型的实验验证
- 使用 Vernier 卡钳(每天 2 次)测量鼠标爪子的厚度。
- 观察并标记足部发红和肿胀的程度。使用以下评分标准:1)脚趾轻微肿胀;2) 带明显红色肿胀的多苏木和脚垫;3)脚踝有红色肿胀。
- 在模拟14天后,通过1%五巴比妥钠钠(50毫克/千克体重)的腹内注射,在深度麻醉下给小鼠安乐死,并去除用于HE染色的爪子。
- 根据制造商的协议,使用商业细胞学珠阵列(CBA)测定,使用商用细胞学珠阵列(CBA)测定确定血清IL-2、IL-4、IL-6、IL-10、IL-10、IL-17A、TNF-α和IFN-α的分泌水平。
2. 通过采用细胞疗法获得iNKT细胞
- iNKT细胞的定向诱导
- 用β-GalCer(0.1毫克/千克的体重)在腹内注射正常小鼠。
- iNKT细胞的隔离
- 建模三天后,用1%的五巴比妥钠(50毫克/千克体重)注射小鼠进行麻醉。充分麻醉的小鼠不会表现出对脚趾捏合的后爪戒断反应。
- 用β-GalCer注射后,分离DBA/1小鼠的脾脏。通过在200个网状筛中切割和研磨脾脏,准备单细胞悬浮液。
- 用PBS清洗细胞悬浮液,在200 x g下离心5分钟,然后丢弃上清液。重复。
- 用1 mL的全血和组织稀释溶液重新悬浮细胞。加入3 mL小鼠淋巴细胞分离培养基,然后在室温下以300 x g将细胞离心20分钟。
- 收集乳白色淋巴细胞的层(即,从顶部的第二层),用PBS洗涤2x,用自动细胞计数器计数。
- 用于 iNKT 细胞纯化的磁性活细胞分拣 (MACS) 正选择策略
注:对于CD1d四聚体的预处理,将1mg/mL的β-Galcer稀释至200μg/mL,加入0.5%的Tween-20和0.9%的NaCl,并将5μL的所得溶液添加到CD1d四聚体溶液的100μL中。该混合物在室温下孵育12小时,置于4°C下使用。TCR = 用去离子水稀释80倍。所有其他抗体都被用作库存溶液。- 用100μL的4°C PBS重新悬浮107个细胞,加入10μL的β-GalCer加载CD1d四聚体PE,并在4°C下孵育它们15分钟。
- 用PBS清洗细胞2倍,并在80μL的PBS中重新悬浮。
- 加入20μL的抗PE微珠,在黑暗中在4°C下孵育20分钟。
- 用PBS清洗2次,用500μL的PBS重新悬浮细胞。
- 将分拣柱置于 MACS 分拣机的磁场中,然后用 500 μL 的 PBS 冲洗。
- 将步骤 2.3.4 中的细胞悬浮液添加到分拣列中,收集流水,然后用 PBS 缓冲液冲洗 3x。
- 移除磁场并从排序列中收集单元格。此时,向分拣柱添加 1 mL 的 PBS 缓冲液,并在恒定压力下快速推动柱塞,将标记的细胞驱动到收集管,并获得纯化的 iNKT 细胞。使用自动细胞计数器计数。
- iNKT细胞表型的识别
- 分别从步骤2.2.5和2.3.7中取取1 x 106个细胞,并在50μL的PBS中重新悬浮。
- 抗体孵育:请勿将抗体添加到阴性控制管中,在单阳性控制管中加入0.5μL的β-GalCer-PE-CD1d四联体或10μL的FITC-TCR+。在样品管中加入0.5μL的β-GalCer-PE-CD1d四聚体和10μL的FITC-TCR+。在黑暗中在4°C下孵育30分钟。
- 在PBS中清洗细胞,然后在200 x g下离心5分钟。
- 丢弃上清液,加入1mL的Foxp3Foxation/渗透工作溶液,在黑暗中4°C下孵育细胞45分钟。
- 加入1mL的1x渗透缓冲液工作溶液,在室温下将细胞在室温下离心500 x g,5分钟。
- 丢弃上清液。在黑暗中室温下,加入 1 μL 的 Alexa Fluor 647 鼠标抗 PLZF 和 1 μL PerCP-Cy 5.5 鼠标抗 T-bet(或 1 μL 的 PerCP-Cy 5.5 鼠标抗 ROR_t),30 分钟。
- 将渗透缓冲液的渗透液添加到 2 mL,用于清洁。
- 丢弃上清液,将细胞重新悬浮在 500 μL 的 PBS 中,然后通过流式细胞测定进行测量。
- iNKT细胞的功能识别
- 从步骤2.3.7中取取3 x 106 iNKT细胞,并将其重新悬浮在12个孔板中,其转速为1.5 mL的RPMI-1640不完全培养基(即,不含血清)。
- 加入phorester(PMA,50纳克/mL)和碘霉素钙(IO,1微克/mL),并放入CO2培养箱24小时。
- 根据制造商的协议,使用商用CBA测定法收集细胞上清液,检测IL-2、IL-17A、TNF-α、IL-6、IL-4、IFN-α和IL-10的分泌水平。
- RA小鼠iNKT细胞迁移途径的实验研究
- 在 DMSO 中溶解二R染料(2.5 mg/mL)。
- 用RPMI-1640不完全培养基在6个孔板中重新悬浮iNKT细胞。密度为1 × 106细胞/mL。
- 加入DiR(5μg/mL)溶液,在CO2培养箱中孵育25分钟。
- 用PBS清洗并重新悬浮细胞(3 x 106/300 μL),以获得标有DiR标记的iNKT细胞(DiR-iNKT)。
- 注射1%的五巴比妥钠(50毫克/千克体重)内腹,给小鼠麻醉。充分麻醉的小鼠不会显示后爪退出脚趾捏。在麻醉下对小鼠眼睛应用兽医药膏,以防止干燥进行成像。
- 将 DiR-iNKT 细胞 3 x 106每只小鼠注入尾静脉与 RA 模型 8 天。使用小型动物体内成像系统(IVIS)监测小鼠注射后0分钟、10分钟、30分钟、60分钟和0天(3小时后)、1、3、6、12、26、34、38和42天的iNKT细胞。使用的激发波长为748nm,发射波长为780nm,暴露时间是自动的。
- 每次观察后,将每只小鼠放在一个单独的笼子中,并保持胸腔。观察,直到麻醉恢复。
3. 用iNKT细胞对RA小鼠的采用免疫治疗的评价
- RA小鼠的iNKT细胞采用免疫疗法
- 通过尾静脉注入3 x 106个细胞iNKT细胞。随机选择15只在8天前进行建模的小鼠,通过尾静脉输液从步骤2.3.7获得不含DiR标记的iNKT细胞。
- 评估采用免疫疗法对iNKT细胞的疗效。
- 测量小鼠爪子的厚度,量化踝关节肿胀,并在iNKT细胞注入后系统地评分,如步骤1.2.1~1.2.2所述。
- 如步骤 1.2.3 所述,观察小鼠关节的炎症细胞渗透和关节变化。
- 如步骤 1.2.4 所述,确定 IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α 和 IFN-*的分泌水平。
- 确定 iNKT 细胞和子集的频率。
- 分离小鼠胸腺并准备单个细胞悬浮液。
- 用淋巴细胞分离液分离淋巴细胞。
- 确定步骤 2.4 中描述的 iNKT 单元频率和子组频率。
- 统计分析
注:所有数据均值为平均值 = SD。P < 0.05 的值被视为具有统计显著性。- 使用方差的单因子分析 (ANOVA)。如果满足方差,请使用 LSD 测试进行进一步比较。
- 如果方差不均匀,请使用非参数检验。使用克鲁斯卡尔-瓦利斯H测试进一步比较31。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
关节指数得分和爪子厚度增加建模后。与对照组相比,RA模型组在建模后6天开始出现红色肿胀,逐渐加重。在14天,脚踝关节的红色肿胀达到顶峰,随后逐渐缓解。爪子的厚度变化类似(P < 0.05) (图 1)。
炎症细胞渗透在建模后显著增加。病理结果表明,RA模型小鼠脚踝间阴膜组织炎症细胞的渗透程度不同。高峰炎症发生在第14天后建模(图2)。
炎症细胞因子增加,抗炎细胞因子在血清中减少。在RA模型组中,亲炎细胞因子(TNF-α、IFN-α和IL-6)的血清水平显著增加(P <0.05),而抗炎细胞因子(IL-4和IL-10)显著下降(P <0.05)(图3)。
通过体内诱导和体外纯化获得的iNKT细胞主要由iNKT2细胞子集组成,这些细胞子集分泌抗炎细胞因子。β-GalCer的腹内注射增加了体内iNKT细胞的频率,主要是iNKT2亚群。正常DBA/1小鼠脾脏iNKT细胞的频率约为淋巴细胞的2%,(iNKT2约为5%,iNKT1约15%,iNKT17约10%)。在β-GalCer的腹内注射三天后,iNKT细胞的频率约为淋巴细胞的6%(iNKT2约为82%,iNKT1约为1.5%,iNKT17约为0.5%)。MACS纯化后,iNKT细胞纯度超过85%,其中iNKT2纯度约为92%,iNKT1为0.4%,iNKT17为0.2%左右(图4)。
收获的iNKT细胞分泌更多的抗炎细胞因子和更少的炎症细胞因子。iNKT细胞从正常小鼠的脾脏中分离出来,在小鼠脾脏(β-GalCer组)和细胞培养上清液中的细胞因子水平检查后3天注射β-GalCer。与对照组相比,β-GalCer组的炎症细胞因子(IL-17A、TNF-α、IFN-α和IL-6)显著减少(P <0.05),抗炎细胞因子IL-4水平显著增加(P0.05)。IL-10(P > 0.05) 无显著差异。IFN-+/IL-4比率显著下降(P < 0.05) (图5)。
IVIS追踪证实DiR-iNKT细胞被采用注入RA小鼠,并立即出现在肺部注射后。10分钟在肝脏中检测到荧光,在60分钟时在脾脏中检测到荧光(图6AI、6AII、6AIII)。在分离的器官中,胸腺和淋巴结在1小时内无荧光,在0分钟内在肺部检测到荧光,荧光强度在10分钟内最大,然后逐渐减弱。0分钟时肝脏荧光较弱,然后逐渐增加。在30分钟内检测到脾中的荧光,然后逐渐增加(图6AIV,6C)。
在将DiR-iNKT细胞注入RA小鼠后,荧光主要集中在肝脾(图6BI、6BII、6BIII),但胸腺和淋巴结无荧光。在细胞输注后的第1天,脾脏和肝脏的荧光强度最高,但逐渐减弱。第34天,表面荧光消失了。第42天,分离的器官的荧光消失了。细胞输注后肝脏的平均荧光信号强度高于脾脏(图6BIV,6D)。
将iNKT细胞的接受注入到RA小鼠中可以缓解疾病进展,改善临床症状。iNKT细胞在采用输注后改善了RA小鼠的临床症状。与未经治疗的RA模型组相比,细胞治疗组脚踝关节肿胀得到缓解,从注射后的第10天到第20天得分明显下降。在细胞治疗组的同一时期,与RA模型组相比,阴膜组织中的炎症细胞渗透减少(图2)。
胸腺 iNKT 细胞的成功率显著增加(P < 0.05)。与健康对照组相比,在RA模型组中,胸腺中的iNKT细胞在进展(第11天)、峰值(第14天)和恢复(第20天)阶段降低。在炎症高峰期,这些值是最小的,并在缓解阶段反弹。与RA模型组(P <0.05)相比,细胞治疗组在高峰期(第14天)和恢复(第20天)阶段表现出显著的iNKT细胞率(图7)。
iNKT细胞输注后,胸腺中iNKT1和iNKT17的成功率下降,iNKT2增加。与对照组相比,在RA模型组第11天iNKT1和iNKT17在胸腺显著增加(P <0.05),和iNKT2显著下降(P <0.05)。第14天,胸腺中的iNKT1和iNKT2显著增加(P<0.05)和iNKT17显著下降(P<0.05)。第20天,胸腺中的iNKT1显著增加(P <0.05),iNKT2没有显著变化(P > 0.05),iNKT17显著下降(P <0.05)。iNKT1/iNKT2 比率在所有三个阶段(P < 0.05)均显著上升。
与RA模型组相比,在β-GalCer和细胞治疗组的第11天,iNKT1和iNKT17显著较低(P <0.05)和iNKT2显著增加(P<0.05)。第14天,在 +-GalCer 组 iNKT1 和 iNKT17 显著减少(P < 0.05),和 iNKT2 没有显著变化(P > 0.05);在细胞治疗组 iNKT1 和 iNKT17 显著减少(P < 0.05) 和 iNKT2 显著增加(P < 0.05)。第20天,在 +-GalCer 组中,iNKT1 显著减少(P < 0.05),iNKT2 没有显著变化(P > 0.05),iNKT17 显著增加(P < 0.05);在细胞治疗组 iNKT1 和 iNKT17 显著减少(P < 0.05) 和 iNKT2 显著增加(P < 0.05)。iNKT1/iNKT2在所有三个阶段(P < 0.05)中的比例显著下降(图7)。
iNKT细胞输注后,血清中炎症细胞因子水平增加,抗炎细胞因子降低。在RA模型组中,TNF-α、IFN-α和IL-6in血清水平显著增加(P<0.05),而IL-4和IL-10与对照组相比,其含量显著下降(P <0.05)。在iNKT细胞治疗组中,与RA模型组相比,血清中的TNF-α、IFN-α和IL-6水平在炎症的推进和高峰期(P<0.05)显著下降,而IL-4和IL-10显著增加(P<0.05)。
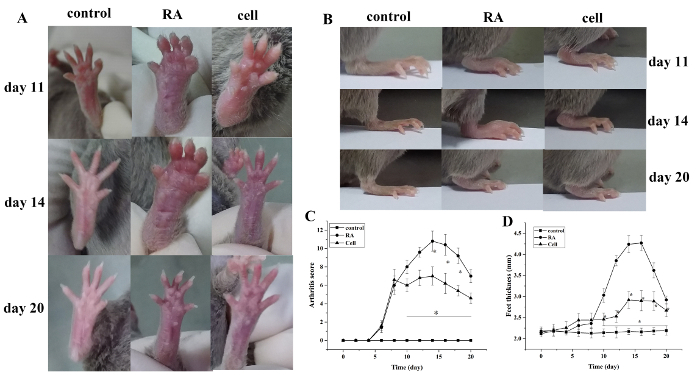
图1:小鼠关节肿胀评分和爪厚变化。(A) 小鼠的踝关节肿胀.(B,D)不同组中的爪子厚度。(C) 不同组的临床分数变化。小鼠关节炎评分和爪子厚度在建模后的第10-20天(即治疗后2-12天)的细胞治疗组显著减少。•P < 0.05 vs. 控制, •P < 0.05 vs. RA.请点击此处查看此图的较大版本。

图2:踝关节的病理变化。炎症细胞在细胞治疗组中的渗透显著减少,并在第14天RA组显著增加。[ ] 炎症细胞。(A) 100x (B) 400x.请点击此处查看此图的较大版本。

图3:每组血清细胞因子水平。(A) 在建模后第11天小鼠的血清细胞因子水平(pg/mL)。(B) 在建模后第14天小鼠的血清细胞因子水平(pg/mL)。TNF-α、IFN-α和IL-6水平显著下降,细胞治疗组中IL-4和IL-10水平显著增加。aP < 0.05 与控件。bP < 0.05 vs. RA.请点击此处查看此图的较大版本。

图4:iNKT细胞的速率和iNKT细胞子集的比例。(A,B,C)正常小鼠的iNKT2率为+5%。(D,E,F)在体内诱导后,iNKT2的发生率约为82%。(G, H, I)MACS纯化后,iNKT2的速率超过92%。请点击此处查看此图的较大版本。

图5:小鼠脾脏衍生iNKT细胞培养上清液中的细胞因子水平。IL-4水平显著增加,IL-17A、TNF-α、IFN-α和IL-6水平显著下降。aP < 0.05 与控件。请点击此处查看此图的较大版本。

图6:由卡钳IVIS亮度二追踪的iNKT细胞的分布和代谢。(A,B)iNKT 单元的迁移路径。(C) 脾脏、肝脏和肺的平均荧光信号强度的变化。(D) 脾肝平均荧光信号强度的变化.在0分钟内在肺和肝脏中检测到荧光,然后逐渐增加。在10分钟内,肺部的荧光强度最强,然后下降。在30分钟内检测到脾的荧光,然后逐渐增加。所有器官的荧光在第42天消失。细胞输液后肝脏的平均荧光信号强度高于脾脏(I:苏巴;二:横向撒谎;三:易发;四:孤立组织;a:控制组;b:细胞输注组;1、2、3、4、5是胸腺、脾脏、肝脏、淋巴结、肺)。请点击此处查看此图的较大版本。

图7:在小鼠胸腺中iNKT及其子集的速率。(A) 建模后 11、14 和 20 天的 iNKT 细胞的速率。(B) iNKT1/iNKT2的比例。(C,D,E)iNKT1、iNKT2 和 iNKT17 的速率。在第11天、第14天和第20天(细胞治疗后的第3天、第6天和第12天),iNKT细胞的速率显著增加,细胞治疗组中胸腺的iNKT1和iNKT17显著减少,iNKT2显著增加。aP < 0.05 vs 控制。bP < 0.05 vs RA。请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT细胞是特殊的T细胞,桥接先天和适应性免疫,主要从CD4+/CD8+ 胸腺细胞开发。iNKT细胞具有不同的免疫调节功能,通过直接接触和分泌不同细胞因子23与其他免疫细胞相互作用,影响树突细胞(DC)、巨噬细胞、嗜中性粒细胞、B细胞、T细胞和NK细胞分化和发育2 4。β-GalCer是从海绵中提取的经典iNKT细胞特异性活化剂。几项研究表明,脾脏iNKT细胞频率达到峰值后,一次腹内注射β-GalCer3天25。我们的实验结果表明,iNKT2子集在小鼠脾脏中占优势3天,在β-GalCer的腹内注射后,主要分泌抗炎细胞因子IL-4和IL-10。我们还发现,在炎症阶段,RA模型小鼠的iNKT2细胞的丰度减小,iNKT1和iNKT17细胞的丰度增加。因此,我们通过β-GalCer的腹内注射分离小鼠脾脏的iNKT细胞3天。这些用于治疗RA模型小鼠。在体内诱导后,iNKT2子集的发生率为82%。MACS纯化后,iNKT2的速率超过92%。
iNKT细胞的具体活化用于RA的新型生物处理。Horikoshi等人21日证明,在皮内注射β-GalCer通过显著抑制CD4+T细胞的数量抑制GPI肽诱发的关节炎。千叶等人26日显示,反复注射合成iNKT2选择性活化剂OCH抑制CIA,而β-GalCer则表现出轻微的抑制作用。我们将脾源的iNKT注射到RA模型小鼠中,结果表明细胞治疗组脚踝关节肿胀程度和渗入关节的炎症细胞数量减少。血清抗炎细胞因子(如IL-4和IL-10)水平增加,亲炎细胞因子(如IFN-α和TNF-α)的分泌减少。iNKT细胞的靶向激活能够缓解RA的进展并抑制炎症反应。此外,我们检测了胸腺中iNKT的频率,发现RA模型组中的iNKT细胞数量显著减少,而在iNKT细胞注入后胸腺中的频率增加。由于血胸腺屏障系统的存在,我们没有考虑到胸腺中iNKT水平的采用性增加,在后来的实验中得到了证实。进一步检测胸腺中iNKT细胞的亚群后发现,与健康对照组相比,RA模型组中的iNKT1细胞数量在炎症的三个阶段和炎症高峰期明显增加,而iNKT2子集的比例在炎症高峰期开始增加。值得注意的是,iNKT1子集可能参与RA的早期炎症,iNKT2子集可能在抑制炎症方面发挥重要作用。与RA模型组相比,细胞治疗组中的iNKT1子集在炎症阶段显著减少,在炎症早期和缓解阶段,iNKT2子集明显增加。这些结果表明,特定表型和功能iNKT细胞的采用注入显著增加了RA中iNKT细胞的频率,并改变了iNKT细胞子集的比例。
我们使用IVIS观察了采用输注后小鼠的iNKT细胞分布情况,并在输注后10分钟发现肺部荧光强度最高,逐渐消退。肝脏荧光较弱,2天后逐渐增加,逐渐减少。在30分钟内在脾脏中检测到荧光,2天后逐渐增加和减少。肝脏的平均荧光强度强于脾脏。然而,在胸腺和淋巴结中未检测到荧光。肺部荧光的检测可能归因于iNKT细胞注入尾静脉。这些细胞与血液一起循环到肺部。肝荧光比脾脏早,肝脏平均荧光强度强于脾脏。iNKT细胞的这种优先积累可能是由于肝脏,主要代谢器官的丰富血管。胸腺中未检测到荧光。这可能是由于血液屏障,这可能阻碍iNKT细胞的进入。荧光从未在淋巴结中检测到,也许是因为进入淋巴结的iNKT细胞较少,没有达到最低检测水平。此外,可以推测,注入尾静脉的iNKT细胞可能不会进入淋巴结。因此,我们假设在采用输注到小鼠体内后,胸腺中iNKT细胞的发育和分化可以通过细胞因子途径进行调节。这需要进一步阐明。
GPI存在于大多数RA患者的血清和血清液中,是临床RA诊断27常用的测试。Bruns等人28使用与GPI序列不同长度的肽,给DBA/1小鼠接种,以识别6个免疫主导性T细胞表位。其中3种是动脉原。关节炎发病率>95%的肽为hGPI 325-339和hGPI469-483。我们先前的研究表明,使用两种肽的混合物建立RA模型比单个肽更好。在生成的RA模型中,小鼠的脚趾和关节在第6天开始出现红色,并在第14天达到炎症的高峰。炎症细胞渗透伴有关节的阴膜组织组织增生,炎症细胞渗透在第14天最为严重。在炎症高峰时,胸腺中的iNKT细胞数量明显减少,这与RA患者29的iNKT细胞趋势一致。对iNKT细胞子集的进一步检测表明,在炎症进展期间(第11天),胸腺中iNKT1和iNKT17的频率增加,iNKT2频率下降。此外,血清细胞因子IFN-α和IL-17A的水平在进展(第11天)和炎症高峰(第14天)期间增加,表明RA模型小鼠30中的Th1和Th17子群有类似的极化。因此,由hGPI325-339和hGPI469-483混合多肽片段诱导的RA小鼠模型表现出CD4+T细胞增殖和iNKT细胞缺陷的特性,与RA患者相似,可作为研究RA细胞免疫的理想动物模型。这些结果与我们先前研究的结果一致,并证明了hGPIs诱导RA模型31的稳定性。
一般来说,混合G6PI肽诱导的RA小鼠模型可以模拟RA患者CD4+T细胞、iNKT细胞和相关细胞因子的变化。这为对RA的深入研究提供了很好的模型。连续,iNKT(主要是iNKT2)诱导的β-GalCer的腹内注射和在体外纯化的用于治疗RA。它可以纠正由异常增殖引起的免疫不平衡,缓解RA的进展,为今后RA的临床治疗提供新的方法。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
提交人宣布没有资金或利益冲突。
Acknowledgments
本研究得到国家自然科学基金(国家自然科学基金)(81771755)、河北省高校科技重点研究项目(ZD2017009)和河北大学医学实验中心动物实验室的支持。我们感谢他们的支持。
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



