Summary
Dieses Protokoll verwendet G6PI gemischte Peptide, um rheumatoide Arthritis-Modelle zu konstruieren, die näher an denen der menschlichen rheumatoiden Arthritis in CD4+ T-Zellen und Zytokinen sind. Hochreine invariante natürliche Killer-T-Zellen (hauptsächlich iNKT2) mit spezifischen Phänotypen und Funktionen wurden durch In-vivo-Induktion und In-vitro-Reinigung zur Adoptivimmuntherapie erhalten.
Abstract
Rheumatoide Arthritis (RA) ist eine komplexe chronisch entzündliche Autoimmunerkrankung. Die Pathogenese der Krankheit ist mit invarianten natürlichen Killer-T-Zellen (iNKT) verwandt. Patienten mit aktiver RA präsentieren weniger iNKT-Zellen, defekte Zellfunktion und übermäßige Polarisation von Th1. In dieser Studie wurde ein RA-Tiermodell mit einer Mischung aus hGPI325-339 und hGPI469-483 Peptiden erstellt. Die iNKT-Zellen wurden durch In-vivo-Induktion und In-vitro-Reinigung gewonnen, gefolgt von einer Infusion in RA-Mäuse für die Adoptivimmuntherapie. Das In-vivo-Bildgebungssystem (IVIS)-Tracking ergab, dass iNKT-Zellen hauptsächlich in Milz und Leber verteilt waren. Am 12. Tag nach der Zelltherapie verlangsamte sich die Krankheitsprogression signifikant, die klinischen Symptome wurden gelindert, die Häufigkeit von iNKT-Zellen im Thymus nahm zu, der Anteil von iNKT1 im Thymus nahm ab, und die Konzentrationen von TNF-, IFN-, und IL-6 in das Serum verringerte sich. Die Adoptivimmuntherapie von iNKT-Zellen stellte das Gleichgewicht der Immunzellen wieder her und korrigierte die übermäßige Entzündung des Körpers.
Introduction
Rheumatoide Arthritis (RA) ist eine Autoimmunerkrankung, die durch chronische, fortschreitende Invasivität mit 0,5–1% Inzidenz1,2gekennzeichnet ist. Die zugrunde liegende Pathogenese wird auf die abnormale Proliferation von autoreaktiven CD4+ und CD8+ T-Zellen zurückgeführt, die sich durch einen Anstieg des Anteils von CD4+IFN-+ und CD4+IL-17A+ T-Zellen und die reduzierte Anzahl von CD4+IL-4+ und CD4+CD25 + FoxP3+T-Zellen manifestiert. Daher wird die Sekretion von entzündlichen Zytokinen erhöht, und eine übermäßige Entzündungsreaktion zerstört die native Gleichgewichts- und Toleranzfunktion des körpereigenen Immunsystems. Darüber hinaus verschlimmern der Helfer T Lymphozyten (Th) 1 Zellen, die das Gelenk durchdringen, die Entzündungsreaktion und Gelenkschäden. Daher sind die Hemmung einer übermäßigen Entzündungsreaktion und die Wiederherstellung der Immuntoleranz und des Immungleichgewichts der Schlüssel zur Behandlung von RA3,4.
Die iNKT-Zellen haben sowohl NK-Zell- als auch T-Zellfunktionen und -Eigenschaften. Die iNKT-Zellen beherbergen eine ausgeprägte, invariante T-Zell-Rezeptor-Kette (TCR) mit begrenztem TCR-Kettenrepertoire5 und erkennen das Glycolipid-Antigen, das durch das Hauptmolekül des Histokompatibilitätskomplexes (MHC) Der Klasse I auf der Oberfläche der Antigen-präsentierenden Zellen dargestellt wird. Mitsuo et al.6 entdeckten eine große Anzahl von iNKT-Zellen und funktionelle Defekte bei vielen Autoimmunerkrankungen, einschließlich RA. Aurore et al.7 zeigten, dass iNKT-Zellen einen positiven Effekt auf die Aufrechterhaltung der Autoimmuntoleranz haben und dass, wenn die Anzahl und Funktion der iNKT-Zellen wiederhergestellt werden, die Krankheit gelindert wird. Darüber hinaus fanden Miellot-Gafsou et al.8 heraus, dass iNKT-Zellen nicht nur die Krankheit aushoben, sondern auch das Fortschreiten der Krankheit erhöhten. Diese widersprüchlichen Ergebnisse deuten darauf hin, dass iNKT-Zellen heterogene T-Zellen sind und die Funktion verschiedener Teilmengen umgekehrt werden kann. In einer klinischen Studie mit RA korrelierte die Häufigkeit von iNKT-Zellen mit dem Score der Krankheitsaktivität9. Die Ergebnisse bestätigten auch, dass die Häufigkeit von iNKT bei RA-Patienten verringert wurde, die Anzahl der CD4+IFN-A+ T-Zell-Untergruppen stieg und die sekretorischen Konzentrationen der entzündlichen Zytokine IFN-- und TNF---Werte um10,11stiegen. Darüber hinaus untersuchten Sharif et al.12 Typ-1-Diabetes (T1D) und fanden heraus, dass eine selektive Infusion von iNKT-Zellen die Expression des entzündlichen Zytokins IL-4 hochregulierte, die Immuntoleranz aufrechterhielt und die Entwicklung von Typ-1-Diabetes verhinderte. Daher erhöht die Adoptivinfusion bestimmter iNKT-Zellen oder die gezielte Aktivierung von iNKT-Zellen das Niveau von iNKT-Zellen bei RA-Patienten, was ein Durchbruch in der RA-Behandlung sein kann.
Die zelluläre Immuntherapie ist derzeit von großem Interesse und wurde häufig in der Krebstherapie eingesetzt. INKT-Zellen sind jedoch seltene, heterogene immunregulierende Zellen (nur 0,3% der Gesamtzahl der PBMCs)13, was potenzielle klinische Anwendungen einschränkt. Diese Zellen sind hauptsächlich in drei Subpopulationen unterteilt: 1) iNKT1-Zellen, die eine hohe Expression von promyelocytischer Leukämie Zink-Finger-Protein (PLZF) und T-Box-Transkriptionsfaktor (T-bet) haben; 2) iNKT2-Zellen mit Zwischenexpression von PLZF und GATA-Bindungsprotein 3 (GATA3); 3) iNKT17-Zellen mit geringer Expression von PLZF und retinooid-bezogenen Orphan-Rezeptor (ROR)--,--, die IFN-, IL-4 und IL-1714absondern. Aktivierte iNKT-Zellen sezernieren Th1, Th2 und Th17-ähnliche Zytokine, die die verschiedenen immunmodulatorischen Wirkungen von iNKT-Zellen15bestimmen. Die immunmodulatorischen und immuntherapeutischen Wirkungen der spezifischen Aktivierung verschiedener Subpopulationen von iNKT-Zellen sind unterschiedlich. Daher kann die Auswahl spezifischer Phänotypen von iNKT-Zellen (hauptsächlich iNKT2) mit entzündungshemmenden Funktionen zur Reregulierung der Immunantwort des Körpers das Immunungleichgewicht und Immunstörungen bei RA korrigieren.
Die Etablierung eines idealen Tiermodells ist von großer Bedeutung für die Behandlung und Untersuchung der RA-Pathogenese. Derzeit, die am häufigsten verwendeten und reifen Tiermodelle gehören Kollagen-induzierte Arthritis, adjuvante Arthritis, Zymosan-induzierte Arthritis, und Polysaccharid-induzierte Arthritis16–17. Es gibt jedoch kein Modell, das alle Funktionen menschlicher RA vollständig simulieren kann. Typ II Kollagen-induzierte Arthritis (CIA) ist ein klassisches Arthritis-Modell. Die CIA wird durch Immunisierung von Mäusen mit Typ-II-Kollagen-spezifischen monoklonalen Antikörpern induziert, die die Antikörperabhängigkeit dieses Krankheitsmodells widerspiegeln. Benurs et al. beschrieben ein Modell mit einer systemischen Immunantwort auf Glucose-6-Phosphat-Isomerase (G6PI), das periphere symmetrische Polyarthritis bei anfälligen Mausstämmen18,19induziert. In diesem Modell hängt die Entwicklung von Arthritis von T-Zellen, B-Zellen und angeborener Immunität18,19,20ab. Horikoshi21 fand heraus, dass RA-Modelle, die aus der Immunisierung von DBA/1-Mäusen mit G6PI-Polypeptidfragmenten resultieren, in Bezug auf CD4+ T-Zellen und Zytokine (d. h. IL-6 und TNF-A) ähnlicher sind als die CIA-Modelle. Um die stimulierende Wirkung auf die TCR-Erkennungsstelle zu erhöhen, wurden die gemischten Polypeptidfragmente von G6PI (hGPI325-339 und hGPI469-483) verwendet, um DBA/1-Mäuse zu immunisieren, um das RA-Mausmodell zu konstruieren. Die Erfolgsrate dieses Ansatzes kann hoch sein, da hGPI325-339 und hGPI469-483 immundominant für I-A q-eingeschränkte T-Zellreaktionen sind. Daher kann dieses Modell die Überproliferation von CD4+ T-Zellen und iNKT-Zelldefekten bei RA-Patienten simulieren22. Die Grundlagenforschung der RA-Immunpathologie legte den Grundstein für unsere weitere vertiefte Untersuchung.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle Versuchsmäuse (insgesamt 150) waren gesunde männliche DBA/1-Mäuse, 6–8 Wochen alt (20,0 x 1,5 g), die in einer bestimmten pathogenfreien Umgebung (SPF) aufgezogen wurden. Es gibt keine spezielle Behandlung vor dem Modellieren. Das Experiment wurde in eine gesunde Kontrollgruppe (15 Mäuse), eine Modellkontrollgruppe (15 Mäuse) und eine Zelltherapiegruppe (55 Mäuse) unterteilt. Diese Studie wurde vom Tierschutz- und Ethikausschuss der Hebei University genehmigt.
1. Aufbau des Krankheitsmodells
- Duplizieren des RA-Tiermodells
- Wiegen Sie 1,75 mg hG6PI 325-339 und hG6PI 469-483 Fragmente und lösen Sie sie in 5,25 ml mit 4 °C dreifach destilliertem Wasser auf.
- Komplettes Freund-Adjuvans (CFA) in einem 50 °C-Wasserbad auflösen, 5,25 ml in ein weiteres 10 ml Zentrifugenrohr ziehen und für den Einsatz abkühlen.
- Setzen Sie die Mischung aus hG6PI-Lösung und CFA-Lösung in eine künstliche Emulgierungseinheit mit zwei angeschlossenen Glasspritzen.
- Drücken Sie die Spritze mit einer konstanten Geschwindigkeit und Frequenz von 10–20x pro min, um die gemischte Peptidlösung und CFA-Lösung vollständig zu emulgieren. Führen Sie den Betrieb in einem Eisbad durch und halten Sie die Emulsionströpfchen nach Abschluss der Emulgierung 10 min im Wasser, ohne sich zu dispergieren.
- Injizieren Sie 150 l emulgierte hG6PIs subkutan in die Schwanzwurzel der Maus.
- Injizieren Sie 200 mg Pertussistoxin intraperitoneal bei 0 h und 48 h nach der hG6PI-Injektion in die Maus.
- Experimentelle Verifizierung des RA-Modells
- Messen Sie die Dicke der Mauspfote mit einem Vernier-Sattel (2x pro Tag).
- Beobachten und markieren Sie den Grad der Rötung und Schwellung des Fußes. Verwenden Sie die folgenden Bewertungskriterien: 1) Zehen mit leichter Schwellung; 2) dorsum pedis und Fußpolster mit klarer roter Schwellung; 3) Knöchel mit roter Schwellung.
- Euthanisieren Sie die Mäuse unter tiefer Anästhesie durch intraperitoneale Injektion von 1% Natriumpentobarbital (50 mg/kg Körpergewicht) 14 Tage nach der Modellierung und entfernen Sie die Pfoten für HE Färbung.
- Bestimmen Sie die Sekretionsniveaus von Serum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-, und IFN-- mit einem kommerziellen cytometrischen Perlenarray (CBA) Assay gemäß dem Herstellerprotokoll.
2. Erhalt von iNKT-Zellen mit Adoptiv-Zelltherapie
- Richtungsinduktion von iNKT-Zellen
- Injizieren Sie normale Mäuse intraperitoneal mit dem '-GalCer (0,1 mg/kg Körpergewicht).
- Isolierung von iNKT-Zellen
- Drei Tage nach der Modellierung, injizieren Mäuse intraperitoneal mit 1% Natriumpentobarbital (50 mg/kg Körpergewicht) zur Anästhesie. Angemessen anästhesierte Mäuse zeigen keine Rückdpfotenentzugsreaktion auf eine Zehenklemme.
- Isolieren Sie die Milz einer DBA/1-Maus, nachdem Sie sie intraperitoneal mit dem GalCer injiziert haben. Bereiten Sie eine Einzelzellsuspension vor, indem Sie die Milz in einem 200-Mesh-Sieb schneiden und schleifen.
- Waschen Sie die Zellsuspension mit PBS, Zentrifuge bei 200 x g für 5 min, und entsorgen Sie den Überstand. Wiederholen.
- Setzen Sie die Zellen mit 1 ml Vollblut- und Gewebeverdünnungslösung aus. Fügen Sie 3 ml Maus-Lymphozyten-Trennmedium hinzu, und zentrieren Sie dann die Zellen für 20 min bei 300 x g bei Raumtemperatur.
- Sammeln Sie die Schicht der milchigen weißen Lymphozyten (d. h. die zweite Schicht von oben), waschen Sie sie 2x mit PBS und zählen Sie mit einem automatisierten Zellzähler.
- Magnetaktivierte Zellsortierung (MACS) positive Selektionsstrategie zur Reinigung von iNKT-Zellen
ANMERKUNG: Für die Vorbehandlung von CD1d-Tetrameren wurden 1 mg/ml von '-Galcer mit 0,5% Tween-20 und 0,9% NaCl auf 200 g/ml verdünnt, und 5 l der resultierenden Lösung wurden 100 l der CD1d-Tetramerlösung zugesetzt. Die Mischung wurde für 12 h bei Raumtemperatur inkubiert und bei 4 °C zur Verwendung gestellt. TCR -wurde 80x mit entionisiertem Wasser verdünnt. Alle anderen Antikörper wurden als Lagerlösung eingesetzt.- 107 Zellen mit 100 l 4 °C PBS wieder aufhängen, 10 L mit dem Mit-GalCer-belasteten CD1d Tetramer-PE hinzufügen und bei 4 °C für 15 min im Dunkeln inkubieren.
- Waschen Sie die Zellen 2x mit PBS und setzen Sie sie in 80 l PBS wieder auf.
- Fügen Sie 20 L Anti-PE-MicroBeads hinzu und inkubieren Sie sie bei 4 °C für 20 min im Dunkeln.
- Waschen Sie sie 2x mit PBS und suspendieren Sie die Zellen mit 500 l PBS.
- Legen Sie die Sortiersäule in das Magnetfeld des MACS-Sortierers und spülen Sie sie mit 500 l PBS.
- Fügen Sie die Zellensuspension aus Schritt 2.3.4 zur Sortierspalte hinzu, sammeln Sie den Flowthrough und spülen Sie 3x mit PBS-Puffer.
- Entfernen Sie das Magnetfeld und sammeln Sie die Zellen aus der Sortierspalte. Fügen Sie an dieser Stelle der Sortierspalte 1 ml PBS-Puffer hinzu, und drücken Sie den Kolben schnell mit konstantem Druck, um die beschrifteten Zellen in das Sammelrohr zu treiben und gereinigte iNKT-Zellen zu erhalten. Zählen Sie mit einem automatisierten Zellenzähler.
- Kennung des iNKT-Zellphänotyps
- Nehmen Sie 1 x 106 Zellen aus den Schritten 2.2.5 bzw. 2.3.7, und setzen Sie sie in 50 l PBS wieder aus.
- Antikörperinkubation: Fügen Sie den Antikörper nicht in das Negative Kontrollröhrchen, fügen Sie 0,5 l Tetramer von '-GalCer-PE-CD1d oder 10 'L FITC-TCR' in das einzelne Positivkontrollrohr ein. Fügen Sie 0,5 l des Tetramers von '-GalCer-PE-CD1d und 10 'L FITC-TCR' in das Probenröhrchen ein. Inkubieren Sie sie bei 4 °C für 30 min im Dunkeln.
- Waschen Sie die Zellen in PBS und zentrieren Sie dann bei 200 x g für 5 min.
- Entsorgen Sie den Überstand, fügen Sie 1 ml Foxp3 Foxation/Permeabilization Arbeitslösung hinzu und inkubieren Sie die Zellen für 45 min bei 4 °C im Dunkeln.
- Fügen Sie 1 ml 1x 1x Permeabilisationspuffer-Arbeitslösung hinzu und zentrifugieren Sie die Zellen bei Raumtemperatur für 500 x g bei Raumtemperatur für 5 min.
- Entsorgen Sie den Überstand. Fügen Sie 1 L Alexa Fluor 647 Maus Anti-PLZF und 1 l PerCP-Cy 5,5 Maus Anti-T-Bet (oder 1 l PerCP-Cy 5,5 Maus Anti-ROR-t) für 30 min bei Raumtemperatur im Dunkeln.
- Fügen Sie 2 ml Permeabilisationspuffer Arbeitslösung für die Reinigung.
- Entsorgen Sie den Überstand, setzen Sie die Zellen in 500 L PBS wieder aus und messen Sie die Durchflusszytometrie.
- Funktionelle Identifikation von iNKT-Zellen
- Nehmen Sie 3 x 106 iNKT-Zellen ab Schritt 2.3.7 und setzen Sie sie in 12 Brunnenplatten mit 1,5 ml RPMI-1640 unvollständigem Medium (d.h. ohne Serum) wieder auf.
- Phorbolester (PMA, 50 ng/ml) und Ionomycin-Calcium (IO, 1 g/ml) hinzufügen und 24 h in einen CO2-Inkubator geben.
- Sammeln Sie den Zellüberstand und erkennen Sie die Sekretionsstufen von IL-2, IL-17A, TNF-, IL-6, IL-4, IFN-, und IL-10 mithilfe eines kommerziellen CBA-Assays gemäß dem Herstellerprotokoll.
- Experimentelle Studie zum Migrationsweg von iNKT-Zellen bei RA-Mäusen
- DiR-Farbstoff (2,5 mg/ml) in DMSO auflösen.
- Resuspend iNKT-Zellen in 6 Wellplatten mit RPMI-1640 unvollständigem Medium. Die Dichte beträgt 1 x 106 Zellen/ml.
- DiR-Lösung (5 g/ml) hinzufügen und 25 min in einem CO2-Inkubator inkubieren.
- Mit PBS waschen und die Zellen (3 x 106/300 l) wieder aussetzen, um DiR-markierte iNKT-Zellen (DiR-iNKT) zu erhalten.
- Injizieren Sie 1% Natriumpentobarbital (50 mg/kg Körpergewicht) intraperitoneal, um die Mäuse zu anästhesieren. Angemessen anästhesierte Mäuse zeigen keinen Hinterpfotenentzug, um zu kneifen. Tragen Sie die tierärztliche Salbe auf die Mausaugen auf, um Trockenheit unter Anästhesie zur Bildgebung zu verhindern.
- Injizieren Sie DiR-iNKT-Zellen 3 x 106 pro Maus in die Schwanzvene mit dem RA-Modell für 8 Tage. Überwachen Sie die iNKT-Zellen in Mäusen nach der Injektion für 0 min, 10 min, 30 min, 60 min und Tag 0 (nach 3 h), 1, 3, 6, 12, 26, 34, 38 und 42 Tage mit einem Kleintier-In-vivo-Bildgebungssystem (IVIS). Die verwendete Anregungswellenlänge betrug 748 nm, die Emissionswellenlänge 780 nm und die Belichtungszeit war automatisch.
- Legen Sie jede Maus nach jeder Beobachtung in einen separaten Käfig und halten Sie die Brustbehebung aufrecht. Beobachten, bis er sich von der Anästhesie erholt.
3. Bewertung der Adoptivimmuntherapie von RA-Mäusen mit iNKT-Zellen
- iNKT-Zell-Adoptivimmuntherapie für RA-Mäuse
- Injizieren Sie 3 x 106 Zellen iNKT-Zellen pro Maus durch die Schwanzvene. Wählen Sie zufällig 15 Mäuse aus, die 8 Tage zuvor modelliert wurden, und erhalten Sie iNKT-Zellen ohne DiR-Beschriftung von Schritt 2.3.7 durch die Infusion der Schwanzvene.
- Bewerten Sie die Wirksamkeit der Adoptivimmuntherapie für iNKT-Zellen.
- Messen Sie die Dicke der Pfote der Maus, quantifizieren Sie die Schwellung des Sprunggelenks und punkten Sie systematisch nach der Infusion von iNKT-Zellen, wie in den Schritten 1.2.1–1.2.2 beschrieben.
- Beobachten Sie die entzündliche Zellinfiltration und Gelenkveränderungen der Mausgelenke, wie in Schritt 1.2.3 beschrieben.
- Bestimmen Sie die Sekretionsstufen von IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-, und IFN--, wie in Schritt 1.2.4 beschrieben.
- Bestimmen Sie die Häufigkeit von iNKT-Zellen und Teilmengen.
- Isolieren Sie den Mausthymus und bereiten Sie eine Einzelzellsuspension vor.
- Trennen Sie die Lymphozyten mit Lymphozyten-Trennflüssigkeit.
- Bestimmen Sie die iNKT-Zellfrequenz und die Untergruppenhäufigkeit, wie in Schritt 2.4 beschrieben.
- Statistische Auswertung
ANMERKUNG: Alle Daten werden als Mittelwert sD dargestellt. Werte von P < 0,05 wurden als statistisch signifikant betrachtet.- Verwenden Sie die Ein-Faktor-Analyse der Varianz (ANOVA). Wenn die Varianz erfüllt ist, verwenden Sie den LSD-Test für einen weiteren Vergleich.
- Wenn die Varianz nicht einheitlich ist, verwenden Sie den nichtparametrischen Test. Verwenden Sie den Kruskal-Wallis H Test für den weiteren Vergleich31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Die Arthritis Index-Score und Pfotendicke erhöht nach dem Modellieren. Im Vergleich zur Kontrollgruppe zeigten die Zehen der RA-Modellgruppe 6 Tage nach dem Modellieren eine rote Schwellung, mit allmählicher Verschlimmerung. Nach 14 Tagen erreichte die rote Schwellung im Sprunggelenk ihren Höhepunkt, gefolgt von einer allmählichen Linderung. Die Dicke der Pfote änderte sich ähnlich (P < 0.05) (Abbildung 1).
Die entzündliche Zellinfiltration nahm nach der Modellierung signifikant zu. Die pathologischen Ergebnisse zeigten, dass der Infiltrationsgrad von Entzündungszellen im Knöchelsynovialgewebe der RA-Modellmäuse in verschiedenen Stadien unterschiedlich war. Spitzenentzündung trat am Tag 14 nach der Modellierung (Abbildung 2).
Entzündliche Zytokine erhöht und entzündungshemmende Zytokine im Serum verringert. In der RA-Modellgruppe stiegen die Serumspiegel der proinflammatorischen Zytokine (TNF-, IFN-, und IL-6) signifikant an(P < 0,05), während entzündungshemmende Zytokine (IL-4 und IL-10) signifikant zurückgingen (P < 0,05) (Abbildung 3).
Die iNKT-Zellen, die durch In-vivo-Induktion und In-vitro-Reinigung gewonnen wurden, bestanden hauptsächlich aus iNKT2-Zellteilmengen, die entzündungshemmende Zytokine absondern. Die intraperitoneale Injektion von '-GalCer erhöhte die Häufigkeit von iNKT-Zellen im Körper, vor allem die iNKT2-Untergruppe. Die Häufigkeit von Milz-iNKT-Zellen bei normalen DBA/1-Mäusen betrug etwa 2% der Lymphozyten (iNKT2 betrug etwa 5%, iNKT1 etwa 15%, iNKT17 etwa 10%). Drei Tage nach der intraperitonealen Injektion von '-GalCer betrug die Häufigkeit von iNKT-Zellen etwa 6% der Lymphozyten (iNKT2 betrug etwa 82%, iNKT1 etwa 1,5% und iNKT17 etwa 0,5%). Nach der Reinigung durch MACS lag die Reinheit der iNKT-Zellen bei über 85 %, wovon iNKT2 etwa 92 %, iNKT1 etwa 0,4 % und iNKT17 etwa 0,2 %(Abbildung 4) betrug.
Die geernteten iNKT-Zellen sezernierten mehr entzündungshemmende Zytokine und weniger entzündliche Zytokine. Die iNKT-Zellen wurden aus den Milz normaler Mäuse isoliert und 3 Tage nach der Mausmilz und den Zytokinspiegeln im Zellkulturüberstand intraperitoneal mit dem Ga-GalCer injiziert. Im Vergleich zur Kontrollgruppe verringerten sich die entzündlichen Zytokine (IL-17A, TNF-, IFN-, und IL-6) der Gruppe a-GalCer signifikant (P < 0,05), und das entzündungshemmende Zytokin IL-4-Spiegel erhöhte sich signifikant (P < 0,05). Es gab keinen signifikanten Unterschied in IL-10 (P > 0,05). Das IFN-/IL-4-Verhältnis verringerte sich signifikant (P < 0,05) (Abbildung 5).
Die IVIS-Tracing bestätigte, dass DiR-iNKT-Zellen adoptiv in RA-Mäuse infundiert wurden und sofort nach der Injektion in der Lunge auftauchten. Fluoreszenz wurde in der Leber bei 10 min und in der Milz bei 60 min nachgewiesen(Abbildung 6AI, 6AII, 6AIII). In den isolierten Organen gab es keine Fluoreszenz in den Thymus- und Leistenlymphknoten innerhalb von 1 h. Fluoreszenz wurde in der Lunge bei 0 min nachgewiesen, die Fluoreszenzintensität war mit 10 min am größten und schwächte sich dann allmählich ab. Es gab eine schwache Fluoreszenz in der Leber bei 0 min, und dann stieg es allmählich an. Die Fluoreszenz in der Milz wurde in 30 min nachgewiesen und dann allmählich erhöht (Abbildung 6AIV, 6C).
Nach der Infusion von DiR-iNKT-Zellen in RA-Mäuse konzentrierte sich die Fluoreszenz hauptsächlich in der Leber und Milz (Abbildung 6BI, 6BII, 6BIII), aber es gab keine Fluoreszenz in den Thymus- und Leistenlymphknoten. Milz und Leber hatten die höchste Fluoreszenzintensität am ersten Tag nach der Zellinfusion, schwächten sich aber allmählich ab. Am 34. Tag verschwand die Oberflächenfluoreszenz. Am 42. Tag verschwand die Fluoreszenz der isolierten Organe. Die durchschnittliche Fluoreszenzsignalintensität der Leber nach der Zellinfusion war höher als die der Milz (Abbildung 6BIV, 6D).
Die Adoptivinfusion von iNKT-Zellen in RA-Mäuse kann das Fortschreiten der Erkrankung lindern und die klinischen Symptome verbessern. Die iNKT-Zellen verbesserten die klinischen Symptome von RA-Mäusen nach einer Adoptivinfusion. Im Vergleich zur unbehandelten RA-Modellgruppe wurde die Schwellung des Sprunggelenks in der Zellbehandlungsgruppe gelindert, und die Ergebnisse verringerten sich von Tag 10 bis Tag 20 nach der Injektion signifikant. Im gleichen Zeitraum in der Zellbehandlungsgruppe wurde die entzündliche Zellinfiltration im Synovialgewebe im Vergleich zur RA-Modellgruppe reduziert (Abbildung 2).
Die Erfolgsraten von Thymus-iNKT-Zellen stiegen signifikant an (P < 0,05). Im Vergleich zur gesunden Kontrollgruppe verringerten sich in der RA-Modellgruppe die Raten der iNKT-Zellen im Thymus beim Fortschritt (Tag 11), Spitzen( Tag 14) und Erholung (Tag 20) an. Bei Spitzenentzündungen waren diese Werte minimal und erholten sich in der Remissionsphase. Die Zelltherapiegruppe zeigte signifikant erhöhte Raten von iNKT-Zellen in den Spitzenstadien (Tag 14) und Erholung (Tag 20) im Vergleich zur RA-Modellgruppe (P < 0,05) (Abbildung 7).
Nach der iNKT-Zellinfusion verringerte sich die Erfolgsrate von iNKT1 und iNKT17 im Thymus und iNKT2 nahm zu. Im Vergleich zur Kontrollgruppe nahm in der RA-Modellgruppe am 11. Tag iNKT1 und iNKT17 im Thymus signifikant zu (P < 0,05), und iNKT2 nahm signifikant ab (P < 0,05). Am 14. Tag nahmen iNKT1 und iNKT2 im Thymus signifikant zu(P< 0,05) und iNKT17 deutlich ab (P< 0,05). Am 20. Tag stieg iNKT1 im Thymus signifikant an (P < 0,05), iNKT2 änderte sich nicht signifikant (P > 0,05) und iNKT17 deutlich (P < 0,05). Das iNKT1/iNKT2-Verhältnis stieg in allen drei Stufen signifikant an (P < 0,05).
Im Vergleich zur RA-Modellgruppe waren iNKT1 und iNKT17 am 11. Tag in den Gruppen "GalCer" und in den Zelltherapiegruppen signifikant niedriger (P < 0,05) und iNKT2 deutlich gestiegen (P < 0,05). Am 14. Tag verringerten sich iNKT1 und iNKT17 in der Gruppe iNKT1 und iNKT17 signifikant (P < 0,05), und iNKT2 änderte sich nicht signifikant (P > 0,05); in der Zelltherapiegruppe iNKT1 und iNKT17 signifikant abnahm (P < 0,05) und iNKT2 signifikant erhöht (P < 0,05). Am 20. Tag verringerte sich der iNKT1 signifikant (P < 0,05), iNKT2 änderte sich nicht signifikant (P > 0,05) und iNKT17 deutlich (P < 0,05); in der Zelltherapiegruppe iNKT1 und iNKT17 signifikant abnahm (P < 0,05) und iNKT2 signifikant erhöht (P < 0,05). Das Verhältnis von iNKT1/iNKT2 verringerte sich in allen drei Stufen signifikant (P < 0,05) (Abbildung 7).
Die Konzentrationen von entzündlichen Zytokinen wurden im Serum erhöht und die entzündungshemmenden Zytokine wurden nach iNKT-Zellinfusion verringert. In der RA-Modellgruppe stiegen die Werte von TNF-, IFN-- und IL-6in-Serum signifikant an (P < 0,05), während IL-4 und IL-10 im Vergleich zur Kontrollgruppe deutlich verringerte Mengen(P < 0,05) zeigten. In der iNKT-Zelltherapiegruppe verringerten sich die Konzentrationen von TNF-, IFN-, und IL-6 im Serum im Verlauf und in den Spitzenstadien der Entzündung signifikant (P < 0,05), während IL-4 und IL-10 im Vergleich zur RA-Modellgruppe(Abbildung 3)signifikant angestiegen sind(P < 0,05 ).
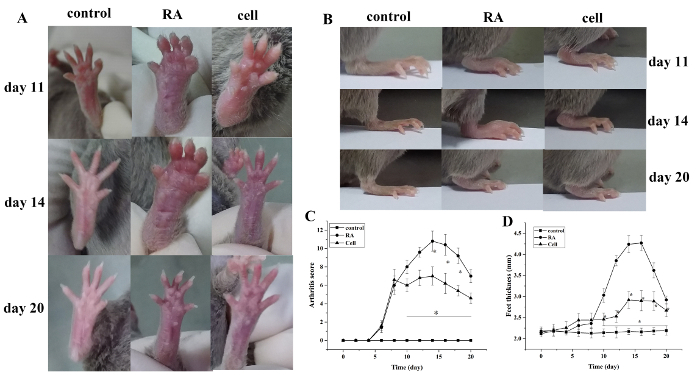
Abbildung 1: Die Gelenkschwellung und die Pfotendicke ändern sich bei Mäusen. (A) Schwellung des Sprunggelenks bei Mäusen. (B,D) Pfotendicke in verschiedenen Gruppen. (C) Klinische Score-Änderungen in verschiedenen Gruppen. Der Maus-Arthritis-Score und die Dicke der Pfote wurden in der Zelltherapiegruppe an den Tagen 10–20 (d.h. 2–12 Tage nach der Behandlung) nach der Modellierung signifikant reduziert. *P < 0.05 vs. Steuerung, **P < 0.05 vs. RA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Histopathologische Veränderungen des Sprunggelenks. Die Infiltration von Entzündlichen Zellen wurde in der Zelltherapiegruppe signifikant reduziert und in der RA-Gruppe am 14. Tag signifikant erhöht. • = entzündliche Zellen. (A) 100x (B) 400x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die Konzentrationen von Serumzytokinen in jeder Gruppe. (A) Serumzytokinspiegel bei Mäusen am 11. Tag nach der Modellierung (pg/ml). (B) Serumzytokinspiegel bei Mäusen am 14. Tag nach der Modellierung (pg/ml). Die Konzentrationen von TNF-, IFN-, und IL-6 verringerten sich signifikant, und die Niveaus von IL-4 und IL-10 stiegen in der Zelltherapiegruppe signifikant an. einP < 0.05 vs. Steuerung. bP < 0,05 gegen RA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Die Raten der iNKT-Zellen und der Anteil der iNKT-Zellteilmengen. (A,B,C) Die INKT2-Rate bei normalen Mäusen liegt bei 5 %. (D,E,F) Die Rate von iNKT2 beträgt etwa 82% nach In-vivo-Induktion. (G, H, I) Die Rate von iNKT2 beträgt mehr als 92% nach DER MACS-Reinigung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Zytokinspiegel im Kulturüberstand von Mausmilz-abgeleiteten iNKT-Zellen. Das Niveau von IL-4 stieg signifikant an, und die Niveaus von IL-17A, TNF-, IFN-, und IL-6 nahmen signifikant ab. einP < 0.05 vs. Steuerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Verteilung und Stoffwechsel von iNKT-Zellen, die mit dem Bremssattel IVIS-Lumina II verfolgt werden. (A,B) Migrationspfad von iNKT-Zellen. (C) Die Veränderung der durchschnittlichen Fluoreszenzsignalintensität in Milz, Leber und Lunge. (D) Die Veränderung der durchschnittlichen Fluoreszenzsignalintensität in Milz und Leber. Die Fluoreszenz wurde in der Lunge und Leber bei 0 min nachgewiesen und nahm dann allmählich zu. Die Fluoreszenzintensität war mit 10 min in der Lunge am stärksten und verringerte sich dann. Die Fluoreszenz der Milz wurde in 30 min nachgewiesen und dann allmählich erhöht. Die Fluoreszenz aller Organe verschwand am 42. Tag. Die durchschnittliche Fluoreszenzsignalintensität der Leber ist höher als die Milz nach der Zellinfusion (I: supine; II: seitliche Lüge; III: anfällig; IV: isoliertes Gewebe; a: Kontrollgruppe; b: Zellinfusionsgruppe; 1, 2, 3, 4, 5 sind Thymus, Milz, Leber, Leistenlymphknoten, Lunge). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Die Raten von iNKT und seinen Teilmengen im Mausthymus. (A) Die Raten von iNKT-Zellen bei 11, 14 und 20 Tagen nach der Modellierung. (B) Das Verhältnis von iNKT1/iNKT2. (C,D,E) Die Rate von iNKT1, iNKT2 und iNKT17. An den Tagen 11, 14 und 20 (Tage 3, 6 und 12 nach der Zelltherapie) stiegen die Raten der iNKT-Zellen signifikant an, die iNKT1 und iNKT17 des Thymus verringerten sich in der Zelltherapiegruppe signifikant, und iNKT2 wurde signifikant erhöht. einP < 0.05 vs Control. bP < 0,05 gegen RA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT-Zellen sind spezielle T-Zellen, die angeborene und adaptive Immunität überbrücken und hauptsächlich aus CD4++/CD8+ Thymosyten entwickelt werden. iNKT-Zellen haben verschiedene immunregulierende Funktionen und interagieren mit anderen Immunzellen durch direkten Kontakt und Sekretion verschiedener Zytokine23, die dendritische Zellen (DCs), Makrophagen, Neutrophile, B-Zellen, T-Zellen und NK-Zelldifferenzierung und -Entwicklung beeinflussen24. Der GalCer ist ein klassischer iNKT-Zell-spezifischer Aktivator, der aus Schwämmen extrahiert wird. Mehrere Studien deuten darauf hin, dass die Milz iNKT-Zellfrequenz nach einer einzigen intraperitonealen Injektion von '-GalCer für 3 Tage25einen Höhepunkt erreicht. Unsere experimentellen Ergebnisse zeigten die Dominanz der iNKT2-Untergruppe in Mäusemilz für 3 Tage nach einer intraperitonealen Injektion von '-GalCer, die hauptsächlich entzündungshemmende Zytokine IL-4 und IL-10 absondert. Wir fanden auch heraus, dass die Häufigkeit von iNKT2-Zellen abnahm und die von iNKT1- und iNKT17-Zellen in den RA-Modellmäusen während der Entzündlichen Phase zunahm. Daher isolierten wir die iNKT-Zellen der Mausmilz durch intraperitoneale Injektion von '-GalCer für 3 Tage. Diese wurden zur Behandlung der RA-Modellmäuse verwendet. Die Rate der iNKT2-Teilmenge betrug 82% nach in vivo Induktion. Nach der Reinigung durch MACS lag die INKT2-Rate bei über 92%.
Die spezifische Aktivierung von iNKT-Zellen wird als neuartige biologische Behandlung für RA eingesetzt. Horikoshi et al.21 zeigten, dass die intradermale Injektion von '-GalCer die GPI-Peptid-induzierte Arthritis hemmte, indem sie die Anzahl der CD4+ T-Zellen signifikant hemmte. Chiba et al.26 zeigten, dass wiederholte Injektionen des synthetischen iNKT2-Selektivaktivators OCH die CIA hemmten, während der Ga-GalCer eine leichte hemmende Wirkung zeigte. Wir injizierten Milz-abgeleitete iNKT in RA-Modell Mäuse, und die Ergebnisse zeigten, dass der Grad der Schwellung der Sprunggelenke in der Zelltherapiegruppe und die Anzahl der entzündlichen Zellen in die Gelenke infiltriert wurde. Der Gehalt an serum entzündungshemmenden Zytokinen (z. B. IL-4 und IL-10) nahm zu, und die Sekretion von proinflammatorischen Zytokinen (z. B. IFN-A und TNF-A) nahm ab. die gezielte Aktivierung von iNKT-Zellen war in der Lage, das Fortschreiten der RA zu lindern und die Entzündungsreaktion zu hemmen. Darüber hinaus haben wir die Häufigkeit von iNKT im Thymus nachgewiesen und festgestellt, dass die Anzahl der iNKT-Zellen in der RA-Modellgruppe signifikant reduziert wurde, während die Frequenz im Thymus nach der Infusion der iNKT-Zellen zunahm. Aufgrund des Vorhandenseins des Blut-Thymus-Barrieresystems haben wir den adoptivinfundierten Anstieg des iNKT-Spiegels im Thymus, der in späteren Experimenten bestätigt wurde, nicht berücksichtigt. Der weitere Nachweis der Subpopulationen von iNKT-Zellen im Thymus ergab, dass die Anzahl der iNKT1-Zellen in der RA-Modellgruppe während der drei Entzündungsstadien und maximal während des Höhepunkts der Entzündung signifikant zunahm, während der Anteil der iNKT2-Teilmenge auf dem Höhepunkt der Entzündung zu steigen begann. Insbesondere könnte die iNKT1-Teilmenge an der frühen Entzündung von RA beteiligt sein, und die iNKT2-Teilmenge kann eine wichtige Rolle bei der Hemmung der Entzündung spielen. Im Vergleich zur RA-Modellgruppe nahm die iNKT1-Teilmenge in der Zelltherapiegruppe während der Entzündlichen Phase signifikant ab, und die iNKT2-Teilmenge erhöhte sich im frühen und Remissionsstadium der Entzündung signifikant. Diese Ergebnisse zeigten, dass die Adoptivinfusion bestimmter Phänotypen und funktioneller iNKT-Zellen die Häufigkeit von iNKT-Zellen in RA signifikant erhöhte und den Anteil der iNKT-Zellteilmengen veränderte.
Wir verwendeten IVIS, um die Verteilung von iNKT-Zellen bei Mäusen nach der Adoptivinfusion zu beobachten und fanden die höchste Fluoreszenzintensität in der Lunge 10 min nach der Infusion, die allmählich verblasste. Die Leber zeigte eine schwache Fluoreszenz, die allmählich zunahm und nach 2 Tagen allmählich abnahm. Fluoreszenz wurde in der Milz bei 30 min nachgewiesen, die allmählich zunahm und nach 2 Tagen abnahm. Die durchschnittliche Fluoreszenzintensität der Leber war stärker als die der Milz. In den Thymus- und Leistenlymphknoten wurde jedoch keine Fluoreszenz nachgewiesen. Der Nachweis der Fluoreszenz in der Lunge könnte auf die Infusion von iNKT-Zellen in die Schwanzvene zurückgeführt werden. Diese Zellen werden mit dem Blut in die Lunge zirkuliert. Die Leber fluoresziert früher als die Milz, und die durchschnittliche Fluoreszenzintensität der Leber ist stärker als die der Milz. Diese bevorzugte Ansammlung der iNKT-Zellen kann auf die reichlich vorhandenen Blutgefäße in der Leber, das wichtigste Stoffwechselorgan, zurückzuführen sein. Fluoreszenz wurde im Thymus nicht nachgewiesen. Dies könnte auf die hämatologische Barriere zurückzuführen sein, die den Eintritt von iNKT-Zellen behindern könnte. Fluoreszenz wurde nie in den Leistenlymphknoten nachgewiesen, vielleicht weil weniger iNKT-Zellen in die Lymphknoten gelangten und nicht das Mindestmaß an Nachweis erreichten. Außerdem könnte spekuliert werden, dass die iNKT-Zellen, die in die Schwanzvene infundiert sind, nicht in die Lymphknoten gelangen könnten. Daher gehen wir davon aus, dass die Entwicklung und Differenzierung von iNKT-Zellen im Thymus durch Zytokinwege nach einer Adoptivinfusion in die Mäuse reguliert werden könnte. Das muss weiter aufgeklärt werden.
GPI ist im Serum und Synovialfluid der meisten RA-Patienten vorhanden und ist ein häufig verwendeter Test für die klinische RA-Diagnose27. Bruns et al.28 verwendeten Peptide unterschiedlicher Länge aus der GPI-Sequenz und immunisierten die DBA/1-Mäuse, um sechs immundominante T-Zellepitope zu identifizieren. Von diesen waren drei arthritistogen. Die Peptide mit >95% Inzidenz von Arthritis sind hGPI 325-339 und hGPI469-483. Unsere früheren Studien haben gezeigt, dass die Verwendung einer Mischung der beiden Peptide zur Etablierung eines RA-Modells besser ist als ein einzelnes Peptid. In den resultierenden RA-Modellen begannen die Zehen und Gelenke der Mäuse am 6. Tag rot zu erscheinen und erreichten am 14. Tag einen Höhepunkt der Entzündung. Die entzündliche Zellinfiltration wurde von Gewebehyperplasie im Synovialgewebe der Gelenke begleitet, und die entzündliche Zellinfiltration war am schwersten an Tag 14. Die Anzahl der iNKT-Zellen wurde im Thymus auf dem Höhepunkt der Entzündung signifikant verringert, was mit dem Trend der iNKT-Zellen bei RA-Patientenübereinstimmte 29. Der weitere Nachweis von iNKT-Zellteilmengen ergab, dass die Häufigkeit von iNKT1 und iNKT17 im Thymus zunahm und die Häufigkeit von iNKT2 während des Fortschreitens der Entzündung abnahm (Tag 11). Darüber hinaus stiegen die Konzentrationen der Serumzytokine IFN-A und IL-17A während der Progression (Tag 11) und der Spitze der Entzündung (Tag 14), was auf eine ähnliche Polarisation der Untergruppen Th1 und Th17 in RA-Modellmäusen30hindeutet. Daher zeigte das durch hGPI325-339 und hGPI469-483 gemischte Polypeptidfragmente induzierte RA-Mausmodell die Merkmale der CD4+ T-Zellhyperproliferation und der iNKT-Zelldefekte, die denen der RA-Patienten ähnelten und als ideales Tiermodell für die Untersuchung der Immunität der RA-Zellen verwendet werden konnten. Diese Ergebnisse entsprachen denen unserer früheren Studien und zeigten die Stabilität des hGPIs-induzierten RA-Modells31.
Im Allgemeinen kann das durch die gemischten G6PI-Peptide induzierte RA-Mausmodell die Veränderungen in CD4+ T-Zellen, iNKT-Zellen und verwandten Zytokinen bei RA-Patienten simulieren. Dies bietet ein gutes Modell für eine eingehende Untersuchung von RA. Konsekutiv wurde iNKT (hauptsächlich iNKT2), induziert durch intraperitoneale Injektion von '-GalCer und gereinigt in vitro, bei der Behandlung von RA verwendet. Es kann das Immunungleichgewicht korrigieren, das durch die abnormale Proliferation von Th-Teilmengen verursacht wird, das Fortschreiten der RA zu lindern und in Zukunft neue Methoden für die klinische Behandlung von RA liefern.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren erklären keine Finanzierung oder Interessenkonflikte.
Acknowledgments
Unsere Studie wurde von der National Natural Science Foundation of China (NSFC) (81771755), Colleges und dem Wissenschafts- und Technologie-Schlüsselforschungsprojekt der Provinz Hebei (ZD2017009) und dem Animal Lab of Medical Experiment Center, Hebei University, unterstützt. Wir sind dankbar für ihre Unterstützung.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



