Summary
このプロトコルは、G6PI混合ペプチドを使用して、CD4+ T細胞およびサイトカインにおけるヒト関節リウマチのモデルに近い関節リウマチモデルを構築します。特定の表現型および機能を有する高純度不変不変天然キラーT細胞(主にiNKT2)は、養子免疫療法のためのインビボ誘導およびインビトロ精製によって得られた。
Abstract
関節リウマチ(RA)は、複雑な慢性炎症性自己免疫疾患である。この疾患の病因は、不変性のナチュラルキラーT(iNKT)細胞に関連している。活性RAを有する患者は、より少ないiNKT細胞、欠損細胞機能、およびTh1の過剰な分極を有する。本研究では、hGPI325-339とhGPI469-483ペプチドの混合物を用いてRA動物モデルを確立した。iNKT細胞をインビボ誘導およびインビトロ精製により得られ、続いて、採用免疫療法用のRAマウスへの注入が行われた。インビボイメージングシステム(IVIS)の追跡により、iNKT細胞は主に脾臓および肝臓に分布していたことが明らかになった。細胞療法後12日目、疾患の進行は著しく低下し、臨床症状は緩和され、胸腺におけるiNKT細胞の存在量は増加し、胸腺におけるiNKT1の割合は減少し、TNF-α、IFN-γ、およびIL-6のレベルは1000年に増加した。血清が減少した。iNKT細胞の養子免疫療法は免疫細胞のバランスを回復させ、身体の過剰な炎症を矯正した。
Introduction
慢性関節リウマチ(RA)は、0.5~1%発生率1、2の慢性進行性侵襲を特徴とする自己免疫疾患である。その根底にある病因は自己反応性CD4+およびCD8+T細胞の異常増殖に起因し、CD4+IFN-γ+およびCD4+IL-17A+T細胞の割合の増加、およびCD4+IL-4+ + FoxP3+T細胞の減少した数によって明らかにされる。したがって、炎症性サイトカインの分泌が増加し、過度の炎症反応が身体の免疫系のネイティブバランスおよび耐性機能を破壊する。また、ヘルパーTリンパ球(Th)を関節に浸透させる1細胞は炎症反応や関節損傷を悪化させる。したがって、過剰な炎症反応の阻害と免疫寛容および免疫バランスの回復がRA3の治療の鍵である、4。
iNKT細胞は、NK細胞とT細胞の両方の機能と特性を有する。iNKT細胞には、限定TCRβ鎖レパートリー5を有する異なる不変T細胞受容体(TCR)α鎖を有し、抗原提示細胞の表面に主要組織適合性複合体(MHC)クラスI分子CD1dによって提示される糖脂質抗原を認識する。ミツオら6は、RAを含む多くの自己免疫疾患において多数のiNKT細胞および機能的欠陥を検出した。Aurore et al.7は、iNKT細胞が自己免疫寛容を維持するのにプラスの効果を有し、iNKT細胞の数と機能が回復すると、疾患が緩和されることを実証した。さらに、ミエロット・ガフソウら8は、iNKT細胞が病気を失起しただけでなく、病気の進行を増加させたことを発見した。これらの矛盾した結果は、iNKT細胞が異種T細胞であり、異なるサブセットの機能が逆転する可能性があることを示唆している。RAの臨床研究において、iNKT細胞の頻度は、疾患活性9のスコアと相関した。また、結果は、INKTの頻度がRA患者において減少し、CD4+IFN-γ+T細胞サブセットの数が増加し、炎症性サイトカインIFN-γおよびTNF-αの分泌レベルが10、11増加したことを確認した。さらに、シャリフら12は1型糖尿病(T1D)を調査し、iNKT細胞の選択的注入が炎症性サイトカインIL-4の発現をアップレギュレートし、免疫寛容を維持し、1型糖尿病の発症を妨げた。したがって、特定のiNKT細胞の導入またはiNKT細胞の標的活性化は、RA患者におけるiNKT細胞のレベルを増加させ、RA治療において画期的となり得る。
細胞免疫療法は現在、大きな関心を持っており、癌治療に広く使用されています。しかし、iNKT細胞は稀であり、異種免疫調節細胞(PBMCの総数のわずか0.3%)13であり、潜在的な臨床応用を制限する。これらの細胞は主に3つの亜集団に分けられる:1)iNKT1細胞は、前骨髄球性白血病ジンフィンガータンパク質(PLZF)およびTボックス転写因子(T-ベット)の高発現を有する。2) PLZFおよびGATA結合タンパク質3(GATA3)の中間発現を有するiNKT2細胞。3)INKT17細胞の発現が低いPLZF及びレチノイド関連の孤児核受容体(ROR)-γtがIFN-γ、IL-4、およびIL-1714を分泌する。活性化されたiNKT細胞は、Th1、Th2、およびTh17様サイトカインを分泌し、iNKT細胞15の異なる免疫調節効果を決定する。iNKT細胞の様々な亜集団の特異的活性化の免疫調節作用および免疫療法効果は異なる。従って、体の免疫応答を調節する抗炎症機能を有するiNKT細胞(主にiNKT2)の特定の表型の選択は、RAにおける免疫の不均衡および免疫障害を補正することができる。
理想的な動物モデルの確立は、RA病因の治療および研究にとって非常に重要である。現在、最も一般的に使用される成熟した動物モデルには、コラーゲン誘発関節炎、アジュバント関節炎、ジモサン誘発関節炎、多糖による関節炎16-17が含まれる。しかし、人間のRAのすべての特徴を完全にシミュレートできるモデルはありません。II型コラーゲン誘発関節炎(CIA)は、古典的な関節炎モデルです。CIAは、II型コラーゲン特異的モノクローナル抗体を用いたマウスの免疫によって誘導され、この疾患モデルの抗体依存性を反映している。Be歳代は、グルコース-6-リン酸イソメラーゼ(G6PI)に対する全身免疫応答を有するモデルを記載し、これは、感受性マウス株における末梢対称多関節炎を誘導する18、19である。このモデルでは、関節炎の発症はT細胞、B細胞、および自然免疫18、19、20に依存する。堀越21は、G6PIポリペプチド断片を有するDBA/1マウスの免疫から生じるRAモデルが、CIAモデルよりもCD4+T細胞およびサイトカイン(すなわち、IL-6およびTNF-α)の点でヒトRAに類似していることを発見した。TCR認識部位に対する刺激効果を高めるために、G6PI(hGPI325-339およびhGPI469-483)の混合ポリペプチド断片を使用して、DBA/1マウスを免疫化し、RAマウスモデルを構築した。hGPI325-339 および hGPI469-483 は I-A q 制限 T 細胞応答に対して免疫優位であるため、このアプローチの成功率は高くなる可能性があります。したがって、このモデルは、RA患者22におけるCD4+T細胞およびiNKT細胞欠損の過剰増殖をシミュレートすることができる。RA免疫病理学の基礎研究は、さらに詳細な調査の基礎を築きました。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
全ての実験マウス(合計150匹)は健常な雄DBA/1マウス、6~8週齢(20.0±1.5g)で、特異的病原体フリー(SPF)環境で飼育した。モデリング前に特別扱いはありません。実験は、健常対照群(15匹)、モデル対照群(15匹)、及び細胞療法群(55匹のマウス)に分けた。この研究は、ヘバイ大学動物福祉倫理委員会によって承認されました。
1. 疾患モデルの構築
- RA動物モデルの複製
- hG6PI 325-339およびhG6PI 469-483断片の両方の1.75 mgを計量し、4°C三重蒸留水の5.25 mLにそれらを溶解します。
- 50°Cの水浴で完全なフロイントのアジュバント(CFA)を溶解し、別の10 mL遠心管に5.25 mLを引き込み、使用するためにそれを冷却します。
- hG6PI溶液とCFA溶液の混合物を、2つのガラスシリンジが接続された人工乳化ユニットに入れます。
- 一定の速度と周波数で10~20x/分でシリンジを押し込み、混合ペプチド溶液とCFA溶液を完全に乳化します。氷浴で操作を行い、乳化終了後10分間、乳化液滴を分散せずに水中に保管します。
- 150 μLの乳化されたhG6Pを皮下にマウスの尾根に注入する。
- hG6PI注入後0時間および48時間でマウス腹腔内に200mgの百日性毒素を注入する。
- RAモデルの実験的検証
- バーニアキャリパー(1日2倍)でマウスの足の厚さを測定します。
- 足の赤みや腫れの程度を観察し、マークします。次のスコア基準を使用してください: 1) 軽度の腫脹を伴うつま先;2)ドーサムペディスと足パッド、透明な赤い腫脹;3)赤い腫れと足首。
- 深い麻酔下でマウスを安楽死させる 1% ペントバルビタールナトリウムの腹腔内注射によって (50 mg/kg 体重) 14 モデル後 14 日と HE 染色のための足を削除します。.
- 市販のサイトメトリックビーズアレイ(CBA)を用いて、血清IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、およびIFN-γの分泌レベルを決定します。
2. 養子細胞療法によるiNKT細胞の獲得
- iNKT細胞の指向性誘導
- 正常マウスを腹腔内にα-GalCer(体重0.1mg/kg)で注射する。
- iNKT細胞の分離
- モデル化の3日後、麻酔用に1%のペントバルビタールナトリウム(体重50mg/kg)でマウスを腹腔内注射する。適切に麻酔されたマウスは、つま先のピンチに対する後足離脱応答を示さない。
- Α-GalCerを腹腔内注射した後、DBA/1マウスの脾臓を分離します。200メッシュのふるいに脾臓を切り、粉砕して単一細胞懸濁液を調製する。
- 細胞懸濁液をPBSで洗浄し、遠心分離器を200xgで5分間、上清を捨てる。 繰り返します。
- 全血および組織希釈液の1 mLで細胞を再懸濁する。マウスリンパ球分離培地を3 mL加え、室温で300xgで20分間細胞を遠心分離する。
- 乳白色リンパ球の層(すなわち、上から2番目の層)を収集し、PBSで2倍に洗浄し、自動細胞カウンターでカウントする。
- iNKT細胞の精製のための磁気活性化細胞選別(MACS)陽性選択戦略
注:CD1d四量種の前処理のために、1mg/mLのα-GalcerをTween-20の0.5%およびNaClの0.9%で200 μg/mLに希釈し、得られた溶液の5μLをCD1d四量式溶液の100μLに添加した。混合物を室温で12時間インキュベートし、使用のために4°Cに置いた。TCR βを脱イオン水で80倍希釈した。他のすべての抗体は、ストック溶液として使用した。- 10個の7個の細胞を4°CPBSの100μLで再懸濁し、α-GalCer搭載CD1dテトラマー-PEを10μL加え、暗闇の中で15分間4°Cでインキュベートした。
- 細胞をPBSで2x洗浄し、PBSの80μLで再サスペンドする。
- 20 μLの抗PE-マイクロビーズを加え、暗闇の中で20分間4°Cでインキュベートします。
- PBSで2倍洗浄し、500μLのPBSで細胞を再懸濁します。
- 選別カラムをMACSソーターの磁場に入れ、500 μLのPBSですすいでください。
- ステップ 2.3.4 のセル懸濁液をソート列に追加し、フロースルーを収集し、PBS バッファーで 3 x をリンスします。
- 磁場を取り除き、ソート列からセルを収集します。この時点で、1 mL の PBS バッファーをソート列に追加し、一定の圧力でプランジャを迅速に押し込み、ラベル付けされたセルを収集チューブに駆動し、精製された iNKT 細胞を得ます。自動セル カウンターを使用してカウントします。
- iNKT細胞表現型の同定
- ステップ2.2.5と2.3.7から1 x 106細胞をそれぞれ取り出し、PBSの50 μLで再サスペンドします。
- 抗体インキュベーション:陰性対照管に抗体を添加しないで、α-GalCer-PE-CD1dテトラマーの0.5 μLまたは10 μLのFITC-TCR βを単一陽性コントロールチューブに添加する。サンプルチューブに0.5 μLのα-GalCer-PE-CD1dテトラマーと10 μLのFITC-TCR βを加えます。暗闇の中で30分間4°Cでインキュベートします。
- PBSの細胞を洗浄し、5分間200 x gで遠心分離します。
- 上清を捨て、Foxp3 Foxation/パーメアビレーション作動液の1 mLを加え、暗い時4°Cで45分間細胞をインキュベートする。
- 1xパーメアビライゼーションバッファーの働き溶液の1 mLを加え、5分間室温で500 x gの細胞を遠心分離します。
- 上清を捨てます。アレクサ・フルオール647マウスのアンチPLZFとPerCP-Cy 5.5マウスのアンチTベット(またはPerCP-Cy 5.5マウスアンチRORСtの1 μL)を暗闇の中で室温で30分間加えます。
- 洗浄のためのパーメアビライゼーションバッファーの働く溶液の2 mLに加える。
- 上清を廃棄し、細胞をPBSの500μLに再懸濁し、フローサイトメトリーで測定する。
- iNKT細胞の機能識別
- ステップ2.3.7から3 x 106 iNKT細胞を取り、1.5 mLのRPMI-1640不完全培地(すなわち血清なし)の12ウェルプレートに再懸濁します。
- フォルボルエステル(PMA、50ng/mL)とイオノマイシンカルシウム(IO、1μg/mL)を加え、CO2インキュベーターに24時間入れる。
- 細胞上清を収集し、メーカーのプロトコルに従って市販のCBAアッセイを使用して、IL-2、IL-17A、TNF-α、IL-6、IL-4、IFN-γ、およびIL-10の分泌レベルを検出します。
- RAマウスにおけるiNKT細胞の遊入経路に関する実験的研究
- DmSOにDiR染料(2.5mg/mL)を溶解します。
- iNKT細胞を6つのウェルプレートにRPMI-1640不完全培地で再懸濁します。密度は1×106細胞/mLである。
- DiR(5 μg/mL)溶液を加え、CO2インキュベーターで25分間インキュベートします。
- PBSで洗浄し、細胞を再懸濁(3 x 106/300 μL)して、DiR標識iNKT細胞(DiR-iNKT)を得る。
- 1%ペントバルビタールナトリウム(50mg/kg体重)を腹腔内に注入してマウスを麻酔する。適切に麻酔されたマウスは、つま先のピンチに後足離脱を示さない。画像化のための麻酔下での乾燥を防ぐために、マウスの目に獣医の軟膏を適用します。
- DiR-iNKT細胞をRAモデルでマウス1個あたり3 x106個のマウスに8日間注入する。インビボイメージングシステム(IVIS)を用いて、マウスの注射後0分、10分、30分、60分、および0日目(3時間後)、1、3、6、12、26、34、38、および42日間のiNKT細胞をモニタリングします。使用した励起波長は748nm、発光波長は780nm、露光時間は自動であった。
- 各観察の後、各マウスを別々のケージに入れ、胸骨の骨の痛さを維持します。麻酔からの回復まで観察する。
3. iNKT細胞を用いたRAマウスの導入免疫療法の評価
- RAマウスに対するiNKT細胞導入免疫療法
- マウスあたり3 x 106細胞iNKT細胞を尾静脈を通して注入する。8日前にモデル化した15匹のマウスを無作為に選択し、尾静脈注入によるステップ2.3.7からDiR標識を行わずにiNKT細胞を得る。
- iNKT細胞に対する養子免疫療法の有効性を評価する。
- マウスの足の厚さを測定し、足首関節の腫れを定量化し、ステップ1.2.1~1.2.2で説明したようにiNKT細胞を注入した後に体系的にスコアを付けます。
- ステップ 1.2.3 で説明したように、マウス関節の炎症細胞浸潤および関節変化を観察する。
- ステップ 1.2.4 で説明したように、IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、および IFN-γ の分泌レベルを決定します。
- iNKT細胞とサブセットの頻度を決定します。
- マウス胸腺を分離し、単一細胞懸濁液を調製する。
- リンパ球分離液でリンパ球を分離する。
- ステップ 2.4 で説明した iNKT セル周波数とサブグループ周波数を決定します。
- 統計分析
注: すべてのデータは平均値として表示されます ± SD. P < 0.05 の値は統計的に有意と考えられていました。- 分散の 1 要素分析 (ANOVA) を使用します。分散が満たされている場合は、LSD 検定を使用してさらに比較します。
- 分散が均一でない場合は、ノンパラメトリック検定を使用します。さらに比較のために、クラスカル-ウォリスH検定を使用します31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
モデル化後、関節炎指数スコアと足の厚さが増加しました。対照群と比較して、RAモデル群のつま先は、モデル化後6日目に赤い腫脹を示し始め、徐々に悪化した。14日で、足首関節の赤い腫れがピークに達し、その後徐々に軽減した。足の太さは同様に変更されました(P < 0.05) (図 1)。
炎症細胞浸潤は、モデリング後に有意に増加した。病的な結果は、RAモデルマウスの足首滑膜組織における炎症細胞の浸潤度が異なる段階で異なっていることを示した。14日目のポストモデリングでピーク炎症が起こった(図2)。
炎症性サイトカインが増加し、血清中の抗炎症性サイトカインが減少した。RAモデル群では、炎症促進サイトカイン(TNF-α、IFN-γ、およびIL-6)の血清レベルが有意に増加した(P< 0.05)、抗炎症性サイトカイン(IL-4およびIL-10)が有意に減少した(P<0.05)(図3)。
インビボ誘導およびインビトロ精製により得られたiNKT細胞は、主にiNKT2細胞サブセットから構成され、これは抗炎症性サイトカインを分泌する。α-GalCerの腹腔内注射は、体内のiNKT細胞の頻度を増加させ、主にiNKT2サブグループ。正常なDBA/1マウスにおける脾臓iNKT細胞の頻度はリンパ球の約2%であったが(iNKT2は約5%、iNKT1は約15%、iNKT17は約10%)。α-GalCerの腹腔内注射の3日後、iNKT細胞の頻度はリンパ球の約6%であった(iNKT2は約82%、iNKT1は約1.5%、iNKT17は約0.5%)であった。MACSによる精製後、iNKT細胞の純度は85%を超え、そのうちiNKT2は約92%、iNKT1は約0.4%、iNKT17は約0.2%であった(図4)。
収穫されたiNKT細胞は、より多くの抗炎症サイトカインと少ない炎症性サイトカインを分泌した。iNKT細胞を正常マウスの脾臓から単離し、マウス脾臓(α-GalCer群)の3日後にα-GalCerを腹腔内注射し、細胞培養上清におけるサイトカインレベルを調べた。対照群と比較して、α-GalCer群の炎症性サイトカイン(IL-17A、TNF-α、IFN-γ、およびIL-6)が有意に減少し(P< 0.05)、および抗炎症性サイトカインIL-4レベルが有意に上昇した(P< 0.05)。IL-10(P>0.05)に有意差はなかった。IFN-γ/IL-4比が有意に減少しました(P < 0.05) (図 5)。
IVISトレースは、DiR-iNKT細胞がRAマウスに採用注入され、すぐに肺の注射後に現れたことを確認した。肝臓では10分で、脾臓では60分で蛍光が検出された(図6AI、6AII、6AIII)。孤立した器官では、胸腺およびうねりのリンパ節に1時間以内に蛍光はなかった。0分で肺で蛍光が検出され、蛍光強度は10分で最も大きく、その後徐々に弱まった。0分で肝臓に弱い蛍光があり、徐々に増加した。脾臓の蛍光を30分で検出し、徐々に増加させた(図6AIV,6C)。
DiR-iNKT細胞をRAマウスに注入した後、蛍光は主に肝臓および脾臓に濃縮された(図6BI、6BII、6BIII)が、胸腺および鼠ゲンリンパ節には蛍光はなかった。脾臓と肝臓は、細胞注入後1日目に蛍光強度が最も高かったが、徐々に弱くなった。34日目、表面蛍光は消失した。42日目に、孤立した器官の蛍光が消失した。細胞注入後の肝臓の平均蛍光シグナル強度は脾臓のそれよりも高かった(図6BIV,6D)。
INKT細胞をRAマウスに導入することで、疾患の進行を緩和し、臨床症状を改善することができます。iNKT細胞は、採用注入後のRAマウスの臨床症状を改善した。未治療のRAモデル群と比較して、細胞治療群における足首関節の腫脹を緩和し、そして、そのスコアは10日目から20日目の後に有意に減少した。細胞治療群の同じ期間において、RAモデル群と比較して滑膜組織における炎症性細胞浸潤が減少した(図2)。
胸腺iNKT細胞の成功率は有意に増加した(P < 0.05)。健常対照群と比較して、RAモデル群では、胸腺中のiNKT細胞の割合が進行(11日目)で減少し、ピーク(14日目)、および回復(20日目)段階が進行する。ピーク炎症では、これらの値は最小限であり、寛解段階で反発した。細胞療法群は、RAモデル群(P<0.05)と比較してピーク(14日目)および回復(20日目)段階でのiNKT細胞の有意な増加率を示した(図7)。
iNKT細胞注入後、胸腺におけるiNKT1およびiNKT17の成功率が低下し、iNKT2が増加した。対照群と比較して、11日目のRAモデル群ではiNKT1およびiNKT17において胸腺のiNKT1は有意に増加し(P< 0.05)、そしてiNKT2は有意に減少した(P< 0.05)。14日目、胸腺のiNKT1およびiNKT2は有意に増加し(P< 0.05)、iNKT17は有意に減少した(P< 0.05)。20日目、胸腺のiNKT1は有意に増加し(P< 0.05)、iNKT2は有意に変化しなかった(P> 0.05)、iNKT17は有意に減少した(P< 0.05)。iNKT1/iNKT2比は、3段階すべて(P < 0.05)で有意に増加しました。
RAモデル群と比較して、α-GalCerおよび細胞療法群における11日目に、iNKT1およびiNKT17は有意に低かった(P< 0.05)およびiNKT2は有意に増加した(P< 0.05)。14日目、α-GalCer群iNKT1およびiNKT17では有意に減少し(P < 0.05)、iNKT2は有意に変化しなかった(P> 0.05)。細胞療法群iNKT1およびiNKT17では有意に減少した(P< 0.05)、iNKT2は有意に増加した(P< 0.05)。20日目、α-GalCer群ではiNKT1が有意に減少し(P< 0.05)、iNKT2は有意に変化しなかった(P> 0.05)、iNKT17は有意に増加した(P< 0.05);細胞療法群iNKT1およびiNKT17では有意に減少した(P< 0.05)、iNKT2は有意に増加した(P< 0.05)。iNKT1/iNKT2の比率は、3つの段階(P < 0.05)(図7)の間で有意に減少しました。
血清中の炎症性サイトカインのレベルが増加し、iNKT細胞注入後に抗炎症性サイトカインが減少した。RAモデル群では、TNF-α、IFN-γ、およびIL-6in血清のレベルが有意に増加し(P< 0.05)、IL-4およびIL-10は対照群と比較して著しく減少した量(P<0.05)を示した。iNKT細胞療法群では、炎症の進行およびピーク段階(P< 0.05)で血清中のTNF-α、IFN-γ、およびIL-6のレベルが有意に低下し、IL-4およびIL-10はRAモデル群と比較して有意に増加した(P< 0.05)。
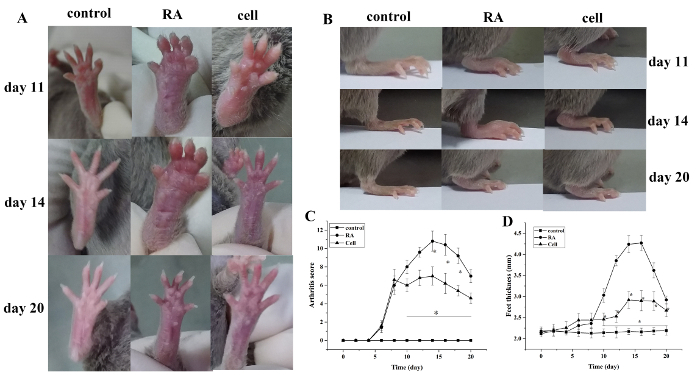
図1:マウスの関節腫れスコアと足の厚さの変化。(A) マウスの足首関節の腫脹(B,D)異なるグループの足の厚さ。(C) 臨床スコアは異なるグループで変化する。マウスの関節炎スコアと足の厚さは、モデル化後10~20日(すなわち、治療後2~12日)に細胞治療群で有意に減少した。*P < 0.05 対コントロール, **P < 0.05 vs. RA.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:足首関節の病理組織学的変化炎症性細胞の浸潤は細胞療法群において有意に減少し、14日目にRA群で有意に増加した。◊ = 炎症細胞。(A)100x (B) 400x.この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:各群における血清サイトカインのレベル。(A) モデル化後11日目のマウスにおける血清サイトカインレベル(pg/mL)。(B) モデル化後14日目のマウスにおける血清サイトカインレベル(pg/mL)。TNF-α、IFN-γ、IL-6のレベルは著しく低下し、細胞療法群におけるIL-4およびIL-10のレベルは有意に増加した。P < 0.05 とコントロールのbP < 0.05 対 RA.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4: iNKT細胞の割合とiNKT細胞サブセットの割合(A,B,C)正常マウスにおけるiNKT2の割合は約5%である。(D,E,F)iNKT2の割合は、インビボ誘導後約82%である。(G, H, I)iNKT2の割合は、MACS精製後92%以上である。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:マウス脾臓由来iNKT細胞の培養上清におけるサイトカインレベルIL-4のレベルは著しく増加し、IL-17A、TNF-α、IFN-γ、およびIL-6のレベルは著しく低下した。P < 0.05 とコントロールのこの図の大きなバージョンを表示するには、ここをクリックしてください。

図6:キャリパーIVISルミナIIによってトレースされたiNKT細胞の分布と代謝(A,B)iNKT細胞の移行経路(C) 脾臓、肝臓、肺における平均蛍光シグナル強度の変化。(D) 脾臓および肝臓における平均蛍光シグナル強度の変化。蛍光は0分で肺と肝臓で検出され、徐々に増加した。蛍光強度は肺で10分で最も強く、その後減少した。脾臓の蛍光を30分で検出し、その後徐々に増加した。42日目に全臓器の蛍光が消失した。肝臓の平均蛍光シグナル強度は、細胞注入後の脾臓よりも高い(I:スピネ;II:横横の嘘。III:傾向がある;IV: 単離された組織;a: コントロールグループ;b: 細胞注入群;1、2、3、4、5は胸腺、脾臓、肝臓、うねりリンパ節、肺である)。この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:マウス胸腺におけるiNKTとそのサブセットの割合。(A) iNKT細胞の11、14、および20日のモデル化後の割合。(B) iNKT1/iNKT2 の比率。(C,D,E)iNKT1、iNKT2、および iNKT17 のレート。11日、14日目、および20日目(細胞療法後の3日目、6日目、および12日目)において、iNKT細胞の割合は有意に増加し、iNKT1およびiNKT17は細胞療法群において著しく減少し、iNKT2は有意に増加した。P < 0.05 対コントロールです。bP < 0.05 対 RA.この図の大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT細胞は、自然免疫と適応免疫を橋渡しする特殊なT細胞であり、主にCD4++ /CD8+胸腺細胞から開発されています。iNKT細胞は多様な免疫調節機能を有し、異なるサイトカイン23の直接接触および分泌により他の免疫細胞と相互作用し、樹状細胞(DC)、マクロファージ、好中球、B細胞、T細胞、およびNK細胞の分化および発達24に影響を及ぼす。α-GalCerはスポンジから抽出された古典的なiNKT細胞特異的な活性化剤である。いくつかの研究は、脾臓iNKT細胞周波数が3日間のα-GalCerの単一腹腔注射の後にピークに達することを示しています25.我々の実験結果は、主に抗炎症性サイトカインIL-4およびIL-10を分泌するα-GalCerの腹腔内注射後3日間、マウス脾臓におけるiNKT2サブセットの優位性を示した。また、炎症期にRAモデルマウスでiNKT1細胞およびiNKT17細胞の豊富さが減少し、iNKT1細胞とiNKT17細胞の細胞が増加したこともわかりました。そこで、マウス脾臓のiNKT細胞を、α-GalCerの腹腔内注射により3日間単離した。これらは、RAモデルマウスを治療するために使用した。iNKT2サブセットの割合は、インビボ誘導後82%であった。MACSによる精製後、iNKT2の割合は92%を超えた。
iNKT細胞の特異的活性化は、RAに対する新規な生物学的処置として採用されている。堀越らの21は、α-GalCerの皮内注射がCD4+T細胞の数を有意に阻害することによってGPIペプチド誘発性関節炎を阻害することを実証した。千葉ら26は、合成iNKT2選択的活性化剤OCHの繰り返し注射がCIAを阻害したことを示し、一方α-GalCerはわずかに抑制効果を示した。RAモデルマウスに脾臓由来のiNKTを注入し、その結果、細胞治療群の足首関節の腫脹の程度と関節に浸潤する炎症性細胞の数が減少することを示した。血清抗炎症サイトカイン(例えば、IL-4およびIL-10)のレベルが上昇し、炎症促進サイトカイン(例えば、IFN-γおよびTNF-α)の分泌が減少した。iNKT細胞の標的活性化は、RAの進行を緩和し、炎症反応を阻害することができた。また、胸腺のiNKTの頻度を検出し、RAモデル群のiNKT細胞数が大幅に減少し、iNKT細胞の注入後に胸腺の頻度が増加することを発見しました。血液胸腺バリアシステムの存在により、後の実験で確認された胸腺におけるiNKTのレベルの採用増加は考慮されなかった。胸腺におけるiNKT細胞の亜集団の検出により、健康な対照群と比較して、炎症の3段階および炎症のピーク時にRAモデル群のiNKT1細胞数が有意に増加し、炎症のピーク時にiNKT2サブセットの割合が増加し始めた。特に、iNKT1サブセットはRAの初期炎症に関与し、iNKT2サブセットは炎症を抑制する上で重要な役割を果たしてもよい。RAモデル群と比較して、細胞療法群のiNKT1サブセットは炎症期に有意に減少し、iNKT2サブセットは炎症の初期および寛解段階で有意に増加した。これらの結果から、特異的表現型および機能性iNKT細胞の導入により、RAにおけるiNKT細胞の頻度が有意に増加し、iNKT細胞サブセットの割合が変化することが分かりました。
IVISを使用して、養子注入後のマウスにおけるiNKT細胞の分布を観察し、注入後10分で肺内で最も高い蛍光強度を見つけ、徐々に衰退した。肝臓は弱い蛍光を示し、2日後に徐々に増加し、徐々に減少した。蛍光は30分で脾臓で検出され、2日後に徐々に増加し、減少した。肝臓の平均蛍光強度は脾臓のそれよりも強かった。しかし、胸腺およびうねりのリンパ節では蛍光は検出されなかった。肺の蛍光検出は、iNKT細胞を尾静脈に注入することに起因する可能性があります。これらの細胞は、血液と肺に循環します.肝臓は脾臓よりも早く蛍光を発し、肝臓の平均蛍光強度は脾臓よりも強い。iNKT細胞のこの優遇蓄積は、主な代謝器官である肝臓の豊富な血管に起因する可能性がある。胸腺では蛍光は検出されなかった。これは、iNKT細胞の侵入を妨げる可能性のある造層バリアが原因である可能性があります。蛍光は、おそらく少ないiNKT細胞がリンパ節に入り、検出の最小レベルに達しなかったため、口内リンパ節で検出されませんでした。また、尾静脈に注入されたiNKT細胞がリンパ節に入らない可能性があると推測できる。したがって、胸腺のiNKT細胞の発達と分化は、マウスへの注入後のサイトカイン経路を介して調節される可能性があると仮定する。これはさらに解明する必要があります。
GPIは、ほとんどのRA患者の血清および滑液中に存在し、臨床RA診断27に一般的に使用される検査である。Bruns et al.28 GPI配列とは異なる長さのペプチドを使用し、DBA/1マウスを免疫して6つの免疫優勢T細胞エピトープを同定した。このうち3つは関節形成性であった。関節炎の95%発生率を>持つペプチドは、hGPI 325-339およびhGPI469-483である。我々の以前の研究は、RAモデルを確立するために2つのペプチドの混合物の使用が単一のペプチドよりも優れていることを実証した。得られたRAモデルでは、マウスのつま先と関節が6日目に赤く見え始め、14日目に炎症のピークに達した。炎症性細胞浸潤は関節の滑膜組織における組織過形成を伴い、炎症性細胞浸潤は14日目に最も重篤であった。炎症のピーク時に胸腺でiNKT細胞数が有意に減少し、これはRA患者29におけるiNKT細胞の傾向と一致した。さらにiNKT細胞サブセットの検出により、胸腺におけるiNKT1およびiNKT17の頻度が増加し、炎症の進行中にiNKT2の頻度が減少した(11日目)。加えて、進行中にIFN-γおよびIL-17Aの血清サイトカインのレベルが増加し(11日目)炎症のピーク(14日目)、RAモデルマウス30におけるTh1およびTh17サブグループの同様の偏光を示唆する。そこで、hGPI325-339とhGPI469-483混合ポリペプチド断片によって誘導されたRAマウスモデルは、CD4+T細胞過剰増殖およびiNKT細胞欠損の特性を示し、これはRA患者のそれと同様であり、RA細胞の免疫を調べるための理想的な動物モデルとして用いられ得る。これらの結果は、我々の以前の研究のものと一致し、hGPIs誘発RAモデル31の安定性を実証した。
一般に、混合G6PIペプチドによって誘導されるRAマウスモデルは、RA患者におけるCD4+ T細胞、iNKT細胞、および関連サイトカインの変化をシミュレートすることができる。これは、RAの詳細な調査のための良いモデルを提供します。連続して、iNKT(主にiNKT2)は、α-GalCerの腹腔内注射によって誘導され、精製されたインビトロでRAの治療に使用した。Thサブセットの異常増殖によって引き起こされる免疫不均衡を補正し、RAの進行を緩和し、そして将来的にはRAの臨床治療のための新しい方法を提供し得る。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者らは、資金や利益相反を宣言していない。
Acknowledgments
我々の研究は、中国自然科学財団(NSFC)(81771755)、河北省の大学と大学の科学技術主要研究プロジェクト(ZD2017009)、河北大学動物実験センターによって支援されました。私たちは彼らのサポートに感謝しています。
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



