Summary
Este protocolo usa peptídeos mistos G6PI para construir modelos de artrite reumatoide que estão mais próximos do da artrite reumatoide humana em células CD4+ T e citocinas. Células T assassinas naturais invariantes de alta pureza (principalmente iNKT2) com fenótipos e funções específicas foram obtidas por indução in vivo e purificação in vitro para imunoterapia adotiva.
Abstract
Artrite reumatoide (RA) é uma doença inflamatória crônica autoimune complexa. A patogênese da doença está relacionada com células invariantes assassinas naturais T (iNKT). Pacientes com RA ativa apresentam menos células iNKT, função celular defeituosa e polarização excessiva de Th1. Neste estudo, foi estabelecido um modelo animal RA utilizando uma mistura de hGPI325-339 e hGPI469-483 peptídeos. As células iNKT foram obtidas por indução in vivo e purificação in vitro, seguidas de infusão em camundongos RA para imunoterapia adotiva. O rastreamento do sistema de imagem in vivo (IVIS) revelou que as células iNKT foram distribuídas principalmente no baço e fígado. No dia 12 após a terapia celular, a progressão da doença desacelerou significativamente, os sintomas clínicos foram aliviados, a abundância de células iNKT no timo aumentou, a proporção de iNKT1 no timo diminuiu, e os níveis de TNF-α, IFN-γ, e IL-6 em o soro diminuiu. A imunoterapia adotiva das células iNKT restaurou o equilíbrio das células imunes e corrigiu a inflamação excessiva do corpo.
Introduction
A artrite reumatoide (RA) é uma doença autoimune caracterizada por incomodade crônica e progressiva com incidência de 0,5 a 1%1,2. A patogênese subjacente é atribuída à proliferação anormal das células CD4+ e CD8+ T, manifestadas por um aumento na proporção de células CD4+IFN-γ+ e CD4+IL-17A+ T, e o número reduzido de células CD4+IL-4+ e CD4+CD25+FoxP3+ T. Portanto, a secreção de citocinas inflamatórias é aumentada, e uma reação inflamatória excessiva destrói o equilíbrio nativo e a função de tolerância do sistema imunológico do corpo. Além disso, o ajudante T linfócito (Th) 1 células que penetram na articulação agravam a resposta inflamatória e danos articulares. Portanto, a inibição da resposta inflamatória excessiva e da restauração da tolerância imunológica e do equilíbrio imunológico são fundamentais para o tratamento de RA3,4.
As células iNKT têm funções e características das células NK e t. As células iNKT abrigam uma cadeia de células T distintae e invariante (TCR) com repertórios limitados de β-cadeia TCR5 e reconhecem o antígeno glicolipídico apresentado pelo maior complexo de histocompatibilidade (MHC) classe I CD1d na superfície das células presentes em antígenos. Mitsuo et al.6 detectaram um grande número de células iNKT e defeitos funcionais em muitas doenças autoimunes, incluindo ra. Aurore et al.7 demonstraram que as células iNKT têm um efeito positivo na manutenção da tolerância autoimune e que quando o número e a função das células iNKT são restaurados, a doença é aliviada. Além disso, Miellot-Gafsou et al.8 descobriram que as células iNKT não só revogaram a doença, mas também aumentaram a progressão da doença. Esses resultados contraditórios sugerem que as células iNKT são células T heterogêneas, e a função de diferentes subconjuntos pode ser revertida. Em um estudo clínico de RA, a frequência de células iNKT correlacionada com o escore da atividade da doença9. Os resultados também confirmaram que a frequência do iNKT foi reduzida em pacientes com RA, o número de subconjuntos de células CD4+IFN-γ+ T aumentou, e os níveis secretos de citocinas inflamatórias IFN-γ e TNF-α aumentaram10,11. Além disso, Sharif et al.12 investigados diabetes tipo 1 (T1D) e descobriram que a infusão seletiva de células iNKT upregulamentou a expressão da citocina inflamatória IL-4, manteve a tolerância imune e impediu o desenvolvimento do diabetes tipo 1. Portanto, a infusão adotiva de células iNKT específicas ou ativação direcionada de células iNKT aumenta o nível de células iNKT em pacientes com RA, o que pode ser um avanço no tratamento de RA.
A imunoterapia celular é atualmente de grande interesse e tem sido amplamente utilizada na terapia contra o câncer. No entanto, as células iNKT são células imunoreguladoras raras e heterogêneas (apenas 0,3% do número total de PBMCs)13, o que limita potenciais aplicações clínicas. Essas células são divididas principalmente em três subpopulações: 1) células iNKT1, que têm uma alta expressão de proteína promielocítica de zinco -finger protein (PLZF) e fator de transcrição t-box (T-bet); 2) células iNKT2 com expressão intermediária de PLZF e proteína de ligação GATA 3 (GATA3); 3) células iNKT17 com baixa expressão de PLZF e receptor nuclear órfão relacionado a retinóides (ROR)-γt que secretam IFN-γ, IL-4 e IL-1714. Células iNKT ativadas secretam citocinas semelhantes a Th1, Th2 e Th17, que determinam os diferentes efeitos imunomodulatórios das células iNKT15. Os efeitos imunomodulatórios e imunoterapêuticos da ativação específica de várias subpopulações de células iNKT são diferentes. Portanto, a seleção de fenótipos específicos de células iNKT (principalmente iNKT2) com funções anti-inflamatórias para regular a resposta imune do corpo pode corrigir o desequilíbrio imunológico e as doenças imunológicas em RA.
O estabelecimento de um modelo animal ideal é de grande importância para o tratamento e estudo da patogênese ra. Atualmente, os modelos animais mais usados e maduros incluem artrite induzida por colágeno, artrite adjuvante, artrite induzida por zimosan e artrite induzida por polissacarídeo16–17. No entanto, não há um modelo que possa simular totalmente todas as características do RA humano. Artrite induzida por colágeno tipo II (CIA) é um modelo clássico de artrite. A CIA é induzida pela imunização de camundongos com anticorpos monoclonais específicos de colágeno tipo II, refletindo a dependência de anticorpos desse modelo da doença. Benurs et al. descreveram um modelo com uma resposta imune sistêmica à isomerase glicose-6-fosfato (G6PI), que induz poliartrite simétrica periférica em cepas de camundongos suscetíveis18,19. Nesse modelo, o desenvolvimento da artrite depende de células T, células B e imunidade inata18,19,20. Horikoshi21 descobriu que os modelos RA resultantes da imunização de camundongos DBA/1 com fragmentos de polipeptídeo G6PI são mais semelhantes ao RA humano em termos de células CD4+ T e citocinas (ou seja, IL-6 e TNF-α) do que os modelos da CIA. Para aumentar o efeito estimulante no local de reconhecimento do TCR, os fragmentos de polipeptídeo misto do G6PI (hGPI325-339 e hGPI469-483) foram usados para imunizar camundongos DBA/1 para construir o modelo de camundongora RA. A taxa de sucesso dessa abordagem pode ser alta porque hGPI325-339 e hGPI469-483 são imunodominantes para respostas de células T restritas a Q I-A. Portanto, este modelo pode simular a superproliferação de células CD4+ T e defeitos celulares iNKT em pacientesRA 22. A pesquisa básica da imunopatologia ra estabeleceu as bases para nossa investigação mais aprofundada.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos os camundongos experimentais (150 no total) eram camundongos saudáveis de DBA/1 masculino, 6-8 semanas de idade (20,0 ± 1,5 g), criados em um ambiente específico sem patógenos (FPS). Não há tratamento especial antes de ser modelo. O experimento foi dividido em um grupo de controle saudável (15 camundongos), um grupo de controle de modelos (15 camundongos) e um grupo de terapia celular (55 camundongos). Este estudo foi aprovado pelo Comitê de Bem-Estar Animal e Ética da Universidade hebei.
1. Construindo o Modelo da Doença
- Duplicando o modelo animal RA
- Pesar 1,75 mg de hG6PI 325-339 e hG6PI 469-483 fragmentos e dissolvê-los em 5,25 mL de 4 °C de água destilada tripla.
- Dissolva o adjuvante completo da Freund (CFA) em um banho de água de 50 °C, desenhe 5,25 mL em outro tubo de centrífuga de 10 mL e esfrie-o para uso.
- Coloque a mistura de solução hG6PI e solução CFA em uma unidade de emulsificação artificial com duas seringas de vidro conectadas.
- Empurre a seringa a uma velocidade e frequência constantes de 10-20x por min para emulsificar completamente a solução de peptídeo misto e a solução CFA. Realize a operação em um banho de gelo, e mantenha as gotículas de emulsão na água por 10 min após a conclusão da emulsificação sem dispersão.
- Injete 150 μL de hG6PIs emulsificados na raiz da cauda do mouse subcutâneamente.
- Injete 200 mg de toxina de Pertussis no mouse intraperitonely a 0 h e 48 h após a injeção hG6PI.
- Verificação experimental do modelo RA
- Meça a espessura da pata do rato com uma pinça Vernier (2x por dia).
- Observe e marque o grau de vermelhidão e inchaço do pé. Use os seguintes critérios de pontuação: 1) dedos com leve inchaço; 2) pedis dorsum e almofada de pé com inchaço vermelho claro; 3) tornozelo com inchaço vermelho.
- Eutanizar os camundongos anestesia profunda por injeção intraperitoneal de 1% de pentobarbital de sódio (50 mg/kg de peso corporal) 14 dias após a modelagem e remover as patas para a coloração de HE.
- Determine os níveis de secreção do soro IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α e IFN-γ usando um ensaio de matriz de bead citométrica comercial (CBA) de acordo com o protocolo do fabricante.
2. Obtenção de células iNKT com terapia celular adotiva
- Indução direcional de células iNKT
- Injete camundongos normais intraperitoneicamente com α-GalCer (0,1 mg/kg de peso corporal).
- Isolamento de células iNKT
- Três dias após a modelagem, injete camundongos intraperitonealmente com 1% pentobarbital de sódio (50 mg/kg de peso corporal) para anestesia. Ratos adequadamente anestesiados não mostram uma resposta de retirada da pata traseira a uma pitada de dedo do pé.
- Isole o baço de um mouse DBA/1 depois de injetá-lo intraperitoneticamente com α-GalCer. Prepare uma única suspensão celular cortando e moendo o baço em uma peneira de malha de 200.
- Lave a suspensão celular com PBS, centrífuga a 200 x g por 5 min, e descarte o supernatante. Repetir.
- Resuspenda as células com 1 mL de solução de diluição de sangue inteiro e tecido. Adicione 3 mL de meio de separação de linfócitos de camundongos e, em seguida, centrífuga as células por 20 min a 300 x g à temperatura ambiente.
- Colete a camada de linfócitos brancos leitosos (ou seja, a segunda camada da parte superior), lave-a 2x com PBS e conte com um contador de células automatizado.
- Estratégia de seleção positiva de classificação celular ativada magnética (MACS)para purificação de células iNKT
NOTA: Para o pré-tratamento dos tetramers CD1d, 1 mg/mL de α-Galcer foi diluído a 200 μg/mL com 0,5% de Tween-20 e 0,9% da NaCl, e 5 μL da solução resultante foi adicionado a 100 μL da solução tetramer CD1dd. A mistura foi incubada por 12h à temperatura ambiente e colocada a 4 °C para uso. O tCR β foi diluído 80x com água deionizada. Todos os outros anticorpos foram usados como solução de estoque.- Resuspender 107 células com 100 μL de PBS 4 °C, adicionar 10 μL de CD1d Tetramer-PE carregado α-GalCer, e incuba-las a 4 °C por 15 min no escuro.
- Lave as células 2x com PBS e resuspenda-as em 80 μL de PBS.
- Adicione 20 μL de anti-PE-MicroBeads e incuba-as a 4 °C por 20 min no escuro.
- Lave-os 2x com PBS e resuspenda as células com 500 μL de PBS.
- Coloque a coluna de classificação no campo magnético do macs sorter e enxágue com 500 μL de PBS.
- Adicione a suspensão celular da etapa 2.3.4 à coluna de classificação, colete o fluxo e enxágue 3x com tampão PBS.
- Remova o campo magnético e colete as células da coluna de classificação. Neste ponto, adicione 1 mL de tampão PBS à coluna de classificação, e empurre rapidamente o êmbolo a uma pressão constante para levar as células rotuladas para o tubo de coleta e obter células iNKT purificadas. Conte com um contador de celular automatizado.
- Identificação do fenótipo celular iNKT
- Tome 1 x 106 células das etapas 2.2.5 e 2.3.7, respectivamente, e resuspenda-as em 50 μL de PBS.
- Incubação anticorpo: Não adicione o anticorpo ao tubo de controle negativo, adicione 0,5 μL de α-GalCer-PE-CD1d Tetramer ou 10 μL de β FITC-TCR no único tubo de controle positivo. Adicione 0,5 μL de α-GalCer-PE-CD1d tetramer e 10 μL de fitc-TCR β no tubo de amostra. Incuba-os a 4 °C por 30 min no escuro.
- Lave as células na PBS e, em seguida, centrífuga a 200 x g por 5 min.
- Descarte o supernatante, adicione 1 mL da foxation/solução de trabalho foxp3/permeabilização, e incuba rastizar as células por 45 min a 4 °C no escuro.
- Adicione 1 mL de 1x solução de trabalho buffer de permeabilização e centrífuga as células em temperatura ambiente por 500 x g em temperatura ambiente por 5 min.
- Descarte o supernatante. Adicione 1 μL de Alexa Fluor 647 mouse Anti-PLZF e 1 μL de perCP-Cy 5.5 mouse anti-T-bet (ou 1 μL de PerCP-Cy 5.5 mouse anti-RORΥt) por 30 min à temperatura ambiente no escuro.
- Adicione a 2 mL da solução de trabalho buffer de permeabilização para limpeza.
- Descarte o supernatante, resuspenda as células em 500 μL de PBS e meça por citometria de fluxo.
- Identificação funcional de células iNKT
- Tome 3 x 106 células iNKT a partir da etapa 2.3.7 e resuspenda-as em 12 placas de poço com 1,5 mL de RPMI-1640 incompleto médio (ou seja, sem soro).
- Adicione phorbol ester (PMA, 50 ng/mL) e ionomicina de cálcio (IO, 1 μg/mL) e coloque em uma incubadora de CO2 por 24 h.
- Colete o supernatant celular e detecte os níveis de secreção de IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ e IL-10 usando um ensaio comercial da CBA de acordo com o protocolo do fabricante.
- Estudo experimental sobre a via migratória de células iNKT em camundongos RA
- Dissolva dir dye (2,5 mg/mL) em DMSO.
- Resuspender as células iNKT em 6 placas de poço com rpmI-1640 incompleto médio. A densidade é de 1 × 106 células/mL.
- Adicione a solução DiR (5 μg/mL) e incuba em uma incubadora de CO2 por 25 min.
- Lave com PBS e resuspenda as células (3 x 106/300 μL) para obter células iNKT com rótulo diR (DiR-iNKT).
- Injete 1% de pentobarbital de sódio (50 mg/kg de peso corporal) intraperitoneicamente para anestesiar os camundongos. Ratos adequadamente anestesiados não mostram uma retirada da pata traseira para beliscar os dedos dos dedos. Aplique pomada veterinária aos olhos do camundongo para evitar a secura enquanto estiver anestesia para imagem.
- Injete as células DiR-iNKT 3 x 106 por mouse na veia traseira com o modelo RA por 8 dias. Monitore as células iNKT em camundongos pós-injeção por 0 min, 10 min, 30 min, 60 min e dia 0 (após 3 h), 1, 3, 6, 12, 26, 34, 38 e 42 dias usando um animal pequeno no sistema de imagem vivo (IVIS). O comprimento de onda de excitação usado foi de 748 nm, o comprimento de onda de emissões era de 780 nm, e o tempo de exposição era automático.
- Coloque cada rato em uma gaiola separada após cada observação e mantenha a rerecência esnaciada. Observe até a recuperação da anestesia.
3. Avaliação da Imunoterapia Adotiva de Camundongos RA com células iNKT
- Imunoterapia adotiva celular iNKT para ratos RA
- Injete 3 x 106 células células iNKT células por mouse através da veia traseira. Selecione aleatoriamente 15 ratos que foram modelados 8 dias antes e obtenham células iNKT sem rotulagem DiR a partir da etapa 2.3.7 pela infusão da veia traseira.
- Avalie a eficácia da imunoterapia adotiva para células iNKT.
- Meça a espessura da pata do camundongo, quantifique o inchaço da articulação do tornozelo e escore sistematicamente após a infusão de células iNKT como descrito nos passos 1.2.1-1.2.2.
- Observe a infiltração celular inflamatória e as alterações articulares das articulações do camundongo, conforme descrito na etapa 1.2.3.
- Determine os níveis de secreção de IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α e IFN-γ como descrito na etapa 1.2.4.
- Determine a frequência de células e subconjuntos iNKT.
- Isole o tímo do rato e prepare uma suspensão de uma única célula.
- Separe os linfócitos com fluido de separação linfócito.
- Determine a frequência celular iNKT e a frequência do subgrupo conforme descrito na etapa 2.4.
- Análise estatística
NOTA: Todos os dados são apresentados como média ± Valores sd. de P < 0,05 foram considerados estatisticamente significativos.- Use uma análise de um fator de variância (ANOVA). Se a variância estiver satisfeita, use o teste LSD para maior comparação.
- Se a variância não for uniforme, use o teste não paramétrico. Use o teste Kruskal-Wallis H para comparação adicional31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A pontuação do índice de artrite e a espessura da pata aumentaram após a modelagem. Em comparação com o grupo controle, os dedos do grupo modelo RA começaram a mostrar inchaço vermelho em 6 dias após a modelagem, com agravamento gradual. Aos 14 dias, o inchaço vermelho na articulação do tornozelo atingiu o pico, seguido de alívio gradual. A espessura da pata mudou de forma semelhante (P < 0,05) (Figura 1).
A infiltração celular inflamatória aumentou significativamente após a modelagem. Os resultados patológicos mostraram que o grau de infiltração de células inflamatórias no tecido sinovial do tornozelo dos camundongos modelo RA era diferente em diferentes estágios. A inflamação máxima ocorreu no dia 14 após a modelagem(Figura 2).
Citocinas inflamatórias aumentaram e citocinas anti-inflamatórias diminuíram no soro. No grupo modelo RA, os níveis de soro de citocinas pró-inflamatórias (TNF-α, IFN-γ e IL-6) aumentaram significativamente (P < 0,05), enquanto citocinas anti-inflamatórias (IL-4 e IL-10) diminuíram significativamente (P < 0,05) (Figura 3).
As células iNKT obtidas por indução in vivo e purificação in vitro consistiam principalmente de subconjuntos celulares iNKT2, que secretam citocinas anti-inflamatórias. A injeção intraperitoneal de α-GalCer aumentou a frequência de células iNKT no corpo, predominantemente o subgrupo iNKT2. A frequência de células iNKT de baço em camundongos DBA/1 normais foi de cerca de 2% dos linfócitos, (iNKT2 era de cerca de 5%, iNKT1 cerca de 15%, iNKT17 cerca de 10%). Três dias após a injeção intraperitoneal de α-GalCer, a frequência das células iNKT foi de cerca de 6% dos linfócitos, (iNKT2 era de cerca de 82%, iNKT1 cerca de 1,5%, e iNKT17 cerca de 0,5%). Após a purificação pelo MACS, a pureza das células iNKT foi superior a 85%, das quais o iNKT2 foi de cerca de 92%, iNKT1 cerca de 0,4%, e iNKT17 cerca de 0,2%(Figura 4).
As células iNKT colhidas secretavam mais citocinas anti-inflamatórias e menos citocinas inflamatórias. As células iNKT foram isoladas dos baços de camundongos normais e injetadas intraperitoneicamente com α-GalCer 3 dias após o baço do rato (grupo α-GalCer) e os níveis de citocina na cultura celular supernatant foram examinados. Em comparação com o grupo controle, as citocinas inflamatórias (IL-17A, TNF-α, IFN-γ e IL-6) do grupo α-GalCer diminuíram significativamente(P < 0,05), e o nível anti-inflamatório de citocina IL-4 aumentou significativamente (P < 0,05). Não houve diferença significativa no IL-10 (P > 0,05). A relação IFN-γ/IL-4 diminuiu significativamente (P < 0,05) (Figura 5).
O rastreamento IVIS confirmou que as células DiR-iNKT foram adotadas em camundongos RA e imediatamente apareceram nos pulmões após a injeção. A fluorescência foi detectada no fígado a 10 min e no baço a 60 min (Figura 6IA, 6AII, 6AIII). Nos órgãos isolados, não houve fluorescência nos linfonodos e linfáticos inguinal dentro de 1h. A fluorescência foi detectada nos pulmões a 0 min, a intensidade da fluorescência foi a maior aos 10 minutos, e então gradualmente enfraquecida. Houve fluorescência fraca no fígado a 0 min, e então ele gradualmente aumentou. A fluorescência no baço foi detectada aos 30 min e, em seguida, gradualmente aumentada (Figura 6AIV, 6C).
Após a infusão de células DiR-iNKT em camundongos RA, a fluorescência estava concentrada principalmente no fígado e no baço (Figura 6BI, 6BII, 6BIII), mas não houve fluorescência nos linfonodos e linfáticos inguinal. O baço e o fígado tiveram a maior intensidade de fluorescência no primeiro dia após a infusão celular, mas gradualmente enfraqueceu. No dia 34, a fluorescência superficial desapareceu. No dia 42, a fluorescência dos órgãos isolados desapareceu. A intensidade média do sinal de fluorescência do fígado após a infusão celular foi maior que a do baço (Figura 6BIV, 6D).
A infusão adotiva de células iNKT em camundongos RA pode aliviar a progressão da doença e melhorar os sintomas clínicos. As células iNKT melhoraram os sintomas clínicos dos camundongos RA após a infusão adotiva. Em comparação com o grupo modelo RA não tratado, o inchaço da articulação do tornozelo foi aliviado no grupo de tratamento celular, e as pontuações diminuíram significativamente do dia 10 para o dia 20 após a injeção. No mesmo período do grupo de tratamento celular, a infiltração celular inflamatória no tecido sinovial foi reduzida em comparação com o grupo modelo RA (Figura 2).
As taxas de sucesso das células iNKT do thymus aumentaram significativamente (P < 0,05). Em comparação com o grupo de controle saudável, no grupo modelo RA as taxas de células iNKT no timo diminuíram no progresso (dia 11), pico (dia 14) e estágios de recuperação (dia 20). No pico de inflamação, esses valores foram mínimos e se recuperaram na fase de remissão. O grupo de terapia celular apresentou aumento significativo das taxas de células iNKT no pico (dia 14) e estágios de recuperação (dia 20) em comparação com o grupo modelo RA (P < 0,05) (Figura 7).
Após a infusão celular iNKT, a taxa de sucesso do iNKT1 e iNKT17 no timo diminuiu e o iNKT2 aumentou. Em comparação com o grupo controle, no grupo modelo RA no dia 11 iNKT1 e iNKT17 no timo significativamente aumentou (P < 0,05), e iNKT2 diminuiu significativamente (P < 0,05). No dia 14, iNKT1 e iNKT2 no timo aumentaram significativamente (P< 0,05) e iNKT17 diminuíram significativamente(P< 0,05). No dia 20, o iNKT1 no timo aumentou significativamente (P < 0,05), o iNKT2 não mudou significativamente (P > 0,05) e iNKT17 diminuiu significativamente (P < 0,05). A relação iNKT1/iNKT2 aumentou significativamente durante as três etapas (P < 0,05).
Em comparação com o grupo modelo RA, no dia 11 no α-GalCer e nos grupos de terapia celular, o iNKT1 e o iNKT17 foram significativamente mais baixos (P < 0,05) e iNKT2 aumentaram significativamente (P < 0,05). No dia 14, no grupo α-GalCer iNKT1 e iNKT17 diminuiu significativamente (P < 0,05), e o iNKT2 não mudou significativamente (P > 0,05); no grupo de terapia celular iNKT1 e iNKT17 diminuíram significativamente (P < 0,05) e iNKT2 aumentaram significativamente (P < 0,05). No dia 20, no grupo α-GalCer, o iNKT1 diminuiu significativamente (P < 0,05), o iNKT2 não mudou significativamente (P > 0,05) e iNKT17 significativamente aumentou (P < 0,05); no grupo de terapia celular iNKT1 e iNKT17 diminuíram significativamente (P < 0,05) e iNKT2 aumentaram significativamente (P < 0,05). A proporção de iNKT1/iNKT2 diminuiu significativamente durante os três estágios (P < 0,05) (Figura 7).
Os níveis de citocinas inflamatórias aumentaram no soro e as citocinas anti-inflamatórias foram diminuídas após a infusão celular iNKT. No grupo modelo RA, os níveis de TNF-α, IFN-γ e Soro IL-6in aumentaram significativamente (P < 0,05), enquanto IL-4 e IL-10 apresentaram quantidades significativamente reduzidas(P < 0,05) em comparação com o grupo controle. No grupo de terapia celular iNKT, os níveis de TNF-α, IFN-γ e IL-6 em soro diminuíram significativamente no progresso e estágios de pico de inflamação (P < 0,05), enquanto IL-4 e IL-10 aumentaram significativamente (P < 0,05) em comparação com o grupo modelo RA (Figura 3).
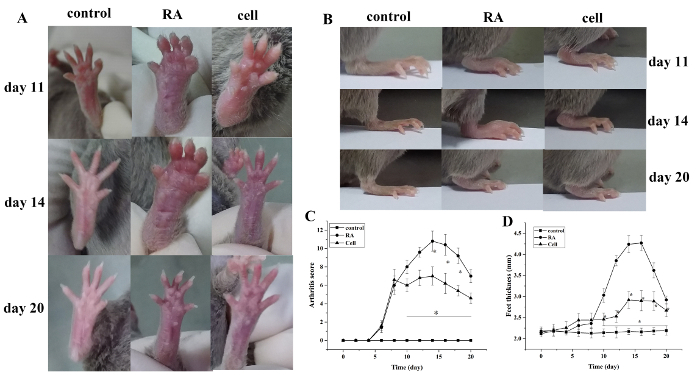
Figura 1: A pontuação de inchaço da articulação e a espessura da pata mudam em camundongos. (A)Inchaço da articulação do tornozelo em camundongos. (B,D) Espessura da pata em diferentes grupos. (C)Mudanças no escore clínico em diferentes grupos. O escore de artrite do camundongo e a espessura da pata foram significativamente reduzidos no grupo de terapia celular nos dias 10-20 (ou seja, 2-12 dias após o tratamento) após a modelagem. *P < 0,05 vs. controle, **P < 0,05 vs. RA. Clique aqui para ver uma versão maior deste valor.

Figura 2: Alterações histopatológicas da articulação do tornozelo. A infiltração de células inflamatórias foi significativamente reduzida no grupo de terapia celular e foi significativamente aumentada no grupo RA no dia 14. = = células inflamatórias. (A)100x (B) 400x. Clique aqui para ver uma versão maior deste valor.

Figura 3: Os níveis de citocinas séricas em cada grupo. (A)Citocinas de soro em camundongos no dia 11 após a modelagem (pg/mL). (B) Citocinas de soro em camundongos no dia 14 após a modelagem (pg/mL). Os níveis de TNF-α, IFN-γ e IL-6 diminuíram significativamente, e os níveis de IL-4 e IL-10 aumentaram significativamente no grupo de terapia celular. aP < 0,05 vs. controle. bP < 0,05 vs. RA. Clique aqui para ver uma versão maior deste valor.

Figura 4: As taxas de células iNKT e proporção de subconjuntos de células iNKT. (A,B,C) A taxa de iNKT2 em camundongos normais é de ~5%. (D,E,F) A taxa de iNKT2 é de cerca de 82% após a indução ao vivo. (G, H, I) A taxa de iNKT2 é superior a 92% após a purificação do MACS. Clique aqui para ver uma versão maior deste valor.

Figura 5: Níveis de citocina na cultura supernatante de células iNKT derivadas do baço de camundongos. O nível de IL-4 aumentou significativamente, e os níveis de IL-17A, TNF-α, IFN-γ e IL-6 diminuíram significativamente. aP < 0,05 vs. controle. Clique aqui para ver uma versão maior deste valor.

Figura 6: Distribuição e metabolismo de células iNKT rastreadas por caliper IVIS lumina II. (A,B) Caminho migratório das células iNKT. (C)A mudança da intensidade média do sinal de fluorescência no baço, fígado e pulmão. (D)A mudança da intensidade média do sinal de fluorescência no baço e fígado. A fluorescência foi detectada nos pulmões e fígado a 0 min, e depois gradualmente aumentou. A intensidade da fluorescência foi mais forte a 10 min nos pulmões e depois diminuiu. A fluorescência do baço foi detectada a 30 min, depois aumentou gradualmente. A fluorescência de todos os órgãos desapareceu no dia 42. A intensidade média do sinal de fluorescência do fígado é maior do que o baço após a infusão celular (I: supina; II: mentira lateral; III: propenso; IV: tecido isolado; a: grupo de controle; b: grupo de infusão celular; 1, 2, 3, 4, 5 são timo, baço, fígado, linfonodos inguinal, pulmões). Clique aqui para ver uma versão maior deste valor.

Figura 7: As taxas de iNKT e seus subconjuntos no tímo do mouse. (A)As taxas das células iNKT em 11, 14 e 20 dias após a modelagem. (B) A proporção de iNKT1/iNKT2. (C,D,E) A taxa de iNKT1, iNKT2 e iNKT17. Nos dias 11, 14 e 20 (dias 3, 6 e 12 após a terapia celular), as taxas de células iNKT aumentaram significativamente, o iNKT1 e o iNKT17 do timo diminuíram significativamente no grupo de terapia celular, e o iNKT2 foi significativamente aumentado. aP < 0,05 vs Controle. bP < 0,05 vs RA. Clique aqui para ver uma versão maior deste valor.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
As células iNKT são células T especiais que fazem a ponte imunidade inata e adaptativa e são desenvolvidas principalmente a partir de CD4++/CD8+ thymocytes. As células iNKT têm funções imunoregulatórias diversas e interagem com outras células imunes por contato direto e secreção de diferentes citocinas23, afetando células dendríticas (DCs), macrófagos, nêutrons, células B, células T e diferenciação e desenvolvimento celular NK24. α-GalCer é um ativador específico de células iNKT clássico extraído de esponjas. Vários estudos indicam que a frequência celular do baço iNKT atinge um pico após uma única injeção intraperitoneal de α-GalCer por 3 diase 25. Nossos resultados experimentais demonstraram a predominância do subconjunto iNKT2 no baço de camundongos por 3 dias após uma injeção intraperitoneal de α-GalCer, que secreta principalmente citocinas anti-inflamatórias IL-4 e IL-10. Também descobrimos que a abundância de células iNKT2 diminuiu e a das células iNKT1 e iNKT17 aumentou nos camundongos modelo RA durante a fase inflamatória. Portanto, isolamos as células iNKT do baço do rato por injeção intraperitoneal de α-GalCer por 3 dias. Estes foram usados para tratar os ratos modelo RA. A taxa do subconjunto iNKT2 foi de 82% após indução invivo. Após a purificação pelo MACS, a taxa de iNKT2 ultrapassou 92%.
A ativação específica das células iNKT é empregada como um novo tratamento biológico para A. Horikoshi et al.21 demonstraram que a injeção intradermal de α-GalCer inibiu a artrite induzida pelo peptídeo de GPI, inibindo significativamente o número de células CD4+ T. Chiba et al.26 mostraram que injeções repetidas do ativador seletivo iNKT2 sintético OCH inibiram a CIA, enquanto α-GalCer mostrou um ligeiro efeito inibidor. Injetamos iNKT derivado do baço em camundongos modeloRA, e os resultados mostraram que o grau de inchaço das articulações do tornozelo no grupo de terapia celular e o número de células inflamatórias infiltradas nas articulações foi reduzido. O nível de citocinas anti-inflamatórias soro (por exemplo, IL-4 e IL-10) aumentou, e a secreção de citocinas pró-inflamatórias (por exemplo, IFN-γ e TNF-α) diminuiu. a ativação direcionada das células iNKT foi capaz de aliviar a progressão de RA e inibir a resposta inflamatória. Além disso, detectamos a frequência de iNKT no timo e descobrimos que o número de células iNKT no grupo modelo RA foi significativamente reduzido, enquanto a frequência no timo aumentou após a infusão das células iNKT. Devido à presença do sistema de barreira hematomo-timo, não consideramos o aumento adotado no nível de iNKT no timo que foi confirmado em experimentos posteriores. Uma maior detecção das subpopulações de células iNKT no timo revelou que, em comparação com o grupo de controle saudável, o número de células iNKT1 no grupo modelo RA aumentou significativamente durante os três estágios de inflamação e máximamente durante o pico da inflamação, enquanto a proporção do subconjunto iNKT2 começou a aumentar no pico da inflamação. Notavelmente, o subconjunto iNKT1 pode estar envolvido na inflamação precoce do RA, e o subconjunto iNKT2 pode desempenhar um papel importante na inibição da inflamação. Em comparação com o grupo modelo RA, o subconjunto iNKT1 no grupo de terapia celular diminuiu significativamente durante a fase inflamatória, e o subconjunto iNKT2 aumentou significativamente no estágio inicial e de remissão da inflamação. Esses resultados indicaram que a infusão adotiva de fenótipos específicos e células iNKT funcionais aumentou significativamente a frequência das células iNKT em RA e alterou a proporção de subconjuntos celulares iNKT.
Usamos IVIS para observar a distribuição de células iNKT em camundongos após a infusão adotiva e encontramos a maior intensidade de fluorescência nos pulmões 10 min após a infusão, que desapareceu gradualmente. O fígado apresentou fluorescência fraca, que aumentou gradualmente e diminuiu gradualmente após 2 dias. A fluorescência foi detectada no baço aos 30 min, que aumentou gradualmente e diminuiu após 2 dias. A intensidade média de fluorescência do fígado foi mais forte que a do baço. No entanto, não foi detectada fluorescência nos linfonodos e linfáticos inguinal. A detecção de fluorescência nos pulmões pode ser atribuída à infusão de células iNKT na veia traseira. Essas células circulam para os pulmões com o sangue. As fluoresces hepáticas mais cedo que o baço, e a intensidade média de fluorescência do fígado é mais forte que a do baço. Este acúmulo preferencial das células iNKT pode ser devido aos abundantes vasos sanguíneos no fígado, o principal órgão metabólico. A fluorescência não foi detectada no timo. Isso pode ser devido à barreira hematológica, que poderia dificultar a entrada de células iNKT. A fluorescência nunca foi detectada nos linfonodos inadinais, talvez porque menos células iNKT entraram nos linfonodos e não atingiram o nível mínimo de detecção. Além disso, pode-se especular que as células iNKT infundidas na veia traseira podem não entrar nos linfonodos. Portanto, nós supõemque que o desenvolvimento e diferenciação das células iNKT no timo podem ser regulados através de caminhos de citocina após a infusão adotiva nos camundongos. Isso precisa ser elucidado ainda mais.
O GPI está presente no soro e fluido sinovial da maioria dos pacientes com RA e é um teste comumente utilizado para o diagnóstico clínico de RA27. Bruns et al.28 usaram peptídeos de diferentes comprimentos da sequência gpi e imunizaram os camundongos DBA/1 para identificar seis epítopos imunodominantes das células T. Destes, três eram arthritogênicos. Os peptídeos com >95% de incidência de artrite são hGPI 325-339 e hGPI469-483. Nossos estudos anteriores demonstraram que o uso de uma mistura dos dois peptídeos para estabelecer um modelo RA é melhor do que um único peptídeo. Nos modelos RA resultantes, os dedos e articulações dos camundongos começaram a aparecer vermelhos no dia 6 e atingiram um pico de inflamação no dia 14. A infiltração celular inflamatória foi acompanhada por hiperplasia tecidual no tecido sinovial das articulações, e a infiltração celular inflamatória foi mais grave no dia 14. O número de células iNKT foi diminuído significativamente no timo no pico da inflamação, o que foi consistente com a tendência de células iNKT em pacientes ra29. Uma nova detecção dos subconjuntos celulares iNKT revelou que a frequência de iNKT1 e iNKT17 no timo aumentou e a frequência do iNKT2 diminuiu durante a progressão da inflamação (dia 11). Além disso, os níveis de citocinas sésas IFN-γ e IL-17A aumentaram durante a progressão (dia 11) e o pico de inflamação (dia 14), sugerindo uma polarização semelhante dos subgrupos Th1 e Th17 em ratos modelo RA30. Portanto, o modelo de camundongo RA induzido pelo hGPI325-339 e hGPI469-483 fragmentos mistos de polipeptídeo exibiam as características da hiperproliferação celular CD4+ T e defeitos celulares iNKT, que era semelhante ao dos pacientes ra, e poderia ser usado como modelo animal ideal para investigar a imunidade das células RA. Esses resultados estavam de acordo com os de nossos estudos anteriores e demonstraram a estabilidade do modelo RA induzido pelo HGPIs31.
Em geral, o modelo de mouse RA induzido pelos peptídeos G6PI mistos pode simular as alterações nas células CD4+ T, células iNKT e citocinas relacionadas em pacientes ra. Isso fornece um bom modelo para uma investigação aprofundada da RA. Consecutivamente, o iNKT (principalmente iNKT2) induzido pela injeção intraperitoneal de α-GalCer e vitro purificado foi usado no tratamento de RA. Pode corrigir o desequilíbrio imunológico causado pela proliferação anormal dos subconjuntos th, aliviar a progressão de RA, e no futuro pode fornecer novos métodos para o tratamento clínico da RA.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores declaram que não há financiamento ou conflitos de interesse.
Acknowledgments
Nosso estudo foi apoiado pela Fundação Nacional de CiênciaNatural da China (NSFC) (81771755), Colleges and university's key research project of Hebei province (ZD2017009) e o Animal Lab of Medical Experiment Center, Hebei University. Somos gratos pelo apoio deles.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



