Summary
Bu protokol, CD4+ T hücreleri ve sitokinlerde insan romatoid artritine daha yakın romatoid artrit modelleri oluşturmak için G6PI karışık peptidler kullanır. Yüksek saflıkta değişmez doğal katil T hücreleri (özellikle iNKT2) belirli fenotip ler ve fonksiyonlar ile in vivo indüksiyon ve in vitro saflaştırma ile benimseyici immünoterapi elde edildi.
Abstract
Romatoid artrit (RA) karmaşık kronik inflamatuar otoimmün bir hastalıktır. Hastalığın patogenezi değişmez doğal katil T (iNKT) hücreleri ile ilişkilidir. Aktif RA'lı hastalarda daha az iNKT hücresi, kusurlu hücre fonksiyonu ve Th1'in aşırı polarizasyonu mevcuttur. Bu çalışmada hGPI325-339 ve hGPI469-483 peptidlerinin karışımı kullanılarak RA hayvan modeli oluşturulmuştur. in vivo indüksiyon ve in vitro saflaştırma ile elde edilen iNKT hücreleri, evlat edinen immünoterapi için RA farelere infüzyon uymaktadır. In vivo görüntüleme sistemi (IVIS) takibi, iNKT hücrelerinin esas olarak dalak ve karaciğerde dağıtıldığını ortaya çıkardı. Hücre tedavisinden sonraki 12 gün, hastalığın ilerlemesi önemli ölçüde yavaşladı, klinik semptomlar hafifletildi, timustaki iNKT hücrelerinin bolluğu arttı, timustaki iNKT1 oranı azaldı ve TNF-α, IFN-γ ve IL-6 düzeyleri serum azalmış. iNKT hücrelerinin benimseyen immünoterapi bağışıklık hücrelerinin dengesini geri ve vücudun aşırı iltihabı düzeltti.
Introduction
Romatoid artrit (RA) kronik, progresif invazivlik ile karakterize otoimmün bir hastalıktır 0.5-1% insidansı1,2. Altta yatan patogenez, CD4+IFN-γ+ ve CD4+IL-17A+ T hücrelerinin oranında ki artış ve CD4 + IL-4+ve CD4 +CD25+FoxP3+ T hücrelerinin azalması ile kendini gösteren otoreaktif CD4+ ve CD8+ T hücrelerinin anormal çoğalmasına bağlanır. Bu nedenle, inflamatuar sitokinlerin salgıları artar, ve aşırı inflamatuar reaksiyon vücudun bağışıklık sisteminin doğal denge ve tolerans fonksiyonu yok. Ayrıca, yardımcı T lenfosit (Th) 1 eklem nüfuz hücreleri inflamatuar yanıt ve eklem hasarı ağırlaştırmak. Bu nedenle, aşırı inflamatuar yanıt ın inhibisyonu ve bağışıklık toleransı ve bağışıklık dengesinin restorasyonu RAtedavisiiçinanahtar dır3 ,4.
iNKT hücreleri hem NK hücre li hem de T hücre fonksiyonlarına ve özelliklerine sahiptir. iNKT hücreleri sınırlı TCR β-zincir repertuvarları5 ile farklı, değişmez T hücre reseptörü (TCR) α-zincir barındırır ve büyük histokompatibilite kompleksi (MHC) sınıf I molekülü CD1d tarafından sunulan glikolipid antijeni tanır. Mitsuo ve ark.6 RA dahil olmak üzere birçok otoimmün hastalıkta çok sayıda iNKT hücresi ve fonksiyonel defekt saptandı. Aurore ve ark.7, iNKT hücrelerinin otoimmün toleransı korumada olumlu bir etkisi olduğunu ve iNKT hücrelerinin sayısı ve işlevi geri yüklendiğinde hastalığın hafiflediğini göstermiştir. Buna ek olarak, Miellot-Gafsou ve ark.8 iNKT hücrelerinin sadece hastalığı ortadan kılmış değil, aynı zamanda hastalığın ilerlemesini artırdığını bulundu. Bu çelişkili sonuçlar, iNKT hücrelerinin heterojen T hücreleri olduğunu ve farklı alt kümelerin işlevinin tersine çevrilebileceğini düşündürmektedir. RA bir klinik çalışmada, iNKT hücrelerinin sıklığı hastalık aktivitesi nin skoru ile ilişkili9. Sonuçlar ayrıca RA hastalarında iNKT sıklığının azaldığını, CD4+IFN-γ+ T hücre alt kümelerinin sayısının arttığını ve inflamatuar sitokinlerin IFN-γ ve TNF-α salgı düzeylerinin10,11arttığını doğruladı. Buna ek olarak, Şerif ve ark.12 tip 1 diyabet (T1D) araştırılmış ve inflamatuar sitokin IL-4 ekspresyonu upregulated iNKT hücrelerinin seçici infüzyon, bağışıklık toleransı muhafaza ve tip 1 diyabet gelişimini engelledi bulundu. Bu nedenle, spesifik iNKT hücrelerinin benimseyen infüzyonu veya iNKT hücrelerinin hedefli aktivasyonu RA hastalarında iNKT hücrelerinin düzeyini artırır, ra tedavisinde bir atılım olabilir.
Hücresel immünoterapi şu anda büyük ilgi ve yaygın kanser tedavisinde kullanılmaktadır. Ancak, iNKT hücreleri nadir, heterojen immünodüzenleyici hücrelerdir (toplam PBMC sayısının sadece %0.3'ü)13, bu da potansiyel klinik uygulamaları sınırlar. Bu hücreler esas olarak üç alt popülasyona ayrılır: 1) promiyelositik lösemi çinko-parmak proteini (PLZF) ve T-box transkripsiyon faktörü (T-bet) yüksek bir ekspresyona ya da iNKT1 hücreleri; 2) PLZF ve GATA bağlayıcı protein 3 (GATA3) ara ekspresyonu ile iNKT2 hücreleri; 3) PLZF ve retinoid ile ilgili yetim nükleer reseptör düşük ekspresyonu ile iNKT17 hücreleri (ROR)-γt bu salgıif IFN-γ, IL-4, ve IL-1714. Aktive iNKT hücreleri th1 salgılar, Th2, ve Th17 benzeri sitokinler, hangi iNKT hücrelerinin farklı immünomodülatör etkilerini belirlemek15. iNKT hücrelerinin çeşitli alt popülasyonlarının spesifik aktivasyonunun immünomodülatör ve immünoterapötik etkileri farklıdır. Bu nedenle, vücudun bağışıklık yanıtını düzenleyen anti-inflamatuar fonksiyonlar ile iNKT hücrelerinin belirli fenotiplerin seçimi (özellikle iNKT2) RA bağışıklık dengesizliği ve bağışıklık bozuklukları düzeltebilirsiniz.
İdeal bir hayvan modelinin oluşturulması RA patogenezinin tedavisi ve incelenmesi açısından büyük önem eve sahiptir. Şu anda, en sık kullanılan ve olgun hayvan modelleri kollajen kaynaklı artrit dahil, adjuvan artrit, zimozan kaynaklı artrit, ve polisakkarit kaynaklı artrit16–17. Ancak, tamamen insan RA tüm özelliklerini simüle edebilirsiniz hiçbir model yoktur. Tip II kollajen kaynaklı artrit (CIA) klasik artrit modelidir. CIA tip II kollajen spesifik monoklonal antikorlar ile farelerin aşılanması ile indüklenen, Bu hastalık modelinin antikor bağımlılığı yansıtan. Benurs ve ark. duyarlı fare suşlarında periferik simetrik poliartrit indükler glukoz-6-fosfat izopir (G6PI), sistemik bağışıklık yanıtı olan bir model tarif18,19. Bu modelde, artrit gelişimi T hücrelerine bağlıdır, B hücreleri, ve doğuştan bağışıklık18,19,20. Horikoshi21, DBA/1 farelerinin G6PI polipeptid parçaları ile bağışıklanması sonucu ortaya çıkan RA modellerinin, CIA modellerine göre CD4+ T hücreleri ve sitokinler (yani IL-6 ve TNF-α) açısından insan RA'sına daha çok benzediğini buldu. TCR tanıma yerinde uyarıcı etkiyi artırmak için, Ra fare modelini oluşturmak için DBA/1 fareleri aşılamak için G6PI'nin (hGPI325-339 ve hGPI469-483) karışık polipeptit parçaları kullanıldı. HGPI325-339 ve hGPI469-483 I-A q-kısıtlı T hücre yanıtları için immündominant olduğu için bu yaklaşımın başarı oranı yüksek olabilir. Bu nedenle, bu model RA hastalarında CD4+ T hücrelerinin aşırı çoğalmasını ve iNKT hücre defektlerini simüle edebilir22. RA immünpatolojisinin temel araştırmaları daha derinlemesine araştırmamızın temelini attı.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tüm deneysel fareler (toplam 150) sağlıklı erkek DBA/1 fareler, 6-8 haftalık (20.0 ± 1.5 g), belirli bir patojen içermeyen (SPF) ortamda yetiştirilen edildi. Modellemeden önce özel bir işlem yoktur. Deney sağlıklı bir kontrol grubu (15 fare), bir model kontrol grubu (15 fare) ve bir hücre terapi grubuna (55 fare) ayrılmıştır. Bu çalışma Hebei Üniversitesi Hayvan Refahı ve Etik Komitesi tarafından onaylanmıştır.
1. Hastalık Modelinin Oluşturulması
- RA hayvan modelinin çoğaltılmı
- HG6PI 325-339 ve hG6PI 469-483 parçalarının 1,75 mg'ını tartın ve 4 °C üçlü distile suyun 5,25 mL'sinde çözün.
- Freund'un adjuvan (CFA) hazırlayışı 50 °C'lik bir su banyosunda çözün, 5,25 mL'lik başka bir 10 mL santrifüj tüpüne çekin ve kullanım için soğutun.
- HG6PI çözeltisi ve CFA çözeltisinin karışımını iki cam şırıngabağlı yapay bir emülsifikasyon ünitesine koyun.
- Karışık peptit solüsyonu ve CFA çözeltisini tamamen emülsifiye etmek için şırıngayı sabit bir hız ve dakikada 10-20x sıklıkta itin. Bir buz banyosunda işlemi gerçekleştirin ve emülsiyon damlacıklarını dağılmadan emülsifikasyon tamamlandıktan sonra 10 dakika suda tutun.
- Farenin kuyruk köküne 150 μL emülsifiye hG6PI enjekte edin.
- HG6PI enjeksiyonundan sonra 0 saat ve 48 h'de fare intraperitoneally içine 200 mg Pertussis toksini enjekte edin.
- RA modelinin deneysel doğrulaması
- Farenin pençesinin kalınlığını vernier kaliper (günde 2 x) ile ölçün.
- Gözlemlemek ve ayak kızarıklık ve şişlik derecesini işaretleyin. Aşağıdaki puanlama kriterlerini kullanın: 1) hafif şişlik ile ayak; 2) dorsum pedis ve açık kırmızı şişme ile ayak pedi; 3) kırmızı şişme ile ayak bileği.
- Modellemeden 14 gün sonra %1 sodyum pentobarbital (50 mg/kg vücut ağırlığı) intraperitoneal enjeksiyon ile derin anestezi altındaki fareleri ötenazi edin ve HE boyama için pençeleri çıkarın.
- Üreticiprotokolüne göre ticari bir sitometrik boncuk dizisi (CBA) kullanarak serum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α ve IFN-γ'ın salgı düzeylerini belirleyin.
2. Benimseyen Hücresel Tedavi ile iNKT Hücrelerinin Elde Edilmesi
- iNKT hücrelerinin yönlü indüksiyonu
- Normal farelere intraperitoneal α-GalCer enjekte edin (0.1 mg/kg vücut ağırlığı).
- iNKT hücrelerinin yalıtımı
- Modellemeden üç gün sonra, anestezi için farelere intraperitoneal %1 sodyum pentobarbital (50 mg/kg vücut ağırlığı) enjekte edin. Yeterince anestezili fareler bir parmak çimdik bir arka pençe çekilmesi yanıt göstermez.
- DBA/1 farenin dalağını α-GalCer ile intraperitoneal olarak enjekte ettikten sonra izole edin. 200 örgü elekteki dalağını kesip öğüterek tek bir hücreli süspansiyon hazırlayın.
- Hücre süspansiyonuna PBS ile yıkayın, 200 x g'de 5 dk santrifüj edin ve süpernatantı atın. Tekrar.
- Tam kan ve doku seyreltme çözeltisi 1 mL ile hücreleri resuspend. Fare lenfosit ayırma orta 3 mL ekleyin ve sonra oda sıcaklığında 300 x g 20 dakika hücreleri santrifüj.
- Sütlü beyaz lenfositler (yani, üstten ikinci tabaka) tabakası toplamak, PBS ile 2x yıkayın ve otomatik bir hücre sayacı ile saymak.
- iNKT hücrelerinin saflaştırılması için manyetik aktif hücre sıralama (MACS) pozitif seçim stratejisi
NOT: CD1d tetramerlerinin ön işlemesi için 1 mg/mL α-Galcer 200 μg/mL'ye seyreltildi ve %0.5'i Tween-20 ve NaCl'nin %0.9'u ile ve elde edilen çözeltinin 5 000'i CD1d tetramer çözeltisinin 100 μL'sine eklendi. Karışım oda sıcaklığında 12 saat kuluçkaya yatırıldı ve kullanım için 4 °C'ye yerleştirildi. TCR β deiyonize su ile 80x seyreltildi. Diğer tüm antikorlar stok çözeltisi olarak kullanıldı.- 100 μL 4 °C PBS ile 100°C PBS ile 10 7 hücreyi yeniden askıya alın, 10 μL α-GalCer yüklü CD1d Tetramer-PE ekleyin ve karanlıkta 15 dakika boyunca 4 °C'de kuluçkaya yatırın.
- Hücreleri 2 kat PBS ile yıkayın ve 80 μL PBS'de yeniden askıya alın.
- 20 μL anti-PE-MicroBeads ekleyin ve karanlıkta 20 dakika boyunca 4 °C'de kuluçkaya yatırın.
- 2 x PBS ile yıkayın ve hücreleri 500 μL PBS ile yeniden askıya alın.
- Sıralama sütununu MACS ayırıcısının manyetik alanına yerleştirin ve 500 μL PBS ile durulayın.
- Hücre süspansiyonu 2.3.4 adımdan ayırma sütununa ekleyin, akışı toplayın ve PBS arabelleğiyle 3x durulayın.
- Manyetik alanı kaldırın ve sıralama sütunundaki hücreleri toplayın. Bu noktada, sıralama sütununa 1 mL PBS arabelleği ekleyin ve etiketli hücreleri toplama tüpüne götürmek ve saflaştırılmış iNKT hücreleri elde etmek için sürekli bir basınçta pistonu hızlı bir şekilde itin. Otomatik bir hücre sayacı ile say.
- iNKT hücre fenotipinin tanımlanması
- Sırasıyla 2.2.5 ve 2.3.7 adımlarından 1 x 106 hücre alın ve 50 μL PBS'de yeniden askıya alın.
- Antikor kuluçka: Negatif kontrol tüpüne antikor eklemeyin, tek pozitif kontrol tüpüne 0,5 μL α-GalCer-PE-CD1d Tetramer veya 10 μL FITC-TCR β ekleyin. Örnek tüpe 0,5 l α-GalCer-PE-CD1d tetramer ve 10 μL FITC-TCR β ekleyin. Karanlıkta 30 dakika boyunca 4 °C'de kuluçkaya yatırın.
- 5 dakika boyunca 200 x g'de PBS'deki hücreleri yıkayın ve santrifüj edin.
- Supernatant atın, Foxp3 Foxation / Permeabilization çalışma çözeltisi 1 mL ekleyin ve karanlıkta 4 ° C'de 45 dakika için hücreleri kuluçka.
- 1 mL 1x Permeabilizasyon Tampon çalışma çözeltisi ekleyin ve 5 dk oda sıcaklığında 500 x g oda sıcaklığında hücreleri santrifüj.
- Supernatant atın. Karanlıkta oda sıcaklığında 30 dakika boyunca 1 000 Alexa Fluor 647 fare Anti-PLZF ve 1 000 PerCP-Cy 5,5 fare anti-T-bet (veya 1 μL PerCP-Cy 5,5 fare anti-RORΥt) ekleyin.
- Temizlik için 2 mL Permeabilizasyon Tampon çalışma çözeltisi ekleyin.
- Supernatant atın, PBS 500 μL hücreleri resuspend ve akış sitometri ile ölçün.
- iNKT hücrelerinin fonksiyonel tanımlanması
- Adım 2.3.7'den 3 x 106 iNKT hücreleri alın ve 1.5 mL RPMI-1640 eksik orta (yani, serum olmadan) ile 12 kuyu plakaları onları yeniden askıya alın.
- Phorbol ester (PMA, 50 ng/mL) ve iyonomisin kalsiyum (IO, 1 μg/mL) ekleyin ve 24 saat boyunca CO2 kuluçka makinesine yerleştirin.
- Hücre supernatant toplamak ve IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ ve IL-10 salgı düzeylerini üreticinin protokolüne göre ticari bir CBA tsay kullanarak tespit.
- RA farelerinde iNKT hücrelerinin göç yolu üzerine deneysel çalışma
- DMSO'da DiR boyayı (2.5 mg/mL) çözün.
- RPMI-1640 eksik orta ile 6 iyi plakalar içinde iNKT hücreleri resuspend. Yoğunluk 1 × 106 hücre/mL'dir.
- DiR (5 g/mL) çözeltisi ekleyin ve 25 dakika boyunca CO2 kuluçka makinesinde kuluçkaya yatırın.
- DiR etiketli iNKT hücreleri (DiR-iNKT) elde etmek için PBS ile yıkayın ve hücreleri (3 x 106/300 μL) yeniden askıya alın.
- Fareleri anestezik etmek için %1 sodyum pentobarbital (50 mg/kg vücut ağırlığı) intraperitoneal enjekte edin. Yeterince anestezili fareler parmak çimdik bir arka pençe çekilmesi göstermez. Görüntüleme için anestezi altında kuruluk önlemek için fare gözlerine veteriner merhem uygulayın.
- 8 gün boyunca RA modeli ile fare başına 3 x 106 diR-iNKT hücreleri enjekte edin. İnjeks sonrası farelerdeki iNKT hücrelerini 0 dk, 10 dk, 30 dk, 60 dk ve gün 0 (3 saat sonra), 1, 3, 6, 12, 26, 34, 38 ve 42 gün boyunca in vivo görüntüleme sistemindeki (IVIS) küçük bir hayvanı kullanarak izleyin. Kullanılan uyarma dalga boyu 748 nm, emisyon dalga boyu 780 nm ve pozlama süresi otomatikti.
- Her gözlemden sonra her fareyi ayrı bir kafese yerleştirin ve sert bir recumbency koruyun. Anesteziden iyileşene kadar gözlemleyin.
3. INKT Hücreleri ile RA Farelerin Evlat edinici İmmünoterapisinin Değerlendirilmesi
- RA fareler için iNKT hücre benimseyen immünoterapi
- Kuyruk damarına fare başına 3 x 106 hücre iNKT hücresi enjekte edin. 8 gün önce modellenmiş 15 fareyi rastgele seçin ve kuyruk damar infüzyonu ile 2.3.7 adımından DiR etiketi olmadan iNKT hücreleri edinin.
- iNKT hücreleri için evlat edinen immünoterapinin etkinliğini değerlendirin.
- Farenin pençe kalınlığını ölçün, ayak bileği ekleminin şişmesini ölçün ve 1.2.1-1.2.2 adımlarında açıklandığı gibi iNKT hücrelerinin infüzyonundan sonra sistematik olarak puan alın.
- Adım 1.2.3'te açıklandığı gibi fare eklemlerinin inflamatuar hücre infiltrasyonlarını ve eklem değişikliklerini gözlemleyin.
- Adım 1.2.4'te açıklandığı gibi IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α ve IFN-γ salgı düzeylerini belirleyin.
- iNKT hücrelerinin ve alt kümelerinin sıklığını belirleyin.
- Fare timusu izole ve tek bir hücre süspansiyon hazırlamak.
- Lenfositleri lenfosit ayırma sıvısı ile ayırın.
- Adım 2.4'te açıklandığı gibi iNKT hücre frekansını ve alt grup sıklığını belirleyin.
- İstatistiksel analiz
NOT: Tüm veriler ortalama ± SD. P < 0.05 değerleri istatistiksel olarak anlamlı olarak değerlendirildi.- Varyans (ANOVA) tek faktörlü analizini kullanın. Varyans tatmin olduysa, daha fazla karşılaştırma için LSD testini kullanın.
- Varyans düzgün değilse, parametrik olmayan testi kullanın. Daha fazla karşılaştırma31için Kruskal-Wallis H testini kullanın.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Modelleme sonrası artrit indeks skoru ve pençe kalınlığı artmıştır. Kontrol grubu ile karşılaştırıldığında, RA model grubunun ayak başları modellemeden 6 gün sonra, kademeli şiddetlenme ile kırmızı şişlik göstermeye başladı. 14 gün sonra, ayak bileği ekleminde kırmızı şişlik doruğa ulaştı, ardından kademeli rahatlama. Pençenin kalınlığı benzer şekilde değişmiştir (P < 0.05) (Şekil 1).
Modelleme sonrası inflamatuar hücre infiltrasyonu önemli ölçüde artmıştır. Patolojik sonuçlar, RA model farelerin ayak bileği sinovyal dokusundaki inflamatuar hücrelerin infiltrasyon derecesinin farklı aşamalarda farklı olduğunu göstermiştir. Tepe inflamasyon gün 14 post modelleme oluştu (Şekil 2).
Serumda inflamatuar sitokinler artmış ve anti-inflamatuar sitokinler azalmıştır. RA model grubunda pro-inflamatuar sitokinlerin (TNF-α, IFN-γ ve IL-6) serum düzeyleri önemli ölçüde artarken(P < 0.05), anti-inflamatuar sitokinler (IL-4 ve IL-10) önemli ölçüde azalmıştır(P < 0.05)(Şekil 3).
In vivo indüksiyon ve in vitro saflaştırma ile elde edilen iNKT hücreleri esas olarak anti-inflamatuar sitokins salgılayan iNKT2 hücre alt kümelerinden oluşuyordu. Α-GalCer intraperitoneal enjeksiyonu vücuttaki iNKT hücrelerinin sıklığını artırdı, ağırlıklı olarak iNKT2 alt grubu. Normal DBA/1 farelerinde dalak iNKT hücrelerinin sıklığı lenfositlerin yaklaşık %2'si, (iNKT2 %5, iNKT1 %15, iNKT17 yaklaşık %10 idi. Α-GalCer intraperitoneal enjeksiyonundan üç gün sonra, iNKT hücrelerinin sıklığı lenfositlerin yaklaşık %6'sı, (iNKT2 %82, iNKT1 %1,5 ve iNKT17 yaklaşık %0,5 idi. MACS ile arındıktan sonra, iNKT hücrelerinin saflığı %85'in üzerindeydi ve bunların %92'si iNKT2, %0,4 iNKT1 ve %0,2 iNKT17 idi(Şekil 4).
Hasat iNKT hücreleri daha fazla anti-inflamatuar sitokinler ve daha az inflamatuar sitokinler salgıladı. INKT hücreleri normal farelerin dalaklarından izole edildi ve intraperitoneal olarak α-GalCer enjekte edildi 3 gün sonra fare dalak (α-GalCer grubu) ve hücre kültüründeki sitokin düzeyleri incelendi. Kontrol grubu ile karşılaştırıldığında α-GalCer grubunun inflamatuar sitokinleri (IL-17A, TNF-α, IFN-γ ve IL-6) önemli ölçüde azaldı(P < 0.05) ve anti-inflamatuar sitokin IL-4 düzeyi anlamlı olarak arttı(P < 0.05). IL-10 arasında anlamlı bir fark yoktu(P > 0.05). IFN-γ/IL-4 oranı önemli ölçüde azaldı(P < 0.05) (Şekil 5).
IVIS takibi, DiR-iNKT hücrelerinin RA farelere adoptively aşılandığını ve enjeksiyon sonrası akciğerlerde hemen ortaya çıktığını doğruladı. Floresan karaciğerde 10 dk ve dalakta 60 dk olarak saptırıldı(Şekil 6AI, 6AII, 6AIII). İzole organlarda 1 saat içinde timus ve inguinal lenf düğümlerinde floresan saptırılmadı. Karaciğerde 0 dk.da zayıf floresan vardı ve sonra yavaş yavaş arttı. Dalaktaki floresan 30 dakika saptanır ve daha sonra kademeli olarak artmıştır(Şekil 6AIV, 6C).
DiR-iNKT hücrelerinin RA farelere infüzyonundan sonra floresan esas olarak karaciğer ve dalakta yoğunlaşmıştır(Şekil 6BI, 6BII, 6BIII),ancak timus ve inguinal lenf düğümlerinde floresan saptanmadı. Dalak ve karaciğer hücre infüzyonu sonrası gün 1 en yüksek floresan yoğunluğu vardı, ama yavaş yavaş zayıfladı. 34. günde, yüzey floresankayboldu. 42. günde, izole edilmiş organların floresansı kayboldu. Hücre infüzyonundan sonra karaciğerin ortalama floresan sinyal yoğunluğu dalaktan daha yüksekti (Şekil 6BIV, 6D).
RA fareler içine iNKT hücrelerinin benimseyen infüzyon hastalığın ilerlemesini hafifletmek ve klinik belirtileri artırabilir. iNKT hücreleri, evlat edinen infüzyon sonrası RA farelerin klinik semptomlarını iyileştirmiştir. Tedavi edilmeyen RA model grubu ile karşılaştırıldığında, hücre tedavi grubunda ayak bileği ekleminin şişmesi giderildi ve skorlar 10 günden 20'ye kadar enjeksiyon sonrası önemli ölçüde azaldı. Hücre tedavi grubunda aynı dönemde sinovyal dokudaki inflamatuar hücre infiltrasyonu RA model grubuna göre azalmıştır(Şekil 2).
Timus iNKT hücrelerinin başarı oranları anlamlı olarak artmıştır(P < 0.05). Sağlıklı kontrol grubu ile karşılaştırıldığında, RA model grubunda timusdaki iNKT hücrelerinin oranları ilerleme (gün 11), pik (gün 14) ve kurtarma (gün 20) aşamalarında azalmıştır. En yoğun inflamasyonda bu değerler minimaldi ve remisyon aşamasında geri ledi. Hücre terapi grubu, RA model grubuna göre en yüksek (gün 14) ve iyileşme (gün 20) aşamalarında iNKT hücrelerinin oranlarının anlamlı olarak arttığını göstermiştir(P < 0.05)(Şekil 7).
iNKT hücre infüzyonundan sonra timusda iNKT1 ve iNKT17 başarı oranı azalmış ve iNKT2 artmıştır. Kontrol grubuna göre, 11. 14. günde timusda iNKT1 ve iNKT2 önemli ölçüde artmıştır(P< 0.05) ve iNKT17 önemli ölçüde azalmıştır(P< 0.05). 20. günde timusda iNKT1 önemli ölçüde artmıştır(P < 0.05), iNKT2 önemli ölçüde değişmedi(P > 0.05) ve iNKT17 önemli ölçüde azaldı(P < 0.05). iNKT1/iNKT2 oranı üç aşamada da önemli ölçüde artmıştır(P < 0.05).
RA model grubu ile karşılaştırıldığında, α-GalCer ve hücre tedavi gruplarında 11. 14. günde α-GalCer grubunda iNKT1 ve iNKT17 önemli ölçüde azaldı(P < 0.05) ve iNKT2 önemli ölçüde değişmedi(P > 0.05); hücre tedavi grubunda iNKT1 ve iNKT17 önemli ölçüde azaldı(P < 0.05) ve iNKT2 önemli ölçüde artmıştır(P < 0.05). 20. günde α-GalCer grubunda iNKT1 önemli ölçüde azaldı(P < 0.05), iNKT2 önemli ölçüde değişmedi(P > 0.05) ve iNKT17 önemli ölçüde arttı(P < 0.05); hücre tedavi grubunda iNKT1 ve iNKT17 önemli ölçüde azaldı(P < 0.05) ve iNKT2 önemli ölçüde artmıştır(P < 0.05). iNKT1/iNKT2 oranı her üç aşamada da önemli ölçüde azalmıştır(P < 0.05)(Şekil 7).
Serumda inflamatuar sitokin düzeyleri artmış ve iNKT hücre infüzyonu sonrası anti-inflamatuar sitokinler azalmıştır. RA model grubunda, TNF-α, IFN-γ ve IL-6in serum düzeyleri anlamlı olarak artarken(P < 0.05), IL-4 ve IL-10 kontrol grubuna kıyasla belirgin şekilde azalmış miktarlar(P < 0.05) gösterdi. iNKT hücre tedavi grubunda serumdaki TNF-α, IFN-γ ve IL-6 düzeyleri inflamasyonun ilerleme ve pik evrelerinde(P < 0.05) önemli ölçüde azalırken, IL-4 ve IL-10RA model grubuna göre anlamlı olarak artmıştır(P < 0.05).
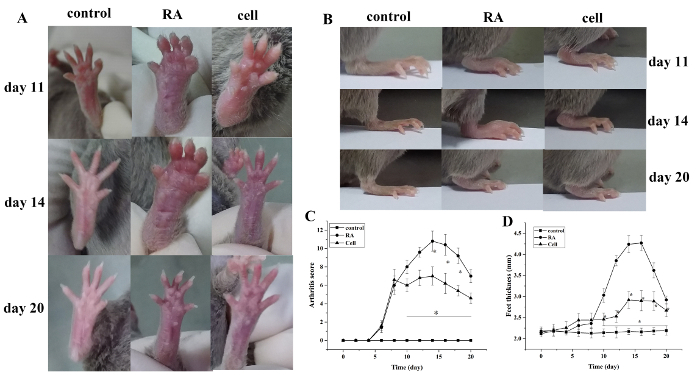
Şekil 1: Farelerde eklem şişme skoru ve pençe kalınlığı değişir. (A) Farelerde ayak bileği ekleminin şişmesi. (B,D) Farklı gruplarda pençe kalınlığı. (C) Klinik skor farklı gruplarda değişir. Fare artriti skoru ve pençe kalınlığı modelleme den sonra 10-20 gün (yani, tedaviden sonra 2-12 gün) hücre terapi grubunda önemli ölçüde azalmıştır. *P < 0.05 vs. kontrol, **P < 0.05 vs. RA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Ayak bileği ekleminde histopatolojik değişiklikler. Hücre tedavi grubunda inflamatuar hücrelerin infiltrasyonu önemli ölçüde azaldı ve 14. ◊ = inflamatuar hücreler. (A) 100x (B) 400x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Her gruptaki serum sitokin düzeyleri. (A) Modellemeden sonra 11. (B) Modellemeden sonra 14. Hücre tedavi grubunda TNF-α, IFN-γ ve IL-6 düzeyleri anlamlı olarak azalmış ve IL-4 ve IL-10 düzeyleri anlamlı olarak artmıştır. birP < 0,05 vs kontrol. bP < 0,05 vs RA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: iNKT hücrelerinin oranları ve iNKT hücre alt kümelerinin oranı. (A,B,C) Normal farelerde iNKT2 oranı ~%5'tir. (D,E,F) in vivo indüksiyon sonrası iNKT2 oranı yaklaşık %82'dir. (G, H, I) MACS arınma sonrasında iNKT2 oranı %92'den fazladır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Fare dalak türetilmiş iNKT hücrelerinin kültür supernatant sitokin düzeyleri. IL-4 düzeyi anlamlı olarak artmış ve IL-17A, TNF-α, IFN-γ ve IL-6 düzeyleri anlamlı olarak azalmıştır. birP < 0,05 vs kontrol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Kaliper IVIS lumina II tarafından izlenen iNKT hücrelerinin dağılımı ve metabolizması. (A,B) iNKT hücrelerinin geçiş yolu. (C) Dalak, karaciğer ve akciğerde ortalama floresan sinyal yoğunluğunun değişimi. (D) Dalak ve karaciğerde ortalama floresan sinyal yoğunluğunun değişimi. Floresan 0 dk akciğerlerde ve karaciğerde tespit edildi ve daha sonra yavaş yavaş arttı. Floresan yoğunluğu akciğerlerde 10 dakika en güçlü ve daha sonra azaldı. Dalanın floresansı 30 dakika olarak saptandı, sonra yavaş yavaş arttı. Tüm organların floresansı 42. Karaciğerin ortalama floresan sinyal yoğunluğu hücre infüzyonu sonrası dalak daha yüksektir (I: supine; II: yanal yalan; III: eğilimli; IV: izole doku; a: kontrol grubu; b: hücre infüzyon grubu; 1, 2, 3, 4, 5 timus, dalak, karaciğer, inguinal lenf düğümleri, akciğerler) vardır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: fare timusundaki iNKT ve alt kümelerinin oranları. (A) modellemeden sonra 11, 14 ve 20 gün deki iNKT hücrelerinin oranları. (B) iNKT1/iNKT2 oranı. (C,D,E) iNKT1, iNKT2 ve iNKT17 oranı. 11, 14 ve 20 günlerinde (hücre tedavisinden sonra 3, 6 ve 12 gün), iNKT hücrelerinin oranları anlamlı olarak artmış, timusun iNKT1 ve iNKT17'si hücre tedavi grubunda anlamlı olarak azalmış ve iNKT2 önemli ölçüde artmıştır. birP < 0,05 vs Kontrol. bP < 0,05 vs RA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT hücreleri doğuştan gelen ve adaptif bağışıklığı kapatan özel T hücreleridir ve esas olarak CD4++/CD8+ timositlerden geliştirilmiştir. iNKT hücreleri farklı immündüzenleyici fonksiyonlara sahiptir ve farklı sitokinlerin doğrudan temas ve salgılanması ile diğer bağışıklık hücreleri ile etkileşim23, dendritik hücreleri etkileyen (DC), makrofajlar, nötrofiller, B hücreleri, T hücreleri, ve NK hücre farklılaşması ve gelişimi 24. α-GalCer süngerlerden çıkarılan klasik bir iNKT hücreye özgü aktivatördür. Çeşitli çalışmalar dalak iNKT hücre frekansının α-GalCer'in tek bir intraperitoneal enjeksiyonundan sonra 3 gün25zirveye ulaştığını göstermektedir. Deneysel sonuçlarımız, iNKT2 alt kümesinin fare dalaktaki hakimiyetini, esas olarak anti-inflamatuar sitokinler IL-4 ve IL-10 salgılayan α-GalCer intraperitoneal enjeksiyonundan sonra 3 gün boyunca göstermiştir. Ayrıca inflamatuar dönemde RA model farelerde iNKT2 hücrelerinin bolluğunun azaldığını ve iNKT1 ve iNKT17 hücrelerinin arttığını bulduk. Bu nedenle fare dalağının iNKT hücrelerini α-GalCer'in intraperitoneal enjeksiyonu ile 3 gün boyunca izole ettik. Bunlar RA model fareleri tedavi etmek için kullanıldı. in vivo indüksiyon sonrası iNKT2 alt kümesinin oranı %82 idi. MACS tarafından saflaştırma sonra, iNKT2 oranı% 92 aştı.
iNKT hücrelerinin spesifik aktivasyonu RA için yeni bir biyolojik tedavi olarak kullanılmaktadır. Horikoshi ve ark.21, α-GalCer'in intradermal enjeksiyonunun CD4+ T hücrelerinin sayısını önemli ölçüde inhibe ederek GPI peptid kaynaklı artriti inhibe ettiğini göstermiştir. Chiba ve ark.26 sentetik iNKT2 selektif aktivatör OCH tekrarlanan enjeksiyonları CIA inhibe gösterdi, α-GalCer hafif bir inhibitör etkisi gösterdi. RA model farelere dalak türetilmiş iNKT enjekte ettik ve sonuçlar hücre terapi grubundaki ayak bileği eklemlerinin şişme derecesinin ve eklemlere sızan inflamatuar hücrelerin sayısının azaldığını gösterdi. Serum anti-inflamatuar sitokinlerin (örneğin, IL-4 ve IL-10) düzeyi artmış ve pro-inflamatuar sitokinlerin salgıları (örn. IFN-γ ve TNF-α) azalmıştır. iNKT hücrelerinin hedeflenen aktivasyonu RA ilerlemesini hafifletmek ve inflamatuar yanıtı inhibe başardı. Buna ek olarak, timus da iNKT frekansını tespit ettik ve RA model grubundaki iNKT hücrelerinin sayısının önemli ölçüde azaldığını, timustaki frekansın ise iNKT hücrelerinin infüzyonundan sonra arttığını gördük. Kan timus bariyer sisteminin varlığı nedeniyle, daha sonraki deneylerde doğrulanan timustaki iNKT düzeyinde ki infüzyon artışını dikkate almadık. Timusdaki iNKT hücrelerinin alt popülasyonlarının daha ileri saptanması, sağlıklı kontrol grubuna kıyasla, RA model grubundaki iNKT1 hücrelerinin sayısının iltihabın üç evresinde ve enflamasyonun doruğunda maksimize olarak önemli ölçüde arttığını, iNKT2 alt kümesinin oranının ise inflamasyonun zirvesinde artmaya başladığını ortaya koymuştur. Özellikle, iNKT1 alt kümesi RA erken inflamasyon dahil olabilir, ve iNKT2 alt inflamasyon inhibe önemli bir rol oynayabilir. RA model grubu ile karşılaştırıldığında, hücre tedavi grubundaki iNKT1 alt kümesi inflamatuar dönemde önemli ölçüde azalmış ve inflamasyonun erken ve remisyon evresinde iNKT2 alt kümesi önemli ölçüde artmıştır. Bu sonuçlar, spesifik fenotiplerin ve fonksiyonel iNKT hücrelerinin benimseyen infüzyonunun RA'daki iNKT hücrelerinin sıklığını önemli ölçüde artırdığını ve iNKT hücre alt kümelerinin oranını değiştirdiğini göstermiştir.
IVIS'i farelerde iNKT hücrelerinin dağılımını gözetmek için kullandık ve infüzyondan 10 dakika sonra akciğerlerde en yüksek floresan yoğunluğunu bulduk. Karaciğer zayıf floresan gösterdi, hangi yavaş yavaş arttı ve yavaş yavaş azaldı 2 gün sonra. Dalakta 30 dakika içinde floresan saptandı ve bu da 2 gün sonra kademeli olarak arttı ve azaldı. Karaciğerin ortalama floresan yoğunluğu dalandan daha güçlüydü. Ancak timus ve inguinal lenf nodlarında floresan saptamadı. Akciğerlerde floresan tespiti kuyruk damarIçine iNKT hücrelerinin infüzyonu atfedilebilir. Bu hücreler kanla birlikte akciğerlere dolaştırılır. Karaciğer floresan dalak daha erken, ve karaciğerin ortalama floresan yoğunluğu dalak daha güçlüdür. iNKT hücrelerinin bu tercihli birikimi karaciğerde bol kan damarları nedeniyle olabilir, ana metabolik organ. Timusta floresan saptamadı. Bunun nedeni hematolojik bariyer olabilir, bu da iNKT hücrelerinin girişini engelleyebilir. Floresan inguinal lenf düğümlerinde tespit edilmedi, belki de daha az iNKT hücreleri lenf düğümlerine girdi ve tespit minimum seviyeye ulaşamadı çünkü. Ayrıca, kuyruk damarına aşılanmış iNKT hücrelerinin lenf düğümlerine giremeyebileceğine dair spekülasyonlar da yapılabilir. Bu nedenle, timus daki iNKT hücrelerinin gelişimi ve farklılaşmasının farelere infüzyon dan sonra sitokin yolları ile düzenlenebileceğini varsayıyoruz. Bunun daha da açıklığa kavuşturulması gerekiyor.
GPI çoğu RA hastasının serum ve sinovyal sıvısında bulunur ve klinik RA tanısı için yaygın olarak kullanılan bir testtir27. Bruns ve ark.28 GPI dizisinden farklı uzunluklarda peptidler kullandı ve altı immündominant T hücre epitoprepini tanımlamak için DBA/1 farelerine aşılandı. Bunlardan üçü arthritojenikti. Artritin %95 insidansı olan peptidler hGPI 325-339 ve hGPI469-483'tür. Önceki çalışmalarımız, ra modeli oluşturmak için iki peptidkarışımının kullanımının tek bir peptitten daha iyi olduğunu göstermiştir. Ortaya çıkan RA modellerinde, farelerin ayak ve eklemleri 6. İnflamatuar hücre infiltrasyonuna eklemlerin sinovyal dokusunda doku hiperplazisi eşlik etti ve inflamatuar hücre infiltrasyonu en şiddetli gün 14 idi. Inflamasyonun doruğunda timusta iNKT hücrelerinin sayısı önemli ölçüde azalmıştır, bu da RA hastalarında iNKT hücrelerinin eğilimi ile tutarlıdır29. iNKT hücre alt kümelerinin daha ileri saptanmasıtimede timusdaki iNKT1 ve iNKT17 sıklığının arttığı ve inflamasyonun ilerlemesi sırasında iNKT2 sıklığının azaldığı saptandı (11. gün). Buna ek olarak, serum sitokinler IFN-γ ve IL-17A düzeyleri ilerleme sırasında arttı (gün 11) ve inflamasyon zirvesi (gün 14), RA model farelerde Th1 ve Th17 alt gruplarıbenzer bir polarizasyon düşündüren30. Bu nedenle, hGPI325-339 ve hGPI469-483 karma polipeptid parçaları tarafından indüklenen RA fare modeli, RA hastalarınınkine benzer olan CD4+ T hücre hiperproliferasyonu ve iNKT hücre defektlerinin özelliklerini sergiledi ve RA hücrelerinin bağışıklığını araştırmak için ideal bir hayvan modeli olarak kullanılabilir. Bu sonuçlar önceki çalışmalarımızdan elde edilenlerle aynı fikirdeydi ve hGPI'lere bağlı RA modeli31'instabilitesini gösterdi.
Genel olarak, karışık G6PI peptidler tarafından indüklenen RA fare modeli, RA hastalarında CD4+ T hücreleri, iNKT hücreleri ve ilgili sitokinlerdeki değişiklikleri simüle edebilir. Bu RA derinlemesine araştırma için iyi bir model sağlar. Ardışık olarak, α-GalCer intraperitoneal enjeksiyonu ile indüklenen ve in vitro saflaştırılmış iNKT (özellikle iNKT2) RA tedavisinde kullanıldı. Bu Th alt kümelerinin anormal çoğalması neden bağışıklık dengesizliği düzeltebilir, RA ilerlemesini rahatlatmak, ve gelecekte RA klinik tedavisi için yeni yöntemler sağlayabilir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar hiçbir finansman veya çıkar çatışması beyan.
Acknowledgments
Çalışmamız Çin Ulusal Doğa Bilimleri Vakfı (NSFC) (81771755), Kolejler ve Hebei eyaleti (ZD2017009) kolejleri ve üniversitenin bilim ve teknoloji anahtar araştırma projesi ve Hebei Üniversitesi Hayvan Laboratuvarı Tıbbi Deney Merkezi tarafından desteklenmiştir. Desteklerinden dolayı minnettarız.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



