Summary
为了测试化学金对体内巨噬细胞招募的影响,使用整个原位杂交检测化学体异位表达,免疫染色用于标记巨噬细胞。实时成像用于实时观察巨噬菌体迁移。
Abstract
斑马鱼在基础和生物医学研究中被广泛使用。许多斑马鱼转基因线目前可用于标记各种类型的细胞。由于斑马鱼的胚胎体透明,研究一种化学素对体内某类细胞行为的影响是很方便的。在这里,我们提供了一个工作流程,以调查化学体内巨噬菌体迁移的功能。我们构建了一个组织特异性过度表达质粒,以过度表达IL-34,并将质粒注入单细胞级转基因鱼胚胎中,其巨噬细胞被荧光蛋白专门标记。然后,我们使用全安装荧光原位杂交和免疫染色来检测化学体表达的模式以及巨噬细胞的数量或位置。注射的WT胚胎被培养成稳定的转基因线。最后,利用共聚焦活成像直接观察稳定转基因鱼的巨噬行为,研究IL-34对体内巨噬细胞的功能。
Introduction
斑马鱼是一种原产于印度的热带硬骨淡水鱼。在基因保护方面,斑马鱼与人类1的相似度为87%。通过研究斑马鱼的基因调节、蛋白质功能和细胞行为,如迁徙、增殖et.al等,我们可以对人类的相关课题进行见解。斑马鱼胚胎可用于观察抑制色素后不同阶段早期胚胎的发育。同时,斑马鱼只需三个月就能发育成性成熟,斑马鱼每4天就能产下数百个卵。体积小,繁殖简单,繁殖能力强,这些优势使斑马鱼养殖非常节省空间,有利于大规模养殖。传统的哺乳动物模型小鼠的维护成本比斑马鱼高,因此限制了小鼠饲养的规模。在早期胚胎发育方面,由于母子宫小鼠胚胎发育的特点,小鼠胚胎在活体条件下难以观察。相反,斑马鱼胚胎在外部发育和透明,因此在显微镜下很容易观察。此外,斑马鱼很容易为相关基因功能研究构建各种转基因线。目前,各种斑马鱼转基因线可用于标记不同类型的细胞。现在,在特定位置构造转基因线来过度表达化学素,并研究化学素对斑马鱼细胞行为的作用是非常方便的。
在这里,我们提供了一个工作流程,使用斑马鱼转基因线来研究IL-34对体内巨噬细胞行为2,3,4,5,6,7的功能。首先,我们构建了基因il34的肝脏特异性过度表达质粒,并将质粒注入单细胞阶段Tg(mpeg1:GFP)鱼胚胎中,该胚胎通过荧光蛋白GFP专门标记巨噬细胞。然后,我们使用全座荧光原位杂交和免疫染色来检测il34表达的图案以及巨噬细胞的数量或位置。注射的WT胚胎被培养成稳定的转基因线。在这些步骤中,我们建立并验证了细胞因子生成线,并直观地评估了对巨噬细胞分布的影响。最后,为了研究巨噬细胞行为对细胞因子的反应,我们使用共聚焦活成像直接观察巨噬细胞迁移,以确认il34对体内巨噬细胞迁移的功能。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:所有样品均通过苯基尿酸(PTU)蛋水处理,以抑制色素。
1. Tg的生成 (fabp10a: il34) 转基因构造和鱼类注射
- 将斑马鱼的 2.8 kb fabp10a启动子8和 IL-34 编码区域 (ENSDART00000126460.3) 克隆到 pTol2 矢量中,以生成 fabp10a-il34 构造。将结构与转座酶mRNA一起注入单细胞阶段Tg(mpeg1:GFP)和WT鱼胚胎。 将fabp10a-il34注射WT胚胎注射到成人9,并通过原位杂交识别转基因创始人。
注:如果另一条转基因线是使用相同的转波系统,则将Tol2结构直接注入另一个转基因物可能会有问题。一般的做法是建立一个独立的转基因线,然后与另一个记者线跨越新的线。这可确保新的转因对先前插入的转基因不会产生影响。
2. 荧光全山原位杂交 (WISH) 与免疫染色相结合
- 样品固定
- 收集瞬态注射或稳定的IL-34转基因线的胚胎,在所需阶段与Tg(mpeg1:GFP)交叉。
注:对于这种情况,胚胎在受精后4d(dpf)收集。(如果需要)用注射器取出胆汁。 - 在室温(RT)(约25°C)下,用4%甲醛(PFA)在4°C或2小时下整夜修复胚胎。
- 用磷酸盐缓冲盐水加补间20(PBST)3x 5分钟清洗胚胎。
- 在PBST(50%甲醇/PBST)和100%甲醇中分别用50%甲醇脱水胚胎,每次1x 5分钟。然后,更改为新鲜的100%甲醇,并储存在-20°C(至少2小时)。
注:可以在此处暂停该协议。
- 收集瞬态注射或稳定的IL-34转基因线的胚胎,在所需阶段与Tg(mpeg1:GFP)交叉。
- 探头杂交(第一天)
- 在前面的步骤中用PBST(50%甲醇/PBST)中50%甲醇对胚胎进行再水化,然后用PBST 3x 5分钟清洗。
- 在RT下用蛋白酶K在PBST中消化胚胎(最终浓度:10微克/mL;PBST为1:2000)。
注:消化时间取决于胚胎阶段:受精后不到36小时(hpf),无需;36 hpf-2 dpf 胚胎,3-5 分钟;2-3 dpf胚胎,10分钟;3-4 dpf胚胎,15分钟;4-5 dpf胚胎,15-20分钟;5-6 dpf胚胎,20-27分钟;>6 dpf 胚胎,RT (约 25 °C)25-30 分钟。 - 丢弃消化溶液,用4%的PFA再次进行固定,在RT处进行20分钟。
- 用PBST 2x 10分钟清洗胚胎。
- 丢弃 PBST,在 65°C 下使用加热杂交缓冲液 (HB 缓冲液) 执行预杂交 5 分钟,将 HB 缓冲液回收到原始管中。
- 在 65°C 下至少 1 小时使用新的加热 HB 缓冲液执行预杂交。
- 预热探头9(本例中为il34探头,1纳克/mL),在65°C下至少10分钟。然后,将 HB 缓冲液回收到原始管中。在65°C下使用预热探头进行混合。
- 抗体治疗(第二天)
- 预热 50% 形式酰胺/2x 盐酸钠柠子加补胶 20 (SSCT),2x SSCT,0.2x SSCT 在 65°C 下。
- 将探头回收到原管中,并将探头储存在 -20°C。
- 用50%的成酰胺/2x SSCT分别清洗胚胎;2x SSCT;0.2x SSCT,3x 20 分钟或 2x 30 分钟,分别在 65°C。
- 用PBST 3x 5分钟清洗胚胎
- 在RT处用600μL的阻断缓冲液(PBST中5%过滤的胎儿牛血清(FBS))将样品阻断1小时。
- 加入400μL的抗二角素-HRP抗体溶液(1:1,000-1:2,000在阻断缓冲液中),并在4°C过夜孵育胚胎。如果信号弱,使用1:500稀释抗体。
- 着色和原发抗体孵育(第三天)
- 取出抗体;用PBST清洗胚胎,6x20分钟在RT。
- 在 RT 下用 30 μL 的 1x 加放大稀释剂冲洗样品 5 分钟。
- 通过移液丢弃稀释剂;稀释氟磷Tyramide库存溶液(青宁3加扩增试剂(Cy3)或青宁5加扩增试剂(Cy5),在这种情况下使用Cy3)1:50在1x加放大稀释剂,使氟磷素泰拉姆迪苯工作溶液。为每个样品准备 50-100 μL 的工作溶液。
- 在RT的黑暗中孵育样品在荧光酸素工作溶液中5-15分钟。如果信号较弱,将孵育时间延长到30分钟。
- 通过使用 PBST 更改工作溶液来停止反应并检查信号。
- 在 RT 处用 PBST 3x 10 分钟清洗胚胎。
- 在4°C下用原抗体孵育样品过夜。对于这种情况,使用山羊-抗GFP抗体作为主要抗体。
- 二次抗体染色(第四天)
- 用PBST清洗胚胎4x30分钟。
- 用二次抗体在4°C孵育胚胎过夜。对于这种情况,使用 Alexa 488-抗山羊抗体作为辅助抗体。
- 拍照(第五天)
- 在 RT 处用 PBST 3x 10 分钟清洗胚胎。
- 将胚胎储存在70%甘油中,在4°C过夜或-20°C下储存更长时间。
3. 实时成像
-
示例选择
注:使用实时图像直接观察Tg(fabp10a:il34;fabp10a:DsRed;mpeg1:GFP)鱼在IL-34诱导下在3-3.5 dpf下是否迁移到肝脏。 在这里Tg (fabp10a-DsRed) 转基因线用于标记肝脏区域并使其可见,以促进肝脏的定位,并确定巨噬细胞是否迁移到肝脏。成像前,使用荧光显微镜选择DsRed和GFP双阳性胚胎。 -
鱼安装
- 使用金属浴将 1 mL 的 1% 低熔化甘蔗加热到 90°C 以上,使其完全熔化。
- 低熔化的甘草冷却至体温后,加入50μL的0.2%三角肌,并均匀地将三角肌与角质混合。
- 将麻醉胚胎移到底部安装有盖滑动的小盘子上,去除周围的水,慢慢将低融化的甘蔗滴在胚胎上,在角膜凝固之前小心地设置鱼的位置,保持肝脏区域靠近盖子在盘子底部滑动。
- 低熔的甘蔗凝固后,小心地用另一层甘蔗覆盖以强化它。
- 将盘子放在共聚焦显微镜载体桌上,用E2溶液10用三角板盖住鱼,然后开始成像。
-
共聚焦显微镜的软件操作
- 打开ZEN 黑色 2.3软件,将客厅工作台安装到显微镜托架表上。
- 单击"查找" |孵化|将温度设置为 29°C 的温度。
- 将盘子放在活细胞工作台的中心,用E2溶液10用三叶草盖住鱼。
- 单击"采集"菜单,在"智能设置"菜单中选择所需的扫描模式和激光,然后选择Z-Stack和位置。
- 单击"实验设计器"菜单,在第一个块中选择"启用多块实验",在低放大倍率下查找样本,然后切换到高放大倍率,让观测区域位于视觉场的中心。
- 设置位置和 Z-Stack 信息,选择适当的激光强度、扫描层和成像速度。
- 创建新块并重复上述步骤。设置所有块后,设置适当的循环数并开始记录 (图 1)。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
斑马鱼协议中涉及的步骤如图2所示。首先,我们生成了 pBLK-fabp10a-il34-sv40 构造,其中il34由fabp10a启动子驱动(图 2)。该结构被微注入单细胞阶段Tg (mpeg1:GFP)斑马鱼胚胎,可以标记巨噬细胞与GFP和WT胚胎,这些胚胎被培养成人,以产生转基因稳定线(图2)。il34的表达通过全支装荧原位杂交进行分析(图2和图3)。通过免疫染色对GFP标记的巨噬细胞进行分析(图2和图3)。我们使用活成像直接观察巨噬细胞是否会在3-3.5 dpf期间在il34感应下迁移到肝脏(图2,图4,补充电影1和补充电影2).
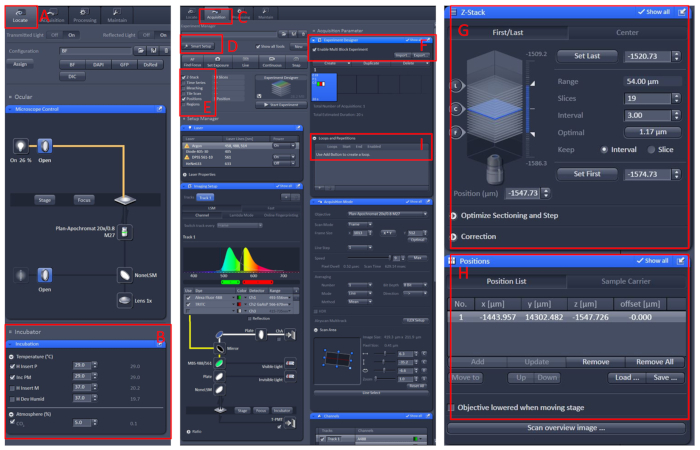
图1:共聚焦显微镜现场成像的软件操作。打开ZEN 黑色 2.3软件,将活细胞工作台安装到显微镜载体表上,然后单击"定位(A) " |孵化|温度(B) 将温度设置为 29 °C.将盘子放在活细胞工作台的中心,用E2溶液10用三叶草盖住鱼。之后,单击"采集(C) "菜单,在智能设置(D) 菜单中选择所需的扫描模式和激光,然后选择Z-Stack和位置(E)。最后,单击实验设计器(F) 菜单,在第一个块中选择"启用多块实验",在低倍率下查找样本,然后切换到高放大倍率,让观察区域在中心视场,设置位置和Z-Stack(G和H)信息,选择适当的激光强度、扫描层和成像速度。创建新块,然后重复上述步骤。设置所有块后,设置适当的循环数 (I) 并开始录制.请点击此处查看此图的较大版本。

图2:研究化学体内巨噬菌体迁移功能的工作流程。我们构建了一个组织特异性(肝脏)过度表达质粒以过度表达IL-34,并将质粒注入单细胞级转基因鱼胚胎中,其巨噬细胞被荧光蛋白专门标记(Tg: (mpeg1: GFP))).注射的WT胚胎被培养成稳定的转基因线。然后,我们使用全座荧光原位杂交和免疫染色来检测基因表达的模式以及瞬态注射胚胎或稳定线胚胎(4 dpf)巨噬细胞的数量或位置。最后,利用共聚焦活成像直接观察稳定转基因鱼(3-3.5 dpf)的巨噬细胞行为,研究IL-34对体内巨噬细胞的功能。请点击此处查看此图的较大版本。

图3:荧光WISH与免疫染色相结合。这个数字已由江等人11日修改。pBLK-fabp10a-il34-sv40构造共1.8 nL(30纳克/μL)被微注入单细胞阶段Tg(mpeg1:GFP)斑马鱼胚胎。(A) 4 dpf 胚胎(6x)中 GFP 表达(绿色)的il34表达(红色)和全安装抗体染色的 WISH。鱼的整个身体图片由两个独立的图像组成,由共聚焦拍摄,并在Photoshop中拼接在一起。内联是相应盒装区域(橙色虚线区域)的高放大倍率(20 倍)。(B) 未注射和构造胚胎肝脏(显示在白色虚线区域)和尾部区域(大约在13号和17号苏米特之间,两条白色虚线之间)的巨噬细胞数定量分析。数据由曼·惠特尼 U 测试分析, = p < 0.01 与对照相比.n = 5,5 为4 dpf注射和控制鱼。条形: 200 μm (白线);50 μm(黄线)。(C) 4 dpf稳定线胚胎(6x)中GFP表达的il34表达和全座抗体染色的WISH。鱼的整个身体图片由两个独立的图像组成,由共聚焦拍摄,并在Photoshop中拼接在一起。内联是相应盒装区域(橙色虚线区域)的高放大倍率(20 倍)。(D) Tg (mpeg1: GFP)和Tg (fabp10a: il34; mpeg1: GFP)胚胎肝脏(显示在白色虚线区域)和尾部区域(大约在13之间)的巨噬细胞数定量分析和 17 号索米特,显示在两条白色虚线之间)。请点击此处查看此图的较大版本。

图4:共聚焦活成像,直接观察稳定转基因鱼的巨噬细胞行为。这个数字已由江等人11日修改。活成像的显微图显示宏噬菌体(绿色,用白色箭头标记)在28分钟内通过肝脏(红色)的过程,以及宏噬菌体(绿色,用白色箭头标记)在28分钟内迁移到肝脏(红色)的过程在 IL-34 中,14 号过度表达鱼 (B)。刻度条 = 40 μm(白线)。请点击此处查看此图的较大版本。

补充电影1:实时成像显示巨噬细胞(绿色,用白色箭头标记)在IL-34过度表达的鱼2小时内迁移到肝脏(红色)的过程。刻度条 = 20 μm(白线)。这部电影已由江等人11日重新出版。请点击此处观看此视频。(右键单击下载。

补充电影2:实时成像显示巨噬细胞(绿色,用白色箭头标记)在2小时内在控制鱼的肝脏(红色)周围游荡的过程。刻度条 = 20 μm(白线)。这部电影已由江等人11日重新出版。请点击此处观看此视频。(右键单击下载。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
这里描述的协议允许我们研究化学对宏噬菌体体内行为的功能,并且该过程需要一些技术专长。总之,在协议中有几个关键步骤可以避免并发症:1) 选择一条合适的转基因线,显示特定且强的转基因信号,为感兴趣的细胞贴上标签;2) 选择适合成像和转基因基因过度表达的组织;3) 进行敏感和特异性的RNA探针;4) 选择适当的观察时间窗口,以准确捕获细胞行为。
在全坐式荧光原位杂交与免疫染色相结合过程中,用于检测基因表达的RNA探针应敏感,信号需要足够强。为了捕捉细胞行为的基因功能,应测试一系列时间点。例如,在观察il34对巨噬细胞迁移的影响时,虽然fabp10a启动子开始在2-3 dpf时表达,但当时肝脏中的巨噬细胞积累并不明显。只有4 dpf,肝脏巨噬菌体的富集才变得明显。此外,原位杂交后,后续免疫染色的信号强度将受到影响。例如,与GFP相比,DsRed在原位杂交后免疫荧光染色中很难着色,这可能是因为蛋白质结构不同。一般来说,全坐式荧光原位杂交后免疫染色的信号强度小于单免疫染色。
在使用共聚焦显微镜的活成像步骤中,有必要将样品保持接近盘子底部。当胚胎漂浮在甘蔗中时,目标的工作距离可能不够,而且,目标与样品之间的焦油会影响成像质量。此外,每次成像的样本数量应正确设置。必须确保每条鱼的两次扫描之间的时间跨度不会太长,不会丢失细胞行为的细节。因此,这种方法不适合跟踪在厚组织中快速移动的细胞。
总之,该协议可用于观察化学基因对巨噬细胞、嗜中性粒细胞和T细胞等多种细胞行为的功能。在这里,我们使用IL-34,一种最近鉴定的CSF-1R功能配体在化学6,7,作为异位表达的化学体诱导巨噬细胞迁移。现有的细胞化学实验模型大多基于体外细胞实验,但体外实验有时过于简单,无法对体内的复杂环境进行建模。此外,当简单地观察体外情况时,很难想象体内的化疗吸引力。该方法利用斑马鱼的具体优势进行直接细胞行为观察,这对小鼠来说是困难的。目前的方法使我们能够在几天内快速测试细胞行为中的化学素功能,使斑马鱼成为研究分子和细胞生物学的强大模型。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
我们感谢彭景荣博士分享Tg(fabp10a:DsRed)转基因线;温子龙博士分享Tg(mpeg1:GFP)转基因线;川口孝一博士提供pTol2向量。这项工作得到了国家自然科学基金(31771594)、广东省科技计划项目(2019A030317001)和中央高校基础研究基金(D2191450)的支持。
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



