Summary
For at afprøve virkningen af en kemokin på makrofag rekruttering in vivo, blev hele Mount in situ hybridisering anvendt til at detektere ektopisk ekspression af chemokin, og immun farvning blev brugt til at mærke makrofager. Live imaging blev brugt til realtids observation af makrofag migration.
Abstract
Zebrafish anvendes i vid udstrækning i grundforskning og biomedicin. Mange Zebra transgene linjer er i øjeblikket tilgængelige til at mærke forskellige typer af celler. På grund af den gennemsigtige embryonale krop af zebrafish, er det bekvemt for os at studere effekten af en chemokine på opførsel af en bestemt type celler in vivo. Her leverede vi en arbejdsgang til at undersøge funktionen af en chemokine på makrofag migration in vivo. Vi konstruerede en vævs specifik overekspression plasmid til at over ekspor IL-34 og injicerede plasmid i en-celle fase transgene fiskeembryoner, hvis makrofager var specifikt mærket af et fluorescerende protein. Vi brugte derefter hele Mount fluorescerende in situ hybridisering og immun farvning til at detektere mønsteret af chemokine ekspression og antallet eller placeringen af makrofager. De injicerede WT embryoner blev opvokset for at generere en stabil transgene linje. Endelig brugte vi konfokale Live imaging til direkte at observere makrofagopførsel i den stabile transgene fisk for at studere funktionen af Il-34 på makrofager in vivo.
Introduction
Zebrafish er en lille tropisk hård knogler ferskvandsfisk stammer fra Indien. Med hensyn til genbevaring, zebra har en lighed på 87% til den menneskelige1. Det kan give os indsigt i beslægtede emner af mennesker ved at studere gen regulering, protein funktion og celle adfærd såsom migration, proliferation et.al i zebrafish. Zebrafish embryo kan bruges til at observere udviklingen af tidlige embryoner på forskellige stadier efter inhibe ring af pigment. I mellemtiden, det tager kun tre måneder for Zebra at udvikle sig til seksuel modenhed, så Zebra kan producere hundredvis af æg hver 4 dage. Mini-størrelse, simpel avl, stærk reproduktionsevne, disse fordele gør Zebra kultur meget pladsbesparende, befordrende for storstilet kultur. Den traditionelle pattedyr model mus har en højere vedligeholdelsesomkostninger end zebrafish, derfor begrænser omfanget af musen hæve. I det aspekt af tidlig embryo udvikling, mus embryo er vanskeligt at observere i levende tilstand på grund af de særlige kendetegn ved mus embryo udvikling i moder livmoderen. Tværtimod udvikler Zebra embryoner eksternt og er gennemsigtige, og derfor er de lette at observere under et mikroskop. Desuden er Zebra meget let at konstruere en række transgene linjer til relateret gen funktion forskning. I øjeblikket er forskellige Zebra transgene linjer tilgængelige til at mærke forskellige typer af celler. Det er meget bekvemt nu at konstruere transgene linjer til overekspressen kemokiner i bestemte steder og studere kemokiner funktion på celle adfærd i zebrafish.
Her leverede vi en arbejdsgang til at bruge Zebra transgene line til at undersøge funktionen af Il-34 på makrofag adfærd i vivo2,3,4,5,6,7. For det første byggede vi en lever-specifik overekspression plasmid af genet il34 og injicerede plasmid i en-celle Stage TG (MPEG1: gfp) fiskeembryoner, som specifikt mærkede makrofager ved fluorescerende protein gfp. Derefter brugte vi hele Mount fluorescerende in situ hybridisering og immun farvning til at detektere mønsteret af il34 udtryk og antallet eller placeringen af makrofager. De injicerede WT embryoner blev opvokset for at generere en stabil transgene linje. I disse trin etablerede og validerede vi den cytokinproducerende linje og vurderede visuelt de virkninger, der kan ses på makrofag distributionen. Endelig, for at undersøge makrofag adfærd som reaktion på cytokin, vi brugte konfokale Live imaging til direkte observere makrofag migration for at bekræfte funktionen af il34 på makrofag migration in vivo.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Bemærk: Alle prøverne blev behandlet med phenylthiourea (PTU) ægge vand for at hæmme pigment.
1. generation af TG (fabp10a: il34) transgene konstruktioner og fisk injektion
- Klon 2,8 KB fabp10a Promoter8 og Il-34 kodning regioner (ensdart 00000126460.3) af Zebra i pTol2 vektor til at generere fabp10a-il34 konstruere. Indsprøjte konstrukterne i en-celle Stage TG (MPEG1: gfp) og WT fiskeembryoner sammen med Transposase mRNA. Hæv de fabp10a-il34 injicerede WT-embryoner til voksen9 og Identificer den transgene grundlægger ved in situ-hybridisering.
Bemærk: Injektion af Tol2 konstruere direkte i en anden transgene kunne være problematisk, hvis den anden transgene linje er lavet med samme gennemførelse system. En generel praksis ville være at gøre en uafhængig transgene linje og derefter krydse den nye linje med en anden Reporter linje. Dette sikrer, at der ikke vil være nogen effekt af den nye transgenese på et tidligere indsat transgen.
2. fluorescerende hele Mount in situ hybridisering (ønske) kombineres med immun farvning
- Prøve fiksering
- Indsamle embryoner af forbigående injektion eller stabil IL-34 transgene linje, som krydsede med TG (MPEG1: GFP) i de ønskede stadier.
Bemærk: I dette tilfælde blev embryonerne indsamlet ved 4 d efter befrugtning (DPF). (Hvis nødvendigt) Fjern chorion med sprøjten. - Embryonerne med 4% PARAFORMALDEHYD (PFA) fastsættes natten over ved 4 °C eller 2 timer ved stuetemperatur (RT) (ca. 25 °C).
- Embryonerne skylles med fosfat bufferet saltvand plus Tween 20 (PBST) 3x 5 min.
- Embryonerne dehydreres separat med 50% methanol i PBST (50% methanol/PBST) og 100% methanol, 1x 5 min. hver. Derefter skiftes til frisk 100% methanol og opbevares ved-20 °C (mindst 2 timer).
Bemærk: Protokollen kan sættes på pause her.
- Indsamle embryoner af forbigående injektion eller stabil IL-34 transgene linje, som krydsede med TG (MPEG1: GFP) i de ønskede stadier.
- Probe hybridisering (dag I)
- Rehydratere embryonerne i de foregående trin med 50% methanol i PBST (50% methanol/PBST), og vask derefter med PBST 3x 5 min.
- Embryonerne med proteinase K i PBST fordøje ved RT (endelig koncentration: 10 μg/mL; 1:2000 i PBST).
Bemærk: Fordøjelsestid afhænger af embryonerne fase: mindre end 36 h efter befrugtning (HPF), intet behov; 36 HPF-2 DPF-embryo, 3-5 min; 2-3 DPF-embryo, 10 min; 3-4 DPF-embryo, 15 min; 4-5 DPF-embryon, 15-20 min; 5-6 DPF-embryon, 20-27 min; > 6 DPF embryo, 25-30 min ved RT (ca. 25 °C). - Kassér fordøjelses opløsningen og Udfør fiksation igen med 4% PFA i 20 minutter ved RT.
- Embryoner vaskes med PBST 2x 10 min.
- Kassér PBST, Udfør præ-hybridisering med opvarmet hybridiserings buffer (HB-buffer) ved 65 °C i 5 minutter, genbrug HB-bufferen i det originale rør.
- Udfør præ-hybridisering med ny opvarmet HB-buffer ved 65 °C mindst 1 time.
- Forvarm sonden9 (i dette tilfælde var en il34 sonde, 1 ng/ml) ved 65 °c mindst 10 min. Derefter genbruge HB buffer i den oprindelige rør. Udfør hybridisering med den foropvarmede sonde ved 65 °C natten over.
- Antistof behandling (dag II)
- Forvarm 50% formamid/2x saltvands natriumcitrat plus Tween 20 (SSCT), 2x SSCT, 0,2 x SSCT ved 65 °C.
- Genanvend sonden i det originale rør, og opbevar sonden ved-20 °C.
- Embryonerne vaskes separat med 50% formamid/2x SSCT; 2x SSCT; 0,2 x SSCT, 3x 20 min eller 2x 30 min hver ved 65 °C.
- Embryoner vaskes med PBST 3x 5 min.
- Prøverne blokeres med 600 μL blokerende buffer (5% filtreret føtal bovint serum (FBS) i PBST) i 1 time ved RT.
- Tilsæt 400 μL anti-digoxigenin-HRP-antistof opløsning (1:1000-1:2000 i blokerende buffer), og Inkuber embryonerne ved 4 °C natten over. Hvis signalerne er svage, skal du bruge 1:500 fortynding af antistof.
- Farvning og primær antistof inkuiering (dag III)
- Fjerne antistoffet; embryoner vaskes med PBST, 6x 20 min ved RT.
- Prøven skylles med 30 μL 1x plus Amplifikationdiluent i 5 minutter ved RT.
- Kassér fortyndingsvæsken ved pipettering ud; fortyndet Fluorophore Tyramid stamopløsning (Cyanine 3 plus Amplifikationreagens (Cy3) eller Cyanine 5 plus Amplifikationreagens (Cy5), i dette tilfælde Cy3 blev brugt) 1:50 i 1x plus Amplifikationfortynder for at gøre Fluorophore Tyramid-arbejdsopløsningen. Forbered 50-100 μL arbejdsopløsning til hver prøve.
- Prøven inkubates i Fluorophore Tyramid-arbejdsopløsningen til 5-15 min i mørke ved RT. Hvis signalerne er svage, skal inkubationstiden forlænges til 30 minutter.
- Stop reaktionen ved at ændre arbejdsopløsningen med PBST og undersøge signalerne.
- Embryoner vaskes med PBST 3x 10 min ved RT.
- Prøven inkubates med primært antistof ved 4 °C natten over. I dette tilfælde skal du bruge Goat-anti-GFP antistof som det primære antistof.
- Sekundær antistof farvning (dag IV)
- Embryoner vaskes med PBST i 4X 30 min.
- Embryonerne med sekundært antistof inkubates ved 4 °C natten over. I dette tilfælde skal du bruge Alexa 488-anti-Goat antistof som det sekundære antistof.
- Tag billeder (dag V)
- Embryoner vaskes med PBST 3x 10 min ved RT.
- Embryonerne opbevares i 70% glycerol i mørke ved 4 °C natten over eller-20 °C i længere tid.
3. Live imaging
-
Prøve at vælge
Bemærk: brug Live-billedet til direkte at observere, om makrofager af TG (fabp10a: Il34; fabp10a: DSRED; MPEG1: gfp) fisk ville MIGRERE til leveren under Il-34 induktion under 3-3.5 DPF. Her anvendes TG (Fabp10a-dsred) transgene line til at mærke leveren regionen og gøre det synligt, at lette lokaliseringen af leveren og til at afgøre, om makrofager migrere ind i leveren. Før billeddannelse skal du bruge et fluorescens mikroskop til at vælge de dobbelte positive embryoner fra DsRed og GFP. -
Fisk montering
- Brug et metalbad til at opvarme 1 mL 1% lav smelte agopstået til over 90 °C for at smelte det helt.
- Efter den lave smeltende agopstået afkøles til kropstemperatur, tilsættes 50 μL 0,2% tricain, og ensartet mix tricain med agrose.
- Flyt de bedøvede embryoner til en lille skål monteret med et cover dias på bunden, fjerne det omgivende vand, langsomt droppe den lave smeltende agopstået på embryonerne, omhyggeligt indstille positionen af fiskene, før agantet er solidificeret, holde leveren området tæt på dækslet glider på bunden af skålen.
- Efter den lave smeltende agopstået er solidificeret, omhyggeligt dække det med et andet lag af agopstået at forstærke det.
- Placer skålen på Konfokal mikroskop bære bord, dække fiskene med E2 løsning10 med tricain og start Imaging.
-
Software drift af confokale mikroskop
- Åbn Zen black 2,3 software, installere Living Cell Workbench på mikroskopet bære bord.
- Klik på Find | Inkubation | Temperatur for at indstille temperaturen til 29 °c.
- Placer skålen i midten af den levende celle Workbench, dække fiskene med E2 løsning10 med tricain.
- Klik på menuen anskaffelse , Vælg den ønskede scanningstilstand og lasere i Smart setup -menuen, og vælg derefter Z-stack og position.
- Klik på eksperiment designer menuen, Vælg Aktivér multi blok eksperiment, i den første blok, for at finde eksemplet under den lave forstørrelse, og skift derefter til den høje forstørrelse, lad det observerede område i midten af det visuelle felt.
- Indstil position og Z-stack oplysninger, Vælg den relevante laser intensitet, scanning lag og billeddannelse hastighed.
- Opret en ny blok, og Gentag ovenstående trin. Efter opsætning af alle blokke, Indstil det relevante antal sløjfer og start optagelsen (figur 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De skridt, der er involveret i protokollen af Zebra er illustreret i figur 2. For det første genererede vi pBLK-fabp10a-il34-SV40-konstruktionen, hvor il34 blev drevet af fabp10a promotoren (figur 2). Konstruktionen blev mikroinjiceres i en-celle Stage TG (MPEG1: gfp) Zebra embryoner, som kan mærke makrofager med gfp og WT embryoner, som blev hævet til voksne til at generere transgene stabil linje (figur 2). Ekspression af il34 blev analyseret af hele Mount fluorescens in situ-hybridisering (figur 2 og figur 3). Makrofager, der er mærket af GFP, blev analyseret ved immun farvning (figur 2 og figur 3). Vi brugte Live imaging til direkte at observere, om makrofager ville migrere til leveren under il34 induktion under 3-3.5 DPF (figur 2, figur 4, supplerende film 1 og supplerende film 2) .
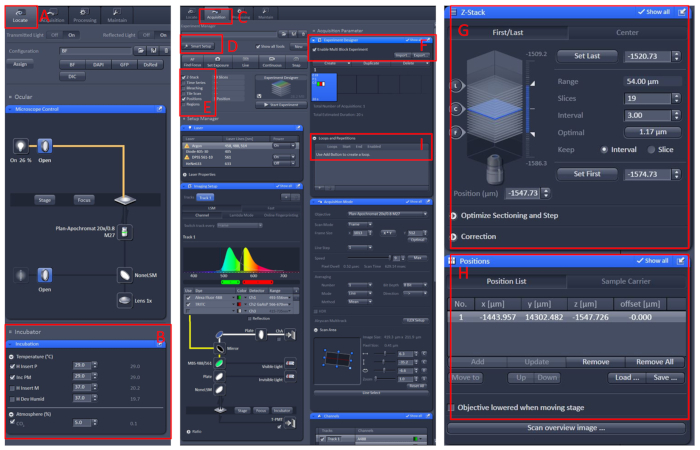
Figur 1: software drift af confokal mikroskop Live imaging. Åbn Zen black 2,3 -softwaren, Installer Living Cell Workbench påmikroskopetbære bord, og klik derefter på Find (A) | Inkubation | Temperatur B) at indstille temperaturen til 29 °c. Placer skålen i midten af den levende celle Workbench, dække fiskene med E2 løsning10 med tricain. Efter alt dette skal du klikke på menuen anskaffelse (C), vælge den ønskede scanningstilstand og lasere i menuen Smart setup (D) og derefter vælge Z-stack og position (E). Endelig skal du klikke på eksperiment designer (F) menu, Vælg Aktivér multi blok eksperiment, i den første blok, for at finde prøven under den lave forstørrelse, og skift derefter til den høje forstørrelse, lad det observerede område i i midten af det visuelle felt, indstille positionen og Z-stack (G og H) oplysninger, skal du vælge den relevante laser intensitet, scanning lag og billeddannelse hastighed. Opret en ny blok, og Gentag ovenstående trin. Når du har indstillet alle blokke, skal du indstille det relevante antal sløjfer (i) og starte optagelsen. Venligst klik her for at se en større version af dette tal.

Figur 2: en arbejdsgang til at undersøge funktionen af en chemokine på makrofag migration in vivo. Vi konstruerede en vævs specifik (lever) overekspression plasmid til overekspressen IL-34 og injicerede plasmid i en-celle fase transgene fiskeembryoner, hvis makrofager specifikt var mærket af et fluorescerende protein (TG: (MPEG1: gfp )). De injicerede WT embryoner blev opvokset for at generere en stabil transgene linje. Vi brugte derefter hele Mount fluorescerende in situ-hybridisering og immun farvning til at detektere mønsteret af genekspression og antallet eller placeringen af makrofager af de forbigående injicerede embryoner eller stabile linje embryoner (4 DPF). Endelig brugte vi konfokale Live imaging til direkte at observere makrofagopførsel i den stabile transgene fisk (3-3.5 DPF) for at studere funktionen af Il-34 på makrofager in vivo. Venligst klik her for at se en større version af dette tal.

Figur 3: fluorescerende ønske kombineres med immun farvning. Dette tal er blevet modificeret fra Jiang et al.11. I alt 1,8 nL (30 ng/μL) af pBLK-fabp10a-il34-SV40-konstruktionen blev mikroinjiceret i en-celle fase TG (MPEG1: GFP) -zebrafiskembryoner. (A) ønske om il34 -ekspression (rød) og antistof farvning af gfp-udtryk (grøn) i 4 DPF-embryo (6x). Hele kroppen billede af fiskene består af to separate billeder taget af konfokale og syet sammen i Photoshop. Insets er høj forstørrelse (20x) af de tilsvarende boxed regioner (orange punkterede områder). B) kvantitativ analyse af makrofagcelletal i un-injiceres og konstruere injicerede embryoner ' lever (vist i det hvide stiplede område) og hale region (omtrent mellem den 13. og 17th somite, vist mellem to hvide stiplede linjer). Data blev analyseret af Mann Whitney U test, * * p < 0,01 sammenlignet med kontrol. n = 5,5 for de 4 DPF injicerede og kontrol fisk. Stænger: 200 μm (hvid linje); 50 μm (gul linje). (C) ønske om il34 -ekspression og antistof farvning af gfp-udtryk i 4 DPF-stabilt linje embryo (6x). Hele kroppen billede af fiskene består af to separate billeder taget af konfokale og syet sammen i Photoshop. Insets er høj forstørrelse (20x) af de tilsvarende boxed regioner (orange punkterede områder). D) kvantitativ analyse af makrofag cellenumre i TG (MPEG1: gfp) og TG (fabp10a: il34; MPEG1: gfp) embryoner ' lever (vist i det hvide stiplede område) og hale region (ca. mellem den 13. og 17th somite, vist mellem to hvide punkterede linjer). Venligst klik her for at se en større version af dette tal.

Figur 4: Confocal Live imaging til direkte observere makrofag adfærd i den stabile transgene fisk. Dette tal er blevet modificeret fra Jiang et al.11. Mikrografer af levende billeddannelse viser processen med en makrofag (grøn, mærket med hvide pile), der passerer leveren (rød) inden for 28 min i kontrol fisk (a) og processen med en makrofag (grøn, mærket med hvide pile) migrere ind i leveren (rød) inden for 28 min i IL-34 overudtrykker fisk (B). Skala stænger = 40 μm (hvid linje). Venligst klik her for at se en større version af dette tal.

Supplerende film 1: Live imaging viser processen med makrofager (grøn, mærket med hvide pile) migrere ind i leveren (rød) inden for 2 h i Il-34 overudtrykker fisk. Skala stænger = 20 μm (hvid linje). Denne film er blevet genudgives fra Jiang et al.11. Venligst klik her for at se denne video. (Højreklik for at downloade.)

Supplerende film 2: Live imaging viser processen med makrofager (grøn, mærket med hvide pile) vandrer rundt i leveren (rød) inden for 2 h i kontrol fisk. Skala stænger = 20 μm (hvid linje). Denne film er blevet genudgives fra Jiang et al.11. Venligst klik her for at se denne video. (Højreklik for at downloade.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den protokol, der er beskrevet her, giver os mulighed for at undersøge funktionen af en chemokine på opførsel af macrophagein vivo og proceduren kræver nogle tekniske ekspertise. Sammenfattende er der flere kritiske skridt for at undgå komplikationer i protokollen: 1) Vælg en egnet transgene linje, der viser specifikke og stærke transgene signal til at mærke cellen af interesse; 2) Vælg et passende væv, der er tilgængeligt for billeddannelse og transgene gen overekspression; 3) lav en følsom og specifik RNA-sonde; 4) Vælg et passende observations tidsvindue for nøjagtigt at fange cellens opførsel.
Under proceduren for hele Mount fluorescens in situ-hybridisering kombineret med immun farvning bør RNA-sonden, der anvendes til at detektere genekspression, være følsom, og signalet skal være stærkt nok. For at fange genet funktion på celle adfærd, en række tidspunkter bør testes. For eksempel, ved at observere effekten af il34 på makrofag migration, selv om fabp10a promotoren begyndte at udtrykke på 2-3 DPF, makrofager ophobning i leveren var ikke indlysende på det tidspunkt. Det er kun ved 4 DPF, at tilsætning af makrofag i leveren bliver tydelig. Desuden vil signal intensiteten af efterfølgende immun farvning blive påvirket efter in situ-hybridisering. For eksempel, sammenligne med GFP, DsRed er vanskeligt at farve i immunofluorescens farvning efter in situ hybridisering, sandsynligvis på grund af de forskellige proteinstrukturer. Generelt ville signal intensiteten af immun farvning efter hele Mount fluorescens in situ-hybridisering være mindre end for enkelt immun farvning.
I Live imaging trin med confokale mikroskop, er det nødvendigt at holde prøven tæt på bunden af skålen. Når embryonerne flyder i agopstået, kan arbejdsafstanden af målet være utilstrækkelig, også den agopstået mellem målet og stikprøven ville påvirke kvaliteten af billeddannelse. Desuden bør antallet af prøver til billeddannelse på hver gang indstilles korrekt. Man skal sørge for, at tidsrummet mellem to scanninger af hver fisk ikke ville være for lang til at miste detaljerne i celle adfærd. Så denne metode er ikke egnet til sporing af celler, der bevæger sig hurtigt i tykt væv.
Afslutningsvis kan denne protokol bruges til at observere funktionen af kemokiner på opførsel af en række celler, såsom makrofager, neutrofiler, og T-celler. Her brugte vi Il-34, en nyligt identificeret ligand af CSF-1r funktion i chemotaxis6,7, som en ektopic udtrykte chemokine at fremkalde makrofager migration. De fleste af de eksisterende eksperimentelle modeller af celle chemotaxis er baseret på in vitro celle eksperimenter, men in vitro eksperimenter undertiden er for enkle til at modellere det komplekse miljø in vivo. Også, det er svært at billedet kemo-attraktion abilityin vivo, når blot se på in vitro-situation. Denne metode udnyttede de specifikke fordele ved zebra for direkte celle adfærd observation, som er svært for mus. Den nuværende metode tillod os hurtigt at teste chemokine funktioner på celle adfærd inden for flere dage og gøre Zebra en kraftfuld model til at studere molekylær og cellebiologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Vi takker Dr. Jingrong Peng for deling af TG (fabp10a: DsRed) transgene line; Dr. Zilong Wen for deling af TG (MPEG1: GFP) transgene linjer; Dr. Koichi Kawakami for at levere den pTol2 vektor. Dette arbejde blev støttet af National Natural Science Foundation i Kina (31771594), Guangdong videnskab og teknologi plan projekter (2019A030317001) og de grundlæggende forskningsmidler til de centrale universiteter (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



