Summary
For å teste effekten av en chemokine på macrophage rekruttering i Vivo, ble hele Mount in situ hybridisering brukt til å påvise chemokine, og immunostaining ble brukt til å merke makrofager. Live Imaging ble brukt for sanntids observasjon av macrophage migrasjon.
Abstract
Sebrafisk er mye brukt i grunnleggende og biomedisinsk forskning. Mange sebrafisk transgene-linjer er for tiden tilgjengelige for å merke ulike typer celler. På grunn av den gjennomsiktige embryonale kroppen av sebrafisk, er det praktisk for oss å studere effekten av en chemokine på atferden til en bestemt type celler in vivo. Her har vi gitt en arbeidsflyt for å undersøke funksjonen til en chemokine på macrophage migrasjon in vivo. Vi konstruerte en vev-spesifikk overuttrykte plasmider til overekspresjon IL-34 og injisert plasmider i en celle scene transgene fisk embryo hvis makrofager var spesielt merket med et fluorescerende protein. Vi brukte deretter hele Mount fluorescerende in situ hybridisering og immunostaining å oppdage mønsteret av chemokine uttrykk og antall eller plassering av makrofager. Den injisert WT embryo ble hevet for å generere en stabil transgene linje. Til slutt brukte vi konfokalmikroskopi Live Imaging å direkte observere macrophage atferd i stallen transgene fisk å studere funksjonen til IL-34 på makrofager in vivo.
Introduction
Sebrafisk er en liten tropisk hard-Bones ferskvannsfisk oppsto i India. Når det gjelder gen bevaring, sebrafisk har en likhet med 87% til den menneskelige1. Det kan gi oss innsikt i beslektede emner av menneskelig ved å studere gen regulering, protein funksjon og celle atferd som migrasjon, spredning et.al i sebrafisk. Sebrafisk embryo kan brukes til å observere utviklingen av tidlig embryo på ulike stadier etter hemme pigment. I mellomtiden tar det bare tre måneder for sebrafisk å utvikle seg til seksuell modenhet, så sebrafisk kan produsere hundrevis av egg hver 4 dager. Mini-størrelse, enkel avl, sterk reproduktiv kapasitet, disse fordelene gjør sebrafisk kultur svært plassbesparende, bidrar til stor skala kultur. Den tradisjonelle pattedyr modellen musen har en høyere vedlikeholdskostnader enn sebrafisk, derfor begrenser omfanget av musen øke. I det aspektet av tidlig embryoutvikling, mus embryo er vanskelig å observere i live tilstand på grunn av egenskapene til musen embryoutvikling i mors liv. Tvert imot, sebrafisk embryo utvikles eksternt og er gjennomsiktige, derfor er de enkle å observere under et mikroskop. Videre er sebrafisk veldig lett å konstruere en rekke transgene linjer for relatert gen funksjon forskning. For tiden er ulike sebrafisk transgene Lines tilgjengelige for å merke ulike typer celler. Det er veldig praktisk nå å konstruere transgene Lines å overekspresjon chemokiner på bestemte steder og studere chemokiner funksjon på celle atferd i sebrafisk.
Her ga vi en arbeidsflyt for å bruke sebrafisk transgene line for å undersøke funksjonen til Il-34 om macrophage adferd i vivo2,3,4,5,6,7. For det første konstruerte vi en lever spesifikk overuttrykte plasmider av genet il34 og injisert plasmider i en-celle scene TG (MPEG1: GFP) fiske embryo som spesielt merket makrofager av fluorescerende protein GFP. Deretter brukte vi hele Mount fluorescerende in situ hybridisering og immunostaining å oppdage mønsteret av il34 uttrykk og antall eller plassering av makrofager. Den injisert WT embryo ble hevet for å generere en stabil transgene linje. I disse trinnene etablerte og validerte vi den cytokin linjen og vurderte effekten visuelt som kan ses på macrophage fordeling. Til slutt, for å undersøke macrophage adferd som svar på cytokin, brukte vi konfokalmikroskopi Live Imaging til direkte å observere macrophage migrasjon for å bekrefte funksjonen til il34 på macrophage migrasjon in vivo.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Merk: Alle prøvene ble behandlet av phenylthiourea (PTU) egg vann for å hemme pigment.
1. generering av TG (fabp10a: Il34) transgene konstruerer og Fish Injection
- Klon det 2,8 KB fabp10a promoter8 og det Il-34 kodingen områder (ensdart 00000126460.3) av sebrafisk inn i pTol2 vektor å utvikle det fabp10a-il34 konstruere. Injiser konstruerer i en-celle scene TG (MPEG1: GFP) og WT fisk embryo sammen med transposase mRNA. Hev fabp10a-il34 injisert WT embryo til voksen9 og Identifiser transgene grunnleggeren av in situ hybridisering.
Merk: Injeksjon av Tol2-konstruksjonen direkte inn i en annen transgene kan være problematisk hvis den andre transgene line er laget med samme Transposon system. En generell praksis vil være å gjøre en uavhengig transgene linje og deretter krysse den nye linjen med en annen reporter linje. Dette sikrer at det ikke vil være noen effekter av den nye transgenesis på en tidligere innsatt transgene.
2. fluorescerende hele Mount in situ hybridisering (ønske) Kombiner med Immunostaining
- Eksempel fiksering
- Samle opp embryo med forbigående injeksjon eller stabil IL-34 transgene linje som krysset med TG (MPEG1: GFP) på ønskede stadier.
Merk: For dette tilfellet ble embryo samlet ved 4 d post befruktning (DPF). (Om nødvendig) Fjern chorionic med sprøyten. - Fest embryo med 4% paraformaldehyde (PFA) over natten ved 4 ° c eller 2 t ved romtemperatur (RT) (ca. 25 ° c).
- Vask embryo med fosfat bufret saltvann pluss mellom 20 (PBST) 3x 5 min.
- Tørke embryo separat med 50% metanol i PBST (50% metanol/PBST) og 100% metanol, 1x 5 min hver. Bytt deretter til fersk 100% metanol og oppbevar ved-20 ° c (minst 2 h).
Merk: Protokollen kan stanses midlertidig her.
- Samle opp embryo med forbigående injeksjon eller stabil IL-34 transgene linje som krysset med TG (MPEG1: GFP) på ønskede stadier.
- Probe hybridisering (dag I)
- Rehydrate embryo i de foregående trinnene med 50% metanol i PBST (50% metanol/PBST), vask deretter med PBST 3x 5 min.
- Fordøye embryo med proteinase K i PBST ved RT (endelig konsentrasjon: 10 μg/mL; 1:2000 i PBST).
Merk: Fordøyelsen tid avhenger av embryo scenen: mindre enn 36 h post befruktning (hpf), ikke behov; 36 hpf-2 DPF embryo, 3-5 min; 2-3 DPF embryo, 10 min; 3-4 DPF embryo, 15 min; 4-5 DPF embryo, 15-20 min; 5-6 DPF embryo, 20-27 min; > 6 DPF embryo, 25-30 min ved RT (ca. 25 ° c). - Kast fordøyelsen løsningen og utføre fiksering igjen med 4% PFA, i 20 min ved RT.
- Vask embryo med PBST 2x 10 min.
- Kast PBST, Utfør pre-hybridisering med oppvarmet hybridisering buffer (HB buffer) ved 65 ° c i 5 min, resirkulere HB buffer i det opprinnelige røret.
- Utfør pre-hybridisering med ny oppvarmet HB-buffer ved 65 ° c minst 1 time.
- Før varme sonden9 (for dette tilfellet var en il34 sonde, 1 ng/ml) ved 65 ° c minst 10 min. Resirkuler deretter HB-bufferen i det opprinnelige røret. Utfør hybridisering med forvarmet sonde ved 65 ° c over natten.
- Antistoff behandling (dag II)
- Før varme opp 50% formamid/2x salt-natrium citrate pluss mellom 20 (SSCT), 2x SSCT, 0,2 x SSCT ved 65 ° c.
- Resirkuler proben i det opprinnelige røret og oppbevar proben ved-20 ° c.
- Vask embryo separat med 50% formamid/2x SSCT; 2x SSCT; 0,2 x SSCT, 3x 20 min eller 2x 30 min hver ved 65 ° c.
- Vask embryo med PBST 3x 5 min.
- Blokker prøvene med 600 μL av blokkerings buffer (5% filtrert fosterets serum (FBS) i PBST) for 1 time ved RT.
- Tilsett 400 μL av anti-digoxigenin-HRP antistoff løsning (1:1000-1:2000 i blokkering buffer) og ruge embryo ved 4 ° c over natten. Hvis signalene er svake, bruk 1:500 fortynning av antistoff.
- Farging og primære antistoff incubating (dag III)
- Fjern antistoff; og vask embryo med PBST, 6 ganger 20 min ved RT.
- Skyll prøven med 30 μL 1x Plus forsterkning fortynningsvæske i 5 minutter ved RT.
- Kast fortynnings MIDlet ved å pipettering ut; fortynne Fluoroforen Tyramide lagerløsning (Cyanine 3 addisjonstegn forsterkning reagens (Cy3) eller Cyanine 5 addisjonstegn forsterkning reagens (Cy5), for denne rettssak Cy3 var anvendt) 1:50 inne 1x addisjonstegn forsterkning Fortynnings å vil få Fluoroforen Tyramide arbeider løsning. Klargjør 50-100 μL av arbeids løsning for hver prøve.
- Ruge prøven i Fluoroforen Tyramide Working Solution for 5-15 min i mørket på RT. Hvis signalene er svake, forlenger du inkubasjonstid til 30 min.
- Stopp reaksjonen ved å endre arbeids løsningen med PBST og Undersøk signalene.
- Vask embryo med PBST 3x 10 min ved RT.
- Ruge prøven med primært antistoff ved 4 ° c over natten. For dette tilfellet, bruk Goat-anti-GFP-antistoff som primær antistoff.
- Sekundær antistoff farging (dag IV)
- Vask embryo med PBST for 4X 30 min.
- Ruge embryo med sekundært antistoff ved 4 ° c over natten. For dette tilfellet, bruk Alexa 488-anti-geit antistoff som sekundær antistoff.
- Ta bilder (dag V)
- Vask embryo med PBST 3x 10 min ved RT.
- Oppbevar embryo i 70% glyserol i mørket ved 4 ° c over natten eller-20 ° c lenger.
3. live Imaging
-
Eksempel på valg
Merk: bruk Live bildet til å direkte observere om makrofager av TG (fabp10a: Il34; fabp10a: DSRED; MPEG1: GFP) fisk ville migrere til leveren under Il-34 induksjon under 3-3.5 DPF. Her er TG (fabp10a-DsRed) transgene-linjen brukt til å merke lever regionen og gjøre den synlig, for å tilrettelegge for lokalisering av leveren og for å avgjøre om makrofager migrerer til leveren. Før bildebehandling, bruk et fluorescens mikroskop for å velge DsRed og GFP doble positive embryo. -
Montering av fisk
- Bruk et metall bad for å varme opp 1 mL 1% lavt smelte agarose til over 90 ° c for å smelte det helt.
- Etter at den lave smelte agarose er avkjølt til kroppstemperatur, tilsett 50 μL av 0,2% tricaine, og jevnt bland tricaine med agarose.
- Flytt anesthetized embryo til en liten tallerken montert med et deksel lysbilde på bunnen, fjerne omkringliggende vann, langsomt slippe lavt smelte agarose på embryo, nøye sette posisjonen til fisken før agarose er befestet, holde leveren området nær dekselet på undersiden av fatet.
- Etter den lave smelte agarose er befestet, forsiktig dekke den med et annet lag av agarose å forsterke den.
- Plasser parabolen på konfokalmikroskopi mikroskop transportør tabellen, dekk fisken med E2 løsning10 med tricaine og starte Imaging.
-
Programvare drift av konfokalmikroskopi mikroskop
- Åpne Zen black 2,3 -programvaren, Installer arbeidsbenken for levende celler på mikroskopstativet.
- Klikk Finn | Inkubasjons | Temperatur for å stille temperaturen til 29 ° c.
- Plasser parabolen i midten av den levende cellen arbeidsbenk, dekke fisken med E2 løsning10 med tricaine.
- Klikk på Acquisition -menyen, Velg ønsket skannemodus og lasere i smart setup -menyen, og velg deretter Z-stack og posisjon.
- Klikk på eksperiment designer menyen, velg Aktiver multi Block Experiment, i den første blokken, for å finne prøven under lav forstørrelse, og bytt deretter til høy forstørrelse, la det observerte området i midten av det visuelle feltet.
- Angi posisjon og Z-stack-informasjon, Velg riktig laser intensitet, skanne lag og bildehastighet.
- Opprett en ny blokk, og Gjenta trinnene ovenfor. Når du har satt opp alle blokkene, angir du riktig antall løkker og starter opptaket (figur 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Trinnene som er involvert i protokollen for sebrafisk er illustrert i figur 2. Først genererte vi den pBLK-fabp10a-il34-SV40 konstruere der il34 ble drevet av Fabp10a arrangøren (figur 2). Konstruksjonen ble microinjected i en-celle scene TG (MPEG1: GFP) sebrafisk embryo som kan merke makrofager med GFP og WT embryo som ble reist til voksne for å generere transgene stabil linje (figur 2). Uttrykket for il34 ble analysert av hele Mount fluorescens in situ hybridisering (figur 2 og Figur 3). Makrofager merket av GFP ble analysert av immunostaining (figur 2 og Figur 3). Vi brukte Live Imaging å direkte observere om makrofager ville migrere inn i leveren under il34 induksjon under 3-3.5 DPF (figur 2, Figur 4, supplerende film 1 og supplerende Movie 2) .
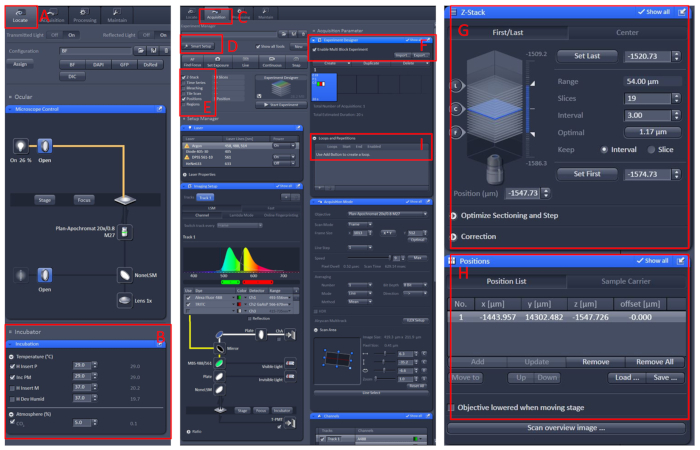
Figur 1: programvare drift av konfokalmikroskopi mikroskop Live Imaging. Åpne Zen black 2,3 -programvaren, Installer arbeidsbenken for levende celler på mikroskopstativet, og klikk deretter på Finn (A) | Inkubasjons | Temperatur (B) for å stille inn temperaturen til 29 ° c. Plasser parabolen i midten av den levende cellen arbeidsbenk, dekke fisken med E2 løsning10 med tricaine. Etter alle disse, klikk på Acquisition (C) menyen, Velg ønsket skannemodus og lasere i smart setup (D)-menyen, og velg deretter Z-stack og posisjon (E). Endelig, klikk på eksperiment designer (F) meny, velg Aktiver multi Block eksperiment, i den første blokken, for å finne prøven under lav forstørrelse, og deretter bytte til høy forstørrelse, la det observerte området i midten av det visuelle feltet, angi posisjon og Z-stack (G og H) informasjon, velger du riktig laser intensitet, skanning lag og tenkelig hastighet. Opprett en ny blokk, og Gjenta trinnene ovenfor. Etter å ha satt opp alle blokkene, angi riktig antall løkker (I) og Start opptak. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 2: en arbeidsflyt for å undersøke funksjonen til en chemokine på macrophage migrering in vivo. Vi konstruerte en vev-spesifikk (lever) overuttrykte plasmider til overekspresjon IL-34 og injisert plasmider i ett celle trinn transgene fisk embryo hvis makrofager var spesielt merket med et fluorescerende protein (TG: (MPEG1: GFP )). Den injisert WT embryo ble hevet for å generere en stabil transgene linje. Vi brukte deretter hele Mount fluorescerende in situ hybridisering og immunostaining å oppdage mønsteret av genet uttrykk og antall eller plassering av makrofager av transient injisert embryo eller stabil linje embryo (4 DPF). Til slutt brukte vi konfokalmikroskopi Live Imaging å direkte observere macrophage atferd i stallen transgene fisk (3-3.5 DPF) for å studere funksjonen til IL-34 på makrofager in vivo. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 3: FLUORESCERENDE ønske kombineres med immunostaining. Dette tallet har blitt modifisert fra Jiang et al.11. Totalt 1,8 nL (30 ng/μL) av pBLK-fabp10a-il34-SV40 konstruere ble microinjected i en celle scene TG (MPEG1: GFP) sebrafisk embryo. (A) ønske av il34 uttrykk (rød) og hel-Mount antistoff farging av GFP uttrykk (grønn) i 4 DPF embryo (6 ganger). Hele kroppen bilde av fisken består av to separate bilder tatt av konfokalmikroskopi og sydd sammen i Photoshop. Inn data er høy forstørrelse (20x) i de tilsvarende boksområdene (oransje stiplede områder). (B) kvantitativ analyse av macrophage celle tall i un-injisert og konstruere injisert embryo ' lever (vist i det hvite stiplede området) og halen region (omtrent mellom 13th og 17th somite, vist mellom to hvite stiplede linjer). Data ble analysert av mann Whitney U test, * * p < 0,01 sammenlignet med kontroll. n = 5, 5 for de 4 DPF injisert og kontroll fisk. Stolper: 200 μm (hvit linje); 50 μm (gul linje). (C) ønske om il34 uttrykk og hel-Mount antistoff farging av GFP uttrykk i 4 DPF stabil linje embryo (6 ganger). Hele kroppen bilde av fisken består av to separate bilder tatt av konfokalmikroskopi og sydd sammen i Photoshop. Inn data er høy forstørrelse (20x) i de tilsvarende boksområdene (oransje stiplede områder). (D) kvantitativ analyse av macrophage celle tall i TG (Mpeg1: GFP) og TG (fabp10a: il34; MPEG1: GFP) embryo lever (vist i det hvite stiplede området) og hale regionen (omtrent mellom 13. og 17nde somite, vist mellom to hvite stiplede linjer). Vennligst klikk her for å se en større versjon av dette tallet.

Figur 4: konfokalmikroskopi levende bildebehandling for direkte å observere macrophage atferd i stallen transgene Fish. Dette tallet har blitt modifisert fra Jiang et al.11. Micrographs av Live Imaging viser prosessen med en macrophage (grønn, merket med hvite piler) passerer leveren (rød) innen 28 min i kontroll fisk (a) og prosessen med en macrophage (grønn, merket med hvite piler) migrerer til leveren (rød) innen 28 min i IL-34 overexpressing fisk (B). Skala stolper = 40 μm (hvit linje). Vennligst klikk her for å se en større versjon av dette tallet.

Utfyllende film 1: Live Imaging viser prosessen med makrofager (grønn, merket med hvite piler) migrerer til leveren (rød) innen 2 t i Il-34 overexpressing fisk. Scale stenger = 20 μm (hvit linje). Denne filmen har blitt publiseres fra Jiang et al.11. Vennligst klikk her for å se denne videoen. (Høyreklikk for å laste ned.)

Utfyllende Movie 2: Live Imaging viser prosessen med makrofager (grønn, merket med hvite piler) vandrende rundt i leveren (rød) innen 2 t i kontroll fisk. Scale stenger = 20 μm (hvit linje). Denne filmen har blitt publiseres fra Jiang et al.11. Vennligst klikk her for å se denne videoen. (Høyreklikk for å laste ned.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Protokollen er beskrevet her tillater oss å undersøke funksjonen av en chemokine på atferden til macrophagein vivo og prosedyren krever noen teknisk ekspertise. Oppsummert er det flere viktige skritt for å unngå komplikasjoner i protokollen: 1) Velg en passende transgene linje som viser spesifikt og sterkt transgene signal for å merke cellen av interesse; 2) Velg et passende vev som er tilgjengelig for bildebehandling og transgene gen overuttrykte; 3) lage en sensitiv og spesifikk RNA-sonde; 4) Velg et passende observasjons tidsvindu for å nøyaktig fange celle atferden.
I prosedyren for hele monterings fluorescens in situ hybridisering kombinert med immunostaining, bør RNA-sonden som brukes til å påvise genuttrykk være følsomme, og signalet må være sterkt nok. For å fange gen funksjonen på celle atferden, bør en rekke tids punkter testes. For eksempel, i observere effekten av il34 på macrophage migrasjon, selv om fabp10a arrangøren begynte å uttrykke at 2-3 DPF, makrofager opphopning i leveren var ikke opplagt på den tiden. Det er bare ved 4 DPF at berikelse av macrophage i leveren blir åpenbar. I tillegg, etter in situ hybridisering, vil signal intensiteten til påfølgende immunostaining bli påvirket. For eksempel, sammenlignende med GFP, DsRed er vanskelig å fargen inne immunofluorescence flekk etter inne situ hybridisering, sannsynligvis med hensyn til det annerledes proteinstrukturer. Generelt sett vil signal intensiteten til immunostaining etter hele Mount fluorescens in situ hybridisering være mindre enn enkelt immunostaining.
I live Imaging trinn med konfokalmikroskopi mikroskop, er det nødvendig å holde prøven nær bunnen av fatet. Når embryo flyte i agarose, arbeidsavstand av målet kan være utilstrekkelig, også, agarose mellom målet og prøven vil påvirke kvaliteten på Imaging. For resten, antallet av eksemplar for tenkelig for hver gang burde være sette riktig. Man må sørge for at tidsrommet mellom to skanninger av hver fisk ikke ville være for lang til å miste detaljer om celle atferd. Så denne metoden er ikke egnet for sporing av celler som beveger seg raskt i tykt vev.
Avslutningsvis kan denne protokollen brukes til å observere funksjonen av chemokiner på atferden til en rekke celler som makrofager, nøytrofile, og T-celler. Her brukte vi Il-34, ennylig identifisert ligand av CSF-1R funksjoni chemotaxis,som et svangerskap utenfor livmoren uttrykt chemokine å indusere makrofager migrasjon. De fleste av de eksisterende eksperimentelle modeller av celle chemotaxis er basert på in vitro celle eksperimenter, men in vitro eksperimenter noen ganger er for enkelt å modellere det komplekse miljøet in vivo. Dessuten er det vanskelig å avbilde kjemoterapi-attraksjon abilityin vivo når bare se på in vitro situasjonen. Denne metoden utnyttet de spesifikke fordelene med sebrafisk for direkte celle atferd observasjon som er vanskelig for mus. Den nåværende metoden tillot oss å raskt teste chemokine funksjoner på celle atferd innen flere dager og gjøre sebrafisk en kraftig modell for å studere molekylær og cellebiologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Vi takker Dr. Jingrong Peng for deling av TG (fabp10a: DsRed) transgene line; Dr. Zilong Wen for deling av TG (MPEG1: GFP) transgene Lines; Dr. Koichi Kawakami for å gi pTol2 vektor. Dette arbeidet ble støttet av National Natural Science Foundation i Kina (31771594), Guangdong Science and Technology plan prosjekter (2019A030317001) og grunnleggende Research Funds for Central universiteter (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



