Summary
Bir kemokinin in vivo makrofaj alımı üzerindeki etkisini test etmek için, yerinde hibridizasyondaki tüm montaj, kemokinin ektopik ekspresyonunu saptamak için kullanıldı ve makrofajları etiketlemek için immünboyama kullanıldı. Makrofaj göçünün gerçek zamanlı gözlemi için canlı görüntüleme kullanıldı.
Abstract
Zebra balıkları temel ve biyomedikal araştırmalarda yaygın olarak kullanılmaktadır. Birçok zebra balığı transgenik hatları şu anda hücrelerin çeşitli etiketlemek için kullanılabilir. Zebra balığının saydam embriyonik gövdesi sayesinde, bir kemokinin in vivo hücrelerinin belirli bir türünün davranışı üzerindeki etkisini incelemek bizim için uygundur. Burada in vivo makrofaj göçü üzerine bir kemokin işlevini araştırmak için bir iş akışı sağladı. IL-34'ü aşırı ekspresye etmek için dokuya özgü aşırı ekspresyon plazmidi yaptık ve plazmidi makrofajları özellikle floresan proteinle etiketlenmiş tek hücreli transgenik balık embriyolarına enjekte ettik. Daha sonra keokin ekspresyonu paterni ve makrofajların sayısını veya yerini saptamak için yerinde hibridizasyon ve immünboyama tüm montaj floresan kullanılır. Enjekte edilen WT embriyoları kararlı bir transgenik çizgi oluşturmak için yetiştirildi. Son olarak, in vivo makrofajlar üzerinde IL-34 işlevini incelemek için doğrudan kararlı transgenik balık makrofaj davranışı gözlemlemek için konfokal canlı görüntüleme kullanılır.
Introduction
Zebra balığı Hindistan kökenli küçük bir tropikal sert kemikli tatlı su balığıdır. Gen koruma ile ilgili olarak, zebra balıkları insan1%87 benzerlik var. Zebra balıklarında gen regülasyonu, protein fonksiyonu ve hücre davranışı, et.al gibi hücre davranışlarını inceleyerek bize insanla ilgili konular hakkında bilgi verebilir. Zebrabalığı embriyosu pigmentini inhibe ettikten sonra farklı evrelerde erken embriyoların gelişimini gözlemlemek için kullanılabilir. Bu arada, zebra balıklarının cinsel olgunluğa dönüşmesi sadece üç ay sürer, o zaman zebra balığı her 4 günde bir yüzlerce yumurta üretebilir. Mini boyutlu, basit üreme, güçlü üreme kapasitesi, bu avantajlar zebra balığı kültürünü çok yer tasarrufu sağlar, büyük ölçekli kültüre elverişli dir. Geleneksel memeli model fare zebra balığıdaha yüksek bakım maliyetleri vardır, bu nedenle fare yetiştirme ölçeğini sınırlayan. Erken embriyo gelişimi açısından, fare embriyosu anne rahminde fare embriyo gelişiminin özellikleri nedeniyle canlı durumda gözlemlemek zordur. Aksine, zebra balığı embriyoları dışarıdan gelişir ve saydamdır, bu nedenle mikroskop altında gözlemlemek kolaydır. Ayrıca, zebra balığı ilgili gen fonksiyonu araştırma için transgenik çizgiler çeşitli inşa etmek çok kolaydır. Şu anda, çeşitli zebra balığı transgenik hatları hücrelerin farklı etiket mevcuttur. Kemokinleri belirli yerlerde aşırı eksprese etmek ve keokinlerin zebra balıklarındaki hücre davranışı üzerine çalışmasını incelemek için transgenik çizgiler oluşturmak artık çok uygundur.
Burada, il-34'ün in vivo2,3,4,5,6,7makrofaj davranışı üzerindeki işlevini araştırmak için zebra balığı transgenik hattını kullanmak için bir iş akışı sağladık. İlk olarak, il34 geninin karaciğere özgü aşırı ekspresyon plazmidini inşa ettik ve plazmidi tek hücreli evre Tg'ye (mpeg1: GFP) enjekte ettik ve bu da makrofajları özellikle floresan protein GFP ile etiketledi. Daha sonra, il34 ekspresyonunun desenini ve makrofajların sayısını veya yerini tespit etmek için yerinde hibridizasyon ve immünboyamada tüm montaj floresanını kullandık. Enjekte edilen WT embriyoları kararlı bir transgenik çizgi oluşturmak için yetiştirildi. Bu adımlarda sitokin üreten çizgiyi oluşturduk ve doğruladık ve makrofaj dağılımında görülebilecek etkileri görsel olarak değerlendirdik. Son olarak, sitokine yanıt olarak makrofaj davranışını araştırmak için, in vivo makrofaj göçünde il34'ün işlevini doğrulamak için makrofaj göçüne doğrudan gözlemlemek için konfokal canlı görüntüleme kullandık.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOT: Tüm örnekler pigmentini inhibe etmek için fenilthiourea (PTU) yumurta suyu ile tedavi edildi.
1. Tg Üretimi (fabp10a:il34) Transgenik Yapılar ve Balık Enjeksiyonu
- Clone 2.8 kb fabp10a organizatörü8 ve IL-34 kodlama bölgeleri (ENSDART00000126460.3) pTol2 vektör içine fabp10a-il34 inşa oluşturmak için zebra balığı. Yapıları transposase mRNA ile birlikte tek hücreli evre Tg (mpeg1: GFP)ve WT balık embriyolarına enjekte edin. Fabp10a-il34 enjekte wt embriyoları yetişkin9 yükseltmek ve in situ hibridizasyon tarafından transgenik kurucusu belirlemek.
NOT: Diğer transgenik hat aynı transpozon sistemi ile yapılırsa Tol2 yapısının doğrudan başka bir transgenik içine enjeksiyonu sorunlu olabilir. Genel bir uygulama bağımsız bir transgenik çizgi yapmak ve daha sonra başka bir muhabir hattı ile yeni çizgiyi geçmek olacaktır. Bu, yeni transgenezin daha önce eklenmiş bir transgen üzerinde hiçbir etkisi olmamasını sağlar.
2. Floresan Tüm Mount In Situ Hibridizasyon (WISH) Immunostaining ile birleştirin
- Örnek fiksasyon
- İstenilen aşamalarda Tg (mpeg1: GFP) ile geçen geçici enjeksiyon veya kararlı IL-34 transgenik hattının embriyolarını toplayın.
NOT: Bu durumda embriyolar 4 döl sonrası döllenme (dpf) olarak toplandı. (Gerekirse) şırınga ile chorion çıkarın. - Embriyoları gece boyunca 4 °C'de %4 paraformaldehit (PFA) veya oda sıcaklığında (RT) (yaklaşık 25 °C) 2 saat olarak düzeltin.
- Embriyoları fosfat tamponlu tuzlu artı Ara 20 (PBST) 3x 5 dk ile yıkayın.
- PBST%50 metanol (%50 Metanol/PBST) ve %100 metanol, her biri 1x 5 dk ile embriyoları ayrı ayrı kurutun. Daha sonra taze %100 metanol'e değiştirin ve -20 °C'de (en az 2 saat) saklayın.
NOT: Protokol burada duraklatılmış olabilir.
- İstenilen aşamalarda Tg (mpeg1: GFP) ile geçen geçici enjeksiyon veya kararlı IL-34 transgenik hattının embriyolarını toplayın.
- Sonda hibridizasyonu (Gün I)
- PBST% 50 metanol ile önceki adımlarda embriyolar rehydrate (%50 Metanol / PBST), sonra PBST 3x 5 dk ile yıkayın.
- RT'de PBST'de Proteinaz K ile embriyoları sindirin (son konsantrasyon: 10 μg/mL; PBST'de 1:2000).
NOT: Sindirim süresi embriyoların evreye bağlıdır: Az 36 h sonrası döllenme (hpf), gerek yok; 36 hpf-2 dpf embriyo, 3-5 dk; 2-3 dpf embriyo, 10 dk; 3-4 dpf embriyo, 15 dk; 4-5 dpf embriyo, 15-20 dk; 5-6 dpf embriyo, 20-27 dk; >6 dpf embriyo, RT'de 25-30 dk (yaklaşık 25 °C). - Sindirim çözeltisini atın ve RT'de 20 dk boyunca %4 PFA ile fiksasyon yapın.
- Embriyoları PBST 2x 10 dk ile yıkayın.
- PBST atın, ısıtmalı hibridizasyon tamponu ile ön hibridizasyon gerçekleştirmek (HB tampon) 65 °C için 5 dakika, orijinal tüp içine HB tampon geri dönüşüm.
- 65 °C'de yeni ısıtmalı HB tamponu ile en az 1 saat önceden hibridizasyon gerçekleştirin.
- Probu önceden ısıtın9 (bu durumda bir il34 prob, 1 ng/mL) 65 °C'de en az 10 dk. Sonra HB tamponorijinal tüp içine geri dönüşüm. Bir gecede 65 °C'de önceden ısıtılmış sonda ile hibridizasyon yapın.
- Antikor tedavisi (Gün II)
- %50 formamid/2x tuzlu sodyum sitrat artı Tween 20 (SSCT), 2x SSCT, 0.2x SSCT'yi 65 °C'de Önceden ısıtın.
- Sondayı orijinal tüpe geri dönüştürün ve sondayı -20 °C'de saklayın.
- Embriyoları %50 formamid/2x SSCT ile ayrı ayrı yıkayın; 2x SSCT; 0.2x SSCT, 3x 20 dk veya 2x 30 dk her biri 65 °C'de.
- Embriyoları PBST 3x 5 dk ile yıkayın.
- 600 μL bloke tampon (PBST'de %5 filtrelenmiş fetal sığır serumu (FBS) ile) numuneleri RT'de 1 saat boyunca bloke edin.
- 400 μL Anti-digoksigenin-HRP antikor çözeltisi ekleyin (1:1,000-1:2,000 bloke tampon) ve embriyoları bir gecede 4 °C'de kuluçkaya yatırın. Sinyaller zayıfsa, 1:500'lük antikor seyreltme kullanın.
- Boyama ve primer antikor kuluçka (Gün III)
- Antikor çıkarın; Embriyoları PBST ile yıkayın, RT'de 6x 20 dk.
- Numuneyi RT'de 5 dakika boyunca 30 μL 1x Plus Amplifikasyon Dilüent ile durula.
- Dışarı boru çekerek dilüent atın; seyreltik Florofor Tyramide Stok Solüsyonu (Siyanin 3 Plus Amplifikasyon Reaktifi (Cy3) veya Siyanin 5 Artı Amplifikasyon Reaktifi (Cy5), Bu durumda Cy3 kullanılmıştır) 1:50 1x Plus Amplifikasyon Diluent Florofor Tyramide Çalışma Çözümü yapmak için. Her numune için 50-100 μL çalışma çözeltisi hazırlayın.
- Rt karanlıkta 5-15 dakika florofor Tyramide Çalışma Solüsyonu örnek kuluçka. Sinyaller zayıfsa, kuluçka süresini 30 dakikaya kadar uzatın.
- PBST ile çalışma çözümlerini değiştirerek reaksiyonu durdurun ve sinyalleri inceleyin.
- Rt'de Embriyoları PBST 3x 10 dk ile yıkayın.
- Numuneyi bir gecede 4 °C'de birincil antikorla kuluçkaya yatırın. Bu durumda, birincil antikor olarak Keçi-Anti-GFP antikor kullanın.
- Sekonder antikor boyama (Gün IV)
- 4x 30 dk için PBST ile embriyoları yıkayın.
- Embriyoları bir gecede 4 °C'de ikincil antikorla kuluçkaya yatırın. Bu durumda, ikincil antikor olarak Alexa 488-Anti-Keçi antikor kullanın.
- Fotoğraf çekme (Gün V)
- Rt'de Embriyoları PBST 3x 10 dk ile yıkayın.
- Embriyoları bir gecede 4 °C veya -20 °C'de %70 gliserol de karanlıkta saklayın.
3. Canlı Görüntüleme
-
Örnek seçme
NOT: Tg makrofajlarının(fabp10a: il34: fabp10a: DsRed; mpeg1: GFP)balığının 3-3,5 dpf sırasında IL-34 indüksiyonu altında karaciğere girip girmeyeceğini doğrudan gözlemlemek için canlı görüntüyü kullanın. Burada Tg (fabp10a-DsRed)transgenik hattı karaciğer bölgesini etiketlemek ve görünür hale getirmek, karaciğerin lokalizasyonunu kolaylaştırmak ve makrofajların karaciğere göç edip etmediğini belirlemek için kullanılır. Görüntülemeden önce, DsRed ve GFP çift pozitif embriyoları seçmek için floresan mikroskobu kullanın. -
Balık montajı
- 1 mL%1 düşük erime agarose'u 90 °C'nin üzerine çıkarmak için metal banyo kullanın.
- Düşük erime agarose vücut sıcaklığına soğutulduktan sonra, 50 μL% 0.2 tricaine ekleyin ve düzgün agarose ile tricaine karıştırın.
- Anestezili embriyoları alttabakada bir kapak kaydırağı ile monte edilmiş küçük bir tabağa taşıyın, çevredeki suyu çıkarın, embriyoların üzerinde yavaşça eriyen agarose'u bırakın, agarose katılaşmadan önce balığın konumunu dikkatlice ayarlayın, karaciğer bölgesini yakın tutun yemeğin altındaki kapak slayt.
- Düşük erime agarose katılaşmış sonra, dikkatle agarose başka bir tabaka ile kapsayacak şekilde güçlendirmek için.
- Kabı konfokal mikroskop taşıyıcı masasına yerleştirin, balığı E2 solüsyonu10 ile tricaine ile kaplayın ve görüntülemeye başlayın.
-
Konfokal mikroskobun yazılım çalışması
- ZEN black 2.3 yazılımını açın, canlı hücre tezgahını mikroskop taşıyıcı tablosuna törleyin.
- Bul 'u tıklatın | Kuluçka | Sıcaklığı 29 °C'ye ayarlamak için.
- Canlı hücre çalışma tezgahının ortasına çanak yerleştirin, tricaine ile E2 çözeltisi10 ile balık kapağı.
- Edinme menüsüne tıklayın, Akıllı Kurulum menüsünde gerekli tetkik modunu ve lazerleri seçin, ardından Z-Stack ve Pozisyon'useçin.
- Deney Tasarımcısı menüsünü tıklatın, ilk blokta Çoklu Blok Deneyi Etkinleştir'iseçin, düşük büyütme altında örneği bulmak için, ardından yüksek büyütmeye geçin, görme alanının merkezindeki gözlemlenen alana izin verin.
- Konumu ve Z-Stack bilgilerini ayarlayın, uygun lazer yoğunluğunu, tarama katmanlarını ve görüntüleme hızını seçin.
- Yeni bir blok oluşturun ve yukarıdaki adımları yineleyin. Tüm blokları ayarladıktan sonra, uygun döngü sayısını ayarlayın ve kayıt başlatmayı başlatın (Şekil 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Zebra balığı protokolünde yer alan adımlar Şekil 2'degösterilmiştir. İlk olarak, il34'ün fabp10a organizatörü tarafından yönlendirildiği pBLK-fabp10a-il34-sv40 yapısını oluşturduk (Şekil 2). Yapı, transgenik kararlı hat oluşturmak için yetişkinlere yetiştirilen GFP ve WT embriyoları ile makrofajları etiketleyebilen tek hücreli evre Tg (mpeg1: GFP)zebra balığı embriyolarına mikroenjekte edilmiştir (Şekil 2). il34 ekspresyonu yerinde hibridizasyonda tüm montaj floresansı ile analiz edilmiştir (Şekil 2 ve Şekil 3). GFP etiketli makrofajlar immünboyama ile analiz edildi (Şekil 2 ve Şekil 3). Makrofajların 3-3.5 dpf sırasında il34 indüksiyon uğrama altında karaciğere göç edip etmeyeceğini doğrudan gözlemlemek için canlı görüntüleme kullandık (Şekil 2, Şekil 4, Ek Film 1 ve Ek Film 2) .
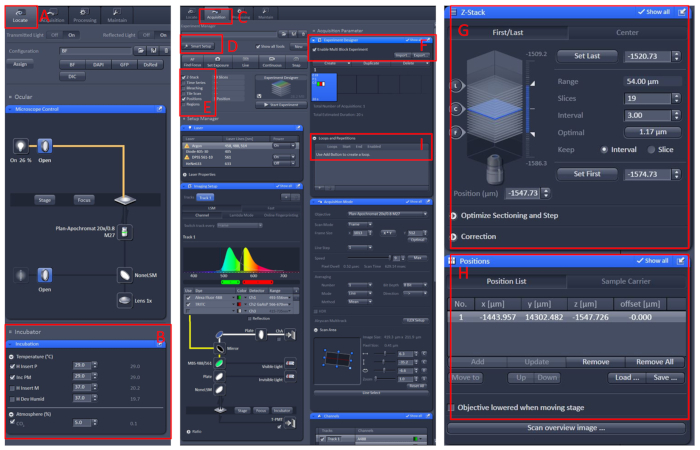
Şekil 1: Konfokal mikroskobun canlı görüntüleme yazılımı çalışması. ZEN siyah 2.3 yazılımını açın, canlı hücre tezgahını mikroskop taşıyıcıtablosuna tonuyla tonuyla tonuyla tonuyla tonuyla( A ) | Kuluçka | Sıcaklık (B) sıcaklığı 29 °C'ye ayarlamak için. Canlı hücre çalışma tezgahının ortasına çanak yerleştirin, tricaine ile E2 çözeltisi10 ile balık kapağı. Tüm bunlardan sonra, Edinme (C) menüsüne tıklayın, Akıllı Kurulum (D) menüsünde gerekli tetkik modunu ve lazerleri seçin, ardından Z-Stack ve Pozisyon (E)seçeneğini belirleyin. Son olarak, Deney Tasarımcısı (F) menüsünü tıklatın, ilk blokta, düşük büyütme altında örnek bulmak için, çoklu blok deneyi etkinleştir'iseçin, sonra yüksek büyütme geçmek, izin görme alanının merkezi, pozisyon ve Z-Stack(G ve H)bilgi ayarlamak, uygun lazer yoğunluğu, tarama katmanları ve görüntüleme hızı seçin. Yeni bir blok oluşturun ve yukarıdaki adımları yineleyin. Tüm blokları ayarladıktan sonra, uygun sayıda döngü(I)ayarlayın ve kaydetmeye başlayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Bir kemokinin in vivo makrofaj göçü üzerindeki işlevini araştırmak için bir iş akışı. IL-34'ü aşırı ekspresye etmek için dokuya özgü (karaciğer) aşırı ekspresyon plazmidi yaptık ve plazmidi, makrofajları özellikle floresan proteinle etiketlenmiş tek hücreli transgenik balık embriyolarına enjekte ettik (Tg: (mpeg1: GFP )). Enjekte edilen WT embriyoları kararlı bir transgenik çizgi oluşturmak için yetiştirildi. Daha sonra gen ekspresyonu deseni ve geçici enjekte embriyolar veya kararlı hat embriyolarının makrofajların sayısını veya konumunu tespit etmek için yerinde hibridizasyon ve immünboyama tüm monte floresan kullandı (4 dpf). Son olarak, in vivo makrofajlar üzerinde IL-34 işlevini incelemek için stabil transgenik balıklarda (3-3.5 dpf) makrofaj davranışını doğrudan gözlemlemek için konfokal canlı görüntüleme kullandık. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Floresan WISH immünboyama ile birleştirir. Bu rakam Jiang ve ark.11değiştirilmiştir. PBLK-fabp10a-il34-sv40 yapısının toplam 1.8 nL (30 ng/μL) tek hücreli evre Tg (mpeg1: GFP) zebra balığı embriyolarına mikroenjekte edildi. (A) 4 dpf embriyo (6x) gfp ekspresyonu (yeşil) il34 ifade (kırmızı) ve tam montaj antikor boyama dileği. Balığın tüm vücut resmi confocal tarafından çekilen ve Photoshop birlikte dikişli iki ayrı görüntü oluşur. Insets ilgili kutulu bölgelerin (turuncu noktalı alanlar) yüksek büyütme (20x) vardır. (B) Enjekte edilmemiş makrofaj hücre sayılarının kantitatif analizi enjekte edilmeden ve enjekte edilmiş embriyoların karaciğerinde (beyaz noktalı alanda gösterilmiştir) ve kuyruk bölgesini (yaklaşık 13 ve 17. somit arasında, iki beyaz noktalı çizgi arasında gösterilmiştir) oluşturmak. Veriler Mann Whitney U testi, ** p < 0.01 ile kontrol egöre analiz edildi. n = 5, 4 dpf enjekte ve kontrol balık için 5. Çubuklar: 200 μm (beyaz çizgi); 50 μm (sarı çizgi). (C) 4 dpf stabil hat embriyo (6x) gfp ekspresyonu il34 ekspresyonu ve tam montaj antikor boyama dileği. Balığın tüm vücut resmi confocal tarafından çekilen ve Photoshop birlikte dikişli iki ayrı görüntü oluşur. Insets ilgili kutulu bölgelerin (turuncu noktalı alanlar) yüksek büyütme (20x) vardır. (D) Tg makrofaj hücre sayılarının kantitatif analizi (mpeg1: GFP) ve Tg (fabp10a: il34; mpeg1: GFP) embriyoların karaciğeri (beyaz noktalı alanda gösterilir) ve kuyruk bölgesi (yaklaşık 13 arasında ve 17. somite, iki beyaz noktalı çizgiler arasında gösterilir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Konfokal canlı görüntüleme, stabil transgenik balıklarda makrofaj davranışını doğrudan gözlemlemek için dir. Bu rakam Jiang ve ark.11değiştirilmiştir. Canlı görüntülemenin mikrografları, 28 dk içinde kontrol balıkları(A)içinde karaciğer (kırmızı) tarafından geçen bir makrofaj (yeşil, beyaz oklarla etiketlenmiş) ve 28 içinde karaciğere (kırmızı) göç eden bir makrofaj (yeşil) işlemini göstermektedir. il-34 aşırı ifade balık min (B). Ölçek çubukları = 40 μm (beyaz çizgi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Film 1: IL-34 aşırı ifade balık 2 saat içinde karaciğer (kırmızı) içine göç makrofajlar (yeşil, beyaz oklar ile etiketli) sürecini gösteren canlı görüntüleme. Ölçek çubukları = 20 μm (beyaz çizgi). Bu film Jiang ve ark.11'denyeniden yayınlanmıştır. Bu videoyu izlemek için lütfen buraya tıklayın. (İndirmek için sağ tıklatın.)

Ek Film 2: Kontrol balık içinde karaciğer (kırmızı) etrafında dolaşan makrofajlar (yeşil, beyaz oklar ile etiketli) sürecini gösteren canlı görüntüleme. Ölçek çubukları = 20 μm (beyaz çizgi). Bu film Jiang ve ark.11'denyeniden yayınlanmıştır. Bu videoyu izlemek için lütfen buraya tıklayın. (İndirmek için sağ tıklatın.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Burada açıklanan protokol bize makrofajin vivo davranışı üzerinde bir kemokin işlevini araştırmak için izin verir ve prosedür bazı teknik uzmanlık gerektirir. Özetle, protokoldeki komplikasyonları önlemek için birkaç kritik adım vardır: 1) ilgi hücresini etiketlemek için spesifik ve güçlü transgenik sinyal gösteren uygun bir transgenik çizgi seçin; 2) görüntüleme ve transgenik gen aşırı ekspresyonu için erişilebilir uygun bir doku seçin; 3) hassas ve spesifik bir RNA probu yapmak; 4) doğru hücre davranışı yakalamak için uygun bir gözlem zaman penceresi seçin.
Immunostaining ile birlikte yerinde hibridizasyonda tüm montaj floresanprosedüründe, gen ekspresyonunu tespit etmek için kullanılan RNA sondası hassas olmalı ve sinyal yeterince güçlü olmalıdır. Hücre davranışı üzerindeki gen işlevini yakalamak için bir dizi zaman noktası test edilmelidir. Örneğin, fabp10a organizatörü 2-3 dpf ifade etmeye başladı rağmen, makrofaj göçü üzerinde il34 etkisini gözlemleyerek, karaciğerde makrofaj birikimi o zaman belirgin değildi. Sadece 4 dpf ile karaciğerde makrofaj zenginleştirme belirgin hale gelir. Buna ek olarak, yerinde hibridizasyon dan sonra, sonraki immünboyama sinyal yoğunluğu etkilenecektir. Örneğin, GFP ile karşılaştırıldığında, DsRed in situ hibridizasyon sonra immünoresans boyama renk zordur, muhtemelen farklı protein yapıları nedeniyle. Genel olarak konuşursak, yerinde hibridizasyon tüm montaj floresan sonra immünboyama sinyal yoğunluğu tek immünboylama daha az olacaktır.
Konfokal mikroskop ile canlı görüntüleme adımında, numunenin yemeğin dibine yakın tutulması gerekir. Embriyolar agarose içinde yüzdüğünde, hedefin çalışma mesafesi yetersiz olabilir, ayrıca, amaç ve örnek arasındaki agarose görüntüleme kalitesini etkileyecektir. Ayrıca, her zaman görüntüleme için örnek sayısı düzgün ayarlanmalıdır. Bir her balık iki taramaları arasındaki zaman aralığı hücre davranışının ayrıntılarını kaybetmek için çok uzun olmaz emin olmalısınız. Yani bu yöntem kalın dokularda hızlı hareket hücreleri izlemek için uygun değildir.
Sonuç olarak, bu protokol makrofajlar, nötrofiller ve T-hücreleri gibi hücrelerin çeşitli davranış kemokinlerin işlevini gözlemlemek için kullanılabilir. Burada, il-34, chemotaxis6,7Bos-1R fonksiyonunun yeni tanımlanmış bir ligand, makrofaj göç indüklemek için ektopik ifade kemokin olarak kullanılır. Hücre kemotaksisi mevcut deneysel modellerin çoğu in vitro hücre deneyleri dayanmaktadır, ancak in vitro deneyler bazen in vivo karmaşık ortamı modellemek için çok basittir. Ayrıca, sadece in vitro duruma baktığınızda kemo-attraction abilityin vivo görüntü zordur. Bu yöntem, fareler için zor olan doğrudan hücre davranış gözlemi için zebra balığının özel avantajlarını kullanmaktadır. Mevcut yöntem bize hızlı bir şekilde birkaç gün içinde hücre davranışları üzerinde kemokin fonksiyonları test etmek ve zebra balığı moleküler ve hücre biyolojisi çalışma için güçlü bir model yapmak sağladı.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarların açıklayacak bir şeyi yok.
Acknowledgments
Dr. Jingrong Peng'e Tg (fabp10a: DsRed) transgenik hattını paylaştığı için teşekkür ederiz; Dr Zilong Wen Tg (mpeg1: GFP) transgenik hatları paylaşmak için; Dr. Koichi Kawakami pTol2 vektörü sağladığı için. Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (31771594), Guangdong Bilim ve Teknoloji Planı projeleri (2019A030317001) ve Merkez Üniversiteler için Temel Araştırma Fonları (D2191450) tarafından desteklenmiştir.
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



