Summary
تهدف هذه المقالة إلى توفير منهجية لتحول العدوى إلى اللافروسية في أجنة الفئران باستخدام حقن متعددة لتعليق الفيروس في الفضاء perivitelline الزيغوت. يتم استخدام الفئران الإناث التي تزاوج مع سلالة الذكور الخصبة مع لون فرو المهيمنة مختلفة لتوليد الأمهات بالتبني الحوامل.
Abstract
نماذج الحيوانات المعدلة وراثيا هي مهمة بشكل أساسي للبحوث الطبية الحيوية الحديثة. إن دمج الجينات الأجنبية في أجنة الفئران أو الفئران المبكرة هو أداة لا تقدر بثمن لتحليل وظائف الجينات في الكائنات الحية. تعتمد طريقة تحويل التكوين القياسية على حقن أجزاء الحمض النووي الأجنبية في نواة من البويضات المخصبة. وتستخدم هذه التقنية على نطاق واسع في الفئران ولكنها لا تزال غير فعالة نسبيا وتتطلب من الناحية التقنية في الأنواع الحيوانية الأخرى. ويمكن أيضا إدخال الترانسجين في الأجنة ذات مرحلة الخلية الواحدة عن طريق العدوى بفيروس اللارض، مما يوفر بديلا فعالا للحقن برونووي القياسية، وخاصة في الأنواع أو السلالات ذات بنية الأجنة الأكثر تحديا. في هذا النهج، يتم حقن التعليق الذي يحتوي على ناقلات الفيروس في الفضاء perivitelline من جنين الفئران المخصبة، والتي هي من الناحية الفنية أقل تطلبا ولديه معدل نجاح أعلى. وقد تبين أن ناقلات الفيروس الليندية تدمج الجين المتحول بكفاءة في الجينوم لتحديد توليد خطوط معدلة مستقرة. وعلى الرغم من بعض القيود (مثل متطلبات المستوى 2 للسلامة البيولوجية، وحدود حجم شظايا الحمض النووي)، فإن تحويل الجينوجينيس إلى اللادفيروسات هو طريقة سريعة وفعالة لتولد الجين. بالإضافة إلى ذلك، يتم تقديم استخدام الفئران الإناث التي تزاوج مع سلالة الذكور الخصبة مع لون فرو المهيمنة مختلفة كبديل لتوليد الأمهات بالتبني الحوامل.
Introduction
لسنوات عديدة، تم استخدام القوارض المختبرية، مثل الفئران والجرذان، لنمذجة الحالات الفسيولوجية والمرضية البشرية. وقد أدت البحوث الحيوانية إلى اكتشافات لم تكن قابلة للتحقيق بأي وسيلة أخرى. في البداية ، ركزت الدراسات الجينية على تحليل الاضطرابات والظواهر التي تحدث تلقائيًا التي تعتبر تحاكي عن كثب الحالة البشرية1. وسمح تطوير أساليب الهندسة الوراثية بإدخال أو حذف جينات محددة للحصول على النمط الظاهري المطلوب. لذلك ، يتم التعرف على جيل الحيوانات المعدلة وراثيا كتقنية أساسية في البحوث الحديثة التي تسمح بإجراء دراسات لوظيفة الجينات في الكائنات الحية.
أصبحت تكنولوجيا الحيوانات المحورة وراثيا ممكنة من خلال مزيج من الإنجازات في علم الأجنة التجريبية والبيولوجيا الجزيئية. في 1960s, الأجنة البولندية أ. ك. Tarkowski نشرت أول عمل على التلاعب الجنين الماوس خلال المراحل المبكرة من التنمية2. بالإضافة إلى ذلك، طور علماء الأحياء الجزيئيون تقنيات لتوليد ناقلات الحمض النووي (أي الناقلين) لإدخال الحمض النووي الأجنبي في جينوم الحيوان في جملة أمور. وتسمح هذه النواقل بانتشار جينات مختارة وتعديلها المناسب، تبعاً لنوع البحوث التي تجرى. تم تقديم مصطلح "الحيوان المعدل وراثيا" من قبل غوردون ورودل3.
أول الأنواع المقبولة على نطاق واسع التي كانت تستخدم في علم الأعصاب، علم وظائف الأعضاء، علم الصيدلة، وعلم السموم، والعديد من المجالات الأخرى للعلوم البيولوجية والطبية كان الجرذ النرويج، راتوس نورفيغيموس4. ومع ذلك ، بسبب صعوبة في التلاعب أجنة الفئران ، أصبح موسكولوس فأر المنزل الأنواع الحيوانية المهيمنة في البحوث الوراثية5. وثمة سبب آخر لأولوية الفأر في مثل هذه البحوث هو توافر تكنولوجيا الخلايا الجذعية الجنينية لتوليد الحيوانات التي خروج المغلوب لهذا النوع. إن الأسلوب الأكثر استخداماً للتوليد (2-10% من النسل المعدل وراثياً بالنسبة لجميع الحيوانات المولودة) هو الحقن المجهري لشظايا الحمض النووي في نواة من البويضات المخصبة. في عام 1990، تم تكييف هذا النهج، الذي قدم لأول مرة في الفئران، للفئران6,7. يتميز تحويل الفئران عن طريق الحقن النووي بكفاءة أقل8 مقارنة بالفئران ، وهو ما يرتبط ارتباطًا صارمًا بوجود بلازما مرنة وأغشية برونووي9. على الرغم من أن بقاء الأجنة بعد التلاعب هو 40-50٪ أقل مما كانت عليه في الفئران، وتعتبر هذه التقنية معيارا في توليد الفئران المعدلة وراثيا10. وجرى بحث النُهج البديلة التي يمكن أن تضمن إدماجاً فعالاً في مجال الجين اتوجينات وارتفاع معدلات بقاء الزيجوتات المحقونة.
المحدد الرئيسي للتعبير عن انتقال مستقر والانتقال إلى ذرية هو اندماجها في جينوم الخلية المضيفة. الفيروسات اللينة (LVs) لديها سمة مميزة للقدرة على إصابة كل من الخلايا المنقسمة وغير المقسمة. استخدامها كأداة لدمج الجينات غير المتجانسة في الأجنة ثبت أن كفاءة عالية11، ويتميز الأفراد المعدلين وراثيا من خلال التعبير المستقر من جزء الحمض النووي المدمجة. وقد تم تأكيد فعالية ناقلات العدوى للفيروسي للتعديل الوراثي للفئران12،13، الفئران12،14،وغيرها من الأنواع11. في هذه الطريقة ، يتم حقن تعليق LV تحت الزونا بيليسيدا للجنين في مرحلة اثنين من النوى. تضمن هذه التقنية بشكل أساسي بقاء الأجنة بنسبة 100٪ لأن الأوليما لا تزال غير متأثرة. إنتاج عالية الجودة وعالية التركيز نسبيا تعليق LV هي عوامل حاسمة. ومع ذلك، يمكن التغلب على تركيزات أقل من تعليق LV عن طريق الحقنالمتكرر11، مما يزيد من كمية الجسيمات الفيروسية على سطح البيض في حين لا تؤثر على تكامل الغشاء. تتطور الأجنة التي تتعرض للحقن المتكررة في الفضاء perivitelline بشكل أكبر ، ويمكن للنسل المعدل وراثيا ً نقل الجين المتحول عبر الخط الجرثومي. كفاءة توليد الفئران المعدلة وراثيا عن طريق توليد transgenesis اتلافيروسي يمكن أن يصل إلى 80٪12.
هنا، نحن نصف إنتاج فيروس نقص المناعة البشرية-1 المؤتلف اتّصال يُعنى بالبروتين المظروف G. استخدام الجيل الثاني من نظام التعبئة والتغليف VSV النمط الزائف يحدد السلبية واسعة من الجسيمات الفيروسية ويسمح بإنتاج ناقلات مستقرة للغاية التي يمكن أن تركز عن طريق ultracentrifugation وcryopreserved. بعد التحقق من التتر، تكون المتجهات جاهزة للاستخدام كوسيلة لتوصيل الجين إلى الزيجوت الفئران الويستار المهق. بعد سلسلة من الحقن، يمكن استزراع الأجنة بين عشية وضحاها ونقلها في مرحلة الخليتين إلى الأمهات التبني. وفي هذه المرحلة، يمكن النظر في أحد نهجين بديلين. يستخدم الإجراء القياسي الإناث الحوامل الزائفات كمتلقيات للأجنة. ومع ذلك، عندما يكون معدل الحمل منخفضًا بعد التزاوج مع الذكور الأسهر، يمكن زرع الأجنة في الإناث الحوامل Wistar/Sprague-Dawley (SD) التزاوج مع الفئران الذكور الخصبة بلون الفراء الداكن (على سبيل المثال، براون النرويج [BN] الفئران). يسمح لون الفراء بتمييز النسل عن الحمل الطبيعي عن النسل الذي ينشأ من الأجنة المنقولة المتلاعب ة.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
وكان إنتاج ناقلات العدوى الفيروسية وتطبيقها وفقاً للمبادئ التوجيهية للسلامة البيولوجية من المستوى 2 ووافقت عليها وزارة البيئة البولندية. وقد وافقت اللجنة الأخلاقية المحلية على جميع الإجراءات التجريبية للحيوانات التي يرد وصفها أدناه. تم إيواء الحيوانات في أقفاص مهواة بشكل فردي في درجة حرارة مستقرة (21-23 درجة مئوية) والرطوبة (50-60٪) مع الإعلان libitum الوصول إلى الماء والغذاء تحت 12 ساعة / 12 ساعة ضوء / دورة مظلمة.
1- إنتاج ناقلات الفيروس اللين
- التقُرال ة للخلايا HEK 293T
ملاحظة: تم تصميم البروتوكول الذي يتم تقديمه هنا لالتقاشي من عشرين أطباق ثقافة Ø10 سم التي تنتج ما يقرب من 200 مل من ناقلات الخام supernatant.- الخلايا الثقافة HEK 293T في المتوسط DMEM التي يتم استكمالها مع مصل البقر الجنين (10٪، v/v) في حاضنة CO2 المبللة في 37 درجة مئوية. للتَغْرُب، أعدّ لوحات قطرها 20 سم، وبذرة 1.5-2 × 106 خلايا HEK 293T لكل طبق.
- عندما يصل التقاء ~ 70٪، transfect الخلايا باستخدام كاشف البوليتيلمين (PEI)، درجة الحموضة 7.0، بنسبة 3 ميكروغرام من جزيرة الأمير إدوارد لكل 1 ميكروغرام من الحمض النووي.
- إعداد خليط الحلويات لخمسة أطباق (إعداد عدد من التكرار وفقا لعدد الأطباق الإجمالي). إلى 1 مل من جلالنسر المعدل متوسط دولبيككو (DMEM؛ بدون مصل)، أضف خليط ثلاثة بلازميدبحيث تصل إلى كمية نهائية قدرها 25 ميكروغرام من VSVg plasmid، و 50 ميكروغرام من دلتا R8.2، و 50 ميكروغرام من بلازميد الترميز.
- بيبيت صعودا وهبوطا، وإضافة 125 ميكرولتر من جزيرة الأمير إدوارد بتركيز 3 ميكروغرام/μL. احتضان في درجة حرارة الغرفة لمدة 15 دقيقة، عكس الأنبوب ثلاث مرات أثناء الحضانة. أضف 200 ميكرولتر من خليط الحلويات لكل لوحة. بعد ذلك، احضن الأطباق في حاضنة CO2 المرطبة عند 37 درجة مئوية.
- تركيز ناقلات العدوى بمضادات الفيروسات اللينة
- بعد 48 ساعة من التَغَلُط، حصد الوسط الذي يحتوي على جسيمات LV. استخدام أنابيب مخروطية 50 مل.
ملاحظة: عند استخدام البلازميد مع علامة الفلورسنت، يمكن تصور الخلايا في هذه المرحلة للتحقق من كفاءة التطفل. يمكن إضافة جزء جديد من متوسط DMEM، وقد يتم احتضان الخلايا لمدة 24 ساعة إضافية. العائد LV قابلة للمقارنة عندما جمعت في 48 و 72 ساعة نقطة الوقت بعد التقال. - طرد مركزي المتوسطة في 3000 × ز لمدة 5 دقيقة ودرجة حرارة الغرفة لإزالة الخلايا المنفصلة.
- تصفية supernatant (0.45 ميكرون) وصبها في أنابيب جديدة.
ملاحظة: يمكن حذف هذه الخطوة. - إضافة DNase I (RNase خالية، 1 ميكروغرام /مل) وMgCl2 (1 mM)، واحتضان في حمام مائي في 37 درجة مئوية لمدة 15 دقيقة.
- نقل أنابيب البولي إيثيلين المتوسطة إلى القابلة للتصرف، وultraالطرد المركزي في الدوار يتأرجح في 115،000 × ز و 4 درجات مئوية لمدة 1.5 ساعة.
- بعد الطرد المركزي، قم بتصريف جدران الأنابيب بلطف من المخلفات المتوسطة.
- نقع بيليه مع محلول ملافي معقم بالفوسفات (PBS; 70-80 ميكرولتر لكل أنبوب).
- احتضان لمدة 2 ساعة في 4-8 درجة مئوية.
- إعادة تعليق ناقلات الفيروسية في برنامج تلفزيوني عن طريق الأنابيب لطيف.
تنبيه: تجنب الرغوة. - نقل إلى أنبوب الطرد المركزي 1.5 مل والطرد المركزي في 7000 × ز و 4 درجات مئوية لمدة 30 s. نقل supernatant إلى أنبوب جديد. كرر هذه الخطوة حتى لا يكون هناك حطام خلوي مرئي.
- Aliquot وتجميد في -80 درجة مئوية. تجنب إعادة تجميد aliquot LV.
- بعد 48 ساعة من التَغَلُط، حصد الوسط الذي يحتوي على جسيمات LV. استخدام أنابيب مخروطية 50 مل.
- تحديد titer الفيروس باستخدام تفاعل سلسلة البوليميراز الكمي
ملاحظة: يتم إجراء معايرة النواقل الفيروسية باستخدام PCR الكمية (qPCR). ويستند هذا الأسلوب على تضخيم مزدوج تقطعت بهم السبل 84 bp جزء الحمض النووي طويلة داخل منطقة تكرار محطة طويلة من الجينوم الفيروسي15.- إعداد المنحنى القياسي عن طريق جعل التخفيفات التسلسلية من البلازميد LV الترميز: 1:500، 1:1،000، 1:5،000، 1:10،000، 1:100،000، و 1:1،000،000. تحديد عدد نسخ البلازميد المستخدمة للمنحنى القياسي. استخدم الصيغة التالية: عدد النسخ/μL = (التركيز [g/μL] x 6.02 × 1023 [رقم/مول]) / (660 [ز/مول] × حجم البلازميد [bp])، حيث 6.02 × 1023 عدد/مول هو رقم أفوغادرو، و660 جم/مول هو وزن bp.
ملاحظة: يمكن استخدام حاسبات رقم النسخ عبر الإنترنت. - إعداد تخفيف تعليق للينفيروسي: 1:100، 1:500، و 1:1،000.
- إعداد خليط التفاعل (وحدات التخزين لكل بئر): 10 ميكرولتر من qPCR Mastermix، 1 ميكرولتر من 10 ميكرومتر التمهيدي إلى الأمام، 1 ميكرولتر من 10 ميكرومتر التمهيدي العكسي، و 7 ميكرولتر من H2O. Pipette الخليط في آبار لوحات بئر 96.
ملاحظة: التمهيدي إلى الأمام: 5'-AGCTTGCCTtGAGTGCTCA. التمهيدي العكسي: 5'-TgACTAAAAGGGTCTGAGGGGGA. - إضافة 1 μL من كل تخفيف القياسية وتعليق lentiviral في ثلاثية.
- تشغيل qPCR وفقا للمعلمات التالية: 50 درجة مئوية لمدة 2 دقيقة، 96 درجة مئوية لمدة 5 دقيقة، و 35 دورة من 96 درجة مئوية لمدة 20 s، 60 درجة مئوية لمدة 40 s، و 70 درجة مئوية لمدة 1 دقيقة، تليها مرحلة منحنى الذوبان: 95 درجة مئوية لمدة دقيقة واحدة و 60 درجة مئوية في 30 ث.
- تحليل النتائج من خلال مقارنة عدد الجزيئات التي يتم تلقيها لكل تخفيف إلى منحنى القياسية. تحديد تركيز جزيئات المتجه كمتوسط ثلاثة يكرر لكل تخفيف.
ملاحظة: يعطي القياس الكمي المقدم التركيز المادي للجسيمات الفيروسية. لا ينبغي أن تعامل على أنها titer وظيفية.
- إعداد المنحنى القياسي عن طريق جعل التخفيفات التسلسلية من البلازميد LV الترميز: 1:500، 1:1،000، 1:5،000، 1:10،000، 1:100،000، و 1:1،000،000. تحديد عدد نسخ البلازميد المستخدمة للمنحنى القياسي. استخدم الصيغة التالية: عدد النسخ/μL = (التركيز [g/μL] x 6.02 × 1023 [رقم/مول]) / (660 [ز/مول] × حجم البلازميد [bp])، حيث 6.02 × 1023 عدد/مول هو رقم أفوغادرو، و660 جم/مول هو وزن bp.
2- توليد الجرذان المحورة وراثيا
- الإباضة الفائقة وجمع الأجنة المخصبة
- إدارة gonadotropins.
ملاحظة: لزيادة عدد الأجنة التي تم جمعها (حوالي 30 لكل أنثى)، استخدم إناث Wistar غير الناضجات البالغات من العمر 5 أسابيع للتحفيز الهرموني.- في اليوم الأول (12 مساءً - 1 مساءً)، يحقن داخل المنتصفية في مصل الجناتوتون (PMSG؛ 25 وحدة دولية لكل أنثى). إعداد 1 مل aliquots من محلول العمل بتركيز 125 وحدة دولية / مل عن طريق حل مسحوق هرمون في 0.9٪ NaCl. يُحفظ في -20 درجة مئوية لمدة تصل إلى شهر واحد أو -80 درجة مئوية لمدة تصل إلى 6 أشهر.
- في اليوم 3 (12 PM-1 PM)، حقن داخل perperitoneally gonadotrophin المشيمي البشري (hCG؛ 30 وحدة دولية لكل أنثى). إعداد 1 مل aliquots من حل العمل (150 وحدة دولية / مل) عن طريق حل مسحوق هرمون في 0.9٪ NaCl. يُحفظ في -20 درجة مئوية لمدة تصل إلى شهر واحد أو -80 درجة مئوية لمدة تصل إلى 6 أشهر.
- بعد إدارة hCG، رفيقة الإناث 1:1 مع الذكور الخصبة جنسيا (3-10 أشهر).
- في صباح اليوم التالي (اليوم 4 في 8-10 صباحا)، تحقق من الإناث لوجود المكونات المهبلية. تحقق من فتحة المهبل لوجود قابس التزاوج الأبيض ، والتي يجب فحصها للحصول على أفضل تصور في الصباح الباكر بعد ليلة التزاوج. لجمع الأجنة، استخدم الإناث فقط مع قابس مرئي.
- جمع الأجنة في الساعة 10 صباحا. التضحية بالحيوانات لاستئصال الأوفيالقنوات، وجمع oviducts في طبق مع المتوسط M2 التدفئة المسبقة.
- نقل الأوفيالقنوات إلى طبق 35 ملم الذي يحتوي على متوسط M2 التدفئة المسبقة مع hyaluronidase من الخصيتين البقرية بتركيز 0.5 ملغ / مل.
- افتح جدران الأوفيقناة باستخدام ملقط دقيقة تحت المجهر الاستريوجيوووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووو
ملاحظة: يهضم Hyaluronidase الخلايا الهوائية، وإطلاق الأجنة.
تنبيه: التعرض المطول للهيالورونيداز ضار بالأجنة. لذلك، يجب أن تستمر هذه الخطوة لا يزيد عن 5 دقيقة. - لتسهيل إطلاق الأجنة من خلايا الكواب ، ماصة بلطف صعودا وهبوطا باستخدام ماصة نقل الزجاج التي ترتبط أنبوب aspirator تعمل بالفم.
- لإنتاج ماصة نقل، اسحب ماصة بستر زجاجية فوق لهب لإنتاج طرف مستقيم ~ 5-10 سم. كسر ماصة ترك ~ 4 سم تلميح.
- غسل الأجنة عدة مرات في M2 المتوسطة لإزالة hyaluronidase والحطام الخلوي. نقل الأجنة إلى طبق 60 ملم يحتوي على (~ 50 ميكرولتر) قطرات من متوسط M16 المتوازن مسبقًا ، مغطى بالبارافين السائل أو الزيت المعدني ، في حاضنة رطبة 37 درجة مئوية مع غلاف جوي CO2 بنسبة 5٪.
- إدارة gonadotropins.
- الحقن المجهري للناقلات ذات الفيروس اللارضي إلى جنين من مرحلة خلية واحدة تحت الزونا بيلسيدو
ملاحظة: استخدم أجنة ذات مرحلة خلية واحدة مع اثنين من النوى المرئية للحقن الدقيق(الشكل 1).- إذاث يسيل LV في درجة حرارة الغرفة والطرد المركزي عند 10,000 × g و RT لمدة دقيقتين لبيليه أي حطام خلوي متبقي.
- إعداد الحقن المجهري
- إعداد الزجاج عقد الماصة (الشعيرات الدموية الزجاج borosilicate) باستخدام microforge. اسحب الشعيرات الدموية الزجاجية فوق اللهب لإنتاج طرف من 5 إلى 10 سم. كسر ماصة ترك ~ 4 سم تلميح. يجب أن يكون القطر الخارجي ~ 80-120 ميكرون.
ملاحظة: تأكد من أن طرف ماصة مستقيم وسلس تمامًا. - تجميع ماصة سحبت في microforge مع طرف أمام خيوط التدفئة. سخني خيوط قريبة جدا من طرف ماصة والسماح لها أن تتقلص إلى قطر ~ 15 ميكرومتر (حوالي 20٪ من حجم الجنين). ضع الماصة عموديًا على خيوط التدفئة، 2-3 مم من طرف الماصة، وابدأ في التسخين. الزجاج سوف يلين. الحرارة حتى تصل إلى زاوية 15 درجة.
- إعداد الشعيرات الدموية الزجاجية borosilicate الحقن المجهري مع خيوط باستخدام سحب ماصة. أدخل الشعيرات الدموية في غرفة السحب. تشغيل اختبار منحدر (لأول مرة لزجاج جديد وفي كل مرة بعد تغيير خيوط). تعيين الحرارة إلى قيمة المنحدر -10، سحب إلى 100، السرعة إلى 150 والوقت إلى 100.
ملاحظة: تعديل المعلمات للحصول على الشعيرات الدموية حقن الأمثل. - تحت غطاء تدفق لامنبر السلامة البيولوجية، قم بتحميل ما يقرب من 2 ميكرولتر من المحلول الفيروسي في ماصة الحقن المجهري مع طرف محمل صغير.
- قم بإعداد طبق حقن دقيق (غطاء من طبق بتري 60 مم) مع قطرة 100 ميكرولتر من M2 المتوسطة (في الوسط) ، مغطاة بالبارافين السائل أو الزيت المعدني.
- قم بتركيب ماصة الاحتجاز وشعيرات الشعيرات الدموية الدقيقة التي يتم تحميلها بالمحلول الفيروسي إلى طبق micromanipulator والحقن المجهري تحت المجهر المقلوب.
- إعداد الزجاج عقد الماصة (الشعيرات الدموية الزجاج borosilicate) باستخدام microforge. اسحب الشعيرات الدموية الزجاجية فوق اللهب لإنتاج طرف من 5 إلى 10 سم. كسر ماصة ترك ~ 4 سم تلميح. يجب أن يكون القطر الخارجي ~ 80-120 ميكرون.
- إجراء الحقن المجهري.
- نقل 15-20 أجنة ذات مرحلة واحدة في مرحلة الخلايا الواحدة إلى قطرة M2 على طبق الحقن الدقيق. عقد الجنين باستخدام ماصة عقد.
- باستخدام التكبير 400x، حقن محلول LV تحت بيلوسا زونا إلى الفضاء perivitelline باستخدام الشعرية الزجاجية التي يتم توصيلها إلى حاقن التلقائي. عقد الشعرية تحت بيلوسيدا زونا للحظة.
ملاحظة: باستخدام الضغط الإيجابي اللطيف، سيتدفق المحلول الفيروسي باستمرار خارج الشعيرات الدموية بالحقن، ولكن لا يمكن التحكم في حجم التعليق الذي يتم تسليمه. - باستخدام ماصة دقيقة، أعد الأجنة إلى طبق الثقافة في الحاضنة عند 37 درجة مئوية في جو CO2 بنسبة 5٪. قد يختلف عدد حقن الزيجوت الواحد ويمكن تكييفه استنادًا إلى تركيز النواقل الفيروسي.
ملاحظة: يمكن نقل الأجنة المحقونة إلى الأمهات بالتبني في مرحلة الخلية الواحدة أو احتضان O/N في وسط M16 قبل نقلها في مرحلة الخليتين. وينبغي تجنب الثقافة المختبرية المطولة لأجنة الفئران.
- نقل الأجنة المحقونة إلى الأمهات التبني
- إعداد الأمهات بالتبني عن طريق تزاوج الإناث SD ناضجة جنسيا مع الذكور BN الخصبة أو مع الذكور SD قطع القناة الدافقة (يتم وصف إجراء قطع القناة الدافقة في القسم 3 أدناه) في اليوم 3 (لنقل الأجنة في مرحلة الخلية الواحدة) أو اليوم 4 (لنقل الأجنة في مرحلة الخلية تين).
ملاحظة: لنقل oviduct، استخدم 0.5 أيام بعد coitum (dpc) الإناث. - في صباح اليوم التالي، تحقق من الإناث SD للحصول على المكونات المهبلية، واستخدام فقط تلك مع المكونات مرئية.
- إجراء نقل الجنين.
ملاحظة: إجراء العملية الجراحية مع أدوات معقمة تحت ستيريوميكرور. قبل يوم الجراحة، مقص الأوتوكلاف، ملقط غرامة، حامل إبرة، وحامل مشرط.- إجراء التأنيز بمحلول i.p. من الكيتامين (50 ملغم/كغ) ومحلول الميثيدوميدين (0.5 ملغم/كغ). اختبار ردود الفعل لتأكيد التخدير قبل بدء العملية الجراحية.
- حقن الحيوان تحت الجلد مع حمض tolefenamic (2 ملغ / كغ) ، ولكن tartrate orphanol (1 ملغ / كجم) ، وenrofloksacin (5-10 ملغ / كجم) لمنع الالتهاب والألم والعدوى ، على التوالي.
- تطبيق مهمم العيون التشحيم على كلتا العينين لمنع تجفيف القرنية. قم بإزالة الفراء من الخلف، وتعقيم الجلد بفرك جراحي متبوعًا بالكحول بنسبة 70% باستخدام منصات غير ملتصقة معقمة. السماح للبشرة لتجف.
- حقن الحيوان تحت الجلد مع 100 ميكرولتر من 0.25٪ bupivacaine (مخدر موضعي) في موقع شق. نقل الحيوان في وضع عرضة لسطح نظيف على وسادة التدفئة تحت هدف المجهر الجراحي. تغطية الفئران مع ستارة معقمة مع ثقب صغير قطع على أسفل الظهر.
- إجراء شق الجلد حوالي 2 سم، بالتوازي مع العمود الفقري القطني.
- باستخدام مقص حاد، وجعل قطع في جدار البطن. الاستيلاء على وسادة الدهون المبيض باستخدام ملقط, وسحب المبيض وoviduct ووضعها على الشاش الذي هو الرطب مع 0.9% NaCl.
- يستنشق M2 المتوسطة، وثلاثة فقاعات من الهواء، والأجنة في الشعيرات الدموية نقل. العدد الإجمالي الموصى به للأجنة التي سيتم نقلها (أحادية أو ثنائية): أنثى حامل (≤ 15-16 جنين)، أنثى حامل ة زائفة (≤ 30 جنينًا).
- جعل شق صغير في أوفيقناة (بين infundibulum وampulla) باستخدام مقص صغير، وإدراج ماصة نقل في أوفيقناة.
- طرد بلطف الأجنة وفقاعات الهواء من الماصة إلى أوفيقناة. مع ملقط حادة، ضع الجهاز التناسلي مرة أخرى في تجويف البطن.
- خياطة جدار البطن مع غرز حمض البولي جليكوليك القابلة للامتصاص وإغلاق شق الجلد مع مقاطع الجرح. اعتمادا على عدد الأجنة المتاحة، كرر هذا الإجراء لoviduct الأخرى.
- حقن الحيوان داخل الرحم مع atipamezole (0.5 ملغ / كغ) لعكس تأثير التخدير.
- نقل الحيوان إلى قفص نظيف والاحتفاظ بها على لوحة الاحترار للتعافي تماما من التخدير. الولادة في الفئران يحدث بعد ~ 21 يوما.
ملاحظة: عندما يتم استخدام الفئران BN الذكور للتزاوج، والجراء البيضاء فقط يحتمل أن تكون معدلة. الجراء البني هي من الحمل الطبيعي. - جمع شظايا الأنسجة (ويفضل من الأذن) إلى الجراء من النمط الجيني 3 أسابيع.
- إعداد الأمهات بالتبني عن طريق تزاوج الإناث SD ناضجة جنسيا مع الذكور BN الخصبة أو مع الذكور SD قطع القناة الدافقة (يتم وصف إجراء قطع القناة الدافقة في القسم 3 أدناه) في اليوم 3 (لنقل الأجنة في مرحلة الخلية الواحدة) أو اليوم 4 (لنقل الأجنة في مرحلة الخلية تين).
3- قطع القناة الدافقة
ملاحظة: قبل يوم الجراحة، مقص الأوتوكلاف، ملقط غرامة وحامل إبرة.
- إجراء التذعن اتّصال ذُجر SD ذكر يبلغ من العمر 5 أسابيع مع إعطاء الكيتامين (50 ملغم/كغ) ومحلول الميديتوميدين (0.5 ملغم/كغ). اختبار ردود الفعل لتأكيد التخدير قبل بدء العملية الجراحية.
- إدارة حمض تولفيناميك (2 ملغ/كغ)، ولكن تارتالاليتيم (1 ملغ/كغ)، وإينرولولوكساكين (5-10 ملغم/كغ) تحت الجلد لمنع الالتهاب والألم والعدوى، على التوالي.
- تطبيق مهمم العيون التشحيم على كلتا العينين لمنع تجفيف القرنية. ضع الجرذ على سطح نظيف على وسادة تدفئة، وتعقيم الجلد على الخصيتين مع فرك الجراحية تليها الكحول 70٪ باستخدام منصات عقيمة غير الملتصقة. السماح للبشرة لتجف. تغطية الفئران مع ستارة معقمة مع ثقب صغير قطع على الخصيتان. اضغط بلطف على البطن لفضح الخصيتين في كيس الصفن.
- باستخدام مقص الجراحية، وجعل ~ 0.5 سم شق في منتصف كيس الصفن. حدد موقع جدار خط الوسط (خط أبيض) بين الخصيين.
- قم بعمل شق 5 مم في غشاء الخصية بالقرب من الجانب الأيسر من جدار خط الوسط.
- دفع بعناية الخصية إلى اليسار وتحديد vas deferens (بين الخصية وخط الوسط) كقناة بيضاء مع وعاء دموي واحد.
- سحب بلطف vas deferens من كيس الصفن باستخدام ملقط صانع الساعات. عقد vas deferens مع زوج واحد من ملقط، وقطع مع مقص غرامة (أو cauterize مع نصائح الأحمر الساخنة من زوج ثان من ملقط). إزالة ~ 1 سم جزء من القناة.
ملاحظة: إذا تم تنفيذ cauterization، عقد غيض من الزوج الثاني من ملقط في اللهب. - كرر الإجراء أعلاه للخصية الأخرى. خياطة الجلد مع غرز حمض البولي جليكوليك القابلة للامتصاص وحقن الحيوان داخل الرحم مع atipamezole (0.5 ملغ / كجم).
- ضع الجرذ في قفص نظيف على لوحة دافئة حتى يتعافى الحيوان من التخدير.
ملاحظة: يمكن استخدام الذكور في التزاوج الاختبار بعد فترة الانتعاش ~ 2 أسبوع. بعد التأكد من العقم، يمكن استخدامها لتحريض الحمل الزائف.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
باستخدام البروتوكول الموصوف هنا، تم إنتاج ناقلات العدوى المُرضية التي حملت بناء Syn-TDP-43-eGFP (titer LV الفعلي = 3.4 × 108/μL) ومن ثم يمكن استخدامها للحقن تحت زوزال الجنين في مرحلة واحدة. فقط أجنّة مع اثنان بوونينوينيّ مرئية كان أخضعت إلى الإجراء. تم تحديد عدد حقن التعليق الفيروسي تجريبيًا. واعتبرت كفاءة الزرع العالية والافتقار المتزامن للنسل المعدل وراثيا مؤشرات على عدم كفاية عدد الجسيمات الفيروسية من أجل نقل ناجح. في هذه الحالة، تم زيادة عدد الحقن. وأسفرت الإدارة الوحيدة لـ LV عن ولادة 20 فأراً من جيل F0، لم يكن أي منها معدلاً وراثياً. لم تسفر الزيادة في عدد الحقن بمقدار درجة واحدة من الحجم عن ولادة الفئران، ولكن 100٪ من الأجنة تطورت إلى مرحلة الخلايا تين. وفي التجارب اللاحقة، زاد عدد الحقن بمقدار واحد مقارنة بالقيمة التي تم الحصول على النسل من أجلها. بالنسبة للمتغير من حقنتين ، ولدت ثمانية فئران ، ثلاثة منها تم تأكيد حملها للمتحول (ملخص في الجدول 1). ولم ينقل أحد المؤسسين الجين إلى ذرية. وكان عدد الأجنة التي تم حقنها ونقلها في كل متغير تجريبي 48 في المتغيرات LV x1 و LV x2 و 45 في LV x10. واستُخدمت ثلاث إناث بالتبني في كل إعداد تجريبي. سمح النهج المختار بتوليد خطوط فئران معدلة مستقرة عبرت عن بروتين الاندماج TDP-43-eGFP تحت سيطرة مروج Synapsin-1 العصبي في جميع أنحاء الجهاز العصبي المركزي بأكمله(الشكل 2A, B)14. أدى التحول القائم على الفيروس إلى إدخال نسخة واحدة من الترانسجين كما يتضح من qPCR(الشكل 2C).
في الإعداد التجريبي الذي تم وصفه أعلاه ، كان معدل البقاء على قيد الحياة من الأجنة المحقونة 95٪. وقد تم الحصول على نتائج مماثلة عندما استخدمت نفس الطريقة لناقلات أخرى للفيروسيل على النحو الموجز في الجدول 2. وكانت النسبة المئوية للأجنة التي نجت من الحقن النووي الأولي أقل بكثير (29-45 في المائة). يلخص الجدول 2 النتائج التمثيلية لكفاءة زرع الزيجوت اتّهمت، مع الأخذ في الاعتبار نقل الحوامل الزائفة مقابل الحوامل. تم الإبلاغ سابقا عن استخدام الأجنة غير المتلاعبة جنبا إلى جنب مع الأجنة المحقونة16. تشير نتائجنا الإجمالية إلى أنه يمكن استخدام الفئران الأنثوية الحامل كأمهات بالتبني بكفاءة مماثلة. حصلنا على نسبة مماثلة من زرع الأجنة الأجنبية في الفئران الحامل والحوامل (المتوسط العام للعديد من الاجهزة التجريبية: 15٪ مقابل 16٪). ومع ذلك، كان معدل الزرع أعلى عندما خضعت الأجنة لتلاعب أكثر دهاءً، مما يعني حقناً تحت الجلد (10% مقابل 21%). وتجدر الإشارة إلى أن البيانات العددية التي تم تحليلها للجولات الفردية من الحقن المجهري تشير إلى أن فعالية الزرع تعتمد على عدد حقن جنين واحد(الجدول 1، العمود الأخير) وتعتمد بشكل غير مباشر على الحمل الفيروسي.
| المتجه | عدد الحقن/ الجنين | عدد الأجنة التي تم حقنها | عدد الجراء | عدد الأمهات بالتبني | عدد المؤسسين المعدلين وراثيا | كفاءة الزرع لكل متغير |
| Syn-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
الجدول 1: موجز لعدد الحقن تحت الزوزونية للزيجوتات معناقلات فيروسنقص التئس الرضائيSyn-TDP-43WT.
| الاسلوب | المتجه | تتر / التركيز | عدد الأجنة المحقونة | الأجنة الناجية | معدل البقاء على قيد الحياة | عدد الأمهات اللائي بتبني | عدد الجراء | كفاءة الزرع | الحمل (P) / الحمل الزائف (PP) |
| PNI | TTYH1-Thy1-EGFP | 1 نانوغرام/ميكرولتر | 1083 | 424 | 39% | 16 | 54 | 13% | Pp |
| PNI | H3mCherry | 0.5-2 نانوغرام/ميكرولتر | 2229 | 647 | 29% | 29 | 67 | 10% | Pp |
| PNI | Syn-TDP-43-A315T | 2 نانوغرام/ميكرولتر | 1256 | 562 | 45% | 31 | 42 | 7% | Pp |
| Lv | Syn-TDP-43-A315T | 8.7 × 108 | 115 | 106 | 92% | 7 | 18 | 17% | ف |
| Lv | Syn-TDP-43 WT | 3.4 × 108 | 152 | 141 | 93% | 9 | 28 | 20% | ف |
| Lv | LVH3mcherry | 1.3 × 107 | 504 | 450 | 89% | 13 | 115 | 26% | Pp |
الجدول 2: معدل بقاء الجنين وكفاءة الزرع، اعتمادا على طريقة الحقن التي استخدمت والحمل مقابل تحريض الحمل الزائف. PNI، الحقن النووي؛ LV، حقن الناقل الملوّن المُضافي.

الشكل 1: صورة مجهرية لجنين فئران من خلية واحدة تم إعداده لحقن ناقل الفيروس تحت الخلايا. تم شل الجنين بكيس عقد. اثنين من النوى التي تحتوي على المواد الوراثية الأم والأبوية والجسم القطبي مرئية. شريط المقياس = 20 ميكرومتر. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
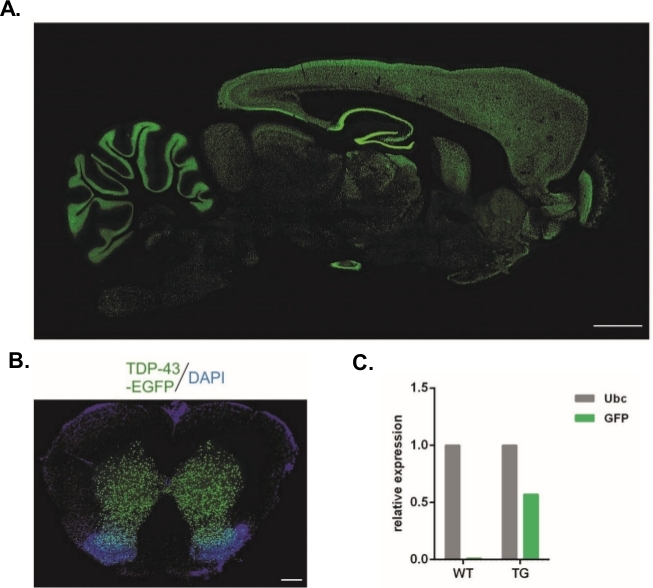
الشكل 2: جيل من خطوط الفئران المعدلة وراثيا مستقرة التي عبرت عن بروتين الانصهار TDP-43-eGFP تحت السيطرة على المروج Synapsin-1 الخلايا العصبية في جميع أنحاء الجهاز العصبي المركزي بأكمله. (A)Synapsin-1 (Syn) مدفوعة hTDP-43-eGFP نمط التعبير في مقطع مجذل من الدماغ الفئران المعدلة وراثيا. شريط مقياس = 3 ملم .(ب)قسم كورونال من الحبل الشوكي من الفئران المعدلة وراثيا حيث eGFP فلورسسين، مضادة مع DAPI، كان يقتصر على المادة الرمادية من الحبل الشوكي. شريط المقياس = 250 ميكرومتر. (C)التعبير النسبي من GFP نسخة transgene مقارنة مع النص المرجعي في كل يوم من الكلى C. ن = 2 البرية. ن = 2 المعدلة وراثيا. تم تعديل الرقم من14. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
وقد جعل التقدم في التكنولوجيات المعدلة وراثيا نماذج القوارض أداة لا تقدر بثمن في البحوث الطبية الحيوية. أنها توفر الفرصة لدراسة العلاقات النمط الجيني والنمط الظاهري في الجسم الحي. هنا، نقدم بديلاً متاحاً على نطاق واسع للتوليد التقليدي عن طريق الحقن النووي. استخدام نقل الجينات lentiviral يتجاوز الحاجة إلى الحقن المجهري ة المطالبة لأن ناقلات الفيروسية يمكن حقنها تحت pellucida زونا. هذا النهج لا يؤثر على سلامة الجنين، والذي يضمن أساسا معدل البقاء على قيد الحياة 100٪ للالزيجوت اتحقن. يتم دمج الترانسجين الذي يتم دمجه عن طريق ناقلات الفيروس اللين بشكل ثابت في الجينوم المضيف ، مما يسمح بالتعبير على المدى الطويل وانتقال الخط الجرثومي. بالإضافة إلى ذلك، نقدم تقنيتين بديلتين لنقل الأجنة المعدلة إلى الأمهات بالتبني. تستخدم إحدى التقنيات نقل الأجنة إلى الإناث الحوامل الزائفات التي تم إعدادها مسبقًا عن طريق التزاوج مع الذكور العقيمين الدافقين. وتستند التقنية الأخرى على استخدام الإناث الحوامل بشكل طبيعي التي تزاوج مع الذكور الخصبة ولكن مع لون فرو مختلفة (أي الفئران BN). هذا الدورة أكثر فسيولوجية من الحمل يسمح النمو السليم للأجنة التي تخضع للتعديلات الوراثية الصعبة16.
تم الإبلاغ عن أول محاولات ناجحة لتوليد الفئران المعدلة وراثيا في عام 19907. ومع ذلك ، بسبب الصعوبات في تحويل الفئران17، تم إنشاء عدد صغير نسبيًا من خطوط الفئران المعدلة وراثياً في العقود الأخيرة9. ويلاحظ العديد من الاختلافات الرئيسية بين الماوس والفئران transgenesis باستخدام الحقن المجهري. بالنسبة للفئران، تستخدم الخطوط الأصيلة بشكل رئيسي (على سبيل المثال، Wistar و SD) لترانسجينيسيس. بالنسبة للفئران ، يستخدم الباحثون بشكل رئيسي السلالة المتقاطعة F1 من السلالات الأصيلة بسبب ارتفاع خصوبتها ، واستجابة أفضل للإباضة الهرمونية ، والتنمية السهلة نسبيًا للأجنة في المختبر من مرحلة الخلية الواحدة إلى الكيسات الأريمية18. تحريض الإباضة الفائقة في الفئران هو أقل كفاءة بكثير مما كانت عليه في الفئران باستخدام التحفيز هرمون PMSG / hCG القياسية. لهذا السبب, وقد بذلت محاولات لتطوير بروتوكولات بديلة لإدارة هذه الهرمونات في الفئران التي تستخدم ضخ FSH المستمر بدلا من إدارة PMSG واحد19. ومع ذلك، وقد ثبت superovulation التي تسببها PMSG/ hCG أو FSH / hCG أن كفاءة مماثلة20. في رأينا، العامل الأكثر أهمية الذي يؤثر على فعالية الإباضة الفائقة هو عمر الإناث مختارة. ومع ذلك، ينبغي اختبار البارامترات الدقيقة لكل سلالة من سلالات الفئران، والمختبر، وما إلى ذلك.
إجراء حقن محلول الحمض النووي في النواة الأولية لجنين أحادي الخلية مشابه لكلا النوعين من القوارض. ومع ذلك ، فإن النوى الأولية للزيجوتات الفئران ليس لديها أشكال منتظمة كما هو الحال في الفئران وتميل إلى أن تكون أكثر صعوبة في تحديد السيتوبلازم للخلية. بالإضافة إلى ذلك ، فإن غشاء خلية الزيجوت الجرذ والغشاء النووي هو أكثر مرونة ولزوجة ، مما يعقد إدخال ميكروبيبيت زجاجي محمل بمحلول الحمض النووي. هذه العوامل تؤدي إلى انخفاض معدلات بقاء بيض الفئران بعد الحقن المجهري (31-65٪ مقابل 80٪ في الفئران) وشرح انخفاض كفاءة التحول في الفئران9. وعلاوة على ذلك، يمكن أن يؤثر التلاعب الميكانيكي المكثف للجنين أيضًا على كفاءة الزرع، والتي تصل في العديد من المختبرات، بما في ذلك مختبراتنا، إلى 10٪ كحد أقصى. ويلاحظ هذا العائد المنخفض نسبيا حتى بعد زرع عدد مناسب من الأجنة21.
إحدى الطرق التي تتغلب على الصعوبات المذكورة أعلاه هي عدوى الأجنة أحادية الخلية بالفيروسات الرجعية. الفيروسات الرجعية تحتوي على مواد وراثية في شكل الحمض النووي الريبي، والتي عند الدخول إلى الخلية المصابة يتم نسخها إلى الحمض النووي عن طريق النسخ العكسي للفيروس. ثم يتم نقل الحمض النووي عبر المسام النووية إلى نواة الخلية ، حيث يتكامل في جينوم الخلية في شكل فيروس. وقد استخدمت ناقلات الفيروس للتوليد الفئران المعدلة وراثيا والفئران12,14,22. يمكن احتضان الأجنة أحادية الخلية التي تفتقر إلى الزونا بيلسيدسيلا في محلول مع ناقل للفيروسي، أو يمكن حقن المتجه تحت الزونا بيليسيدا في الفضاء perivitelline. الميزة الرئيسية لهذه الطريقة هي كفاءتها العالية للغاية ، حيث تصل إلى أكثر من 80٪ من النسل المعدل وراثيا. بعد العدوى بناقل العدوى المُرضية، قد تندمج نسخ كثيرة في مواقع مختلفة في جينوم الزيجوت، على النقيض من طريقة التحول إلى الجينق عن طريق الحقن المجهري النووي، حيث عادة ما يُلاحظ موقع تكامل واحد12. في نسل المؤسس المعدل وراثيا التي يتم إجراؤها باستخدام ناقلات الفيروس، يتم فصل نسخ فردية من transgene، والتي يمكن أن تتجلى من خلال ملامح التعبير المختلفة من transgene في كل من ذرية. ومع ذلك، يمكن أن يزيد هذا من فرصة تلقي موضوع مع التشكيل الجانبي التعبير المطلوب المستمدة من transgene. تنطبق القيود بشكل رئيسي على حجم الترانسجين ، والذي يقتصر على حوالي 8 كيلوبايت23.
وثمة صعوبة أخرى في تحويل الفئران هي جيل الإناث التي تعمل كأمهات بديلات للأجنة المعدلة وراثيا. في الإجراء القياسي ، يتم عبور الإناث مع الذكور المعقمة المزهرية للحث على الحمل الزائف. في الفئران ، تقنية تقييم الحمل الزائف أكثر صعوبة بكثير مما كانت عليه في الفئران ، لذلك يتم استخدام التحفيز مع gonadotropin الإفراج عن هرمون ناهض في بعض الأحيان قبل بضعة أيام من التزاوج مع الذكور. ولهذه الأسباب، نقدم في البروتوكول الموصوف نهجين بديلين للحصول على الأمهات بالتبني. كفاءة الزرع الإجمالية للزيجوتات المتلاعب بها عند استخدام الإناث الحوامل أو الحوامل الزائفات متشابهة. ومع ذلك ، فإن وجود الأجنة الطبيعية غير المتلاعبة جنبا إلى جنب مع تلك التي تم التلاعب بها يمكن أن يحسن معدل الحمل16. على الرغم من أن الفرق الرئيسي في معدل الزرع هو تقنية التلاعب (أي PNI مقابل LV ، 10٪ مقابل 20٪؛ انظر الجدول 2)، فإن استخدام الإناث الحوامل الزائفات كأمهات بالتبني قد يكون مفيدًا لبعض التجارب.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
لصاحب البراءة (W.K.) حقوق في براءة الاختراع، "طريقة إنتاج الحيوان المعدل وراثيا"، من مكتب براءات الاختراع في جمهورية بولندا (رقم P 355353؛ 21.03.2008).
Acknowledgments
وقد تم دعم هذه الدراسة من قبل مشروع ANIMOD ضمن برنامج Team Tech Corefacilits Plus التابع لمؤسسة العلوم البولندية ، الذي شارك في تمويله الاتحاد الأوروبي في إطار صندوق التنمية الإقليمية الأوروبي إلى WK.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



