Summary
Dit artikel is bedoeld om de methodologie voor lentivirale transgenese in rattenembryo's met behulp van meerdere injecties van een virussuspensie in de zygote perivitelline ruimte. Vrouwelijke ratten die zijn gepaard met een vruchtbare mannelijke stam met een andere dominante vacht kleur wordt gebruikt om pseudozwangere pleegmoeders te genereren.
Abstract
Transgene diermodellen zijn van fundamenteel belang voor modern biomedisch onderzoek. De integratie van vreemde genen in vroege muis- of rattenembryo's is een waardevol instrument voor genfunctieanalyse in levende organismen. De standaard transgenese methode is gebaseerd op micro-injecterende vreemde DNA-fragmenten in een kern van een bevruchte eicel. Deze techniek wordt veel gebruikt bij muizen, maar blijft relatief inefficiënt en technisch veeleisend bij andere diersoorten. Het transgeen kan ook via lentivirale infectie in embryo's in een celstadium worden gebracht, wat een effectief alternatief biedt voor standaard pronucleaire injecties, vooral bij soorten of stammen met een meer uitdagende embryostructuur. In deze benadering wordt een suspensie die lentivirale vectoren bevat geïnjecteerd in de perivitellineruimte van een bevrucht rattenembryo, dat technisch minder veeleisend is en een hoger slagingspercentage heeft. Lentivirale vectoren bleken het transgeen efficiënt in het genoom op te nemen om de generatie van stabiele transgene lijnen te bepalen. Ondanks enkele beperkingen (bijvoorbeeld biosafety level 2-vereisten, DNA-fragmentgroottelimieten), is lentivirale transgenese een snelle en efficiënte transgenesemethode. Bovendien, met behulp van vrouwelijke ratten die zijn gepaard met een vruchtbare mannelijke stam met een andere dominante vacht kleur wordt gepresenteerd als een alternatief voor het genereren van pseudozwangere pleegmoeders.
Introduction
Al vele jaren worden laboratoriumknaagdieren, zoals ratten en muizen, gebruikt om menselijke fysiologische en pathologische aandoeningen te modelleren. Dierlijk onderzoek heeft geleid tot ontdekkingen die op een andere manier onbereikbaar waren. Aanvankelijk richtten genetische studies zich op de analyse van spontaan voorkomende aandoeningen en fenotypes die worden beschouwd als een nauwe nabootsing van de menselijke conditie1. De ontwikkeling van genetische manipulatie methoden konden de introductie of verwijdering van specifieke genen om een gewenste fenotype te verkrijgen. Daarom wordt de generatie transgene dieren erkend als een fundamentele techniek in modern onderzoek dat studies van genfunctie in levende organismen mogelijk maakt.
Transgene diertechnologie is mogelijk geworden door een combinatie van prestaties in experimentele embryologie en moleculaire biologie. In de jaren 1960 publiceerde de Poolse embryoloog A. K. Tarkowski het eerste werk over de manipulatie van muisembryo's in de vroege stadia van ontwikkeling2. Daarnaast ontwikkelden moleculaire biologen technieken om DNA-vectoren (d.w.z. dragers) te genereren voor onder meer de introductie van vreemd DNA in het genoom van het dier. Deze vectoren maken de voortplanting van geselecteerde genen en de juiste modificatie mogelijk, afhankelijk van het type onderzoek dat wordt uitgevoerd. De term "transgene dier" werd geïntroduceerd door Gordon en Ruddle3.
De eerste algemeen aanvaarde soort die werd gebruikt in de neurobiologie, fysiologie, farmacologie, toxicologie, en vele andere gebieden van de biologische en medische wetenschappen was de Noorse rat, Rattus norvegicus4. Echter, vanwege de moeilijkheid bij het manipuleren van rattenembryo's, is de huismuis Mus musculus uitgegroeid tot de dominante diersoorten in genetisch onderzoek5. Een andere reden voor het primaat van de muis in dergelijk onderzoek was de beschikbaarheid van embryonale stamceltechnologie om knock-outdieren voor deze soort te genereren. De meest gebruikte techniek van transgenese (2-10% van transgene nakomelingen ten opzichte van alle geboren dieren) is de micro-injectie van DNA-fragmenten in een kern van een bevruchte eicel. In 1990 werd deze aanpak, die voor het eerst werd geïntroduceerd bij muizen, aangepast voor ratten6,7. Transgenese van ratten door pronucleaire injectie wordt gekenmerkt door een lagere efficiëntie8 in vergelijking met muizen, die strikt gerelateerd is aan de aanwezigheid van elastisch plasma en pronucleaire membranen9. Hoewel de overleving van embryo's na manipulatie 40-50% lager is dan bij muizen, wordt deze techniek beschouwd als een standaard in de generatie van genetisch gemodificeerde ratten10. Er zijn alternatieve benaderingen onderzocht die een efficiënte transgeneintegratie en hogere overlevingskansen van geïnjecteerde zygotes kunnen garanderen.
De belangrijkste determinant van stabiele transgene expressie en overdracht naar nakomelingen is de integratie ervan in het genoom van de gastheercel. Lentivirussen (LVs) hebben het onderscheidende kenmerk van de mogelijkheid om zowel delende als niet-delende cellen te infecteren. Hun gebruik als hulpmiddel voor de integratie van heterologe genen in embryo's bleek zeer efficiënt11, en transgene individuen worden gekenmerkt door stabiele expressie van de opgenomen DNA-fragment. De werkzaamheid van lentivirale vectoren is bevestigd voor de genetische modificatie van muizen12,13, ratten12,14en andere soorten11. Bij deze methode wordt de LV-suspensie geïnjecteerd onder de zonapellucida van het embryo in het stadium van twee pronuclei. Deze techniek garandeert in wezen 100% overleving van de embryo's omdat de oolemma onaangetast blijft. De productie van hoogwaardige en relatief sterk geconcentreerde LV-ophangingen zijn cruciale factoren. Lagere concentraties LV-suspensingen kunnen echter worden overwonnen door herhaalde injecties11, waardoor de hoeveelheid virale deeltjes aan het eioppervlak toeneemt en de membraanintegratie niet wordt beïnvloed. Embryo's die worden onderworpen aan herhaalde injecties in de perivitelline ruimte ontwikkelen zich verder, en transgene nakomelingen kunnen het transgeen overbrengen via de kiembaan. De efficiëntie van transgene rattengeneratie door lentivirale transgenese kan oplopen tot 80%12.
Hier beschrijven we de productie van hiv-1-afgeleid recombinant lentivirus dat pseudotyped was met vesiculaire stomatitisvirus (VSV) G-envelopeiwit. Het gebruik van het tweede generatie verpakkingssysteem VSV pseudotype bepaalt de brede infectiviteit van virale deeltjes en maakt de productie van zeer stabiele vectoren die kunnen worden geconcentreerd door ultracentrifugatie en cryopreserved. Na titer verificatie, de vectoren zijn klaar om te worden gebruikt als een voertuig voor transgene levering in albino Wistar rat zygotes. Na een reeks injecties kunnen de embryo's 's nachts worden gekweekt en in het tweecellige stadium worden overgedragen aan pleegmoeders. Op dit punt kan een van de twee alternatieve benaderingen worden overwogen. De standaardprocedure maakt gebruik van pseudozwangere vrouwtjes als embryo-ontvangers. Echter, wanneer de zwangerschap laag is na de paring met vasectomized mannetjes, kunnen de embryo's worden geïmplanteerd in zwangere Wistar / Sprague-Dawley (SD) vrouwtjes die zijn gepaard met vruchtbare mannelijke ratten met een donkere vacht kleur (bijvoorbeeld, Brown Norway [BN] ratten). De kleur van de vacht maakt het mogelijk om nakomelingen van natuurlijke zwangerschap en nakomelingen die afkomstig zijn van de overgedragen gemanipuleerde embryo's, te onderscheiden.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
De productie en toepassing van virale vectoren was in overeenstemming met de bioveiligheidsniveau 2-richtlijnen en werd goedgekeurd door het Poolse ministerie van Milieu. Alle experimentele dierprocedures die hieronder worden beschreven, zijn goedgekeurd door de Lokale Ethische Commissie. De dieren werden ondergebracht in individueel geventileerde kooien bij een stabiele temperatuur (21-23 °C) en vochtigheid (50-60%) met ad libitum toegang tot water en voedsel onder een 12 h/12 h licht/donker cyclus.
1. Lentivirale vectorproductie
- Transfection van HEK 293T cellen
OPMERKING: Het protocol dat hierin wordt gepresenteerd is ontworpen voor de transfection van twintig Ø10 cm kweekgerechten die ongeveer 200 mL ruwe vector supernatant produceert.- Kweek HEK 293T cellen in DMEM medium dat wordt aangevuld met foetaal runderserum (10%, v/v) in een bevochtigde CO2 incubator bij 37 °C. Voor transfection, bereiden twintig 10 cm diameter platen, en zaad 1,5-2 x 106 HEK 293T cellen per schotel.
- Wanneer de samenvloeiing ~70% bereikt, transfect de cellen gebruikend polyethyleenimine (PEI) reagens, pH 7.0, bij een verhouding van 3 μg PEI per 1 μg van DNA.
- Bereid het transfection mengsel voor vijf platen (bereid het aantal herhalingen op basis van het totale aantal gerechten). Voeg het mengsel van drie plasmiden van 1 mL van Dulbecco (DMEM; zonder serum) toe, zodat ze een eindbedrag van 25 μg VSVg plasmi, 50 μg delta R8.2 en 50 μg coderingsplasmiden bereiken.
- Pipetteer op en neer en voeg 125 μL PEI toe bij een concentratie van 3 μg/μL. Incubeer bij kamertemperatuur gedurende 15 min, waarbij de buis drie keer wordt omkeerd tijdens de incubatie. Voeg 200 μL van het transfection mengsel per plaat toe. Bemeer vervolgens de platen in een bevochtigde CO2-incubator bij 37 °C.
- Concentratie van lentivirale vectoren
- Achtenveertig uur na transfection, oogst het medium dat LV deeltjes bevat. Gebruik 50 mL conische buizen.
OPMERKING: Bij het gebruik van een plasmide met een fluorescerende tag kunnen cellen op dit punt worden gevisualiseerd om de transfection-efficiëntie te controleren. Een nieuw gedeelte van DMEM medium kan worden toegevoegd, en cellen kunnen worden geïncubeerd voor een extra 24 uur. De LV-opbrengst is vergelijkbaar wanneer deze na de transfetie wordt verzameld op de tijdspunten 48 en 72 uur. - Centrifugeer het medium op 3.000 x g gedurende 5 min en kamertemperatuur om losstaande cellen te verwijderen.
- Filtreer de supernatant (0,45 μm) en giet het in nieuwe buizen.
LET OP: Deze stap kan worden weggelaten. - Voeg DNase I (RNase-vrij, 1 μg/mL) en MgCl2 (1 mM) toe en broed in een waterbad bij 37 °C gedurende 15 min.
- Breng de medium- tot wegwerppolyethyleenbuizen en ultracentrifuge in een swingende rotor op 115.000 x g en 4 °C gedurende 1,5 uur.
- Na het centrifugeren, voorzichtig afvoer van de wanden van de buizen van de medium residuen.
- Week de pellet met steriele fosfaatgebufferde zoutoplossing (PBS; 70-80 μL per buis).
- Incubeer gedurende 2 uur bij 4-8 °C.
- Resuspend de virale vectoren in PBS door zachte pipetteren.
LET OP: Vermijd schuimvorming. - Breng over op een centrifugebuis van 1,5 mL en centrifuge er bij 7.000 x g en 4 °C voor 30 s. Breng de supernatant over op een nieuwe buis. Herhaal deze stap totdat er geen cellulaire puin pellet zichtbaar is.
- Aliquot en vries bij -80 °C. Vermijd het opnieuw invriezen van de LV aliquot.
- Achtenveertig uur na transfection, oogst het medium dat LV deeltjes bevat. Gebruik 50 mL conische buizen.
- Bepaling van virustiter met behulp van kwantitatieve polymerasekettingreactie
OPMERKING: De titratie van virale vectoren wordt uitgevoerd met behulp van kwantitatieve PCR (qPCR). Deze methode is gebaseerd op het versterken van een dubbelstrengs 84 bp lang DNA-fragment binnen het lange terminale herhalingsgebied van het virale genoom15.- Bereid de standaardcurve voor door seriële verdunningen van het LV-coderende plasmide te maken: 1:500, 1:1.000, 1:5.000, 1:100.000 en 1:1.000.000. Bepaal het aantal kopieën van de plasmide die wordt gebruikt voor de standaardcurve. Gebruik de volgende formule: aantal exemplaren/μL = (concentratie [g/μL] x 6,02 x 1023 [getal/mol]) / (660 [g/mol] x plasmidgrootte [bp]), waarbij 6,02 x 1023 nummer/mol het nummer van Avogadro is en 660 g/mol het gewicht bp.
OPMERKING: Online kopieernummercalculators kunnen worden gebruikt. - Bereid verdunningen van de lentivirale suspensie voor: 1:100, 1:500 en 1:1.000.
- Bereid het reactiemengsel (volumes per put): 10 μL qPCR Mastermix, 1 μL van 10 μM Forward primer, 1 μL of 10 μM reverse primer en 7 μL H2O. Pipetteer het mengsel in de putten van 96-well platen.
OPMERKING: Voorwaartse primer: 5'-AGCTTGCCTTGAGTGCTTCA. Reverse primer: 5'-TGACTAAAAGGGTCTGAGGGA. - Voeg 1 μL van elke standaard verdunning en lentivirale suspensie in drievoud toe.
- Voer de qPCR uit volgens de volgende parameters: 50 °C voor 2 min, 96 °C voor 5 min en 35 cycli van 96 °C voor 20 s, 60 °C voor 40 s en 70 °C gedurende 1 min, gevolgd door smeltcurvefase: 95 °C voor 1 min en 60 °C bij 30 s.
- Analyseer de resultaten door het aantal moleculen dat voor elke verdunning wordt ontvangen te vergelijken met de standaardcurve. Bepaal de concentratie van vectormoleculen als het gemiddelde van drie repliceert voor elke verdunning.
OPMERKING: De gepresenteerde kwantificering geeft de fysieke concentratie van de virale deeltjes. Het moet niet worden behandeld als een functionele titer.
- Bereid de standaardcurve voor door seriële verdunningen van het LV-coderende plasmide te maken: 1:500, 1:1.000, 1:5.000, 1:100.000 en 1:1.000.000. Bepaal het aantal kopieën van de plasmide die wordt gebruikt voor de standaardcurve. Gebruik de volgende formule: aantal exemplaren/μL = (concentratie [g/μL] x 6,02 x 1023 [getal/mol]) / (660 [g/mol] x plasmidgrootte [bp]), waarbij 6,02 x 1023 nummer/mol het nummer van Avogadro is en 660 g/mol het gewicht bp.
2. Generatie transgene ratten
- Superovulatie en verzameling van bevruchte embryo's
- Bestuur gonadotropinen.
OPMERKING: Om het aantal verzamelde embryo's (ongeveer 30 per vrouwtje) te verhogen, gebruik onrijpe 5 weken oude Wistar-vrouwtjes voor hormonale stimulatie.- Op dag 1 (12 pm-1 PM) injecteer je het serum gonadotropine van zwangere merrie (PMSG; 25 IE per vrouwtje). Bereid 1 mL aliquots van werkende oplossing bij een concentratie van 125 IE/mL door hormoonpoeder in 0.9% NaCl op te lossen. Bewaar op -20 °C voor maximaal 1 maand of -80 °C gedurende maximaal 6 maanden.
- Op dag 3 (12 PM-1 PM) injecteer je intraperitoneally menselijke chorionic gonadotrofine (hCG; 30 IE per vrouwtje). Bereid 1 mL aliquots van de werkoplossing (150 IE/mL) door hormoonpoeder op te lossen in 0,9% NaCl. Bewaar op -20 °C voor maximaal 1 maand of -80 °C gedurende maximaal 6 maanden.
- Na hCG toediening, stuur vrouwtjes 1:1 met seksueel vruchtbare mannetjes (3-10 maanden oud).
- De volgende ochtend (dag 4 om 8-10 uur), controleer de vrouwtjes op de aanwezigheid van een vaginale plug. Controleer de vaginale opening op de aanwezigheid van een witachtige paringsplug, die voor de beste visualisatie vroeg in de ochtend na de paringsnacht moet worden gecontroleerd. Voor het verzamelen van embryo's, gebruik alleen vrouwtjes met een zichtbare stekker.
- Verzamel embryo's om 10 uur. Offer de dieren op om de eiducten uit te snijden en verzamel de eikanalen in een schaal met voorverwarmd M2-medium.
- Breng de oviducten over op een schaal van 35 mm die voorverwarmd M2-medium met hyaluronidase van rundertees met een concentratie van 0,5 mg/mL bevat.
- Open de wanden van het oviduct met behulp van fijne tangen onder een stereomicroscoop en druk op de ampulla (dat wil zeggen, het gezwollen deel van het oviduct dat bevruchte embryo's bevat die zijn omgeven door cumuluscellen) totdat de embryo's worden bevrijd.
OPMERKING: Hyaluronidase verteert embryo's enzymatisch en laat embryo's los.
LET OP: Langdurige blootstelling aan hyaluronidase is schadelijk voor embryo's; daarom mag deze stap niet langer dan 5 min duren. - Om het vrijkomen van embryo's uit cumuluscellen te vergemakkelijken, pipetteer ze voorzichtig op en neer met behulp van een glazen overdracht pipet die is aangesloten op een mondbediende aspirator buis.
- Om de overdracht pipet te produceren, trek een glazen Pasteur pipet over een vlam om een rechte ~ 5-10 cm tip te produceren. Breek de pipet en laat een punt van ~4 cm achter.
- Was de embryo's een paar keer in M2 medium om hyaluronidase en cellulair puin te verwijderen. Breng de embryo's over op een schaal van 60 mm die (~50 μL) druppels voorgeëalibrated M16-medium bevat, bedekt met2 vloeibare paraffine of minerale olie, in een bevochtigde couveuse van 37 °C met een 5% CO 2-atmosfeer.
- Bestuur gonadotropinen.
- Micro-injectie van lentivirale vectoren tot eencellige embryo onder de zona pellucida
OPMERKING: Gebruik embryo's in één celstadium met twee zichtbare pronuclei voor micro-injectie (figuur 1).- Ontdooi de LV aliquot bij kamertemperatuur en centrifugeer op 10.000 x g en RT gedurende 2 minuten om alle resterende cellulaire resten te pelleten.
- Microinjectie-installatie
- Bereid glazen houdpipetten (borosilicaat glazen capillair) met behulp van een microforge. Trek de glazen capillair over een vlam om een 5-10 cm tip te produceren. Breek de pipet en laat een punt van ~4 cm achter. De buitendiameter moet ~80-120 μm zijn.
LET OP: Zorg ervoor dat de pipettip perfect recht en glad is. - Monteer de getrokken pipet in een microforge met de punt voor de verwarmingsgloeidraad. Verwarm de gloeidraad zeer dicht bij de pipetpunt en laat het krimpen tot een diameter van ~ 15 μm (ongeveer 20% van de embryogrootte). Plaats de pipet loodrecht op de verwarmingsgloeidraad, 2-3 mm van de pipetpunt, en begin te verwarmen. Het glas zal verzachten. Verwarm tot het een hoek van 15° bereikt.
- Bereid microinjectie borosilicaat glazen haarvaten met een gloeidraad met behulp van een pipet trekker. Plaats de capillaire in de trekkamer. Voer een hellingstest uit (voor het eerst voor nieuw glas en elke keer na het vervangen van de gloeidraad). Stel de heat in op de hellingwaarde -10, Trek op 100, Snelheid op 150 en Tijd op 100.
OPMERKING: Wijzig de parameters om een optimale injectiecapillaire te verkrijgen. - Onder een bioveiligheidslaminaire stroomkap, laad ongeveer 2 μL van de virale oplossing in de microinjectie pipet met een microloader tip.
- Bereid een micro-injectieschaal (deksel van 60 mm petrischaal) met een 100 μL-druppel M2-medium (in het midden), bedekt met vloeibare paraffine- of minerale olie.
- Monteer de houdpipet en micro-injectie capillaire die is geladen met virale oplossing om een micromanipulator en micro-injectie schotel onder een omgekeerde microscoop.
- Bereid glazen houdpipetten (borosilicaat glazen capillair) met behulp van een microforge. Trek de glazen capillair over een vlam om een 5-10 cm tip te produceren. Breek de pipet en laat een punt van ~4 cm achter. De buitendiameter moet ~80-120 μm zijn.
- Voer de micro-injectie uit.
- Breng 15-20 embryo's uit één cel naar de M2-druppel op de micro-injectieschaal. Houd het embryo vast met behulp van een houdpijp.
- Met behulp van 400x vergroting, injecteer de LV-oplossing onder de zona pellucida naar de perivitelline ruimte met behulp van de glazen capillaire die is aangesloten op een automatische injector. Houd de capillaire onder de zona pellucida voor een moment.
OPMERKING: Met behulp van zachte positieve druk zal de virale oplossing continu uit de injectiecapillaire stromen, maar het volume van de geleverde suspensie kan niet worden gecontroleerd. - Breng met een fijne pipet de embryo's terug naar de kweekschaal in2 de couveuse bij 37 °C in een 5% CO 2-atmosfeer. Het aantal injecties van één zygote kan variëren en kan worden aangepast op basis van de virale vectorconcentratie.
OPMERKING: De geïnjecteerde embryo's kunnen worden overgedragen aan pleegmoeders in het stadium van één cel of geïncubeerd O/N in M16-medium voordat ze in het tweecellige stadium worden overgedragen. Langdurige in vitro kweek van rattenembryo's moet worden vermeden.
- Overdracht van geïnjecteerde embryo's aan pleegmoeders
- Bereid pleegmoeders voor door seksueel volwassen SD-vrouwtjes te paren met vruchtbare BN-mannetjes of met vasectomized SD-mannetjes (de vasectomieprocedure wordt beschreven in punt 3 hieronder) op dag 3 (voor het overbrengen van embryo's in het eencellige stadium) of dag 4 (voor het overbrengen van embryo's in het tweecellige stadium).
OPMERKING: Gebruik voor oviducttransfer 0,5 dagen na coitum (dpc) vrouwtjes. - De volgende ochtend, controleer SD vrouwtjes voor een vaginale plug, en gebruik alleen die met een zichtbare plug.
- Voer embryotransfer uit.
LET OP: Voer de chirurgische ingreep uit met steriele instrumenten onder een stereomicroscoop. Vóór de dag van de operatie, autoclave schaar, fijne tangen, naaldhouder, en scalpel houder.- Verdoof een vrouw met i.p. toediening van ketamine (50 mg/kg) en medetomidine (0,5 mg/kg) oplossing. Test op reflexen om anesthesie te bevestigen voordat de chirurgische ingreep wordt gestart.
- Injecteer het dier onderhuids met tolefenamic zuur (2 mg/kg), butorphanol tartraat (1 mg/kg) en enrofloksacin (5-10 mg/kg) om ontstekingen, pijn en infectie te voorkomen, respectievelijk.
- Breng oogheelkundige zalfsmering aan op beide ogen om hoornvliesdrogen te voorkomen. Scheer de vacht van de rug, en steriliseren van de huid met chirurgische scrub gevolgd door 70% alcohol met behulp van steriele niet-vasthoudenpads. Laat de huid drogen.
- Injecteer het dier onderhuids met 100 μL van 0,25% bupivacaine (lokale verdoving) op de incisieplaats. Breng het dier in een gevoelige positie naar een schoon oppervlak op een verwarmingskussen onder het doel van een chirurgische microscoop. Bedek de rat met een steriel gordijn met een klein gaatje over de onderrug.
- Voer een huidincisie van ongeveer 2 cm uit, parallel aan de wervelkolom van de lenden.
- Met behulp van een scherpe schaar, maak een snede in de buikwand. Pak een ovariële vetpad met behulp van tangen, en trek de eierstok en oviduct en plaats ze op gaas dat is bevochtigd met 0,9% NaCl.
- Aanzuigen M2 medium, drie bubbels van lucht, en de embryo's in de overdracht capillair. Aanbevolen totaal aantal embryo's dat moet worden overgedragen (eenzijdig of bilateraal): drachtig vrouwtje (≤ 15-16 embryo's), pseudozwanger vrouwtje (≤ 30 embryo's).
- Maak een kleine incisie in het eiduct (tussen het infundibulum en ampulla) met behulp van micro-schaar, en steek de overdracht pipet in het eiduct.
- Verdrijving voorzichtig embryo's en luchtbellen uit de pipet naar het eiduct. Met stompe tangen, plaats het voortplantingskanaal terug in de buikholte.
- Hecht de buikwand aan met polyglycolische zuuropneembare hechtingen en sluit de huidincisie met wondklemmen. Afhankelijk van het aantal beschikbare embryo's herhaalt u deze procedure voor het andere ei- geleider.
- Injecteer het dier intraperitoneally met atipamezool (0,5 mg/kg) om het effect van anesthesie te keren.
- Breng het dier naar een schone kooi en houd het op een opwarmende plaat om volledig te herstellen van anesthesie. Levering bij ratten vindt plaats na ~ 21 dagen.
OPMERKING: Wanneer mannelijke BN-ratten worden gebruikt voor de paring, zijn alleen witte pups potentieel transgeen; bruine pups zijn van natuurlijke zwangerschap. - Verzamel weefselfragmenten (bij voorkeur van het oor) tot genotype 3 weken oude pups.
- Bereid pleegmoeders voor door seksueel volwassen SD-vrouwtjes te paren met vruchtbare BN-mannetjes of met vasectomized SD-mannetjes (de vasectomieprocedure wordt beschreven in punt 3 hieronder) op dag 3 (voor het overbrengen van embryo's in het eencellige stadium) of dag 4 (voor het overbrengen van embryo's in het tweecellige stadium).
3. Vasectomie
LET OP: Vóór de dag van de operatie, autoclave schaar, fijne tangen en naaldhouder.
- Verdoof een 5 weken oude mannelijke SD-rat met bijvoorbeeld toediening van ketamine (50 mg/kg) en medetomidine (0,5 mg/kg) oplossing. Test op reflexen om anesthesie te bevestigen voordat de chirurgische ingreep wordt gestart.
- Toewijsorgasgehalte (2 mg/kg), butorphanoltartraat (1 mg/kg) en enrofloksacin (5-10 mg/kg) onderhuids om respectievelijk ontsteking, pijn en infectie te voorkomen.
- Breng oogheelkundige zalfsmering aan op beide ogen om hoornvliesdrogen te voorkomen. Plaats de rat supine op een schoon oppervlak op een verwarmingskussen, en steriliseren van de huid op de teelballen met chirurgische scrub gevolgd door 70% alcohol met behulp van steriele niet-vasthoudenpads. Laat de huid drogen. Bedek de rat met een steriel gordijn met een klein gaatje dat over de teelballen wordt gesneden. Druk voorzichtig op de buik om de teelballen in de scrotale zak bloot te leggen.
- Met behulp van chirurgische schaar, maak een ~ 0,5 cm incisie in het midden van de scrotale zak. Zoek de middellijnwand (witachtige lijn) tussen de teelballen.
- Maak een incisie van 5 mm in het testismembraan dicht bij de linkerkant van de middenlijnwand.
- Duw de testis voorzichtig naar links en lokalis (tussen de testis en middellijn) als een wit kanaal met een enkel bloedvat.
- Trek voorzichtig de vas deferens uit de scrotale zak met behulp van een watchmaker tang. Houd de vas deferens met een paar tangen, en snijd het met fijne schaar (of cauterize met roodgloeiende uiteinden van een tweede paar tangen). Verwijder een fragment van ~1 cm van het kanaal.
OPMERKING: Als cauterisatie wordt uitgevoerd, houdt u de punt van het tweede paar tangen in de vlam. - Herhaal de bovenstaande procedure voor de andere testis. Hecht de huid aan met polyglycolische zuuropneembare hechtingen en injecteer het dier intraperitoneally met atipamezool (0,5 mg/kg).
- Plaats de rat in een schone kooi op een opwarmende plaat totdat het dier herstelt van anesthesie.
OPMERKING: Mannetjes kunnen worden gebruikt in de testparingen na een herstelperiode van ~ 2 weken. Nadat steriliteit is bevestigd, kunnen ze worden gebruikt voor pseudozwangerschapsinductie.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Met behulp van het hierbeschreven protocol werden lentivirale vectoren die de Syn-TDP-43-eGFP-constructie droegen geproduceerd (fysieke LV-titer = 3,4 x 108/μL) en vervolgens kunnen worden gebruikt voor embryosubzonale injecties in één cel. Alleen embryo's met twee zichtbare pronuclei werden onderworpen aan de procedure. Het aantal injecties met virale suspensies werd experimenteel bepaald. Hoge implantatie-efficiëntie en een gelijktijdig gebrek aan transgene nakomelingen werden beschouwd als indicatoren van een onvoldoende aantal virale deeltjes voor succesvolle transductie. In dit geval werd het aantal injecties verhoogd. De enige toediening van LV resulteerde in de geboorte van 20 F0-generatie ratten, die geen van allen transgeen waren. Een toename van het aantal injecties met één orde van grootte resulteerde niet in de geboorte van ratten, maar 100% van de embryo's ontwikkelde zich tot het tweecellige stadium. In latere experimenten werd het aantal injecties met één verhoogd ten opzichte van de waarde waarvoor de nakomelingen werden verkregen. Voor de variant van twee injecties werden acht ratten geboren, waarvan er drie werden bevestigd om het transgene te dragen (samengevat in tabel 1). Een van de oprichters heeft het transgene niet overgedragen aan nakomelingen. Het aantal embryo's dat in elke experimentele variant werd geïnjecteerd en overgedragen was 48 in de varianten LV x1 en LV x2 en 45 in LV x10. Drie pleegvrouwtjes werden gebruikt voor elke experimentele opstelling. De gekozen aanpak maakte het mogelijk om stabiele transgene rattenlijnen te genereren die het TDP-43-eGFP-fusieeiwit onder controle van de neuronale Synapsen-1-promotor in het hele centrale zenuwstelsel uitdrukten (Figuur 2A,B)14. Lentivirus-gebaseerde transgenese resulteerde in een enkele kopie inbrengen van het transgene zoals aangetoond door qPCR (Figuur 2C).
In de experimentele opstelling die hierboven wordt beschreven, was de overlevingskans van de geïnjecteerde embryo's 95%. Vergelijkbare resultaten werden verkregen toen dezelfde methode werd gebruikt voor andere lentivirale vectoren zoals samengevat in tabel 2. Het percentage embryo's dat de pronucleaire injecties overleefde was aanzienlijk lager (29-45%). Tabel 2 vat de representatieve resultaten van de implantatie-efficiëntie van gemanipuleerde zygotes samen, gezien de overdracht van pseudozwangere versus zwangere vrouwen. Het gebruik van niet-gemanipuleerde embryo's samen met geïnjecteerde embryo's werd eerder gemeld16. Onze algemene resultaten suggereren dat zwangere vrouwelijke ratten kunnen worden gebruikt als pleegmoeders met vergelijkbare efficiëntie. We kregen een vergelijkbaar percentage van implantatie van buitenlandse embryo's bij zwangere en pseudozwangere ratten (algemeen gemiddelde voor verschillende experimentele opstellingen: 15% vs. 16%). De implantatiegraad was echter hoger toen de embryo's een subtielere manipulatie ondergingen, wat een subzonale injectie betekent (10% vs. 21%). Met name de numerieke gegevens die werden geanalyseerd voor individuele rondes van micro-injectie bleek dat de effectiviteit van implantatie afhing van het aantal injecties van een embryo (Tabel 1, laatste kolom) en indirect afhankelijk van virale belasting.
| Vector | aantal injecties/embryo's | aantal geïnjecteerde embryo's | aantal pups | aantal pleegmoeders | aantal transgene oprichters | Implantatie-efficiëntie voor elke variant |
| Syn-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
Tabel 1: Samenvatting van het aantal subzonale injecties van zygoten met Syn-TDP-43WTlentivirale vectoren.
| Methode | Vector | Titer/ Concentratie | Aantal geïnjecteerde embryo's | Overleefde embryo's | Overlevingskans | Aantal pleegmoeders | Aantal pups | Implantatie-efficiëntie | Zwangerschap (P) /Pseudozwangerschap (PP) |
| PNI PNI | TTYH1-Thy1-EGFP | 1 ng/μL | 1083 | 424 | 39% | 16 | 54 | 13% | Pp |
| PNI PNI | H3mCherry H3mCherry | 0,5-2 ng/μL | 2229 | 647 | 29% | 29 | 67 | 10% | Pp |
| PNI PNI | Syn-TDP-43-A315T | 2 ng/μL | 1256 | 562 | 45% | 31 | 42 | 7% | Pp |
| Lv | Syn-TDP-43-A315T | 8,7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | Syn-TDP-43 WT | 3,4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mkers | 1,3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | Pp |
Tabel 2: Embryo overlevingssnelheid en implantatie-efficiëntie, afhankelijk van de gebruikte injectiemethode en zwangerschap versus pseudozwangerschapsinductie. PNI, pronucleaire injectie; LV, lentivirale vector subzonale injectie.

Figuur 1: Microscopische foto van eencellig rattenembryo dat was voorbereid op subzonale lentivirale vectorinjectie. Het embryo werd geïmmobiliseerd met een houdpijp. Twee pronuclei die moederlijk en vaderlijk genetisch materiaal en het polaire lichaam bevatten zijn zichtbaar. Schaalbalk = 20 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
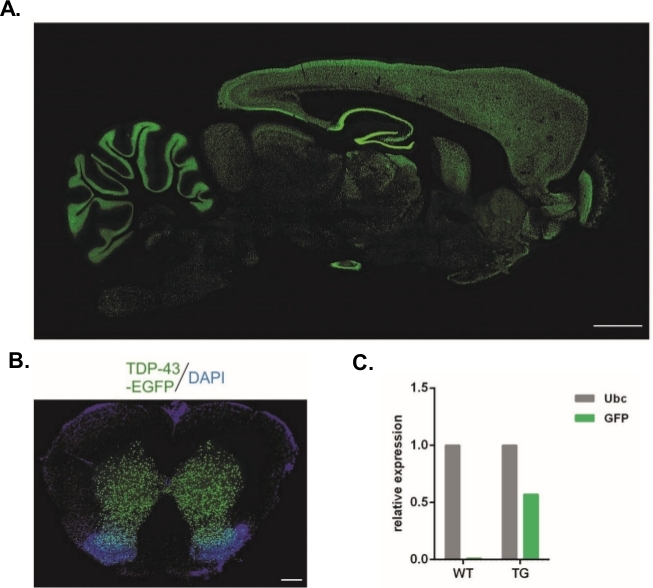
Figuur 2: Generatie van stabiele transgene rattenlijnen die het TDP-43-eGFP-fusieeiwit onder controle van de neuronale Synapsen-1-promotor in het hele centrale zenuwstelsel uitdrukten. (A) Synapsine-1 (Syn)-gedreven hTDP-43-eGFP expressiepatroon in een sagittale sectie van de transgene rat hersenen. Schaalbalk = 3 mm. (B) Coronale sectie van het ruggenmerg van een transgene rat waar eGFP fluorescentie, tegengesteld met DAPI, was beperkt tot grijze stof van het ruggenmerg. Schaalbalk = 250 μm. (C) Relatieve expressie van GFP transgene transcript in vergelijking met de ubiquitine C referentie transcript. n = 2 wildtype. n = 2 transgeen. Het cijfer werd gewijzigd van14. Klik hier om een grotere versie van dit cijfer te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De vooruitgang in transgene technologieën heeft knaagdiermodellen tot een waardevol hulpmiddel in biomedisch onderzoek gemaakt. Ze bieden de mogelijkheid om genotype-fenotype relaties in vivo te bestuderen. Hier presenteren we een breed beschikbaar alternatief voor conventionele transgenese door pronucleaire injecties. Het gebruik van lentivirale gentransductie omzeilt de noodzaak van veeleisende micro-injecties omdat virale vectoren kunnen worden geïnjecteerd onder de zona pellucida. Deze aanpak heeft geen invloed op de embryo-integriteit, wat in wezen een overlevingskans van 100% garandeert voor geïnjecteerde zygotes. Het transgeen dat wordt opgenomen door middel van lentivirale vectoren is stabiel geïntegreerd in het gastheergenoom, waardoor langdurige expressie en kiembaanoverdracht mogelijk zijn. Daarnaast presenteren we twee alternatieve technieken voor gemodificeerde embryotransfer naar pleegmoeders. Een techniek maakt gebruik van embryo-overdracht naar pseudozwangere vrouwtjes die eerder zijn bereid door te paren met vasectomized onvruchtbare mannetjes. De andere techniek is gebaseerd op het gebruik van natuurlijk zwangere vrouwtjes die zijn gepaard met vruchtbare mannetjes, maar met een andere vachtkleur (d.w.z. BN ratten). Dit meer fysiologische verloop van de zwangerschap maakt de juiste ontwikkeling van embryo's die uitdagende genetische modificaties ondergaan16.
De eerste succesvolle pogingen om transgene ratten te genereren werden gemeld in 19907. Vanwege moeilijkheden bij de transgenese van ratten17is er in de afgelopen decennia echter een relatief klein aantal transgene rattenlijnen ontstaan. Verschillende belangrijke verschillen worden waargenomen tussen muis en rat transgenese met behulp van micro-injecties. Voor ratten worden voornamelijk outbred lijnen (bijvoorbeeld Wistar en SD) gebruikt voor transgenese. Voor muizen, onderzoekers gebruiken vooral de F1 kruising van inteelt stammen vanwege hun hogere vruchtbaarheid, betere reactie op hormonale superovulatie, en relatief eenvoudige ontwikkeling van embryo's in vitro van de eencellige fase blastocysten18. De inductie van superovulatie bij ratten is veel minder efficiënt dan bij muizen met behulp van standaard PMSG/ hCG hormoonstimulatie. Om deze reden, pogingen zijn gedaan om alternatieve protocollen te ontwikkelen om deze hormonen te beheren bij ratten die gebruik maken van continue FSH-infusie in plaats van een enkele PMSG administratie19. Echter, superovulatie die wordt veroorzaakt door PMSG/hCG of FSH / hCG is aangetoond dat vergelijkbare efficiëntie20hebben . Naar onze mening is de meest kritische factor die de effectiviteit van superovulatie beïnvloedt de leeftijd van geselecteerde vrouwtjes. Niettemin moeten de exacte parameters worden getest voor elke rattenstam, laboratorium, enz.
De procedure voor het injecteren van DNA-oplossing in de kern van een eencellige embryo is vergelijkbaar voor beide knaagdiersoorten. Echter, de pronuclei van rat zygotes hebben niet zulke regelmatige vormen als bij muizen en hebben de neiging om moeilijker te definiëren in het cytoplasma van de cel. Bovendien zijn het rattenzygotecelmembraan en het pronucleaire membraan elastischer en stroperig, waardoor het inbrengen van een glazen micropipet die is geladen met DNA-oplossing, wordt bemoeilijkt. Deze factoren leiden tot lagere overlevingskansen van ratteneieren na de micro-injectie (31-65% vs. 80% bij muizen) en verklaren de lagere transgeneseefficiëntie bij ratten9. Bovendien kan intensieve, mechanische manipulatie van het embryo ook de implantatie-efficiëntie beïnvloeden, die in veel laboratoria, waaronder de onze, een maximum van 10% bereikt. Deze relatief lage opbrengst wordt waargenomen, zelfs na de implantatie van een passend aantal embryo's21.
Een methode die de bovengenoemde moeilijkheden overwint is de infectie van eencellige embryo's met retrovirussen. Retrovirussen bevatten genetisch materiaal in de vorm van RNA, dat bij binnenkomst in de geïnfecteerde cel wordt omgezet in DNA door omgekeerde transcriptie van het virus. Het DNA wordt vervolgens via de nucleaire poriën getransporteerd naar de celkern, waar het zich integreert in het genoom van de cel in de vorm van een provirus. Lentivirale vectoren zijn gebruikt om transgene muizen en ratten te genereren12,14,22. Eencellige embryo's die geen zona pellucida hebben, kunnen worden geïncubeerd in een oplossing met een lentivirale vector, of de vector kan onder de zona pellucida in de perivitellineruimte worden geïnjecteerd. Het belangrijkste voordeel van deze methode is de extreem hoge efficiëntie, het bereiken van meer dan 80% van de transgene nakomelingen. Na besmetting met de lentivirale vector, kunnen vele exemplaren op verschillende plaatsen in het zygotegenoom, in tegenstelling tot de transgenesemethode door pronucleaire microinjectie integreren, waarin één integratieplaats gewoonlijk12wordt waargenomen. Bij nakomelingen van de transgene stichter die wordt gemaakt met behulp van lentivirale vectoren, worden individuele kopieën van het transgene gescheiden, die zich kunnen manifesteren door verschillende expressieprofielen van het transgeen in elk van de nakomelingen. Dit kan echter de kans op het ontvangen van een onderwerp met het gewenste expressieprofiel dat is afgeleid van het transgene verhogen. De beperkingen gelden voornamelijk voor de grootte van het transgeen, dat beperkt is tot ongeveer 8 kb23.
Een ander probleem in de transgenese van ratten is de generatie van vrouwtjes die dienen als surrogaat moeders voor genetisch gemodificeerde embryo's. In de standaardprocedure worden vrouwtjes gekruist met steriele vasectomized mannetjes om pseudozwangerschap te induceren. Bij ratten is de pseudozwangerschapsbeoordelingstechniek veel moeilijker dan bij muizen, dus stimulatie met de gonadotropine die hormoonagonist vrijgeeft, wordt soms een paar dagen voor de paring met mannetjes gebruikt. Om deze redenen bieden we in het beschreven protocol twee alternatieve benaderingen om pleegmoeders te verkrijgen. De algehele implantatie-efficiëntie van gemanipuleerde zygotes wanneer zwangere of pseudozwangere vrouwtjes worden gebruikt is vergelijkbaar. Echter, de aanwezigheid van natuurlijke, niet-gemanipuleerde embryo's samen met gemanipuleerde embryo's kan het zwangerschapspercentageverbeteren 16. Hoewel het belangrijkste verschil in implantatiesnelheid de manipulatietechniek is (d.w.z. PNI vs. LV, 10% vs. 20%; zie tabel 2),kan het gebruik van pseudozwangere vrouwen als pleegmoeders gunstig zijn voor sommige experimenten.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteur (W.K.) heeft rechten op het octrooi,"Methode voor de productie van een transgeen dier", van het octrooibureau van de Republiek Polen (nr. P 355353; 21.03.2008).
Acknowledgments
Deze studie werd ondersteund door het ANIMOD-project binnen het Team Tech Core Facility Plus-programma van de Foundation for Polish Science, medegefinancierd door de Europese Unie in het kader van het Europees Fonds voor Regionale Ontwikkeling aan WK.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



