Summary
本稿は、ザイゴテのペリビテリン空間へのウイルス懸濁液の複数の注射を用いたラット胚におけるレンチウイルストランスジェネシスの方法論を提供することを目的とする。異なる支配的な毛皮の色を持つ肥沃な男性株と交配される雌ラットは、偽妊娠の里親を生成するために使用されます。
Abstract
トランスジェニック動物モデルは、現代の生物医学研究にとって基本的に重要です。初期のマウスまたはラット胚への外来遺伝子の組み込みは、生物における遺伝子機能解析にとって非常に貴重なツールです。標準的な遺伝子導入法は、受精卵母細胞の原核に外来DNA断片をマイクロ注入することに基づいている。この技術はマウスで広く使用されていますが、他の動物種では比較的非効率的で技術的に要求が厳しいままです。この遺伝子は、レンチウイルス感染を介して1細胞段階の胚に導入することもできるので、特により困難な胚構造を有する種または株において、標準的な前核注射に代わる効果的な代替手段を提供する。このアプローチでは、レンチウイルスベクターを含む懸濁液を受精ラット胚の腹腔内空間に注入し、技術的に要求が少なく、成功率が高い。レンチウイルスベクターは、トランス遺伝子をゲノムに効率的に組み込み、安定なトランスジェニックラインの生成を決定することが示された。いくつかの制限(例えば、バイオセーフティレベル2要件、DNA断片サイズ制限)にもかかわらず、レンチウイルストランスジェネシスは迅速かつ効率的なトランスジェネシス法である。さらに、異なる支配的な毛皮の色を有する肥沃な男性株と交配される雌ラットを使用して、偽妊娠の里親を生成する代わりとして提示される。
Introduction
長年にわたり、ラットやマウスなどの実験室のげっ歯類は、ヒトの生理学的および病理学的状態をモデル化するために使用されてきました。動物研究は、他の手段では達成できなかった発見につながっています。当初、遺伝学的研究は、人間の状態を密接に模倣すると考えられている自然発生障害および型の解析に焦点を当てた1.遺伝子工学的手法の開発により、特定の遺伝子の導入または欠失が望ましい表現型を得ることが可能となった。そのため、遺伝子導入動物の生成は、生物における遺伝子機能の研究を可能にする現代研究の基礎技術として認識されている。
遺伝子導入動物技術は、実験発生学と分子生物学の成果を組み合わせて可能になりました。1960年代、ポーランドの発生学者A.K.タルコフスキは、開発初期段階におけるマウス胚操作に関する最初の研究を発表した。さらに、分子生物学者は、動物のゲノムに外来DNAを導入するためのDNAベクター(すなわち、キャリア)を生成する技術を開発した。これらのベクターは、選択した遺伝子の伝播と、実施される研究の種類に応じて、それらの適切な修飾を可能にします。「トランスジェニック動物」という用語は、ゴードンとラドル3によって導入された。
神経生物学、生理学、薬理学、毒物学、および生物医学と医学の他の多くの分野で使用された最初の広く受け入れられた種は、ノルウェーラット、ラトゥスノルベギカス4でした。しかし、ラット胚の操作が困難であるため、家のマウスの筋肉は、遺伝子研究5で支配的な動物種となっています。このような研究におけるマウスの優位性のもう一つの理由は、この種のノックアウト動物を生成する胚性幹細胞技術の利用可能性であった。トランスジェネシスの最も一般的に使用される技術(生まれたすべての動物に対するトランスジェニック子孫の2〜10%)は、受精卵母細胞の前核へのDNA断片のマイクロインジェクションです。1990年、マウスで初めて導入されたこのアプローチは、ラット66,77に適応した。前核注入によるラットトランスジェネシスは、マウスと比較して効率8が低いことを特徴とし、これは弾性プラズマおよび前核膜9の存在に厳密に関連している。操作後の胚の生存率はマウスより40〜50%低いが、この技術は遺伝子組み換えラット10の生成における標準と考えられている。効率的な導入遺伝子導入と注入された接合の高い生存率を保証できる代替アプローチが検討されている。
安定したトランスジーン発現と子孫への伝達の重要な決定要因は、宿主細胞ゲノムへの統合である。レンチウイルス(LV)は、分裂細胞と非分裂細胞の両方に感染することができるという特徴があります。異種遺伝子を胚に組み込むツールとしての使用は、高効率の11であることが判明し、トランスジェニック個体は、組み込まれたDNA断片の安定な発現によって特徴付けられる。レンチウイルスベクター,の有効性は、マウス12、13、ラット12、14、および他の,13種11の遺伝子改変について確認されている。14この方法では、LV懸濁液は、2つの前核の段階で胚の透明帯下に注入される。この技術は、オイレンマが影響を受けないので、本質的に胚の100%生存を保証する。高品質で比較的集中度の高いLVサスペンションの製造は、重要な要素です。しかし、LV懸濁液の低濃度は、繰り返し注射11によって克服することができ、これは膜の集積に影響を与えずに卵表面でのウイルス粒子の量を増加させる。膜領域への反復注射を受けた胚はさらに発達し、トランスジェニック子孫は生殖細胞系列を介してトランスジーンを伝達することができる。レンチウイルストランスジェネシスによるトランスジェニックラット生成の効率は、80%12までも12高くすることができる。
ここでは、HIV-1由来組換えレンチウイルスの産生について、胞性口内炎ウイルス(VSV)Gエンベロープタンパク質を擬似タイプ型にした。第二世代のパッケージングシステムVSV疑似型の使用は、ウイルス粒子の広い感染性を決定し、超遠心分離および凍結保存によって濃縮することができる非常に安定したベクターの生産を可能にする。滴下検証後、ベクターはアルビノウィスターラットジゴテへのトランスジーンデリバリーの車両として使用する準備ができています。一連の注射の後、胚は一晩培養され、母親を育てるために2細胞段階で移すことができる。この時点で、2 つの代替アプローチのいずれかを検討できます。標準的な手順は、胎児のレシピエントとして疑似妊娠女性を利用する。しかし、精管切除された男性と交配した後に妊娠率が低い場合、胚は、暗い毛皮の色を有する肥沃な雄ラット(例えば、ブラウンノルウェー[BN]ラット)と交配している妊娠中のウィスター/スプレイグ・ドーリー(SD)メスに移植することができる。毛皮の色は、移された操作された胚に由来する子孫から自然妊娠からの子孫の区別を可能にする。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
ウイルスベクターの生産と適用は、バイオセーフティレベル2ガイドラインに従い、ポーランド環境省によって承認されました。以下に記載されているすべての実験動物の手順は、地方倫理委員会によって承認されました。動物は安定した温度(21-23 °C)および湿気(50-60%)で個別に換気されたケージに収容された12時間/12時間の明暗サイクルの下で水と食べ物へのアドリビタムアクセスで。
1. レンチウイルスベクターの生産
- HEK 293T細胞のトランスフェクション
注:本明細書で提示されるプロトコルは粗ベクトル上清の約200 mLを作り出す20 Ø10 cmの培養皿のトランスフェクションのために設計されている。- 37°Cで加湿CO2インキュベーター中にウシ胎児血清(10%、v/v)を添加したDMEM培地中のHEK293T細胞を培養する。トランスフェクションの場合は、直径20枚のプレートを10 cm、皿1皿あたり1.5~2 x 106 HEK 293Tセルを作ります。
- 合流度が70%に達すると、ポリエチレンアミン(PEI)試薬を用いて細胞をトランスフェクトし、pH 7.0、DNA1μg当たりPEIの3μgの割合で。
- トランスフェクション混合物を5皿用に準備します(皿の総数に応じて繰り返し回数を準備してください)。Dulbeccoの修飾イーグル培地(DMEM;血清なし)の1mLに、3つのプラスミドの混合物を加えて、VSVgプラスミドの最終量25μg、デルタR8.2の50 μg、および50 μgのコーディングプラスミドに達します。
- ピペットを上下に、3 μg/μLの濃度で125μLのPEIを加え、室温で15分間インキュベートし、インキュベーション中にチューブを3回反転させます。プレートごとにトランスフェクション混合物を200 μL加えます。次に、37°Cで加湿したCO2インキュベーターにプレートをインキュベートする。
- レンチウイルスベクターの濃度
- トランスフェクション後48時間、LV粒子を含む培地を収穫する。50 mL円錐形チューブを使用してください。
注:蛍光タグ付きのプラスミドを使用する場合、この時点で細胞を可視化してトランスフェクション効率を検証できます。DMEM培地の新しい部分を加えることができ、そして細胞は、さらに24時間インキュベートされてもよい。LV収率は、トランスフェクション後の48および72時間の時点で収集した場合に比較可能です。 - 5分間3,000xgで遠心分離gし、室温で分離した細胞を除去する。
- 上清(0.45 μm)をフィルターし、新しいチューブに注ぎます。
注: この手順は省略できます。 - DNase I(RNaseフリー、1 μg/mL)とMgCl2(1mM)を加え、37°Cの水浴中で15分間インキュベートします。2
- 培地を使い捨てのポリエチレンチューブに移し、115,000 x gでスイングローターに超遠心分離機を1.5時間移動します。
- 遠心分離後、チューブの壁を媒体の残留物から静かに排出します。
- ペレットに無菌リン酸緩衝生理食塩分(PBS;1管当たり70~80 μL)を浸します。
- 4~8 °Cで2時間インキュベートします。
- 穏やかなピペットによってPBSのウイルスベクターを再中断する。
注意:発泡を避けてください。 - 1.5 mL遠心分離管と遠心分離機を7,000 x gで、4 °Cで30sに移し、上清を新しいチューブに移します。細胞破片ペレットが見えなくなるまで、このステップを繰り返します。
- アリコートと -80 °Cで凍結します。LVアリコートを再凍結することは避けてください。
- トランスフェクション後48時間、LV粒子を含む培地を収穫する。50 mL円錐形チューブを使用してください。
- 定量ポリメラーゼ連鎖反応によるウイルス力の定量
注: ウイルスベクターの滴定は定量PCR(qPCR)を使用して行われます。この方法は、ウイルスゲノム15の長末端リピート領域内で長いDNA断片を84bp長鎖で増幅することに基づいている。- LVコードプラスミドの連続希釈を行って標準曲線を作成します:1:500、1:1,000、1:5,000、1:10,000、1:100,000、および1:1,000,000。標準曲線に使用されるプラスミドのコピー数を決定します。次の式を使用してください: コピー数/μL = (濃度 [g/μL] x 6.02 x 1023 [数/モル]) / (660 [g/mol] x プラスミドサイズ [bp]), 6.02 x 1023数/モルは、アボガドロの数であり、660 g/molはbp重量です。
注: オンラインコピー番号計算機を使用することができます。 - レンチウイルス懸濁液の希釈液を調製する:1:100、1:500、および1:1,000。
- 反応混合物(ウェルあたりの体積)を調製する:qPCRマスターミックス10 μL、10 μMフォワードプライマーの1 μL、10 μMリバースプライマーの1 μL、および7 μLのH2O.ピペット混合物を96ウェルプレートのウェルに入れます。
注:フォワードプライマー:5'-AGCTTGCCTTGAGTGCTTCA。リバースプライマー:5'-TACTAAAAAGGGTGAGGGGgA。 - 各標準的な希釈液とレンチウイルス懸濁液を三重に1μL加えます。
- qPCRは、2分間50°C、5分間96°C、96°Cの35サイクル(20s)、60°C(40s)、1分間の70°C、メルトカーブステージ:95°C(1分、30°C)に従って実行します。
- 各希釈に対して受け取った分子の数を標準曲線と比較して、結果を分析します。各希釈に対する3つの反復の平均としてベクター分子の濃度を決定する。
注:提示された定量化は、ウイルス粒子の物理的な濃度を与える。機能性の高い機能として扱うべきではありません。
- LVコードプラスミドの連続希釈を行って標準曲線を作成します:1:500、1:1,000、1:5,000、1:10,000、1:100,000、および1:1,000,000。標準曲線に使用されるプラスミドのコピー数を決定します。次の式を使用してください: コピー数/μL = (濃度 [g/μL] x 6.02 x 1023 [数/モル]) / (660 [g/mol] x プラスミドサイズ [bp]), 6.02 x 1023数/モルは、アボガドロの数であり、660 g/molはbp重量です。
2. トランスジェニックラットの生成
- 受精胚の超排卵と採取
- 性腺刺激ホルモンを投与する。
注:採取した胚の数を増やすには(女性1人あたり約30個)、ホルモン刺激には未熟な5週齢のウィスターメスを使用してください。- 1日目(午後12時~午後1時)に、腹腔内に妊娠中の雌の血清性性性性性腺刺激ホルモン(PMSG;女性1人あたり25 IU)を注射する。0.9%NaClでホルモン粉末を溶解することにより、125 IU /mLの濃度で作業溶液の1 mLアリコートを調製します。-20 °Cで最大1ヶ月間、または-80°Cで6ヶ月間保管してください。
- 3日目(午後12時~午後1時)に、腹腔内にヒト絨毛性ゴナドトロフィン(hCG;女性1人あたり30 IU)を注入する。0.9%NaClでホルモン粉末を溶解することにより、1 mLの作業溶液(150 IU /mL)を調製します。-20 °Cで最大1ヶ月間、または-80°Cで6ヶ月間保管してください。
- hCG投与後、女性は1:1に性的に肥沃な男性(生後3~10ヶ月)と交尾する。
- 翌朝(4日目午前8時~10時)、女性に膣プラグがないか確認します。最高の視覚化のための最良の視覚化は、交配の夜の後に早朝にチェックする必要があり、白っぽい交配プラグの存在のために膣の開口部をチェックしてください。胚の収集には、可視プラグを持つメスのみを使用してください。
- 午前10時に胚を収集します。動物を犠牲にして排卵物を切除し、事前に温めたM2培地で排卵物を皿に集めます。
- 牛の精巣からヒアルロニダーゼを含む35mmのM2培地を含む35mmの皿に排卵物を0.5mg/mLの濃度で移します。
- 天体顕微鏡下で微細な鉗子を使用して卵管の壁を開き、胚が解放されるまでアンペア(すなわち、乳雲細胞に囲まれた受精胚を含む卵性の腫れた部分)を押す。
注:ヒアルロンダイダーゼは、胚を放出し、cumulus細胞を酵素的に消化します。
注意: ヒアルロンジダーゼへの長期暴露は胚に有害である;したがって、このステップは5分以上続くはずです。 - 積雲細胞からの胚の放出を容易にするために、口で作動させた吸引管に接続されるガラス転写ピペットを使用して、それらを上下に穏やかにピペット化する。
- 転写ピペットを製造するには、グラスパスツールピペットを火炎の上に引っ張り、ストレート〜5〜10cmの先端を作り出します。約4cmの先端を残してピペットを割ります。
- 胚をM2培地で数回洗浄し、ヒアルロンジーゼおよび細胞の破片を除去する。液体パラフィンまたはミネラルオイルで覆われた平衡化されたM16培地の(約50μL)滴を含む60mmの皿に、5%CO2雰囲気の加湿された37°Cインキュベーターに胚を移す。2
- 性腺刺激ホルモンを投与する。
- 透明帯下の1細胞期胚へのレンチウイルスベクターのマイクロインジェクション
メモ:マイクロインジェクションには、2つの目に見える前核を持つ1細胞段の胚を使用してください(図1)。- LVアリコートを室温で解凍し、遠心分離機を10,000 x gで2分間解凍し、残りの細胞デブリをペレットにします。
- マイクロインジェクションのセットアップ
- マイクロフォージを使用してピペット(ホウケイ酸ガラスキャピラリー)を保持するガラスを準備します。ガラスの毛管を炎の上に引っ張って、5〜10 cmの先端を作り出します。約4cmの先端を残してピペットを割ります。外径は~80~120μmです。
注:ピペットチップが完全にまっすぐで滑らかであることを確認してください。 - 引っ張られたピペットをマイクロフォージに、加熱フィラメントの前に先端を付けて組み立てます。フィラメントをピペットチップに非常に近く加熱し、直径約15μm(胚サイズの約20%)まで縮小させます。ピペットを加熱フィラメントに垂直に、ピペットチップから2~3mm離して熱を出します。ガラスが柔らかくなります。15°の角度になるまで加熱します。
- ピペットプーラーを使用してフィラメントでマイクロインジェクションホウケイ酸ガラス毛細血管を準備します。引っ張る部屋に毛管を挿入します。ランプテストを実行します(新しいガラスのために初めて、フィラメントを変更した後、毎回)。[熱]をランプ値-10に、プルを100に、速度を150に、時間を100に設定します。
注: 最適な射出毛管を得るためにパラメータを変更します。 - バイオセーフティラミナーフローフードの下で、マイクロローダーチップを用いて約2μLのウイルス溶液をマイクロインジェクションピペットにロードします。
- 液体パラフィンまたはミネラルオイルで覆われたM2培地(中央)の100 μLドロップでマイクロインジェクション皿(60mmペトリ皿の蓋)を準備します。
- ウイルス溶液を装填した保持ピペットとマイクロインジェクション毛細管を、逆顕微鏡下でマイクロマニピュレーターとマイクロインジェクション皿に取り付けます。
- マイクロフォージを使用してピペット(ホウケイ酸ガラスキャピラリー)を保持するガラスを準備します。ガラスの毛管を炎の上に引っ張って、5〜10 cmの先端を作り出します。約4cmの先端を残してピペットを割ります。外径は~80~120μmです。
- マイクロインジェクションを行います。
- マイクロインジェクション皿のM2ドロップに15〜20個の1細胞段階の胚を移す。保持ピペットを使用して胚を保持します。
- 400x倍率を使用して、自動インジェクターに接続されているガラスキャピラリーを使用して、透明帯下のLV溶液をペリビテリン空間に注入します。帯内透明帯の下に毛細血管を少し持ち続けなさい。
注:穏やかな正圧を使用して、ウイルス溶液は注入毛細血管から連続的に流れ出るが、送達される懸濁液の容積は制御できない。 - 微細なピペットを用いて、5%CO2雰囲気中の37°Cで培養器内の培養皿に胚を戻2す。1つのザイゴテの注射の数は変化し、ウイルスベクター濃度に基づいて適応することができる。
注:注入された胚は、2細胞段階で移管される前に、1細胞段階で里親に移管するか、M16培地でO/Nをインキュベートすることができます。ラット胚の長期のインビトロ培養は避けるべきである。
- 母親を育てる注射胚の移入
- 肥沃なBN男性または精管切除されたSD男性(精管切除手順は後述のセクション3)を3日目(1細胞段階で胚を移す場合)または4日目(2細胞段階で胚を移す場合)で性的に成熟したSDメスを交配して里親を準備する。
注:卵管の転送のために、0.5日後のコイタム(dpc)女性を使用してください。 - 翌朝、SDメスの膣プラグをチェックし、目に見えるプラグを持つものだけを使用してください。
- 胚移植を行う。
メモ:立体顕微鏡で滅菌器具を使用して手術を行ってください。手術の日の前に、オートクレーブはさみ、細かい鉗子、針のホールダー、およびメスのホールダー。- ケタミン(50mg/kg)およびメデトミジン(0.5mg/kg)溶液のi.p.投与で女性を麻酔する。手術を開始する前に、麻酔を確認するために反射神経をテストします。
- 動物をトレフェナミック酸(2mg/kg)、ブトルファンノール酒引酸(1mg/kg)、エンロフロクサシン(5〜10mg/kg)で皮下に注射し、それぞれ炎症、痛み、感染を防ぎます。
- 角膜乾燥を防ぐために、両眼に眼科軟膏潤滑を適用します。後ろから毛皮を剃り、外科用スクラブで皮膚を殺菌し、続いて無菌非付着パッドを使用してアルコールを70%アルコール化する。皮膚を乾燥させます。
- 切開部位に0.25%ブピバカイン(局所麻酔薬)の100 μLで皮下に注入します。手術顕微鏡の目的の下で加熱パッド上のきれいな表面に起こりやすい位置に動物を移す。下背部に小さな穴を開けて、無菌ドレープでラットを覆います。
- 腰椎柱に平行に約2cmの皮膚切開を行う。
- 鋭利なはさみを使って、腹壁に切り傷をつけます。鉗子を使用して卵巣脂肪パッドをつかみ、卵巣と卵化管を引き出し、0.9%NaClで濡れたガーゼの上に置きます。
- 吸引M2培地、空気の3つの気泡、および胚を転写毛細管に入れた。移送される胚の推奨総数(一方的または両側性):妊娠中の女性(≤15-16胚)、疑似妊娠女性(≤30胚)。
- マイクロハサミを使用して卵管(インファンディブラムとアンプラの間)に小さな切開を行い、卵管に移管ピペットを挿入します。
- ピペットから卵管に胚と気泡を静かに排出します。鈍い鉗子で、生殖管を腹腔に戻す。
- ポリグリコール酸吸収性縫合糸で腹壁を縫合し、創傷クリップで皮膚切開を閉じます。利用可能な胚の数に応じて、他の卵管に対してこの手順を繰り返します。
- 動物の腹腔内に、アトピテゾール(0.5mg/kg)を注入して麻酔の効果を逆転させます。
- きれいなケージに動物を移し、完全に麻酔から回復するために、温めのプレートの上に保管してください。ラットでの送達は~21日後に起こる。
注:オスのBNラットが交配に使用される場合、白い子犬だけがトランスジェニックである可能性があります。茶色の子犬は自然妊娠からです。 - 組織断片(好ましくは耳から)を遺伝子型3週齢の子犬に収集する。
- 肥沃なBN男性または精管切除されたSD男性(精管切除手順は後述のセクション3)を3日目(1細胞段階で胚を移す場合)または4日目(2細胞段階で胚を移す場合)で性的に成熟したSDメスを交配して里親を準備する。
3. 精管切除術
注意:手術の日の前に、オートクレーブはさみ、細かい鉗子および針のホールダー。
- ケタミン(50mg/kg)およびメデトミジン(0.5mg/kg)溶液のi.p.投与で5週齢の雄SDラットを麻酔する。手術を開始する前に、麻酔を確認するために反射神経をテストします。
- トルフェナミン酸(2mg/kg)、ブトルファノール酒を1mg/kg、エンロフロクサシン(5~10mg/kg)を皮下に投与し、炎症、痛み、感染を予防します。
- 角膜乾燥を防ぐために、両眼に眼科軟膏潤滑を適用します。ラットのスパインを加熱パッドのきれいな表面に置き、外科用スクラブで精巣の皮膚を殺菌し、続いて無菌非接着パッドを使用して70%アルコールを殺菌する。皮膚を乾燥させます。精巣の上に小さな穴を開けて無菌ドレープでラットを覆います。腹部を軽く押して、陰嚢嚢の精巣を露出させる。
- 手術用ハサミを使用して、陰嚢嚢の真ん中に〜0.5cmの切開を行います。精巣の間の正中線の壁(白線)を見つけます。
- 正中壁の左側に近い精巣膜に5mmの切開を行います。
- 慎重に精巣を左に押し、単一の血管を持つ白い管として(精巣と正線の間)精管を見つけます。
- 時計職人の鉗子を使用して、陰嚢嚢からゆっくりと精管を引き出します。1組の鉗子で精管を保持し、細かいはさみでそれをカットします(または鉗子の2番目のペアの赤熱の先端で焼灼します)。ダクトの1cmの破片を取り除きます。
注:焼灼が行われる場合は、2番目の鉗子の先端を炎に入れなさい。 - 他のテストで上記の手順を繰り返します。ポリグリコール酸吸収性縫合糸で皮膚を縫合し、動物を腹腔内にアティパメゾール(0.5mg/kg)で注入する。
- 動物が麻酔から回復するまで、ラットを温め皿の上のきれいなケージに入れます。
注:オスは、〜2週間の回復期間後にテストの交配で使用することができます。無菌性が確認された後、それらは偽妊娠誘導に使用することができる。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
本明細書に記載のプロトコルを用いて、Syn-TDP-43-eGFP構築物を運んだレンチウイルスベクターが産生され(物理LV力計=3.48x 10 8/μL)、次いで1細胞段胚下天注射に使用することができた。2つの目に見える前核を有する胚のみが処置に供された。ウイルス懸濁液の注射回数を実験的に決定した。高い移植効率とトランスジェニック子孫の同時欠如は、成功したトランスダクションのためのウイルス粒子の不十分な数の指標と考えられていた。この場合、注射数が増加した。LVの単一投与は20匹のF0生成ラットの誕生をもたらし、いずれもトランスジェニックではなかった。注射回数が1桁増加してもラットの誕生は見えなかったが、2細胞段階に発達した胚の100%であった。その後の実験では、注射数が、子孫が得られた値と比較して1つ増加した。2回の注射の変異体について、8匹のラットが生まれ、そのうちの3匹がトランスジーンを運ぶことが確認された(表1にまとめ)。創設者の一人は、トランスジーンを子孫に移しませんでした。各実験変異体で注入され、移された胚の数は、LV x1およびLV x2のバリアントで48、LVx10で45であった。実験の各セットアップには3人の里親女性が使用された。選択されたアプローチにより、中枢神経系全体にわたってニューロンシナプシン-1プロモーターの制御下でTDP-43-eGFP融合タンパク質を発現する安定したトランスジェニックラット株の生成が可能となった(図2A,B)14。14レンチウイルス系トランスジェネシスは、qPCRで示されるようにトランスジーンの単一コピー挿入をもたらした(図2C)。
上記の実験セットアップでは、注入された胚の生存率は95%であった。同様の結果は、表2に要約した他のレンチウイルスベクターに対しても同様の方法を用いた場合に得られた。前核注射を生き延びた胚の割合は有意に低かった(29-45%)。表2は、擬似妊娠女性と妊娠女性の移送を考慮して、操作された接合体の移植効率の代表結果を要約する。注入された胚と共に非操作胚の使用は、以前に報告された16.我々の全体的な結果は、妊娠中の雌ラットが同等の効率で里親として使用できることを示唆している。我々は、妊娠中および疑似妊娠ラットにおける外来胚の移植の同様の割合を得た(いくつかの実験設定の全体的な平均:15%対16%)。しかし、胚がより微妙な操作を受けたときの移植率は高く、これはサブゾーナル注射(10%対21%)を意味する。特に、マイクロインジェクションの個々のラウンドについて分析された数値データは、移植の有効性が1つの胚(表1、最終カラム)の注射の数に依存し、間接的にウイルス負荷に依存することを示した。
| ベクトル | 注射/胚の数 | 注入された胚の数 | 子犬の数 | 里親の数 | トランスジェニック創業者の数 | 各変形のための注入の効率 |
| シン・TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
表1:Syn-TDP-43 WTレンチウイルスベクターを用いたザイゴトのサブゾーナル注射数WTの概要
| メソッド | ベクトル | ティター/濃度 | 注入された胚の数 | 生き残った胚 | 生存率 | 里親の数 | 子犬の数 | 移植効率 | 妊娠(P)/偽妊娠(PP) |
| PNI | TTYH1-ティア1-エグFP | 1 ng/μL | 1083 | 424 | 39% | 16 | 54 | 13% | 頁 |
| PNI | H3mチェリー | 0.5-2 ng/μL | 2229 | 647 | 29% | 29 | 67 | 10% | 頁 |
| PNI | シン・TDP-43-A315T | 2 ng/μL | 1256 | 562 | 45% | 31 | 42 | 7% | 頁 |
| Lv | シン・TDP-43-A315T | 8.7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | シン・TDP-43 WT | 3.4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mcherry | 1.3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | 頁 |
表2:胚生存率および移植効率は、使用された注射方法および妊娠対偽妊娠誘導に依存する。PNI, 前核注射;LV、レンチウイルスベクターサブゾナル注射。

図1:下腹レンチウイルスベクター注射のために調製した1細胞期ラット胚の顕微鏡写真。胚を保持ピペットで固定化した。母体と父方の遺伝物質と極体を含む2つの前核が見える。スケールバー= 20 μmこの図の大きなバージョンを表示するには、ここをクリックしてください。
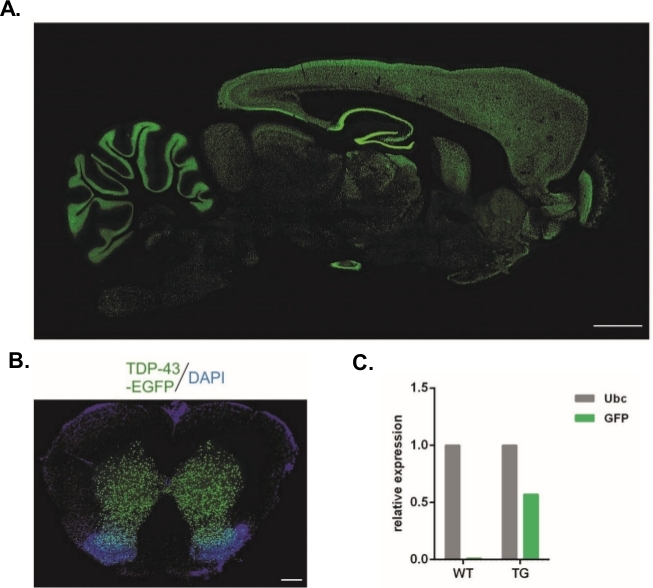
図2:中枢神経系全体にわたって神経シナプシン-1プロモーターの制御下でTDP-43-eGFP融合タンパク質を発現した安定なトランスジェニックラット株の生成。(A) トランスジェニックラット脳の矢状部におけるシナプシン-1(Syn)駆動hTDP-43-eGFP発現パターンスケールバー=3mm(B)トランスジェニックラットの脊髄のコロナ部は、eGFP蛍光は、DAPIで対抗し、脊髄の灰色物質に制限された。スケールバー= 250 μm。(C) ユビキチンC参照転写産物と比較したGFPトランスジーン転写産物の相対的発現n = 2ワイルドタイプ。n = 2 トランスジェニック。図は14から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
トランスジェニック技術の進歩により、げっ歯類モデルは生物医学研究において非常に貴重なツールとなっています。彼らは、生体内で遺伝子型-表現型の関係を研究する機会を提供する。ここでは、プロ核注射による従来のトランスジェネシスに対して広く利用可能な代替手段を提示する。レンチウイルス遺伝子導入の使用は、ウイルスベクターを透明帯下に注入することができるので、要求の多いマイクロインジェクションの必要性をバイパスする。このアプローチは、本質的に注入された接合体の100%の生存率を保証する胚の完全性に影響を与えません。レンチウイルスベクターによって組み込まれる導入遺伝子は、宿主ゲノムに安定的に組み込まれ、長期発現および生殖細胞系列伝達を可能にする。さらに、里親に対する改変胚移植のための2つの代替技術を提示する。1つの技術は、精管切除された不妊の男性と交配することによって以前に調製された偽妊娠女性への胚移植を利用する。もう一つの技術は、肥沃な男性と交配しているが、異なる毛皮の色(すなわち、BNラット)と交配される自然妊娠女性の使用に基づいている。妊娠のこのより生理学的なコースは、挑戦的な遺伝子改変を受ける胚の適切な発達を可能にする16.
トランスジェニックラットを生成する最初の成功した試みは、1990年7月に報告されました。しかし、ラットトランスジェネシス17の困難のために、比較的少数のトランスジェニックラット株が最近数十年で生成されている9.マイクロインジェクションを用いたマウスとラットの遺伝子導入には、いくつかの主な違いが認められる。ラットの場合、主に外交系(例えば、WistarおよびSD)がトランスジェネシスに使用される。マウスの場合、研究者は主に、その高い生殖能力、ホルモン超ovulationに対するより良い応答、および1細胞段階から胚盤胞18へのインビトロにおける胚の比較的容易な発達のために、近血株のF1交配を使用する。ラットの超排卵の誘導は、標準的なPMSG /hCGホルモン刺激を用いたマウスに比べてはるかに効率が悪い。このため、単一のPMSG投与の代わりに連続的なFSH注入を利用するラットにおいてこれらのホルモンを投与する代替プロトコルを開発する試みがなされてきた19。しかし、PMSG/hCGまたはFSH/hCGによって引き起こされる超排卵は、同等の効率20を有することが示されている。我々の意見では、超排卵の有効性に影響を与える最も重要な要因は、選択された女性の年齢である。それにもかかわらず、正確なパラメータは、ラット株、実験室など、各ラット株についてテストする必要があります。
単細胞胚の前核にDNA溶液を注入する手順は、両方のげっ歯類種に似ています。しかし、ラットジゴの原核は、マウスのような規則的な形状を有しておらず、細胞の細胞質で定義することがより困難である傾向がある。さらに、ラットのジゴテ細胞膜と前核膜はより弾性で粘性があり、DNA溶液を装填したガラスマイクロピペットの挿入を複雑にする。これらの因子は、マイクロインジェクション後のラット卵生存率の低下(マウスでは31~65%対80%)を招き、ラット9の転生効率の低下を説明する。さらに、胚の集中的な機械的操作は、私たちをはじめとする多くの研究室で最大10%に達する着床効率にも影響を与える可能性があります。この比較的低い収率は、適切な数の胚21の移植後も観察される。
前述の困難を克服する方法の1つは、レトロウイルスによる単細胞胚の感染である。レトロウイルスにはRNAの形で遺伝物質が含まれており、感染した細胞に入るとウイルスの逆転写酵素によってDNAに転写される。その後、DNAは核の細孔を通って細胞核に運ばれ、そこでプロウイルスの形で細胞のゲノムに統合される。レンチウイルスベクターは、トランスジェニックマウスおよびラット12、14、22,14,22を生成するために使用されてきた。透明帯を欠いた単細胞胚は、レンチウイルスベクターを有する溶液中でインキュベートすることができ、またはベクターを透明帯下でペリビテリン空間に注入することができる。この方法の主な利点は、トランスジェニック子孫の80%以上に達する非常に高い効率です。レンチウイルスベクターによる感染後、異なる部位の多くのコピーがザイゴテゲノムに統合され得るが、プロ核マイクロインジェクションによるトランスジェネシス法とは対照的に、1つの集積部位が通常12に観察される。レンチウイルスベクターを用いて作られたトランスジェニック創業者の子孫では、トランス遺伝子の個々のコピーが分離され、これは各子孫におけるトランスジーンの異なる発現プロファイルによって現れる可能性がある。しかし、これにより、トランスジーンから派生した目的の発現プロファイルを持つ被検体を受け取る機会が増える可能性があります。制限は主にトランスジーンのサイズに適用され、約8 kb23に制限されています。
ラットの遺伝子導入のもう一つの困難は、遺伝子組み換え胚の代理母として機能する女性の生成である。標準的な手順では、女性は偽妊娠を誘発するために生殖不能精管切除された男性と交差する。ラットでは、擬似妊娠評価技術はマウスよりもはるかに困難であるため、男性と交配する数日前に性腺刺激ホルモン放出ホルモンアゴニストによる刺激が使用されることもある。これらの理由から、記載されたプロトコルでは、里親を得るための2つの代替アプローチを提供しています。妊娠中または疑似妊娠女性が使用される場合の操作された接合体の全体的な移植効率は類似している。しかし、操作されたものと一緒に自然で操作されていない胚の存在は、妊娠率16を改善することができる。移植速度の主な違いは、操作技術(すなわち、PNI対LV、10%対20%、表2参照)であるが、母親の養生者としての疑似妊娠女性の使用は、いくつかの実験に有益である可能性がある。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者(W.K.)は、ポーランド共和国の特許庁(No. P 355353;21.03.2008)から特許「トランスジェニック動物の製造方法」に対する権利を有する。
Acknowledgments
この研究は、ポーランド科学財団のチームテックコアファシリティプラスプログラム内のANIMODプロジェクトによって支援され、欧州連合(EU)がWKに対して欧州地域開発基金の下で共同出資しました。
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



