Summary
Эта статья направлена на обеспечение методологии лентивирусного трансгенеза в эмбрионах крыс с помощью нескольких инъекций вирусной подвески в пространство зигота перивителлина. Самки крыс, которые спариваются с плодородной мужской деформации с различным доминирующим цветом меха используется для создания псевдобеременных приемных матерей.
Abstract
Трансгенные модели животных принципиально важны для современных биомедицинских исследований. Включение иностранных генов в ранние эмбрионы мыши или крыс является бесценным инструментом для анализа функций генов в живых организмах. Стандартный метод трансгенеза основан на микроинъекционном фрагментах чужеродных фрагментов ДНК в пронуклеус оплодотворенных яйцеклеток. Этот метод широко используется у мышей, но остается относительно неэффективным и технически требовательным в других видах животных. Трансген также может быть введен в одноклеточные эмбрионы через лентивирусную инфекцию, обеспечивая эффективную альтернативу стандартным проядерным инъекциям, особенно у видов или штаммов с более сложной структурой эмбриона. При таком подходе подвеска, содержащая лентивирусные векторы, вводится в перивительное пространство оплодотворенного эмбриона крысы, которое технически менее требовательно и имеет более высокий показатель успеха. Было показано, что лентивирусные векторы эффективно включают трансген в геном для определения генерации стабильных трансгенных линий. Несмотря на некоторые ограничения (например, требования уровня биобезопасности 2, ограничения размера фрагментов ДНК), лентивирусный трансгенез является быстрым и эффективным методом трансгенеза. Дополнительно, использование женских крыс которые сопрягаты с плодородной мыжск омичим напряжением с по-разному доминантным цветом шерсти представлено как алтернатива для того чтобы произвести pseudopregnant foster мати.
Introduction
На протяжении многих лет лабораторные грызуны, такие как крысы и мыши, используются для моделирования физиологических и патологических условий человека. Исследования на животных привели к открытиям, которые были недостижимы никакими другими средствами. Первоначально, генетические исследования сосредоточены на анализе спонтанно происходящих расстройств и фенотипов, которые считаются тесно имитировать состояние человека1. Разработка методов генной инженерии позволила ввести или утилизировать специфические гены для получения желаемого фенотипа. Таким образом, генерация трансгенных животных признана в качестве фундаментального метода в современных исследованиях, что позволяет исследования функции генов в живых организмах.
Трансгенные технологии животных стали возможны благодаря сочетанию достижений в экспериментальной эмбриологии и молекулярной биологии. В 1960-х годах польский эмбриолог А. К. Тарковский опубликовал первую работу по манипуляциям эмбрионов мышей на ранних стадиях развития2. Кроме того, молекулярные биологи разработали методы генерации векторов ДНК (т.е. носителей) для, в частности, введения чужеродной ДНК в геном животного. Эти векторы позволяют распространять выбранные гены и их соответствующую модификацию, в зависимости от типа исследований, которые проводятся. Термин "трансгенное животное" был введен Гордон и Ruddle3.
Первый широко признанных видов, которые были использованы в нейробиологии, физиологии, фармакологии, токсикологии, и многие другие области биологических и медицинских наук была норвегия крысы, Rattus norvegicus4. Однако, из-за трудностей в манипулировании эмбрионов крыс, домашняя мышь Mus musculus стала доминирующим видом животных в генетических исследованиях5. Еще одной причиной примата мыши в таких исследованиях было наличие эмбриональной технологии стволовых клеток для создания нокаут животных для этого вида. Наиболее часто используемым методом трансгенеза (2-10% трансгенного потомства по отношению ко всем рожденным животным) является микроинъекция фрагментов ДНК в пронуклеус оплодотворенного яйцеклетки. В 1990 году этот подход, который был впервые введен на мышах, был адаптирован для крыс6,7. Крысиный трансгенез при проядерном инъекциях характеризуется более низкой эффективностью8 по сравнению с мышами, что строго связано с наличием эластичной плазмы и пронуклеарных мембран9. Хотя выживаемость эмбрионов после манипуляций на 40-50% ниже, чем у мышей, этот метод считается стандартом в поколении генетически модифицированных крыс10. Исследованы альтернативные подходы, которые могут гарантировать эффективное трансгенное включение и более высокую выживаемость инъекционных зиготов.
Ключевым фактором, определяющим стабильную трансгенную экспрессию и передачу потомству, является его интеграция в геном клетки-хозяина. Лентивирусы (ЛВ) имеют отличительную особенность быть в состоянии заразить как деления и неразделяющихся клеток. Их использование в качестве инструмента для включения гетерологических генов в эмбрионы оказалось высокоэффективным11,а трансгенные особи характеризуются стабильным выражением включенного фрагмента ДНК. Эффективность лентивирных векторов подтверждена для генетической модификации мышей12,,13,крыс12,,14и других видов11. В этом методе, подвеска LV вводится под zona pellucida эмбриона на стадии двух пронуклий. Этот метод по существу гарантирует 100% выживание эмбрионов, потому что олемма остается нетронутой. Производство высококачественных и относительно высококонцентрированных суспензий LV является решающим фактором. Тем не менее, более низкие концентрации суспензий LV могут быть преодолены путем повторных инъекций11, что увеличивает количество вирусных частиц на поверхности яйцеклетки, не влияя на интеграцию мембран. Эмбрионы, подвергающиеся повторным инъекциям в периферийное пространство, развиваются дальше, и трансгенное потомство может передавать трансген через зародыш. Эффективность выработки трансгенных крыс при трансвирусном трансгенезе может достигать 80%12.
Здесь мы описываем производство рекомбинантного лецивируса, полученного от ВИЧ-1, который был псевдотипирован вирусом везикулярного стоматита (VSV) G-конвертного белка. Использование упаковочной системы второго поколения VSV pseudotype определяет широкую инфекционность вирусных частиц и позволяет выражать высокостабильные векторы, которые могут быть сконцентрированы путем ультрацентрриффирования и криоконсервации. После проверки титра, векторы готовы быть использованы в качестве средства для трансгенной доставки в альбинос Wistar крысы zygotes. После серии инъекций эмбрионы могут быть культивированы в одночасье и переданы на двухклеточной стадии приемным матерям. На данном этапе можно рассмотреть один из двух альтернативных подходов. Стандартная процедура использует псевдобеременных женщин в качестве реципиентов эмбриона. Однако, когда уровень беременности низок после спаривания с вазэктомизированными самцами, эмбрионы могут быть имплантированы беременным крысам Wistar/Sprague-Dawley (SD), которые спариваются с плодородными самцами крыс темного меха (например, крысы Браун Норвегии). Цвет меха позволяет отличить потомство от естественной беременности от потомства, которое происходит от перенесенных манипулируемых эмбрионов.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Производство и применение вирусных векторов соответствовало руководящим принципам уровня 2 уровня биобезопасности и было одобрено министерством окружающей среды Польши. Все экспериментальные процедуры для животных, описанные ниже, были одобрены местным этическим комитетом. Зверей размещали в индивидуально проветриваемых клетках при стабильной температуре (21-23 градусов по Цельсию) и влажности (50-60%) с доступом к воде и пище ad libitum под световым/темным циклом 12 ч/12 ч.
1. Производство трансвиральных векторов
- Трансфекция клеток HEK 293T
ПРИМЕЧАНИЕ: Протокол, представленный в настоящем представленном, предназначен для трансфекции двадцати культурных блюд стоимостью 10 см, которые производят около 200 мл сырого векторного супернатанта.- Культура HEK 293T клеток в среде DMEM, которая дополняется сыворотки крупного рогатого скота плода (10%, v/v) в увлажненных CO2 инкубаторпри при 37 градусов по Цельсию. Для трансфекции, подготовить двадцать 10 см диаметр пластин, и семена 1,5-2 х 106 HEK 293T клеток на блюдо.
- Когда слияние достигает 70%, перевращайте клетки с использованием полиэтиленимногона (PEI) реагента, pH 7.0, в соотношении 3 мкг PEI на 1 мкг ДНК.
- Приготовьте трансфекционную смесь на пять тарелок (подготовьте количество повторений в зависимости от общего количества блюд). До 1 мл модифицированного орла Dulbecco Medium (DMEM; без сыворотки), добавьте смесь из трех плазмидов, чтобы они достигли конечного количества 25 мкг плазмида VSVg, 50 мкг дельты R8.2, и 50 мкг кодирования плазмида.
- Пипетка вверх и вниз, и добавить 125 мл ПЭИ в концентрации 3 мкг / Л. Инкубировать при комнатной температуре в течение 15 минут, инвертирование трубки три раза во время инкубации. Добавьте 200 л трансфекционной смеси на тарелку. Далее, инкубировать пластины в увлажненных CO2 инкубатор при 37 градусах Цельсия.
- Концентрация лентивирных векторов
- Сорок восемь часов после трансфекции, урожай среды, которая содержит частицы LV. Используйте 50 мл конических труб.
ПРИМЕЧАНИЕ: При использовании плазмиды с флуоресцентной меткой, клетки могут быть визуализированы в этот момент для проверки эффективности трансфекции. Новая часть среды DMEM может быть добавлена, и клетки могут быть инкубированы еще на 24 ч. Доходность LV сопоставима, когда собрана на 48 и 72 ч временных точек после трансфекции. - Центрифуги среды на 3000 х г в течение 5 мин и комнатной температуры для удаления отдельных клеток.
- Фильтр супернатанта (0,45 мкм) и вылейте его в новые трубки.
ПРИМЕЧАНИЕ: Этот шаг может быть опущен. - Добавьте DNase I (без RNase, 1 мкг/мл) и MgCl2 (1 мМ) и инкубировать в водяной бане при 37 градусах По цельсии в течение 15 мин.
- Перенесите средние и одноразовые полиэтиленовые трубки и ультрацентрифуги в размахивая ротором при 115 000 х г и 4 кв. м на 1,5 ч.
- После центрифуги, аккуратно слейте стенки труб из средних остатков.
- Замочите гранулы сотерянием стерильных фосфатных солей (PBS; 70-80 л на трубку).
- Инкубировать в течение 2 ч при 4-8 градусах Цельсия.
- Приостановить вирусные векторы в PBS путем нежного пипетки.
ВНИМАНИЕ: Избегайте пены. - Перенесите на центрифугу мощностью 1,5 мл и центрифугу при 7000 х г и 4 градусах по Цельсию на 30 с. Перенесите супернатант в новую трубку. Повторите этот шаг, пока не будет видно клеточного мусора гранулы.
- Aliquot и заморозить при -80 градусах по Цельсию. Избегайте замораживания LV aliquot.
- Сорок восемь часов после трансфекции, урожай среды, которая содержит частицы LV. Используйте 50 мл конических труб.
- Определение вирусного титра с использованием количественной цепной реакции полимеразы
ПРИМЕЧАНИЕ: Титрование вирусных векторов выполняется с использованием количественных ПЦР (qPCR). Этот метод основан на усилении двухцепочечного фрагмента ДНК длиной 84 б.б в течение длинного терминального рецидива области вирусного генома15.- Подготовьте стандартную кривую, сделав серийные разбавления плазмиды LV-кодирования: 1:500, 1:1,000, 1:5,000, 1:10,000, и 1:1,000,000. Определите количество копий плазмиды, которая используется для стандартной кривой. Используйте следующую формулу: количество копий/кЛ (концентрация (концентрация (g/l) x 6.02 x 1023 «число/мол») / (660 г/мол) х плазмидный размер «bp»), где 6.02 x 1023 число/mol является числом Авогадро, и 660 г/моль является bp весом.
ПРИМЕЧАНИЕ: Онлайн калькуляторы номеров копий могут быть использованы. - Приготовьте разбавления лентивирусной суспензии: 1:100, 1:500 и 1:1 000.
- Подготовка реакционная смесь (объемы в скважине): 10 qL qPCR Mastermix, 1 зл из 10 мКм вперед грунтовки, 1 кЛ из 10 ММ обратной грунтовки, и 7 QL Из H2O. Pipette смесь в скважины 96-ну хорошо пластин.
ПРИМЕЧАНИЕ: Передняя грунтовка: 5'-AGCTTGCCTTGAGTTCA. Обратная грунтовка: 5'-TGACTAAAGGGTCTGAGGA. - Добавьте 1 зл и лентивирусную подвеску в тройной.
- Запустите qPCR в соответствии со следующими параметрами: 50 градусов по Цельсию на 2 мин, 96 градусов по Цельсию на 5 мин и 35 циклов 96 градусов по Цельсию на 20 с, 60 градусов по Цельсию на 40 с и 70 градусов по Цельсию в течение 1 мин, а затем этап амплуа: 95 градусов по Цельсию на 1 мин и 60 градусов по Цельсию на 30 с.
- Проанализируйте результаты, сравнив количество молекул, которые получены за каждое разбавление, со стандартной кривой. Определите концентрацию векторных молекул в среднем по три репликации для каждого разбавления.
ПРИМЕЧАНИЕ: Представленная количественная оценка дает физическую концентрацию вирусных частиц. Не следует рассматривать как функциональный титр.
- Подготовьте стандартную кривую, сделав серийные разбавления плазмиды LV-кодирования: 1:500, 1:1,000, 1:5,000, 1:10,000, и 1:1,000,000. Определите количество копий плазмиды, которая используется для стандартной кривой. Используйте следующую формулу: количество копий/кЛ (концентрация (концентрация (g/l) x 6.02 x 1023 «число/мол») / (660 г/мол) х плазмидный размер «bp»), где 6.02 x 1023 число/mol является числом Авогадро, и 660 г/моль является bp весом.
2. Поколение трансгенных крыс
- Суперовуляция и сбор оплодотворенных эмбрионов
- Администрирование гонадотропинов.
ПРИМЕЧАНИЕ: Для увеличения количества собранных эмбрионов (примерно 30 на женщину) используйте незрелых 5-недельных самок Wistar для гормональной стимуляции.- На 1 день (12 pm-1 PM) интраперитонезно вводят гонадотропин беременной кобылы (PMSG; 25 МЕ на женщину). Приготовьте 1 мл аликвот овешного раствора в концентрации 125 МЕ/мл путем растворения гормона порошка в 0,9% NaCl. Хранить при -20 градусов по Цельсию до 1 месяца или до -80 градусов по Цельсию в течение 6 месяцев.
- На 3-й день (12 п.п. - 1 п.п.) интраперитонезно вводят хорионический гонадотрофин человека (ХГЧ; 30 МЕ на женщину). Приготовьте 1 мл aliquots рабочего раствора (150 МЕ/мл) путем растворения гормона порошка в 0,9% NaCl. Хранить при -20 градусов по Цельсию до 1 месяца или до -80 градусов по Цельсию в течение 6 месяцев.
- После введения ХГЧ, спариваться с самками 1:1 с сексуально плодородными самцами (3-10 месяцев).
- На следующее утро (день 4 в 8-10 утра), проверить женщин на наличие вагинальной вилки. Проверьте вагинальное отверстие на наличие беловатой брачную вилку, которая для лучшей визуализации должна быть проверена рано утром после брачного дня. Для сбора эмбрионов используйте только самок с видимой вилкой.
- Сбор эмбрионов в 10 утра. Пожертвуйте животными, чтобы вырезать яйточки, и собирать овидуки в блюдо с предварительно подогретой M2 среды.
- Перенесите яйцеводы в 35-мм блюдо, которое содержит предварительно разогретую среду М2 с гиалуронидазой из яичек крупного рогатого скота в концентрации 0,5 мг/мл.
- Откройте стенки яйцеклетки с помощью тонких щипц под стереомикроскопом и нажмите ампулу (т.е. опухшие части яйцеклетки, которая содержит оплодотворенные эмбрионы, которые окружены кучевыми клетками) до тех пор, пока эмбрионы не освободятся.
ПРИМЕЧАНИЕ: Hyaluronidase ферментативно переваривает кучевые клетки, высвобождая эмбрионы.
ВНИМАНИЕ: Длительное воздействие гиалуронидаза вредно для эмбрионов; таким образом, этот шаг должен длиться не более 5 мин. - Для облегчения высвобождения эмбрионов из кучевых клеток, аккуратно пипетку их вверх и вниз с помощью стеклянной передачи пипетки, которая подключена к рот-работает аспиратор трубки.
- Для получения передачи пипетки, потяните стеклянную пипетку Pasteur над пламенем, чтобы произвести прямой наконечник 5-10 см. Разбейте пипетку, оставив кончик на 4 см.
- Вымойте эмбрионы несколько раз в среде M2 для удаления гиалуронидаза и клеточного мусора. Перенесите эмбрионы в 60-мм блюдо, содержащее (50 л) капли предварительно уравновешенной среды М16, покрытые жидким парафином или минеральным маслом, в увлажненном инкубаторе 37 градусов по Цельсию с атмосферой 5% CO2.
- Администрирование гонадотропинов.
- Микроинъекция лентивирных векторов в одноклеточный эмбрион под zona pellucida
ПРИМЕЧАНИЕ: Используйте одноклеточные эмбрионы с двумя видимыми пронуклиями для микроинъекции(рисунок 1).- Оттепель LV aliquot при комнатной температуре и центрифуги на 10000 х г и RT в течение 2 минут, чтобы гранулы любого оставшегося клеточного мусора.
- Установка микроинъекций
- Подготовка стекла проведения пипетки (боросиликат стекла капилляров) с помощью микрокузнии. Потяните стеклянный капилляр над пламенем, чтобы произвести кончик 5-10 см. Разбейте пипетку, оставив кончик на 4 см. Внешний диаметр должен быть 80-120 мкм.
ПРИМЕЧАНИЕ: Убедитесь, что кончик пипетки идеально прямой и гладкий. - Соберите вытащил пипетку в микрокузе с наконечником перед нагревательной нитью. Нагрейте нить очень близко к кончику пипетки и дайте ей уменьшиться до диаметра 15 мкм (примерно 20% от размера эмбриона). Расположите пипетку перпендикулярно нагревательной нити, 2-3 мм от наконечника пипетки, и начинайте нагреваться. Стекло смягчится. Нагрейте, пока он не достигнет угла 15 градусов.
- Подготовка микроинъекции боросиликатных стеклянных капилляров с нитью с помощью пипетки шкив. Вставьте капилляр в потянув камеры. Выполнить тест рампы (в первый раз для нового стекла и каждый раз после изменения нити). Установите тепло на рампе значение -10, потяните до 100, скорость до 150 и время до 100.
ПРИМЕЧАНИЕ: Изменить параметры для получения оптимального капилляра инъекции. - Под капотом ламинара биобезопасности загрузите около 2 квл/л вирусного раствора в пипетку микроинъекций с наконечником микрозагрузчика.
- Приготовьте блюдо из микроинъекций (крышка 60 мм петри блюдо) с 100 л капли M2 среды (в середине), покрытые жидким парафином или минеральным маслом.
- Смонтируйте удерживающие пипетки и капилляр микроинъекций, который загружается вирусным раствором к микроманипулятору и микроинъекционному блюду под перевернутым микроскопом.
- Подготовка стекла проведения пипетки (боросиликат стекла капилляров) с помощью микрокузнии. Потяните стеклянный капилляр над пламенем, чтобы произвести кончик 5-10 см. Разбейте пипетку, оставив кончик на 4 см. Внешний диаметр должен быть 80-120 мкм.
- Выполните микроинъекцию.
- Передача 15-20 одноклеточных эмбрионов на m2 падение на микроинъекции блюдо. Держите эмбрион с помощью удерживая пипетки.
- Используя 400x увеличение, введите раствор LV под zona pellucida в пространство перивителина с помощью стеклянного капилляра, который соединен с автоматическим инжектора. Держите капилляр под zona pellucida на мгновение.
ПРИМЕЧАНИЕ: Используя мягкое положительное давление, вирусное решение будет непрерывно вытекать из инъекционного капилляра, но объем подвески, которая поставляется не может контролироваться. - Используя тонкую пипетку, верните эмбрионы в культурное блюдо в инкубаторе при 37 градусах Цельсия в атмосфере CO2 5%. Количество инъекций одной зиготы может варьироваться и может быть адаптировано на основе концентрации вирусного вектора.
ПРИМЕЧАНИЕ: Инъекционные эмбрионы могут быть переданы приемным матерям на стадии одной клетки или инкубированные O/N в среде M16, прежде чем быть переданы на двухклеточной стадии. Длительной культуры в пробирке эмбрионов крыс следует избегать.
- Передача инъекционных эмбрионов приемным матерям
- Подготовьте приемных матерей путем спаривания сексуально зрелых самок SD с плодородными самцами BN или с вазэктомизированными самцами SD (процедура вазэктомии описана в разделе 3 ниже) на 3-й день (для переноса эмбрионов на одноклеточной стадии) или 4-й день (для переноса эмбрионов на двухклеточной стадии).
ПРИМЕЧАНИЕ: Для передачи яйцты, используйте 0,5 дней после coitum (dpc) женщин. - На следующее утро, проверить SD женщин для вагинальной вилки, и использовать только те, с видимой вилкой.
- Выполните перенос эмбриона.
ПРИМЕЧАНИЕ: Проведение хирургической процедуры с помощью стерильных инструментов под стереомикроскопом. Перед днем операции, автоклав ножницы, тонкие щипцы, держатель иглы, и скальпель держатель.- Анестезируемую самку с помощью и.п. введения раствора кетамина (50 мг/кг) и мететомидина (0,5 мг/кг). Тест на рефлексы для подтверждения анестезии перед началом хирургической процедуры.
- Вводят животному подкожно с толефенамовой кислотой (2 мг/кг), но ортратом ортрата тортратом тортратом тортратом (1 мг/кг) и энрофлоксацином (5-10 мг/кг) для предотвращения воспаления, боли и инфекции, соответственно.
- Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить высыхание роговицы. Бритьмеха со спины, и стерилизовать кожу с хирургическим скраб следуют 70% алкоголя с использованием стерильных не-придерживающихся колодки. Дайте коже высохнуть.
- Вводят животное подкожно с 100 л 0,25% бупивакаина (местная анестезия) в месте разреза. Перенесите животное в подверженное положение на чистую поверхность на грелку под действием хирургического микроскопа. Обложка крысы стерильной драпировки с небольшим отверстием вырезать над нижней части спины.
- Выполните примерно 2 см разрез кожи, параллельно поясничного позвоночника.
- Используя острые ножницы, сделайте разрез в брюшной стенке. Захватите яичников жира площадку с помощью щипки, и вытащить яичников и яичников и поместить их на марлю, которая смачивается с 0,9% NaCl.
- Аспир M2 средний, три пузырька воздуха, и эмбрионы в передаче капилляров. Рекомендуемое общее количество эмбрионов для передачи (одностороннего или двустороннего): беременная женщина (15–16 эмбрионов), псевдобеременная женщина (30 эмбрионов).
- Сделайте небольшой разрез в яйцете (между инфундибулумом и ампулой) с помощью микро-ножниц, и вставьте передачу пипетки в яйцепровод.
- Аккуратно изгнать эмбрионы и пузырьки воздуха из пипетки в яйц. С тупыми щипками, поместите репродуктивного тракта обратно в брюшной полости.
- Шов брюшной стенки с полиликоловой кислотой поглощают швы и закрыть разрез кожи с раны клипы. В зависимости от количества эмбрионов, которые доступны, повторить эту процедуру для других овидуков.
- Вводят животное интраперитонеально с атипамезола (0,5 мг/кг), чтобы обратить вспять эффект анестезии.
- Перенесите животное в чистую клетку и держите его на согревающей тарелке, чтобы полностью оправиться от наркоза. Доставка у крыс происходит через 21 день.
ПРИМЕЧАНИЕ: Когда самцы крыс BN использованы для сопрягая, только белые щенки потенциально transgenic; коричневые щенки от естественной беременности. - Собирайте фрагменты тканей (желательно от уха) к генотипу 3-недельных щенков.
- Подготовьте приемных матерей путем спаривания сексуально зрелых самок SD с плодородными самцами BN или с вазэктомизированными самцами SD (процедура вазэктомии описана в разделе 3 ниже) на 3-й день (для переноса эмбрионов на одноклеточной стадии) или 4-й день (для переноса эмбрионов на двухклеточной стадии).
3. Вазэктомия
ПРИМЕЧАНИЕ: Перед днем операции, автоклав ножницы, тонкие щипцы и держатель иглы.
- Анестезия 5-недельный самец SD крысы с i.p. введение кетамина (50 мг/кг) и medetomidine (0,5 мг/кг) раствор. Тест на рефлексы для подтверждения анестезии перед началом хирургической процедуры.
- Администрирование толфенамовой кислоты (2 мг/кг), но ортрат ортрата ортрата ортрата (1 мг/кг) и энрофолоксацина (5-10 мг/кг) подкожно для предотвращения воспаления, боли и инфекции, соответственно.
- Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить высыхание роговицы. Поместите крысиный наспине на чистую поверхность на грелке и стерилизовать кожу на яичках с хирургическим скрабом, за которым следует 70% алкоголя с использованием стерильных прокладок без примыкания. Дайте коже высохнуть. Обложка крысы стерильной драпировки с небольшим отверстием вырезать над яичками. Аккуратно нажмите на живот, чтобы разоблачить яички в мошонке мешок.
- Используя хирургические ножницы, сделайте разрез на 0,5 см в середине мошонки. Найдите стену средней линии (утихая линия) между яичами.
- Сделайте разрез 5 мм в мембране яичка близко к левой стороне стенки средней линии.
- Тщательно нажмите яичка влево и найти ваз deferens (между яичка миочным и средней линии) в виде белого протока с одним кровеносным сосудом.
- Аккуратно вытащите вазу из мошонки с помощью щипцы часовщика. Держите ваз deferens с одной парой щипцы, и вырезать его с мелкими ножницами (или прижигать с раскаленные кончики второй пары щипцы). Удалите фрагмент протока на 1 см.
ПРИМЕЧАНИЕ: Если прижигается, удерживайте кончик второй пары щипцы в пламени. - Повторите вышеупомянутую процедуру для других яичек. Шов кожи с полиликоловой кислотой поглощает швы и вводить животное интраперитонеально с атипамезоле (0,5 мг/кг).
- Поместите крысу в чистую клетку на согревающую тарелку до тех пор, пока животное не оправится от наркоза.
ПРИМЕЧАНИЕ: Мужчины могут быть использованы в тестовых спариваниях после 2-недельного периода восстановления. После того, как стерильность подтверждается, они могут быть использованы для индукции псевдобеременности.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Используя описанный в нем протокол, были произведены ленцивиральные векторы, несшиточные конструкции Syn-TDP-43-eGFP (физический титр LV 3,4 х 108/ЗЛ), а затем могут быть использованы для одноклеточных инъекций эмбриона. Только эмбрионы с двумя видимыми пронуклиями были подвергнуты процедуре. Количество инъекций вирусных суспензий определялось экспериментально. Высокая эффективность имплантации и одновременное отсутствие трансгенного потомства считались показателями недостаточного количества вирусных частиц для успешной трансдукции. При этом количество инъекций было увеличено. Однократная администрация LV привела к рождению 20 крыс поколения F0, ни одна из которых не была трансгенной. Увеличение количества инъекций на один порядок не привело к рождению крыс, но 100% эмбрионов развились до двухклеточной стадии. В последующих экспериментах количество инъекций было увеличено на одну по сравнению с значением, за которое было получено потомство. Для варианта двух инъекций родились восемь крыс, три из которых были подтверждены для переноса трансгена (обобщено в таблице 1). Один из основателей не передал трансген потомству. Количество эмбрионов, которые были введены и переданы в каждом экспериментальном варианте было 48 в вариантах LV x1 и LV x2 и 45 в LV x10. Три приемные женщины были использованы для каждой экспериментальной установки. Выбранный подход позволил создать стабильные трансгенные крысиные линии, которые выражали белок синтеза TDP-43-eGFP под контролем промотора нейронов Synapsin-1 по всей центральной нервной системе(рисунок 2A,B)14. Трансгенез на основе ленты привело к одной копии вставки трансгена, как показано на qPCR(Рисунок 2C).
В экспериментальной установке, описанной выше, выживаемость инъекционных эмбрионов составила 95%. Аналогичные результаты были получены, когда тот же метод был использован для других лентивиральных векторов, как обобщено в таблице 2. Процент эмбрионов, переживших проядерные инъекции, был значительно ниже (29-45%). Таблица 2 обобщает репрезентативные результаты эффективности имплантации манипулируемых зиготов, учитывая передачу псевдобеременных беременным женщинам. Ранеесообщалосьоб использовании неманутированных эмбрионов вместе с инъекционными эмбрионами. Наши общие результаты показывают, что беременные женщины крысы могут быть использованы в качестве приемных матерей с сопоставимой эффективностью. Мы получили аналогичный процент имплантации иностранных эмбрионов у беременных и псевдобеременных крыс (в среднем за несколько экспериментальных установк: 15% против 16%). Тем не менее, скорость имплантации была выше, когда эмбрионы прошли более тонкие манипуляции, что означает подзональную инъекцию (10% против 21%). Примечательно, что численные данные, которые были проанализированы для отдельных раундов микроинъекции, показали, что эффективность имплантации зависит от количества инъекций одного эмбриона(таблица 1,последняя колонка) и косвенно зависит от вирусной нагрузки.
| Вектор | количество инъекций/эмбрионов | количество инъекционных эмбрионов | количество щенков | число приемных матерей | число трансгенных учредителей | Эффективность имплантации для каждого варианта |
| Син-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
Таблица 1: Резюме количества подзональных инъекций зиготов с син-TDP-43WTлентивирными вектором.
| Метод | Вектор | Титер/ Концентрация | Количество инъекционных эмбрионов | Выжившие эмбрионы | Выживаемость | Число приемных матерей | Количество щенков | Эффективность имплантации | Беременность (P) /Псевдобеременность (PP) |
| Pni | TTYH1-Thy1-EGFP | 1 нг/Лл | 1083 | 424 | 39% | 16 | 54 | 13% | Pp |
| Pni | H3mCherry | 0,5-2 нг/л | 2229 | 647 | 29% | 29 | 67 | 10% | Pp |
| Pni | Син-ТДП-43-A315T | 2 нг/Л л | 1256 | 562 | 45% | 31 | 42 | 7% | Pp |
| Lv | Син-ТДП-43-A315T | 8.7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | Син-TDP-43 WT | 3,4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mcherry | 1,3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | Pp |
Таблица 2: Коэффициент выживаемости эмбрионов и эффективность имплантации, в зависимости от метода инъекции, который был использован и беременности против псевдобеременности индукции. ПНИ, пронуклеарита; LV, ленцивиральный вектор субзональной инъекции.

Рисунок 1: Микроскопическая фотография одноклеточного эмбриона крысы, подготовленного для подзональной лецивирусной инъекционной инъекции. Эмбрион был обездвижен с помощью удерживающих пипетки. Видны два пронукли, которые содержали материнский и отцовский генетический материал и полярное тело. Шкала бар 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
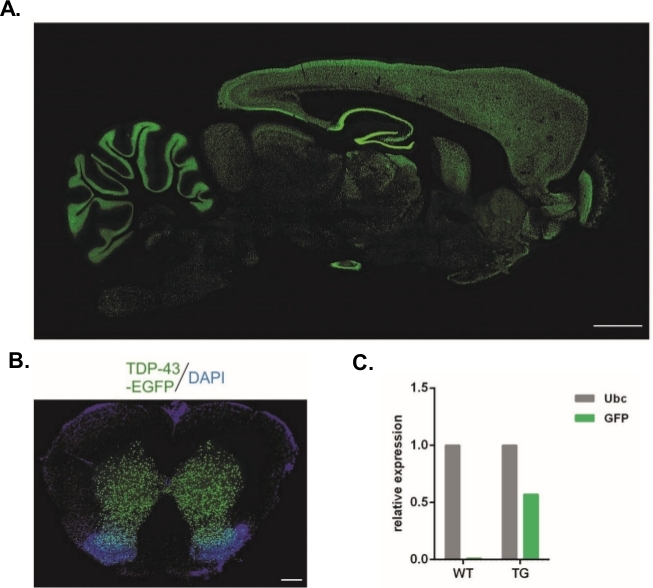
Рисунок 2: Поколение стабильных трансгенных крысиных линий, которые выражали белок синтеза TDP-43-eGFP под контролем промотора нейронов Синапсин-1 по всей центральной нервной системе. (A)Synapsin-1 (Syn)-управляемый hTDP-43-eGFP шаблон выражения в сагиттальной части трансгенного мозга крысы. Шкала бар 3 мм. (B) Корональный раздел спинного мозга трансгенной крысы, где eGFP флуоресценции, вразрез с DAPI, был ограничен серого вещества спинного мозга. Шкала бар 250 мкм. (C) Относительное выражение трансгенной стенограммы GFP по сравнению с стенограммой ссылки на убиквитин C. n 2 дикий тип. n 2 трансгенных. Рисунок был изменен с14. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Достижения в области трансгенных технологий сделали модели грызунов бесценным инструментом в биомедицинских исследованиях. Они дают возможность изучить генотип-фенотип отношения in vivo. Здесь мы представляем широко доступную альтернативу обычному трансгенезу с помощью проядерных инъекций. Использование трансдукции лентивиральных генов обходит необходимость требовательных микроинъекций, потому что вирусные векторы могут быть введены под zona pellucida. Такой подход не влияет на целостность эмбриона, что по существу гарантирует 100% выживаемость инъекционных зиготов. Трансген, который включается с помощью лентивирусных векторов, прочно интегрируется в геном хозяина, что позволяет долго временно выражать и передавать зародышевые дрожи. Кроме того, мы представляем два альтернативных метода для модифицированного переноса эмбрионов приемным матерям. Один метод использует перенос эмбриона к псевдобеременным самкам, которые предварительно подготовлены путем спаривания с вазэктомизированными бесплодными самцами. Другой метод основан на использовании естественно супоросых женщин которые сопрягаты с плодородными мыжами но с другим цветом шерсти (т.е., крысы BN). Это более физиологическое течение беременности позволяет правильное развитие эмбрионов, которые проходят сложные генетические модификации16.
Первые успешные попытки создания трансгенных крыс были зарегистрированы в 1990году 7. Однако, из-за трудностей в трансгенезе крыс17, относительно небольшое количество трансгенных линий крыс были созданы в последние десятилетия9. Несколько основных различий наблюдаются между мышью и трансгенезом крыс с помощью микроинъекций. Для крыс для трансгенеза используются в основном выведенные линии (например, Wistar и SD). Для мышей, исследователи в основном используют F1 скрещивания инбредных штаммов из-за их более высокой плодородия, лучше реагировать на18гормональные суперовуляции, и относительно легкое развитие эмбрионов в пробирке от одной клетки стадии бластоцисты18 . Индукция суперовуляции у крыс гораздо менее эффективна, чем у мышей с использованием стандартной стимуляции гормонов PMSG/hCG. По этой причине, были предприняты попытки разработать альтернативные протоколы для администрирования этих гормонов у крыс, которые используют непрерывный вливание ФСГ вместо одного pmSG администрации19. Тем не менее, суперовуляция, которая вызвана PMSG/hCG или FSH/hCG, как было показано, имеет сопоставимую эффективность20. На наш взгляд, наиболее важным фактором, влияющим на эффективность суперовуляции, является возраст отдельных самок. Тем не менее, точные параметры должны быть проверены для каждого штамма крысы, лаборатории и т.д.
Процедура введения раствора ДНК в пронуклеус одноклеточного эмбриона аналогична для обоих видов грызунов. Тем не менее, пронукли крысиных зиготы не имеют таких регулярных форм, как у мышей и, как правило, труднее определить в цитоплазме клетки. Кроме того, мембрана клетки циготы крысиной и пронуклеатической мембраны более эластичны и вязки, что усложняет вставку стеклянного микропипетита, который загружается с помощью ДНК-раствора. Эти факторы приводят к снижению выживаемости крысиных яиц после микроинъекции (31-65% против 80% у мышей) и объясняют более низкую эффективность трансгенеза у крыс9. Кроме того, интенсивные механические манипуляции эмбриона также могут повлиять на эффективность имплантации, которая во многих лабораториях, в том числе и в нашей, достигает максимум 10%. Такая относительно низкая урожайность наблюдается даже после имплантации соответствующего количества эмбрионов21.
Одним из методов преодоления вышеупомянутых трудностей является заражение одноклеточных эмбрионов ретровирусами. Ретровирусы содержат генетический материал в виде РНК, которая при входе в зараженную клетку транскрибируется в ДНК путем обратной транскриптазы вируса. Затем ДНК транспортируется через ядерные поры в ядро клетки, где она интегрируется в геном клетки в виде провируса. Лентивирусные векторы были использованы для генерации трансгенных мышей и крыс12,14,,22. Одноклеточные эмбрионы, в недостающей zona pellucida, могут быть инкубированы в раствор с лентивирусным вектором, или вектор может быть введен под zona pellucida в перивителинное пространство. Основным преимуществом этого метода является его чрезвычайно высокая эффективность, достигающая более 80% трансгенного потомства. После заражения лентивирусным вектором, многие копии на разных участках могут интегрироваться в геном зиготы, в отличие от метода трансгенеза с помощью проядерной микроинъекции, в котором один интеграционный участок обычно наблюдается12. У потомства трансгенного основателя, которое производится с использованием лентивирных векторов, отдельные копии трансгена сегрегированы, что может проявляться различными экспресс-профилями трансгена в каждом из потомков. Тем не менее, это может увеличить вероятность получения предмета с желаемым профилем выражения, который является производным от трансгена. Ограничения в основном распространяются на размер трансгена, который ограничен примерно 8 кб23.
Еще одной трудностью в трансгенезе крыс является поколение самок, которые служат в качестве суррогатных матерей для генетически модифицированных эмбрионов. В стандартной процедуре, женщины скрещены со стерильными вазэктомизированными самцами, чтобы вызвать псевдобеременность. У крыс, псевдобеременность оценки техники гораздо сложнее, чем у мышей, так что стимуляция с гонадотропина высвобождая агонист гормона иногда используется за несколько дней до спаривания с мужчинами. По этим причинам в описанном протоколе мы предоставляем два альтернативных подхода к приему приемных матерей. Общая эффективность имплантации манипулируемых зиготы при использовании беременных или псевдобеременных женщин аналогична. Тем не менее, наличие естественных, неманитируемых эмбрионов вместе с манипулируемыми из них может улучшить уровень беременности16. Хотя основное различие в скорости имплантации является метод манипуляции (т.е. PNI против LV, 10% против 20%; см. Таблица 2), использование псевдобеременных женщин в качестве приемных матерей может быть полезным для некоторых экспериментов.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Автор (W.K.) имеет права на патент "Метод производства трансгенного животного" от патентного ведомства Республики Польша (No P 355353; 21.03.2008).
Acknowledgments
Это исследование было поддержано проектом ANIMOD в рамках программы Team Tech Core Facility Plus Фонда польской науки, совместно финансируемой Европейским союзом в рамках Европейского фонда регионального развития WK.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



