Summary
Denna artikel syftar till att ge metoden för lentiviral transgenes hos råtta embryon med flera injektioner av ett virus suspension i zygot perivitelline utrymme. Kvinnliga råttor som paras med en bördig manlig stam med en annan dominerande päls färg används för att generera pseudopregnant fostermödrar.
Abstract
Transgena djurmodeller är i grunden viktiga för modern biomedicinsk forskning. Införlivandet av främmande gener i tidiga mus- eller råttembryon är ett ovärderligt verktyg för genfunktionsanalys i levande organismer. Standardtransgenesismetoden bygger på mikroinjecting utländska DNA-fragment till en pronucleus av en befruktad äggcell. Denna teknik används ofta hos möss men är fortfarande relativt ineffektiv och tekniskt krävande hos andra djurarter. Transgenen kan också föras in i encelliga embryon via lentiviral infektion, vilket ger ett effektivt alternativ till vanliga pronukleära injektioner, särskilt hos arter eller stammar med en mer utmanande embryostruktur. I detta tillvägagångssätt injiceras en suspension som innehåller lentivirala vektorer i perivitelline utrymmet hos en befruktad råtta embryo, som är tekniskt mindre krävande och har en högre framgång. Lentiviral vektorer visade sig effektivt införliva transgenen i genomet för att bestämma utvecklingen av stabila transgena linjer. Trots vissa begränsningar (t.ex. biosäkerhetsnivå 2 krav, DNA fragment storleksgränser), lentiviral transgenes är en snabb och effektiv transgenes metod. Dessutom, med hjälp av kvinnliga råttor som paras med en fertil manlig stam med en annan dominerande päls färg presenteras som ett alternativ för att generera pseudopregnant fostermödrar.
Introduction
Under många år har laboratoriegnagare, såsom råttor och möss, använts för att modellera mänskliga fysiologiska och patologiska tillstånd. Djurforskning har lett till upptäckter som var ouppnåeliga på något annat sätt. Inledningsvis fokuserade genetiska studier på analys av spontant förekommande sjukdomar och fenotyper som anses efterlikna det mänskliga tillståndet1. Utvecklingen av gentekniska metoder gjorde det möjligt att införa eller ta bort specifika gener för att få en önskad fenotyp. Därför är generering av transgena djur erkänd som en grundläggande teknik i modern forskning som möjliggör studier av genfunktion i levande organismer.
Transgen djurteknik har blivit möjlig genom en kombination av landvinningar inom experimentell embryologi och molekylärbiologi. På 1960-talet publicerade den polske embryologen A. K. Tarkowski det första arbetet med manipulering av musembryon under de tidiga utvecklingsstadierna2. Dessutom utvecklade molekylärbiologer tekniker för att generera DNA-vektorer (dvs. bärare) för bland annat införande av främmande DNA i djurets arvsmassa. Dessa vektorer möjliggör spridning av utvalda gener och deras lämpliga modifiering, beroende på vilken typ av forskning som bedrivs. Termen "transgena djur" infördes av Gordon och Ruddle3.
Den första allmänt accepterade arter som användes i neurobiologi, fysiologi, farmakologi, toxikologi, och många andra områden av biologiska och medicinska vetenskaper var Norge råtta, Rattus norvegicus4. Men på grund av svårigheten att manipulera råtta embryon, har huset musen Mus muskulos blivit den dominerande djurarten i genetisk forskning5. En annan orsak till musens företräde i sådan forskning var tillgången på embryonal stamcellsteknik för att generera knockout djur för denna art. Den vanligaste tekniken för transgenes (2–10% av transgena avkommor i förhållande till alla födda djur) är mikroinjektion av DNA-fragment till en pronucleus av en befruktad äggcell. År 1990 anpassades detta tillvägagångssätt, som först introducerades hos möss, för råttor6,7. Råtttransgenes genom pronukleär injektion kännetecknas av lägre verkningsgrad8 jämfört med möss, vilket är strikt relaterat till närvaron av elastisk plasma och pronukleära membran9. Även om överlevnaden av embryon efter manipulering är 40–50% lägre än hos möss, anses denna teknik vara en standard i genereringen av genetiskt modifierade råttor10. Alternativa metoder som kan garantera effektiv transgeninkorporering och högre överlevnad av injicerade zygoter har undersökts.
Den viktigaste faktorn för stabila transgenuttryck och överföring till avkomma är dess integrering i värdcellsgenomet. Lentiviruses (LVs) har det utmärkande draget att kunna infektera både dela och icke-dela celler. Deras användning som ett verktyg för att införliva heterologa gener i embryon visade sig vara mycket effektiv11, och transgena individer kännetecknas av ett stabilt uttryck för det inkorporerade DNA-fragmentet. Effekten avlentivirala vektorer har bekräftats för genetisk modifiering av möss12,,13,råttor12,,14och andra arter11. I denna metod injiceras LV suspensionen under embryots zona pellucida i stadiet av två pronuclei. Denna teknik garanterar i huvudsak 100% överlevnad av embryon eftersom oolemma förblir opåverkad. Produktionen av högkvalitativa och relativt starkt koncentrerade LV-suspensioner är avgörande faktorer. Lägre koncentrationer av LV suspensioner kan dock övervinnas genom upprepade injektioner11, vilket ökar mängden viruspartiklar på äggytan utan att påverka membranintegration. Embryon som utsätts för upprepade injektioner i perivitelline utrymmet utvecklas ytterligare, och transgena avkomma kan överföra transgenen genom sett. Effektiviteten av transgen råtta generation av lentiviral transgenes kan vara så hög som 80%12.
Här beskriver vi produktionen av HIV-1-härledda rekombinanta lentivirus som var pseudotyped med vesikulära stomatitis virus (VSV) G kuvert protein. Användningen av andra generationens förpackningssystem VSV pseudotyp bestämmer den breda smittsamhet av viruspartiklar och tillåter produktion av mycket stabila vektorer som kan koncentreras genom ultracentrifugering och kryoreserverad. Efter titerverifiering är vektorerna redo att användas som ett medel för transgenleverans till albino Wistar råttzygoter. Efter en rad injektioner kan embryona odlas över natten och överföras i tvåcelliga skede för att fosterhem. I det här läget kan ett av två alternativa tillvägagångssätt övervägas. Standardförfarandet använder pseudopregnant honor som embryomottagare. Men när graviditetsfrekvensen är låg efter parning med vasektomiserade män, embryona kan implanteras i gravida Wistar /Sprague-Dawley (SD) honor som paras med bördiga hanråttor med en mörk päls färg (t.ex. Brown Norge [BN] råttor). Pälsens färg gör det möjligt att skilja av avkomma från naturlig graviditet från avkomman som kommer från de överförda manipulerade embryona.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Produktionen och tillämpningen av virusvektorer var i enlighet med riktlinjerna på biosäkerhetsnivå 2 och godkändes av det polska miljöministeriet. Alla försöksförsök som beskrivs nedan godkändes av den lokala etiska kommittén. Djuren var inhysta i individuellt ventilerade burar vid en stabil temperatur (21–23 °C) och fuktighet (50–60%) med ad libitum tillgång till vatten och mat under en 12 h/12 h ljus/mörk cykel.
1. Lentiviral vektorproduktion
- Transfektion av HEK 293T-celler
OBS: Det protokoll som presenteras häri är utformat för transfection av tjugo Ø10 cm kulturrätter som producerar cirka 200 ml rå vektor supernatant.- Kultur HEK 293T-celler i DMEM-medium som kompletteras med fetala bovinserum (10%, v/v) i en fuktad CO2-inkubator vid 37 °C. För transfection, förbereda tjugo 10 cm diameter plattor, och utsäde 1,5-2 x 106 HEK 293T celler per maträtt.
- När sammanflödet når ~70%, transfekt cellerna med polyetylenimine (PEI) reagens, pH 7.0, vid ett förhållande av 3 μg PEI per 1 μg DNA.
- Förbered transfection blandningen för fem plattor (förbereda antalet repetitioner enligt det totala antalet rätter). Till 1 ml Dulbecco's Modified Eagle Medium (DMEM; utan serum), tillsätt blandningen av tre plasmider så att de når en slutlig mängd av 25 μg VSVg plasmid, 50 μg delta R8.2 och 50 μg kodning plasmid.
- Pipett upp och ner och tillsätt 125 μl PEI vid en koncentration av 3 μg/μL. Inkubera vid rumstemperatur i 15 min, vilket inverterar röret tre gånger under inkubationen. Tillsätt 200 μL av transfktionsblandningen per platta. Därefter inkubera plattorna i en2 fuktad CO 2-inkubator vid 37 °C.
- Koncentration av lentivirala vektorer
- Fyrtioåtta timmar efter transfection, skörda mediet som innehåller LV partiklar. Använd 50 ml koniska rör.
OBS: När du använder en plasmid med en fluorescerande tagg, celler kan visualiseras på denna punkt för att kontrollera transfection effektivitet. En ny del av DMEM-medium kan läggas till, och celler kan inkuberas för ytterligare 24 timmar. LV-avkastningen är jämförbar när den samlas in vid 48 och 72 h tidpunkter efter transfection. - Centrifugera mediet vid 3000 x g i 5 min och rumstemperatur för att avlägsna fristående celler.
- Filtrera supernatanten (0,45 μm) och häll den i nya rör.
Det här steget kan utelämnas. - Tillsätt DNase I (RNase-fri, 1 μg/ml) och MgCl2 (1 mM) och inkubera i ett vattenbad vid 37 °C i 15 min.
- Överför de medelstora polyetenrören och ultracentrifugen i en svängande rotor vid 115 000 x g och 4 °C i 1,5 timmar.
- Efter centrifugering, dränera försiktigt väggarna i rören från de medelstora rester.
- Blötlägg pelleten med steril fosfatbuffrad koksaltlösning (PBS; 70–80 μl per rör).
- Inkubera i 2 timmar vid 4–8 °C.
- Resuspend de virala vektorerna i PBS genom skonsam pipettering.
VARNING: Undvik skumbildning. - Överför till ett 1,5 ml centrifugrör och centrifug vid 7 000 x g och 4 °C för 30 s. Överför supernatanten till ett nytt rör. Upprepa detta steg tills ingen cellskräppellet är synlig.
- Alikvot och frys vid -80 °C. Undvik att frysa LV aliquot.
- Fyrtioåtta timmar efter transfection, skörda mediet som innehåller LV partiklar. Använd 50 ml koniska rör.
- Bestämning av virusiter med kvantitativ polymeraskedjereaktion
T.ex. Denna metod bygger på att förstärka ett dubbelsträngat 84 bp långt DNA-fragment inom det långa terminalrepeterningsregionen i virusgenomet15.- Förbered standardkurvan genom att göra seriella utspädningar av LV-kodning plasmid: 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000 och 1:1,000,000. Bestäm antalet kopior av plasmid som används för standardkurvan. Använd följande formel: antal kopior/μL = (koncentration [g/μL] x 6,02 x 1023 [antal/mol]) / (660 [g/mol] x plasmidstorlek [bp]), där 6,02 x 1023 tal/mol är Avogadros nummer och 660 g/mol är bp-vikten.
Obs! - Bered utspädningar av den lånade ivirala suspensionen: 1:100, 1:500 och 1:1 000.
- Förbered reaktionsblandningen (volymer per brunn): 10 μL qPCR Mastermix, 1 μL 10 μM Framåtprimer, 1 μL 10 μM omvänd primer och 7 μL H2O. Pipett blandningen i brunnarna på 96-brunnsplattor.
OBS: Framåt primer: 5'-AGCTTGCCTTGAGTGCTTCA. Omvänd primer: 5'-TGACTAAAAGGGTCTGAGGGA. - Tillsätt 1 μl av varje standardutspädning och lentiviral suspension i tre exemplar.
- Kör qPCR enligt följande parametrar: 50 °C i 2 min, 96 °C i 5 min och 35 cykler av 96 °C för 20 s, 60 °C för 40 s och 70 °C i 1 min, följt av smältkurvstadiet: 95 °C i 1 min och 60 °C vid 30 s.
- Analysera resultaten genom att jämföra antalet molekyler som tas emot för varje utspädning med standardkurvan. Bestäm koncentrationen av vektormolekyler som medelvärdet av tre replikat för varje utspädning.
OBS: Den presenterade kvantifieringen ger den fysiska koncentrationen av viruspartiklarna. Det bör inte behandlas som en funktionell titer.
- Förbered standardkurvan genom att göra seriella utspädningar av LV-kodning plasmid: 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000 och 1:1,000,000. Bestäm antalet kopior av plasmid som används för standardkurvan. Använd följande formel: antal kopior/μL = (koncentration [g/μL] x 6,02 x 1023 [antal/mol]) / (660 [g/mol] x plasmidstorlek [bp]), där 6,02 x 1023 tal/mol är Avogadros nummer och 660 g/mol är bp-vikten.
2. Generering av transgena råttor
- Superovulation och insamling av befruktade embryon
- Administrera gonadotropiner.
OBS: För att öka antalet insamlade embryon (cirka 30 per hona), använd omogna 5 veckor gamla Wistar honor för hormonell stimulering.- Dag 1 (12.00–13)) injicerar intraperitonealt dräktigt stos serum gonadotropin (PMSG; 25 IE per hona). Förbered 1 ml alikvoter av arbetslösning vid en koncentration av 125 IE/mL genom att lösa upp hormonpulver i 0,9% NaCl. Förvaras vid -20 °C i upp till 1 månad eller -80 °C i upp till 6 månader.
- På dag 3 (12:00–13)) injicerar intraperitonealt humant chorionic gonadotrophin (hCG; 30 IE per hona). Förbered 1 ml alikvoter av arbetslösning (150 IE/ml) genom att lösa upp hormonpulver i 0,9% NaCl. Förvaras vid -20 °C i upp till 1 månad eller -80 °C i upp till 6 månader.
- Efter hCG administration, mate kvinnor 1:1 med sexuellt fertila män (3-10 månader gammal).
- Nästa morgon (dag 4 kl 08.00–10.00), kontrollera att honorna är förekomst av en vaginal plugg. Kontrollera vaginal öppning för närvaron av en vitaktig parningsplugg, som för bästa visualisering bör kontrolleras tidigt på morgonen efter parningsnatten. För embryosamling, använd endast honor med synlig plugg.
- Samla embryon klockan 10.00. Offra djuren för att punktskatta äggledarna, och samla oviducts i en maträtt med förvärmda M2 medium.
- Överför äggledarna till en 35 mm-skål som innehåller förvärmt M2-medium med hyaluronidas från bovintestes vid en koncentration av 0,5 mg/ml.
- Öppna väggarna i äggledaren med hjälp av fina pincett under ett stereomikroskop och tryck på ampulla (dvs. den svullna delen av äggledaren som innehåller befruktade embryon som är omgivna av cumulus celler) tills embryona frigörs.
OBS: Hyaluronidase enzymatically smälter cumulus celler, släppa embryon.
VARNING: Långvarig exponering för hyaluronidase är skadlig för embryon; Därför bör detta steg inte vara längre än 5 min. - För att underlätta frisättningen av embryon från cumulusceller, försiktigt pipett dem upp och ner med hjälp av en glasöverföring pipett som är ansluten till en mun-drivna aspirator röret.
- För att producera överföringspipetten, dra en pastörpipaett i glas över en låga för att producera en rak ~5-10 cm spets. Bryt pipetten och lämna en ~4 cm spets.
- Tvätta embryona några gånger i M2 medium för att ta bort hyaluronidase och cellulära skräp. Överför embryona till en 60 mm skål som innehåller (~50 μL) droppar förjämlkvikt M16 medium, täckt av flytande paraffin eller mineralolja, i en fuktad 37 °C-inkubator med en 5% CO2-atmosfär.
- Administrera gonadotropiner.
- Mikroinjektion av lentivirala vektorer till encelligt embryo under zona pellucida
OBS: Använd embryon i ett cellsteg med två synliga pronuclei för mikroinjektion (figur 1).- Tina LV aliquot vid rumstemperatur och centrifug på 10.000 x g och RT för 2 min till pellet eventuella återstående cellulära skräp.
- Konfiguration av Microinjection
- Förbered glashållpipetter (borosilikatglaskapillär) med hjälp av en mikroforge. Dra glaskapillären över en låga för att producera en 5–10 cm spets. Bryt pipetten och lämna en ~4 cm spets. Ytterdiametern ska vara ~80–120 μm.
OBS: Se till att pipettspetsen är helt rak och smidig. - Montera den dragna pipetten i en mikroforge med spetsen framför värmeglödtråden. Värm glödtråden mycket nära pipettspetsen och låt den krympa till en diameter på ~15 μm (cirka 20 % av embryostorleken). Placera pipetten vinkelrätt mot värmeglödtråden, 2–3 mm från pipettspetsen och börja värma. Glaset mjuknar. Värm tills den når en 15° vinkel.
- Förbered microinjection borosilikat glas kapillärer med en glödtråd med hjälp av en pipett avdragare. Sätt in kapillären i dragkammaren. Kör ett ramptest (för första gången för nytt glas och varje gång efter byte av glödtråd). Ställ in värmen på rampvärdet -10, Dra till 100, Hastighet till 150 och Tid till 100.
OBS: Ändra parametrarna för att få en optimal insprutningskapillär. - Under en biosäkerhetslaminär flödeshuva, ladda cirka 2 μL av viruslösningen i mikroinjektionspipetten med en mikrolastarspets.
- Förbered en mikroinjektionsskål (lock på 60 mm petriskål) med en 100 μL droppe M2 medium (i mitten), täckt av flytande paraffin eller mineralolja.
- Montera den hållpipett och mikroinjektion kapillär som är laddad med viral lösning till en mikromanipulator och microinjection skålen under ett inverterat mikroskop.
- Förbered glashållpipetter (borosilikatglaskapillär) med hjälp av en mikroforge. Dra glaskapillären över en låga för att producera en 5–10 cm spets. Bryt pipetten och lämna en ~4 cm spets. Ytterdiametern ska vara ~80–120 μm.
- Utför mikroinjektionen.
- Överför 15–20 encelliga embryon till M2-droppen på mikroinjektionsskålen. Håll embryot med en pipett.
- Med hjälp av 400x förstoring, injicera LV-lösningen under zona pellucida till perivitelline utrymme med hjälp av glas kapillär som är ansluten till en automatisk injektor. Håll kapillären under zona pellucida en stund.
OBS: Med ett försiktigt positivt tryck kommer viruslösningen att flöda kontinuerligt ut ur injektionskapillären, men suspensionsvolymen som levereras kan inte kontrolleras. - Med hjälp av en fin pipett, returnera embryona till kulturskålen i inkubatorn vid 37 °C i en 5% CO2 atmosfär. Antalet injektioner av en zygot kan variera och kan anpassas baserat på virusvektorkoncentrationen.
OBS: De injicerade embryona kan överföras till fostermödrar i encelligt stadium eller inkuberad O/N i M16-medium innan de överförs i tvåcellsstadiet. Långvarig in vitro-odling av råttembryon bör undvikas.
- Överföring av injicerade embryon till fostermödrar
- Förbered fostermödrar genom att para ihop sexuellt mogna SD-honor med fertila BN-män eller med vasektomiserade SD-män (vasektomiproceduren beskrivs i avsnitt 3 nedan) dag 3 (för överföring av embryon i encelligt stadium) eller dag 4 (för överföring av embryon i tvåcellsstadiet).
OBS: För oviduct överföring, använd 0,5 dagar efter coitum (dpc) honor. - Nästa morgon, kontrollera SD honor för en vaginal plugg, och använd endast de med en synlig plugg.
- Utför embryoöverföring.
OBS: Utför det kirurgiska ingreppet med sterila instrument under ett stereomikroskop. Före dagen för operationen, autoklav sax, fina pincett, nålhållare, och skalpell innehavaren.- Bedöva en hona med i.p. administrering av ketamin (50 mg/kg) och medetomidinlösning (0,5 mg/kg). Test för reflexer för att bekräfta anestesi innan det kirurgiska ingreppet påbörjas.
- Injicera djuret subkutant med tolefenamic syra (2 mg/kg), butorphanol tartrat (1 mg/kg) och enrofloksacin (5-10 mg/kg) för att förhindra inflammation, smärta och infektion, respektive.
- Applicera oftalmisk salva smörjning på båda ögonen för att förhindra hornhinnans torkning. Raka pälsen från baksidan, och sterilisera huden med kirurgisk scrub följt av 70% alkohol med sterila icke-adhering kuddar. Låt huden torka.
- Injicera djuret subkutant med 100 μL av 0,25% bupivakain (lokalbedövning) vid snittstället. Överför djuret i ett utsatt läge till en ren yta på en värmedyna under målet med ett kirurgiskt mikroskop. Täck råttan med en steril drapering med ett litet hål skuren över nedre delen av ryggen.
- Utför ett ca 2 cm hudsnitt, parallellt med ländkotapelten.
- Använd vass sax, gör ett snitt i bukväggen. Ta en äggstockscancer fett pad med pincett, och dra ut äggstocken och äggledaren och placera dem på gasväv som är fuktad med 0,9% NaCl.
- Sug M2 medium, tre bubblor av luft, och embryona i överföringen kapillär. Rekommenderat totalt antal embryon som ska överföras (ensidiga eller bilaterala): dräktiga hondjur (≤ 15–16 embryon), pseudopregnant hona (≤ 30 embryon).
- Gör ett litet snitt i äggledaren (mellan infundibulum och ampulla) med hjälp av mikrosax, och sätt in överföringspipet i äggledaren.
- Utvisa försiktigt embryon och luftbubblor från pipetten till äggledaren. Med trubbiga pincett, placera reproduktionsorganen tillbaka i bukhålan.
- Sutur bukväggen med polyglykolsyra absorberbara suturer och stäng huden snitt med sår klipp. Beroende på antalet embryon som finns tillgängliga, upprepa detta förfarande för den andra äggledaren.
- Injicera djuret intraperitoneally med atipamezole (0,5 mg/kg) för att vända effekten av anestesi.
- Överför djuret till en ren bur och hålla den på en värmande platta för att helt återhämta sig från anestesi. Leverans hos råttor sker efter ~21 dagar.
OBS: När hanråttor BN-råttor används för parning är endast vita ungar potentiellt transgena. bruna ungar är från naturlig graviditet. - Samla vävnadsfragment (helst från örat) till genotyp 3 veckor gamla valpar.
- Förbered fostermödrar genom att para ihop sexuellt mogna SD-honor med fertila BN-män eller med vasektomiserade SD-män (vasektomiproceduren beskrivs i avsnitt 3 nedan) dag 3 (för överföring av embryon i encelligt stadium) eller dag 4 (för överföring av embryon i tvåcellsstadiet).
3. Vasektomi
OBS: Före operationsdagen, autoklavsax, fina pincett och nålhållare.
- Bedöva en 5 veckor gammal hanråtta med i.p. administrering av ketamin (50 mg/kg) och medetomidinlösning (0,5 mg/kg). Test för reflexer för att bekräfta anestesi innan det kirurgiska ingreppet påbörjas.
- Administrera tolfenamic syra (2 mg/kg), butorphanol tartrate (1 mg/kg), och enrofloksacin (5–10 mg/kg) subkutant för att förhindra inflammation, smärta och infektion, respektive.
- Applicera oftalmisk salva smörjning på båda ögonen för att förhindra hornhinnans torkning. Placera råttsvinet på en ren yta på en värmedyna och sterilisera huden på testiklen med kirurgisk skrubb följt av 70% alkohol med sterila icke-vidhäftande kuddar. Låt huden torka. Täck råttan med en steril drapering med ett litet hål som skärs över testikorna. Tryck försiktigt på buken för att exponera testiklen i scrotal säcken.
- Använd kirurgisk sax, gör ett ~0,5 cm snitt i mitten av scrotal säcken. Placera mittlinjen väggen (vitaktig linje) mellan testikarna.
- Gör ett 5 mm snitt i testmembranet nära vänster sida av mittlinjen väggen.
- Tryck försiktigt testikelerna åt vänster och lokalisera vas deferens (mellan testikeln och mittlinjen) som en vit kanal med ett enda blodkärl.
- Dra försiktigt ut vas deferens ur scrotal säcken med hjälp av en urmakare s pincett. Håll vas deferens med ett par pincett, och skär den med fin sax (eller cauterize med glödheta tips av ett andra par pincett). Ta bort ett ~1 cm fragment av kanalen.
OBS: Om cauterization utförs, håll spetsen på det andra paret pincett i lågan. - Upprepa ovanstående procedur för den andra testiken. Sutur huden med polyglykolsyra absorberbara suturer och injicera djuret intraperitoneally med atipamezole (0,5 mg/kg).
- Placera råttan i en ren bur på en värmande platta tills djuret återhämtar sig från anestesi.
OBS: Män kan användas i testparingarna efter en ~ 2-veckors återhämtningsperiod. Efter sterilitet bekräftas, de kan användas för pseudopregnancy induktion.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Med hjälp av det protokoll som beskrivs häri producerades lentivirala vektorer som bar Syn-TDP-43-eGFP-konstruktionen (fysiska LV-titer = 3,4 x 108/μL) och kunde sedan användas för encelliga embryo subzonal injektioner. Endast embryon med två synliga pronuclei utsattes för förfarandet. Antalet injektioner av virus suspensioner fastställdes experimentellt. Hög implantation effektivitet och en samtidig brist på transgena avkomma ansågs indikatorer på ett otillräckligt antal viruspartiklar för framgångsrik transduktion. I detta fall ökade antalet injektioner. Den enda administrering av LV resulterade i födelsen av 20 F0-generation råttor, varav ingen var transgena. En ökning av antalet injektioner med en storleksordning resulterade inte i födelsen av råttor, men 100% av embryona utvecklades till tvåcellsstadiet. I efterföljande experiment ökade antalet injektioner med en jämfört med det värde för vilket avkomman erhölls. För varianten av två injektioner föddes åtta råttor, varav tre bekräftades bära transgenen (sammanfattad i tabell 1). En av grundarna överförde inte transgenen till avkomman. Antalet embryon som injicerades och överfördes i varje experimentell variant var 48 i varianterna LV x1 och LV x2 och 45 i LV x10. Tre fosterhonor användes för varje experimentell installation. Det valda tillvägagångssättet gjorde det möjligt att generera stabila transgena råttlinjer som uttryckte fusionsprotein TDP-43-eGFP under kontroll av den neuronala Synapsin-1-promotorn i hela centrala nervsystemet (figur 2A,B)14. Lentivirus-baserade transgenes resulterade i en enda kopia insättning av transgenen som framgår av qPCR (Figur 2C).
I den experimentella inställning som beskrivs ovan var överlevnadsgraden för de injicerade embryona 95%. Liknande resultat erhölls när samma metod användes för andra lentivirala vektorer som sammanfattas i tabell 2. Andelen embryon som överlevde pronukleära injektioner var betydligt lägre (29–45 %). Tabell 2 sammanfattar de representativa resultaten av implantationseffektiviteten hos manipulerade zygoter, med tanke på överföringen av pseudopregnant jämfört med gravida kvinnor. Användningen av icke-manipulerade embryon tillsammans med injicerade embryon rapporterades tidigare16. Våra övergripande resultat tyder på att dräktiga honråttor kan användas som fostermödrar med jämförbar effektivitet. Vi fick en liknande andel av implantation av utländska embryon i gravida och pseudopregnant råttor (totalt genomsnitt för flera experimentella inställningar: 15% vs. 16%). Implantationsfrekvensen var dock högre när embryona genomgick mer subtil manipulation, vilket innebär en subzonal injektion (10% jämfört med 21%). Noterbart är att de numeriska data som analyserades för enskilda omgångar av mikroinjektion visade att implantationens effektivitet berodde på antalet injektioner av ett embryo (tabell 1, sista kolumnen) och indirekt berodde på virusbelastning.
| Vektor | antal injektioner/embryo | antal embryon som injiceras | antal valpar | antal fostermödrar | antal transgena grundare | Implantationseffektivitet för varje variant |
| Syn-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
Tabell 1: Sammanfattning av antalet subzonal injektioner av zygoter med Syn-TDP-43WTlentivirala vektorer.
| Metod | Vektor | Titer/ Koncentration | Antal injicerade embryon | Överlevde embryon | Överlevnadsgrad | Antal fostermödrar | Antal valpar | Implantationseffektivitet | Graviditet (P) /Pseudopregnancy (PP) |
| PNI (på andra sätt) | TTYH1-Thy1-EGFP | 1 ng/μL | 1083 | 424 | 39% | 16 | 54 | 13% | Pp |
| PNI (på andra sätt) | H3mCherry (på ett sätt) | 0,5-2 ng/μL | 2229 | 647 | 29% | 29 | 67 | 10% | Pp |
| PNI (på andra sätt) | Syn-TDP-43-A315T | 2 ng/μL | 1256 | 562 | 45% | 31 | 42 | 7% | Pp |
| Lv | Syn-TDP-43-A315T | 8,7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | Syn-TDP-43 WT | 3,4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mcherry (LVH3mcherry) | 1,3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | Pp |
Tabell 2: Embryo överlevnad och implantation effektivitet, beroende på injektionsmetod som användes och graviditet kontra pseudopregnancy induktion. PNI, pronuclear injektion; LV, lentiviral vektor subzonal injektion.

Figur 1: Mikroskopiskt fotografi av encelligt råttembryo som förbereddes för subzonal lentiviral vektorinjektion. Embryot var immobiliserat med en pipett. Två pronuclei som innehöll moderns och faderliga genetiska material och polarkroppen är synliga. Skalstång = 20 μm. Klicka här för att se en större version av denna siffra.
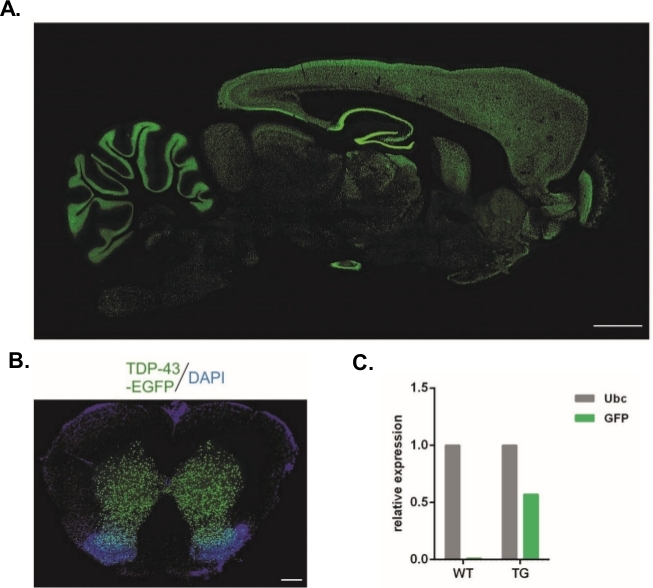
Figur 2: Generering av stabila transgena råttlinjer som uttryckte fusionsproteinet TDP-43-eGFP under kontroll av den neuronala Synapsin-1-promotorn i hela centrala nervsystemet. (A)Synapsin-1 (Syn)-driven hTDP-43-eGFP uttryck mönster i en sagittal del av den transgena råtta hjärnan. Skala bar = 3 mm.(B)Koronal del av ryggmärgen i en transgen råtta där eGFP fluorescens, kontratainrade med DAPI, var begränsad till grå substans i ryggmärgen. Skalstång = 250 μm. (C)Relativt uttryck för GFP transgene avskrift jämfört med ubiquitin C referens avskrift. n = 2 wildtype. n = 2 transgena. Siffran ändrades från14. Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Framsteg inom transgen teknik har gjort gnagare modeller ett ovärderligt verktyg inom biomedicinsk forskning. De ger möjlighet att studera genotyp-fenotyp relationer in vivo. Här presenterar vi ett allmänt tillgängligt alternativ för konventionell transgenes genom pronukleära injektioner. Användningen av lentiviral gentransduktion kringgår behovet av krävande mikroinjektioner eftersom virusvektorer kan injiceras under zona pellucida. Detta tillvägagångssätt påverkar inte embryointegriteten, vilket i huvudsak garanterar en 100% överlevnad för injicerade zygoter. Transgenet som ingår med hjälp av lentivirala vektorer är stabilt integrerad i värdgenomet, vilket möjliggör långsiktiga uttryck och sett överföring. Dessutom presenterar vi två alternativa tekniker för modifierad embryoöverföring till fostermödrar. En teknik använder embryo överföring till pseudopregnant honor som tidigare utarbetats genom parning med vasectomized infertila män. Den andra tekniken är baserad på användning av naturligt gravida honor som paras med fertila hanar men med en annan pälsfärg (dvs. BN råttor). Denna mer fysiologiska graviditet tillåter en korrekt utveckling av embryon som genomgår utmanande genetiska modifieringar16.
De första framgångsrika försöken att generera transgena råttor rapporterades 19907. Men på grund av svårigheter i råtta transgenes17, ett relativt litet antal transgena råtta linjer har genererats under de senaste decennierna9. Flera huvudsakliga skillnader observeras mellan mus och råtta transgenes med microinjections. För råttor används huvudsakligen outbred linjer (t.ex. Wistar och SD) för transgenes. För möss, forskare använder främst F1 korsning av inavlade stammar på grund av deras högre fertilitet, bättre svar på hormonella superovulation, och relativt enkel utveckling av embryon in vitro från encelliga scenen till blastocysts18. Induktion av superovulation hos råttor är mycket mindre effektiv än hos möss med standard PMSG/hCG hormonstimulering. Av denna anledning, försök har gjorts att utveckla alternativa protokoll för att administrera dessa hormoner hos råttor som använder kontinuerlig FSH infusion istället för en enda PMSG administration19. Superovulation som orsakas av PMSG/hCG eller FSH/hCG har dock visat sig ha jämförbar effektivitet20. Enligt vår mening är den mest kritiska faktorn som påverkar superovulationens effektivitet åldern på utvalda kvinnor. De exakta parametrarna bör dock testas för varje råttastam, laboratorium etc.
Förfarandet för att injicera DNA-lösning i pronucleus av ett encelligt embryo är liknande för båda gnagare arter. Pronuclei av råttzygoter har dock inte så vanliga former som hos möss och tenderar att vara svårare att definiera i cellens cytoplasma. Dessutom är råttzygotcellmembranet och pronukleära membranet mer elastiska och trögflytande, vilket komplicerar införandet av en mikropipette av glas som är laddad med DNA-lösning. Dessa faktorer leder till lägre råttäggsöverlevnad efter mikroinjektionen (31–65 % jämfört med 80 % hos möss) och förklarar den lägre transgeneseffektiviteten hos råttor9. Dessutom kan intensiv, mekanisk manipulering av embryot också påverka implantationseffektiviteten, som i många laboratorier, inklusive våra, når maximalt 10%. Denna relativt låga avkastning observeras även efter implantation av ett lämpligt antal embryon21.
En metod som övervinner de ovan nämnda svårigheterna är infektionen av encelliga embryon med retrovirus. Retrovirus innehåller genetiskt material i form av RNA, som vid inträde i den infekterade cellen transkriberas till DNA genom omvänd transkriptas av viruset. DNA transporteras sedan genom kärnporerna till cellkärnan, där det integreras i cellens arvsmassa i form av ett provirus. Lentivirala vektorer har använts för att generera transgena möss och råttor12,,14,22. Encelliga embryon som saknar en zona pellucida kan inkuberas i en lösning med en lentiviral vektor, eller vektorn kan injiceras under zona pellucida i perivitelline utrymmet. Den största fördelen med denna metod är dess extremt höga effektivitet och når mer än 80% av de transgena avkomman. Efter infektion med den lentivirala vektorn, många kopior på olika platser kan integreras i zygotgenomet, i motsats till transgenesmetoden genom pronuclear microinjection, där en integration webbplats vanligtvis observeras12. Hos avkommor till den transgena grundaren som görs med hjälp av lentivirala vektorer, är enskilda kopior av transgenen segregerade, vilket kan manifesteras av olika uttrycksprofiler av transgenen i var och en av avkomman. Detta kan dock öka risken för att få ett ämne med önskad uttrycksprofil som härleds från transgenen. Begränsningarna gäller huvudsakligen transgenens storlek, som är begränsad till cirka 8 kb23.
En annan svårighet i råtta transgenes är den generation av honor som fungerar som surrogatmödrar för genetiskt modifierade embryon. I standardförfarandet korsas honor med sterila vasectomiserade män för att inducera pseudopregnancy. Hos råttor är pseudopregnancy bedömningsteknik mycket svårare än hos möss, så stimulering med gonadotropin släppa hormon agonist används ibland några dagar innan parning med män. Av dessa skäl erbjuder vi i det beskrivna protokollet två alternativa metoder för att få fostermödrar. Den totala implantation effektiviteten av manipulerade zygoter när gravida eller pseudopregnant honor används är liknande. Förekomsten av naturliga, icke-manipulerade embryon tillsammans med manipulerade kan dock förbättra graviditetsfrekvensen16. Även om den största skillnaden i implantation är manipulationstekniken (dvs. PNI vs LV, 10% jämfört med 20%; se tabell 2), kan användningen av pseudopregnant honor som fostermödrar vara till nytta för vissa experiment.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författaren (W.K.) har rätt till patentet, "Metod för framställning av ett transgent djur", från Polens patentverk (nr P 355353; 21.03.2008).
Acknowledgments
Denna studie stöddes av Animod-projektet inom Team Tech Core Facility Plus-programmet från Stiftelsen för polsk vetenskap, som medfinansierades av Europeiska unionen inom ramen för Europeiska regionala utvecklingsfonden till WK.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



