Summary
Bu makalede, zigot perivitellin uzaya bir virüs süspansiyon birden fazla enjeksiyon kullanarak sıçan embriyolarında lentiviral transgenez için metodoloji sağlamayı amaçlamaktadır. Farklı bir baskın kürk rengi ile doğurgan bir erkek zorlanma ile çiftleştirilmiş dişi sıçanlar sözde hamile koruyucu anneler oluşturmak için kullanılır.
Abstract
Transgenik hayvan modelleri modern biyomedikal araştırmalar için temelde önemlidir. Yabancı genlerin erken fare veya sıçan embriyolarına dahil edilmesi canlı organizmalarda gen fonksiyon analizi için paha biçilmez bir araçtır. Standart transgenez yöntemi, döllenmiş bir yumurtanın pronüklesine yabancı DNA parçalarının mikroenjekte edilmesine dayanır. Bu teknik farelerde yaygın olarak kullanılır ancak diğer hayvan türlerinde nispeten verimsiz ve teknik olarak zorlayıcı dır. Transgen aynı zamanda lentiviral enfeksiyon yoluyla tek hücreli embriyolar içine girişlenebilir, standart pronükleer enjeksiyonlar için etkili bir alternatif sağlayan, özellikle tür veya daha zorlu bir embriyo yapısı ile suşları. Bu yaklaşımda, lentiviral vektörler içeren bir süspansiyon, teknik olarak daha az talep ve daha yüksek bir başarı oranına sahip bir döllenmiş sıçan embriyosu perivitellin uzayiçine enjekte edilir. Lentiviral vektörlerin, kararlı transgenik çizgilerin oluşumunu belirlemek için transgeni genoma etkin bir şekilde dahil etmek için gösterilmiştir. Bazı sınırlamalar rağmen (örneğin, Biyogüvenlik Düzey 2 gereksinimleri, DNA parça boyutu sınırları), lentiviral transgenez hızlı ve etkili bir transgenez yöntemidir. Ayrıca, farklı bir baskın kürk rengi ile doğurgan bir erkek zorlanma ile çiftleştirilmiş dişi sıçanlar kullanarak sözde hamile koruyucu anneler oluşturmak için bir alternatif olarak sunulmaktadır.
Introduction
Uzun yıllar boyunca, fare ve fare gibi laboratuvar kemirgenleri, insan fizyolojik ve patolojik koşulları modellemek için kullanılmıştır. Hayvan araştırmaları başka yollarla ulaşılamayan keşiflere yol açmıştır. Başlangıçta, genetik çalışmalar yakından insan durumunu taklit etmek için kabul edilir spontan meydana gelen bozuklukların ve fenotiplerin analizi üzerinde duruldu1. Genetik mühendislik yöntemlerinin geliştirilmesi, belirli genlerin istenilen fenotipi elde etmek için tanıtılmasına veya silinmesine olanak sağlamıştır. Bu nedenle, transgenik hayvanların üretimi, canlı organizmalarda gen fonksiyonunun incelenmesine olanak sağlayan modern araştırmalarda temel bir teknik olarak kabul edilmektedir.
Transgenik hayvan teknolojisi deneysel embriyoloji ve moleküler biyolojideki başarıların bir kombinasyonu ile mümkün olmuştur. 1960'larda, Polonyalı embriyolog A. K. Tarkowski geliştirme nin erken aşamalarında fare embriyo manipülasyon u ilk çalışma yayınladı2. Buna ek olarak, moleküler biyologlar, yabancı DNA'nın hayvanın genomuna diğer adıyla girişi için DNA vektörleri (yani taşıyıcılar) oluşturmak için teknikler geliştirdiler. Bu vektörler, yapılan araştırmanın türüne bağlı olarak seçilen genlerin yayılmasına ve uygun modifikasyonlarına izin verir. Terim "transgenik hayvan" Gordon ve Ruddle3tarafından tanıtıldı.
Nörobiyoloji, fizyoloji, farmakoloji, toksikoloji ve biyolojik ve tıbbi bilimlerin diğer birçok alanda kullanılan ilk yaygın olarak kabul edilen türler Norveç sıçan, Rattus norvegicus4oldu. Ancak, fare embriyoları manipüle zorluk nedeniyle, ev fare Mus musculus genetik araştırma5baskın hayvan türleri haline gelmiştir. Bu tür araştırmalarda farenin önceliğinin bir diğer nedeni de bu tür için nakavt hayvanlar üretmek için embriyonik kök hücre teknolojisinin kullanılabilirliğiydi. Transgenezin en yaygın kullanılan tekniği (transgenik yavruların tüm doğan hayvanlara göre %2-10'u) DNA parçalarının döllenmiş bir yumurtanın pronüklesine mikroenjeksiyonudur. 1990 yılında, ilk farelerde tanıtılan bu yaklaşım, sıçanlar için uyarlanmıştır6,7. Pronükleer enjeksiyon ile sıçan transgenezi daha düşük verimlilik ile karakterizedir8 fareler ile karşılaştırıldığında, hangi kesinlikle elastik plazma ve pronükleer membranların varlığı ile ilgilidir9. Manipülasyon sonrası embriyoların sağkalım% 40-50 farelerde daha düşük olmasına rağmen, bu teknik genetik olarak modifiye sıçanların üretiminde bir standart olarak kabul edilir10. Enjekte edilen zigotların verimli transgen birleşmesini ve daha yüksek sağkalım oranlarını garanti eden alternatif yaklaşımlar araştırılmıştır.
Kararlı transgen ekspresyonu ve döle iletiminin temel belirleyicisi konak hücre genomuna entegrasyonudur. Lentiviruses (LVs) hem bölücü hem de bölücü olmayan hücreleri enfekte edebilmek ayırt edici bir özelliğe sahiptir. Heterolog genlerin embriyolara dahil edilmesi için bir araç olarak kullanılmaları son derece verimli olduğu kanıtlanmıştır11, ve transgenik bireyler dahil DNA parçasının kararlı ifadesi ile karakterizedir. Lentiviral vektörlerin etkinliği farelerin genetik modifikasyonu için teyit edilmiştir12,13, sıçanlar12,14, ve diğer türler11. Bu yöntemde, LV süspansiyon iki pronüklei aşamasında embriyozon pellucida altında enjekte edilir. Oolemma etkilenmemiş kalır, çünkü bu teknik aslında embriyoların% 100 sağkalım garanti eder. Yüksek kaliteli ve nispeten yüksek konsantrasyonlu LV süspansiyonların üretimi önemli faktörlerdir. Ancak, LV süspansiyonlar düşük konsantrasyonlarda tekrarlanan enjeksiyonlar ile aşılabilir11, membran entegrasyonu etkilemezken yumurta yüzeyinde viral parçacıkların miktarını artırır. Perivitellin uzaya tekrarlanan enjeksiyonlara maruz kalan embriyolar daha da gelişir ve transgeni mikrop hattı yoluyla transgeni iletebilirler. Lentiviral transgenezi ile transgenik sıçan oluşumunun etkinliği %8012'yekadar çıkabilir.
Burada, veziküler stomatit virüsü (VSV) G zarf proteini ile psödotiplenmiş HIV-1-türetilmiş rekombinant lentivirus üretimini açıklıyoruz. İkinci nesil ambalaj sistemi VSV psödotipinin kullanımı viral parçacıkların geniş enfekteliğini belirler ve ultrasantrifüj ve kriyoopreserved ile konsantre edilebilir son derece kararlı vektörlerin üretimine olanak sağlar. Titer doğrulama sonra, vektörler albino Wistar sıçan zigotlar içine transgen teslim için bir araç olarak kullanılmak üzere hazır. Enjeksiyonlar bir dizi sonra, embriyolar bir gecede kültürlü ve anneleri beslemek için iki hücreli aşamada transfer edilebilir. Bu noktada, iki alternatif yaklaşımlardan biri düşünülebilir. Standart prosedür embriyo alıcıolarak sözde hamile kadın kullanır. Ancak, vazektomi yapılan erkeklerle çiftleştikten sonra gebelik oranı düşük olduğunda, embriyolar koyu kürk renginde (örn. Kahverengi Norveç [BN] sıçanlar gibi doğurgan erkek sıçanlarla çiftleştirilmiş hamile Wistar/Sprague-Dawley (SD) dişilere yerleştirebilir. Kürk rengi transfer manipüle embriyolar kaynaklanan yavrulardan doğal gebelik yavrularının ayrım sağlar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Viral vektörlerin üretimi ve uygulanması Biyogüvenlik Düzey 2 yönergelerine uygun olarak ve Polonya Çevre Bakanlığı tarafından onaylanmıştır. Aşağıda açıklanan tüm deneysel hayvan prosedürleri Yerel Etik Komitesi tarafından onaylanmıştır. Hayvanlar stabil sıcaklıkta (21-23 °C) ve nem (%50-60) ayrı ayrı havalandırılan kafeslerde barındırıldı. 12 h/12 h ışık/karanlık döngüsü altında su ve gıda reklam libitum erişimi ile.
1. Lentiviral vektör üretimi
- HEK 293T hücrelerinin transfeksiyonu
NOT: Burada sunulan protokol, yaklaşık 200 mL ham vektör süpernatant üreten yirmi Ø10 cm kültür yemeklerinin transfeksiyonu için tasarlanmıştır.- DMEM ortamda 37 °C'de nemlendirilmiş CO2 kuluçka makinesinde fetal büyükbaş serum (%10, v/v) ile takviye edilen Kültür HEK 293T hücreleri. Transfeksiyon için, yirmi 10 cm çapında plakalar hazırlamak ve tohum 1.5-2 x 106 HEK 293T çanak başına hücreleri.
- Birleştiğinde ~%70'e ulaştığında, hücreleri polietilenin (PEI) reaktifi pH 7.0 kullanarak 1 μg DNA'da 3 μg PEI oranında transfect.
- Transfeksiyon karışımını beş tabak için hazırlayın (toplam tabak sayısına göre tekrar sayısını hazırlayın). Dulbecco'nun Modifiye Kartal Orta (DMEM) 1 mL için, üç plazmid karışımı ekleyin böylece VSVg plazmid 25 μg, delta R8.2 50 μg ve kodlama plazmid 50 g nihai bir miktar ulaşmak.
- Pipet yukarı ve aşağı, ve 3 μg/μL konsantrasyonda 125 μL PEI ekleyin. Plaka başına transfeksiyon karışımı200 μL ekleyin. Daha sonra, 37 °C'de nemlendirilmiş co2 kuluçka makinesinde plakaları kuluçkaya yatırın.
- Lentiviral vektörlerin konsantrasyonu
- Transfeksiyondan kırk sekiz saat sonra, LV parçacıkları içeren ortamı hasat edin. 50 mL konik tüpler kullanın.
NOT: Floresan etiketli bir plazmid kullanırken, hücreler transfeksiyon verimliliğini doğrulamak için bu noktada görselleştirilebilir. DMEM ortamının yeni bir kısmı eklenebilir ve hücreler ek olarak 24 saat kuluçkaya yatırılabilir. LV verimi transfeksiyon sonrası 48 ve 72 saat zaman noktalarında toplandığında karşılaştırılabilir. - Ayrılmış hücreleri kaldırmak için 5 dakika ve oda sıcaklığında 3.000 x g orta santrifüj.
- Supernatant 'ı (0,45 m) filtreleyin ve yeni tüplere dökün.
NOT: Bu adım atlanabilir. - DNase I (RNase içermez, 1 μg/mL) ve MgCl2 (1 mM) ekleyin ve 37 °C'de 15 dakika boyunca bir su banyosunda kuluçkaya yatırın.
- Orta yı tek kullanımlık polietilen tüplere aktarın ve 115.000 x g ve 4 °C'de 1,5 saat boyunca sallanan bir rotorda ultracentrifuge'a aktarın.
- Santrifüjden sonra tüplerin duvarlarını orta kalıntılardan hafifçe boşaltın.
- Peleti steril fosfat tamponlu salin (PBS; tüp başına 70-80 μL) ile ıslatın.
- 4-8 °C'de 2 saat kuluçka.
- PBS'deki viral vektörleri nazik pipetleme ile yeniden askıya alın.
DİkKAT: Köpürmekten kaçının. - 1,5 mL santrifüj tüpüne ve santrifüje 7.000 x g ve 4 °C'de 30 s. Süpernatant'ı yeni bir tüpe aktarın. Hücresel enkaz peleti görünmeyene kadar bu adımı tekrarlayın.
- Aliquot ve -80 °C'de dondurun. LV aliquot'u yeniden dondurmaktan kaçının.
- Transfeksiyondan kırk sekiz saat sonra, LV parçacıkları içeren ortamı hasat edin. 50 mL konik tüpler kullanın.
- Kantitatif polimeraz zincir reaksiyonu kullanılarak virüs titresinin tayini
NOT: Viral vektörlerin titrasyonu nicel PCR (qPCR) kullanılarak gerçekleştirilir. Bu yöntem, viral genomun uzun terminal tekrar bölgesi içinde çift iplikli 84 bp uzunluğunda DNA parçasının yükseltilmelerine dayanmaktadır15.- 1:500, 1:1.000, 1:5.000, 1:10.000, 1:100.000 ve 1:1.000.000: LV kodlama plazmid seri seyreltme yaparak standart eğrihazırlayın. Standart eğri için kullanılan plazmidkopya sayısını belirleyin. Aşağıdaki formülü kullanın: kopya sayısı/μL = (konsantrasyon [g/μL] x 6,02 x 1023 [sayı/mol]) / (660 [g/mol] x plazmid boyutu [bp]), 6,02 x 1023 sayı/mol Avogadro'nun sayısı dır ve 660 g/mol bp ağırlığıdır.
NOT: Çevrimiçi kopya numarası hesap makineleri kullanılabilir. - Lentiviral süspansiyon un seyreltmelerini hazırlayın: 1:100, 1:500 ve 1:1,000.
- Reaksiyon karışımını (kuyu başına hacimler): 10 μL qPCR Mastermix, 1 μL 10 μM Forward astar, 1 μL 10 μM ters astar ve 7 μL H2O. Pipet karışımı 96 kuyulu plakaların kuyularına yerleştirin.
NOT: İleri astar: 5'-AGCTTGCCTTGAGTGCTTCA. Ters astar: 5'-TGACTAAAAGGGTGAGGGA. - Trilikat olarak her standart seyreltme ve lentiviral süspansiyon 1 μL ekleyin.
- QPCR'ı aşağıdaki parametrelere göre çalıştırın: 2 dk için 50 °C, 5 dk için 96 °C ve 20 s için 96 °C'nin 35 döngüsü, 40 s için 60 °C ve 1 dk için 70 °C, ardından erime eğrisi aşaması: 1 dk için 95 °C ve 30 sn'da 60 °C.
- Her seyreltme için alınan molekül sayısını standart eğriyle karşılaştırarak sonuçları analiz edin. Her seyreltme için üç çoğaltma ortalaması olarak vektör moleküllerinin konsantrasyonu belirleyin.
NOT: Sunulan nicelik viral parçacıkların fiziksel konsantrasyonunu verir. Fonksiyonel bir titre olarak ele alınmamalıdır.
- 1:500, 1:1.000, 1:5.000, 1:10.000, 1:100.000 ve 1:1.000.000: LV kodlama plazmid seri seyreltme yaparak standart eğrihazırlayın. Standart eğri için kullanılan plazmidkopya sayısını belirleyin. Aşağıdaki formülü kullanın: kopya sayısı/μL = (konsantrasyon [g/μL] x 6,02 x 1023 [sayı/mol]) / (660 [g/mol] x plazmid boyutu [bp]), 6,02 x 1023 sayı/mol Avogadro'nun sayısı dır ve 660 g/mol bp ağırlığıdır.
2. Transgenik sıçanların üretimi
- Döllenmiş embriyoların süperovülasyonu ve toplanması
- Gonadotropinleri uygulayın.
NOT: Toplanan embriyo sayısını artırmak için (kadın başına yaklaşık 30), hormonal stimülasyon için olgunlaşmamış 5 haftalık Wistar dişikullanın.- 1. Günde (12:00-1PM), intraperitoneally gebe mare serum gonadotropin enjekte (PMSG; 25 Kadın başına IU). Hormon tozunu %0,9 NaCl'de eriterek 125 IU/mL konsantrasyonda 1 mL çalışma çözeltisi hazırlayın. -20 °C'de 1 aya kadar veya -80 °C'de 6 aya kadar saklayın.
- 3. günde (12 PM-1 PM), intraperitoneally enjekte insan koryonik gonadotrophin (hCG; kadın başına 30 IU). Hormon tozunu %0,9 NaCl'de eriterek 1 mL çalışma çözeltisi (150 IU/mL) hazırlayın. -20 °C'de 1 aya kadar veya -80 °C'de 6 aya kadar saklayın.
- HCG uygulamasından sonra, eş kadın 1:1 cinsel doğurgan erkekler (3-10 aylık) ile.
- Ertesi sabah (gün 4 8-10 AM), bir vajinal fiş varlığı için kadın kontrol edin. En iyi görüntüleme için miyetgecesinden sonra sabah erken saatlerde kontrol edilmelidir beyazımsı bir miyon fiş varlığı için vajinal açılış kontrol edin. Embriyo toplama için, görünür bir fiş ile sadece kadın kullanın.
- 10:00'da embriyoları toplayın. Oviducts çıkarmak için hayvanları kurban ve önceden ısıtılmış M2 orta ile bir tabak içinde oviducts toplamak.
- Oviduct'ları, 0,5 mg/mL konsantrasyonla büyükbaş testislerinden hyaluronidaz ile önceden ısıtılmış M2 ortamı içeren 35 mm'lik bir tabağa aktarın.
- Oviduct'in duvarlarını stereomikroskop altında ince çömleçler kullanarak açın ve embriyolar serbest bırakılıncaya kadar ampulla (yani kümülüs hücreleri yle çevrili döllenmiş embriyolar içeren oviduct'in şişmiş kısmına) basın.
NOT: Hyaluronidase enzimatik olarak kümülüs hücrelerini sindirir ve embriyoları serbest bırakarak.
DİkKAT: Hyaluronidase uzun süreli maruz kalma embriyolar için zararlıdır; bu nedenle, bu adım en fazla 5 dakika sürmelidir. - Embriyoların kümülüs hücrelerinden salınımını kolaylaştırmak için, ağızdan işletilen bir aspiratör tüpüne bağlı cam transfer pipetini kullanarak onları yavaşça yukarı ve aşağı pipetleyin.
- Transfer pipetüretmek için, düz ~ 5-10 cm ucu üretmek için bir alev üzerinde bir cam Pasteur pipet çekin. ~4 cm'lik bir uç bırakarak pipeti kırın.
- Hyaluronidase ve hücresel enkaz kaldırmak için M2 orta embriyolar birkaç kez yıkayın. Embriyoları % 5 CO2 atmosfere sahip nemlendirilmiş 37 °C kuvözde, sıvı parafin veya mineral yağ la kaplı önceden dengelenmiş M16 ortamı (~50°L) damlaları içeren 60 mm'lik bir tabağa aktarın.
- Gonadotropinleri uygulayın.
- Zona pellucida altında tek hücreli embriyo merceksi viral vektörlerin mikroenjeksiyon
NOT: Mikroenjeksiyon için iki görünür pronüklei içeren tek hücreli evreli embriyolar kullanın (Şekil 1).- Kalan hücresel enkaz pelet 2 dakika için oda sıcaklığında ve santrifüj 10.000 x g ve RT LV aliquot çözültün.
- Mikroenjeksiyon kurulumu
- Bir mikroforge kullanarak cam tutma pipetleri (borosilikat cam kılcal) hazırlayın. 5-10 cm'lik bir uç üretmek için cam kılcal damarı bir alevin üzerine çekin. ~4 cm'lik bir uç bırakarak pipeti kırın. Dış çapı ~80-120 μm olmalıdır.
NOT: Pipet ucunun mükemmel düz ve pürüzsüz olduğundan emin olun. - Çekilen pipetleri, ısıtma filamentinin önünde ucu yla bir mikroforge halinde monte edin. Filamenti pipet ucuna çok yakın ısıtın ve ~15 μm (embriyo büyüklüğünün yaklaşık %20'si) çapına küçülmesine izin verin. Pipeti, pipet ucundan 2-3 mm uzaklıktaki ısıtma filamentine dik olarak yerleştirin ve ısıtmaya başlayın. Cam yumuşayacak. 15° açıya ulaşana kadar ısıtın.
- Bir pipet çekmece kullanarak bir filament ile mikroenjeksiyon borosilikat cam kılcal hazırlar. Kılcal damarı çekme odasına yerleştirin. Bir rampa testi çalıştırın (yeni cam için ilk kez ve filament değiştirdikten sonra her zaman). Isı'yı rampa değerine -10, Çekme'yi 100'e, Hızı 150'ye ve Zaman'ı 100'e ayarlayın.
NOT: En uygun enjeksiyon kılcal damarı elde etmek için parametreleri değiştirin. - Biyogüvenlik laminar akış kaputu altında, viral çözeltinin yaklaşık 2 μL'sini mikroyükleyici ucuyla mikroenjeksiyon pipete yükleyin.
- Sıvı parafin veya mineral yağ la kaplı 100°L M2 orta (ortada) içeren bir mikroenjeksiyon kabı (60 mm Petri kabıkapağı) hazırlayın.
- Ters bir mikroskop altında bir mikromanipülatör ve mikroenjeksiyon çanağı viral çözelti ile yüklenir tutma pipet ve mikroenjeksiyon kılcal monte.
- Bir mikroforge kullanarak cam tutma pipetleri (borosilikat cam kılcal) hazırlayın. 5-10 cm'lik bir uç üretmek için cam kılcal damarı bir alevin üzerine çekin. ~4 cm'lik bir uç bırakarak pipeti kırın. Dış çapı ~80-120 μm olmalıdır.
- Mikroenjeksiyonu gerçekleştirin.
- 15-20 tek hücreli embriyoyu mikroenjeksiyon kabındaki M2 damlasına aktarın. Bir tutma pipetkullanarak embriyo tutun.
- 400x büyütme kullanarak, otomatik bir enjektöre bağlı cam kılcal kullanarak perivitellin alana zona pellucida altında LV çözeltisi enjekte. Bir an için zona pellucida altında kılcal tutun.
NOT: Hafif pozitif basınç kullanılarak, viral çözelti enjeksiyon kılcal damarDan sürekli olarak akar, ancak teslim edilen süspansiyonun hacmi kontrol edilemez. - İnce bir pipet kullanarak, embriyoları %5 CO2 atmosferinde 37 °C'de kuvözdeki kültür kabına geri getirin. Bir zigotun enjeksiyon sayısı değişebilir ve viral vektör konsantrasyonuna göre uyarlanabilir.
NOT: Enjekte edilen embriyolar, tek hücreli evrede koruyucu annelere transfer edilebilir veya iki hücreli aşamada transfer edilmeden önce M16 ortamda o/n inkübe edilebilir. Sıçan embriyolarının uzun süreli in vitro kültüründen kaçınılmalıdır.
- Enjekte edilen embriyoların koruyucu annelere transferi
- Doğumla olgun sd erkek veya vazektomi SD erkek (vazektomi prosedürü bölüm 3 aşağıda açıklanan) ile cinsel olgun SD kadın çiftleşme tarafından foster anneler hazırlamak gün 3 (tek hücreli aşamada embriyo transferi için) veya gün 4 (iki hücreli aşamada embriyo transferi için).
NOT: Oviduct transferi için, 0,5 gün sonra coitum (dpc) dişikullanın. - Ertesi sabah, vajinal fiş için SD kadın kontrol edin ve sadece görünür bir fiş ile kullanın.
- Embriyo transferi gerçekleştirin.
NOT: Cerrahi işlemi stereomikroskop altında steril aletlerle gerçekleştirin. Ameliyat gününden önce, otoklav makas, ince forceps, iğne tutucu ve neşter tutucu.- Ketamin (50 mg/kg) ve medetomidin (0.5 mg/kg) çözeltisi i.p. uygulaması ile bir dişiyi anesteziedin. Cerrahi işlem başlamadan önce anestezi onaylamak için refleksler için test edin.
- İltihabı, ağrıyı ve enfeksiyonu önlemek için hayvana subkutan olarak tolefenamik asit (2 mg/kg), butorphanol tartarat (1 mg/kg) ve enrofloksacin (5-10 mg/kg) enjekte edin.
- Korneanın kurumasını önlemek için her iki göze de oftalmik merhem yağlanması uygulayın. Kürkü arkadan tıraş edin ve cildi cerrahi scrub ile sterilize edin ve ardından %70 alkol le yapışmaz pedler kullanarak. Cildin kurumasını bekleyin.
- Hayvana subkutan olarak %0,25 bupivacaine (lokal anestezik) enjekte edin. Cerrahi mikroskop amacı altında bir ısıtma yastığı üzerinde temiz bir yüzeye eğilimli bir pozisyonda hayvan aktarın. Alt sırt üzerinde kesilmiş küçük bir delik ile steril bir perde ile sıçan kapağı.
- Lomber vertebral kolona paralel olarak yaklaşık 2 cm deri kesisi yapın.
- Keskin makas kullanarak, karın duvarında bir kesim yapmak. Forceps kullanarak bir yumurtalık yağ yastığı kapmak ve yumurtalık ve oviduct çekin ve gazlı bez üzerine yerleştirin 0.9% NaCl ile ıslanır.
- Aspire M2 orta, hava üç kabarcıklar, ve transfer kılcal içine embriyolar. Transfer edilmesi önerilen toplam embriyo sayısı (tek taraflı veya iki taraflı): gebe kadın (≤ 15-16 embriyo), psödoge gebe kadın (≤ 30 embriyo).
- Mikro makas kullanarak oviduct (infundibulum ve ampulla arasında) küçük bir kesi yapın ve oviduct transfer pipet eklemek.
- Yavaşça oviduct için pipet gelen embriyolar ve hava kabarcıkları dışarı. Künt forceps ile, karın boşluğunda geri üreme yolu yerleştirin.
- Poliglikolik asit emilebilir dikişler ile karın duvarı dikiş ve yara klipleri ile cilt kesi kapatın. Mevcut embriyo sayısına bağlı olarak, diğer oviduct için bu işlemi tekrarlayın.
- Anestezinin etkisini tersine çevirmek için hayvana intraperitoneal atipamezole (0.5 mg/kg) enjekte edin.
- Temiz bir kafese hayvan aktarın ve anestezi tamamen kurtarmak için bir ısınma plaka üzerinde tutmak. Sıçanlarda doğum ~ 21 gün sonra gerçekleşir.
NOT: Erkek BN sıçanlar çiftleme için kullanıldığında, sadece beyaz yavrular potansiyel olarak transgeniktir; kahverengi yavrular doğal gebelikten. - Doku parçalarını (tercihen kulaktan) 3 haftalık yavrulara kadar genotip toplayın.
- Doğumla olgun sd erkek veya vazektomi SD erkek (vazektomi prosedürü bölüm 3 aşağıda açıklanan) ile cinsel olgun SD kadın çiftleşme tarafından foster anneler hazırlamak gün 3 (tek hücreli aşamada embriyo transferi için) veya gün 4 (iki hücreli aşamada embriyo transferi için).
3. Vazektomi
NOT: Ameliyat gününden önce otoklav makas, ince prifone ve iğne tutucu.
- Ketamin (50 mg/kg) ve medetomidin (0.5 mg/kg) çözeltisi i.p. uygulaması ile 5 haftalık erkek SD sıçan anestezi. Cerrahi işlem başlamadan önce anestezi onaylamak için refleksler için test edin.
- Sırasıyla inflamasyon, ağrı ve enfeksiyonu önlemek için tolfenamik asit (2 mg/kg), butorphanol tartatat (1 mg/kg) ve enrofloksain (5-10 mg/kg) subkutan olarak uygulayın.
- Korneanın kurumasını önlemek için her iki göze de oftalmik merhem yağlanması uygulayın. Bir ısıtma yastığı üzerinde temiz bir yüzeye sıçan supine yerleştirin ve cerrahi scrub ile testisler üzerinde sterilize% 70 alkol steril olmayan yapışma pedleri kullanarak takip. Cildin kurumasını bekleyin. Testisler üzerinde küçük bir delik kesilmiş steril bir perde ile sıçan kapağı. Skrotal kesedeki testisleri ortaya çıkarmak için karnına hafifçe bastırın.
- Cerrahi makas kullanarak, skrotal kese ortasında ~ 0,5 cm kesi yapmak. Testisler arasındaki orta çizgi duvarını (beyazımsı çizgi) bulun.
- Midline duvarın sol tarafına yakın testis membran5 mm kesi olun.
- Dikkatle sola testis itin ve vas deferens bulmak (testis ve orta hat arasında) tek bir kan damarı ile beyaz bir kanal olarak.
- Bir saatçinin püslerini kullanarak vas deferens'i skrotal keseden yavaşça çekin. Vas deferens bir çift forceps ile tutun ve ince makas ile kesin (veya ikinci bir çift forceps kırmızı-sıcak uçları ile cauterize). Kanalın ~1 cm'lik bir parçasını çıkarın.
NOT: Katuterizasyon yapılırsa, ikinci çift forceps'un ucunu alev içinde tutun. - Diğer testisler için yukarıdaki yordamı tekrarlayın. Cildi poliglikolik asit emilebilir dikişlerle süsler ve hayvana intraperitoneal olarak atipamezole (0.5 mg/kg) enjekte edin.
- Hayvan anestezi kurtarır kadar bir ısınma plaka üzerinde temiz bir kafese sıçan yerleştirin.
NOT: Erkekler ~ 2 haftalık iyileşme döneminden sonra test çiftleşmelerinde kullanılabilir. Kısırlık onaylandıktan sonra, psödogebelik indüksiyonu için kullanılabilir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Burada açıklanan protokol kullanılarak Syn-TDP-43-eGFP yapısını taşıyan lentiviral vektörler üretildi (fiziksel LV titresi = 3.4 x 108/l) ve daha sonra tek hücreli embriyo subzonal enjeksiyonları için kullanılabilir. Sadece iki görünür pronüklei olan embriyolar prosedüre tabi tutuldu. Viral süspansiyonların enjeksiyon sayısı deneysel olarak belirlendi. Yüksek implantasyon verimi ve aynı anda transgenik yavruların eksikliği başarılı transdüksiyon için yetersiz sayıda viral partikülün göstergesi olarak kabul edildi. Bu durumda enjeksiyon sayısı artırıldı. LV'nin tek yönetimi 20 F0-nesil sıçanın doğumuyla sonuçlandı, bunların hiçbiri transgenik değildi. Enjeksiyon sayısında bir büyüklük artışı sıçanların doğumuna yol etmemiş, ancak embriyoların %100'ü iki hücreli evreye gelişmiştir. Sonraki deneylerde, enjeksiyon sayısı bir oranında yavru elde edilen değeri ile karşılaştırıldığında artmıştır. İki enjeksiyonun varyantı için sekiz sıçan doğmuştur ve bunlardan üçünün transgeni taşıdığı doğrulanmıştır (Tablo 1'deözetlenmiştir). Kuruculardan biri transgeni yavruya aktarmadı. Her deneysel varyantta enjekte edilen ve aktarılan embriyo sayısı LV x1 ve LV x2 varyantlarında 48, LV x10'da ise 45 idi. Her deneysel düzeniçin üç koruyucu kadın kullanıldı. Seçilen yaklaşım tüm merkezi sinir sistemi boyunca nöronal Synapsin-1 organizatörü kontrolü altında TDP-43-eGFP füzyon proteinifade istikrarlı transgenik sıçan hatları nın nesil izin(Şekil 2A,B)14. Lentivirus tabanlı transgenezis, qPCR(Şekil 2C)tarafından gösterildiği gibi transgenin tek bir kopya takılması ile sonuçlanmıştır.
Yukarıda açıklanan deneysel kurulumda enjekte edilen embriyoların sağkalım oranı %95 idi. Benzer sonuçlar, Tablo 2'deözetlendiği gibi diğer lentiviral vektörler için de aynı yöntem kullanıldığında elde edilebildi. Pronükleer enjeksiyonlardan sağ kurtulan embriyoların yüzdesi anlamlı olarak daha düşüktü (%29-45). Tablo 2, sözde gebe ve hamile dişilerin transferi göz önünde bulundurularak, manipüle edilen zigotların implantasyon etkinliğinin temsili sonuçlarını özetleyilmiştir. Enjekte edilen embriyolar ile birlikte manipüle edilmeyen embriyoların kullanımı daha önce16bildirilmiştir. Genel sonuçlarımız, hamile dişi sıçanların karşılaştırılabilir verimlilikte koruyucu anne olarak kullanılabileceğini göstermektedir. Gebe ve psödoge gebe sıçanlara benzer bir yabancı embriyo implantasyonu yüzdesi elde ettik (çeşitli deneysel kurulumlar için genel ortalama: %15'e karşılık %16). Ancak embriyolar daha ince manipülasyon alıdığında implantasyon oranı daha yüksekti, bu da subzonal enjeksiyon anlamına geliyor (%10'a karşılık %21). Özellikle, mikroenjeksiyon bireysel turlar için analiz edilen sayısal veriler, implantasyonun etkinliğinin bir embriyonun enjeksiyon sayısına(Tablo 1, son kolon) bağlı olduğunu ve dolaylı olarak viral yüke bağlı olduğunu göstermiştir.
| Vektör | enjeksiyon sayısı/embriyo | enjekte edilen embriyo sayısı | yavru sayısı | koruyucu anne sayısı | transgenik kurucuların sayısı | Her varyant için implantasyon verimliliği |
| Syn-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
Tablo 1: Syn-TDP-43WTlentiviral vektörleri ile zigotların subzonal enjeksiyonlarının özeti.
| Yöntem | Vektör | Titer / Konsantrasyon | Enjekte edilen embriyo sayısı | Hayatta kalan embriyolar | Hayatta kalma oranı | Koruyucu anne sayısı | Yavru sayısı | İmplantasyon verimliliği | Gebelik (P) /Psödogebelik (PP) |
| PNI | TTYH1-Thy1-EGFP | 1 ng/μL | 1083 | 424 | 39% | 16 | 54 | 13% | S |
| PNI | H3mKiraz | 0.5-2 ng/μL | 2229 | 647 | 29% | 29 | 67 | 10% | S |
| PNI | Syn-TDP-43-A315T | 2 ng/μL | 1256 | 562 | 45% | 31 | 42 | 7% | S |
| Lv | Syn-TDP-43-A315T | 8,7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | Syn-TDP-43 WT | 3,4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mkiraz | 1.3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | S |
Tablo 2: Kullanılan enjeksiyon yöntemine ve gebelik etekasyonuna karşı embriyo sağkalım oranı ve implantasyon verimi. PNI, pronükleer enjeksiyon; LV, lentiviral vektör subzonal enjeksiyon.

Şekil 1: Subzonal lentiviral enjeksiyon için hazırlanan tek hücreli sıçan embriyosu mikroskobik fotoğrafı. Embriyo bir pipetle hareketsiz kaldı. Anne ve baba genetik materyali ve kutup cismi içeren iki pronüklei görülebilir. Ölçek çubuğu = 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
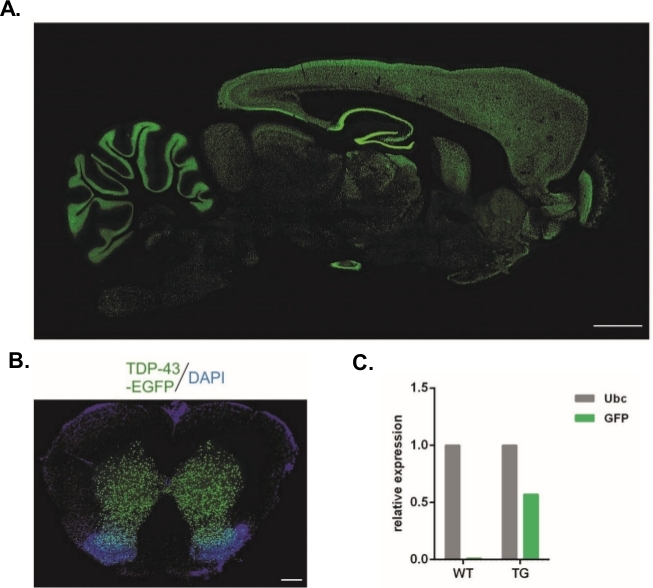
Şekil 2: Tüm merkezi sinir sistemi boyunca nöronal Synapsin-1 promotörü kontrolü altında TDP-43-eGFP füzyon proteinini ifade eden kararlı transgenik sıçan hatlarının üretimi. (A) Synapsin-1 (Syn)-güdümlü hTDP-43-eGFP ekspresyon deseni transgenik sıçan beyninin sagital bölümünde. Ölçek çubuğu = 3 mm. (B) Transgenik bir sıçanın omuriliğin koronal kesiti, DAPI ile karşıte, omuriliğin gri maddesi ile sınırlandırıldı. Ölçek çubuğu = 250 μm. (C) GFP transgen transkriptinin göreli ekspresyonu ubikitin C referans transkripti ile karşılaştırıldığında. n = 2 wildtype. n = 2 transgenik. Rakam14'tendeğiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Transgenik teknolojilerdeki gelişmeler kemirgen modellerini biyomedikal araştırmalarda paha biçilmez bir araç haline getirmiştir. Onlar vivo genotip-fenotip ilişkileri çalışma fırsatı sağlar. Burada pronükleer enjeksiyonlar ile konvansiyonel transgenez için yaygın olarak kullanılabilir bir alternatif salıyoruz. Lentiviral gen transdüksiyonunun kullanımı, zona pellucida altında enjekte edilebildiği için zorlu mikroenjeksiyon ihtiyacını atlar. Bu yaklaşım embriyo bütünlüğünü etkilemez, bu da enjekte edilen zigotlar için %100 sağkalım oranını garanti eder. Lentiviral vektörler ile birleşen transgen, konak genomuna entegre edilerek uzun süreli ekspresyon ve germline iletimine olanak sağlar. Ayrıca, biz koruyucu annelere modifiye embriyo transferi için iki alternatif teknikler salıyoruz. Bir teknik daha önce vazektomi kısır erkeklerle çiftleşme tarafından hazırlanan sözde hamile kadınlara embriyo transferi kullanır. Diğer teknik, doğurgan erkeklerle çiftleşerek farklı bir kürk renginde (yani BN sıçanlar) doğal olarak hamile kadınların kullanımına dayanmaktadır. Gebeliğin bu daha fizyolojik ders zorlu genetik değişiklikler16geçmesi embriyoların uygun gelişimini sağlar.
Transgenik sıçanlar üretmek için ilk başarılı girişimleri 19907yılında bildirilmiştir. Ancak, sıçan transgenezi ndeki zorluklar nedeniyle17, sonyıllardanispeten az sayıda transgenik sıçan hatları 9 üretilmiştir. Fare ve sıçan transgenezi arasında mikroenjeksiyonlar kullanılarak çeşitli temel farklılıklar gözlenmektedir. Sıçanlar için, özellikle outbred hatları (örneğin, Wistar ve SD) transgenez için kullanılır. Fareler için, araştırmacılar esas olarak yüksek doğurganlık nedeniyle inbred suşların F1 crossbreed kullanmak, hormonal superovülasyon daha iyi yanıt, ve blastosistler için tek hücreli aşamadan in vitro embriyoların nispeten kolay gelişimi18. Sıçanlarda süperovülasyon indüksiyonu standart PMSG/hCG hormon stimülasyonu kullanan farelere göre çok daha az etkilidir. Bu nedenle, tek bir PMSG yönetimi19yerine sürekli FSH infüzyonu kullanan sıçanlarda bu hormonları yönetmek için alternatif protokoller geliştirmek için girişimlerde bulunulmaktadır. Ancak PMSG/hCG veya FSH/hCG'nin neden olduğu süperovülasyonun karşılaştırılabilir verime sahip olduğu gösterilmiştir20. Bize göre, süperovülasyonun etkinliğini etkileyen en kritik faktör seçilen kadınların yaşıdır. Yine de, kesin parametreler her sıçan suş, laboratuvar, vb için test edilmelidir.
TEK hücreli bir embriyonun pronüsine DNA çözeltisi enjekte etme prosedürü her iki kemirgen türü için de benzerdir. Ancak, sıçan zigotlarının pronükleisi farelerdeki gibi düzenli şekillere sahip değildir ve hücresi sitoplazmasında tanımlanması daha zor olma eğilimindedir. Ayrıca, sıçan zigot hücre zarı ve pronükleer membran daha elastik ve viskoz, böylece DNA çözeltisi ile yüklenir bir cam mikropipet ekleme zorlaştıran. Bu faktörler mikroenjeksiyon dan sonra sıçan yumurtası sağkalım oranlarının düşmesine yol açar (farelerde %31-65'e karşılık %80) ve sıçanlarda transgenez veriminin düşük olduğunu açıklar9. Ayrıca, embriyonun yoğun ve mekanik manipülasyonu implantasyon verimliliğini de etkileyebilir, ki bu da bizimki de dahil olmak üzere birçok laboratuvarda maksimum %10'a ulaşır. Bu nispeten düşük verim embriyoların uygun sayıda implantasyonu sonra bile gözlenir21.
Söz konusu zorlukların üstesinden gelen yöntemlerden biri de tek hücreli embriyoların retrovirüslerle enfeksiyonudur. Retrovirüsler RNA şeklinde genetik materyal içerirler ve enfekte hücreye girdikten sonra virüsün ters transkripsiyonu ile DNA'ya aktarılır. DNA daha sonra nükleer gözenekleri aracılığıyla hücre çekirdeğine taşınır ve burada provirüs şeklinde hücrenin genomuna entegre olur. Lentiviral vektörler transgenik fare ve sıçan12,14,,22oluşturmak için kullanılmıştır. Zona pellucida eksikliği tek hücreli embriyolar bir lentiviral vektör ile bir çözelti içinde kuluçka ya da vektör perivitelline uzaya zona pellucida altında enjekte edilebilir. Bu yöntemin en büyük avantajı transgenik yavruların % 80'inden fazlasına ulaşan son derece yüksek verimidir. Lentiviral vektör ile enfeksiyon sonra, farklı sitelerde birçok kopya zigot genomuna entegre olabilir, pronükleer mikroenjeksiyon ile transgenez yöntemiaksine, hangi bir entegrasyon sitesi genellikle gözlenen12. Lentiviral vektörler kullanılarak yapılan transgenik kurucunun yavrularında, transgenin tek tek kopyaları ayrı ayrıştırılır ve bu da her bir singenin farklı ifade profilleri ile ortaya çıkabilir. Ancak, bu transgen türetilen istenen ifade profili ile bir konu alma şansını artırabilir. Kısıtlamalar esas olarak yaklaşık 8 kb23ile sınırlı olan transgenin boyutu için geçerlidir.
Sıçan transgenezinde bir diğer zorluk da genetiği değiştirilmiş embriyolar için taşıyıcı anne olarak hizmet veren dişilerin neslidir. Standart prosedürde, dişiler sözde gebeliği tetiklemek için steril vazektomili erkeklerle kesişir. Sıçanlarda, sözde gebelik değerlendirme tekniği farelere göre çok daha zordur, bu nedenle gonadotropin salgılayan hormon agonisti ile stimülasyon bazen erkeklerle çiftleme birkaç gün önce kullanılır. Bu nedenlerden dolayı, açıklanan protokolde koruyucu anneleri elde etmek için iki alternatif yaklaşım salıyoruz. Hamile veya sözde gebe kadınlar kullanıldığında manipüle zigotların genel implantasyon verimliliği benzerdir. Ancak, manipüle olanlar ile birlikte doğal, manipüle olmayan embriyoların varlığı gebelik oranını artırabilir16. İmplantasyon oranındaki temel fark manipülasyon tekniği olsa da (örneğin, PNI vs. LV, %10'a karşı %20; bkz. Tablo 2),sözde hamile kadınların koruyucu anne olarak kullanılması bazı deneyler için yararlı olabilir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazar (W.K.) Polonya Cumhuriyeti patent ofisinden "Transgenik hayvan üretme yöntemi" patentine sahiptir (no. P 355353; 21.03.2008).
Acknowledgments
Bu çalışma, Avrupa Birliği tarafından WK'ya Avrupa Bölgesel Kalkınma Fonu kapsamında ortaklaşa finanse edilen Polonya Bilim Vakfı'nın Team Tech Core Facility Plus programı kapsamında ki ANIMOD projesi tarafından desteklenmiştir.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



