Summary
Das Ziel dieser Studie ist es, das orthotopische Lebertransplantationsmodell der Ratte zu modifizieren, um die Transplantation menschlicher Leber besser darzustellen und das Überleben der Empfänger zu verbessern. Die vorgestellte Methode stellt den hepatischen arteriellen Zufluss wieder her, indem die gemeinsame Leberarterie der Spenderleber mit der richtigen Leberarterie der Empfängerleber verbunden wird.
Abstract
Das Modell der orthotopischen Lebertransplantation (OLT) der Ratte ist ein leistungsfähiges Werkzeug, um akute und chronische Abstoßung zu untersuchen. Es ist jedoch keine vollständige Darstellung der menschlichen Lebertransplantation aufgrund des Fehlens einer arteriellen Wiederverbindung. Hier wird ein modifiziertes Transplantationsverfahren beschrieben, das die Wiederverbindung der Leberarterie (HA) umfasst, was zu einer deutlichen Verbesserung der Transplantationsergebnisse führt. Mit einer durchschnittlichen anhepatischen Zeit von 12 min und 14 s führt die HA-Wiederverbindung zu einer verbesserten Perfusion der transplantierten Leber und einer Erhöhung des langfristigen Überlebens der Empfänger von 37,5 % auf 88,2 %. Dieses Protokoll beinhaltet die Verwendung von 3D-gedruckten Manschetten und Haltern, um die Portalvene und die infrahepatische minderwertige Vena cava zu verbinden. Es kann für die Untersuchung mehrerer Aspekte der Lebertransplantation implementiert werden, von der Immunantwort und Infektion bis hin zu technischen Aspekten des Verfahrens. Durch die Integration einer einfachen und praktischen Methode zur arteriellen Wiederverbindung mit einer mikrovaskulären Technik imitiert dieses modifizierte Ratten-OLT-Protokoll Aspekte der menschlichen Lebertransplantation und dient als wertvolles und klinisch relevantes Forschungsmodell.
Introduction
Die weltweite Belastung durch Lebererkrankungen nimmt weiter zu, mit einem Anstieg der Todesfälle durch Lebererkrankungen um 30 % von 2005 bis 20131,2. Lebertransplantationistin ist oft der einzige Regress für Patienten mit Lebererkrankungen im Endstadium. Die Leber ist das am zweithäufigsten transplantierte feste Organ, und die Zahl der Lebertransplantationen weltweit durchgeführt stieg um 7,25% von 2015 bis 20161,2. Trotz seiner Prävalenz stagnieren die Überlebensraten nach der Transplantation3,4,5. Die Überlebensrate des 15-jährigen Patienten liegt den Angaben zufolge bei 53 %, und die Überlebensrate des 20-jährigen Patienten kann bei 21%3,5liegen. Zwar gibt es aufregende neue immunbiologische Initiativen, die zu neuen Behandlungen und verbesserten klinischen Ergebnissen führen können, aber es gibt noch kein zuverlässiges Modell für Kleintiere, um sie zu testen.
Die Ratte OLT-Modell wurde weit verbreitet in der Untersuchung von Lebertransplantation, einschließlich Ablehnung6,7,8,9,10, Immuntoleranz11, Transplantation Ischämie-Reperfusionsverletzung12, Immunsuppression13, und Gallenbaum Verletzung14,15,16,17. Ein Nachteil des Modells in seiner jetzigen Form ist jedoch seine hohe postoperative Morbidität und Mortalität18,19. Dies ist ein gravierender Nachteil, der im Widerspruch zur menschlichen Operation steht, und es beeinträchtigt die Fähigkeit, klinisch relevante Schlussfolgerungen aus dem Modell20zu ziehen.
Darüber hinaus kann ein großer Teil dieser Morbidität auf eine fehlende oder unvollkommene Leberarterie (HA) zurückgeführt werden18. Obwohl ein kritischer Schritt bei der Transplantation menschlicher Leber, neigen technische Schwierigkeiten dazu, die HA-Wiederverbindung im OLT-Modell der Ratte zu beeinträchtigen. Infolgedessen ist Gallengang (BD) Anastomose schwach und führt zu hohen Raten von Gallenlecks und BD-Nekrose21. Jenseits der hohen Inzidenz von Gallenkomplikationen22verändert das Fehlen eines arteriellen Zuflusses die Physiologie der Transplantatleber nach der Transplantation23, mit Hypoxie im Spenderlebertransplantat24 und Leberschäden, die in entzündeten Lappen beobachtet wurden19,25,26. Ratte OLT ohne arterielle Wiederverbindung neigt auch dazu, Fibrose zu fördern27. Das unten beschriebene Ratten-OLT-Protokoll befasst sich mit diesen Problemen, indem es einen einfachen HA-Rekonstruktionsschritt mit einer zuvor veröffentlichten Ratten-OLT-Methode28einbezieht, was zur Erhaltung von Leberparenchym und verbesserten Überlebensraten führt.
Die Lebertransplantation hat drei Phasen: (1) Extraktion des Lebertransplantats vom Spender, (2) Vorbereitung des Spenderlebertransplantats und (3) Ersatz der Empfängerleber durch das Lebertransplantat. Das Verfahren beinhaltet die Manipulation von fünf anatomischen Strukturen: die suprahepatische untere Vena cava (SHVC), Portalvene (PV), infrahepatische minderwertige Vena cava (IHVC), Leberarterie (HA) und Gallengang (BD).
OLT in der Ratte wurde zuerst von Lee et al. mit Mikrosuture Anastomose der SHVC, PV und IHVC eingeführt, und eine Durchziehtechnik für die BD29. Dieses Modell wurde später durch den Einsatz der Zwei-Manschette-Technik im Jahr 197930verbessert. Seitdem wurden mehrere alternative Techniken vorgeschlagen, wobei sich die Mehrheit auf venöse Anastomose konzentrierte und eine Zwei-Manschetten-Technik mit einigen Modifikationenverwendete 31. Obwohl HA Anastomose zuvor im OLT-Modell der Ratte mit Techniken wie Mikronaht, Manschette und intraluminale Hülsen26,31,32,33,34beschrieben wurde, erfordern diese Techniken oft hochqualifizierte mikrochirurgische Fähigkeiten, verändern die Physiologie der Ratte signifikant und werden durch Thrombose und/oder Gallenkomplikationen behindert27,35.
Darüber hinaus kann die Wahl des chirurgischen Eingriffs auch die anhepatische Zeit beeinflussen (Zeit von PV-Klemmung bis zur Reperfusion von Transplantat durch die rekonstituierte PV), was für den Erfolg der Rattenlebertransplantation entscheidend ist. Insbesondere werden hohe Überlebensraten mit anhepatischen Zeiten von 15-20 min36beobachtet, und 30 min ist die obere Erfolgsgrenze37,38. Daher ist das Ziel dieser Methode, ein weniger invasives und leichter zu adoptierbares chirurgisches Ratten-OLT-Modell zu implementieren, das in der Lage ist, die Leberarterie wieder zu verbinden, eine effiziente Durchblutung der transplantierten Leber zu fördern, den Fluss zum Gallengang des Empfängers aufrechtzuerhalten und den physiologischen Zustand des Empfängers zu erhalten.
Hier sind alle Schritte dieses überarbeiteten Protokolls aufgeführt, einschließlich der Manipulation des Zöliakie-Stamms der Spenderleber sowie der Verwendung von 1) einem 1,5 mm Stent zur Durchführung einer extraluminalen Hülsenverbindung mit dem Empfänger, der tatsächlich HA, 2) einer laufenden Naht für die SHVC-Rekonstruktion, 3) zwei 3D-gedruckten Kunststoffmanschetten für PV- und IHVC-Rekonstruktion39,40, 4) eine mikrovaskuläre Hülsenverbindung für die HA18,27,41 und 5) eine zuvor beschriebene BD-Stenting-Technik28. Zwei weitere Schritte sind ebenfalls enthalten: eine Kaltspülung über die PV und ein Antibiotika-Regime, das auf früheren Befunden basiert17. Dieses optimierte OLT-Protokoll minimiert perioperative Komplikationen und Morbidität und modelliert den chirurgischen Operationsprozess bei der Transplantation menschlicher Leber genauer.
Protocol
Die Studie wurde nach den Richtlinien der Nagetierbehandlung und -chirurgie durchgeführt, und das Studienprotokoll wurde vom University Health Network Animal Care Committee (UHN AUP Nr.: 5840.3) genehmigt und folgt den Richtlinien des Canadian Council of Animal Care. Die Studie verwendet männliche Lewis-Ratten (Stamm LEW/SsNHsd), 12-14 Wochen alt, mit einem Gewicht zwischen 250-300 g.
1. Ausrüstungsaufbau
- Halten Sie eine 31 G scharfe Spitze mit einem Nadelhalter und erstellen Sie einen stumpfen L-förmigen Injektor, indem Sie die Spitze wiederholt hin und her biegen, bis die Spitze abrast. Mit einer flachen Metallfeile, stumpf und glatt das Ende des Injektors.
- Schneiden Sie die Portalvene (PV) und die infrahepatischen unteren Venenhöhlen (IHVC) Manschetten aus der 3D-gedruckten Basis mit einem Skalpell(Zusatzmaterial 1, Ergänzungsmaterial 2, Abbildung 1, Ergänzende Abbildung 1).
HINWEIS: Eine 3D-Design-Software wird verwendet, um die Manschetten und Halter zu entwerfen, die auf einem 3D-Drucker(Tabelle der Materialien) mit autoklavierbarem Harz39,40 (Spezifikationen für alle 3D-gedruckten Materialien im Ergänzungsmaterial 1-10) gedruckt werden. - Verwenden Sie ein neues Skalpell, um den 22 G Katheter in ein doppelseitiges schräges Rohr (3,5 mm Länge) zu schneiden. Mit dem Skalpell, sanft ätzen Linien auf die Oberfläche des Gallengangs (BD) Stent (nicht durch die Wand des Rohres schneiden). Diese Radierungen verhindern, dass Krawatten während des Verfahrens verrutschen.
- Verwenden Sie ein neues Skalpell, um den 24 G Katheter in ein einseitig schräges Rohr (2,0 mm Länge) zu schneiden und mehrere Kratzer auf der Oberfläche des neuen arteriellen Stents zu erzeugen.
HINWEIS: Verhindern Sie verengen oder Okklusion des Lumens des BD-Stents, indem Sie die Anwendung von Druck auf den Stent vermeiden. Wenn der Stent verengt oder verschlossen ist, wird das Überleben des Empfängers durch Gallenverschluss beeinträchtigt.
- Schneiden Sie die Portalvene (PV) und die infrahepatischen unteren Venenhöhlen (IHVC) Manschetten aus der 3D-gedruckten Basis mit einem Skalpell(Zusatzmaterial 1, Ergänzungsmaterial 2, Abbildung 1, Ergänzende Abbildung 1).
2. Spenderoperation
- Stellen Sie ein Wärmepolster auf 37 °C ein und legen Sie es unter die chirurgische Plattform. Schalten Sie den Temperaturmonitor ein, damit die Kerntemperatur der Ratte über eine Rektalsonde überwacht werden kann. Richten Sie den Isofluran-Anästhesieapparat ein.
HINWEIS: Überwachen Sie während der Operation die Tiefe der Anästhesie, indem Sie die Atemfrequenz, die Herzfrequenz, die Färbung der Organe/Schleimhäute und das Vorhandensein von Pedalentzugsreflexen beachten. - Ordnen Sie den chirurgisch drapierten Arbeitsbereich mit allen notwendigen Instrumenten und Materialien (z.B. Schere, Zange, Gaze, Heparin, Retraktoren, Mittelteilpad, Baumwollspitzen, 4-0 Seide, 7-0 Seide, 8-0 nicht resorbierbare sterile Naht und 10-0 nicht resorbierbare Monofilament-Nähte) bequem an den Seiten der chirurgischen Plattform platziert.
- Ordnen Sie den Arbeitsplatz mit allen Lösungen, einschließlich Ringers Laktatlösung und 300 I.E. Natriumheparin (siehe Tabelle der Materialien).
- Wiegen Sie das Tier. Anästhesisieren Sie die Spenderratte, indem Sie sie in die Anästhesiekammer mit 5% Isofluran, 5 l/min Luftstrom und 70% FiO2 für die Induktion legen. Wenn die Ratte das Bewusstsein verliert, verringern Sie die Anästhesie auf 3% Isofluran, 0,5 l/min Luftstrom und 70% FiO2. Überprüfen Sie, ob das Pedal nicht reagiert, indem Sie den Zehen kneifen.
- Bereiten Sie die Haut des Bauches vor. Entfernen Sie das Fell mit einem elektrischen Rasierer von der ventralen Seite. Beobachten Sie aufmerksam die Atmungsrate des Spenders, bis er eine stabile und tiefe Rate erreicht.
- Legen Sie die chirurgisch drapierte Ratte so, dass ihre ventrale Seite zur Decke gerichtet ist. Legen Sie die Nase in einen Anästhesiefänger mit 3% Isofluran, 0,5 l/min Luftstrom und 70% FiO2. Bereiten Sie die Bauchwand mit Povidon-Jod vor, arbeiten von der Mittellinie nach außen, gefolgt von 70% Ethanol.
- Machen Sie einen Schnitt vom xiphoiden Prozess zur Schamsymphyse mit einer runden chirurgischen Schere, dann verbessern Sie die Exposition mit einem bilateralen Querschnitt. Stoppen Sie alle Blutungen aus der Bauchwand mit einer bipolaren elektrochirurgischen Einheit für die Kautery. Nach dem Schnitt, verringern Wartung isoflurane auf 2%, 0,5 l/min Luftstrom, und 70% FiO2.
HINWEIS: Passen Sie den Isofluran-Verdampfer an, um eine Atmungsrate von etwa einem Atemzug pro Sekunde zu erreichen, und denken Sie daran, die Tiefe der Anästhesie während der Operation regelmäßig zu bewerten. - Legen Sie einen 4-0 Seidenstich in den xiphoiden Prozess und verwenden Sie die Naht, um die Brustwand Cephalad zurückzuziehen. Kleben Sie den Seidenfaden an die Oberseite der Struktur, die den Anästhesiefänger an Ort und Stelle hält. Halten Sie die Körperhöhle der Spenderratte mit 3D-gedruckten Retraktoren offen (siehe Ergänzungsmaterial 3), die auf beiden Seiten des Bauches platziert sind (Retraktoren werden mit Gummibändern an Magneten auf der chirurgischen Plattform befestigt).
HINWEIS: Mückenzange kann auch verwendet werden, um den xiphoiden Prozess zu erfassen und die Cephalade zurückzuziehen. Fixieren Sie die Mückenzange an Ort und Stelle mit Klebeband. - Verwenden Sie einen Vlies Gazeschwamm (4 cm x 4 cm), der durch Ringers Laktatlösung gedämpft wird, um den Kleinen und Dendarm einzuschließen. Verwenden Sie einen kleinen, nassen, vliesgewebten Gazeschwamm (2 cm x 4 cm), um die Leber sanft zu bedecken.
- Legen Sie eine kleine gerollte Gaze unter den Mittelteil, um den Bauch zu heben und die Exposition der suprahepatischen unteren Vena cava (SHVC) zu verbessern.
- Schneiden Sie das falciform Band. Trennen Sie die linke Membranvene mit Mikrozangen vom SHVC. Ligate die linke Membran Vene mit 7-0 Seide, in der Nähe des SHVC bleiben.
HINWEIS: Verwenden Sie den kleinen, nassen, vliesgewebten Gazeschwamm, der mit Ringers Laktat gedämpft und auf die Leber gelegt wird, um die Leber sanft vom xiphoiden Prozess wegzuziehen und die linke Membranvene freizulegen. - Schneiden Sie das linke Dreieck und die Gastro-Hepatic Bänder mit runder Schere.
- Setzen Sie den Caudate-Lappen aus, indem Sie vorsichtig die linken und mittleren Lappen in Richtung des xiphoiden Prozesses mit einem kleinen, nassen, vliesgewebten Gazeschwamm zurückziehen. Lassen Sie das Band, das den Caudate-Lappen vom Rest der Leber trennt, mit einer runden Schere.
- Teilen und trennen Sie das hepato-ösophageale Band mit einer bipolaren elektrochirurgischen Einheit in der Nähe der Speiseröhre.
HINWEIS: Verschieben Sie den kleinen und großen Darm vorsichtig auf die linke Seite der Bauchhöhle und bedecken Sie sie mit nasser, vliesgewebter Gaze. - Sezieren Sie das Retroperitoneum und das Fett, das den IHVC bedeckt. Setzen Sie den IHVC bis zur linken Nierenvene aus und isolieren Sie ihn.
- Den IHVC mit einem Wattestäbchen leicht verdrängen, um kleine Venen, die in die rechte Seite des IHVC verschmelzen, mit der bipolaren elektrochirurgischen Einheit freizulegen und dann zu kauterisieren. Kauterisieren Sie auch alle Lendenvenen, die in den IHVC verschmelzen.
- Teilen Sie die rechte suprarenale (Nebennieren) Vene zwischen zwei 7-0 Seidenligaturen, in der Nähe des IHVC bleiben. Befreien Sie die Leber von ihren hinteren Bändern, indem Sie diese unter sanfter Traktion schneiden.
- Isolieren Sie die rechte Nierenvene von der rechten Nierenarterie und aus dem benachbarten Gewebe mit einer Feinspitze Kautery. Versiegeln Sie die rechte Renalvenenöffnung mit einer 8-0 nicht resorbierbare sterile Ligatur.
- Lösen Sie das Fett, das die PV bedeckt, um die pylorische Vene (rechte Magenvene) und die Milzvene an den Stellen zu lokalisieren, an denen sie die PV verschmelzen. Ligate diese Venen mit 7-0 Seide, Verstärkung der Seite am nächsten an der PV mit einem 8-0 nicht resorbierbarer steriler Nahtstich. Teilen Sie die Venen zwischen den Krawatten.
HINWEIS: Setzen Sie die PV aus, indem Sie kleine, nasse Gaze verwenden, um das Zwölffingerdarm zurückzuziehen. Das Einsetzen der Manschette ist einfacher, wenn Fett aus der PV abgenommen wird, was auch die Stenose der PV-Manschette verhindert. - Injizieren Sie 300 I.E. Heparin-Natrium in den IHVC, verdünnt auf 1 ml normaler Saline, mit einer 1 ml Spritze (31 G Nadel).
- Machen Sie einen Schnitt 5 mm unterhalb der BD-Bifurkation und legen Sie den BD-Stent in den gemeinsamen BD ein. Sichern Sie den Stent mit einer 7-0 Seidenligatur 1 mm über dem Einschnitt. Unterhalb des Einschnitts kann eine zusätzliche Krawatte hergestellt werden, die 10 mm unter der Bifurkation liegt. Sobald der Stent gesichert ist, schneiden Sie den BD zwischen diesen beiden Krawatten.
- Schneiden Sie niemals die BD oder die richtige Leberarterie (HA) ab. Legen Sie einen 10-0 nicht resorbierbaren sterilen chirurgischen Monofilament-Nahtstich an der 3-Uhr-Position in der BD an der Einschnitte als Marker, um Verdrehungen nach wiederherstellung zu verhindern.
- Stellen Sie die richtige HA und teilen Sie die Gastroduodenalarterie (GDA) zwischen zwei 7-0 Seidenligaturen. Setzen Sie die linke Magenarterie, Die Staubarterie und den Zöliakie-Stamm aus. Binden Sie die drei Arterien sowohl distally und in der Nähe ihrer Starts.
- Schneiden Sie die linke Magenarterie, Die Splenic Arterie und den Zöliakiestamm zwischen den Arterienbinden. Mit einer 20 ml Spritze mit einer 21,5 G Nadel spritzen Sie langsam 20 ml kalte (4 °C) Ringer-Laktatlösung in die PV. Schneiden Sie die Vena cava unterhalb des Punkts, an dem die linke Nierenvene mit dem IHVC verschmilzt, um einen bündigen Abfluss zu ermöglichen.
HINWEIS: Die Nadel sollte so weit wie möglich vom Hilum entfernt gehalten werden. Die Spenderleber-Kaltperfusion sollte zwischen 1-2 min dauern. Während der Spülung der Leber, verwenden Sie die andere Hand, um kalte Ringer Laktat auf die Leberoberfläche spritzen. - Schneiden Sie den PV-Stamm nach der Spülung unter die Milzvene. Schneiden Sie den IHVC knapp über der linken Nierenvene. Schneiden Sie den SHVC direkt neben der Membran.
- Schneiden Sie die Bänder und Bindegewebe zwischen der Leber und Retroperitoneum.
HINWEIS: Stellen Sie sicher, dass die vorderen und hinteren SHVC-Wände ausreichend lang sind, um die obere Kavallekavalastomose zu erleichtern. Es ist wichtig, unmittelbar neben der Membran zu schneiden, um so viel Länge wie möglich zu halten. - Nachdem die Leber aus dem Bauch entfernt wurde, legen Sie sie schnell in eine Schale, die mit 4 °C Ringer-Laktatlösung gefüllt ist. Legen Sie die Schale auf ein Eispad, um eine kalte Temperatur zu halten.
- Entsorgen Sie die überresten der Spenderratte gemäß den institutionellen Leitlinien.
3. Spender-Rattenleber-Präparat ("Rückbank")
- Füllen Sie die kalte Petrischale mit einem ausreichenden Volumen von 4 °C Ringer-Laktatlösung, um die Spenderrattenleber zu untertauchen. Drehen Sie die Spenderleber vorsichtig in der Schale schwebend, so dass die untere Oberfläche nach oben zeigt. Legen Sie die Manschetten für PV und IHVC(Ergänzungsmaterial 1 bzw. Zusatzmaterial 2)in die Schale.
- Ziehen Sie die PV durch die PV-Manschette und falten Sie das Ende der Vene über die Manschette. Binden Sie die PV sicher um die Manschette mit 7-0 Seide. Spülen Sie die PV mit 10 ml 4 °C Ringer-Laktatlösung.
- Wiederholen Sie Schritt 3.2 mit dem IHVC, ohne Flush.
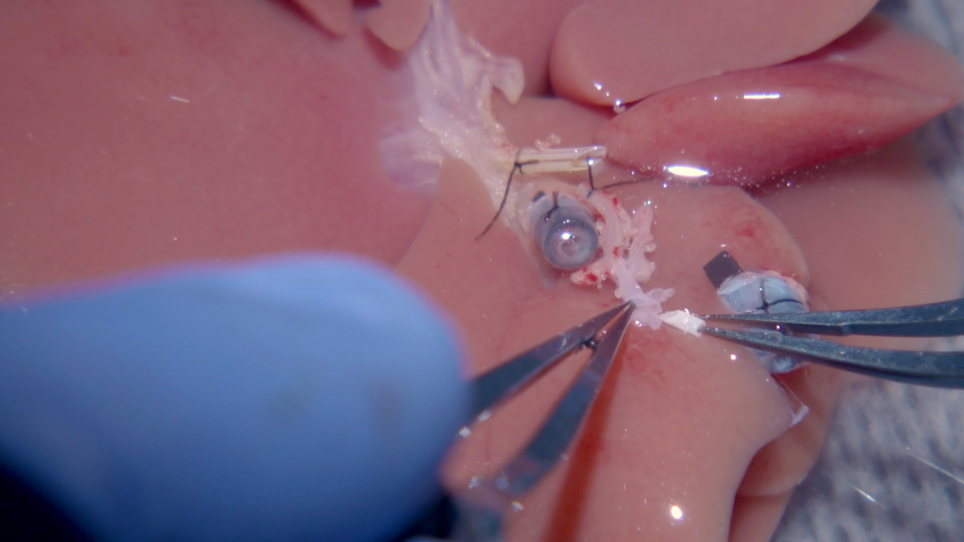
- Entfernen Sie das Fettgewebe um den Zöliakie-Stamm. Bilden Sie eine größere arterielle Ärmelmanschette, indem Sie die Bifurkation des Zöliakie-Stamms, der Milzarterie und der linken Magenarterie(Abbildung 2A) aufschneiden.
HINWEIS: Es ist schwierig, den arteriellen Stent in die gemeinsame HA einzufügen. Dehnen und richten Sie die Arterie mehrmals mit Zangen aus, bevor Sie den Stent einsetzen. Stellen Sie sicher, dass die Abschrägung des Stents nach oben zeigt und die Arterie nicht verdreht ist (Abbildung 2B). - Legen Sie den 1,5 mm langen 24 G arteriellen Stent über die arterielle Manschette in den Spender-Gemeinsamen HA. Sichern Sie den Stent mit einem 8-0 Polypropylen-Ligatur (Abbildung 2C) und spülen Sie den Stent mit Ringers Laktatlösung (Abbildung 2D).
- Positionieren Sie eine Mikroklemme (4-6 mm Länge) auf den proximalen IHVC, der den Blutverlust nach der Portalreperfusion verhindern und Luftembolien vermeiden soll.
- Drehen Sie die Leber und setzen Sie ihre überlegene Seite aus. Einfügen von zwei 8-0 Polypropylen-Verjüngungspunkt-Nähte an den Seitlichen und Medialkanten des SHVC.
- Halten Sie die Leber bei 4 °C, damit sie für die Transplantation in den Spender bereit ist.
4. Empfängeroperation
- Lesen Sie den Abschnitt "Spenderoperation" oben und wiederholen Sie die Schritte 2.1-2.4.
HINWEIS: Männliche Lewis Ratten im Alter von 12-14 Wochen werden hier verwendet, mit einem Gewicht von 5-20 g schwerer als die Spender. Während der Operation, überwachen Sie die Tiefe der Anästhesie, indem Sie die Atemfrequenz, Herzfrequenz, Färbung der Organe / Schleimhäute, und das Vorhandensein von PedalEntzugreflexe. - Legen Sie die chirurgisch drapierte Ratte mit ihrer ventralen Seite nach oben. Legen Sie die Nase in die Anästhesie Scavenger für Isofluran-Inhalation. Befeuchten Sie die Augen mit opthalamischem Schmiermittel. Bereiten Sie die Bauchwand mit Providon-Jod zuerst, dann mit 70% Ethanol vor.
- Injizieren Sie 5 ml Ringers Laktatlösung subkutan auf beiden Unterseiten der ventralen Bauchwand. Verwenden Sie einen chirurgischen Assistenten Hilfsmittel, um 0,5 ml von 200 mg/kg Piperacillin Natrium intramuskulär in die linke Bauchwand vor der Laparotomie zu injizieren. Zusätzlich 0,5 ml 10 mg/ml Bupivacain subkutan in die rechte Bauchwand verabreichen.
HINWEIS: Verabreichen Sie die gleiche Dosis Piperacillin-Natrium 1x/Tag für 3 Tage postoperativ. - Bereiten Sie die Bauchwand zuerst mit Providon-Jod und dann mit 70% Ethanol vor. Machen Sie einen Mittellinienschnitt vom sternalen Xiphoid bis 1 cm über der Schambeinsymphyse. Abnahme von Isofluran auf 2%, 0,5 l/min Luftstrom und FiO2 70% für die Aufrechterhaltung der Anästhesie nach dem Schnitt.
HINWEIS: Mückenzange kann verwendet werden, um den xiphoiden Prozess zu erfassen und die Cephalade zurückzuziehen. Fixieren Sie die Mückenzange an Ort und Stelle mit Klebeband. Die Körperhöhle wird von 3D-gedruckten Retraktoren (siehe Ergänzungsmaterial 3) auf beiden Seiten mit Gummibändern, die magnetisch an der chirurgischen Plattform gehalten werden, offen gehalten. - Wickeln Sie den kleinen und großen Darm mit einem nassen, vliesgewebten Gazeschwamm (4 cm x 4 cm), der mit Ringers Laktatlösung gedämpft wird. Verwenden Sie einen kleinen (2 cm x 4 cm), nassen, vliesnassen Gazeschwamm, der mit Ringers Laktatlösung gedämpft ist, um die Leber sanft zu bedecken.
- Platzieren Sie ein kleines 3D-gedrucktes Stützpad (Rückenhalter; siehe Ergänzungsmaterial 4) unter den Rattenmittelschnitt, um die Belichtung des SHVC durch Biegen der Drehung zu erhöhen. Dies kann sicher bei Ratten durchgeführt werden und wird von einem Chirurgenassistenten durchgeführt.
- Schneiden Sie das falciform Band und verwenden Sie den kleinen, nassen Vlies Gazeschwamm, um die Leber sanft den xiphoiden Prozess wegzuziehen und die linke zwerchfellmatische Vene freizulegen. Trennen Sie die linke Membranvene mit Mikrozangen vom SHVC. Ligate die linke Membran Vene mit 7-0 Seide in der Nähe des Zwerchfells.
- Schneiden Sie das linke Dreieck und die Gastro-Hepatic Bänder mit runder Schere.
- Ziehen Sie die linken und mittleren Lappen zart in Richtung des xiphoiden Prozesses mit einem kleinen, nassen Vlies Gazeschwamm, um den Caudate-Lappen zu offenbaren. Trennen Sie das Band, das den Caudate-Lappen vom Rest der Leber trennt.
- Teilen Sie das hepato-ösophageale Band und koagulieren Sie alle Blutungspunkte mit der bipolaren elektrochirurgischen Einheit, in der Nähe der Leber bleiben. Schneiden Sie die Bänder am hinteren Aspekt der Leber.
- Ziehen Sie den kleinen und großen Darm vorsichtig auf die linke Seite der Bauchhöhle und bedecken Sie sie mit nasser, vliesstoffischer Gaze.
- Sezieren Sie das Retroperitoneum und Fett auf dem IHVC, um den IHVC bis zur rechten Nierenvene zu entlarven und zu isolieren. Den IHVC mit einem Wattestäbchen leicht verdrängen und alle kleinen Venen, die in die rechte Seite des IHVC einfließen, mit der bipolaren elektrochirurgischen Einheit kauterisieren. In ähnlicher Weise kauterisieren Sie alle Lendenvenen, die in den IHVC gelangen.
- Teilen Sie die rechte suprarenale (Nebennieren) Vene zwischen zwei 7-0 Seidenligaturen. Befreien Sie die Leber von ihren hinteren Bändern, indem Sie sie unter sanfter Traktion schneiden.
- Verwenden Sie kleine, nasse Gaze, die mit Ringers Laktatlösung gedämpft ist, um das Zwölffingerdarm zurückzuziehen und die PV freizulegen. Fett von der Bifurkation der PV und pyloric Vene lösen.
- Teilen Sie den BD 0,5 cm unter seiner Hilar-Bifurkation und legen Sie einen BD-Stent in den distalen gemeinsamen BD ein. Sichern Sie den Stent in Position mit einer 7-0 Ligatur etwa 0,2 mm unterhalb des Einschnitts. Eine zusätzliche Krawatte kann über dem Schnitt platziert werden, in der Nähe der Bifurkation. Schneiden Sie die BD in der Nähe der Leber, aber distal auf die Krawatte.
- Trennen Sie den BD mit Zangen und vermeiden Sie das Ausschneiden des BD oder der richtigen HA. Legen Sie einen 10-0 nicht resorbierbaren Monofilamentstich (z.B. ethilon) an der 3-Uhr-Position in den BD als Marker, um verdrehen nach dem Wiedervernehmen zu verhindern.
- Stellen Sie die richtige HA und die Bifurkation des gemeinsamen HA und GDA zur Schau. Stellen Sie die linke HA, die mittlere HA und die rechte HA zur Macht. Binden Sie die drei Arterien distal an die CHA-Bifurkation und schneiden Sie die Arterien in der Nähe der Leber, über den Krawatten.
- Legen Sie ein langes dünnes Stück Gaze hinter den SHVC.
- Legen Sie einen 3D-gedruckten IHVC-Halter oder "Griff" (Cava 150g 2.1; siehe Ergänzungsmaterial 5) hinter den IHVC und nähen Sie die Enden des 3D-gedruckten "Griffs" mit 10-0 nicht resorbierbarer Monofilament-Nähte zusammen (Abbildung 3A).
- Legen Sie einen 3D-gedruckten PV-Halter oder "Griff" (Porta 1.4.1-siehe Zusatzmaterial 6) hinter die PV, die der Leber direkt unterlegen ist, und nähen Sie die Enden des 3D-gedruckten "Griffs" mit 10-0 nicht resorbierbarer Monofilament-Nähte zusammen.
- Binden Sie eine 7-0 Seidenligatur unter beiden 3D-gedruckten Halterungen (IHVC und PV) (Abbildung 3A).
- Klemmen Sie den IHVC knapp über der rechten Nierenvene, die immer noch unter dem 3D-gedruckten Kavalleholder liegen sollte.
- Klemmen Sie die PV knapp über der pyloric Vene, die unter dem 3D-gedruckten PV-Halter liegen sollte. Zeichnen Sie die anhepatische Zeit auf, die an diesem Punkt beginnt. Verringern Sie auf 0,5% Isofluran, 0,5 l/min Luftstrom und 70% FiO2 für die Aufrechterhaltung der Anästhesie.
- Spülen Sie 2 ml 37 °C Ringer-Laktatlösung über die Bifurkation der PV mit einer 3 ml Spritze mit einer 27 G Nadel befestigt.
- Klemmen Sie den SHVC mit einer Kitzmiller-Klemme über der Leber. Unter die gleiche Klemme schneiden, so nah wie möglich an der Leber bleiben.
- Schneiden Sie über die 3D-gedruckten Halter für PV und IHVC (Abbildung 3A). Entfernen Sie die Leber des Empfängers. Richten Sie die Spenderleber sorgfältig aus und positionieren Sie sie in der Körperhöhle des Empfängers so, dass die obere Kavallekaastomose erzeugt werden kann.
- Verwenden Sie eine 8-0 Polypropylen-Laufnaht, um den SHVC des Spenders mit dem SHVC des Empfängers in der Nähe des Zwerchfells zu verbinden. Erste, Platz bleiben Nähte von 8-0 Polypropylen links und rechts des Spenders und Empfängers SHVC. Dann binden Sie diese an der Außenseite der Venenwand.
- Verwenden Sie die linke 8-0 Polypropylen zum Nähen der hinteren Wand des SHVC von links nach rechts und Krawatte nach rechts 8-0 Polypropylen. Verwenden Sie die linke 8-0 Polypropylen, um die vordere Wand der SHVC-Anastomose von links nach rechts zu nähen, so dass die letzten zwei Drittel der Nahtlinie losbleiben. Spülen Sie mit 20 ml Ringer-Laktat zwischen den losen Stichen und stellen Sie sicher, dass alle Luftblasen zu extrahieren.
- Ziehen Sie die losen Stiche und machen Sie eine Krawatte auf der Außenseite des SHVC. Schneiden Sie die restlichen 8-0 Polypropylen-Nähte.
HINWEIS: Der Clip hält den SHVC des Empfängers an Ort und Stelle, was das Zusammennähen des SHVC des Spenders und des Empfängers erleichtert. Zeichnen Sie die Dauer der SHVC-Anastomose auf. An dieser Stelle sind die Porta-Griffe am Halterarmapparat (Halterarm McGil + Halter-Miniarm LAB + Halterarm-Weichteil 1.3; siehe Ergänzungsmaterial 7, Ergänzungsmaterial 8bzw. Zusatzmaterial 9)befestigt, direkt schlechter als die Leber. Dieses Gerät wird durch eine 3D-gedruckte Halterbasis (Halterbasis 3.1; siehe Ergänzungsmaterial 10) unterstützt. - Legen Sie die PV-Manschette (Zusatzmaterial 1) vom Spender in die Empfänger-PV ein und ziehen Sie die 7-0 Seidenkrawatte fest. Spülen Sie die PV des Spenders und Empfängers mit Ringers Laktatlösung auf 37 °C erwärmt, bevor der Anschluss.
- Entfernen Sie die atraumatische Klemme aus dem SHVC (zuerst), dann den mikrovaskulären Clip für die PV (zweite). Die Leber mit warmem Blut erneut durchdringen; an diesem Punkt ist die anhepatische Phase beendet. Zeichnen Sie dieses Mal auf.
- Gießen Sie 10 ml warme Ringer-Laktatlösung auf die Leber, um sie zu erwärmen. Entfernen Sie die 3D-gedruckten Halter mit einer rundgekippten Schere (schneiden Sie den Sicherungsstich).
- Legen Sie die Spender-IHVC-Manschette (Zusatzmaterial 2) in den Empfänger IHVC ein und sichern Sie sie mit einer 7-0 Seidenkrawatte. Entfernen Sie zuerst den Spender-IHVC-Clip und dann den Clip des Empfängers (Abbildung 3B). Der Cava ist wie oben beschrieben am Halterapparat und Haltersockel befestigt,
- Entfernen Sie die 3D-Druckerhalter (Porta und Cava) mit einer rundgekippten Schere (Schneiden Sie den Sicherungsstich; Abbildung 3C), was zu einem angeschlossenen IHVC führt (Abbildung 3D).
- Untersuchen Sie den Bereich um die Leber sorgfältig auf Blutungen. Instillieren Sie 3 ml 37 °C Ringer-Laktatlösung in der Körperhöhle.
- Arterielle Anastomose: Schneiden Sie den Teil des Zöliakiestamms vom Spender ab, der über den Stent hinausgeht.
- Klemmen Sie die richtige HA des Empfängers und schneiden Sie die Krawatte am Ende ab. Schneiden Sie zusätzliches Gewebe, das das Gefäß umgibt (Abbildung 4A). Mit Ringers Laktatlösung spülen Sie die Lumen von Spender- und Empfängergefäßenen.
- Ziehen Sie den Empfänger richtige HA in die Hülse des Spenders HA Stent, um die HA Anastomose zu erreichen. Legen Sie einen 10-0 Ethilon durch den linken Aspekt des (Spender) HA, 2,5 mm über der distalen Öffnung des Stents (von außen nach innen), dann durch das Ende des Stents, mit 10-0 Ethilon (4 cm Länge) durch eine gekrümmte Nadel geführt (Abbildung 4B).
- Transfixieren Sie den Empfänger 0,5 mm unter der Gefäßöffnung, platzieren Sie den Stich zuerst (von innen nach außen) auf die linke Seite des Gefäßes, dann (von außen nach innen) auf die rechte Seite der Arterie.
- Legen Sie die Naht durch die rechte Wand des (Spender-) HA von innen nach außen, in einem Abstand von der Stentöffnung, die mit dem ursprünglichen Stich identisch ist. Ziehen Sie an den beiden Enden des 10-0 nicht resorbierbaren Monofilaments nach oben, wodurch der Empfänger die richtige HA nach oben und in den HA-Stent rutscht (Abbildung 4C).
HINWEIS: Beobachten Sie das Pumpen von Blut. Eine Möglichkeit besteht darin, den Spender-GDA zu schneiden, um zu bestätigen, dass Blut durch die Anastomose pumpt. Achten Sie darauf, die Arterie neu zu binden, bevor Sie in den nächsten Schritt des Verfahrens wechseln, wenn der GDA abgetrennt wird. - Binden Sie das 10-0 nicht resorbierbare Monofilament mit sich selbst über den Spender HA (Abbildung 4D). Die arterielle Anastomose ist nun abgeschlossen.
- Gallenanastomose: Legen Sie eine Krawatte locker um den Empfänger BD und Stent (Abbildung 5A), dann entfernen Sie den BD-Stent. Spülen Sie den BD sowohl des Empfängers als auch des Spenders, bevor die Gallenverbindung abgeschlossen ist.
- Legen Sie den BD-Stent des Spenders in den Gallengang des Empfängers ein (Abbildung 5B) und ziehen Sie die Krawatte fest, die zuvor um den Empfänger BD gelegt wurde (Abbildung 5C).
- Bringen Sie den Darm in die Körperhöhle zurück. 2 ml 37 °C Ringer-Laktatlösung in den Hohlraum einlassen, um ihn zu spülen. Etwas von der Lösung mit Gaze einweichen.
- Stellen Sie sicher, dass sich der Darm wieder in seiner ursprünglichen Position befindet, bevor Sie das parietale Peritoneum und die Haut mit 5-0 Monocryl aufnähen.
- Schließen Sie den Schnitt in zwei Schichten mit 5-0 Monocryl. 0,5 ml 0,5% Bupivacain um das genähte parietale Peritoneum injizieren und wiederholen, sobald die Haut zusammengenäht ist.
- Wickeln Sie die Empfängerratte beim Übertragen in den Käfig vorsichtig in ein Papiertuch. Gewähren Sie dem Tier freien Zugang zu Wasser und Nahrung aus der Zeit des Erwachens. Halten Sie eine warme wasserzirkulierende Decke unter der Hälfte des Käfigs für 24-38 h. Eine Ratte wird während der unmittelbaren postoperativen Periode in einen Käfig ausgewiesen.
5. Postoperative Pflege
- Essenpellets in Wasser einweichen und in eine Petrischale auf dem Käfigboden legen.
- Überwachen Sie die Herzfrequenz, die Atemfrequenz und die Hautfarbe der Ratte.
- Piperacillin an den postoperativen Tagen 1, 2 und 3 verabreichen. Buprenorphin subkutan verabreichen und auf Anzeichen von Schmerzen wie Verhaltensänderungen, Lethargie, ungezimmertes Fell, Depression, Verstümmelung oder Appetitlosigkeit für die ersten 72 h überwachen.
HINWEIS: Schmerzen werden mindestens 2x täglich für 3 Tage nach der Transplantation, dann mindestens 1x täglich bewertet.
Representative Results
Bei der Erstellung eines OLT-Modells für Nicht-HA-Anastomoseratten unter Verwendung eines zuvor beschriebenen Protokolls28beobachtete unser Team 50 % bzw. 37,5 % Überlebensraten bei 21 Tagen bzw. 60 Tagen nach der Operation. Obwohl hohe Raten des langfristigen Überlebens ohne HA Anastomose von einigen Gruppen berichtet wurden28, diese frühen Ergebnisse zeigen die Nachteile von nicht mit arteriellen Zustrom. Im Gegensatz dazu erhöhte das optimierte HA-Wiederverbindungsverfahren das Langfristige Überleben signifikant von 37,5 % auf 88,2 % (p = 0,015) (Abbildung 6).
Die histologische Analyse einer repräsentativen Teilmenge transplantierter Tiere ohne HA-Wiederverbindung (an den Tagen 6 und 13 nach der Operation) zeigte Anzeichen einer hypoxischen Leberverletzung mit zentriobularer Nekrose (Abbildung 7). Umfangreiche Lebernekrose war mit enorm erhöhten Konzentrationen von Alanin-Aminotransferase (ALT) und Aspartat-Aminotransferase (AST) bei diesen Tieren verbunden (Abbildung 7). Im Gegensatz dazu zeigten transplantierte Ratten mit HA-Wiederverbindung keine Anzeichen einer Leberverletzung, und histologische Analysen zeigten eine normale Leberparenchymstruktur mit organisierten Acini, Lobulen (z. B. mittelven- und Portaltriaden mit Lebervene), Arterien und Gallengang (Abbildung 7).
Obwohl die mittlere anhepatische Zeit im Laufe von 23 separaten Operationen akzeptabel war (12 min und 14 s [± 78 s]), ist es immer noch möglich, dass das Überleben im Nicht-HA-Wiederverbindungsmodell schließlich mit verstärkter Praxis verbessert werden kann. Es ist jedoch erwähnenswert, dass drei der vier Tiere, die ohne HA-Wiederverbindung transplantiert wurden (die für ein langfristiges Überleben verfolgt wurden), aufgrund von Not an den Tagen 56, 96 und 111 nach der Operation eingeschläfert wurden. Zusätzlich ergab die histologische Analyse der Leber nümische Veränderungen nach hypoxischen Leberverletzungen, einschließlich ausgeprägter Gallengangproliferation, Periportalfibrose und Entzündung, und verzerrtem Leberparenchym (Zusatzabbildung 2). Das Vorhandensein morphologischer Merkmale einer hypoxischen Leberverletzung bestätigt die Befunde, dass die HA-Wiederverbindung für eine effiziente Leberdurchblutung und normale Funktion wichtig ist.

Abbildung 1: Schematische Darstellung des 3D-gedruckten Manschettendesigns für Portalvene und infrahepatische untere Vena cava. Die erste Krawatte wird in der Nut (ii) am nächsten am Griff (iii) angezogen, und die zweite Krawatte wird in der Nut (i) am weitesten vom Griff entfernt angezogen. Die Außendurchmesser betragen (iv) 2,38 mm für die Portalvene (PV) und 2,15 mm für die infrahepatische untere Vena cava (IHVC). Die Innendurchmesser sind (v) 1,74 mm für die PV und 1,38 mm für den IHVC. Die Längen sind (vi) 2,60 mm für die PV und 2,15 mm für den IHVC (genaue Spezifikationen für alle 3D-gedruckten Materialien finden Sie in Ergänzenden Materialien). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Hepatische Arterien-Stent-Insertion in Transplantat. (A) Das Öffnungsende des Zöliakiestamms (i) wird durch Schneiden der Milzarterie auf die linke Magenarterie erweitert, die die Bifurkation des gemeinsamen HA freilegt. ii) Der BD-Stent ist vor der Extraktion der Spenderrattenleber gebunden. iii) Die PV-Manschette und (iv) die IHVC-Manschette werden durch Falten der Enden der Gefäße über die Manschette eingesetzt und gebunden. (B) (i) Um den HA-Stent einzusetzen, wird der exponierte gemeinsame HA mehrfach mit Zangen gestreckt. (C) (i) Der HA-Stent wird sicher in der gemeinsamen HA platziert und mit 8-0 Prolene. (D) (i) Der HA-Stent wird mit (ii) Ringer-Laktatlösung gespült (BD = Gallengang, IHVC = infrahepatische untere Vena cava, HA = Hepatische Arterie). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Infrahepatische untere Vena-Cava-Verbindung mit 3D-gedrucktem Halter. (A) Die (i) PV wird mit der gleichen Technik wie die IHVC-Verbindung verbunden. Das Transplantat wird (ii) über die (iii) IHVC-Manschette geklemmt. Die Empfänger-IHVC-Öffnung wird (iv) an den Seiten der Öffnung zu einem 3D-gedruckten Halter vernässt, um sie offen zu halten. Eine lose (v) 7-0 Seide ist um den Empfänger IHVC gebunden. (B) Die Manschette des Transplantats IHVC wird (i) in den Empfänger IHVC eingesetzt. Die lose Krawatte ist nun angezogen. (C) Die Klemme wird entfernt, und (i) der 3D-gedruckte Halter wird mit einer Schere abgenommen. (D) Eine zusätzliche (i) 7-0 Seide ist um die Verbindung gebunden, wenn nicht sicher, aber in der Regel eine Krawatte ist ausreichend (PV = Portal Vene, IHVC = infrahepatische minderwertige Vena cava). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Mikrovaskuläre Hülsenverbindung der Leberarterie. (A) (i) Der BD-Stent ist nicht mit dem Empfänger verbunden. ii) Der HA-Stent wird in das Transplantat gelegt, das mit dem richtigen HA des Empfängers verknüpft ist. (iii) Die PV ist angeschlossen. (B) 10-0 ethilon mit einer (i) gekrümmten Nadel wird durch den HA-Stent an die Seiten des Empfänger-HA-Öffnungsendes gezogen. (C) Der 10-0 Ethilon wird durch den HA-Stent zurückgezogen; Daher wird der richtige HA des Empfängers wie eine Hülse durch den Stent gezogen. (D) (i) Eine Krawatte mit 10-0 ethilon wird hergestellt, sobald der richtige HA des Empfängers in den Stent gezogen wird, auf den Teil, der zuerst durch den HA-Stent läuft. (E) Hier ist ein Schaltplan der HA-Anastomose in beschrieben (B), (C) und (D) (BD = Gallengang, HA = Hepatische Arterie, PV = Portalvene). *Das Öffnungsende des Zöliakie-Stamms wird durch Schneiden der Milzarterie auf die linke Magenarterie erweitert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Bile-Kanal-Anschluss mit zwei Stents. (A) (i) Graft BD Stent wird mit Hilfe des (ii) Stents, der lose an der Öffnung des BD des Empfängers gebunden ist, in den Empfänger-BD-Stent eingeführt. (iii) Die PV ist vor der BD-Verbindung verbunden, die sich hinter der BD befindet. (B) Der Stent am Ende des BD des Empfängers wird entfernt und als verbreiterte Öffnung zum (i) Einschub verwendet. (C) Die Krawatte, die den Empfängerstent lose sichert, wird nun verwendet, um die Verbindung zu binden, und (i) eine weitere 7-0 Seide wird verwendet, um den Stent fest an Ort und Stelle zu halten, um ein Verrutschen oder Verdrehen des Stents zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Überleben in Transplantationsprozent. Orthotopische Rattenlebertransplantation ohne HA-Wiederverbindung (n = 8) und mit HA-Wiederverbindung (n = 17). Tiere werden nach der Transplantation bei Anzeichen von Leberversagen und/oder Infektionen für mindestens 60 Tage genau verfolgt. Ratten, die nach der Operation keine Komplikationen zeigten, galten als Überlebende (*p = 0,015, wie nach Kaplan-Meier-Schätzung berechnet [Langrangtest]). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Leber histopathologische Bewertung. Repräsentative Hämatoxylin- und Eosin-gefärbte Abschnitte bei Tieren (A) ohne und (B) mit Leberarterie (HA) wieder verbunden an den Tagen 6 und 13 nach Lebertransplantation (LTx). (C) Normales Leberparenchym mit Portaltriade (Portalvene, Arterie und Gallengang), Lobulen einschließlich zentraler Vene und Acini. Hepatozyten neben der Portaltriade sind Hepatozyten der Zone 1; Hepatozyten neben der zentralen Vene in den Lobulen sind Zone 3 Hepatozyten; und Hepatozyten zwischen den Zonen 1 und 3 sind Zone 2 Hepatozyten (ALT = Alanin-Aminotransferase, AST = Aspartat-Aminotransferase, CV = zentrale Vene). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 1: Stent- und Manschettenmaße. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 2: Leber histopathologische Bewertung, die eine Störung des Leberparenchyms zeigt. Repräsentative Hämatoxylin- und Eosin-gefärbte Abschnitte bei Tieren ohne HA-Wiederverbindung an den Tagen 54, 96 und 111 nach LTx. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsmaterial 1: Porta Manschette 200g - Unterstützung 2.0. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 2: Cava Manschette 200g - Unterstützung 2.0. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 3: Leberretraktor 200g. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 4: Rückhalter - 1.2. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 5: Cava 150g - 2.1. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzendes Material 6: Porta 1.4.1. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 7: Halterarm McGil. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Zusatzmaterial 8: Halter Miniarm LAB. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 9: Halter und Arm weich Teil 1.3. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Ergänzungsmaterial 10: Haltersockel - 3.1. Bitte klicken Sie hier, um diese Datei anzuzeigen (Rechtsklick zum Herunterladen).
Discussion
Kleintierlebertransplantationsmodelle sind wichtig, um die Transplantatimmunität zu verstehen und neuartige therapeutische Strategien zu identifizieren32. Das ideale Modell der Kleintierlebertransplantation repliziert alle Schritte des menschlichen Verfahrens, einschließlich der arteriellen Anastomose. Es kann schwierig sein, Ergebnisse aus dem OLT-Modell der Ratte zu interpretieren, da die meisten Versionen keinen HA-Anastomose-Schritt enthalten, was zu höheren Komplikations- und Morbiditätsraten führt42. Einige Rekonstruktionsverfahren haben die Nierenarterie verwendet, die Entfernung der Niereerfordert 27. Dieses Protokoll vermeidet die Organentfernung, da es über das hinausgeht, was im menschlichen Verfahren vorkommt.
Arterielle Rekonstruktionen können auch durch Manipulation der Rattenaorta31durchgeführt werden. Diese Methoden erfordern jedoch eine umfangreiche Zerlegung und Klemmung der Aorta. Wenn die Klemmzeit verlängert wird, dann wird die Empfängerratte schlechte Ergebnisse im Zusammenhang mit distaler Ischämie43haben. Beim Menschen beinhaltet eine LT-Chirurgietechnik die Ligation und Teilung der Empfänger-Gastroduodenalarterie (GDA). Die physiologischen und anatomischen Merkmale von Nagetieren machen die Transplantation mit dieser Technik jedoch physiologisch anspruchsvoller und können zu Komplikationen führen (d. h. Nekrose der Bauchspeicheldrüse und des Gallengangs35 und Gallenleckage44). Die arterielle Wiederverbindung in diesem Protokoll soll diese Herausforderung umgehen, den Kanaldurchfluss aufrechterhalten und das Empfängerergebnis verbessern.
Die Verwendung einer Hülsen- und Stenting-Technik zur Rekonstruktion der Ratte HA wurde bereits beschrieben27. Bei dieser Technik wird ein Stent als Leitfaden verwendet, und die Arterie wird vom Spenderzöllstamm zum Empfänger common HA rekonstruiert. Der gemeinsame HA des Empfängers wird dann seziert, und der Empfänger-GDA wird27abgebunden. Als Ergebnis kann die Blutversorgung des unteren Teils des Empfängers BD und Kopf der Bauchspeicheldrüse beeinträchtigt werden. Es wird angenommen, dass die Kollateralzirkulation in diesen Bereich oft unzureichende Durchblutung des Gallengangs bietet. Dieses Protokoll-Test klemmt z. B. den Empfänger-GDA zunächst mit einem mikrovaskulären Clip und teilt dann den Empfänger-BD. Mit dem GDA geklemmt, blutet der geteilte BD nicht. Nach dem Entfernen der GDA-Klemme wird eine kräftige Blutung aus dem BD beobachtet. Dieses Protokoll, das einen guten Fluss zum geteilten Empfänger Gallengang aufrechterhält, schützt die Physiologie des Lebergewebes des Empfängers, indem es eine ausreichende Leberblutdurchblutung bereitstellt und eine hypoxische Leberverletzung nach dem OLT verhindert.
Auf der Spenderseite wird der HA-Stent während der Transplantatvorbereitung mit Leichtigkeit in den Zöliakiestamm eingeführt, indem ein Pflaster aus dem Zöliakiestamm, der linken Magenarterie und der Milzarterie erstellt wird. Der Stent kann durch die breite Öffnung eingeführt werden, was weniger schwierig ist, als zu versuchen, den Stent allein in den Zöliakiestamm einzufügen. Es wurde festgestellt, dass 24 G eine ideale Größe für den HA-Stent ist. Die Länge des Stents sollte 1,0-1,5 mm lang sein, da er als offenes Tor dient, damit der richtige HA des Empfängers leicht in die gemeinsame HA des Spenders gezogen werden kann. Mit sorgfältiger Aufmerksamkeit, wo die 10-0 Ethilon Naht platziert wird, wird Blut, das durch diese Verbindung fließt, nie den Stent direkt berühren, und die richtige HA des Empfängers wird ihn von innen abschirmen, wodurch das Risiko von Komplikationen reduziert wird. Wichtig ist, dass die HA des Spenders nie eingeklemmt wird, um Vasospasmus zu vermeiden. Der Erfolg der arteriellen Rekonstruktion wird bewertet, indem der Spender GDA offen gelassen wird. Eine erfolgreiche Anastomose führt nach Abschluss des Wiederaufbaus zu einem guten Blutfluss des Spender-GDA.
In diesem Protokoll ist die SHVC-Wiederverbindung, ähnlich wie bei anderen, der langsamste Schritt und bestimmt letztlich die Dauer der anhepatischen Phase. Mit zunehmender Dauer der anhepatischen Zeit erhöht sich das Risiko ischämischer Verletzungen und Leberfunktionsstörungenum 45. Eine weitere wichtige Komponente der OLT-Rattenmodelle sind die Größe des Transplantats, der Stents und der Manschetten. Wenn das Transplantat zu klein ist, kann sich das Transplantat drehen oder kippen, was die Gefäßverbindungen behindert. Die Größe der Stents und Manschetten kann Anpassungen in Anmaßung des Alters, des Geschlechts, des Gewichts und der Belastung der Ratte erfordern. Die Größe der hier verwendeten Manschetten wurde wie zuvor beschrieben28gewählt, und es wurde eine Manschettengröße verwendet, die für die Rattengröße kontrolliert wurde. Während der Nachbeobachtungszeit (bis heute: Median = 133 Tage nach der Operation, mindestens = 115 Tage nach der Operation, maximal = 161 Tage nach der Operation) gab es keine Anzeichen von Not oder Komplikationen (d. h. Leberstaus, Ödeme, Aszites oder Splenomegalie). Weitere Studien zur Bestimmung der geeigneten Größe von PV und IHVC für verschiedene Rattenstämme, die sowohl Alter als auch Geschlecht berücksichtigen, sind gerechtfertigt.
Dieses modifizierte Ratten-OLT-Protokoll verwendet 3D-gedruckte Manschetten für PV und IHVC, wie zuvor beschrieben39,40. Bestehende Methoden zum Anschluss der PV und IHVC umfassen eine Mikronahttechnik32, Manschettentechnik46und Mikronaht-temporäre Schiene Technik47. Die 3D-gedruckte Manschettentechnik wurde gewählt, da sie es ermöglicht, die Größe der Manschette nach Rattenstamm zu standardisieren und ist einfach zu zuzubereiten und zu verwenden. Große Mengen von Manschetten mit den gleichen Abmessungen können auf einmal gedruckt werden. Die Außenfläche der Manschette hat zwei Rillen, um die Sicherung der Krawatten zu unterstützen und ein Verrutschen zu verhindern. Ein Schwanz ist auch in das Manschettendesign integriert, um eine einfachere Manipulation der Manschette zu ermöglichen. Insgesamt wird angenommen, dass die Integration von 3D-gedruckten Manschetten zu hohen Erfolgsraten und Reproduzierbarkeit des OLT-Verfahrens führt, indem die Anhepatenzeit verkürzt wird. Es wird festgestellt, dass diese Technik auch die chirurgische Lernkurve verkürzt.
Zusammenfassend wurde mit dem beschriebenen Protokoll ein Modell festgelegt, das der Transplantation menschlicher Leber ähnlicher ist, indem ein arterieller Wiederverbindungsschritt integriert wird. Dieses Protokoll kann angepasst werden, um viele immunologische und chirurgische Aspekte der Lebertransplantation zu untersuchen und kann als Modell dienen, um neuartige therapeutische Interventionen zu testen, die für die Transplantation relevant sind.
Disclosures
Die Autoren haben nichts zu verraten.
Acknowledgments
Diese Forschung wurde aus Mitteln des Multi-Organ-Transplantationsprogramms an der UHN und der Unterstützung der Toronto General und Toronto Western Foundation finanziert.
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).