Summary
यह प्रोटोकॉल बड़े प्लाज्मिड (10 केबी की सीमा तक) के साथ चार अलग-अलग गैस्ट्रोइंटेस्टाइनल ऑर्गेनॉइड संस्थाओं के ट्रांसफेक्शन के लिए एक कुशल इलेक्ट्रोपोरेशन विधि का वर्णन करता है। यह एक दिन के भीतर किया जा सकता है और व्यापक तैयारी या विशेष, लागत गहन इलेक्ट्रोपोराशन बफ़र्स की आवश्यकता नहीं है।
Abstract
इलेक्ट्रोपोराशन प्लाज्मा झिल्ली के विद्युत पार्म्यीकरण द्वारा विभिन्न प्रकार के अणुओं के साथ ट्रांसफेक्शन के लिए एक आम विधि है। पिछले वर्षों में प्राथमिक रोगी सामग्री के लिए एक खेती विधि के रूप में ऑर्गेनॉइड के बढ़ते उपयोग के साथ, इस 3 डी संस्कृति प्रणाली में आनुवंशिक इंजीनियरिंग के लिए घटकों के कुशल हस्तांतरण तरीकों की आवश्यकता है। विशेष रूप से ऑर्गेनॉइड के लिए, आनुवंशिक जोड़तोड़ की दक्षता एक सफल ट्रांसफेक्शन पर निर्भर करती है। इस प्रकार, यह प्रोटोकॉल ऑर्गेनॉइड के इलेक्ट्रोपोशन को सुविधाजनक बनाने और विभिन्न संस्थाओं में अपनी सार्वभौमिक कार्यक्षमता को साबित करने के लिए विकसित किया गया था। मानव कोलोरेक्टल, अग्नाशय, हेपेटिक और गैस्ट्रिक कैंसर ऑर्गेनॉइड की तुलना में छोटे और बड़े प्लाज्मिड के साथ सफलतापूर्वक इलेक्ट्रोपोरेट किए गए थे। जीएफपी एन्कोडिंग वैक्टर के आधार पर, ट्रांसफेक्शन दक्षता एफएसीएस द्वारा निर्धारित की गई थी। कोशिकाओं या विशेष, लागत-गहन विद्युत बफ़र्स की कोई व्यापक तैयारी आवश्यक नहीं है, और प्रोटोकॉल एक दिन के भीतर किया जा सकता है।
Introduction
हाल के वर्षों में, एक उपन्यास 3 डी सेल संस्कृति प्रणाली, जिसे ऑर्गेनॉइड कहा जाता है, विभिन्न सामान्य और कैंसर ऊतकों के लिए विकसित किया गया था। ऑर्गेनॉइड कार्यात्मक रूप से और रूपात्मक रूप से उनके मूल के ऊतकों के बहुत करीब होते हैं। वे विभिन्न प्रजातियों से उत्पन्न हो सकते हैं, आसानी से विस्तारयोग्य, मिलनसार रूप से स्थिर और आनुवंशिक रूप से संशोधित होते हैं, जो उन्हें आनुवंशिक जांच के लिए एक आदर्श मॉडल प्रणाली बनाता है1,2,3। CRISPR (संकुल नियमित रूप से इंटरस्पेस्ड शॉर्ट पैलिंड्रोमिक रिपीट्स) /Cas9 प्रणाली जैसी जेनेटिक इंजीनियरिंग तकनीक विविध जोड़तोड़ को सक्षम करती है । क्लोन के चयन को परिभाषित मीडिया स्थितियों द्वारा महसूस किया जा सकता है, उदाहरण के लिए, एपीसी (एडेनोमाटोसिस पॉलीपोसिस कोलाई) नॉकआउट क्लोन4,5के लिए डब्ल्यूएनटी लिगलैंड वापसी द्वारा। वैकल्पिक रूप से, चयन मार्कर को लक्ष्यीकरण वेक्टर6,7की मरम्मत के अनुसार निर्देशित द्वारा पेश किया जाना चाहिए। इस तथ्य के कारण कि अक्सर एक से अधिक प्लाज्मिड को पेश करने की आवश्यकता होती है, एक कुशल ट्रांसफेक्शन एक महत्वपूर्ण पैरामीटर बन जाता है। इसके अतिरिक्त, अविशिष्ट ऑफ-टारगेट प्रभावों को कम करने के लिए, Cas9 एंनोटुकलीज की क्षणिक अभिव्यक्ति वांछनीय8है।
इलेक्ट्रोपोराशन डीएनए, आरएनए, प्रोटीन या अन्य मैक्रोअणुओं के साथ कोशिकाओं को स्थानांतरित करने के लिए तुलनात्मक रूप से सरल विधि है। विद्युत दालों के माध्यम से, कोशिका झिल्ली अधिक सामर्य हो जाती है और9में वृद्धि का कारण बनती है। कोलन ऑर्गेनॉइड के पहले प्रकाशित इलेक्ट्रोपोरेशन प्रोटोकॉल में एक गुल्लक-बीएसी जीएफपी (ग्रीन फ्लोरोसेंट प्रोटीन) व्यक्त करने वाले वेक्टर (7.4 केबी) के साथ30%दक्षता चार दिनों की प्रक्रिया 10 में पहुंच गई थी। निम्नलिखित प्रोटोकॉल एकल गाइड आरएनए (एसजीआरएनए) और कै9 एंडोन्यूलीज अनुक्रम (जैसे 9.3 केबी के साथ वेक्टर के रूप में px458) के लिए बड़े प्लाज्मिड्स एन्कोडिंग के साथ कैंसर या स्वस्थ ऑर्गेनॉइड के कुशल ट्रांसफेक्शन को सुविधाजनक बनाने के लिए विकसित किया गया था। पूरी इलेक्ट्रोपोराशन प्रक्रिया एक दिन के भीतर, विशेष इलेक्ट्रोपोशन बफ़र्स के बिना, और विभिन्न गैस्ट्रोइंटेस्टाइनल ऑर्गेनॉइड के बीच कम से कम तुलनीय क्षमताओं के साथ किया जा सकता है, अर्थात् अग्नाशय के डक्टल एडेनोकार्सिनोमा (पीडीएसी), कोलोरेक्टल कैंसर (सीआरसी), कोलेंगियोकार्सिनोमा (जीसी) अंग।
Protocol
टीयू ड्रेसडेन (#EK451122014) की नैतिक समिति से नैतिकता की मंजूरी ली गई थी।
1. इलेक्ट्रोपॉरेशन से पहले ऑर्गेनॉइड कल्चर और तैयारी
- ऊतक पाचन द्वारा ऑर्गेनोइड स्थापित करें जैसा कि पहले वर्णित है और उन्हें तहखाने मैट्रिक्स में अपनी संबंधित इकाई विशिष्ट संस्कृति माध्यम से विस्तारित करें (अवलोकन तालिका 1 और सामग्री की तालिकादेखें)11,12,13,14,15,16,17।
नोट: मानव ऊतक के नमूनों के लिए सूचित सहमति और एक नैतिक समिति द्वारा अध्ययन के अनुमोदन आवश्यक है । - इलेक्ट्रोपोशन सीडिंग के बाद 37 डिग्री सेल्सियस पर प्रीवार्म 48-कूवित प्लेटें।
- बेसल मीडियम डब्ल्यू/ओ एंटीबायोटिक्स के साथ-साथ एंटिटी स्पेसिफिक ऑर्गेनॉइड कल्चर मीडियम डब्ल्यू/ओ एंटीबायोटिक्स (टेबल 1देखें) तैयार करें जिसमें 10 माइक्रोन वाई-२७६३२ और 3 माइक्रोन चिर99021 शामिल हैं ।
नोट: विषाक्त प्रभावों को कम करने के लिए एंटीबायोटिक दवाओं की वापसी महत्वपूर्ण है। वाई-27632 और CHIR99021 सुधार सेल वसूली10. -
ऑर्गेनोइड की तैयारी (चित्रा 1देखें)
- संस्कृति माध्यम में इलेक्ट्रोपोशन सैंपल के प्रति 48-वेल प्लेट में ऑर्गेनॉइड के 5 कुओं की खेती करें।
नोट: प्रोलिफेरेटिव ऑर्गेनॉइड का उपयोग किया जाना चाहिए (पिछले बंटवारे के लगभग 2-3 दिन बाद)। - 10 μM Y-27632 प्रति अच्छी तरह से सहित विच्छेदन अभिकर्मक (सामग्री की तालिकादेखें) के 230 μL तैयार करें।
- प्रत्येक कुएं से संस्कृति माध्यम निकालें और तैयार वियोजन मिश्रण के 230 माइक्रोन में यांत्रिक रूप से ऑर्गनॉइड को अलग करें। पूल 5 कुओं प्रति इलेक्ट्रोपोराशन नमूना एक 15 मीटर ट्यूब में ।
- भंवर द्वारा मिश्रण और 37 डिग्री सेल्सियस पर 5-15 मीटर के लिए इनक्यूबेट जब तक 10-15 कोशिकाओं के समूह ों होते हैं। इसलिए, विसोशन माइक्रोस्कोपिक रूप से जांच करें। 10 मीटर तक बेसल मीडियम डब्ल्यू/ओ एंटीबायोटिक्स डालकर पाचन बंद करें।
नोट: यह कदम बहुत महत्वपूर्ण है! विद्युत क्रिया क्षमता कम हो जाएगी, जब ऊष्मायन बहुत कम होगा, लेकिन लंबे पाचन से जीवितता कम हो जाएगी। - कमरे के तापमान पर 5 न्यूनतम के लिए 450 x ग्राम पर अपकेंद्रित्र, सुपरनेटेंट को त्यागें और इलेक्ट्रोपोराशन बफर के 4 मीटर के साथ दो बार धोएं (सामग्री की तालिकादेखें)।
- संस्कृति माध्यम में इलेक्ट्रोपोशन सैंपल के प्रति 48-वेल प्लेट में ऑर्गेनॉइड के 5 कुओं की खेती करें।
2. इलेक्ट्रोपोरेशन
नोट: निम्नलिखित प्रोटोकॉल वर्ग तरंगों में सक्षम इलेक्ट्रोपोरेटर के लिए विकसित किया गया है और अलग पोरिंग और स्थानांतरण पल्स दृश्यों (चित्रा 2देखें) । वैकल्पिक रूप से, बाधा मूल्यों के साथ-साथ नमूने में स्थानांतरित वोल्टेज, धाराओं और ऊर्जा को प्रजनन योग्य प्रयोगों के लिए नियंत्रण के रूप में मापा जा सकता है।
- इलेक्ट्रोपोशन बफर के 100 माइक्रोन में ऑर्गेनॉइड पैलेट को फिर से निलंबित करें (सामग्री की तालिकादेखें) जिसमें प्लाज्मिड डीएनए का 30 μg होता है।
नोट: प्रयुक्त प्लाज्मिड डीएनए की एकाग्रता इलेक्ट्रोपोराशन प्रक्रिया के दौरान इष्टतम नमक एकाग्रता के लिए 5 μg/μL से अधिक होनी चाहिए । इसलिए, वेक्टर तैयार करने के लिए एंडोफ्री प्लाज्मिड मैक्सी किट (सामग्री की तालिकादेखें) की सिफारिश की जाती है। डीएनए के 45 μg तक कुल राशि साइटोटॉक्सिक प्रभाव के बिना इस्तेमाल किया जा सकता है। - हवा के बुलबुले का उत्पादन किए बिना 2 मिमी गैप चौड़ाई के साथ एक इलेक्ट्रोपोराशन क्यूवेट में पूर्ण डीएनए-ऑर्गेनॉइड मिश्रण को वितरित करें।
- फुजी एट अल10 के अनुसार इलेक्ट्रोपोरेशन पैरामीटर सेट करें (तालिका 2, चित्रा 2देखें)।
- एक उंगली के साथ cuvette दोहन द्वारा फोमिंग के बिना कोशिकाओं को थोड़ा मिलाएं। क्यूवेट को क्यूवेट चैंबर में रखें।
- इलेक्ट्रोपोरेटर का ω बटन दबाएं और बाधा मूल्य का नोट बनाएं।
नोट: 30-40 के बीच एक बाधाω सबसे अच्छा परिणाम दिखाया । सामान्य तौर पर यह 30-55 के बीच की रेंज में होना चाहिएω। यदि यह मामला नहीं है, तो कृपया निम्नलिखित पहलुओं को नियंत्रित करें: उपयोग किए गए क्यूवेट की गैप चौड़ाई, इलेक्ट्रोपोरेटर के केबल कनेक्शन, संभावित हवा के बुलबुले, इलेक्ट्रोपोराशन मिश्रण की सही मात्रा और नमक एकाग्रता। - इलेक्ट्रोपॉरणेशन प्रोग्राम को निष्पादित करने और प्रदर्शित धाराओं, वोल्टेज और ऊर्जा के मूल्यों को नियंत्रित करने के लिए स्टार्ट बटन दबाएं।
नोट: मापा वोल्टेज, धाराओं और ऊर्जा के मूल्यों सेट इलेक्ट्रोपोशन मापदंडों के अनुरूप होना चाहिए । बार-बार प्रयोगों की तुलना के लिए, इन डेटा को नोट करना मददगार हो सकता है। - इलेक्ट्रोपॉरेशन के बाद, तुरंत संस्कृति माध्यम w/o एंटीबायोटिक दवाओं के ५०० μL जोड़ें (CHIR99021 और Y-२७६३२ के साथ; कदम १.३ देखें) । सफेद फोम को अलग करने के लिए ऊपर और नीचे पाइपिंग करके मिलाएं।
नोट: सफेद फोम इलेक्ट्रोपोशन प्रक्रिया के बाद दिखाई देता है और कोशिकाओं की एक महत्वपूर्ण संख्या से जुड़ा हुआ है । इसलिए कोशिकाओं को न खोने के लिए इसका विसोशन बहुत जरूरी है। - इलेक्ट्रोपोराशन क्यूवेट से संबंधित पिपेट का उपयोग करके क्यूवेट से नमूना को पूरी तरह से 15 मिलीएल ट्यूब में स्थानांतरित करें (सामग्री की तालिकादेखें)। शेष कोशिकाओं को प्राप्त करने के लिए बेसल माध्यम के साथ फिर से क्यूवेट को फिर से बंद करने की सिफारिश की जाती है।
- कोशिकाओं के उत्थान के लिए, उन्हें कमरे के तापमान पर 40 मीटर के लिए इनक्यूबेट करें।
3. कोशिकाओं की सीडिंग
- कमरे के तापमान पर 5 न्यूनतम के लिए 450 x ग्राम पर कोशिकाओं को अपकेंद्रित करें और सुपरनेटेंट को त्यागदें।
- एक पूर्वगरम 48-अच्छी तरह से प्लेट में तहखाने मैट्रिक्स और बीज 20 μL बूंदों के 100 μL में गोली को फिर से निलंबित करें (चरण 1.2 देखें)। बहुलीकरण के लिए 37 डिग्री सेल्सियस पर 10 00 के लिए इनक्यूबेट और संस्कृति माध्यम के 250 μL जोड़ें, जो विकसित ऑर्गेनॉइड (लगभग 5-7 दिनों) के अगले विभाजन तक वाई-27632 और चिर99021 के साथ पूरक है।
4. ट्रांसफेक्शन दक्षता का निर्धारण
नोट: सामान्य तौर पर, अतिरिक्त ट्रांसफेक्शन नियंत्रण के रूप में फ्लोरेसेंस मार्कर ले जाने वाले वेक्टर को इलेक्ट्रोपोरेट करने की सिफारिश की जाती है। चुने हुए मार्कर और उसके गुणसूत्र परिपक्वता पर निर्भर फ्लोरेसेंस लगभग 24-48 घंटे पोस्ट ट्रांसफेक्शन18के भीतर दिखाई देगा।
- ट्रांसफेक्शन कंट्रोल में 24-48 घंटे के बाद फ्लोरेसेंस माइक्रोस्कोपी की जांच करें (चित्रा 4बीदेखें)।
-
फ्लोरोसेंट सक्रिय सेल स्कैनिंग (FACS)
- कोशिकाओं को 1.4.2-1.4.4 कदम करने के लिए अनुरूप रूप से फसल करें और 10-20 0 0 के आसपास पचाएं जब तक कि एकल कोशिकाएं न हों। फॉस्फेट-बफर्ड लवइन (पीबीएस) के 10 मिलील तक जोड़ें।
- कमरे के तापमान पर 5 न्यूनतम के लिए 450 x ग्राम पर अपकेंद्रित्र और अलौकिक त्यागें।
- जीवित कोशिकाओं के भेदभाव के लिए वैकल्पिक रूप से: फॉस्फेट-बफर्ड लवण (पीबीएस) के 1 एमएल में गोली को फिर से निलंबित करें और एक उपयुक्त एंटीबॉडी जोड़ें (सामग्री की तालिकादेखें) या प्रोपिडियम आयोडाइड (पीआई)। अंधेरे में कमरे के तापमान पर 30 मिनट के लिए टैप करके और इनक्यूबेट द्वारा बहुत सावधानी से मिलाएं। पीबीएस के 10 mL के साथ धोएं, अपकेंद्री और अतिशयोक्ति त्यागें।
- पीबीएस के 200 माइक्रोन में सेल पैलेट को फिर से निलंबित करें और वैकल्पिक रूप से 100 माइक्रोन सेल छलनी के माध्यम से निलंबन को एक FACS ट्यूब में फ़िल्टर करें।
- एक उपयुक्त गेटिंग रणनीति का उपयोग करके एक FACS मशीन द्वारा कोशिकाओं का विश्लेषण करें (चित्रा 3देखें; चित्रा 4ए)और ट्रांसफेक्शन दक्षता निर्धारित करें।
Representative Results
चार अलग-अलग कैंसर संस्थाओं (सीआरसी, सीसीसी, पीडीएसी, जीसी) के ऑर्गेनॉइड को कम से कम 3 बार एक छोटे प्लाज्मिड (पीसीएमवी-ईजीपी, 4.2 केबी) या एक बड़े प्लाज्मिड (px458, 9.3 kb) के 30 μg का उपयोग करके इलेक्ट्रोपोरेट किया गया था। दोनों वैक्टर एक जीएफपी कैसेट लेते हैं जो फ्लो साइटोमेट्री द्वारा इलेक्ट्रोपोरेट के बाद ट्रांसफेक्शन दक्षता 48 एच के निर्धारण की अनुमति देता है। केवल जीवित कोशिकाओं का विश्लेषण करने के लिए, स्कैनिंग से पहले एक जीवन मौत एंटीबॉडी के साथ धुंधला प्रदर्शन किया गया था । गेटिंग रणनीति चित्रा 3में दिखाया गया है ।
सभी चार ऑर्गेनोइड संस्थाओं में 4.2 केबी आकार के प्लाज्मिड को बड़े की तुलना में उच्च दक्षता से ट्रांसकिया गया था (चित्रा 4देखें)। छोटे प्लाज्मिड का सबसे कुशल ट्रांसफेक्शन 92.1 ± 5.2% जीएफपी सकारात्मक कोशिकाओं के साथ पीडीएसी ऑर्गेनॉइड में पहुंचा था, जबकि बड़े प्लाज्मिड को 46.7 ± 3.7% (मतलब ± मानक विचलन, एन = 3) की दक्षता से संक्रमित किया गया था। अग्नाशय के कैंसर ऑर्गेनॉइड की तुलना में, बड़ा प्लाज्मिड 53.4 ± 11.7% की औसत दक्षता के साथ सीआरसी ऑर्गेनॉइड में अधिक कुशलता से ट्रांस्प्ड था, जबकि छोटे प्लाज्मिड को 84.3 ± 5.8% की औसत दक्षता से ट्रांसकिया गया था। ट्रांसफेक्ट करने के लिए सबसे कठिन इकाई गैस्ट्रिक कैंसर ऑर्गेनॉइड थी: बड़े और छोटे प्लाज्मिड दोनों के लिए, इस इकाई (क्रमशः 32.3 ± 12.7% और 74.1 ± 5.5%) में सबसे कम ट्रांसफेक्शन दक्षता पहुंच गई थी। सीसीसी ऑर्गेनॉइड ने छोटे प्लाज्मिड के लिए 83.0 ± 13.1% की एक मतलब ट्रांसफेक्शन दक्षता दिखाई और बड़े प्लाज्मिड 39.5 ± 10.4% के लिए प्राप्त किया गया।
अवधारणा के सबूत के रूप में, मानव सामान्य पेट ऑर्गेनॉइड को Cas9, GFP और टीपी53को लक्षित करने वाले दो एसजीआरएनए के लिए प्लाज्मिड एन्कोडिंग के px458_Conc2 के साथ इलेक्ट्रोपोरेट किया गया था। एक्सोन 8 पर Cas9-प्रेरित डबल स्ट्रैंड ब्रेक की मरम्मत गैर-अाहचार अंत में शामिल होने (NHEJ) द्वारा की गई थी, जिसके परिणामस्वरूप फ्रेमशिफ्ट होते हैं और परिणामस्वरूप जीन का नॉकआउट होता है (पूरक चित्रा 1देखें)।
तालिका 1: बेसल मीडिया, पाचन मिश्रण और खेती मीडिया की संरचना। कृपया इस फ़ाइल को देखने के लिए यहां क्लिक करें (डाउनलोड करने के लिए सही क्लिक करें)।

तालिका 2: फुजी एट अल10के अनुसार इलेक्ट्रोपोशन सेटिंग्स ।

चित्रा 1: इलेक्ट्रोपोशन तैयारी कार्यप्रवाह। सबसे पहले, ऑर्गेनॉइड को 10-15 कोशिकाओं के समूहों से विसोशिएट किया जाना चाहिए और एंटीबायोटिक दवाओं को धोया जाना चाहिए । इलेक्ट्रोपोजन के बाद सफेद फोम को विसोसिएट ेड करने की जरूरत होती है। कमरे के तापमान पर 40 न्यूनतम के लिए पुनर्जीवित करने के बाद कोशिकाओं को वरीयता दी जा सकती है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्रा 2: दो कदम इलेक्ट्रोपोराशन। उच्च वोल्टेज und अल्प अवधि के साथ दो poring दालों (१७५ वी और १५७.५ वी, 5 एमएस के लिए प्रत्येक, ५० एमएस के लिए ठहराव, वोल्टेज क्षय 10%) कोशिका झिल्ली में छिद्रों के गठन के लिए सीसा। निम्नलिखित हस्तांतरण दालों कोशिकाओं में डीएनए उद्धार: पांच सकारात्मक हस्तांतरण दालों (20 वी के साथ, 12 वी, 7.2 वी, 4.32 वी और 2,592 वी, प्रत्येक 50 एमएस के लिए, 50 एमएस के लिए ठहराव, वोल्टेज क्षय 40%), इसके बाद पांच ध्रुवीकरण ने हस्तांतरण दालों का आदान-प्रदान किया (20 वी, 12 वी, 7.2 वी, 4.32 वी और 2,592 वी के साथ, प्रत्येक 50 एमएस के लिए ठहराव, वोल्टेज क्षय 40%)। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्रा 3: सीसीसी ऑर्गेनॉइड द्वारा दिखाई गई प्रतिनिधि गेटिंग रणनीति। इलेक्ट्रोपोराशन के बाद फ्लो साइटोमेट्री 48 एच द्वारा सभी इलेक्ट्रोपोरेटेड ऑर्गेनॉइड का विश्लेषण किया गया। प्लाज्मिड डीएनए के बिना इलेक्ट्रोपोरेटेड कोशिकाओं को नकारात्मक नियंत्रण के रूप में इस्तेमाल किया गया था। गेट्स निम्नलिखित के रूप में स्थापित किए गए थे:(ए)सेल आकार के लिए गेटिंग,(बी,सी)एकल कोशिकाओं के लिए गेटिंग (डबल भेदभाव),(डी)जीवित कोशिकाओं के लिए गेटिंग (अपोप्टोटिक कोशिकाओं के लिए एक एंटीबॉडी के साथ दाग) और(ई,एफ)अंत में ईजीएफपी व्यक्त कोशिकाओं (FITC चैनल) के लिए गेटिंग । एफएससी = आगे तितर बितर; एसएससी = साइड स्कैटर। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्रा 4: चार ऑर्गेनोइड संस्थाओं की इलेक्ट्रोपोरेशन दक्षता। (A)एफएसीएस विश्लेषण (एन = 34, मतलब मानक विचलन और प्रत्येक एक मूल्य दिखाया जाता है) और(ख)फ्लोरेसेंस माइक्रोस्कोप द्वारा दृश्य तुलना। स्केल बार = 1,000 माइक्रोन. बीएफ = उज्ज्वल क्षेत्र; सीसीसी = कोलैंगियोकार्सिनोमा; सीआरसी = कोलोरेक्टल कैंसर; जीसी = गैस्ट्रिक कैंसर; पीडीएसी = अग्नाशय के डक्टल एडेनोकार्सिनोमा। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

अनुपूरक चित्र 1: अनुकरणीय CRISPR/Cas9-सामान्य मानव पेट ऑर्गेनॉइड में TP53 के नॉकआउट आधारित । px458_Conc2 वेक्टर (सामग्री की तालिकादेखें) 2 gRNA concatemer वेक्टर, बॉन-Kyoung कू19से एक उदार उपहार, px45820के साथ, 2 sgRNAs, Cas9 और GFP के लिए एक प्लाज्मिड एन्कोडिंग में जिसके परिणामस्वरूप संयोजन द्वारा क्लोन किया गया था । TP53 को लक्षित करने वाले दो एसजीआरएनए को गोल्डन गेट क्लोनिंग (एंडरसन-रॉल्फ एट अल19)द्वारा px458_Conc2 वेक्टर में पेश किया गया था। 10 माइक्रोन प्लाज्मिड डीएनए को मानव सामान्य गैस्ट्रिक ऑर्गेनॉइड(ए)में इलेक्ट्रोपोरेट किया गया था। क्लोन Nutlin3 प्रशासन(बी)द्वारा चुना गया था और TP53 नॉकआउट TOPO टीए क्लोनिंग और एलील्स के अनुक्रमण द्वारा पुष्टि की थी, यहां अनुकरणीय एक क्लोन(सी)के लिए दिखाया गया है । संदर्भ में एसजीआरएनए को रेखांकित किया गया है। स्केल बार = 200 माइक्रोन. BF = उज्ज्वल क्षेत्र। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Discussion
यह प्रोटोकॉल विभिन्न ऑर्गेनोइड संस्थाओं के इलेक्ट्रोपोशन को करने के लिए एक कुशल, त्वरित और आसान प्रदर्शन के लिए विस्तृत निर्देश देता है। पीडीएसी, सीआरसी, सीसीसी और जीसी से प्रस्तुत ट्यूमर ऑर्गेनॉइड के लिए अतिरिक्त, यह स्वस्थ ऊतक ों से प्राप्त ऑर्गेनॉइड के लिए भी सफलतापूर्वक काम करता है। प्रोटोकॉल एक दिन के भीतर किया जा सकता है। प्रकाशित ऑर्गेनोइड ट्रांसफेक्शन प्रोटोकॉल में पूरी प्रक्रिया चार दिनों तक चली जिसमें विभिन्न प्रकार की खेती मीडिया10,21के साथ दो दिन की तैयारी शामिल है । हमारे प्रोटोकॉल में कोई विशेष पूर्वउपचार की आवश्यकता नहीं है। इलेक्ट्रोपोजन से पहले इलेक्ट्रोपोराशन बफर के साथ धोने से मीडिया के एंटीबायोटिक घटकों को धोया गया और इष्टतम बाधा मूल्यों के लिए खारा सांद्रता का समायोजन हासिल किया गया । फिर भी, एक सफल इलेक्ट्रोपोशन के लिए कुछ महत्वपूर्ण पहलुओं पर विचार किया जाना चाहिए:
कक्षों
फुजी एट अल द्वारा इलेक्ट्रोपोरेशन प्रोटोकॉल में10 को एकल कोशिकाओं में ऑर्गेनॉइड को अलग करने और उन्हें 20 माइक्रोन सेल-छलनी के माध्यम से फ़िल्टर करने की सिफारिश की जाती है। एकल कोशिकाओं के लिए हमारे हाथों में पाचन कोशिकाओं की उत्तरजीविता को दृढ़ता से कम कर देता है। जैसा कि मेरेंडा एट अल21में सुझाव दिया गया है, हमने 10-15 कोशिकाओं के समूहों में ऑर्गेनॉइड को भी विसोशिएट किया और एकल कोशिका विसोशन की तुलना में कम दक्षता निर्धारित नहीं कर सके। इलेक्ट्रोपॉरेज के बाद सफेद फोम को अलग करने के लिए यह एक बहुत ही महत्वपूर्ण कदम है, ताकि कोई संलग्न कोशिकाएं खो न जाएं।
2डी सेल संस्कृति के लिए, यह दिखाया गया है कि 40 मिन तक 10 से अधिक के विद्युतीकरण के बाद एक पुनर्जनन समय विशेष रूप से बड़े प्लाज्मिड्स22की उत्तरजीविता और ट्रांसफेक्शन दक्षता को बढ़ाता है। परीक्षण प्रयोगों में, इसे ऑर्गेनॉइड के लिए प्रलेखित किया जा सकता है, जिससे इस प्रोटोकॉल में इलेक्ट्रोपोराशन के बाद 40 मिन का ऊष्मायन कदम हो सकता है। इलेक्ट्रोपॉरेशन से रिकवरी बढ़ाने के लिए हमने उन्हें पांच से सात दिनों23के लिए Rho-संबद्ध प्रोटीन किनेज (रॉक) अवरोधक वाई-२७६३२ के साथ सुसंस्कृत किया । इसी तरह, ग्लाइकोजन सिंथाज काइनाज़ 3 (जीएसके 3) अवरोधक CHIR99021 का अतिरिक्त पूरकीकरण एकल कोशिकाओं को10को ठीक करने में मदद करने के लिए है।
सेटिंग्स
उपयोग किए गए इलेक्ट्रोपोरेटर के फायदों में से एक यह है कि बाधा को इष्टतम स्थितियों के लिए इलेक्ट्रोपोराशन से पहले मापा जा सकता है। निर्माता के अनुसार बाधा मान 30-55 होनी चाहिएω। हमारे हाथों में 30-40 के बाधा मानहैंω ने इष्टतम क्षमता दिखाई है। प्रारंभिक प्रयोग में, जीवित रहने की दक्षता का इष्टतम अनुपात खोजने के लिए पोरिंग पल्स के विभिन्न वोल्टेज और पल्स लंबाई मूल्यों को अलग-अलग किया गया था। सारांश में, हम यहां वर्णित विभिन्न संस्थाओं में फुजी एट अल10 के वर्णित मूल्यों की पुष्टि कर सकते हैं।
डीएनए
विभिन्न डीएनए मात्रा के प्रभाव का परीक्षण प्रारंभिक प्रयोगों में प्रति नमूने के ४५ μg डीएनए तक किया गया था । कोई साइटोटॉक्सिक प्रभाव का पता नहीं लगाया जा सका। संतृप्ति और 30 μg के साथ एक खुराक निर्भर तरीके से ट्रांसफेक्शन दक्षता में वृद्धि की गई थी। इसलिए, हमने अंतिम प्रोटोकॉल में प्रति नमूना 30 μg का उपयोग किया, लेकिन निश्चित रूप से इसे बढ़ाया जा सकता है (उदाहरण के लिए, समानांतर में अधिक प्लाज्मिड के इलेक्ट्रोपोराशन के लिए)। इसके अतिरिक्त, डीएनए की शुद्धता और एकाग्रता बहुत महत्वपूर्ण प्रतीत होती है। 5 μg/μL से अधिक एकाग्रता इष्टतम ट्रांसफेक्शन क्षमता दिखाया गया है ।
जैसा कि उम्मीद थी, 9.3 केबी प्लाज्मिड छोटे 4.2 केबी प्लाज्मिड (देखें चित्रा 4)की तुलना में कम दक्षता से ट्रांसकिया जा सकता है। 10 केबी से भी बड़े प्लाज्मिड ्स के उपयोग से दक्षता में और कमी होने का अनुमान है। भविष्य के अनुप्रयोगों के लिए, एक वेक्टर के रूप में मिनीसर्कल डीएनए का परीक्षण करना दिलचस्प हो सकता है, क्योंकि इन जीन वाहकों में प्लाज्मिड की बैक्टीरियल रीढ़ की कमी होती है जो उन्हें24से छोटा बनाती है। इसके परिणामस्वरूप बढ़ी हुई ट्रांसफेक्शन दक्षता होनी चाहिए। इसके अलावा, CRISPR आधारित ऑर्गेनॉइड के जोड़तोड़ के लिए एक रिपोन्यूक्लियोप्रोटीन (आरएनपी) परिसर के रूप में Cas9 से बंधे एसजीआरएनए का एक सीधा इलेक्ट्रोपोशन एक विकल्प या इसके अलावा25हो सकता है।
Disclosures
लेखकों के पास खुलासा करने के लिए कुछ नहीं है ।
Acknowledgments
हम उत्कृष्ट तकनीकी सहायता के लिए जूलियन फोहग्रब, ऐन-क्रिस्टीन मेनेके और मैक्स हीडुक का शुक्रिया अदा करते हैं। ड्यूश क्रेबशिल्फ (कोई 111350 और 70112925), सैंडर स्टिफतुंग (कोई 2014.104.1), हेक्टर स्टिफतुंग (कोई M65.2) और यूरोपीय संघ (ईआरसी नंबर 639050) द्वारा वित्तपोषण प्रदान किया गया था।
Materials
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 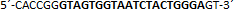 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 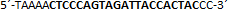 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 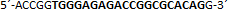 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 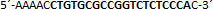 |
References
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).



