Summary
Denne protokollen beskriver en effektiv elektroporasjonsmetode for transfeksjon av fire forskjellige gastrointestinale organoide enheter med større plasmider (i den grad 10 kB). Det kan utføres innen en dag og trenger ikke omfattende forberedelse eller spesielle, kostnadsintensive elektroporasjonsbuffere.
Abstract
Elektroporasjon er en vanlig metode for transfeksjon med ulike typer molekyler ved elektrisk permeabilisering av plasmamembranen. Med økende bruk av organoider som en kulturingsmetode for primærpasientmateriale de siste årene, er effektive overføringsmetoder for komponenter for genteknologi i dette 3D-kultursystemet i nød. Spesielt for organoider avhenger effektiviteten av genetiske manipulasjoner av en vellykket transfeksjon. Dermed ble denne protokollen utviklet for å lette elektroporasjonen av organoider og for å bevise sin universelle funksjonalitet i forskjellige enheter. Human kolorektal, bukspyttkjertel, lever- og magekreftorganoider ble vellykket elektroporated med små og store plasmider i sammenligning. Basert på GFP-kodingsvektorer ble transfection-effektiviteten bestemt av FACS. Ingen omfattende forberedelse av cellene eller spesielle, kostnadsintensive elektroporasjonsbuffere er nødvendig, og protokollen kan utføres innen en dag.
Introduction
I de senere årene ble et nytt 3D-cellekultursystem, kalt organoider, utviklet for ulike normale og kreftvev. Organoider er funksjonelt og morfologisk svært nær deres opprinnelsesvev. De kan genereres fra forskjellige arter, er lett utvidbare, genomically stabile og genetisk modifiserbare, noe som gjør dem til et ideelt modellsystem for genetiske undersøkelser1,2,3. Genteknologi teknikker som CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)/Cas9 system muliggjør ulike manipulasjoner. Valget av kloner kan realiseres av definerte medieforhold, for eksempel ved WNT ligand tilbaketrekking for APC (Adenomatose Polyposis Coli) knockout kloner4,5. Alternativt må utvalgsmarkører introduseres av homologrettet rettet reparasjon av en målrettingsvektor6,7. På grunn av det faktum at ofte mer enn én plasmid må innføres, blir en effektiv transfection en avgjørende parameter. I tillegg, for å redusere uspesifikke off-target effekter, er et forbigående uttrykk for Cas9 endonuclease ønskelig8.
Elektroporasjon er en relativt enkel metode for å transfect celler med DNA, RNA, proteiner eller andre makromolekyler. Ved hjelp av elektriske pulser blir cellemembranen mer gjennomtrengelig og forårsaker økt opptak9. I en tidligere publisert elektroporasjonsprotokoll av kolonorganoider ble det oppnådd 30 % effektivitet med piggybac GFP (grønt fluorescerende protein) som uttrykte vektor (7,4 kB) i en fire dagers prosedyre10. Følgende protokoll ble utviklet for å lette en effektiv transfection av kreft eller friske organoider med store plasmider koding for enkelt guide RNA (sgRNA) og Cas9 endonuclease sekvens (f.eks px458 som vektor med 9.3 kb). Hele elektroporasjonsprosessen kan utføres innen en dag, uten spesielle elektroporasjonsbuffere, og med minst sammenlignbare effektivitet mellom ulike gastrointestinale organoider, nemlig pankreasductal adenokarsinom (PDAC), kolorektal kreft (CRC), kolangiokarsinom (CCC) og magekreft (GC) organoider.
Protocol
Etikkgodkjenning ble hentet fra tudresdenens etiske komité (#EK451122014).
1. Organoid kultur og preparater før elektroporasjon
- Etablere organoider ved vev fordøyelse som beskrevet tidligere og utvide dem med sine tilsvarende enhet spesifikke kulturmedium i en kjeller matrise (oversikt se Tabell 1 og Tabell av materialer)11,12,13,14,15,16,17.
MERK: For menneskelige vevsprøver er informert samtykke og godkjenning av studien av en etisk komité nødvendig. - Forvarm 48-brønnplater ved 37 °C for blad av post-elektroporering.
- Forbered basal medium m / o antibiotika samt enhetsspesifikk organoid kultur medium m / o antibiotika (se tabell 1) inkludert 10 μM Y-27632 og 3 μM CHIR99021.
MERK: Tilbaketrekking av antibiotika er viktig for å redusere toksiske effekter. Y-27632 og CHIR99021 ameliorate celle utvinning10. -
Fremstilling av organoider (se figur 1)
- Dyrke 5 brønner av organoider i en 48-brønnsplate per elektroporasjonsprøve i kulturmedium.
MERK: Proliferative organoider bør brukes (rundt 2-3 dager etter siste splitting). - Forbered 230 μL dissosiasjonsreagens (se Materialtabell)inkludert 10 μM Y-27632 per brønn.
- Fjern kulturmediet fra hver brønn og dissosierorganoider mekanisk i 230 μL av den tilberedte dissosiasjonsblandingen. Basseng 5 brønner per elektroporasjonsprøve i ett 15 ml rør.
- Bland med virvlende og inkubator i 5-15 min ved 37 °C til klynger på 10-15 celler oppstår. Kontroller derfor dissosiasjonen mikroskopisk. Stopp fordøyelsen ved å legge til basal medium m / o antibiotika opp til 10 ml.
MERK: Dette trinnet er svært kritisk! Elektroporasjonseffektiviteten vil bli redusert, når inkubasjonen er for kort, men lang fordøyelse vil redusere overlevelsesevnen. - Sentrifuge ved 450 x g i 5 min ved romtemperatur, kast supernatanten og vask to ganger med 4 ml elektroporasjonsbuffer (se Materialtabell).
- Dyrke 5 brønner av organoider i en 48-brønnsplate per elektroporasjonsprøve i kulturmedium.
2. Elektroporering
MERK: Følgende protokoll er utviklet for elektroporatorer som er i stand til firkantede bølger og separerte poring- og overføringspulssekvenser (se figur 2). Eventuelt kan impedansverdier samt spenninger, strømmer og energier som overføres til prøven, måles som kontroll for reproduserbare eksperimenter.
- Resuspender organoidpellet i 100 μL elektroporasjonsbuffer (se Materialtabell) som inneholder 30 μg plasmid DNA.
MERK: Konsentrasjonen av det brukte plasmid-DNAet bør overstige 5 μg/μL for optimal saltkonsentrasjon under elektroporasjonsprosessen. Derfor anbefales endofree plasmid maxi-sett (se Materialtabell)for fremstilling av vektorer. En total mengde opp til 45 μg DNA kan brukes uten cytotoksiske effekter. - Dispenser den komplette DNA-organoidblandingen i en elektroporasjonskuvett med 2 mm gapbredde uten å produsere luftbobler.
- Still inn elektroporasjonsparametrene i henhold til Fujii et al.10 (se tabell 2, Figur 2).
- Bland cellene litt uten skummende ved å trykke på cuvette med en finger. Plasser cuvette i cuvette kammeret.
- Trykk på Ω-knappen på elektroporatoren og noter impedansverdien.
MERK: En impedans mellom 30-40 Ω viste de beste resultatene. Generelt bør det være i området mellom 30-55 Ω. Hvis dette ikke er tilfelle, må du kontrollere følgende aspekter: gapbredde på cuvette som brukes, kabeltilkoblinger av elektroporatoren, mulige luftbobler, riktig volum og saltkonsentrasjon av elektroporasjonsblandingen. - Trykk på Start-knappen for å utføre elektroporasjonsprogrammet og kontrollere verdiene til strømmer, spenninger og energier som vises.
MERK: Verdiene av målte spenninger, strømmer og energier skal tilsvare de innstilte elektroporasjonsparametrene. For sammenligning av gjentatte eksperimenter kan det være nyttig å merke seg disse dataene. - Etter elektroporasjon, umiddelbart legge til 500 μL kultur medium m / o antibiotika (med CHIR99021 og Y-27632; se trinn 1.3). Bland ved pipettering opp og ned for å dissosiere det hvite skummet.
MERK: Det hvite skummet vises etter elektroporasjonsprosessen, og et betydelig antall celler er festet til den. Så, dissosiasjon av det er svært viktig for ikke å miste celler. - Overfør prøven helt fra cuvette til et nytt 15 ml rør ved hjelp av pipetten som tilhører elektroporasjonskuvetter (se Materialtabell). Sinsing av cuvette igjen med basalmedium anbefales å oppnå gjenværende celler.
- For regenerering av cellene, inkuber dem i 40 min ved romtemperatur.
3. Seeding av celler
- Sentrifuge cellene ved 450 x g i 5 min ved romtemperatur og kast supernatanten.
- Resuspender pelleten i 100 μL kjellermatrise og frø 20 μL dråper i en forutvarmet 48-brønnplate (se trinn 1.2). Inkuber i 10 min ved 37 °C for polymerisering og tilsett 250 μL kulturmedium, som suppleres med Y-27632 og CHIR99021 til neste splitting av de voksne organoidene (rundt 5-7 dager).
4. Bestemmelse av transfection effektivitet
MERK: Generelt anbefales det å elektroporate en vektor som bærer en fluorescensmarkør som ekstra transfeksjonskontroll. Avhengig av den valgte markøren og dens krommodning vil fluorescensen være synlig innenfor rundt 24-48 h etter transfeksjon18.
- Kontroller fluorescensen mikroskopisk etter 24-48 timer i transfeksjonskontrollen (se figur 4B).
-
Fluorescerende aktivert celleskanning (FACS)
- Høst cellene analogt til trinn 1.4.2-1.4.4 og fordøye rundt 10-20 min til det er enkeltceller. Legg til opptil 10 ml fosfatbufret saltvann (PBS).
- Sentrifuge ved 450 x g i 5 min ved romtemperatur og kast supernatanten.
- Eventuelt for diskriminering av levende celler: Resuspendpellet i 1 ml fosfatbufret saltvann (PBS) og legg til et egnet antistoff (se Materialtabell)eller propidiumjodid (PI). Bland veldig forsiktig bare ved å trykke og inkubere i 30 min ved romtemperatur i mørket. Vask med 10 ml PBS, sentrifuge og kast supernatanten.
- Resuspender cellepelleten i 200 μL PBS og filtrer suspensjonen eventuelt gjennom en 100 μm cellesil i et FACS-rør.
- Analyser cellene med en FACS-maskin ved hjelp av en passende gatingstrategi (se figur 3; Figur 4A) og bestem transfection effektiviteten.
Representative Results
Organoider av fire forskjellige kreftenheter (CRC, CCC, PDAC, GC) ble elektroporated minst 3 ganger ved hjelp av 30 μg av en liten plasmid (pCMV-EGFP, 4.2 kb) eller en stor plasmid (px458, 9.3 kb). Begge vektorene bærer en GFP-kassett som tillater bestemmelse av transfection effektivitet 48 timer etter elektroporasjon ved flyt cytometri. For å analysere bare levende celler, flekker med et liv-død antistoff før skanning ble utført. Gating-strategien vises i figur 3.
I alle fire organoide enheter ble den 4,2 kB størrelse plasmid transfected med høyere effektivitet sammenlignet med den større (se figur 4). Den mest effektive transfection av den lille plasmid ble nådd i PDAC organoider med 92,1 ± 5,2 % GFP positive celler, mens den store plasmid ble transinfisert med en effektivitet på 46,7 ± 3,7 % (gjennomsnittlig ± standardavvik, n = 3). Sammenlignet med organoider av bukspyttkjertelkreft ble den større plasmidmer mer effektivt overført til CRC organoider med en gjennomsnittlig effektivitet på 53,4 ± 11,7 %, mens den lille plasmiden ble overført med en gjennomsnittlig effektivitet på 84,3 ± 5,8 %. Den vanskeligste enheten å transfect var magekreft organoider: for både den store og den lille plasmid, den laveste transfection effektivitet ble nådd i denne enheten (32,3 ± 12,7 % og 74,1 ± 5,5 %, henholdsvis). CCC organoider viste en gjennomsnittlig transfection effektivitet på 83,0 ± 13,1 % for den lille plasmid og for den store plasmid 39,5 ± 10,4 % ble oppnådd.
Som bevis på konseptet ble menneskelige normale mageorganoider elektroporated med en px458_Conc2 plasmid koding for Cas9, GFP og to sgRNAs rettet mot TP53. De Cas9-induserte dobbelttrådbruddene på exon 8 ble reparert av ikke-homologend-joining (NHEJ), noe som resulterte i rammeskift og dermed en knockout av genet (se Supplerende figur 1).
Tabell 1: Sammensetning av basalmedia, fordøyelsesblandinger og dyrkingsmedier. Vennligst klikk her for å vise denne filen (Høyreklikk for å laste ned).

Tabell 2: Elektroporasjonsinnstillinger i henhold til Fujii et al.10.

Figur 1: Arbeidsflyt for elektroporeringsforberedelse. Først bør organoider dissosieres til klynger av 10-15 celler og antibiotika bør vaskes ut. Etter elektroporering må det hvite skummet dissosieres. Celler kan seedes etter regenerere i 40 min ved romtemperatur. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 2: Totrinns elektroporasjon. To poring pulser med høyere spenning und kort varighet (175 V og 157,5 V, hver for 5 ms, pause for 50 ms, spenningsforfall 10%) føre til dannelse av porer i cellemembraner. Følgende overføringspulser leverer DNA inn i cellene: fem positive overføringspulser (med 20 V, 12 V, 7.2 V, 4.32 V og 2,592 V, hver for 50 ms, pause for 50 ms, spenningsforfall 40%), etterfulgt av fem polaritet utvekslet overføringspulser (med 20 V, 12 V, 7,2 V, 4,32 V og 2592 V, hver for 50 ms, pause for 50 ms, spenningsforfall 40%). Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 3: Representativ gating strategi vist av CCC organoider. Alle elektroporatedorganoider ble analysert av flow cytometri 48 h etter elektroporering. Celler elektroporated uten plasmid DNA ble brukt som negative kontroller. Portene ble satt som følger: (A) gating for celleform, (B,C) gating for enkeltceller (dobbel tdiskriminering), (D) gating for levende celler (farget med et antistoff for apoptotiske celler) og (E,F) endelig gating for eGFP uttrykksceller (FITC kanal). FSC = forover scatter; SSC = sidescatter. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 4: Elektroporasjonseffektivitet hos fire organoide enheter. (A) FACS analyse (n = 34, gjennomsnittlig standardavvik og hver enkelt verdi vises) og (B) visuell sammenligning ved fluorescensmikroskop. Skala bar = 1000 μm. BF = lyst felt; CCC = kolangiokarsinom; CRC = kolorektal kreft; GC = magekreft; PDAC = pankreasductal adenokarsinom. Vennligst klikk her for å vise en større versjon av dette tallet.

Tilleggstall Figur 1: Eksemplarisk CRISPR/Cas9-basert knockout av TP53 i normale organoider i morsmelk hos mennesker. den px458_Conc2 vektoren (se Materialtabell)ble klonet ved å kombinere 2 gRNA-koncatemervektoren, en sjenerøs gave fra Bon-Kyoung Koo19, med px45820, noe som resulterte i en plasmid koding for 2 sgRNAs, Cas9 og GFP. To sgRNAs rettet mot TP53 ble introdusert i px458_Conc2 vektor ved golden gate kloning (analogt til Andersson-Rolf et al.19). 10 μg plasmid DNA ble elektroporated i humane normale mageorganoider (A). Kloner ble valgt av Nutlin3 administrasjon (B) og TP53 knockout ble bekreftet av TOPO TA kloning og sekvensering av allelene, her eksemplarisk vist for en klone (C). SgRNAs er understreket i referansen. Skala bar = 200 μm. BF = lyst felt. Vennligst klikk her for å vise en større versjon av dette tallet.
Discussion
Denne protokollen gir detaljerte instruksjoner for en effektiv, rask og enkel å utføre elektroporering av forskjellige organoide enheter. I tillegg til de presenterte tumororganoider fra PDAC, CRC, CCC og GC, fungerer det vellykket for organoider avledet fra sunt vev også. Protokollen kan utføres innen én dag. I publiserte organoid transfection protokoller hele prosedyren varte i fire dager, inkludert to dager med preparater med ulike typer dyrking media10,21. I vår protokoll er det ikke nødvendig med spesiell forbehandling. Ved å vaske med elektroporasjonsbuffer før elektroporering ble antibiotikakomponentene i mediet vasket ut og en justering av saltvannskonsentrasjoner for optimalimpedansverdier ble oppnådd. Likevel bør noen kritiske aspekter vurderes for en vellykket elektroporasjon:
Celler
I elektroporasjonsprotokollen fra Fujii et al.10 anbefales det å dissosiere organoider til enkeltceller og filtrere dem gjennom en 20 μm celle-sil. I våre hender fordøyelse navtil enkeltceller sterkt reduserer overlevelseav celler. Som foreslått i Merenda et al.21,vi også dissociated organoider til klynger av 10-15 celler og kunne ikke bestemme en redusert effektivitet sammenlignet med single celle dissosiasjon. Etter elektroporasjon er det et svært viktig skritt for å dissosiere det hvite skummet, slik at ingen vedlagte celler går seg vill.
For 2D cellekultur har det vist seg at en regenereringstid etter elektroporering på mer enn 10 min opptil 40 min øker overlevelsesevne og transfection effektivitet spesielt av store plasmider22. I testeksperimenter kan det samme dokumenteres for organoider, noe som fører til et inkubasjonstrinn på 40 min etter elektroporasjon i denne protokollen. For å øke utvinningen fra elektroporasjonen, dyrket vi dem med Rho-assosiert protein kinase (ROCK) hemmer Y-27632 i fem til syv dager23. Tilsvarende er den ekstra tilskudd av glykogen synthase kinase 3 (GSK3) hemmer CHIR99021 ment å hjelpe enkeltceller til å gjenopprette10.
Innstillinger
En av fordelene med den brukte elektroporatoren er at impedansen kan måles før elektroporasjon for optimale forhold. Ifølge produsenten bør impedansverdiene være 30-55 Ω. I våre hender har impedansverdier på 30-40 Ω vist optimal effektivitet. I et foreløpig eksperiment var ulike spenninger og pulslengdeverdier i poringpulsen variert for å finne den optimale andelen effektivitet til overlevelse. Oppsummert kan vi bekrefte de beskrevne verdiene til Fujii et al.10 i de forskjellige enhetene som er beskrevet her.
Dna
Effekten av forskjellige DNA-mengder ble testet i foreløpige eksperimenter opp til 45 μg DNA per prøve. Ingen cytotoksiske effekter kan påvises. Transfection effektivitet ble økt på en doseavhengig måte med metning > 30 μg. Så, vi brukte 30 μg per prøve i den endelige protokollen, men selvfølgelig kan det økes (f.eks, for elektroporering av flere plasmider parallelt). I tillegg synes renheten og konsentrasjonen av DNA å være svært viktig. En konsentrasjon på over 5 μg/μL har vist optimal transfeksjonseffektivitet.
Som forventet kan 9,3 kB plasmid transfected med lavere effektivitet enn den mindre 4,2 kB plasmid (se figur 4). Bruken av enda større plasmider enn 10 kB forventes å ytterligere redusere effektiviteten. For fremtidige applikasjoner kan det være interessant å teste minicircle DNA som vektor, siden disse genbærerne mangler bakteriell ryggraden i en plasmid som gjør dem mindre24. Dette bør resultere i en forbedret transfection effektivitet. Videre, for CRISPR-baserte manipulasjoner av organoider, kan en direkte elektroporasjon av sgRNAs bundet til Cas9 som et ribonucleoprotein (RNP) kompleks være et alternativ eller tillegg25.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Vi takker Juliane Fohgrub, Ann-Christin Meinecke og Max Heiduk for utmerket teknisk assistanse. Finansieringen ble gitt av Deutsche Krebshilfe (Nr. 111350 og 70112925), Sander Stiftung (Nr. 2014.104.1), Hector Stiftung (No M65.2) og EU (ERC No 639050).
Materials
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 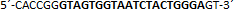 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 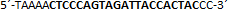 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 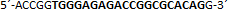 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 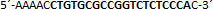 |
References
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).



