Summary
Burada, formalin-sabit parafin gömülü tümör doku bölümlerinde bağışıklık hücrelerini görselleştirmek, ölçmek ve haritalamak için basit ve erişilebilir bir strateji tanımlıyoruz. Bu metodoloji, mevcut görüntüleme ve dijital analiz tekniklerini görüntüleme testlerinin çoklama yeteneğini ve multiparametre analizini genişletmek amacıyla birleştirir.
Abstract
Tümör mikroçevresinin (TME) immün ortamı kanserin ilerlemesi ve tedaviye yanıtın belirleyici bir faktördür. Özellikle, TME bağışıklık hücrelerinin yoğunluğu ve konumu önemli tanısal ve prognostik değerlere sahiptir. TME'nin multiomik profilinin çıkarılması, tümörün başlatılmasını ve ilerlemesini düzenleyen çok sayıda hücresel ve moleküler ağ hakkındaki anlayışımızı katlanarak artırmıştır. Ancak, bu teknikler hücrelerin veya hücre-hücre etkileşimlerinin uzamsal organizasyonu hakkında bilgi sağlamaz. Tek hücre tabanlı yüksek iş çıkışlı teknolojileri tamamlamak için doku bölümlerinde ki bağışıklık hücrelerinin mekansal çözünürlüğünü sağlayan uygun fiyatlı, erişilebilir ve kolay çokluk lama teknikleri ne zaman kullanılır. Burada, tüm doku bölümlerinin sanal multiparametre slaytları oluşturmak için seri görüntüleme, sıralı etiketleme ve görüntü hizalama entegre bir strateji açıklar. Sanal slaytlar daha sonra, şüpheli hücre popülasyonlarının tanımlanmasını, ölçülmesini ve eşleştirilmesini sağlayan kullanıcı tanımlı protokoller kullanılarak otomatik olarak analiz edilir. Görüntü analizi, bu durumda analiz modülleri Tissuealign, Author ve HISTOmap kullanılarak yapılır. Bu stratejiyi tek bir klinik örneğe başarıyla uyguladığımız, sınırlı doku örneklerinden elde edilebilen bilgileri en üst düzeye çıkararak tüm doku bölümünde TME'nin tarafsız bir görünümünü sağladığımız bir örnek sayılmaktayız.
Introduction
Kanser gelişimi malign hücreler ve TME arasındaki karşılıklı etkileşimleri içeren çok aşamalı bir sürecin sonucudur. Tümör hücreleri dışında, TME nonmalign hücreler, stromal hücreler, bağışıklık hücre popülasyonları ve ekstrasellüler matriks (ECM)1oluşur. Tümör dokusunun farklı hücresel ve yapısal bileşenlerinin mekansal organizasyon ve kanser ve komşu kanser dışı hücreler arasındaki dinamik değişim sonuçta tümör ilerlemesi ve tedaviye yanıt modüle2,3,4. Bu kanserde bağışıklık yanıtı spatiotemporal düzenlenmiş olduğu gösterilmiştir5,6. Neoplastik lezyona ve komşu dokuya sızan farklı immün hücre popülasyonları, farklı fonksiyonlarla ilişkili farklı mekansal dağılım şekilleri ve farklı aktivasyon ve farklılaşma durumları sergilerler (örn. pro-karşı antitümör). Bu farklı immün popülasyonlar ve parametreleri tümör ve stromal kompartmanlar ile fazla mesai birlikte.
Tek hücreli multiomik profilleme sağlayan teknolojilerin ortaya çıkması, karsinogenezi ve tümör ilerlemesini düzenleyen çok sayıda hücresel ve moleküler ağ hakkındaki anlayışımızı katlanarak artırmıştır. Ancak, en tek hücre tabanlı yüksek iş gücü analitik araçlar doku bozulması ve tek hücre izolasyonu gerektirir, hücrelerin mekansal organizasyonu ve hücre hücre etkileşimleri hakkında bilgi kaybına neden7. TME'deki spesifik bağışıklık hücrelerinin yeri ve düzenlenmesi tanısal ve prognostik değere sahip olduğundan, mekansal çözünürlüğe olanak tanıyan teknolojiler tek hücre tabanlı immün profilleme tekniklerinin önemli bir tamamlayıcısıdır.
Geleneksel olarak, immünohistokimya (IHC) ve multipleks immünoresans (mIF) gibi görüntüleme teknikleri aynı anda görselleştirilebilen az sayıda biyobelirteçle sınırlandırılmıştır. Bu sınırlama genellikle birkaç henotik belirteçleri ile tanımlanan tümör-infiltrasyon bağışıklık hücrelerinin spatiotemporal dinamikleri çalışma engellemiştir. Görüntüleme ve analitik araçlardaki son gelişmeler çoklama olanaklarını genişletmiştir. Histo-sitometri ve görüntüleme kitle sitometrisi gibi yeni antikor bazlı etiketleme teknolojileri mekansal olarak 12 ve 32 biyobelirteçleri, sırasıyla8,9kadar ayırmak için kullanılmıştır. Kütle spektrometresi görüntüleme, etiketleme gerektirmeyen bir teknik, tek bir doku bölümünde aynı anda biyobelirteçleri binlerce görüntü potansiyeline sahiptir10,11. Bu teknikler zaten kanser doku bağışıklık manzara diseksiyon için büyük bir potansiyel göstermiştir rağmen, onlar son derece sofistike ve pahalı ekipman ve yazılım kullanmak ve kolayca araştırmacıların çoğunluğu için erişilebilir değildir.
Alternatif olarak, geleneksel IHC ve mIF çoklama yeteneği seri görüntüleme, etiketleme sıralı tur lar ve spektral görüntüleme7,12,13,14,,15,16kullanımı ile genişletilmiştir. Bu teknikler, görüntü analizi yazılımı kullanılarak sanal multiparametre slaytlar halinde birleştirilmiş olabilir aynı veya seri doku bölümlerinden birden fazla görüntü oluşturur. Sonuç olarak, aynı anda görselleştirilebilen ve analiz edilebilen işaretleyicilerin sayısı artar.
Burada, ticari olarak sunulan reaktifler, uygun fiyatlı mikroskopi ekipmanları ve kullanıcı dostu yazılımlar kullanarak doku çokkatlı tahlillerinin rasyonel tasarımı için bir strateji öneriyoruz(Şekil 1). Bu metodoloji seri görüntüleme, sıralı multipleks etiketleme, tüm doku görüntüleme ve doku hizalama otomatik kantitatifikasyon ve doku bölümlerinde bağışıklık hücrelerinin haritalanması için kullanılabilecek sanal multiparametre slaytlar oluşturmak için entegre. Bu stratejiyi kullanarak, 11 biyobelirteç ve iki sık kullanılan histolojik lekelerden oluşan bir sanal slayt oluşturduk: hematoksilin ve eozin (H&E) ve picrosirius kırmızısı (PSR). Farklı doku bölmelerinde birden fazla immün hücre popülasyonu tespit edildi, tespit edildi ve ölçüldü ve bunların mekansal dağılımı doku ısı haritaları kullanılarak çözüldü. Bu strateji, sınırlı klinik örneklerden elde edilebilen bilgileri en üst düzeye çıkarır ve tüm doku, çekirdek iğne biyopsileri ve doku mikrodizileri de dahil olmak üzere formalin-sabit parafin gömülü (FFPE) arşivlenmiş doku örnekleri için geçerlidir. Bu metodolojiyi, TME'deki bağışıklık hücre popülasyonlarının tanımlanması, ölçülmesi ve haritalanması için özel tahliller tasarlamak için yararlı bir kılavuz olarak öneriyoruz.
Protocol
Rezeke hepatit B virüsü (HBV) ilişkili insan hepatosellüler karsinom üç seri FFPE bölümleri Merkezi hospitalier de l'Université de Montréal (CHUM) Hepatopancreatobiliary Cancer Klinik Veritabanı ve Biyolojik Örnek elde edildi Depo (HBP Biobank). Bu doku bankasına katılan hastalara bilgilendirilmiş onam verildi. Bu çalışma kurumsal etik komitesi (Protokol numarası 09.237) tarafından onaylanmış ve Helsinki Bildirgesi'ne uygun olarak gerçekleştirilmiştir.
1. Hematoksilin ve eozin (H&E) boyama protokolü
NOT: H&E boyama, Centre de Recherches du Centre hospitalier de l'Université de Montréal 'in (CRCHUM) moleküler patoloji çekirdek tesisi tarafından aşağıdaki program kullanılarak Shandon çok programlı robotik slayt boyası kullanılarak gerçekleştirilmiştir.
- Deparafinizasyon için, ksilen yerine her biri 2,5 dk için 3x slaytlar batırın.
DİkKAT: Ksilen yerine yanıcı, cilt tahriş edici ve solunduğunda zararlıdır. - Rehidrasyon için, 2,5 dakika her için% 100 etanol 3x slaytlar batırın. Rehidrat için çift distile su (ddH2O) 1 dakika yıkayın.
- Hematoksilin 1 dk kuluçka. DDH2O'da her biri 1 dk boyunca 3x yıkayın.
- Eozin ile 5 s inkübate. Yıkama 30 s% 95 etanol ile. Yıkama 2x 1 dakika için 100% etanol ile.
DİkKAT: Etanol yanıcı ve göz tahriş edicidir. Eozin göz tahriş edici. - Dehidratasyon için, ksilen yerine her biri 1,5 dk için 3x batırın. Slaytları el ile monte edin.
NOT: Protokolün bu bölümünü yürütmek için tahmini süre 30 dk'dır.
2. FFPE kesitleri için multipleks immünfloresans boyama protokolü
NOT: Bu protokol Robertson ve ark.17uyarlanmıştır.
- Deparafinizasyon ve rehidrasyon
NOT: FFPE bölümlerinin IHC veya mIF ile antikor aracılı etiketlemesi önce parafin çıkarılmalıdır. Parafinin etkin bir şekilde çıkarılamaması, optimum derecede boyanmasına neden olabilir.- 4 μm FFPE doku kesitslaytlarını cam kaydırak tutuculara yerleştirin. Duman kaputunun altında, slaytları 37°C önceden ısıtılmış ksilen içeren coplin kavanozuna 10 dakika batırın.
DİkKAT: Ksilen yanıcı, bir cilt tahriş edici, ve zararlı eğer solunmuş. - Her 2 dk.'da 10 s.'lik slaytları elle çalkalayın.
- Kimyasal kaputta, aşağıdaki çözeltilerin her birinde 5 dakika sırayla slaytları batırın: 1) ksilen: etanol (1:1 v/v); 2)% 100 etanol; 3) %70 etanol; 4) 50% etanol; 5) % 30 etanol; 6) fosfat tamponlu salin (PBS).
NOT: Slaytları antijen alımını gerçekleştirmeye hazır olana kadar PBS'de tutun. Dewaxed bölümleri her zaman sulu tutun. Kuruma nonspesifik antikor bağlanmasına ve dolayısıyla yüksek arka plan boyama neden olur.
- 4 μm FFPE doku kesitslaytlarını cam kaydırak tutuculara yerleştirin. Duman kaputunun altında, slaytları 37°C önceden ısıtılmış ksilen içeren coplin kavanozuna 10 dakika batırın.
- Isıya bağlı antijen alımı
NOT: Antijenler formalin fiksasyonu üzerine maskelenebilir, antikor bağlanmasını ve dolayısıyla görselleştirmeyi önler. Antijen unmasking tamponlar ve prosedürlerin kullanımı kısmen epitopların yerli konformasyon yeniden ve bu şekilde antikor tanıma geri. Antijen alma tamponunun tipi ve süresi belirli bir istinat koşulları (örn. hedef, antikor, doku, vb.) için optimize edilmelidir.- Antijen alma çözeltisi içeren bir Coplin kavanozda dewaxed slaytlar batırın (Malzemeler Tablosunda tarifi).
- Musluk suyu ile bir elektrikli düdüklü tencere içine coplin kavanoz kapalı yerleştirin. Su, antijen alma çözeltisi ile karışmaması için kavanozun yüksekliğinin yarısını geçmemelidir.
- Tencerenin kapağını ve basınç vanasını kapatın. 10 dakika yüksek basınç seçin ve başlayın. Bittiğinde, tencerenin fişini çekin, basıncı bırakın, kapağı açın ve kavanozu tencerenin içinde 30 dakika boyunca saklayın, böylece slaytlar soğumasını bekleyin.
- Nonspesifik bağlamanın engellenmesi
- Kaydıraklarla rafı PBS dolu coplin kavanozuna aktarın. Her biri 5 dakika boyunca PBS 2x ile antijen alma tamponunu durula.
- Bir hidrofobik bariyer oluşturmak için bir PAP kalem ile doku bölümleri çevreleyen. Slaytları PBS'de 0,1 M glisin içeren coplin kavanozuna batırın. Oda sıcaklığında 15 dakika (RT) kuluçka.
NOT: Glisin, antijen alımı sırasında oluşan aldehit gruplarını doygunlaştırır. Bu gruplar primer ve sekonder antikorları özel olarak bağlayabilir. - 5 dk. 5 dakika PBS ile 2x yıkayarak glisin çözeltisini durulayın. Hidrofobik bariyerin taşmasını önle. RT'de 30 dakika kuluçka.
NOT: Engelleme çözeltisi tarifi malzemeler tablosundabulunabilir. Engelleme solüsyonu, spesifik olmayan bağlanma alanlarını engellemek için bir protein (örneğin, BSA) içermelidir. Ayrıca triton X-100 veya Tween 20 gibi antikorlar ve doku hedefleri arasındaki hidrofobik etkileşimleri azaltmak gibi deterjanlar dahil edebilir, bu nedenle antijen tanıma daha seçici hale. Dokunun geldiği türden %10 toplam serum eklenmesi Fc reseptörlerini bloke eder ve böylece nonspesifik antikor bağlanmasını azaltır. Son olarak, ikincil antikorların yetiştirildiği türlerden serumun %10'unun eklenmesi, sekonder antikorların doku bölümüne doğrudan nonspesifik bağlanmasını en aza indirecektir.
- İmmünofloresan etiketleme
- PBS-Tween ile durulanın (%0.1 v/v) her biri 5 dakika 2x ve slaytları nem odasına geri yerleştirin.
- Engelleme çözeltisinde yeniden askıya alınan birincil antikorkokteylini ekleyin. Gece boyunca 4 °C'de kuluçkaya yatırın. Bu çalışmada kullanılan primer ve sekonder antikorlar Malzeme Tablosu'ndalistelenmiştir.
NOT: Primer antikorların kokteyli ya farklı türlerde yetiştirilen antikorları içermelidir, ya da aynı türden ama farklı izotiplerden. Bu çalışmada kullanılan primer-sekonder antikor çiftleri listesi için Tablo 2'yebaşvurun. Kullanılan tüm antikorların detayları Malzeme Tablosu'nda ve Tablo 2'de yer alıyor. - PBS-Tween ile durulanın (%0.1 v/v) 5 dakika için 3x ve slaytları nem odasına geri yerleştirin. Karanlıkta, ikincil antikorkokteylekleyin ve RT 1 saat için kuluçka.
NOT: Birincil antikorlar farklı türlerden olduğunda, ikincil antikorlar seçilmelidir, böylece her biri sadece birincil antikorlardan birine bağlanır ve birbirlerine bağlanmamalıdır. Bu genellikle, birincil antikorların üretildiği türlerden farklı olduğu sürece, aynı türlerde yetiştirilen ikincil antikorlar kullanılarak elde edilir. Primer antikorların aynı türde yetiştirildiği ancak farklı izotipleri olduğu durumlarda izotipe özgü sekonder antikorlar kullanılmalıdır. - Her biri 5 dakika için PBS-Tween (%0,1 v/v) 3x ile durula. DDH2O ile durula. Fazla sıvıyı çıkarın ve DAPI ile montaj ortamlarına monte edin. Kullanılan birim bölümün boyutuna bağlıdır. Genellikle 40 μL normal bir mikroskopi slayt yüzeyini kapsayacak şekilde yeterlidir.
- Kapak kaydırağı nın üzerine yerleştirin ve kabarcık oluşumunu önleyen fazla montaj ortamını hafifçe sıkın. Slaytlar karanlıkta RT'de 20 dk kurusun ve 4 °C'de satın almaya hazır olana kadar saklayın.
- Tüm slayt tarayıcısını kullanarak tüm kanallar için görüntü edinin (bkz. Malzemeler Tablosu).
NOT: Antikorlar pozitif kontrol olarak insan hepatosellüler karsinom dokusu kullanılarak doğrulandı. Her primer antikor için, üç seri bölüm ya primer antikor, isotip kontrolü, ya da sadece boyama protokolünün geri kalanında herhangi bir varyasyon olmadan çözüm engelleme ile boyandı. Elde edilen görüntüler boyama özgüllüğünü belirlemek için karşılaştırıldı. Primer antikor ile inkübe edilen bölümdeki sinyalin beklenen desene sahip olması ve arka plandan kolayca ayırt edilebildiği zaman boyama özel olarak kabul edildi. İzotipte yüksek arka plan sinyali veren primer antikorlar veya etiketleme doku bileşenleri ve primer antikor kesitleri nonspesifik olarak kabul edilmiştir. Protokolün bu bölümünü tamamlamak için tahmini süre 2 gündür. Gerekli kontroller şunlardır: (1) Birincil antikorun arka plan sinyaline spesifik olmayan bağlanmasının katkısını belirlemek için İzotip kontrolü. Bir bölüm, primer antikor kökenli ve aynı izotipe sahip bir antikor ile kuluçkaya yatırılabilen ancak doku bölümünde bulunmayan bir hedefe özgü olması dışında diğer örnek dokularla aynı şekilde boyanmıştır. Uygun izotip kontrol antikormevcut değilse, birincil antikor yetiştirilen aynı türden toplam IgG ile değiştirilebilir; (2) Boyamanın özgüllüğünü belirlemek ve ikincil antikorların arka plan sinyaline nonspesifik bağlanmasının katkısını tahmin etmek için birincil antikor kontrolü (yani negatif kontrol) yoktur. Bu durumda, kontrol bölümü, primer antikor eklenmedikçe diğer bölümlerle aynı şekilde boyanırken; (3) Pozitif kontrol boyama çalıştığını kurmak için. Bu durumda, boyama primer antikor tarafından tanınan belirteci ifade etmek için bilinen bir doku bölümü üzerinde yapılır.
3. Picro-sirius kırmızısı (PSR)/hızlı yeşil boyama protokolü
NOT: Bu boyamanın amacı FFPE doku bölümlerinde fibrillar kollajeni I ve III'ü görselleştirmektir. Bu protokol Segnani ve ark.18uyarlanmıştır. Tüm adımlar kimyasal bir başlık içinde gerçekleştirilir.
- FFPE kesitleri için multipleks immünfloresans boyama protokolüne benzer doku bölümlerinin deparafinizasyonunu ve rehidrasyonunu gerçekleştirin (bölüm 2.1).
NOT: Boyanacak bölüm daha önce immünoresans etiketlemeiçin kullanılmışsa ve parafin çıkarılmışsa, deparafinizasyon-rehidrasyon adımları montaj ortamını çıkarmak için yararlıdır. DAPI bu yordam kullanılarak çıkarılmaz, ancak PSR boyama ile algılanabilir bir şekilde müdahale etmez. - Picro-sirius kırmızı/hızlı yeşil çözelti (Malzeme Tablosutarifi)içeren bir kavanoza slaytlar batırın ve RT 30 dakika kuluçka (hepatosit çekirdekleri nonspesifik boyama 30 dakikadan fazla sonuç).
- Slaytları ddH2O 'da (5 dip) hızla yıkayın. Daha sonra etanolde hızlı cayın %100 (5 daldırma). Ksilen-100% etanol (1:1 v /v) 30 s için yıkayın. Ksilende 30 s'lik yıkayın. Ksilen tamamen buharlaşmadan önce montaj lı ortamla monte edin (Bkz. Malzeme Tablosu)(montaja yardımcı olur).
NOT: Protokolün bu bölümünü yürütmek için tahmini süre 1 saattir.
4. Doku kesitlerinden antikorların elüsasyonu
NOT: Ardışık etiketleme tahlillerinde doku kesitlerinin yeniden kullanılabilmesi için primer ve sekonder antikorların tamamen çıkarılması gerekmektedir. Bağlı antikorlar daha önce açıklandığı gibi çıkarıldı13.
Su banyosunu 56 °C'ye önceden ısıtın. Sıyırma tamponu içeren bir kavanozun içine bölümleri koyun (Tarifmalzemeler Tablosu),kapağı kapatın ve sallayarak sızıntıyı önlemek için parafin film bandı ile kapatın.
- Su banyosu içine kavanoz koyun ve ajitasyon ile 30 dakika kuluçka.
- PBS-Tween ile rinse de ddH2O 15 dakika her yıkama (0.1% v/v).
- Bölümleri PBS-Tween veya suda ikinci tur primer antikorlarla yeniden probetmeye hazır olana kadar sulu tutun.
NOT: Protokolün bu bölümünü yürütmek için tahmini süre 2 saattir. - Antikor elüsyon prosedürünün verimliliğini doğrulayın.
NOT: Ardışık etiketleme testinde antikor elüsasyonu protokolünü kullanmadan önce, primer ve sekonder antikorların çıkarılmasının etkinliği doğrulanmalıdır.- FFPE kesitleri için multipleks immünoreskans boyama protokolünde belirtildiği gibi belirli bir primer-sekonder antikor çifti ile bir bölümün boyama ve görüntü edinimi gerçekleştirin (bölüm 2.1-2.4.6).
- Görüntü edinimi üzerine, bölüm 4.1-4.3'te belirtildiği gibi dokuya bağlı primer-sekonder antikor komplekslerinin elüsasyonunu gerçekleştirin.
- Bölümü aynı sekonder antikor ve adım 2.4.3'te kullanılan aynı koşullarla kuluçkaya yatırın.
- 2.4.4-2.4.6'da belirtildiği gibi yıkama, montaj ve görüntü edinme adımlarını gerçekleştirin.
- Belirli sinyalin kaybolup olmadığını belirlemek için sıyırmadan önce ve sonra elde edilen görüntüleri yan yana karşılaştırın.
NOT: Antikor çıkarmadan önceki ve sonraki görüntülerin karşılaştırılması, elüsyon işleminin verimliliğini doğrulayacaktır. Ancak, tüm kanallarda arka plan sinyalinde bir artış ve DAPI difüzyonu görmek normaldir. Bu, aynı doku bölümünde yürütülebilecek sıyırma turlarının sayısını sınırlar. Üç tur sıyırma maksimum gibi görünüyor.
5. Görüntü edinimi
- Tüm slayt tarayıcısı kullanarak görüntü oluşturun.
- 20x 0.75NA objektif lens ve 0,3225 m/piksel çözünürlük kullanın.
6. Görüntü analizi
NOT: Burada özetlenen yöntem geçerli örneğe başvurur. Diğer özel örneklere uyum sağlamak için lütfen Tablo 1'e ve metne bakın.
- Görüntü analiz yazılımının Tissualign modülünü kullanarak doku hizalamasını gerçekleştirin (VIS bu protokolde, Bkz. Malzeme Tablosu).
- Görüntü analizi yazılımını açın ve Tissuealign sekmesine tıklayın.
- Dosyaya giderek Slayt Tepsisine hizalanacak görüntüleri alma | Veritabanı ve hizalanacak ilk görüntüyü seçin. Tissuealign sekmesine geri dön ve Slayt Tepsisindeki Slide Tray Yükle düğmesini tıklatarak resmi yükleyin. Görüntü Slayt Tepsisi'nde ve çalışma alanında görünür.
NOT: Slayt tepsisine yalnızca ilgi yığını yüklenmelidir. - Sırayla tüm görüntüler için adım 6.1.2'yi tekrarlayın, teker teker yükleyin. İlgi çekici tüm görüntüler slayt tepsisine yüklendikten sonra şeritteki İş Akışı Adımlarında İleri tuşuna basarak görüntüleri bağlamaya devam edin.
- Ardından, ikinci görüntüyü ilk görüntünün üzerine sürükleyin ve bırakın. Birinci ve ikinci görüntüler artık birbirine bağlı. Diğer görüntülerin düzenli bir şekilde tektek hizalanmış olması için bu adımı tekrarlayın. İlk görüntünün adı, diğer resimlerle bağlantılı olduğunu belirterek değişecektir. Aynı anda, bağlantılı görüntüler slayt tepsisinin sağındaki çalışma alanında görüntülenir.
- Bu noktada, görüntüleri otomatik hizalama, yarı otomatik hizalama veya el ile hizalama kullanarak hizala. Her zaman önce otomatik hizalamayı denemek tercih edilir. Otomatik hizalama için şeritteki iş akışı adımlarında (adım 3) Sonraki düğmesine basın.
- Dokunun farklı konumlarında gezinerek ve farklı görüntülerdeki ilgili yapıların görüntünün iki boyutunda aynı şekilde düzenlendiğini görsel olarak doğrulayarak otomatik hizalamayı gözden geçirin.
- Otomatik hizalamanın sonucu tatmin edici değilse, bağlantılı görüntülerde homolog doku özelliklerini gösteren pinler (görüntü başına en az üç pin kullanın) kullanarak geliştirin. Pinler bağlantılı görüntülerde homolog konumlara yerleştirildikten sonra, kullanıcının iki seçeneği vardır: yarı otomatik hizalama veya manuel hizalama. Yarı otomatik hizalama için şeritteki geçerli nokta noktalarını temel alan Otomatik hizalama düğmesini tıklatın. Manuel hizalama için şeritteki Pin uygula düğmesini tıklatın.
- Hizalamamemnun olduğunda iş akışı adımlarında İleri düğmesine tıklayın ve veritabanında bileşik görüntü kaydedin.
NOT: Sunulan analizde 11 işaretleyicinin yanı sıra H&E ve PSR görüntülerini kapsayan altı slayt ın hizalanması 15 dakika sürdü.
- Kullanıcı tanımlı protokol Analiz Protokolü Paketi 1 'i kullanarak doku tespiti gerçekleştirin (APP 1, Tablo 1).
- Şeritteki Görüntü Analizi sekmesini tıklatarak yazılımın Görüntü Analizi modülünün açın.
- Dosyaya giderek bileşik (hizalanmış) görüntüyü alma | Veritabanı ve ilgi resmi seçerek ve Görüntü Analizi sekmesini geri tıklayarak.
- APP'i Aç simgesine tıklayarak APP seçim iletişim kutusunu açın ve hangi Analiz Protokol Paketi'ni (APP) kullanacağız seçin. Bu durumda doku tespiti için APP 1'i seçin.
- APP 1 açıldıktan sonra, seçili doku konumuna giderek ve Önizleme düğmesine tıklayarak APP1'in düzgün çalıştığını doğrulayın. Sonuçlar tatmin ediciyse, bir sonraki adıma geçin.
- APP 1'i çalıştırmak ve seçili UYGULAMAYı kullanarak görüntüyü işlemek için tıklatın.
- Analiz yapıldığında verileri (örn. resimler, ölçümler, vb.) Dosya/Dışa aktar'a tıklayarak dışa aktarın.
NOT: APP 1, dokuyu (ROI Tissue) delineating ilgi alanı (ROI) oluşturur ve doku alanını hesaplar. - Değiştirilen görüntüyü Dosyaya giderek yeni oluşturulan YG ile kaydetme | Kaydet.
NOT: Verilen örnekte dokuyu tespit etmek ve APP 1 ile yatırım getirisi oluşturmak açıklanan görüntü analiz istasyonunda 5 dakika sürdü. İşlenen dokunun alanı 3.2 cm2idi.
- APP 2 kullanarak Stroma ve Parenkim içine doku segmentasyonu gerçekleştirin(Tablo 1).
NOT: APP 2 önceden tanımlanmış Yatırım Getirisi Dokusu üzerinde çalışır. APP 2, dokuyu ROIs Stroma ve Parenchyma'ya böler.- Şeritteki Görüntü Analizi sekmesini tıklatarak Görüntü Analizi modüllerini açın.
- Dosyaya giderek YG dokusunu içeren görüntüyü alma | Veritabanı ve adım 6.2.7 kaydedilen görüntü seçerek. Görüntü Analizi sekmesine geri dön ve Slayt Load Tepsisindeki Slide TrayYükle düğmesini tıklatarak resmi yükleyin. Görüntü Slayt Tepsisi'nde ve çalışma alanında görünür.
- 6.2.3'teki gibi APP seçim iletişim kutusunu kullanarak APP 2'yi açın.
- Seçili bir görüş alanında işleyerek APP 2'yi önizleyin. Sonuçlar tatmin ediciyse, Çalıştır düğmesini tıklatarak APP 2'yi görüntünün tamamında çalıştırın. APP 2 çıktıolarak, ROI doku ROIs Stroma ve Parenchyma ve ilgili alanlarda belirlenen segmente edilir. İhracat sonuçları 6.2.6 olarak. Değiştirilen görüntüyü 6.2.7'deki gibi kaydedin.
NOT: Stroma ve Parenkim'deki dokunun APP 2 kullanılarak segmente edilmesi sunulan analiz istasyonunda 4 saat olarak gerçekleşti. İşlenen dokunun alanı 3.2 cm2idi.
- FoxP3hiCD4+ hücrelerini kullanıcı tanımlı protokol APP 3 kullanarak tanımlayın ve ölçün (Tablo 1).
NOT: APP 3 önceden tanımlanmış ROIs Stroma ve Parenchyma üzerinde çalışır.- Görüntü Analizi modüllerini açın ve ROIs Stroma ve Parenchyma içeren görüntüyü 6.3.1 ve 6.3.2 olarak aktarın. 6.2.3'teki gibi APP seçim iletişim kutusunu kullanarak APP 3'u açın.
- FoxP3hiCD4+ hücrelerinde zenginleştirilmiş seçili bir görüş alanında APP 3 işlemini önizleyin. Sonuçlar tatmin ediciyse, APP 3'ün tam görüntüüzerinde çalıştırın. APP 3 çıktıolarak, tüm bireysel FoxP3hiCD4 + nesneleri etiketli ve doku koordinatları saklanır. ROIs Stroma ve Parenchyma'daki FoxP3hiCD4+ nesnelerinin yoğunlukları belirlenecektir. Sonuçları 6.2.6 olarak dışa aktarın.
- FoxP3hiCD4+ etiketli nesnelerin doku ısı haritalama gerçekleştirin.
- 6.2.3'teki GIBI APP seçim iletişim kutusunu kullanarak kullanıcı tanımlı iletişim kuralı FoxP3hiCD4+ MAP'i açın.
NOT: FoxP3hiCD4+ MAP yoğunluk ısı haritaları oluşturmak için FoxP3hiCD4+ etiketli nesnelerin koordinatlarını kullanır. App 3 kullanarak FoxP3hiCD4+ etiketli nesnelerin tanımlanması ve sayma 25 dk görüntü analiz istasyonunda açıklanan aldı. İşlenen dokunun alanı 3.2 cm2idi. - Çalıştır düğmesine basarak FoxP3hiCD4+ MAP'i çalıştırın. Dosya 'ya tıklayarak doku ısı haritasını dışa aktarma | İhracat | Çalışma Alanı.
NOT: FoxP3hiCD4+ etiketli nesnelerin Haritalaması FoxP3hiCD4+ MAP kullanılarak açıklanan görüntü analiz istasyonunda 5 dk aldı.
- 6.2.3'teki GIBI APP seçim iletişim kutusunu kullanarak kullanıcı tanımlı iletişim kuralı FoxP3hiCD4+ MAP'i açın.
- Kullanıcı tanımlı APP 4, APP5, APP6, APP7 ve APP 8(Tablo 1)bölüm 6.4 ile 6.4.3.2 bölümlerinde yapılan ve her durumda ilgi çekici APP'ı yükleyerek kullanıcı tanımlı protokolleri APP 4, APP5, APP6, APP6, APP6, APP8 ve APP 8'i kullanarak CD8+, CD68+, MPO+, αSMA ve CD34 + nesneleri tanımlayın ve ölçün.
NOT: APPs 4-8 önceden tanımlanmış ROIs Stroma ve Parenkima üzerinde çalışır.
Representative Results
TME'deki ilgi alan hücre popülasyonlarını görselleştirme, ölçme ve haritalama stratejisine genel bakış
Farklı doku bölmelerindeki (TC) hücre popülasyonlarını (COI) ölçmek ve mekansal organizasyonlarını karakterize etmek için, uygun fiyatlı ve kullanımı kolay teknikleri entegre eden ve değerli FFPE klinik numunelerinden elde edilebilen konumbilgilerini en üst düzeye çıkaran bir iş akışı tasarladık (Şekil 1). İlk olarak, seri tüm doku FFPE bölümleri COI'lerin (örneğin, bağışıklık hücreleri) ve TC'lerin (örneğin, stroma karşı parankim) görselleştirilmesi için boyandı (Şekil 1, adım 1). Ardışık kesit lerin sayısı, araştırma sorusunun ele alınması için gerekli olan ilgi veya doku özelliklerine sahip hücrelerin görüntülenmesine olanak tanıyan minimumda tutulmalıdır. Seri bölümlerin sayısı ne kadar azsa, bitişik bölümler arasında doku mimarisi benzerlik ve uyum o kadar yüksek olabilir. Buna ek olarak, çoklama yeteneği sıyırma ve reprobing teknikleri19ile floresan lekeli bölümlerin yeniden kullanımı yoluyla genişletilebilir.
Boyama adımları yapıldıktan sonra, görüntüleri dijitalleştirmek için tüm bir slayt tarayıcısı kullanıldı. Seri bölümlerden elde edilen görüntüler otomatik bir şekilde sanal çok katlı bir slaytta hizalanmış ve birleştirilmiştir(Şekil 1, bölüm 2). Daha sonra, doku için bir YG doku ilişkili piksel (TAPs)(Şekil 1, adım 3) tanımlanan kullanıcı tanımlı bir protokol ile tanımlanmıştır. Daha sonra, RoI doku ek ROI olarak tanımlanan TCs içine segmente edildi. (Şekil 1, adım 4). Daha sonra, farklı TC'lerde kullanıcı tanımlı protokoller algılandı ve ölçüldü COI'ler(Şekil 1, adım 5). Son olarak, COI'lerin doku ısı haritaları yoğunluklarına ve doku koordinatlarına göre oluşturulmuştur(Şekil 1, adım 6).
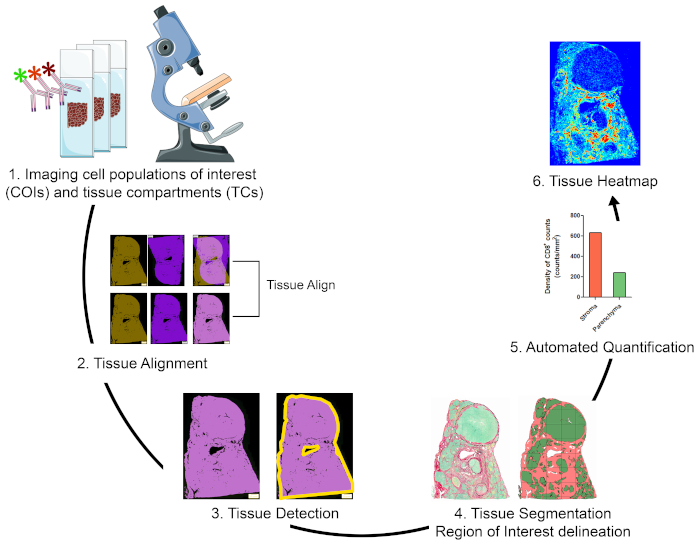
Şekil 1: TME'deki bağışıklık hücrelerini görselleştirme, ölçme ve haritalama stratejisinin şematik gösterimi. (1) Seri tüm doku bölümleri COI ve TCs etiketleme için lekeli edildi. Lekeli tüm doku bölümleri bütün bir slayt tarayıcı kullanılarak sayısallaştırılmış. (2) Seri bölümlerden elde edilen görüntüler, Tissuealign analiz modülü kullanılarak otomatik olarak birbirine bağlandı, hizalandı ve birlikte kaydedildi. Tek tek görüntülerin yüksek hassasiyetli hizalamasından bileşik bir görüntü oluşturuldu. (3) Kompozit görüntüdeki doku ilişkili piksellerin (TAP) otomatik olarak algılanması için kullanıcı tanımlı bir protokol kullanılmıştır. (4) Doku, ROI olarak tanımlanan TC'ler (örneğin stroma ve parankim) olarak bölümlere ayrılmıştır. (5) Farklı TC'lerde COI'lerin otomatik olarak saptanması ve ölçülmesi için kullanıcı tanımlı protokoller kullanılmıştır. (6) COI'lerin doku ısı haritaları oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Görüntüleme COI ve TCs
HBV ilişkili hepatosellüler karsinomlu bir deneğin rezeke edilen tümörün üç seri FFPE bütün doku kesiti Şekil 2A'daolduğu gibi bir veya daha fazla kez boyama da boyandı. Bölüm I, doku mimarisini, hücre morfolojisini göstermek ve malignite tipi, tümör derecesi ve immün infiltrasyonun genel değerlendirilmesi gibi klinik olarak ilgili parametreleri belirlemek için H&E ile boyanmışlardır(Şekil 2C). Bitişik bölüm II'de karaciğer parankimal ve non-parenkimal hücrelerinin etiketilmesinde iki tur mIF kullanıldı(Şekil 2A). İlk turda, endotel hücrelerinin CD34 boyaması ile normal ve tümör damarları görselleştirildi. Ayrıca epitel hücreleri (hepatositler ve kolanjiyositler) sittokeratin 8/18 kullanılarak, fibrojenik aktiv hepatik yıldız hücreleri alfa düz kas aktinin pozitif (αSMA+) hücreleri olarak tanımlanmıştır(Şekil 2C). Görüntü edinimi nin ardından doku bölümleri söküldü ve makrofajlara (CD68) ve miyofibroblastlara (desmin) karşı antikorlarla reprobeedildi. Daha iyi tümör bağışıklık infiltrasyon karakterize etmek için, bitişik seri bölüm III hücresel belirteçleri CD3, CD4, CD8, forkhead kutusu P3 (FoxP3) ve myeloperoxidase (MPO) için mIF iki tur kullanılarak lekeli oldu. Her durumda DAPI nükleer bir karşı leke olarak kullanılmıştır. Son olarak, bölüm III PSR leke ile lekelenmiş ve fibriller kollajen görselleştirmek ve stroma ve parankim içine doku segment(Şekil 2C)hızlı yeşil ile countertained oldu.
Lekeli bölümleri dijitalleştirmek ve sanal slaytlar oluşturmak için 20X objektif lens ile donatılmış bir slayt tarayıcısı kullanıldı. Üç seri bölümden(Şekil 2B)altı görüntü elde edildi ve sanal slaytlar daha sonra Şekil 1'dekişematik gösterime göre VIS yazılımı kullanılarak analiz edildi.
Görüntü Analizi
Görüntü analizi beş adımdan oluşuyordu: 1) doku hizalaması; 2) doku tespiti; 3) doku segmentasyonu; 4) COI otomatik nicel; ve 5) doku ısı haritalama. Görüntü analizi için tüm protokoller görüntü analizi yazılımının Yazar modülü kullanılarak geliştirilmişve metinde APP olarak anılmıştır.
Doku hizalaması
Üç seri bölümden, 11 işaretin yanı sıra H&E ve PSR lekelerini kapsayan altı sanal slayt, görüntü analiz yazılımının Tissualign modülüne yüklendi. Daha sonra, görüntüler otomatik bir şekilde bağlanarak, hizalandı ve birlikte kaydedildi ve tek tek görüntülerin tüm katmanlarını içeren 11-plex artı H&E ve PSR sanal kompozit görüntü(Şekil 2A-C)üretildi. Bitişik seri bölümlerden kaynaklanan görüntülerde hizalama doğru ydu ve buna karşılık gelen doku yapılarını homolog bir şekilde hizalama üzerine konumlandırDı ve gösterdi (Şekil 2C ve Şekil S1A). Ayrıca, hizalama aynı bölümden kaynaklanan görüntüler için tek tek hücre düzeyinde kesindi(Şekil S1B). Otomatik hizalama zamanı, hizalanacak görüntülerin sayısına, boyutuna, karmaşıklığına ve benzerliğine bağlıdır. Yukarıda belirtilen altı sanal slaytların hizalanması VIS istasyonumuzda 15 dakika sürdü.

Şekil 2: Seri doku bölümlerinin boyanışı ve görüntü hizalaması. (A) COI ve TCs görselleştirme için üç seri bölüm üzerinde yapılan boyama özeti. Bölüm II ve III için dokular soyuldu ve antikorlardan oluşan ikinci bir kokteyl le reprobeedildi. (B) Doku hizalamadan önce ve sonra altı ayrı bütün doku görüntüsüne genel bakış (sırasıyla sol ve sağ). Ölçek çubuğu = 3.500 μm. (C) Hizalanmış görüntülerin yakınlaştırılmış görünümü. Ölçek çubuğu = 80 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Doku Algılama
Görüntüler birbirine bağlanıp hizalandıktan sonra, TAP'leri tanımlamaya çalıştık (Şekil 3A). TAP'lerin otomatik olarak algılanması için bir UYGULAMA tasarlamak için (APP 1, Tablo 1),TAP'leri dokuyla ilişkili olmayan piksellerden ayıran iki özellikten yararlandık. İlk olarak, DAPI sinyali (mavi bant) sadece dokuda bulunan çekirdeklerle sınırlıdır, yani tüm DAPI+ pikselleri TAP'lerin bir alt kümesidir. İkinci olarak, TAP'ler yeşil ve sarı bantlarda dokuyla ilişkili olmayan piksellere göre daha yüksek otofloresan ssinyaline sahiptir. Sonuç olarak, basit eşik teknikleri kullanarak bu kanallardaki temel sinyale dayalı TAP'leri algılayan doku tespiti için APP1 (Tablo 1)geliştirdik. Mavi, yeşil ve sarı bantlar için eşikler, TAP'lerin eşiklerin üzerinde arka plan yoğunluğu değerlerine sahip olacak şekilde ayarlanmış, dokuyla ilişkili olmayan piksellerin ise aşağıda değerleri vardır. Doku tespiti için APP 1, mavi, yeşil ve sarı kanallarda tabakalar içeren resim IIA'ya uygulandı (Şekil 3A). APP 1 çıktıları olarak, parlak yeşil bir maske TAPs üstüne koydu ve bir yatırım getirisi "Doku" olarak adlandırılan (çıkış, Şekil 3A)olarak belirlenmiştir. Ayrıca doku alanı nicel bir çıkış değişkeni olarak belirlendi. APP 1, dokuyu ilişkilendirmeyen pikselleri Yatırım Getirisi Dokusuna dahil etmediğinden, bu Yatırım Getirisi 'ne dayalı sonraki analizlerin dışında tutulmuşlar (Şekil 3A). TAZ'ları tanımlamada APP 1'in hassasiyeti Şekil 3A'dagösterilmiştir.
TC'ler için ROM'ların doku segmentasyonu ve deliasyonu
Daha sonra, stroma ve parankim içine doku segmente ederek RoI doku içinde farklı bölmeleri tanımlamak için devam etti. Biz PSR lekeli görüntü (IIIC, Şekil 2C),stroma fibriller kollajenlerin birikimi ile ilişkili alan olarak tanımlanabilir (kırmızı bant), fibriller kollajenlerin olmadığı alan olarak parenkim kullanılan ve hızlı yeşil karşı boyama boya hakim (yeşil bant)(Şekil 3B). TCs Stroma ve Parenchyma'yı dijital olarak sınırlamak için APP 2(Tablo 1)oluşturduk. Bu APP, önceden tanımlanmış Yatırım Getirisi Dokusu (çıktı, Şekil 3A)üzerinde çalışır ve Görüntü Analizi modülüne entegre sınıflandırıcı aracının eğitimi için temsili stroma ve parankim alanlarını kullanır. Eğitimli Classifier pikselleri bir stroma veya parankim etiketine atar (sırasıyla somon ve yeşil, Şekil 3B). Piksellerin sınıflandırılması üzerine, APP 2 ROIs Stroma ve Parenchyma tanımlamayı amaçlayan morfolojik işlemleri yürüttü(Şekil 3B ve Tablo 1). APP 2'nin pikselleri sınıflandırma ve ilgili ROI'ları oluşturma performansı Şekil 3B'degösterilmiştir. Ayrıca, APP 2 stroma ve parankim alanını ölçer. Son olarak, segmentasyon PSR lekeli bölüm kullanılarak yapılsa da, özetlenen stroma ve parankim bölgeleri PSR görüntüsüne hizalanmış herhangi bir görüntüye aktarılabilir.

Şekil 3: Otomatik doku algılama/segmentasyon ve ilgili ROI üretimi. (A) Image IIA, TAP'leri tanımlamak için kullanılmıştır (sol görüntü, ölçek çubuğu = 6,000 μm). AP 1(Tablo 1)kullanılarak TAP'lere parlak yeşil bir maske atandı ve Doku (çıktı 1) adı verilen bir yatırım getirisi elde edildi. Doğru, inset, TAKP'leri algılamada APP 1'in hassasiyetini gösteren yakınlaştırılmış görünümü gösterir. Ölçek çubuğu = 350 μm. (B) Yatırım Getirisi Dokusu (çıktı 1) APP 2 kullanılarak stroma ve parankim olarak bölümlere ayrılır. Soldaki görüntü, ROI stroma (somon) ve ROI parankim (yeşil) segmente Yatırım Getirisi Doku bir görünüm gösterir. Ölçek çubuğu = 4,500 μm. Sağda, ROI Doku, orijinal PSR boyama (resim IIIC) ve ROIs stroma ve parankim için inset yakınlaştırılmış görünümleri. Ölçek çubuğu = 250 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
COI'lerin otomatik olarak ölçülmesi
Daha sonra, ROIs Stroma ve Parenchyma'daki COI'leri tespit etmeye, bulmaya ve ölçmeye devam ettik. Aşağıdaki COI'leri bulmak ve saymak için 3-8(Tablo 1)PP'ler oluşturuldu: sırasıyla CD4+FoxP3+, CD8+, CD68+, MPO+, αSMA+, ve CD34+ hücreleri. APP 3, CD4+FoxP3+ hücrelerini (resim IIIA, Şekil 2C)düzenleyici T hücrelerinin (Tregs) vekil belirteçleri olarak bulmak ve saymak için tasarlanmıştır. Bu protokol, nükleer transkripsiyon faktörü FoxP3 (kırmızı bant) ve DNA etiketleme boya DAPI (mavi bant) gelen sinyalin colocalization algılar. Son zamanlarda aktive T hücreleri FoxP3 upregulate göz önüne alındığında, Tregs için zenginleştirmek için biz sadece parlak FoxP3 + hücreleri (FoxP3hi)önceden seçmek için eşikleri ayarlayın. Daha sonra, önceden seçilmiş tüm DAPI+FoxP3hi hücreleri arasında, sadece parlak halka şeklindeki CD4 sinyalleri (yeşil bant) ile çevrili olanlar etiketlendi ve FoxP3hiCD4+ hücreleri olarak sayıldı (pembe etiket, Şekil 4A). ROIs Stroma ve Parenkim'deki FoxP3hiCD4+ hücrelerinin yoğunluğu APP 3'ün nicel çıkış değişkenleri olarak belirlendi (Şekil 4A).
Benzer şekilde, 4-6 APP'ler CD8+, CD68+ve MPO+ hücrelerinin tespiti için tasarlanmıştır. Bu ApP'ler, COI'leri algılamak ve ölçmek için aynı temel tasarımı paylaşır. Özellikle, COI'ler belirli hücre popülasyonu biyobelirtecisinyal yoğunluğuna göre tanımlanır ve daha sonra tek tek hücreleri tanımlamak için birkaç postprocessing morfolojik adım yürütülür(Tablo 1). Tek tek hücreler veya COI'ler etiketlenir, sayılır ve doku koordinatları kaydedilir. 4-6 apps da ROIs Stroma ve Parenchyma COI yoğunluğunu belirlemek(Şekil 4B-D).
DAPI boyamamızın kalitesi, çekirdek segmentasyonunu 3'ten 6'ya entegre etmek için yeterli değildi, bu nedenle tek tek etiketlenmiş tüm nesnelerin tek tek hücreler olmasını sağlayamayız. Bu nedenle, etiketli nesne/mm2 sayılarında hücrelerin yoğunluğunu ifade ettik (Şekil 4). Ancak, hücre agregaları, 3 ile 6 arasında aftler halinde yerleşik postprocessing adımlarda tek tek hücrelere başarıyla ayrılmış ve kapsamlı görsel inceleme, etiketlenmiş nesnelerin çoğunun tek hücrelere karşılık geldiğini göstermiştir.
αSMA+ ve CD34+ alanını saptamak için sırasıyla 7 ve 8 apps geliştirdik (Tablo 1). Her iki AP eşiklere dayalı spesifik sinyali algılar ve ROIs Stroma ve Parenchyma'daki pozitif alanın yüzdesini belirler(Şekil 4E-F).
Sanal çok katlı slaytlar oluşturmanın en ilginç olasılıklarından biri, kolocalizasyon ifadesinin analizidir. ΑSMA ve desmin arasındaki kolokalizasyonu saptamak için APP 10 oluşturduk, karaciğerdeki miyofibroblastlar tarafından ortaklaşa ifade edilen iki belirteç. APP 10 αSMA, desmin ve αSMA plus desmin için pozitif piksel bulmak için eşikleri kullanır (Tablo 1). Nicel çıktı değişkenleri olarak APP 10 αSMA+ alanını, desmin+ alanını ve bu iki belirteçlerin kolocalize ifade alanını belirler(Şekil S3).

Şekil 4: TCs stroma ve parankimde COI'lerin tanımlanması ve ölçülmesi. (A–F) 3, 4, 5, 6, 7 ve 8 protokollerini kullanarak ROIs Stroma ve Parenchyma'daki CD4+FoxP3+, CD8+, CD68+, MPO+, αSMA+ve CD34+ COI'lerin sırasıyla 3, 4, 5, 6, 7 ve 8 protokollerini kullanarak otomatik olarak algılanması ve ölçülmesi(Tablo 1). Solda gösterilen orijinal görüntüler, ortada işlenmiş görüntüler ve sağda niceliksel. Şekil 4A-Diçin ölçek çubuğu = 40 μm. Şekil 4E ve F, ölçek çubuğu = 350 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
TCs Stroma ve Parenchyma COI'lerin ölçülmeye alternatif olarak, 1 ile 4 arasında adlandırılmış farklı malign nodüllerde bağışıklık hücrelerinin yoğunluğunu belirledik(Şekil 5A, H, ve I). Her nodül için YG, Şekil 5A'dabelirtildiği gibi el ile belirtilmiştir. Ayırt edici doku immün izleri her nodül karakterize, daha fazla TME içsel heterojenite ortaya.
Doku Isı Haritaları
Yukarıda belirtildiği gibi, ApPs 3-8 her ayrı etiketli nesnenin doku koordinatları saklayın. Bu özellik, belirli bir hücre popülasyonunun yüksek yoğunluklu bölgelerinin sıcak noktalar (kırmızı) olarak ve nispeten düşük yoğunluklu bölgelerin soğuk noktalar (koyu mavi) olarak gösterildiği otomatik doku haritalarının oluşmasını sağlar. Ara yoğunluk değerleri Şekil 5'tegösterilen renk skalasına göre renkler atanır. Doku ısı haritaları, görüntüleri 50 μm çapındaki dairelere ayıran ve daire içindeki belirli bir COI'nin göreli yoğunluğuna göre bir renk atanaplar tarafından oluşturuldu. Şekil 5B–G'degösterildiği gibi, TME'deki farklı COI'lerin konumlandırma desenleri ve yoğunluk dağılımı oldukça çeşitliydi. Ayrıca, bireysel nodüller düzeyinde, doku alanındaki farklı popülasyonların düzenlenmesi benzersizdi(Şekil S2A–C). Bu tekniğin gücüne bir örnek vermek ve aynı nodüldeki farklı popülasyonlardan gelen sıcak noktaların mekansal organizasyonunu görselleştirmek için, tek tek hücre tiplerinden gelen sıcak noktalar elle ayıklandı ve nodül 2 anahat üzerine eşlendi (Şekil S2, Şekil D, ve Şekil E).

Şekil 5: TME'deki COI'lerin doku ısı haritaları. (A) Nodüllerin 1, 2, 3 ve 4'ün yerini gösteren Picrosirius Kırmızı boyama. (B–G) CD4+FoxP3+, CD8+, CD68+, MPO+, CD34+ve αSMA+ COI'ler için doku ısı haritaları. Koyu mavi göreceli düşük yoğunluğu gösterir ve kırmızı göreli yüksek yoğunluğu gösterir. Ara yoğunluk değerleri gösterilen renk skalasına göre renkler atanır. (H ve I) Nodüllerde 1, 2 ve 3 + 4'te hücre tipi ve nodül başına düzenlenmiş COI'lerin ölçülmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Şekil S1: Doku hizasının doğrulanması. (A) CD34 boyama (kırmızı) bölüm II (giriş 1) yeşil (çıkış 1) bir CD34 maskesi oluşturmak için kullanılır. Yeşil maske (çıkış 1) hizalanmış seri bölüm I (giriş 2) H & E görüntü üzerine overlaid. Birleştirme görüntüsü vasküler yapıların mükemmel yazışmalarını gösterir. Ölçek çubuğu = 50 μm. (B) CD4+FoxP3+ hücreleri (çıkış 1 in agenta) için bir etiket oluşturmak için DAPI, CD4 ve FoxP3 (giriş 1) birliş gösteren Resim IIIA kullanılmıştır. Çıkış 1 etiketi hizalanmış görüntü IIIB üzerine transfer edildi (giriş 2) ve çiftleri FoxP3/DAPI arasında mükemmel yazışma gösterir ve CD4/CD3 birleştirme görüntü. Ölçek çubuğu = 15 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Şekil S2: Doku ısı haritalarının yakınlaştırılmış görünümü. (A–C) NODüllerde CD4+FoxP3+, CD8+, CD68+, ve MPO+ hücreleri için doku ısı haritaları 1-4. Nodül1, 2 ve 3 + 4'teki ölçek çubukları sırasıyla 1.500 μm, 700 μm ve 500 μm'yi temsil eder. (D) Nodül anahat 2 siyah düz çizgi ile. (E) Nodül 2'deki CD4+FoxP3+, CD8+, CD68+ve MPO+ hücreleri için sıcak noktalar ayıklandı ve D'detanımlanan nodül 2 anahattı üzerine eşlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Şekil S3: Kolokalizasyon Analizi. (A) Sol ve ortadaki αSMA etiketinin yeşil ve desmin etiketinde sırasıyla kırmızı görüntüler bulunmaktadır. Sağtarafta sarı bir αSMA /desmin çift pozitif alandır. (B) ΑSMA+ alanı, desmin + alanı ve αSMA/desmin çift pozitif alanın sayısallaştırılması. Ölçek çubuğu = 150 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| App | Amaç | Sınıflandırma | Sınıflandırma | İşlem Sonrası Adımlar | Çıktı Değişkenleri |
| Yöntem | Özellik | ||||
| (piksel değeri) | |||||
| 1 | Doku tespiti | Eşik | Kanal DAPI (150) | o 3 kanal için eşiğe uygun eşik üstü değerleri olan nesneleri etiketleme | o ROI Doku |
| Kanal FITC/A488 (120) | o Pozitif nesneyi 5 piksel kapatın | o Doku Alanı | |||
| Kanal TRITC/A568 (40) | o RoI Doku oluşturun | ||||
| 2 | Doku Segmentasyonu | Karar Orman | RGB-R ortanca | o Boşlukları doldurun | o ROI Stroma |
| RGB-G ortanca | o ROI Stroma oluşturun | o Stroma Alanı | |||
| RGB-B ortancası | o ROI Parenchyma oluşturun | o ROI Parenchyma | |||
| IHS-S ortanca | o Parenchyma Alanı | ||||
| H&E Eosin median | |||||
| 3 | CD4+ FoxP3+ hücrelerini bulmak ve ölçmek için | Eşik | Kanal DAPI (>600) | o FITC/A488 sinyali ile çevrili DAPI ve Cy5/A647 ortak yerelleştirmeli nesneleri etiketleme | o ROIs Stroma ve Parenchyma'daki CD4+FoxP3+ hücrelerinin sayıları ve yoğunluğu |
| Kanal FITC/A488 poli yumuşatma (>850) | o 7μm'den küçük nesneleri temizleyin 2 | o Tek tek CD4+FoxP3+ hücrelerinin koordinatları | |||
| Kanal Cy5/A647(>800) | |||||
| 4 | CD8+ hücrelerini bulmak ve ölçmek için | Eşik | Kanal DAPI (<1200) | o 15μm'den küçük pozitif nesneleri temizleyin 2 | o ROIs Stroma ve Parenkim'deki CD8+ hücrelerinin sayıları ve yoğunluğu |
| Kanal Cy5/A647 medyan (>80) | o Pozitif nesneleri 2 piksel kapatın | o Tek tek hücrelerin koordinatları | |||
| o Ayrı nesneler | |||||
| 5 | CD68+ hücrelerini bulmak ve ölçmek için | Eşik | Kanal FITC/A488 (>200) | o 20 μm'den küçük pozitif nesneleri temizleyin2 | o ROIs Stroma ve Parenkim'deki CD68+ hücrelerinin sayıları ve yoğunluğu |
| o Pozitif nesneleri 3 piksel dilate | o Tek tek CD68+ hücrelerinin koordinatları | ||||
| o Ayrı nesneler | |||||
| 6 | MPO+ hücrelerini bulmak ve ölçmek için | Eşik | Kanal DAPI (>400) | o 5 μm'den küçük nesneleri temizleyin2 | o ROIs Stroma ve Parenkim'deki MPO+ hücrelerinin sayıları ve yoğunluğu. |
| Kanal TRITC/A568 (900-4000) | o 3 piksel pozitif nesneleri dilate | o Bireysel MPO+ hücrelerinin koordinatları. | |||
| o Ayrı nesneler | |||||
| 7 | αSMA+ alanını bulmak ve ölçmek için | Eşik | Kanal TRITC/CF568 (>1050) | o 25 μm'den küçük pozitif nesneleri temizleyin2 | o ROIs Stroma ve Parenkima αSMA+ alanının sayıları ve yoğunluğu |
| o 3 piksel pozitif nesneleri dilate | o αSMA+ piksellerinin koordinatları | ||||
| 8 | CD34+ alanını bulmak ve ölçmek için | Eşik | Kanal DAPI (<5000) | o 25 μm'den küçük pozitif nesneleri temizleyin2 | o ROIs Stroma ve Parenchyma'da CD34+ alanının sayıları ve yoğunluğu |
| Kanal Cy5/A647 medyan (>120) | o 3 piksel pozitif nesneleri dilate | o CD34+ pikselkoordinatları | |||
| 9 | Belirli bir hücre popülasyonu için doku ısı haritaları oluşturma | Nesne Isı Haritası | Nesne Isı Haritası | o Isı Haritası | |
| Çizim yarıçapı 50 μm | --- | ||||
| 10 | αSMA ve Desmin arasındaki kolokalizasyonu ölçmek | Eşik | Kanal TRITC (CF568) (>1050) | o TRITC için eşik değerlerinin üzerinde olan etiketler (CF568) | o αSMA ve Desmin'in kolokalize ekspresyonunu ölçmek |
| Kanal Cy5 (A647) (>1000) | o Cy5 (A647) için eşik değerlerinin üzerinde olan etiketler | ||||
| o TRITC (CF568) ve Cy5 (A647) için yukarıdaki eşik değerlerinin eşlokalizasyonu olan etiket nesneleri | |||||
| o 25 μm'den küçük pozitif nesneleri temizleyin2 |
Tablo 1: Görüntü analizi için kullanılan AP'lerin tasarımında kullanılan genel parametreler. Bu tabloda belirtilen parametreler, bu çözümlemede kullanılan görüntülerin benzersiz özelliklerine (örn. arka plan, eserler, vb.) ayarlanır ve diğer görüntüler için geçerli olmayabilir. Söz konusu işlem sonrası adımlar bu çalışmada analiz edilen belirli görüntüler için tanımlandıklarından, kasıtlı olarak ayrıntılı değildir. Kullanıcı, ApPs'yi analiz edilecek görüntülere göre özelleştirmelidir.
| Kesit/Boyama | Primer Antikor | İkincil Antikor |
| Bölüm II/1st Boyama | Fare IgG2a anti-insan αSMA Fare IgG1 anti-insan CD34 Tavşan anti-insan Cytokeratin 8/18 |
Keçi anti-fare IgG2a CF568 Fare anti-fare IgG1 A647 Eşek anti-tavşan A488 |
| Bölüm II/2.nd | Tavşan anti-insan Desmin Fare anti-insan CD68 |
Eşek anti-tavşan A647 Eşek fare karşıtı DyLight 755 |
| Bölüm III/1st Boyama | Fare anti-insan CD4 Tavşan anti-insan FoxP3 Keçi anti-insan MPO |
Eşek fare karşıtı A488 Eşek anti-tavşan A647 Eşek anti-keçi A568 |
| BölümIII/2. Boyama | Tavşan anti-insan CD3 Fare anti-insan CD8 |
Eşek fare karşıtı DyLight 755 Eşek anti-tavşan A647 |
Tablo 2: mIF için Primer-Sekonder Antikor Çiftleri.
Discussion
Basit, erişilebilir ve doku bölümlerinde bağışıklık hücrelerinin mekansal çözünürlüğü sağlayan çoklama teknikleri yürütmek kolay kanser ve diğer immünolojik bozukluklar bağışıklık manzara harita için gereklidir. Burada, görüntüleme tahlilleri12,13,,17,19çoklama yeteneği ve çok boyutlu değerlendirme genişletmek için yaygın olarak kullanılabilir etiketleme ve dijital analiz teknikleri entegre bir strateji açıklar. Farklı belirteçler için üç seri bölümün boyanması ve bölümlerin sıyırma ve reprobing teknikleri ile yeniden kullanılması, H&E ve PSR lekelerine ek olarak 11 parametreyi görselleştirmemizi sağladı. Bu bölümlerden altı görüntü doku hizalama modülü kullanılarak otomatik bir şekilde hizalandı. Hizalama, aynı bölümden gelen görüntüler için tek tek hücre düzeyinde hassas ve komşu bölümlerden kaynaklanan görüntüler için son derece uyumluydu. Sanal çoklama, bir bölümde görselleştirilen işaretçilerin bitişik başka bir bölümde görselleştirilen işaretçilerle mekansal olarak nasıl ilişkili olduğunu belirlememizi sağladı. Bazı lekeler COI etiketli iken, diğerleri bize farklı TCs COI ölçmek için izin TCs etiketli. COI'lerin otomatik olarak ölçülmesi için yazılım araçlarının kullanılması büyük ölçüde basitleştirilmiş ve görüntülerin işlenmesini hızlandırmış. Ayrıca, seçilen görüş alanları yerine tüm doku bölümlerine dijital analiz uygulanarak TME'nin tarafsız bir temsili elde edilmiştir. Ayrıca, COI doku koordinatları kayıtlı olduğundan, doku ısı haritaları oluşturmak mümkün oldu.
Bu protokolde sorun giderme gerekebileceği birkaç alan vardır. İlk olarak, kötü antijen alma mIF kalitesini etkileyebilir, bu nedenle antijen alma tampon ve süre türü kullanılan özel araştırma / biyomarker koşulları için optimize edilmelidir. İkinci olarak, kullanılan bloklama çözeltisinin türü primer ve sekonder antikordoku/antijen/türe uyarlanmalıdır. Elimizde, doku bloke Fc reseptörlerinden gelen türlerden% 10 toplam serum eklenmesi, ve böylece nonspesifik antikor bağlanması azaltılmış. Serumun %10'unun ikincil antikorların yetiştirildiği türlerden eklenmesi, sekonder antikorların doku bölümüne doğrudan nonspesifik olmayan bağlanmasını en aza indirir. Üçüncü olarak, uygun pozitif ve negatif kontroller kullanılarak primer ve sekonder antikorların özgüllüğünün doğrulanması esastır. Dördüncü olarak, bazı kanallarda artmış otofloresans ve primer antikor sıyırma üzerine DAPI difüzyonu da yaygındır. Gelişmiş otofloresansa değinmek için, spesifik sinyalin arka plandakinin en az 5 kat yoğunluk değerlerine sahip olduğu birincil/ikincil antikor çiftleri kullandık. Son olarak, bazı yüksek yakınlık antikorları düzenli sıyırma prosedürleri ile eluted olamaz. Bu durumda, etiketlemenin son turunda bu tür antikorların kullanılmasını öneririz. Kullanıcı ilgi antikorları için en uygun yapılandırmayı bulmak için farklı boyama dizileri denemek zorunda kalabilirsiniz. İkinci veya üçüncü kez etiketleme işlemine geçmeden önce sıyırma nın etkinliği teyit edilmelidir.
Bu stratejinin temel sınırlama ve sorun ilgi belirteçleri için primer ve ikincil floresan antikorların doğru kombinasyonları bulmaktır. Farklı türlerde veya aynı anda kullanılabilen farklı izotiplerle yetiştirilen birincil antikorların bulunması, ticari olarak mevcut olanlarla sınırlıdır. Tüm slayt tarayıcılarının çoğu, en fazla beş kanalgörüntülemeye izin veren lambalar ve filtrelerle donatılmıştır ve doğru türlerde ve sağ floroforlarda ikincil antikorlar her zaman mevcut değildir. Seri boyamalar ve sıralı etiketleme kullanarak bu sınırlamaları kısmen aştık. İlgi işaretleri için en iyi kombinasyona ulaşmak için çeşitli antikor kombinasyonlarının test edilmesi gerekebilir. Sıyırma ve reprobing her zaman çekirdek segmentasyon gerçekleştirmeye izin olmayabilir, çünkü başka bir sınırlama DAPI boyama kalitesidir.
Doku hizalama modülü en az eğitim ve kullanıcılardan hiçbir programlama becerileri gerektirir. Yazılım teorik olarak görüntülerin sınırsız sayıda hizalanmasına olanak sağlar. Ancak, kesin hizalama, daha histolojik olarak uyumlu olan yakın bölümlerin daha doğru bir şekilde hizalandığı bölümlerin ilgililiğine bağlıdır. APP'leri oluşturmak için VIS'in Yazar modüllerini kullandık. AAP'ler oluşturmak için temel görüntü analizi bilgisi gereklidir, ancak bu durum diğer görüntü analizi yazılımlarını kullanırken de aynı şekilde geçerlidir. VIS'in diğer görüntü analiz yazılımlarına kıyasla benzersiz avantajları arasında farklı yöntemlerkullanılarak hazırlanan bölümlerden görüntülerin otomatik olarak hizalanması yer almaktadır (örneğin, IF, histochemistry, IHC). Bu sanal çoklama kullanarak ilgi birden fazla belirteçleri colocalization çalışmaları sağlar. Ayrıca, APP'lerin esnek ve kullanıcı dostu tasarımı kullanıcıya özel özelleştirmeye olanak tanır. Otomatik niceleme ve haritalama ve tüm doku bölümleriişleme olasılığı, zaman kazandırır ve görsel muayene ile manuel sayma ile karşılaştırıldığında önyargı azaltır.
Bu strateji kanser ve otoimmünite bağlamında doku immünolojisi için çok yararlı bir araştırma aracıdır ancak klinik kullanım için doğrulanmamış kalır. Ek standardizasyon ve doğrulama ile, gelecekte birden fazla uygulama için kullanılabilir (örneğin, tahmin etmek ve immünoterapötik ajanlara yanıtı izlemek için kanser bağışıklık manzara harita). Patolojik değerlendirmeile prognostik biyobelirteçleri birleştirmek için farklı inflamatuar durumlara (örn. inflamatuar barsak hastalığı) da adapte edilebilir.
Bu protokoldeki temel kritik adımlar, etiketlemenin verimliliği/özgüllüğü ve amaçlanan kullanım veya biyomarker için tasarlanmış AA'ların sağlamlığıdır. Bu nedenle, görsel denetim tarafından düzenli doğrulama, özellikle yeni bir APP tasarımı üzerine, esastır. Aynı bölümde birden fazla sıyırma ve reprobing veya lekelerin farklı türde verimli kullanımı kritik bileşenleri ve doku veya bölüm özgü olabilir. Büyük toplu iş çözümlemesi ile devam etmeden önce bu tür süreçlerin verimliliğini doğrulamak çok önemlidir.
Özetle, değerli klinik doku örneklerinden elde edilebilen nicel ve mekansal bilgileri en üst düzeye çıkaran bir strateji sayılmaktayız. Bu metodolojiyi uygulamak için gereken kaynaklara, ekipmanlara ve bilgilere çok erişilebilir. Bu metodolojiyi, TME'deki bağışıklık hücre popülasyonlarını tanımlamayı, ölçmeyi ve haritalamayı amaçlayan tahlillerin planlanmasında yararlı bir kılavuz olarak öneriyoruz.
Disclosures
Yazarlar çıkar çatışması beyan etmezler.
Acknowledgments
Çalışma katılımcısı teşekkür ederiz. Biz Louise Rousseau, doku örnekleri ve ilgili tüm klinik bilgilerin kurtarma için HBP biyobank koordinatörü teşekkür ederiz. Mükemmel teknik yardım için CRCHUM'daki moleküler patoloji ve hücre görüntüleme çekirdek tesislerini ve Visiopharm'dan Michael Persch'i kabul ediyoruz. Finansman: Bu çalışma Kanada Karaciğer Vakfı, Fonds de recherche du Québec-Santé (FRQS) AIDS ve Bulaşıcı Hastalıklar Ağı (Réseau SIDA-MI) ve Hepatit C Kanada Ağı (CanHepC) tarafından desteklenmiştir. CanHepC, Kanada Sağlık Araştırmaları Enstitüleri (CIHR) (NHC-142832) ve Kanada Halk Sağlığı Ajansı'nın ortak girişimi yle finanse edilmektedir. M.F.M., Université de Montréal, Bourse Gabriel Marquis ve FRQS'den burs aldı. T.F., CIHR ve CanHepC'ten doktora bursu aldı. S.T. hepatobiliary ve pankreas onkolojik cerrahi Roger-Des-Groseillers Başkanı tutar, Université de Montréal.
Yazar katkıları: M.F.M. tasarlanmış, deneyler yapmış ve verileri analiz edilmiştir. T.F. deneyler tasarladı. A.C-B. teknik rehberlik sağladı. G.S. çalışma konusunun tüm patolojik değerlendirmesini yapmış ve tüm patolojik yönleri hakkında bilgi verilmiştir. L.M. H&E boyama, optimize etme ve görüntü edinimi gerçekleştirdi. M.N.A. PSR lekesini uyguladı ve değerli teknik girdi sağladı. N.B. görüntü analizine katkıda bulundu. S.T. HBP biyobank'ın baş araştırmacısıdır ve biyobankın genel işleyişini denetlemekten sorumludur. Ayrıca projenin tüm yönleri ve klinik etkileri hakkında paha biçilmez bir girdi sağladı. M.F.M, T.F., ve N.H.S. çalışmayı kavramsallaştırdı ve tasarladı. N.H.S. işi denetledi ve fon elde etti. Taslağı M.F.M., T.F., A.C-B. ve N.H.S. yazdı. Tüm yazarlar el yazını gözden geçirdi ve onayladı.
Materials
| Name | Company | Catalog Number | Comments |
| Antigen Retrieval Solution: Sodium Citrate Buffer (10 mM Sodium Citrate, 0.05% v/v Tween 20, pH 6.0) | |||
| Blocking Solution: 1 % BSA, 10 % filtered human serum, 10 % filtered donkey serum, 0.1 % Tween 20, and 0.3% Triton in PBS | |||
| Bovine serum albumin (BSA) | Multicell | 800-095-EG | |
| Coplin jars (EASYDIP SLIDE STAINING SYSTEM) | Newcomersupply | 5300KIT | |
| Cover slides | Fisherbrand | 12-545E 22*50 | |
| Direct Red 80 | Sigma Aldrich | 365548 | |
| Donkey Serum | Sigma Aldrich | D9663 | |
| Ethanol 100% | |||
| Electric pressure cooker | Salton | ||
| Eosin | Leica Biosystems | 3801600 | CAUTION, eye irritation |
| Fast Green FCF | Sigma Aldrich | F7252 | CAUTION, harmful by inhalation, ingestion and skin absortion |
| FFPE section (4μm) slides | |||
| Glycine 0,1 M in PBS | |||
| Hematoxylin Stain Solution, Gil 1. Formulation, Regular Strength | Ricca Chemical Company | 3535-32 | |
| Holder (EasyDip Staining Jar Holder) | Newcomersupply | 5300RK | |
| Human Serum | Gemini | 22210 | |
| Humidity chamber | Millipore Sigma | Z670138-1EA | |
| Pap pen | abcam | ab2601 | |
| PBS | |||
| PBS-Tween 20 (0.1% v/v) | |||
| Permount Mounting Media | Fisher Chemical | SP15-500 | |
| Picric Acid 1.3 % | Sigma Aldrich | P6744 | CAUTION, skin and eye irritation |
| Picro-Sirius Red/Fast Green solution: Fast Green 0.1 % w/v + Sirius Red 0.2 % w/v in 1,3 % picric acid solution | |||
| Primary Antibody Anti-αSMA | Mouse IgG2a 1A4 | Sigma A2547 | Dilution 1/100 |
| Primary Antibody Anti-CD34 | Mouse IgG1 HPCA1/763 | Novus Biologicals NBP2-44568 | Dilution 1/250 |
| Primary Antibody Anti-Cytokeratin 8/18 | Rabbit EP17/EP30 | Agilent IR09461-2 | Ready to use |
| Primary Antibody Anti-CD68 | Mouse KP1 | Abcam ab955 | Dilution 1/200 |
| Primary Antibody Anti-Desmin | Rabbit Polyclonal | Invitrogen PA5-16705 | Dilution 1/200 |
| Primary Antibody Anti-CD4 | Mouse N1UG0 | Affymetrix 14-2444 | Dilution 1/250 |
| Primary Antibody Anti-FoxP3 | Rabbit 1054C | R & D MAB8214 | Dilution 1/100 |
| Primary Antibody Anti-MPO | Goat Polyclonal | R & D Systems AF3667 | Dilution 1/250 |
| Primary Antibody Anti-CD3 | Rabbit SP7 | Abcam ab16669 | Dilution 1/200 |
| Primary Antibody Anti-CD8 | Mouse C8/144B | Invitrogen 14-0085-80 | Dilution 1/200 |
| Secondary Antibody Donkey anti-mouse A488 | Polyclonal | Invitrogen A-21202 | Dilution 1/500 |
| Secondary Antibody Donkey anti-Rabbit A488 | Polyclonal | Invitrogen A-21206 | Dilution 1/500 |
| Secondary Antibody Donkey anti-goat A568 | Polyclonal | Invitrogen A-11057 | Dilution 1/500 |
| Secondary Antibody Donkey anti-rabbit A647 | Polyclonal | Invitrogen A-31573 | Dilution 1/500 |
| Secondary Antibody Rat anti-mouse IgG1 A647 | RMG1-1 | Biolegend 406618 | Dilution 1/500 |
| Secondary Antibody Goat anti-mouse IgG2a CF568 | Polyclonal | Sigma Aldrich SAB4600315 | Dilution 1/500 |
| Secondary Antibody Donkey anti-mouse DyLight 755 | Polyclonal | Invitrogen SA5-10171 | Dilution 1/500 |
| Secondary Antibody Donkey anti-rabbit DyLight 755 | Polyclonal | Invitrogen SA5-10043 | Dilution 1/500 |
| SDS | BioShop | SDS001,500 | CAUTION, oral skin and eye toxicity |
| Shandon multi-program robotic slide stainer | LabX | 11384903 | |
| Shandon Xylene Substitute, | Thermo Fisher Scientific | CA89413-336 | CAUTION, Flammable, skin and eye irritation, Harmful when inhaled |
| Shaking water bath | |||
| SlowFade Gold antifade reagent with DAPI | Invitrogen | S36938 | |
| Sodium Citrate Dihydrate | Millipore Sigma | 1545801 | CAUTION, eye irritation |
| Stripping Buffer: mix 20 ml 10% w/v SDS with 12.5 ml 0.5 M Tris-HCl (pH 6.8), and 67.5 ml ultra-pure water. Under a fume hood, add 800 uL of 2-mercapto ethanol (114,4 mM final concentration) | |||
| Triton X-100 | Sigma Aldrich | T8787-50ML | |
| Tris-HCl | BioShop | 77-86-1 | |
| Tween 20 | Fisher Scientific | BP337-500 | |
| VIS Software | Visiopharm | ||
| Whole slide scanner Olympus BX61VS | Olympus | Microscope: Olympus Slide Scanner BX61VS, 5 slides scanner, motorized stage, autofocus. Camera: Lightsource: Xcite-120. Filters: BrightLine® Sedat filter set (# LED-DA/FI/TR/Cy5-4X4M-B-000, Semrock) | |
| Xylene | Sigma Aldrich | 214736-4L | CAUTION, Flammable, skin and eye irritation, Harmful when inhaled |
| Xylene : Ethanol solution (1:1 v/v) | |||
| 2-mercaptoethanol | Sigma | M6250 | CAUTION, harmful by ingestion, inhalation, fatal if sking absortion. Eye irritation. Use fume hood |
References
- Greten, F. R., Grivennikov, S. I. Inflammation and Cancer:Triggers, Mechanisms, and Consequences. Immunity. 51 (1), 27-41 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Taube, J. M., et al. Implications of the tumor immune microenvironment for staging and therapeutics. Modern Pathology: an official journal of the United States and Canadian Academy of Pathology, Inc. 31 (2), 214-234 (2018).
- Bindea, G., et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer. Immunity. 39 (4), 782-795 (2013).
- Galon, J., et al. Towards the introduction of the 'Immunoscore' in the classification of malignant tumours. The Journal of Pathology. 232 (2), 199-209 (2014).
- Finotello, F., Eduati, F. Multi-Omics Profiling of the Tumor Microenvironment: Paving the Way to Precision Immuno-Oncology. Frontiers in Oncology. 8, 430 (2018).
- Gerner, M. Y., Kastenmuller, W., Ifrim, I., Kabat, J., Germain, R. N. Histo-cytometry: a method for highly multiplex quantitative tissue imaging analysis applied to dendritic cell subset microanatomy in lymph nodes. Immunity. 37 (2), 364-376 (2012).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Porta Siegel, T., et al. Mass Spectrometry Imaging and Integration with Other Imaging Modalities for Greater Molecular Understanding of Biological Tissues. Molecular Imaging and Biology : MIB: the official publication of the Academy of Molecular Imaging. 20 (6), 888-901 (2018).
- Buchberger, A. R., DeLaney, K., Johnson, J., Li, L. Mass Spectrometry Imaging: A Review of Emerging Advancements and Future Insights. Analytical Chemistry. 90 (1), 240-265 (2018).
- Pirici, D., et al. Antibody elution method for multiple immunohistochemistry on primary antibodies raised in the same species and of the same subtype. Journal of Histochemistry and Cytochemistry. 57 (6), 567-575 (2009).
- Gendusa, R., Scalia, C. R., Buscone, S., Cattoretti, G. Elution of High-affinity (>10-9 KD) Antibodies from Tissue Sections: Clues to the Molecular Mechanism and Use in Sequential Immunostaining. Journal of Histochemistry and Cytochemistry. 62 (7), 519-531 (2014).
- van der Loos, C. M. Multiple immunoenzyme staining: methods and visualizations for the observation with spectral imaging. Journal of Histochemistry and Cytochemistry. 56 (4), 313-328 (2008).
- Stack, E. C., Wang, C., Roman, K. A., Hoyt, C. C. Multiplexed immunohistochemistry, imaging, and quantitation: a review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis. Methods. 70 (1), 46-58 (2014).
- Toth, Z. E., Mezey, E. Simultaneous visualization of multiple antigens with tyramide signal amplification using antibodies from the same species. Journal of Histochemistry and Cytochemistry. 55 (6), 545-554 (2007).
- Robertson, D., Savage, K., Reis-Filho, J. S., Isacke, C. M. Multiple immunofluorescence labeling of formalin-fixed paraffin-embedded (FFPE) tissue. BMC Cell Biology. 9, 13 (2008).
- Segnani, C., et al. Histochemical Detection of Collagen Fibers by Sirius Red/Fast Green Is More Sensitive than van Gieson or Sirius Red Alone in Normal and Inflamed Rat Colon. PloS One. 10 (12), 0144630 (2015).
- Bolognesi, M. M., et al. Multiplex Staining by Sequential Immunostaining and Antibody Removal on Routine Tissue Sections. Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).



