Summary
鉴于全球化学品资源是有吸引力的可药物靶点,因此GPCR配体筛查对于确定铅化合物和脱化研究是必不可少的。为了这些努力,我们描述了PRESTO-Tango,一个开源资源平台,用于使用基于TEV的记者分析,同时分析在大约300个全球资源中的瞬态β-逮捕2招募。
Abstract
作为最大和最通用的基因超级家族和一系列细胞信号通路的中介,G-蛋白质耦合受体(GPCRs)是制药行业最有希望的目标之一。Ergo,GPCR配体筛选测定的设计、实施和优化至关重要,因为它们代表了用于药物发现和操纵GPCR药理学和结果的远程控制工具。过去,G蛋白依赖性测定是这一研究领域的典型化,它检测了配体引起的事件,并量化了二次信使的生成。然而,由于功能选择性的出现,以及对其他几个与G蛋白无关途径的认识,以及与G蛋白依赖性测定相关的局限性的增强,在创造替代方法方面有了更大的推动GPCR 配体筛选测定。为了这一努力,我们描述了一个这样的资源,PRESTO-Tango平台的应用,一个基于荧光酶的记者系统,能够并行和同时询问人类GPCR-ome,这一壮举以前被认为是技术和经济上不可行。基于G蛋白独立β-逮捕2招募测定,在GPCR中,β-逮捕2中介贩运和信号的普遍性使PRESTO-TANGO成为研究大约300个非嗅觉人类全球活动能力(包括约100种)的合适工具。孤儿受体。PRESTO-Tango 的灵敏度和鲁棒性使其适用于使用复合库的主要高通量屏幕,用于发现已知药物的新 GPCR 靶点或发现用于孤儿受体的新配体。
Introduction
G-蛋白质耦合受体(GPCRs)是最大、最多样化的跨膜蛋白系列,作为细胞与环境之间的通信接口运行。GPCR 的多功能性因它们能够检测各种配体(从神经递质到核苷酸、肽到光子等)的能力,以及它们调节大量涉及细胞生长、迁移、分化、凋亡、细胞激发等的下游信号级联的能力。考虑到它们无处不在和参与多种生理过程,这种受体家族具有最重要的治疗意义,目前超过三分之一的处方药针对GPCRs4。然而,这些现有的治疗只针对一小部分的超级家族(估计10%),和许多GPCR的药理学仍然未被阐明。此外,100多个GPCRs作为孤儿受体存在,因为它们没有与内源配体5相匹配。因此,GPCR配体筛选在脱化和药物开发中至关重要,因为它为铅发现和优化铺平了道路,并可能进入临床试验阶段。
GPCR配体筛选方法传统上属于两类之一,即G蛋白依赖或G蛋白独立功能测定6。GPCR 信号由异质 G-蛋白质 (G+) 调节,通过将 GTP 交换到 G# 子单元7上的 GDP 激活。来自激活受体的信号由G蛋白通过二次信使(如cAMP、钙、DAG和IP3)传递,以调解下游效应器8的下游信号。G蛋白信号的功能后果的性质已被利用来创建反映受体活化的基于细胞的检测。这些方法测量G蛋白信号中的近端(直接)或远端(间接)事件,最常用于GPCR配体筛选,主要用于脱化研究6。直接测量GPCR介导G蛋白活化的测定示例包括 [35S]GTP_S 结合测定, 测量与G+子单元模拟的放射性标记和非水解GTP的绑定,以及Fürster/生物发光共振能量转移(分别为FRET/BRET)探测器,以监测GPCR-G+和G+/G®相互作用,这些相互作用在9、10年间获得了更大的牵引力。分析监视器远端事件是 GPCR 分析最常用的工具;例如,cAMP和IP1/3测定测量G蛋白依赖性辅助信使的细胞内积累,而[Ca2]通量和报告器检测涉及与G蛋白活化相关的特定响应元素(CRE、NFAT-RE、SRE、SRF-RE)检查信号级联11下游事件。虽然上述大多数检测都可以在高吞吐量级别执行, 是相当敏感的,并夸耀某些测定特异性的优点(例如,在GTP_S结合的情况下,全/偏激动剂、中性拮抗剂和反向激动剂之间的歧视,或对活细胞(如[Ca2]和IP1/3)6的检测功能,不幸的是,没有现有的G蛋白依赖方法适合对整个可摄药GPCR-ome的询问。这主要是由于多个G蛋白子家族与GPCR的本机耦合,导致多个级联的信号和孤儿GPCR未知G蛋白耦合。为了缓解此问题,已开发出一种测定方法,通过单个通用信令读出(如 cAMP 和 Ca2+)强制混合 G 蛋白耦合,尽管大多数是低通量12。
GPCR生命周期的一个重要方面是G-蛋白依赖性信号的终止,这在很大程度上是通过招募β-逮捕素,导致G蛋白分离,并最终使受体脱敏,这是针对克拉林涂层内化13。最普遍表达的β-逮捕形式是非视觉β-逮捕1和β-逮捕2,也分别表示为逮捕-2和逮捕-3,分别为14。输入G蛋白独立细胞基测定,为GPCR配体筛选增加新的维度;受体贩运、无标签全细胞和β-逮捕招募检测都是值得注意的例子。GPCR贩运测定使用氟磷标记配体或联合内化抗体针对受体15,而无标签全细胞检测使用生物传感器,将配体结合引起的细胞变化转化为可量化输出,如电信或光学信号16。值得注意的是,典型的GPCR-β-逮捕互动时尚β-逮捕在招聘检测作为一个有吸引力的工具,在功能测定的剧目17。探戈系统,最初由巴内亚等人开发,直到十年前, 涉及引入三种外源遗传元素:由β-卡丁2与烟草蚀刻病毒蛋白酶(TEVp)组成的蛋白质融合,一种通过烟草蚀刻与GPCR相连的四环素转导剂(tTA)。 病毒蛋白酶裂解部位(TEVcs),前面是V2血管加压素受体(V2尾部)的C端序,以促进逮捕招募,和记者卢卡皮基因的转录是由tTA 转录因子转移到核,在β-逮捕2招募后从膜锚定中释放出来(图1)18。GPCR 激活和 β-逮捕2 招聘的定量读数随后可以通过读数来确定为发光。一个值得注意的区别是,虽然受体贩运和无标签全细胞方法的通量相对较低,探戈有几个优点,包括选择性读出是特定于目标受体和灵敏度由于信号集成,这使得它适合选择配体筛选在更大规模18。
鉴于这些战略特征,Kroeze等人开发了PRESTO-Tango(通过转录输出探戈进行平行受体-渗透表达和筛选),这是一个高通量开源平台,使用探戈方法以并行和同时的方式对可的药物GPCR-ome进行剖面分析。PRESTO-Tango 利用"混杂性"招募 β-逮捕2到几乎所有 GPCRs,在基于细胞的功能测定方面是首创的,几乎可以在所有非嗅觉性 GPCRs(包括孤儿)中快速"第一轮"筛选小分子化合物,而与 G-蛋白子家族耦合无关。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 初级筛选:细胞培养和板播种
- 要制备聚-L-赖因 (PLL) 涂层板,请使用电子多通道移液器或试剂分配器在白色或黑色 384 孔光学底板上分配 25 μg/mL PLL 的 20 μL/mL 库存溶液。在室温下孵育板 0.5~2 小时。
注:如果使用黑色 384 孔板,则预计背景信号比白色板低。建议使用黑色板来减少相邻井之间的发光。 - 要保留涂层板并洗掉多余的 PLL,请将其轻拂到水槽上,用纸巾轻点干燥,并使用电子多通道移液器或试剂分配器加入 40 μL/well 稀释的 1 倍抗生素抗炎溶液。将 PLL 涂层板储存在 4 °C,直到准备好进行板播种。
- 维持HTLA细胞(由理查德·阿克塞尔博士提供)-人类胚胎肾细胞系(HEK293T)在完整的Dulbecco的改良鹰的介质(DMEM)中,以5%的胎儿牛血清补充, 5%的牛小牛血清,2.5微克/mL的紫霉素,50微克/mL的湿霉素,100 U/mL青霉素,和100微克/mL链霉素在37°C的加湿培养箱含有5%CO2。
- 培养150 mm的培养性HTLA细胞,每周两次通过细胞,稀释系数为1:10,最佳细胞通过数为5~25。确保根据主屏幕的刻度,在 384 孔板播种的当天,将足够数量的 150 mm 盘子与一天汇入。
注:使用大于通道25的HTLA细胞可能会导致生存能力降低,从而产生不理想的结果。 - 要为主屏幕种子 HTLA 细胞,请用 1x 磷合盐水 (PBS)(pH 7.4)轻轻冲洗 150 mm 的汇液。分离约 6 mL 0.05% Trypsin/0.53 mM EDTA 的细胞,并转移到至少同等数量的完全 Dulbecco 改性鹰介质 (DMEM) 的离心管中和色氨酸。
- 在 500 x g下旋 HTLA 细胞 3 分钟,并在完整的 DMEM 中以 0.22 x 106细胞/mL的密度重新悬浮细胞颗粒,省略了 2.5 μg/mL 的紫杉醇素和 50 μg/mL 的吸血素,因为它们会降低转染效果。
- 在37°C下孵育必要的384孔PLL涂层板,在播种细胞之前加热它们。将盘子轻拂在水槽上,用纸巾贴上,将其从 384 孔 PLL 涂层板中取出 1 倍抗生素抗异化剂的存储溶液。
- 种子细胞进入384孔PLL涂层板,最终密度为10,000细胞/井,使用电子多通道移液器分配0.22 x 106细胞/mL HTLA悬浮液的45μL。在37°C下孵育板过夜。如果首选同日转染,种子细胞密度为16,000细胞/井,并在4小时后执行转染。
注:对于高转染效率,50-70% 的细胞汇合是最佳选择。
2. 初级筛查:DNA板制备和转染
- 为了准备384孔DNA源板的转染,如图2所示,分配质粒cDNA编码GPCR-Tango构造感兴趣的在96孔板,与不同的GPCR/井。质粒DNA应悬浮在0.1xTris-EDTA(TE)缓冲液中,浓度为50纳克/μL。
注:96孔DNA板可在-20°C密封和储存,并重新用于多个筛选实验。所有cDNA编码GPCR-探戈结构均具有商业性(参见材料表),并在pcDNA3.1新霉素质粒中克隆。PRESTO-Tango GPCR 套件由四个 96 孔板组成,每个板包括 80 个 GPCR、一对带有空矢量作为负控制的孔和保存多巴胺受体 D2 (DRD2) 的正控制孔,以及携带对荧光蛋白 (YFP) 进行编码的质粒编码的正控制孔,以跟踪转染效率。 - 使用多通道移液器,手动将DNA溶液从96孔转移到384孔DNA源板,每384孔增加10μL。为了确保实验的每个条件都用象限进行测定,96 孔 DNA 板(A-D 排或 E-H)的一半将通过将每个 GPCR 分布到两个象限(第一象限 = 复合、第二象限 = 复合)中覆盖整个 384 孔板(参见图 2 作为指南),从而将相同的 GPCR 转染在 384 孔板的 8 孔中( 参见图 2)。
- 按照约旦等人20:0.1x TE缓冲液(1 mM Tris-HCl和0.1mM EDTA)所述,组装磷酸钙沉淀法所需的以下转染试剂;2.5 M CaCl2解决方案;2x 六角缓冲液,pH 7.05 (50 mM HEPES,280 mM NaCl,1.5 mM Na2HPO4)。通过过滤对所有溶液进行消毒,并储存在4°C。转染当天,允许试剂在使用前达到室温。
- 将 2.5 M CaCl2库存溶液稀释 0.1x TE (1:8 稀释) 到最终浓度 0.313 M CaCl2和涡流。将 40 μL 0.313 M CaCl2传输到 384 孔 DNA 源板,并通过上下移液与手持多通道移液器或自动台面 384 通道移液器混合。
- 在384孔DNA源板中加入50μL的2xHepes缓冲液,通过上下移液再次混合,让站立1分钟;每个384孔将有足够的DNA/转染混合物,用于转染9个384孔板,这取决于需要测试的化合物数量。将DNA/转染混合物的10μL从384孔DNA源板转移到种子的HTLA细胞,并在37°C下孵育板过夜。
3. 初级筛查:细胞刺激
- 24小时后,轻轻将384孔板轻拂在水槽上,用纸巾或吸气器头将其贴在水槽上,从而将转染细胞介质浸出。缓慢添加40μL的饥饿介质(DMEM补充1%分解胎儿牛血清(dFBS)和1倍抗生素/抗异质性,小心避免直接接触细胞。
- 浓度为3倍的感兴趣化合物的20 μL(细胞板中药物的最终浓度为1倍)进入交替行(+)刺激,20 μL的车辆缓冲液为20μL,用于无(-)化合物的交替行。在 5% CO2中以 37 °C 返回电池板,孵育至少 16 小时。
4. 初级筛查:发光读数
- 准备Glo试剂,从贝克和博伊斯21:108mM Tris_HCl修改;42 mM 三酯-底座,75 mM NaCl,3 mM MgCl2,5 mM 二磷酸醇(DTT),0.2 mM辅酶A,0.14毫克/毫升D-Luciferin,1.1 mM ATP,0.25% v/v Triton X-100,2 mM氢硫酸钠。
注:试剂的库存解决方案可以提前进行,但D-Luciferin除外,后者总是以粉末形式新鲜添加到Glo试剂中。如果使用黑板,D-Luciferin 的含量可增加至 0.25 毫克/mL。 - 在刺激后16-24小时,轻轻将384孔板轻拂在水槽上,用纸巾贴上,从而将转染细胞介质散下。加入20 μL/孔Glo试剂,在室温下孵育板5~20分钟。使用微板发光计数器读取板材,集成时间为1 s/孔。
5. 初级筛选:数据分析
- 从发光计数器导出已保存的文件作为电子表格;结果将记录在相对发光单位(RLU) 中。根据 384 孔板的布局,使用以下公式计算每个受体的激活(折叠变化):
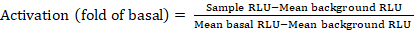
注:此处样本 RLU 指受刺激 (+ 化合物) 象限的四个复制孔中的每个孔的值,均值背景 RLU 是板上负控制值,均基底 RLU 指同一受体未经处理象限的平均值 (- 化合物)。此外,计算4个数据点的标准差以验证结果的质量。建议对折数变化的平均值执行 log2 变换,以纠正任何异端性;log2 基础是帮助识别正命中的实际选择。从经验上设置正击阈值;必须指出,有些受体可以有低至2倍的增加和高达40倍的增加,为其他与全激动剂。 - 根据结果,选择对二次筛查的潜在正极性打击的 GPCR。
6. 二次筛选:细胞播种和转染
- 在100毫米菜肴中亚培养HTLA细胞,总细胞密度为5 x 106细胞,在11 mL的完整介质(4.55 x 105/mL)中,在37°C下孵育24小时。如果首选同日转染,种子细胞密度为7.5 x 106细胞,4小时后执行转染。
- 在室温下预热磷酸钙沉淀所需的试剂。将 450 μL 0.1x TE 缓冲液与 50 μL 的 2.5 M CaCl2结合,快速涡流;这些量是特定为一个100毫米菜,根据它持有的生长介质的体积。
- 在管中,将TE/CaCl2溶液的500μL加入到10μg的GPCR cDNA和涡流中。在管中加入500 μL的2xHepes缓冲液,大力摇动(不要涡流),孵育1分钟。
注:编码荧光蛋白(如YFP、mCherry等)的任何质粒的1μg可与9μgGPCR cDNA共同转染,共10微克。荧光蛋白用于跟踪转染效率,这种最小量不会干扰测定。 - 在短暂孵育之后,立即将1 mL溶液滴到细胞上。轻轻地来回摇动板,均匀地分配沉淀物,注意不要旋转板,并在37°C孵育24小时。
- 第二天,观察荧光蛋白在荧光细胞成像器下的表达,观察转染效率;超过 50% 的转染是理想的。
- 在37°C下孵育培养箱中所需的384孔PLL涂层板,在播种细胞之前加热。将盘子轻拂在水槽上,用纸巾贴上,将其从 384 孔 PLL 涂层板中取出 1 倍抗生素抗异化剂的存储溶液。
- 使用 Versene 溶液(1X PBS,pH 7.4;0.53 mM EDTA)轻轻冲洗转染细胞,然后向盘中添加 3 mL 0.05% 的胰蛋白酶/0.53 mM EDTA。将内容物转移到至少含有相同量的完整DMEM的离心管中和胰蛋白酶。
- 以500 x g的速度旋转细胞3分钟,在饥饿的介质中以0.4 x 106细胞/mL的密度重新悬浮细胞。使用电子多通道移液器分配45μL的细胞悬浮液,将细胞以最终密度为25,000细胞/孔,将细胞放入384孔PLL涂层板中。将板返回到 37 °C 至少 4 小时,使细胞在继续刺激之前正确附着在孔上。
7. 二次筛查:16点(半原数)剂量曲线的药盘制备
- 在 96 孔板中,添加 270 μL 的 1X HBSS 药物缓冲液(1x 汉克的平衡盐溶液 [HBSS],20 mM HEPES pH 7.4,1x 抗生素抗神秘性),不包括板的最后一排 (行 H),如图4所示。
注:对于肽、胶体分子和水溶性较差的化合物,建议添加0.1-1%BSA。为了防止药物氧化,还可以添加高达0.01%的抗坏血酸。 - 从药物库存中,通过计算最终3倍浓度(细胞板中药物的最终浓度为1倍),制备药物溶液(称为"高"浓度)。例如,对于以10μM为最高浓度的剂量-反应曲线,在30μM时制备"高"浓度。在H排的井中,将300 μL的"高"浓度注入井中。
- 在另一管中,制备"低"浓度,表示"高"浓度除以3.16(半原数)。根据前面的示例,"低"浓度为 9.49 μM。在H排,与"高"井相邻的流液300μL"低"浓度进入井中。
注:H排所需的96口总数量将取决于细胞数量和刺激条件。四口井(两口"高"和两口"低")将有足够的药物溶液来刺激整个384孔板。 - 通过将 30 μL 的药物溶液从 H 行的"高"和"低"井移液移位到上一排(前排 G),并通过手动上下移液或按建议使用具有"移液和混合"功能的电子多通道移液器进行混合,从而执行连续稀释。重复此步骤,直到第一行和最稀释的行(行 A),同时丢弃稀释之间的提示。
注:如果需要,串行稀释可以在 A 行之前停止,表示没有药物的内部控制,换句话说,是"真正的零"。 - 以图4为参考,通过从96孔板向先前播种的384孔板的A+O行移液20μL的"低"柱稀释液,以及20μL的"高"柱稀释液,以37°C孵育板,至少16小时,刺激转染细胞。
8. 二次筛选:发光读数和数据分析
- 在刺激后16-24小时,轻轻将384孔板轻拂在水槽上,用纸巾贴上,从而将转染细胞介质散下。加入20 μL/孔Glo试剂,在室温下孵育板5~20分钟。使用微板发光计数器读取板材,集成时间为1 s/孔。
- 从发光计数器导出已保存的文件作为电子表格;结果将记录在相对发光单位(RLU) 中。将 384 孔板的数据传输到统计软件,使用内置 XY 分析分析非线性回归曲线拟合分析结果。选择内置的 3 参数剂量响应刺激函数"日志(激动剂)与响应(三个参数)",

注:此处顶部和底部是 Y 轴单位中的高原,分别为最大响应和基底水平,EC50 是在顶部和底部之间产生 50% 响应的激动剂的浓度,X 表示激动剂的日志浓度。此模型假定剂量响应曲线的标准坡度为 1。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
使用本文介绍的PRESTO-Tango协议,对168个非嗅觉GPCR靶点筛选了一种色胺素颗粒(CG)提取物,其中大多数是孤儿受体。根据Barnea等人18所设计的原则(图1),通过检查所选受体的β-arrestin2动员,对上述提取物进行分析。感兴趣的GPCCr的质粒体cDNA取自PRESTO-Tango GPCR套件,并组装成两个96孔板,在所需的布局。总共,用HTLA细胞种子的四个384孔板被转染,因为96孔DNA板的每半部分被制成一个完整的384孔板,导致每个受体被转染成两个象限(共8个384孔)。两个象限之一用CG提取物刺激;放不同,交替行 C+D、G+H、K+L 和 O+P 表示 (+) 刺激(图 2)。在初级筛查中被询问的168种GPCR中,只有两个受体作为潜在的活性靶点,特别是多巴胺受体D3(DRD3)和奥辛5(OPN5)。DRD3 产生了 4.70 的显著日志 2 倍变化,而 OPN5 的响应略低于 2.39,两者都符合 log2 折变化 >2 的阈值截止。相比之下,主屏幕的正控制是DRD2用该受体的选择性激动剂的五分位刺激,并产生了4.58的log2折变化(图3)。为了重现这些信号窗口并消除误报命中的可能性,使用上述受体进行了辅助屏幕。除了测试CG提取物,鉴于DRD3是非孤儿受体,另一个条件被准备为一个积极的控制,特别是刺激与五位一体,其选择性激动剂之一。另一方面,OPN5是一种孤立受体,因此,不能将参考激动剂与CG提取物一起作为阳性对照进行检测;只有缓冲区被测试为负控件。通过制备10-5 M至10-12.5 M的16点剂量曲线,对这两种GPCR进行进一步的药理鉴定。 具体来说,在10mM处的CG提取物和五苯丙二醇库存溶液被稀释到30μM和9.49μM,96孔药板底部行(H排)的相应"高"和"低"浓度;一旦在40μL的饥饿介质中向转染细胞分配20μL,这些配方将变成10-5M和10-5.5M,每个384口井内共60μL。如前所述,进行连续稀释,使10-12 M和10-12.5 M最稀药的形成位于上一排(A行)(图4)。使用 GraphPad 棱镜从二次筛选中创建剂量响应曲线,以评估配体的效力和功效。与quinpirole相比,CG提取物产生了类似的信号窗口和EC50值,证实了其作为DRD3活动命中的有效性。然而,为OPN5产生了类似于负控制的扁平剂量曲线,排除了它作为CG提取物的可能目标(图5)。

图1:TANGO构造(A)的模块化设计,以及β-逮捕(探戈)招聘测定(B)的一般方案。(A) GPCR 探戈构造按以下顺序由各种模块元素组成:HA 信号/FLAG 标签、GPCR CDS、血管压子受体 2 C 端尾、TEV 蛋白酶裂解位点和 tTA 转录因子。(B) 探戈测定的原理包括在HTLA细胞中暂时转染GPCR探戈质粒,HEK293T细胞稳稳地表达β-arrestin2-TEV蛋白酶融合蛋白和荧光酶报告基因,其表达被tTA激活。GPCR的激活最终将导致将β-逮捕inin2-TEV调动到受体上,使蛋白酶接近其裂解部位。因此,tTA 从 GPCR 尾部中切合,释放转录因子以转定位入核并激活荧光酶表达式。请点击此处查看此图形的较大版本。

图2:96孔cDNA板和384孔细胞板的布局,用于PRESTO-TANGO初级筛查的转染和刺激。GPCR探戈结构描绘了384孔cDNA源板的转染准备,首先从96孔板的一半转移到一个完整的384孔板中,每个受体以八倍转染。在此设置中,对具有 (+) 且没有 (-) 感兴趣的药物的刺激将在每个受体的四肢内发生。请点击此处查看此图形的较大版本。

图 3:PRESTO-Tango 主筛选命中识别的图形表示。作为概念验证,分析了GPCRome上铬马芬颗粒(CG)提取物的生物活性。HTLA细胞在384孔板中转染,具有168个GPCR探戈结构,或者用CG提取物(+化合物)或车辆缓冲器(-化合物)刺激。pcDNA3.1用作负控制,用五氯苯甲酸为刺激的DRD2受体被用作正控制。信号窗口 (A) 和原数2折变化 (B) 在受体激活之间计算在没有或存在 CG 提取物.所有误差条表示 SD(n = 四个测量值)。请点击此处查看此图形的较大版本。

图4:96孔药板准备在二次筛查中刺激的布局。描述96孔药物板的细胞刺激准备,16点剂量曲线范围的序列稀释从H排的10-5 M(最终浓度)开始,每点之间的半记录间隔,直到10-12.5M行A。请点击此处查看此图形的较大版本。

图5:剂量曲线反应化合物特征分析,并在二次筛查中向GPCR招募β-逮捕2。HTLA细胞与受体DRD3 (A) 和 OPN5 (B) 一起瞬时转染。两种转染条件都以半原数增量刺激CG提取物,以及DRD3特定的激动剂奎皮罗尔作为正对照,以及OPN5的车辆缓冲作为负控制。所有误差条表示 SD(n = 三个测量值)。请点击此处查看此图形的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
构象动态 GPCR 是信号转导的强大动力。这些七边螺旋受体结合口袋的物理化学特性及其生理相关性强调了GPCR配体筛选工具的需求。如上所述,PRESTO探戈测定是快速、敏感和方便用户,适合药物开发。这种测定不仅测量了激动剂引起的活化,还可以用来量化拮抗剂和利器调制器19的活性。鉴于功能选择性,一个概念,表明不同的药物结构可以引起不同的受体信号级联在一个单一的受体,比较使用G蛋白依赖性测定的G蛋白通路的激活与使用PRESTO-Tango的β-逮捕招募,可以为设计具有减少负面副作用的铅化合物提供线索。值得注意的是,它独立于检测G蛋白耦合,有助于识别以前由G蛋白依赖性测定检测的孤立GPCR的耦合伙伴。
为了确保 PRESTO-Tango 屏幕的一致性和鲁棒性,在协议的所有步骤中都必须小心谨慎,因为由于该平台的性质,引入的扰动将放大。当然,所有 HTS 屏幕都有一般性措施,应考虑,例如使用相同批次/配方的试剂以确保整个过程中相同的稳定性和生物活性,以及保持 HTS 系统条件一致,如细胞播种密度和药物孵育时间。PRESTO-Tango 的小型化格式需要注意几个关键点:孔之间的细胞播种密度变化及其均匀分布(结块与单细胞悬浮),转染效率低,复合刺激和输送不良,将阻止日常和板对板的重复性。为此,在播种前对HTLA细胞悬浮液进行三分,使溶液均质化,并确保转染前50-70%的细胞流合。应验证化合物的运载工具,其中二甲基亚硫酸二氧化物是最常见的载体。通常,我们的剂量曲线的最高浓度为10μM,但这可能根据化合物的性质和效力而变化;测试各种浓度以推断细胞耐受性和毒性是很重要的。
鉴于某些GPCR具有较高的组织活性,筛查过程中可能出现的一个问题是动态范围减小,背景信号高于预期。通过确保血清饥饿与DMEM介质补充1%dFBS,可以减轻一些缓解。应该考虑到,如果发光输出足够高,则仍有可能渗入相邻的井中,这可能导致错误计算的褶皱变化。无法检测或低信号(假设有反应是预料的)可以通过多种方式解释,即HTLA细胞中GPCR(s)表达不良,化合物的生物活性丧失,导致其无法有效,或相关受体没有内在招募β-逮捕2。分别评估转染质粒体受体DNA的数量和质量,测试其他制剂/大量相关有效化合物,以及执行矫形蛋白-蛋白质相互作用技术,如BRET/FRET或共同免疫沉淀是这一问题的一些建议的解决方案。此外,通过将感兴趣的探戈受体亚克隆到慢病毒载体和转导HTLA细胞,产生HTLA-GPCR稳定细胞系,也可以改善受体表达。在二次筛查期间,激动剂的预期效力发生变化可能意味着刺激反应所需的药物刺激时间和/或浓度不足,或者药物板序列稀释准备不当。使用电子多通道移液器或自动移液器系统,在创建药物串行稀释时不更改提示,可能是使用粘性化合物时的问题。
Barnea等人18世开发的原版探戈测定法与PRESTO-Tango平台之间的显著差异包括采用模块化格式的受体设计,由codon优化序列组成,可改善哺乳动物细胞中的受体表达、验证上述表达的表上标记,以及侧翼GPCRs、V2尾部和TEVc-tTA的限制性位点,使部分和子克隆能够切除。最重要的是,PRESTO-Tango在筛选能力和实验设计方面超过了探戈测定。在8 384孔板中仅完成了约300个GPCR的四肢样品测试,同时考虑负背景控制和正控制,以监测转染效率。虽然PRESTO-Tango只适合对GPCR-ome进行筛选,但也可以对多配体进行检测,尽管成本和资源使用增加,例如与汇集或阵列的小分子化合物库或由各种化学实体混合物组成的生物样本进行。当然,通过对相关化合物库进行化学相似性和多样性分析,减少被询问的化合物数量可以缓解这一问题。虽然 PRESTO-Tango 平台更适用于主要筛选目的,但二次分析可以以较小的比例(中低通量格式)进行,以确认配体刺激的功能后果。然而,与所有其他GPCR测定一样,必须承认,在探戈检测的二次筛查中,孤儿受体没有合适的阳性对照。尽管如此,如果输出数据能够安装到 sigmoidal 剂量响应曲线(具有计算的信号窗口和 EC50 值),则可以识别潜在的正命中。还必须注意,配体活动机制,无论是针对孤儿或非孤儿受体,如果不进行平行检测,就无法阐明。
由于PRESTO-Tango的所有组件已经过优化,包括HTLA细胞系和GPCR探戈结构,除了选择用于药物刺激的复合制剂外,几乎没有修改的空间。如果需要,通过克隆推荐的pIRESbleo3载体(Clonetech)中的GPCR-探戈受体,并使用zeocin选择克隆,可以很容易地产生一个HTLA细胞系,以稳稳地表达受体。关于从 pcDNA3.1 到 pIRESbleo3 的交换,只需使用 NotI 和 XbaI 消化 GPCR 探戈构造,并在限制站点 NotI 和 NheI 插入到目标矢量中。尽管如此,还是有调整和优化这项技术的途径。该技术的支柱之一是HTLA细胞,一种HEK293T细胞系,能稳稳地表达β-卡丁2-TEV融合基因和TTA依赖的荧光酶报告器,由理查德·阿克塞尔实验室慷慨提供。虽然PRESTO-Tango是一个关键的组成部分,但在细胞系起源或它们表达的基因方面,目前没有其他选择。此外,未来的工程细胞系可以产生,以表达其他TEV融合基因,以跟踪其他蛋白质,除了β-逮捕2,特别是那些以前已被证明相互作用或发现在居住与GPCRs,如14-3-322,SAP9723,和β-逮捕1,这是更普遍的非视觉逮捕在脊椎动物24。这可以通过使用仅包含由 ttO7 促进器控制的荧光酶报告器的父 HTL 细胞来实现。PRESTO-Tango 的一个限制是非特定激活报告器启动。基于四环素相关调节系统 (tet 系统),四环素响应元件 (TRE) 控制下游荧光素酶报告器的表达式。然而,先前的研究已经证明,由于内源转录因子25,26,荧光酶的"泄漏"表达。因此,一些化合物可以独立于β-逮捕2招募或GPCR激活来激活记者,从而增加误报的数量。另一个出现的问题,也是其他HTS方法常见的,是"频繁击球手",混杂的化合物,刺激在几个目标27的实质性反应。尽管如此,PRESTO-Tango 的平行筛选设置有助于识别这些文物,可以进一步测试,以确认它们对透明酶活性的影响。总体而言,PRESTO-Tango为研究全球公益物的捕捕工作以及作为一种utile GPCR配体筛选和脱化工具的更大药物发现计划提供了坚实的基础。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
声明没有相互竞争的利益。
Acknowledgments
这项工作得到了加拿大卫生研究所(CIHR赠款#MOP142219)的支持。
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).