Summary
Gitt at GPCRs er attraktive druggable mål, GPCR ligand screening er dermed uunnværlig for identifisering av bly forbindelser og for deorphanization studier. Mot dette arbeidet beskriver vi PRESTO-Tango, en åpen kildekode-ressursplattform som brukes til samtidig profilering av forbigående β-arrestin2-rekruttering på ca. 300 GPCRs ved hjelp av en TEV-basert reporteranalyse.
Abstract
Som den største og mest allsidige gensuperfamilien og meklerne av et spekter av cellulære signalveier, representerer G-protein-koblede reseptorer (GPCRs) et av de mest lovende målene for den farmasøytiske industrien. Ergo, design, implementering og optimalisering av GPCR ligand screening analyser er avgjørende, da de representerer fjernstyringsverktøy for narkotikaoppdagelse og for manipulering av GPCR-farmakologi og resultater. Tidligere har G-proteinavhengige analyser preget dette forskningsområdet, oppdageligoginduserte hendelser og kvantifisere generering av sekundære budbringere. Men siden bruk av funksjonell selektivitet, samt økt bevissthet om flere andre G protein-uavhengige veier og begrensningene forbundet med G-proteinavhengige analyser, er det et større press mot etableringen av alternative GPCR ligand screening analyser. Mot dette arbeidet beskriver vi anvendelsen av en slik ressurs, PRESTO-Tango-plattformen, et luciferase reporterbasert system som muliggjør parallell og samtidig avhør av den menneskelige GPCR-ome, en prestasjon som tidligere ble ansett som teknisk og økonomisk umulig. Basert på en G-protein uavhengig β-arrestin2 rekrutteringsanalyse, universaliteten av β-arrestin2-mediert menneskehandel og signalisering ved GPCRs gjør PRESTO-TANGO til et passende verktøy for å studere ca 300 ikke-olfaktoriske menneskelige GPCRs, inkludert ca. 100 foreldreløse reseptorer. PRESTO-Tangos følsomhet og robusthet gjør den egnet for primære skjermer med høy gjennomstrømning ved hjelp av sammensatte biblioteker, ansatt for å avdekke nye GPCR-mål for kjente stoffer eller å oppdage nye ligander for foreldreløse reseptorer.
Introduction
G-protein-koblede reseptorer (GPCRs) utgjør den største og mest varierte familien av transmembrane proteiner, opererer som kommunikasjonsgrensesnitt mellom en celle og dens miljø1. Allsidigheten til GPCRs fremheves av deres evne til å oppdage et variert utvalg av ligander – fra nevrotransmittere til nukleotider, peptider til fotoner, og mange flere – samt deres evne til å regulere mange nedstrøms signalkaskader involvert i cellulær vekst, migrasjon, differensiering, apoptose, celleavfyring, etc.2,3. Tatt i betraktning deres ubiquity og engasjement i en rekke fysiologiske prosesser, er denne reseptorfamilien av største terapeutisk betydning, vist av det faktum at mer enn en tredjedel av for tiden tilgjengelige foreskrevne medisiner retter seg mot GPCRs4. Imidlertid retter disse eksisterende terapeutiske bare mot en liten undergruppe av superfamilien (anslagsvis 10%), og farmakologien til mange GPCRs forblir uklar. Videre finnes mer enn 100 GPCRs som foreldreløse reseptorer, da de ikke har blitt matchet med en endogen ligand5. Dermed er GPCR ligand screening kritisk i deorphanization og narkotikautvikling, da det baner veien mot blyoppdagelse og optimalisering, og muligens til den kliniske studiefasen.
Metoder for GPCR ligand screening har tradisjonelt falt i en av to kategorier, G-protein avhengige eller G-protein uavhengig funksjonell analyser6. GPCR-signalering reguleres av heterotrimeric G-proteiner (Gαβγ), som aktiveres ved utveksling av GTP for BNP bundet på Gα-underenheten7. Signaler fra den aktiverte reseptoren overføres av G-proteiner via sekundære budbringere, for eksempel cAMP, Calcium, DAG og IP3, for å megle nedstrøms signalering ved nedstrøms effektorer8. Arten av de funksjonelle konsekvensene av G-protein signalering har blitt utnyttet til å lage cellebaserte analyser som gjenspeiler reseptoraktivering. Disse metodene, som måler proksimale (direkte) eller distale (indirekte) hendelser i G-proteinsignalering, brukes oftest til GPCR ligand screening og har hovedsakelig vært ansatt i deorphanization studier6. Eksempler på analyser som direkte måler GPCR-mediert G-proteinaktivering inkluderer [35S]GTPγS bindingsanalyse, som måler binding av en radiomerket og ikke-hydrolyzable GTP analog til Gα-underenheten, og Förster/bioluminescence resonansenergioverføring (HENHOLDSVIS FRET/BRET) for å overvåke GPCR-Gα- og Gα/Gγ-interaksjoner, som har fått mer trekkraft gjennom årene9,10. Analyser som overvåker distale hendelser er de mest brukte verktøyene for GPCR-profilering; for eksempel, cAMP og IP1/3 analyser måle intracellulær akkumulering av G-protein avhengige sekundære budbringere, mens [Ca2 +] flux og reporter analyser som involverer spesifikke responselementer involvert i G-protein aktivering (CRE, NFAT-RE, SRE, SRF-RE) undersøke hendelser videre nedstrøms signalkaskade11. Mens de fleste av de nevnte analyser kan utføres på et høyt gjennomstrømningsnivå, er ganske følsomme, og skryte av visse analysespesifikke fordeler (f.eks. diskriminering mellom full/delvis agonister, nøytrale antagonister og inverse agonister i tilfelle gtpγs binding, eller analysefunksjonalitet på levende celler som [Ca2 +] og IP1/3)6, er det dessverre ingen eksisterende G-proteinavhengige metoder som passer til avhør av hele druggable GPCR-ome. Dette skyldes i stor grad den innfødte koblingen av flere G-protein subfamilies til GPCRs, noe som resulterer i signalering på flere kaskader og ukjent G-protein kobling på foreldreløse GPCRs. For å redusere dette problemet, analyser har blitt utviklet for å tvinge promiskuøse G-protein kobling gjennom en enkelt felles signalavlesning, for eksempel cAMP, og Ca2 +, om enn de fleste av dem er lav-gjennomstrømning12.
Et viktig aspekt ved GPCR-livssyklusen er avslutningen av G-proteinavhengig signalisering, som i stor grad oppstår gjennom rekruttering av β-arrestiner som induserer dissosiasjon av G-proteinet, og til slutt desensimere reseptoren, som er rettet mot klathrinbelagt internalisering13. De mest allestedsnærværende uttrykte isoformene av β-arrestin er de ikke-visuelle β-arrestin1 og β-arrestin2, også betegnet som arrestin-2 og arrestin-3, henholdsvis14. Skriv inn G-protein uavhengige cellebaserte analyser, som legger til en ny dimensjon til GPCR ligand screening; reseptorhandel, etikettfri hele celle, og β-arrestin rekruttering analyser er alle bemerkelsesverdige eksempler. GPCR-smuglingsanalyser bruker fluorofanermerket ligander eller saminternaliserte antistoffer rettet mot reseptoren15, mens etikettfrie hele celleanalyser bruker biosensorer som oversetter cellulære endringer indusert av ligandbinding til kvantifiserbare utganger, for eksempel elektriske eller optiske signaler16. Spesielt, quintessential GPCR- β-arrestin interaksjoner mote β-arrestin rekruttering analyse som et attraktivt verktøy i repertoar av funksjonelle analyser17. Tango-systemet, først utviklet av Barnea et al. for bare et tiår siden, innebærer innføring av tre eksogene genetiske elementer: en proteinfusjon bestående av β-arrestin2 med en tobakketsevirusprotease (TEVp), en tetracyklintransactivator (tTA) som er bundet til en GPCR via et tobakksetse virus protease cleavage site (TEVcs) og innledes med en sekvens fra C-terminus av V2 vasopressin reseptoren (V2 hale) for å fremme arrestin rekruttering, og en reporter luciferase genet hvis transkripsjon utløses av tTA transkripsjonfaktor translokasjon til kjernen, som frigjøres fra membranen forankring etter β-arrestin2 rekruttering (Figur 1)18. Kvantitative avlesninger av GPCR-aktivering og β-arrestin2 rekruttering kan senere bestemmes ved å lese for luminescens. Et bemerkelsesverdig skille er at mens reseptorhandel og etikettfrie hele cellemetoder er relativt lav gjennomstrømning, har Tango flere fordeler, inkludert selektiv avlesning som er spesifikk for målreseptoren og følsomheten på grunn av signalintegrasjon, noe som gjør den til en passende kandidat for ligandscreening i større skala18.
I lys av disse strategiske funksjonene utviklet Kroeze et al. PRESTO-Tango (Parallel Receptor-ome Expression and Screening via Transcriptional Output-Tango), en høygjennomstrømnings plattform med åpen kildekode som bruker Tango-tilnærmingen til å profilere den druggable GPCR-ome på en parallell og samtidig måte19. Ved å utnytte den "promiskuøse" rekrutteringen av β-arrestin2 til nesten alle GPCRs, er PRESTO-Tango den første av sitt slag når det gjelder cellebaserte funksjonelle analyser, noe som muliggjør rask "første runde" screening av små molekylforbindelser ved nesten alle ikke-olfaktoriske GPCRs, inkludert foreldreløse, uavhengig av G-protein subfamily kobling.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Primær screening: cellekultur og plateseeding
- For å forberede poly-L-lysine (PLL)-belagte plater, dispenser 20 μL/brønn på en 25 μg/ml lageroppløsning av PLL i hvite eller svarte 384-brønnoptiske bunnplater ved hjelp av en elektronisk flerkanals pipette eller en reagensdispenser. Inkuber platene ved romtemperatur i 0,5–2 timer.
MERK: Hvis du bruker de svarte 384-brønnplatene, forventer bakgrunnssignalet å være lavere sammenlignet med de hvite platene. Svarte plater anbefales å redusere gjennomfallende luminescens mellom tilstøtende brønner. - For å bevare de belagte platene og vask av overflødig PLL, fjern PLL ved å sveipe den over vasken, trykk tørr over et papirhåndkle og tilsett 40 μL / brønn av fortynnet 1x løsning av antibiotika-antimykotisk ved hjelp av en elektronisk flerkanals pipette eller en reagensdispenser. Oppbevar PLL-belagte plater ved 4 °C til de er klare for platesåing.
- Opprettholde HTLA celler (vennlig levert av Dr. Richard Axel)-en human embryonal nyre celle linje (HEK293T) stabilt uttrykke β-arrestin2-TEV og tTA-drevet luciferase-i komplett Dulbecco modifisert Eagle medium (DMEM) supplert med 5% av Fetal Bovine Serum, 5% av Storfe kalv serum, 2,5 μg/ ml puromycin, 50 μg/ml hygromycin, 100 U/ml penicillin, og 100 μg/ml streptomycin ved 37 °C i en fuktet inkubator som inneholder 5% CO2.
- Kultur HTLA celler i 150 mm retter og passere celler to ganger i uken med en fortynning faktor på 1:10, med optimal celle passasje nummer 5-25. Sørg for at et tilstrekkelig antall 150 mm retter er confluent dagen av 384-brønnplate seeding, avhengig av omfanget av primærskjermen.
MERK: Bruk av HTLA-celler som er større enn passasje 25 kan føre til redusert levedyktighet, noe som gir suboptimale resultater. - For å så HTLA-celler for primærskjermen, skyll forsiktig konfluent 150 mm parabolen (e) med 1x fosfatbufret saltvann (PBS), pH 7.4. Løsne celler med ca 6 ml av 0,05% Trypsin/0,53 mM EDTA, og overføre til et sentrifugerør som inneholder minst like mye komplett Dulbeccos modifiserte Eagle medium (DMEM) for å nøytralisere trypsin.
- Senk ned HTLA-celler ved 500 x g i 3 min og resuspend cellepellet en tetthet på 0,22 x 106 celler/ml i fullstendig DMEM, og utelate tilsetning av 2,5 μg/ml puromycin og 50 μg/ml hygromycin, da de kan redusere transfeksjonseffekten.
- Inkuber de nødvendige 384-brønnen PLL-belagte platene ved 37 °C for å varme dem før seeding celler. Fjern lagringsløsningen til 1x antibiotikaantimykotisk fra 384-brønnen PLL-belagte plater ved å knipse platen over vasken og teipe den over et papirhåndkle for å tørke.
- Frøceller i 384-brønnen PLL-belagte plater med en endelig tetthet på 10 000 celler/brønn ved å dispensere 45 μL av 0,22 x 106 celler/ml HTLA-fjæring ved hjelp av et elektronisk flerkanalsrør. Inkuber plater ved 37 °C over natten. Hvis en samme dag transfection er foretrukket, frøceller med en tetthet på 16.000 celler / godt og utføre transfection 4 timer senere.
MERK: For høy transfection effektivitet, 50-70% celle samløpet er optimal.
2. Primær screening: DNA-plateforberedelse og transfections
- For å forberede 384-brønnen DNA kilde plate for transfection som vist i figur 2, distribuere plasmid cDNAs koding GPCR-Tango konstruerer av interesse i en 96-brønn plate, med en annen GPCR / brønn. Plasmid DNA skal suspenderes i 0,1x Tris-EDTA (TE) buffer med en konsentrasjon på 50 ng/μL.
MERK: De 96-brønns DNA-platene kan forsegles og lagres ved -20 °C, og brukes på nytt for flere screeningeksperimenter. Alle cDNA-koding GPCR-Tango konstruksjoner er tilgjengelig kommersielt (se Table of Materials) og er klonet i pcDNA3.1 neomycin plasmid. PRESTO-Tango GPCR Kit består av fire 96-brønnplater, som inkluderer 80 GPCRs hver, et par brønner med en tom vektor som negative kontroller, og positive kontrollbrønner som holder dopaminreseptoren D2 (DRD2), og brønner som bærer en plasmid som koder et fluorescerende protein (YFP) for å spore transfeksjonseffektivitet. - Ved hjelp av en flerkanals pipette, overføre DNA-oppløsning manuelt fra 96-brønnen til en 384-brønn DNA-kildeplate, og tilsett 10 μL per 384-brønn. For å sikre at hver tilstand av eksperimentet er analyset i quadruplicate, halvparten av 96-brønnen DNA plate (rader A-D eller E-H) vil dekke en full 384-brønn plate ved å distribuere hver GPCR i to kvadranter (første kvadrant = - sammensatt, andre kvadrant = + sammensatt), slik at samme GPCR vil bli transfected i 8 brønner av 384-brønn plate (se figur 2 som en guide).
- Monter følgende transfection reagenser som trengs for kalsiumfosfat nedbør metode, som beskrevet av Jordan et al.20: 0.1x TE buffer (1 mM Tris-HCl og 0,1 mM EDTA); 2,5 M CaCl2 løsning; 2x Hepes buffer, pH 7,05 (50 mM HEPES, 280 mM NaCl, 1,5 mM Na2HPO4). Steriliser alle løsningene ved filtrering og lagre ved 4 °C. Transfection-dagen, la reagensene nå romtemperatur før bruk.
- Fortynn 2,5 M CaCl 2-lageroppløsningen i 0,1 x TE (1:8 fortynning) til en endelig konsentrasjon på 0,313 M CaCl2 og vortex. Overfør 40 μL 0,313 M CaCl2 til 384-brønn DNA-kildeplaten og bland ved å pipe opp og ned med en håndholdt flerkanals pipette eller en automatisert benkeplate 384-kanals pipettor.
- Tilsett 50 μL 2x Hepes buffer til 384-brønnen DNA kildeplate, bland igjen ved pipettering opp og ned og la stå i 1 min; hver 384-brønn vil ha en tilstrekkelig mengde DNA / transfection blanding for transfection av ni 384-brønnplater, avhengig av antall forbindelser som må testes. Overfør 10 μL av DNA/transfection blandingen fra 384-brønnen DNA kildeplate til seeded HTLA celler og inkuber platene over natten ved 37 °C.
3. Primær screening: Cellestimulering
- Tjuefire timer senere, dekantere transinfiserte cellemedier ved å forsiktig flikke 384-brønnplaten over vasken og teipe den over et papirhåndkle, eller med et aspiratorhode. Tilsett langsomt 40 μL sultende medier (DMEM supplert med 1 % dialyzed føtal storfeserum (dFBS) og 1x antibiotika/antimykotisk), vær forsiktig med å unngå å berøre cellene direkte.
- Rør 20 μL av forbindelsen av interesse ved en 3x konsentrasjon (endelig konsentrasjon av stoffet i celleplaten vil være 1x) i vekslende rader med (+) stimulering, og 20 μL av kjøretøybuffer for vekslende rader uten (-) sammensatt. Returner celleplaten ved 37 °C i 5 % CO2 og inkuber i minst 16 timer.
4. Primær screening: Luminescence lesing
- Forbered Glo-reagensen, modifisert fra Baker og Boyce21: 108 mM Tris–HCl; 42 mM Tris-Base, 75 mM NaCl, 3 mM MgCl2, 5 mM Dithiothrei-tol (DTT), 0,2 mM Coenzyme A, 0,14 mg/ml D-Luciferin, 1,1 mM ATP, 0,25% v/v Triton X-100, 2 mM Natriumhydrosulfite.
MERK: Lagerløsninger av reagensene kan gjøres på forhånd, med unntak av D-Luciferin, som alltid er fersktilsatt til Glo-reagensen i pulverform. Hvis svarte plater ble brukt, kan mengden D-Luciferin økes opp til 0,25 mg/ml. - Ved 16–24 timer etter stimulering dekanterer dekanttransinfiserte cellemediet forsiktig ved å sveipe den 384-brønnplaten over vasken og teipe den over et papirhåndkle. Tilsett 20 μL/brønn glo reagens og inkuber platen ved romtemperatur i 5–20 min. Les platene ved hjelp av en mikroplatearmaturteller, med en integrasjonstid på 1 s/brønn.
5. Primær screening: Dataanalyse
- Eksporter de lagrede filene fra luminescence telleren som et regneark; resultatene registreres i relative armaturenheter (RLU). Basert på utformingen av 384-brønnplaten beregner du aktiveringen (foldendring) for hver reseptor ved hjelp av følgende formel:
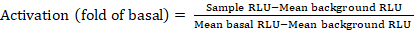
MERK: Her viser Sample RLU til verdien av hver av de fire replikeringbrønnene til den stimulerte (+ forbindelsen), Gjennomsnittlig bakgrunn RLU er gjennomsnittet av de negative kontrollene på platen, og Gjennomsnittlig basal RLU refererer til gjennomsnittet av den ubehandlede kvadranten til den samme reseptoren (- sammensatt). I tillegg beregner du standardavviket for de 4 datapunktene for å verifisere kvaliteten på resultatene. Det anbefales å utføre en log2 transformasjon på gjennomsnittet av foldendringer for å rette opp heteroskedasticity; log2-basen er et praktisk valg for å identifisere positive treff. Empirisk sette positive hit terskler; det må bemerkes at noen reseptorer kan ha så lav som 2-ganger økning og opptil 40 ganger økning for andre med full agonist. - Basert på resultatene velger du GPCR-ene som er potensielle positive treff for sekundær screening.
6. Sekundær screening: Celleseeding og transfections
- Subkultur HTLA celler i 100 mm retter med en total celletetthet på 5 x 106 celler i 11 ml komplette medier (4,55 x 105/ ml) og inkubere ved 37 °C i 24 timer. Hvis en samme dag transfection er foretrukket, frøceller med en tetthet på 7,5 x 106 celler og utføre transfection 4 timer senere.
- Forvarm reagensene som trengs for kalsiumfosfatnedbør ved romtemperatur. Kombiner 450 μL 0,1 x TE buffer med 50 μL på 2,5 M CaCl2 og raskt virvel; disse mengdene er spesifikke for en 100 mm tallerken, basert på volumet av vekstmedium det holder.
- I et rør tilsett 500 μL av TE/CaCl 2-oppløsningen til 10 μg GPCR cDNA og vortex. Tilsett 500 μL 2x Hepes bufferoppløsning i røret, rist kraftig (ikke vortex), og inkuber i 1 min.
MERK: 1 μg av plasmid som koder et fluorescerende protein (f.eks. yfp, mCherry osv.) kan være samtidig transfect med 9 μg GPCR cDNA for totalt 10 μg. Fluorescerende protein brukes til å spore transfection effektivitet, og denne minimale mengden vil ikke forstyrre analysen. - Umiddelbart etter den korte inkubasjonen, dispenser ei 1 ml oppløsning dropwise på cellene. Behek platen frem og tilbake for å fordele utfellingen jevnt, pass på at du ikke virvler platen og ruger ved 37 °C i 24 timer.
- Dagen etter, observere transfection effektivitet ved å se på uttrykket av fluorescerende protein under en fluorescerende celle imager; transfections større enn 50% dekning er ideelle.
- Inkuber de nødvendige 384-brønnenPLL-belagte platen(e) i inkubatoren ved 37 °C for å varme den opp før seeding celler. Fjern lagringsløsningen til 1x antibiotikaantimykotisk fra 384-brønnen PLL-belagte plater ved å knipse platen over vasken og teipe den over et papirhåndkle for å tørke.
- Skyll de transinfiserte cellene forsiktig med Versene-oppløsning (1X PBS, pH 7.4; 0,53 mM EDTA), og løsne ved å tilsette 3 ml 0,05 % trypsin/0,53 mM EDTA til parabolen. Overfør innholdet til et sentrifugerør som inneholder minst like mye fullstendig DMEM for å nøytralisere trypsin.
- Snurr ned cellene på 500 x g i 3 min og resuspendcellene med en tetthet på 0,4 x 106 celler/ml i sultende medier. Frøceller i 384-brønnen PLL-belagt plate(er) med en endelig tetthet på 25 000 celler/brønn ved å dispensere 45 μL av cellesuspensjonen ved hjelp av et elektronisk flerkanalsrør. Returner platene til 37 °C i minst 4 timer, slik at cellene kan festes ordentlig til brønnene før du fortsetter til stimuleringen.
7. Sekundær screening: Forberedelse av legemiddelplate for 16-punkts (halvstokk) dosekurve
- I en 96-brønnplate tilsett 270 μL av 1X HBSS-legemiddelbuffer (1x Hanks balanserte saltoppløsning [HBSS], 20 mM HEPES pH 7.4, 1x antibiotikaantimykotisk), unntatt den siste raden (rad H) på platen, som vist i figur 4.
MERK: For peptider, kolloidale molekyler og dårlig vannløselige forbindelser foreslås tilsetning av 0,1–1 % BSA. For å forhindre legemiddeloksidasjon kan opptil 0,01 % askorbinsyre også tilsettes. - Fra stoffet lager, forberede en narkotikaløsning (referert til som "Høy" konsentrasjon) ved å beregne en endelig 3x konsentrasjon (endelig konsentrasjon av stoffet i celleplaten vil være 1x). For eksempel, for en doseresponskurve med 10 μM som høyeste konsentrasjon, må du forberede konsentrasjonen "Høy" ved 30 μM. Rør 300 μL "Høy" konsentrasjon i brønner i rad H.
- I et annet rør, forberede "Lav" konsentrasjon, som representerer "Høy" konsentrasjon delt på 3,16 (halv-log). Basert på det forrige eksemplet, vil "Lav" konsentrasjonen være 9,49 μM. Rør 300 μL "Lav" konsentrasjon i brønner i rad H, ved siden av "Høye" brønner.
MERK: Det totale antallet 96 brønner som trengs på rad H vil avhenge av antall celler og stimuleringsforhold. Fire brønner (to "High" og to "Low") vil ha rikelig med legemiddelløsning for å stimulere en hel 384 brønnplate. - Utfør en seriell fortynning ved å pipe ut 30 μL med legemiddeloppløsning fra "Høy" og "Lav" brønner av rad H til forrige rad (rad G) og bland ved å manuelt pipetting opp og ned, eller som anbefalt, ved hjelp av en elektronisk flerkanals pipette med "Pipette og mix" funksjon. Gjenta dette trinnet opp til første og mest fortynnede rad (rad A), mens du kaster tips mellom fortynninger.
MERK: Hvis ønskelig, kan de serielle fortynningene stoppes før rad A, som representerer en internkontroll uten stoff, med andre ord, en "sann null". - Ved hjelp av figur 4 som referanse, stimulere transinfiserte celler ved pipettering 20 μL av "Lav" kolonne fortynninger fra 96-brønnplate til rader A-O av den tidligere seedede 384-brønnplate, samt 20 μL av "Høy" kolonne fortynninger til brønner B-P. Inkuber platen på 37 °C i minst 16 timer.
8. Sekundær screening: Lesinescence lesing og dataanalyse
- Ved 16–24 timer etter stimulering dekanterer dekanttransinfiserte cellemediet forsiktig ved å sveipe den 384-brønnplaten over vasken og teipe den over et papirhåndkle. Tilsett 20 μL/brønn glo reagens og inkuber platen ved romtemperatur i 5–20 min. Les platene ved hjelp av en mikroplatearmaturteller, med en integrasjonstid på 1 s/brønn.
- Eksporter de lagrede filene fra luminescence telleren som et regneark; resultatene registreres i relative armaturenheter (RLU). Overfør dataene til 384-brønnplaten til en statistikkprogramvare for å analysere resultatene ved hjelp av sin innebygde XY-analyse for ikke-lineær regresjonskurvetilpasning. Velg den innebygde 3-parameterdoseresponsstimuleringsfunksjonen "Log(agonist) vs. respons (tre parametere)",

MERK: Her topp og bunn er platåer i enhetene i Y-aksen, henholdsvis maksimal respons og basalnivå, EC50 er konsentrasjonen av agonist som genererer 50% respons mellom topp og bunn, og X refererer til loggkonsentrasjonen av agonist. Denne modellen forutsetter at doseresponskurven har en standard Hill-helling på 1.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ved hjelp av PRESTO-Tango-protokollen som presenteres her, ble et kromparagranul (CG) ekstrakt screenet mot 168 ikke-olfaktoriske GPCR-mål, og de fleste var foreldreløse reseptorer. Profilering av nevnte ekstrakt ble utført ved å undersøke β-arrestin2 mobilisering ved de valgte reseptorene, basert på prinsippet designet av Barnea et al.18 (Figur 1). Plasmid cDNA av GPCRs av interesse ble tatt fra PRESTO-Tango GPCR Kit og satt sammen i to 96 brønnplater i ønsket layout. Totalt ble fire 384-brønnplater sådd med HTLA-celler transfected, da hver halvdel av de 96-brønn DNA-platene ble gjort til en full 384-brønnplate, noe som resulterte i at hver reseptor ble transfected i to kvadranter (åtte 384-brønner totalt). En av de to kvadrantene ble stimulert med CG-ekstraktet; enkelt sagt, vekslende rader C–D, G–H, K–L og O–P representerte (+) stimulering (Figur 2). Av de 168 GPCRs som ble avhørt i den primære screening, bare to reseptorer var utfordrere som potensielle aktive mål, spesielt dopamin reseptor D3 (DRD3) og opsin 5 (OPN5). DRD3 produserte en betydelig log2fold endring på 4,70, mens OPN5 produsert en litt lavere respons på 2,39, begge oppfyller terskelen cut-off av log2 fold endring >2. Til sammenligning ble den positive kontrollen for primærskjermen DRD2 stimulert med quinpirole, en selektiv agonist av denne reseptoren, og produserte en log2 ganger endring på 4,58 (Figur 3). For å reprodusere disse signalvinduene og eliminere muligheten for falske positive treff, ble en sekundær skjerm utført med de nevnte reseptorene. Foruten å teste CG-ekstraktet, gitt at DRD3 er en ikke-foreldreløs reseptor, ble en annen tilstand utarbeidet som en positiv kontroll, spesielt stimulering med quinpirole, en av sine selektive agonister. På den annen side er OPN5 en foreldreløs reseptor, og som sådan kan ingen referanseagonist testes sammen med CG-ekstraktet som en positiv kontroll; bare bufferble testet som en negativ kontroll. Ytterligere farmakologisk karakterisering av disse to GPCRs ble utført ved å forberede 16-punkts dosekurver fra 10-5 M til 10-12,5 M. Spesielt ble CG-ekstrakt- og quinpirolelagerløsningene ved 10 mM fortynnet til 30 μM og 9,49 μM, tilsvarende "Høy" og "Lav" konsentrasjoner i nederste rad (rad H) av 96-brønns legemiddelplaten; disse formuleringene vil bli 10-5 M og 10-5,5 M når 20 μL er dispensert på de transinfiserte cellene i 40 μL av sultet medium, for totalt 60 μL innenfor hver 384-brønn. Som tidligere beskrevet, ble seriefortynninger utført slik at de mest fortynnede legemiddelformasjonene for 10-12 M og 10-12,5 M er i øverste rad (rad A) (figur 4). Doseresponskurver fra den sekundære screeningen ble opprettet ved hjelp av GraphPad Prism for å evaluere ligandstyrke og effekt. Sammenlignet med quinpirole produserte CG-ekstraktet lignende signalvinduer og EC50-verdier, som bekrefter gyldigheten som en aktiv hit på DRD3. En flat dosekurve som ligner på den negative kontrollen ble imidlertid produsert for OPN5, og utelukket det som et mulig mål for CG-ekstraktet (figur 5).

Figur 1: Modulær design av TANGO konstruerer (A) og generell ordning for β-arrestin (Tango) rekrutteringsanalyse (B). (A) GPCR Tango-konstruksjonene består av ulike modulelementer i følgende rekkefølge: et HA-signal/FLAGG-merke, GPCR CDS, en Vasopressinreseptor 2 C-terminal hale, TEV protease cleavage-område og en tTA transkripsjonsfaktor. (B) Prinsippet i Tango-analysen innebærer å transiently transfecting GPCR Tango plasmids i HTLA celler, HEK293T celler stabilt uttrykk en β-arrestin2-TEV protease fusjon protein og en luciferase reporter genet hvis uttrykk er aktivert av tTA. Aktivering av GPCR vil til slutt resultere i mobilisering av β-arrestin2-TEV til reseptoren, bringe protease i nærheten av sin cleavage området. Som et resultat, er tTA spaltet fra GPCR halen, frigjør transkripsjonsfaktoren for å omfortre inn i kjernen og aktivere luciferase uttrykk. Vennligst klikk her for å se en større versjon av denne figuren.

Figur 2: Oppsett av 96-brønn cDNA plate og 384-brønn celleplate for transfection og stimulering i PRESTO-TANGO primær screening. Som viser utarbeidelsen av en 384-brønn cDNA kildeplate for transfection, GPCR Tango konstruksjoner overføres først fra den ene halvdelen av en 96-brønnplate til en full 384-brønnplate, med hver reseptor blir transfected i octuplicate. I denne innstillingen vil stimulering av celler med (+) og uten (-) stoffet(e) av interesse forekomme i quadruplicate for hver enkelt reseptor. Vennligst klikk her for å se en større versjon av denne figuren.

Figur 3: Grafiske representasjoner av treffidentifikasjon fra PRESTO-Tango primærscreening. Som et konseptbevis ble den biologiske aktiviteten til et krombeingranul (CG) ekstrakt på GPCRome analysert. HTLA-celler ble transfected i 384 brønnplater med 168 GPCR Tango konstruksjoner, og enten stimulert med CG ekstrakt (+ sammensatt) eller med kjøretøy buffer (- sammensatt). pcDNA3.1 ble brukt som en negativ kontroll, og DRD2 reseptor stimulert med quinpirole ble brukt som en positiv kontroll. Signalvinduene (A) og log2 foldendring (B) i reseptoraktivering ble beregnet mellom brønnene i fravær eller tilstedeværelse av CG ekstrakt. Alle feilfelt representerer SD (n = fire målinger). Vennligst klikk her for å se en større versjon av denne figuren.

Figur 4: Oppsett av 96-brønns legemiddelplateforberedelse for stimulering i sekundær screening. Viser utarbeidelsen av en 96-brønn legemiddelplate for cellestimulering, seriell fortynninger for en 16-punkts dose kurve området starter på 10-5 M (endelig konsentrasjon) i rad H, med halv-logg intervaller mellom hvert punkt til 10-12,5 M i rad A. "Høy" og "Lav" narkotika kolonner brukes til å stimulere vekslende rader av seeded 384-brønn plate. Vennligst klikk her for å se en større versjon av denne figuren.

Figur 5: Dosekurveresponser for sammensatt profilering og demonstrasjon av β-arrestin2 rekruttering til GPCRs i sekundær screening. HTLA-celler ble transienttransert med reseptorer DRD3 (A) og OPN5 (B). Begge transinfiserte forhold ble stimulert med et CG-ekstrakt i trinn på halv pålogging, samt DRD3-spesifikk agonist quinpirole som en positiv kontroll, og kjøretøybuffer for OPN5 som en negativ kontroll. Alle feilfelt representerer SD (n = tre mål). Vennligst klikk her for å se en større versjon av denne figuren.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De konformasjonsdynamiske GPCRs er kraftstasjoner av signaltransduksjon. De fysiokjemiske egenskapene til de bindende lommene til disse heptahelical reseptorene, samt deres fysiologiske relevans understreker behovet for GPCR ligand screening verktøy. Som presentert ovenfor, presto-tango analysen er rask, følsom og brukervennlig, utlån seg til narkotikautvikling. Ikke bare måler denne analysen agonist-indusert aktivering, men den kan også brukes til å kvantifisere aktiviteten til antagonister og allosteric modulatorer19. I lys av funksjonell selektivitet, et konsept som tyder på at ulike narkotikastrukturer kan fremkalle forskjellige reseptorsignaler eskader på en enkelt reseptor, sammenligne aktiveringen av G-protein banen ved hjelp av G-protein avhengige analyser med β-arrestin rekruttering ved hjelp av PRESTO-Tango kan gi signaler for design bly forbindelser med redusert negative bivirkninger. Spesielt, sin uavhengighet fra å oppdage G-protein kobling bidrar til å identifisere koblingspartnere for foreldreløse GPCRs som ikke ville ha blitt tidligere oppdaget av G-protein avhengige analyser.
For å sikre konsistens og robusthet av PRESTO-Tango-skjermer, må det tas hensyn i alle trinn i protokollen, da perturbasjoner introdusert vil bli forstørret på grunn av arten av denne plattformen. Selvfølgelig er det generelle tiltak felles for alle HTS-skjermer som bør tas i betraktning, for eksempel bruk av reagenser av samme mye / formulering for å sikre identisk stabilitet og biologisk aktivitet gjennom, samt holde forholdene på HTS-systemet konsekvent som celleseeding tetthet og narkotikainkubasjonstid. Det miniatyriserte formatet til PRESTO-Tango krever oppmerksomhet til et par kritiske punkter: variasjon i cellesådingstetthet og deres homogene distribusjon (klumping versus encellesuspensjon) mellom brønner, lav transfeksjonseffektivitet og dårlig sammensatt stimulering og levering vil forhindre daglig og plate-til-plate reproduserbarhet. Til denne effekten, triturate HTLA celle suspensjon for å homogenisere løsningen før seeding og sikre en 50-70% celle samløpet før transfection. Kjøretøyet for levering av forbindelsene bør verifiseres, med dimetylsulfoksid som den vanligste transportøren. Vanligvis er den høyeste konsentrasjonen av våre dosekurver 10 μM, men dette kan endres avhengig av arten og styrken til forbindelsen; det er viktig å teste ulike konsentrasjoner for å utlede cellulær toleranse og toksisitet.
Gitt at noen GPCRs har høy konstitutiv aktivitet, er ett problem som kan oppstå under screening et redusert dynamisk område og et bakgrunnssignal som er høyere enn forventet. Dette kan reduseres noe ved å sikre at serumsult utføres med DMEM medium supplert med 1% dFBS. Det bør tas i betraktning at hvis luminescensproduksjonen er høy nok, kan det fortsatt bløs inn i tilstøtende brønner, noe som kan føre til feilaktig beregnede foldeendringer. Undetectable eller lave signaler (forutsatt at et svar forventes) kan forklares på en rekke måter, nemlig dårlig uttrykk for GPCR(er) i HTLA-celler, er den biologiske aktiviteten til forbindelsen tapt, noe som gjør det inefficacious, eller reseptoren (e) i spørsmålet ikke i boende rekruttere β-arrestin2. Henholdsvis å vurdere mengden og kvaliteten på transfected plasmid reseptor DNA, teste andre preparater / mange av den ineffektive forbindelsen i spørsmålet, og utføre ortologprotein-protein interaksjon teknikker som BRET / FRET eller co-immunoprecipitation er noen foreslåtte løsninger på dette problemet. I tillegg kan reseptoruttrykk også forbedres ved å subkloning Tango reseptor (er) av interesse i lentivirale vektorer og transducing HTLA celler, genererer en HTLA-GPCR stabil cellelinje. Et skifte i forventet styrke av en agonist under sekundær screening kan innebære at stoffet stimulering tid og / eller konsentrasjon av sammensatte som trengs for å stimulere en respons er utilstrekkelig, eller at stoffet plate seriell fortynninger var feil forberedt. Bruk av en elektronisk flerkanals pipette eller et automatisert pipettorsystem uten å endre tips i mellom når du oppretter seriell fortynninger kan være et problem når du arbeider med klissete forbindelser.
Bemerkelsesverdige forskjeller mellom den opprinnelige Tango-analysen utviklet av Barnea et al.18 og PRESTO-Tango-plattformen inkluderer utformingen av reseptoren i et modulært format, bestående av codon-optimaliserte sekvenser, som forbedrer reseptoruttrykket i pattedyrceller, epitopkoder for å validere nevnte uttrykk og begrensningssteder som flankerer GPCRs, V2-hale og TEVcs-tTA, noe som gjør det mulig for excision av deler og subkloning. Viktigst av alt, PRESTO-Tango overgår Tango-analysen når det gjelder screeningkraft og eksperimentell design. Quadruplicate prøvetesting av ca 300 GPCRs oppnås i bare 8 384-brønnplater, mens regnskap for negative bakgrunnskontroller og positive kontroller for å overvåke transfection effektivitet. Mens PRESTO-Tango er egnet for screening av GPCR-ome med bare en forbindelse av interesse, kan avhør med flere ligander også utføres, om enn til økt kostnad og bruk av ressurser, for eksempel med samlet eller arrayed små molekylsammensatte biblioteker eller biologiske prøver som består av blandinger av ulike kjemiske enheter. Gitt, Dette problemet kan reduseres ved å redusere antall forbindelser for å avhøre ved å utføre kjemisk likhet og mangfold analyser av sammensatte biblioteker aktuelle. Mens PRESTO-Tango-plattformen er mer anvendelig for primære screeningformål, kan sekundær profilering utføres i mindre skala, i mellomstore eller lavgjennomstrømningsformater, for å bekrefte de funksjonelle konsekvensene av ligandstimulering. Men som med alle andre GPCR-analyser, må det erkjennes at det ikke er noen egnede positive kontroller for foreldreløse reseptorer under sekundær screening med Tango-analysen. Likevel kan potensielle positive treff identifiseres hvis utgangsdataene kan monteres på en sigmoidal doseresponskurve, med et beregnet signalvindu og EC50-verdi. Det er også viktig å merke seg at mekanismen for ligand aktivitet, det være seg for foreldreløse eller ikke-foreldreløse reseptorer, kan ikke belyses uten å kjøre parallelle analyser.
Med alle komponenter av PRESTO-Tango allerede optimalisert, inkludert HTLA celle linje og GPCR Tango konstruksjoner, lite rom for modifisering er nødvendig bortsett fra valg av sammensattformulering (er) som skal brukes til legemiddelstimulering. Hvis ønskelig, en HTLA celle linje stabilt uttrykker en reseptor kan lett genereres ved kloning sa GPCR-Tango reseptor i den anbefalte pIRESbleo3 vektor (Clonetech), og velge kloner ved hjelp av zeocin. Med hensyn til bytte fra pcDNA3.1 til pIRESbleo3, bare fordøye GPCR Tango konstruere med NotI og XbaI og sette inn i destinasjonsvektoren på begrensning nettsteder NotI og NheI. Til tross for det, er det veier for å tilpasse og optimalisere denne teknologien. En av pilarene i denne teknologien er HTLA-celler, en HEK293T cellelinje som tydelig uttrykker et β-arrestin2-TEV fusjonsgen og en tTA-avhengig luciferase reporter, nådig levert fra laboratoriet til Richard Axel. Mens en viktig del av PRESTO-Tango, er det for tiden ingen andre alternativer når det gjelder cellelinjeopprinnelse, eller genene de uttrykker. Videre kan fremtidige konstruerte cellelinjer genereres for å uttrykke andre TEV fusjonsgener for å spore andre proteiner i tillegg til β-arrestin2, spesielt de som tidligere har vist seg å samhandle eller funnet i bolig til GPCRs, for eksempel 14-3-322, SAP9723, og β-arrestin1, som er den mer utbredte isoform av ikke-visuelle arrestasjoner i virveldyr24. Dette kan oppnås ved å bruke de foreldre HTL-cellene som utelukkende inneholdt luciferase-reporteren kontrollert av tetO7-arrangøren. En begrensning til PRESTO-Tango er ikke-spesifikk aktivering av reporterarrangøren. Basert på et tetracyklinavhengig reguleringssystem (tet system), kontrollerer tetracyklinresponsivt element (TRE) uttrykket til den nedstrøms luciferase-reporteren. Tidligere studier har imidlertid vist "lekk" uttrykk for luciferase på grunn av endogene transkripsjonsfaktorer25,26. Som et resultat, noen forbindelser kan aktivere reporteruavhengig av β-arrestin2 rekruttering eller GPCR aktivering, øke antall falske positive. Et annet problem som dukker opp, også felles for andre HTS-metoder, er "hyppige hitters", promiskuøse forbindelser som stimulerer betydelige responser i flere mål27. Likevel forenkler PRESTO-Tangos parallelle screeningoppsett identifisering av disse gjenstandene, som kan testes ytterligere for å bekrefte deres effekt på luciferase-aktiviteten. Til sammen har PRESTO-Tango gitt solide grunnlag for studiet av arrestasjon i rekruttering til GPCRs, og i den større ordningen med narkotikaoppdagelse, som et utile GPCR ligand screening og deorphanization verktøy.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Authours erklærer ingen konkurrerende interesser.
Acknowledgments
Dette arbeidet ble støttet av Canadian Institutes of Health Research (CIHR-tilskudd #MOP142219).
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).