Summary
Med tanke på att GPCRs är attraktiva druggable mål, GPCR ligand screening är därför oumbärlig för identifiering av blyföreningar och för deorphanization studier. Mot dessa insatser beskriver vi PRESTO-Tango, en resursplattform med öppen källkod som används för samtidig profilering av övergående β-arrestin2-rekrytering på cirka 300 GPCRs med hjälp av en TEV-baserad reporteranalys.
Abstract
Som den största och mest mångsidiga gensuperfamiljen och medlare av ett spektrat av cellulära signalvägar, g-protein-kopplade receptorer (GPCRs) representerar en av de mest lovande målen för läkemedelsindustrin. Ergo, design, genomförande och optimering av GPCR ligand screening analyser är avgörande, eftersom de representerar fjärrstyrning verktyg för läkemedelsupptäckt och för att manipulera GPCR farmakologi och resultat. Tidigare, G-protein beroende analyser kännetecknas detta område av forskning, upptäcka ligand-inducerad händelser och kvantifiera generering av sekundära budbärare. Men sedan tillkomsten av funktionell selektivitet, samt en ökad medvetenhet om flera andra G protein-oberoende vägar och begränsningar i samband med G-protein beroende analyser, det finns en större push mot skapandet av alternativa GPCR ligand screening analyser. Mot denna strävan beskriver vi tillämpningen av en sådan resurs, PRESTO-Tango-plattformen, ett luciferase reporterbaserat system som möjliggör parallella och samtidiga förhör av den mänskliga GPCR-ome, en bedrift som tidigare ansågs tekniskt och ekonomiskt omöjligt. Baserat på en G-protein oberoende β-arrestin2 rekrytering analys, universalitet β-arrestin2-medierad människohandel och signalering på GPCRs gör PRESTO-TANGO ett passande verktyg för att studera cirka 300 icke-lukt mänskliga GPCRs, inklusive cirka 100 särläkemedel. PRESTO-Tangos känslighet och robusthet gör den lämplig för primära höggenomströmningsskärmar med hjälp av sammansatta bibliotek, används för att avslöja nya GPCR-mål för kända läkemedel eller för att upptäcka nya ligander för föräldralösa receptorer.
Introduction
G-protein-kopplade receptorer (GPCRs) utgör den största och mest varierande familjen av transmembrane proteiner, fungerar som kommunikationsgränssnitt mellan en cell och dess miljö1. Mångsidigheten hos GPCRs framhävs av deras förmåga att upptäcka ett varierat utbud av ligander-från signalsubstanser till nukleotider, peptider till fotoner, och många fler, samt deras förmåga att reglera många nedströms signalering kaskader inblandade i cellulära tillväxt, migration, differentiering, apoptos, cell bränning, etc.2,3. Med tanke på deras allestädes närvarande och engagemang i en mängd fysiologiska processer, denna receptorfamilj är av yttersta terapeutisk betydelse, framgår av det faktum att mer än en tredjedel av för närvarande tillgängliga föreskrivna läkemedel mål GPCRs4. Dessa befintliga terapier riktar dock endast in sig på en liten delmängd av superfamiljen (uppskattningsvis 10 %), och farmakologiför många GPCRs förblir oklarat. Dessutom finns mer än 100 GPCRs som föräldralösa receptorer, eftersom de inte har matchats med en endogen ligand5. Därför är GPCR ligand screening avgörande i avbarnbildning och läkemedelsutveckling, eftersom det banar väg mot bly upptäckt och optimering, och eventuellt till den kliniska prövningen fasen.
Metoder för GPCR ligand screening har traditionellt fallit i en av två kategorier, G-protein beroende eller G-protein oberoende funktionella analyser6. GPCR-signalering regleras av heterotrimeric G-proteiner (Gαβγ), som aktiveras genom utbyte av GTP för BNP på bundet på Gα-underenheten7. Signaler från den aktiverade receptorn transduceds av G-proteiner via sekundära budbärare, såsom cAMP, kalcium, DAG och IP3, att medla nedströms signalering vid nedströms effektorer8. Arten av de funktionella konsekvenserna av G-protein signalering har utnyttjats för att skapa cellbaserade analyser som återspeglar receptoraktivering. Dessa metoder, som mäter proximala (direkta) eller distala (indirekta) händelser i G-protein signalering, används oftast för GPCR ligand screening och har huvudsakligen använts i deorphanization studier6. Exempel på analyser som direkt mäter GPCR-medierad G-proteinaktivering är [35S]GTPγS bindningsanalys, som mäter bindning av en radiomärkt och icke-hydrolyzable GTP-analog till Gα-underenheten, och Förster/bioluminescensresonansenergiöverföring (FRET/BRET) sonder för att övervaka GPCR-Gα- och Gα/Gγ-interaktioner, som har fått mer dragkraft under åren9,10. Analyser som övervakar distala händelser är de vanligaste verktygen för GPCR-profilering; Till exempel cAMP och IP1/3 analyser mäta intracellulär ackumulering av G-protein beroende sekundära budbärare, medan [Ca2 +] flux och reporter analyser med specifika svarelement inblandade i G-protein aktivering (CRE, NFAT-RE, SRE, SRF-RE) undersöka händelser längre nedströms signalering kaskad11. Medan de flesta av de ovannämnda analyser kan utföras på en hög genomströmningsnivå, är ganska känsliga, och skryta med vissa analysspecifika fördelar (t.ex. diskriminering mellan fullständiga / partiella agonister, neutrala antagonister och omvända agonister när det gäller GTPγS bindning, eller analys funktionalitet på levande celler som [Ca2 +] och IP1 /3)6, det finns tyvärr inga befintliga G-protein beroende metoder som anstår förhör et hela druggable GPCR-ome. Detta beror till stor del på den inhemska kopplingen av flera G-protein underfamiljer till GPCRs, vilket resulterar i signalering vid flera kaskader och den okända G-protein koppling på föräldralösa GPCRs. För att mildra denna fråga, analyser har utvecklats för att tvinga promiskuösa G-protein koppling genom en enda gemensam signalering avläsning, såsom cAMP, och Ca2 +, om än de flesta av dem är låg genomströmning12.
En viktig aspekt av GPCR livscykel är uppsägning av G-protein-beroende signalering, som uppstår till stor del genom rekrytering av β-arrestiner som inducerar dissociation av G-proteinet, och slutligen desensibilisera receptorn, som är avsedd för clathrin-belagda internalisering13. De mest allmänt uttryckta isoformerav β-arrestin är icke-visuella β-arrestin1 och β-arrestin2, också betecknas som arresti-2 och arrestin-3, respektive14. Ange G-protein oberoende cellbaserade analyser, som lägger till en ny dimension till GPCR ligand screening; receptorhandel, etikettfri helcell och β-arresteringi rekrytering analyser är alla anmärkningsvärda exempel. GPCR människohandel analyser anställa fluorfores-märkta ligands eller co-internalized antikroppar riktade mot receptorn15, medan etikett-fri hela cellanalyser använder biosensorer som översätter cellulära förändringar som orsakas av ligand bindning till kvantifierbara utgångar, såsom elektriska eller optiska signaler16. Noterbart är att kvintessensen GPCR- β-arrestin interaktioner mode β-arrestin rekrytering analys som ett attraktivt verktyg i repertoaren av funktionella analyser17. Tango-systemet, som först utvecklades av Barnea et al. för bara ett decennium sedan, innebär införande av tre exogena genetiska element: en proteinfusion bestående av β-arrestin2 med ett växtskydd för tobaksetetetsvirus (TEVp), en tetracyklintransactivator (tTA) som är bunden till en GPCR via ett tobaksetsningsvirus proteas klyvning webbplats (TEVcs) och föregås av en sekvens från C-ändstationen av V2 vasopressin receptorn (V2 svans) för att främja arrestering i rekrytering, och en reporter luciferase gen vars transkription utlöses av tTA transkriptionsfaktor flyttning till kärnan, som befrias från membranet förankring efter β-arrestin2 rekrytering (figur 1)18. Kvantitativa avläsningar av GPCR-aktivering och β-arrestin2-rekrytering kan senare bestämmas genom läsning för luminiscens. En anmärkningsvärd skillnad är att medan receptorhandel och etikettfria hela cellmetoder är relativt låggenomströmning, har Tango flera fördelar, inklusive selektiv avläsning som är specifik för målreceptorn och känslighet på grund av signalintegration, vilket gör det till en lämplig kandidat för ligand screening i större skala18.
Med tanke på dessa strategiska funktioner utvecklade Kroeze et al. PRESTO-Tango (Parallellreceptor-ome Expression and Screening via Transkriptionsproduktion-Tango), en öppen källkodsplattform med hög genomströmning som använder Tango-metoden för att profilera den drogbara GPCR-ome på ett parallellt och samtidigt sätt19. Utnyttja "promiskuösa" rekrytering av β-arrestin2 till nästan alla GPCRs, presto-Tango är den första i sitt slag när det gäller cellbaserade funktionella analyser, vilket möjliggör snabb "första omgången" screening av små molekyler föreningar på nästan alla icke-lukt GPCRs, inklusive föräldralösa barn, oberoende av G-protein underfamilj koppling.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Primär screening: cellkultur och plåtsådning
- För att förbereda poly-L-lysin (PLL)-belagda plattor, fördela 20 μL/brunn av en 25 μg/ml lagerlösning av PLL i vita eller svarta 384-brunns optiska bottenplattor med hjälp av en elektronisk flerkanalig pipett eller en reagensdispenser. Inkubera plattorna i rumstemperatur i 0,5–2 h.
OBS: Om du använder de svarta 384-brunnsplattorna, förvänta dig att bakgrundssignalen är lägre jämfört med de vita plattorna. Svarta plattor rekommenderas för att minska blödninggenom luminiscens mellan intilliggande brunnar. - För att bevara de belagda plattorna och tvätta bort det överskjutande pLL:et, ta bort PLL genom att flimra den över diskbänken, knacka torrt över en pappershandduk och tillsätt 40 μL/brunn av utspädd 1x lösning av antibiotikaantimykotiska med hjälp av en elektronisk flerkanalig pipett eller en reagensdispenserare. Förvara PLL-belagda plattor vid 4 °C tills de är klara för plåtsådd.
- Upprätthålla HTLA-celler (vänligen tillhandahålls av Dr Richard Axel)-en mänsklig embryonal njure cellinje (HEK293T) stabilt uttrycker β-arrestin2-TEV och tTA-driven luciferase-i komplett Dulbecco modifierade Eagle medium (DMEM) kompletteras med 5% av fetala nötkreatur serum, 5 % av bovinkalvserum, 2,5 μg/ml puromycin, 50 μg/ml hygromycin, 100 U/ml penicillin och 100 μg/mL streptomycin vid 37 °C i en fuktad inkubator som innehåller 5 % CO2.
- Kultur HTLA-celler i 150 mm rätter och passerar celler två gånger i veckan med en utspädningsfaktor på 1:10, med optimalt cellpassagenummer 5–25. Se till att ett tillräckligt antal 150 mm rätter är confluent dagen för 384-brunnsplåtssådring, beroende på den primära skärmens skala.
OBS: Användning av HTLA-celler som är större än passage 25 kan leda till minskad lönsamhet, vilket ger suboptimala resultat. - För att så HTLA-celler för primärskärmen, skölj försiktigt konfluentmet 150 mm skålen (er) med 1x fosfat-buffrad koks (PBS), pH 7.4. Lossa celler med cirka 6 ml på 0,05% Trypsin/0,53 m EDTA och överför till ett centrifugrör som innehåller minst lika mycket komplett Dulbeccos modifierade Eagle medium (DMEM) för att neutralisera trypsin.
- Snurra ner HTLA-celler vid 500 x g i 3 min och återsuspendcellkulanten vid en densitet på 0,22 x 106 celler/ml i fullständig DMEM, utan att tillsatsen av 2,5 μg/ml puromycin och 50 μg/ml hygromycin utelämnas eftersom de kan minska transfectioneffekten.
- Inkubera de nödvändiga 384-brunns pll-belagda plattorna vid 37 °C för att värma dem innan de såsceller. Ta bort lagringslösningen av 1x antibiotikaantimykotiska från 384-brunns pll-belagda plattor genom att snärta plattan över diskbänken och tejpa den över en pappershandduk för att torka.
- Fröceller i de 384-brunnspLL-belagda plattorna med en slutlig densitet på 10 000 celler/brunn genom att fördela 45 μL av 0,22 x 106 celler/mL HTLA-suspension med hjälp av en elektronisk flerkanalig rörledning. Inkubera plattorna vid 37 °C över natten. Om en samma dag transfection är att föredra, fröceller med en densitet av 16.000 celler / väl och utföra transfection 4 h senare.
OBS: För hög transfection effektivitet, 50-70% cell sammanflödet är optimal.
2. Primär screening: DNA-skyltberedning och transfections
- För att förbereda 384-brunnS-DNA-källplattan för transfection som visas i figur 2, distribuera plasmid cDNAs kodning GPCR-Tango konstruktioner av intresse i en 96-brunn platta, med en annan GPCR / brunn. Plasmid-DNA:t ska avbrytas i bufferten 0,1 x Tris-EDTA (TE) vid en koncentration på 50 ng/μL.
OBS: DE 96-brunns-DNA-plattorna kan förseglas och förvaras vid -20 °C och återanvändas för flera screeningexperiment. Alla cDNA kodning GPCR-Tango konstruktioner finns kommersiellt (se tabellen över material)och klonas i pcDNA3.1 neomycin plasmid. PRESTO-Tango GPCR Kit består av fyra 96-brunnsplattor, som inkluderar 80 GPCRs vardera, ett par brunnar med en tom vektor som negativa kontroller och positiva kontrollbrunnar som håller dopaminreceptorn D2 (DRD2), och brunnar som bär ett plasmidkodning slysrör (YFP) för att spåra transfectioneffektivitet. - Med hjälp av en flerkanalig pipett, manuellt överföra DNA-lösning från 96-brunn till en 384-brunn DNA-källplatta, lägga till 10 μL per 384-brunn. För att säkerställa att varje villkor för experimentet analyseras i fyrdubbla, hälften av 96-brunnDNA-plattan (rader A-D eller E-H) kommer att täcka en full 384-brunn säteri genom att distribuera varje GPCR i två kvadranter (första kvadrant = - förening, andra kvadrant = + förening), så att samma GPCR kommer att transfectedi 8 brunnar i 384-brunnplattan (se figur 2 som en guide).
- Montera följande transfectionreagenser som behövs för kalciumfosfatutfällningsmetod, enligt beskrivningen av Jordan et al.20: 0.1x TE-buffert (1 mM Tris-HCl och 0,1 m EDTA); 2,5 M CaCl2 lösning; 2x Hepes buffert, pH 7,05 (50 mM HEPES, 280 mM NaCl, 1,5 mM Na2HPO4). Sterilisera alla lösningar genom filtrering och förvara vid 4 °C. Dagen för transfection, låt reagenserna nå rumstemperatur före användning.
- Späd 2,5 M CaCl2-lagerlösningen i 0,1 x TE (1:8 utspädning) till en slutlig koncentration på 0,313 M CaCl2 och virvel. Överför 40 μL på 0,313 M CaCl2 till 384-brunns-DNA-källplattan och blanda genom att pipettera upp och ner med en handhållen flerkanalig pipett eller en automatiserad bänkskiva 384-kanalig pipettor.
- Tillsätt 50 μL 2x Hepes buffert till 384-brunnDNA-källplattan, blanda igen genom att pipetting upp och ner och låt stå i 1 min; varje 384-brunn kommer att ha en tillräcklig mängd DNA/ transfection blandning för införlivandet av nio 384-brunnplattor, beroende på antalet föreningar som behöver testas. Överför 10 μL av DNA/transfectionblandningen från 384-brunns-DNA-källplattan till de seedade HTLA-cellerna och inkubera plattorna över natten vid 37 °C.
3. Primär screening: Cellstimulering
- Tjugofyra timmar senare, dekantera transfected cell media genom att försiktigt snärta 384-brunn plattan över diskbänken och tejpa den över en pappershandduk, eller med en aspirator huvud. Tillsätt långsamt 40 μL svältande medier (DMEM kompletterat med 1% dialyzed fetala nötkreatur serum (dFBS) och 1x antibiotika/antimykotiska), var noga med att undvika att röra cellerna direkt.
- Pipet 20 μL av intresseföreningen vid en 3x koncentration (den slutliga koncentrationen av läkemedlet i cellplattan kommer att vara 1x) i de alternerande raderna med (+) stimulering och 20 μL fordonsbuffert för de alternerande raderna utan (-) förening. Returnera cellplattan vid 37 °C i 5 % CO2 och inkubera i minst 16 timmar.
4. Primär screening: Luminescensläsning
- Förbered Glo reagens, modifierad från Baker och Boyce21:108 mM Tris-HCl; 42 mM Tris-Base, 75 mM NaCl, 3 mM MgCl2, 5 mM Dithiothrei-tol (DTT), 0,2 mM Coenzym A, 0,14 mg/ml D-Luciferin, 1,1 mM ATP, 0,25% mot/v Triton X-100, 2 mNatriumhydrosulfit.
OBS: Lagerlösningar av reagenserna kan göras i förväg, med undantag för D-Luciferin, som alltid nyligen läggs till Glo reagensen i sin pulverform. Om svarta plattor användes kan mängden D-Luciferin ökas upp till 0,25 mg/ml. - Vid 16–24 h efter stimulering, dekantera det transinfekterade cellmediet genom att försiktigt snärta 384-brunnsplattan över diskbänken och tejpa den över en pappershandduk. Tillsätt 20 μL/brunn av Glo-reagens och inkubera plattan vid rumstemperatur i 5–20 min. Läs plattorna med en mikroplateluminescensräknare, med en integrationstid på 1 s/brunn.
5. Primär screening: Dataanalys
- Exportera de sparade filerna från luminiscensräknaren som ett kalkylblad. kommer att registreras i relativa luminiscensenheter (RLU). Baserat på layouten av 384-brunnsplattan, beräkna aktiveringen (vikförändring) av varje receptor med hjälp av följande formel:
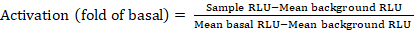
OBS: Här hänvisar exempel RLU till värdet för var och en av de fyra replikatbrunnarna i den stimulerade (+ sammansatta) kvadranten, Medelbakgrundsrlu är medelvärdet av de negativa kontrollerna på plattan, och Medelbasal RLU avser medelvärdet av den obehandlade kvadranten av samma receptor (- förening). Beräkna dessutom standardavvikelsen för de 4 datapunkterna för att kontrollera resultatens kvalitet. Det rekommenderas att utföra en log2 omvandling på medelvärdet av luckan förändringar för att rätta till någon heteroskedasticiteticitet; log2-basen är ett praktiskt val för att identifiera positiva träffar. Empirically sätta positiva träfftrösklar; Det måste noteras att vissa receptorer kan ha så lågt som 2-faldig ökning och upp till 40-faldig ökning för andra med full agonist. - Baserat på resultaten väljer du de GPCR:er som är potentiella positiva träffar för sekundär screening.
6. Sekundär screening: Cellsådd och transfections
- Subkultur HTLA celler i 100 mm rätter vid en total celltäthet på 5 x 106 celler i 11 ml kompletta medier (4,55 x 105/ ml) och inkubera vid 37 °C för 24 h. Om en samma dag transfection är att föredra, fröceller med en densitet på 7,5 x 106 celler och utföra transfection 4 h senare.
- Förvärm reagenser som behövs för kalciumfosfatutfällning vid rumstemperatur. Kombinera 450 μL 0,1 x TE-buffert med 50 μL på 2,5 M CaCl2 och snabbt virvel; Dessa mängder är specifika för en 100 mm maträtt, baserat på volymen av tillväxt medium den rymmer.
- I ett rör, tillsätt 500 μL av TE/CaCl2-lösningen till 10 μg GPCR cDNA och virvel. Tillsätt 500 μL 2x Hepes buffertlösning i röret, skaka kraftigt (inte virvel) och inkubera i 1 min.
OBS: 1 μg av någon plasmidkodning av ett fluorescerande protein (t.ex. Fluorescerande protein används för att spåra transfection effektivitet, och denna minimala mängd kommer inte att störa analysen. - Omedelbart efter den korta inkubationen, dela ut 1 ml-lösningen dropwise på cellerna. Klipp försiktigt plattan fram och tillbaka för att jämnt fördela fällningen, var noga med att inte snurra plattan och inkubera vid 37 °C i 24 timmar.
- Följande dag, observera transfection effektivitet genom att titta på uttrycket av fluorescerande protein under en fluorescerande cell imager; transfections mer än 50% täckning är idealiska.
- Inkubera den nödvändiga 384-brunns pll-belagda plattan(er) i inkubatorn vid 37 °C för att värma den innan såddceller. Ta bort lagringslösningen av 1x antibiotikaantimykotiska från 384-brunns pll-belagda plattor genom att snärta plattan över diskbänken och tejpa den över en pappershandduk för att torka.
- Skölj försiktigt de transinfekterade cellerna med Versene-lösning (1X PBS, pH 7.4; 0,53 mM EDTA) och lossa genom att lägga till 3 ml på 0,05 % trypsin/0,53 m EDTA till skålen. Överför innehållet till ett centrifugrör som innehåller minst lika mycket komplett DMEM för att neutralisera trypsin.
- Snurra ner cellerna vid 500 x g i 3 min och återsuspendera cellerna med en densitet på 0,4 x 106 celler/ml i svältande medier. Fröceller i 384-brunns pll-belagda plattor med en slutlig densitet på 25 000 celler/brunn genom att dela ut 45 μL av cellfjädringen med hjälp av en elektronisk flerkanalig rörledning. Återför plattorna till 37 °C i minst 4 timmar, så att cellerna kan fästas ordentligt på brunnarna innan du fortsätter till stimuleringen.
7. Sekundär screening: Läkemedelsplatta beredning för 16-punkt (halv log) dos-kurva
- I en 96-brunnsplatta, tillsätt 270 μL 1X HBSS-läkemedelsbuffert (1x Hank's Balanced Salt Solution [HBSS], 20 mHEPES pH 7.4, 1x antibiotiska antimykotiska), med undantag för den sista raden (rad H) på plattan, som visas i figur 4.
OBS: För peptider, kolloidala molekyler och dåligt vattenlösliga föreningar föreslås tillsatsen av 0,1–1% BSA. För att förhindra läkemedelsoxidation kan upp till 0,01% askorbinsyra också tillsättas. - Från läkemedelsbeståndet, förbereda en läkemedelslösning (kallad "Hög" koncentration) genom att beräkna en slutlig 3x koncentration (slutlig koncentration av läkemedlet i cellplattan kommer att vara 1x). Till exempel, för en dosresponskurva med 10 μM som högsta koncentration, bered du "Hög" koncentration vid 30 μM. Pipet 300 μL "Hög" koncentration i brunnar i rad H.
- I ett annat rör, förbereda "Låg" koncentration, som representerar den "höga" koncentrationen dividerat med 3,16 (halv-log). Baserat på föregående exempel skulle den "låga" koncentrationen vara 9,49 μM. Pipet 300 μL "Låg" koncentration i brunnar i rad H, intill de "höga" brunnarna.
OBS: Det totala antalet 96-brunnar som behövs i rad H beror på antalet celler och stimuleringsförhållanden. Fyra brunnar (två "High" och två "Låg") kommer att ha gott om läkemedelslösning för att stimulera en hel 384 brunnsplatta. - Utför en seriell utspädning genom att pipetting 30 μL av läkemedelslösning från "High" och "Low" brunnar rad H till föregående rad (rad G) och blanda genom att manuellt pipetting upp och ner, eller som rekommenderas, med hjälp av en elektronisk flerkanalig pipett med "Pipette och Mix" funktion. Upprepa det här steget fram till den första och mest utspädda raden (rad A), samtidigt som du kasserar tips mellan utspädningar.
OBS: Om så önskas kan serieutspädningarna stoppas före rad A, som representerar en intern kontroll utan läkemedel, med andra ord en "sann nolla". - Använd figur 4 som referens, stimulera transinfekterade celler genom att pipettera 20 μL av "Låg" kolonnutspädningar från 96-brunnsplattan till rader A-O av den tidigare seedade 384-brunnsplattan samt 20 μL av "Höga" kolonnutspädningar till brunnarna B–P. Inkubera plattan vid 37 °C i minst 16 timmar.
8. Sekundär screening: Luminescensläsning och dataanalys
- Vid 16–24 h efter stimulering, dekantera det transinfekterade cellmediet genom att försiktigt snärta 384-brunnsplattan över diskbänken och tejpa den över en pappershandduk. Tillsätt 20 μL/brunn av Glo-reagens och inkubera plattan vid rumstemperatur i 5–20 min. Läs plattorna med en mikroplateluminescensräknare, med en integrationstid på 1 s/brunn.
- Exportera de sparade filerna från luminiscensräknaren som ett kalkylblad. kommer att registreras i relativa luminiscensenheter (RLU). Överför data från 384-brunnsplattan till en statistikprogramvara för att analysera resultaten med hjälp av sin inbyggda XY-analys för icke-linjär regressionskurva. Välj den inbyggda doseringsstimuleringsfunktionen med 3 parametrar "Log(agonist) vs. response (tre parametrar)",

OBS: Här Topp och botten är platåer i enheterna i Y-axeln, respektive maximal respons och basalnivå, EC50 är koncentrationen av agonist som genererar 50% svar mellan Top och Bottom, och X hänvisar till loggkoncentrationen av agonist. Denna modell förutsätter att dos-responskurvan har en standard Hill lutning på 1.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Med hjälp av PRESTO-Tango protokollet presenteras häri, en chromaffin granulat (CG) extrakt kontrollerades mot 168 icke-lukt GPCR mål, med majoriteten är föräldralösa receptorer. Profilering av nämnda extrakt utfördes genom att undersöka β-arrestin2 mobilisering vid de valda receptorerna, baserat på den princip som utformats av Barnea et al.18 (figur 1). Plasmid cDNA av GPCRs av intresse togs från PRESTO-Tango GPCR Kit och monteras i två 96 brunnsplattor i önskad layout. Totalt var fyra 384-brunnsplattor seedade med HTLA-celler transinfekterade, eftersom varje halva av 96-brunns-DNA-plattorna gjordes till en full 384-brunnsplatta, vilket resulterade i att varje receptor transsmitterades i två kvadranter (åtta 384-brunnar totalt). En av de två kvadranterna stimulerades med CG extrakt; uttryckt på olika sätt, alternerande rader C-D, G-H, K-L och O-P representerade (+) stimulering (figur 2). Av de 168 GPCRs som förhördes i den primära screeningen var endast två receptorer utmanare som potentiella aktiva mål, särskilt dopaminreceptorn D3 (DRD3) och opsin 5 (OPN5). DRD3 gjorde en betydande stock2fold förändring av 4,70, medan OPN5 gav ett något lägre svar på 2,39, båda uppfyller tröskelsänkningen av log2 gånger förändring >2. I jämförelse var den positiva kontrollen för den primära skärmen DRD2 stimuleras med quinpirole, en selektiv agonist av denna receptor, och producerade en log2 gånger förändring av 4,58(figur 3). För att reproducera dessa signalfönster och eliminera risken för falskt positiva träffar, utfördes en sekundär skärm med ovannämnda receptorer. Förutom att testa CG extraktet, med tanke på att DRD3 är en icke-föräldralös receptor, ett annat tillstånd var beredd som en positiv kontroll, särskilt stimulering med quinpirole, en av dess selektiva agonister. Å andra sidan är OPN5 en föräldralös receptor och som sådan kan ingen referensagonist testas tillsammans med CG-extraktet som en positiv kontroll; endast bufferten testades som en negativ kontroll. Ytterligare farmakologisk karakterisering av dessa två GPCRs utfördes genom att förbereda 16-punkts doskurvor från 10-5 M till 10-12,5 M. Specifikt späddes CG-extraktet och quinpirole-lagerlösningarna på 10 mM ut till 30 μM och 9,49 μM, motsvarande "höga" och "låga" koncentrationer i nedre raden (rad H) i 96-brunnsläkemedelsplattan. Dessa formuleringar kommer att bli 10-5 M och 10-5,5 M när 20 μL doseras på de transinfekterade cellerna i 40 μL svalt medium, för totalt 60 μL inom varje 384-brunn. Som tidigare beskrivits utfördes seriella utspädningar så att de mest utspädda läkemedelsformationerna för 10-12 M och 10-12,5 M är i den översta raden (rad A) (figur 4). Dos-respons kurvor från den sekundära screening skapades med GraphPad Prism att utvärdera ligand potens och effekt. I jämförelse med quinpirole producerade CG-extraktet liknande signalfönster och EC50-värden, vilket bekräftade dess giltighet som en aktiv träff på DRD3. En platt doskurva som liknar den negativa kontrollen producerades dock för OPN5, och uteslöt den som ett möjligt mål för CG-extraktet (figur 5).

Figur 1: Modulär design av TANGO konstruktioner (A) och allmänna system för β-arrestin (Tango) rekrytering analys (B). (A) GPCR Tango konstruktioner består av olika modulelement i följande ordning: en HA signal / FLAG tag, GPCR CDS, en Vasopressin receptor 2 C-terminal svans, TEV proteas klyvning webbplats, och en tTA transkription faktor. (B) Principen om Tango analysen innebär transiently transfecting GPCR Tango plasmids i HTLA celler, HEK293T celler kraftigt uttrycka en β-arrestin2-TEV proteas fusion protein och en luciferase reporter gen vars uttryck aktiveras av tTA. Aktivering av GPCR kommer så småningom att resultera i mobilisering av β-arrestin2-TEV till receptorn, vilket ger proteas i närheten av dess klyvning webbplats. Som ett resultat är tTA klyvrad från GPCR svansen, vilket frigör transkriptionsfaktorn för att flytta till kärnan och aktivera luciferas uttryck. Klicka här för att se en större version av denna siffra.

Figur 2: Layouter av 96-brunncDNA-platta och 384-brunnscellplatta för transfection och stimulering i PRESTO-TANGO primär screening. Visar beredningen av en 384-brunn cDNA-källplatta för transfection, GPCR Tango konstruktioner överförs först från ena halvan av en 96-brunn platta till en full 384-brunn tallrik, med varje receptor som transfected i octuplicate. I denna inställning, stimulering av celler med (+) och utan (-) läkemedlet (er) av intresse kommer att ske i fyrdubbla för varje enskild receptor. Klicka här för att se en större version av denna siffra.

Figur 3: Grafiska representationer av hit identifiering från PRESTO-Tango primära screening. Som ett proof-of-concept analyserades den biologiska aktiviteten hos ett kromaffingranulat (CG) extrakt på GPCRome. HTLA celler var transfected i 384 brunn plattor med 168 GPCR Tango konstruktioner, och antingen stimuleras med CG extrakt (+ förening) eller med fordonetbuffert (- förening). pcDNA3.1 användes som en negativ kontroll, och DRD2-receptorn stimuleras med quinpirole användes som en positiv kontroll. Signalfönstren(A) och stock2-vikningen(B)i receptoraktivering beräknades mellan brunnarna i frånvaro eller förekomst av CG-extrakt. Alla felstaplar representerar SD (n = fyra mått). Klicka här för att se en större version av denna siffra.

Figur 4: Layout av 96-brunn snett preparat av läkemedelsplattan för stimulering vid sekundär screening. Visar beredningen av en 96-brunn snarkotikamissbruk för cellstimulering, seriella utspädningar för en 16-punkts doskurva intervall börjar vid 10-5 M (slutlig koncentration) i rad H, med halv-log intervall mellan varje punkt till10-12,5 M i rad A. "Hög" och "Låg" drog kolumner används för att stimulera alternerande rader av den seedade 384-brunn plattan. Klicka här för att se en större version av denna siffra.

Figur 5: Doskurva svar för sammansatt profilering och demonstration av β-arrestin2 rekrytering till GPCRs i sekundär screening. HTLA-celler var transiently transfected med receptorer DRD3 (A) och OPN5 (B). Båda transinfekterade villkor stimulerades med ett CG extrakt i halv-log steg, liksom DRD3 specifika agonist quinpirole som en positiv kontroll, och fordon buffert för OPN5 som en negativ kontroll. Alla felstaplar representerar SD (n = tre mätningar). Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Konformationally dynamiska GPCRs är kraftpaket av signaltransduktion. De fysiokemiska egenskaperna hos de bindande fickorna på dessa heptaheliska receptorer, liksom deras fysiologiska relevans understryker behovet av GPCR ligand screeningverktyg. Som presenteras ovan, presto-Tango analysen är snabb, känslig och användarvänlig, utlåning sig till läkemedelsutveckling. Inte bara denna analys åtgärd agonist-inducerad aktivering, men det kan också användas för att kvantifiera aktiviteten hos antagonister och allosteric modulatorer19. Mot bakgrund av funktionell selektivitet, ett koncept som tyder på att olika läkemedelsstrukturer kan framkalla olika receptorsignalering kaskader på en enda receptor, jämföra aktiveringen av G-protein vägen med G-protein beroende analyser med β-arresteringi rekrytering med PRESTO-Tango kan ge ledtrådar för utformningen bly föreningar med minskade negativa biverkningar. Noterbart är att dess oberoende från att upptäcka G-proteinkoppling hjälper till att identifiera kopplingspartner för sär-GPCRs som inte tidigare skulle ha upptäckts av G-proteinberoende analyser.
För att säkerställa konsekvens och robusthet av PRESTO-Tango skärmar, måste försiktighet iakttas i alla steg i protokollet, eftersom störningar införs kommer att förstoras på grund av arten av denna plattform. Naturligtvis finns det allmänna åtgärder som är gemensamma för alla HTS-skärmar som bör beaktas, såsom att använda reagenser av samma parti/formulering för att säkerställa identisk stabilitet och biologisk aktivitet i hela, samt att hålla villkoren på HTS-systemet konsekvent, såsom cellsåddtäthet och läkemedelsinkubationstid. Det miniatyriserade formatet av PRESTO-Tango kräver uppmärksamhet på ett par kritiska punkter: variation i cellsådsdensitet och deras homogena fördelning (klumpning kontra encellig suspension) mellan brunnar, låg transfectioneffektivitet och dålig sammansatt stimulering och leverans kommer att förhindra daglig och platta till platta reproducerbarhet. För detta ändamål triturate HTLA cellsuspension en homogenisera lösningen före sådd och säkerställa en 50-70% cell sammanflödet före transfection. Fordonet för leverans av föreningarna bör kontrolleras, med dimetylsulfoxid är den vanligaste transportören. Typiskt, den högsta koncentrationen av våra doskurvor är 10 μM, men detta kan förändras beroende på arten och styrkan i föreningen; det är viktigt att testa olika koncentrationer för att härleda cellulär tolerans och toxicitet.
Med tanke på att vissa GPCRs har hög konstituerande aktivitet, en fråga som kan uppstå under screening är ett minskat dynamiskt omfång och en bakgrundssignal som är högre än väntat. Detta kan mildras något genom att se till att serumsvält utförs med DMEM medium kompletterat med 1% dFBS. Det bör beaktas att om luminescenseffekten är tillräckligt hög, kan det fortfarande finnas blödningar till intilliggande brunnar, vilket kan resultera i felaktigt beräknade vikändringar. Omätbara eller låga signaler (förutsatt att ett svar förväntas) kan förklaras på flera sätt, nämligen dåligt uttryck för GPCR(er) i HTLA-celler, är den biologiska aktiviteten hos föreningen förlorad vilket gör det ineffriskt, eller receptorn (s) i fråga inte i sig rekrytera β-arrestin2. Respektive, bedöma kvantitet och kvalitet transinfekterade plasmidreceptorN DNA, testa andra preparat / massor av den ineffektiva föreningen i fråga, och utföra ortologprotein-protein interaktion tekniker såsom BRET / FRET eller co-immunoprecipitation är några föreslagna lösningar på detta problem. Dessutom kan receptoruttryck också förbättras genom subkloning Tango receptor (er) av intresse i lentivirala vektorer och transducing HTLA celler, generera en HTLA-GPCR stabil cellinje. En förskjutning i den förväntade styrkan hos en agonist under sekundär screening kan innebära att läkemedelsstimuleringstiden och/eller koncentrationen av sammansatta som behövs för att stimulera ett svar är otillräcklig, eller att läkemedelsplattans seriella utspädningar var felaktigt förberedda. Användning av en elektronisk flerkanalig pipett eller ett automatiserat pipettorsystem utan att ändra tips mellan när du skapar drogserieutspädningar kan vara ett problem när man arbetar med klibbiga föreningar.
Anmärkningsvärda skillnader mellan den ursprungliga Tango analys som utvecklats av Barnea et al.18 och PRESTO-Tango plattformen inkluderar utformningen av receptorn i ett modulärt format, bestående av codon-optimerade sekvenser, vilket förbättrar receptoruttryck i däggdjursceller, epitoptaggar för att validera nämnda uttryck, och begränsningsplatser som flankerar GPCRs, V2 svans och TEVcs-tTA, vilket möjliggör excision av delar och subcloning. Viktigast av allt överträffar PRESTO-Tango Tango Tango tango analysen när det gäller screening makt och experimentell design. Fyrdubbla provtestning av cirka 300 GPCR:er sker i endast 8 384 brunnsplattor, samtidigt som de står för negativa bakgrundskontroller och positiva kontroller för att övervaka transfectioneffektiviteten. Medan PRESTO-Tango är lämplig för screening AV GPCR-ome med endast en förening av intresse, förhör med flera ligands kan också utföras, om än till ökad kostnad och användning av resurser, såsom med poolade eller arrayed små molekyler sammansatta bibliotek eller biologiska prover som består av blandningar av olika kemiska enheter. Beviljas, denna fråga kan mildras genom att minska antalet föreningar att förhöra genom att utföra kemisk likhet och mångfald analyser av sammansatta bibliotek i fråga. Medan PRESTO-Tango-plattformen är mer tillämplig för primära screeningändamål, kan sekundär profilering utföras i mindre skala, i medel- eller låggenomströmningsformat, för att bekräfta de funktionella konsekvenserna av ligandstimulering. Men som med alla andra GPCR analyser, Det måste erkännas att det inte finns några lämpliga positiva kontroller för särläkemedel receptorer under sekundär screening med Tango analysen. Icke desto mindre kan potentiella positiva träffar identifieras om utdata kan monteras på en sigmoidal dos-responskurva, med ett beräknat signalfönster och EC50-värde. Det är också viktigt att notera att mekanismen för ligand aktivitet, vare sig det gäller föräldralösa eller icke-föräldralösa receptorer, inte kan klarläggas utan att köra parallella analyser.
Med alla komponenter i PRESTO-Tango redan optimerad, inklusive HTLA cellinje och GPCR Tango konstruktioner, lite utrymme för modifiering krävs bortsett från val av sammansatta formuleringar som ska användas för läkemedelsstimulering. Om så önskas, en HTLA cellinje stabilt uttrycka en receptor kan lätt genereras av kloning sa GPCR-Tango receptor inom den rekommenderade pIRESbleo3 vektor (Clonetech), och välja kloner med zeocin. När det gäller bytet från pcDNA3.1 till pIRESbleo3, helt enkelt smälta GPCR Tango konstruktion med NotI och XbaI och sätt in i destinationen vektor på begränsning platser NotI och NheI. Trots det finns det vägar för att anpassa och optimera denna teknik. En av pelarna i denna teknik är HTLA celler, en HEK293T cellinje stabilt uttrycker en β-arrestin2-TEV fusion gen och en tTA-beroende luciferase reporter, nådigt levereras från labbet av Richard Axel. Medan en viktig del av PRESTO-Tango, det finns för närvarande inga andra alternativ när det gäller celllinje ursprung, eller de gener de uttrycker. Dessutom kan framtida konstruerade cellinjer genereras för att uttrycka andra TEV fusiongener för att spåra andra proteiner förutom β-arrestin2, särskilt de som tidigare har visat sig interagera eller hittas i bostad till GPCRs, såsom 14-3-322, SAP9723, och β-arrestin1, som är den vanligare isoform av icke-visuella arresterar i ryggradsdjur24. Detta kan uppnås genom att använda de föräldraceller som endast innehöll den luciferase-reporter som kontrolleras av tetO7-promotorn. En begränsning till PRESTO-Tango är icke-specifik aktivering av reporterpromotorn. Baserat på ett tetracyklinberoende regleringssystem (tet-system) kontrollerar det tetracyklinresponsiva elementet (TRE) uttryck för den nedströms luciferas reportern. Tidigare studier har dock visat "läckande" uttryck för luciferas på grund av endogena transkriptionsfaktorer25,26. Som ett resultat, vissa föreningar kan aktivera reportern oberoende av β-arrestin2 rekrytering eller GPCR aktivering, öka antalet falska positiva. En annan fråga som framträder, även gemensamt för andra HTS metoder, är "frekventa hitters", promiskuösa föreningar som stimulerar betydande svar i flera mål27. Presto-Tangos parallella screeninguppsättning underlättar dock identifieringen av dessa artefakter, som kan testas ytterligare för att bekräfta deras effekt på luciferas aktivitet. Sammantaget har PRESTO-Tango gett solida grunder för studier av arrestering i rekrytering till GPCRs, och i det större systemet för läkemedelsupptäckt, som en utile GPCR ligand screening och deorphanization verktyg.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Authours na förklarar inga konkurrerande intressen.
Acknowledgments
Detta arbete stöddes av Canadian Institutes of Health Research (CIHR grant #MOP142219).
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).