Summary
GPCR'lerin cazip ilaçlanabilir hedefler olduğu göz önüne alındığında, GPCR ligand taraması böylece kurşun bileşiklerinin belirlenmesi ve yetimleşme çalışmaları için vazgeçilmezdir. Bu çalışmalara yönelik olarak, TEV tabanlı bir muhabir tsay'ı kullanarak yaklaşık 300 KPCR'de geçici β-arrestin2 alımının eşzamanlı olarak profilini çıkarmak için kullanılan açık kaynak kaynak platformu PRESTO-Tango'u tanımlıyoruz.
Abstract
Hücresel sinyal yollarının en büyük ve en çok yönlü gen superfamily ve arabulucuları olarak, G-protein-coupled reseptörleri (GPCR) ilaç endüstrisi için en umut verici hedeflerinden birini temsil eder. Ergo, gpcr ligand tarama testlerinin tasarımı, uygulanması ve optimizasyonu çok önemlidir, çünkü ilaç keşfi ve GPCR farmakolojisi ve sonuçlarını manipüle etmek için uzaktan kumanda araçlarını temsil etmektedirler. Geçmişte, G-protein bağımlı tahliller, ligand kaynaklı olayları tespit ve ikincil habercilerin nesil ölçme, araştırma bu alanda tiplenmiş. Ancak, fonksiyonel seçicilik gelişiyle, yanı sıra diğer birçok G protein-bağımsız yollar ve G-protein bağımlı tahliller ile ilişkili sınırlamalar artan bir farkındalık bu yana, alternatif oluşturulması yönünde daha büyük bir itme var GPCR ligand tarama tahlilleri. Bu çabaya doğru, böyle bir kaynağın uygulanmasını, PRESTO-Tango platformunun, insan GPCR-ome'nin paralel ve eşzamanlı sorgulamasını sağlayan, daha önce düşünülen bir başarıolan, teknik ve ekonomik açıdan mümkün değildir. G-protein bağımsız β-arrestin2 işe alım testini temel alan, GPCR'lerde β-arrestin2 aracılı insan ticaretinin ve sinyalizasyonunun evrenselliği, PRESTO-TANGO'yu yaklaşık 100'ü dahil olmak üzere yaklaşık 300 omalımsız insan KPCR'ı incelemek için uygun bir araç haline getirir. yetim reseptörleri. PRESTO-Tango'nun duyarlılığı ve sağlamlığı, bilinen ilaçlar için yeni GPCR hedeflerini ortaya çıkarmak veya yetim reseptörleri için yeni ligandlar keşfetmek için kullanılan bileşik kütüphaneleri kullanarak birincil yüksek iş yapma ekranları için uygun hale getirir.
Introduction
G-protein-coupled reseptörleri (GpPCR) transmembran proteinlerin en büyük ve en çeşitli aile oluşturmaktadır, bir hücre ve çevresi arasında iletişim arabirimleri olarak faaliyet1. GPCR çok yönlülük ligands çeşitli bir dizi tespit yeteneği ile vurgulanır-nörotransmitterlerden nükleotitler için, peptidler fotonlara, ve daha birçok-yanı sıra çok sayıda aşağı sinyal çağlayanlar hücresel büyüme, göç, farklılaşma, apoptosis, hücre ateş, vb2,3. Fizyolojik süreçlerin çok sayıda onların her yerde ve katılımı göz önüne alındığında, bu reseptör ailesi son derece terapötik öneme sahiptir, şu anda mevcut reçete li ilaçların üçte birinden fazla hedef GPCRs4gerçeği ile vitrine . Ancak, bu mevcut terapötikler sadece süper ailenin küçük bir alt kümesini hedeflemektedir (%10) ve birçok GPCR'nin farmakolojisi henüz aydınlatılmamıştır. Ayrıca, 100'den fazla PcPCR yetim reseptörleri olarak var, onlar endojen ligand5ile eşleşen olmamıştır gibi. Bu nedenle, GPCR ligand taraması deorphanization ve ilaç gelişiminde kritik, kurşun bulma ve optimizasyon yolunda yol açar gibi, ve muhtemelen klinik deneme aşamasına.
GPCR ligand tarama yöntemleri geleneksel olarak g-protein bağımlı veya G-protein bağımsız fonksiyonel tahliller6olmak üzere iki kategoriden birine düşmüştür. GPCR sinyalizasyonu heterotrimerik G proteinleri (Gαβγ) tarafından düzenlenir ve Gα alt birimi7'yebağlı GSYİh için GTP değişimi ile aktive edilir. Aktif reseptörden gelen sinyaller, cAMP, Kalsiyum, DAG ve IP3 gibi ikincil haberciler aracılığıyla G-proteinleri tarafından transeyoluyla downstream efektörleri8'deaşağı sinyalizasyona aracılık eder. G-protein sinyalinin fonksiyonel sonuçlarının doğası, reseptör aktivasyonunu yansıtan hücre bazlı tahliller oluşturmak için kullanılmıştır. G-protein sinyalizasyonunda proksimal (doğrudan) veya distal (dolaylı) olayları ölçen bu yöntemler en sık GPCR ligand taraması nda kullanılırve esas olarak deorphanization çalışmalarında 6. GPCR aracılı G-protein aktivasyonunu doğrudan ölçen tahlil örnekleri arasında [35S]GTPγS bağlayıcı tahlil, gα alt ünitesine radyoetiketli ve hidrolize edilemeyen GTP analogunun ve Förster/biyolüminesans rezonans enerji transferinin (FRET/BRET, sırasıyla) gpcr-Gα ve Gα/Gγ etkileşimlerini izlemek için 9,10yıliçinde daha fazla çekiş elde eden probların bağlanmasını ölçen. Distal olayları izlemek GPCR profilleme için en yaygın olarak kullanılan araçlar olduğunu tahliller; örneğin, cAMP ve IP1/3 tahlilleri G-proteinbağımlı ikincil habercilerin hücre içi birikimini ölçerken, [Ca2+] akı ve G-protein aktivasyonuna karışan spesifik yanıt öğelerini içeren muhabir tahlilleri (CRE, NFAT-RE, SRE, SRF-RE) sinyalleri veren basamak11'indaha aşağısındaki olayları inceler. Söz konusu tahlillerin çoğu yüksek iş seviyesi düzeyinde gerçekleştirilebilse de, oldukça hassas, ve bazı tasmaya özgü avantajları övünme (örneğin, gtpγs bağlama durumunda tam / kısmi agonistler, nötr antagonistler ve ters agonistler arasında ayrımcılık, ya da [Ca2 +] ve IP1/3 gibi canlı hücrelerde gut işlevselliği)6, ne yazık ki tüm ilaç GPCR-ome sorgulama uygun mevcut G-protein bağımlı yöntemler vardır. Bu büyük ölçüde birden fazla G-protein alt ailelerin In GPCR yerli kaplin kaynaklanmaktadır, birkaç basamaklı ve yetim G-protein kaplin de bilinmeyen G-protein kaplin sinyal sonuçlanan. Bu sorunu azaltmak için, tahliller promiscuous G-protein kaplin cAMP gibi tek bir ortak sinyal okuma yoluyla zorlamak için geliştirilmiştir, ve Ca2 +, çoğu düşük iş gücü12olsa .
GPCR yaşam döngüsünün önemli bir yönü G-proteinbağımlı sinyalizasyon sona erdirilmesi, büyük ölçüde G-protein ayrıştırma neden β-arrestins işe yoluyla oluşur, ve sonuçta reseptör duyarsızlaştırma, hangi clathrin kaplı internalization için hedeflenen13. Β-arrestinin en yaygın olarak ifade edilen isoformları görsel olmayan β-arrestin1 ve β-arrestin2'dir, ayrıca sırasıyla arrestin-2 ve arrestin-3 olarak da belirtilir,sırasıyla 14. GPCR ligand taramasına yeni bir boyut katan G-protein bağımsız hücre bazlı tahliller girin; reseptör ticareti, etiketsiz tüm hücre ve β-arrestin işe alım tahlilleri dikkate değer örneklerdir. GPCR kaçakçılık tahlilleri reseptör15hedefleyen florofor etiketli ligands veya ko-internalize antikorlar istihdam ederken, etiketsiz tüm hücre tahlilleri ligand tarafından indüklenen hücresel değişiklikleri çevirmek biyosensörler kullanın ölçülebilir çıkışlar, elektrik veya optik sinyaller gibi16. Özellikle, quintessential GPCR- β-arrestin etkileşimleri, fonksiyonel tahlillerin repertoiresinde çekici bir araç olarak β-arrestin işe alım tahlillerini moda eder17. İlk olarak Barnea ve ark. tarafından sadece on yıl önce geliştirilen Tango sistemi, üç eksojen genetik elementin tanıtılmasını içerir: β-arrestin2'den oluşan bir protein füzyonu tütün etch virüs proteazı (TEVp), bir tetrasiklin transaktivator (tTA) tütün etch ile GPCR'ye bağlanır. virüs proteaz dekolte sitesi (TEVcs) ve V2 vazopressin reseptörünün C-terminus bir dizi öncesinde (V2 kuyruk) işe tutuklama teşvik etmek, ve transkripsiyon tarafından tetiklenen bir muhabir luciferase gen β-arrestin2 işe alımını takiben membran demirlemeden serbest bırakılan çekirdeğe tTA transkripsiyon faktörü translokasyonu (Şekil 1)18. GPCR aktivasyonu ve β-arrestin2 işe kantitatif okumalar daha sonra lüminesans için okuma ile belirlenebilir. Önemli bir ayrım reseptör ticareti ve etiketsiz tüm hücre yöntemleri nispeten düşük iş akışı iken, Tango çeşitli avantajları vardır, hedef reseptör ve sinyal entegrasyonu nedeniyle duyarlılık özgü seçici okuma dahil olmak üzere, hangi daha büyük bir ölçekte ligand tarama için uygun bir aday yapmak18.
Kroeze ve ark. bu stratejik özellikler göz önüne alındığında, PRESTO-Tango (Transkripsiyonel Çıktı-Tango ile Paralel Reseptör-ome İfade ve Tarama), paralel ve eşzamanlı bir şekilde ilaçlanabilir GPCR-ome profili tango yaklaşımını kullanan bir yüksek verim açık kaynak platformu19geliştirdi. Neredeyse tüm GPCR'lere β-arrestin2'nin "promiscuous" işe alımını kullanan PRESTO-Tango, hücre bazlı fonksiyonel tahliller açısından türünün ilk türünün ilk günüdür ve yetimler de dahil olmak üzere, G-protein alt familya bağlantısından bağımsız olarak küçük molekül bileşiklerinin hemen hemen tüm koku dışı KPCR'larda hızlı "ilk tur" taranmasını sağlar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Birincil tarama: hücre kültürü ve plaka tohumlama
- Poli-L-lizin (PLL) kaplamalı plakalar hazırlamak için, elektronik çok kanallı pipet veya reaktif dispenser kullanarak beyaz veya siyah 384 kuyulu optik alt plakalarda 25 μG/mL pll pll stok çözeltisi dağıtın. Plakaları oda sıcaklığında 0,5-2 saat kuluçkaya yatırın.
NOT: Siyah 384-kuyu plakaları kullanıyorsanız, arka plan sinyalinin beyaz plakalara göre daha düşük olmasını bekleyin. Siyah plakalar bitişik kuyular arasında parlaklık kanamasını azaltmak için tavsiye edilir. - Kaplamalı plakaları korumak ve fazla PLL'yi yıkamak için PLL'yi lavabonun üzerine itiştirerek çıkarın, kağıt havlunun üzerine kuru dokunun ve elektronik çok kanallı pipet veya reaktif dağıtıcıkullanarak 40 μL/iyi seyreltilmiş 1x antibiyotik-antimikotik çözelti ekleyin. PLL kaplı tabakları 4 °C'de tabak tohumlama için hazır olana kadar saklayın.
- HTLA hücrelerini (dr. Richard Axel tarafından sağlanmaktadır)–β-arrestin2-TEV ve tTA güdümlü luciferase'i tam olarak ifade eden bir insan embriyonik böbrek hücre hattı (HEK293T) -Dulbecco'nun modifiye kartal ortamının (DMEM) Fetal Sığır Serumunun %5'i ile desteklenmiş, %5'i Büyükbaş Buzağı Serumu, 2,5 μg/mL puromisin, 50 g/mL higromisin, 100 U/mL penisilin ve %5 CO2içeren nemlendirilmiş bir kuluçka makinesinde 37 °C'de 100 μg/mL streptomisin .
- Kültür HTLA hücreleri 150 mm tabaklarda ve 5-25 optimal hücre geçiş sayısı ile, 1:10 bir seyreltme faktörü haftada iki kez hücreleri geçmek. Birincil ekranın ölçeğine bağlı olarak 384 kuyulu tabak tohumlama gününde yeterli sayıda 150 mm'lik tabakların etkili olduğundan emin olun.
NOT: 25 no'dan büyük HTLA hücrelerinin kullanımı canlılığın azalmasına ve optimal olmayan sonuçlara yol açabilir. - Birincil ekran için HTLA hücrelerini tohumlamak için, 150 mm'lik kabı (es) 1x fosfat tamponlu salin (PBS), pH 7.4 ile hafifçe durulayın. Yaklaşık 6 mL trypsin/0,53 mM EDTA olan hücreleri ayırın ve tripsini nötralize etmek için en az eşit miktarda tam Dulbecco modifiye Kartal ortamı (DMEM) içeren bir santrifüj tüpüne aktarın.
- HTLA hücrelerini 500 x g'de 3 dk'da döndürün ve hücre peletini tam DMEM'de 0,22 x 106 hücre/mL yoğunlukta yeniden askıya alın, 2,5 g/mL puromisin ve 50 g/mL higromisin ilavesini atlayın, transfeksiyon etkinliğini azaltabilirler.
- Hücreleri tohumlamadan önce ısıtmak için gerekli 384 kuyulu PLL kaplı plakaları 37 °C'de kuluçkaya yatırın. 384 kuyulu PLL kaplı plaka(lar)dan 1x antibiyotik antimikotik depolama çözeltisini lavabonun üzerine sallama ve kuruması için kağıt havlunun üzerine bantlayarak çıkarın.
- 0,22 x 106 hücre/mL HTLA süspansiyonun 45 μL'sini elektronik çok kanallı pipet kullanarak 45 μL'lik bir şekilde 10.000 hücre/kuyu luk son yoğunlukta 384 kuyulu PLL kaplı plakalara yerleştirin. Bir gecede 37 °C'de kuluçka plakaları. Aynı gün transfeksiyon tercih edilirse, 16.000 hücre/kuyu yoğunluğundaki tohum hücreleri ve transfeksiyon4 saat sonra yapılır.
NOT: Yüksek transfeksiyon verimliliği için hücre birleşimi %50-70 en uygun uymaktadır.
2. Birincil tarama: DNA plakası hazırlama ve transfeksiyonlar
- Şekil 2'degösterildiği gibi 384 kuyulu DNA kaynak plakasını transfeksiyon için hazırlamak için, GPCR-Tango'yu kodlayan plazmid cDNA'larını 96 kuyulu bir plakada farklı bir GPCR/kuyuile dağıtın. Plazmid DNA 50 ng/μL konsantrasyonda 0.1x Tris-EDTA (TE) tamponunda askıya alınmalıdır.
NOT: 96 kuyulu DNA plakaları -20 °C'de mühürlenebilir ve saklanabilir ve birden fazla tarama deneyi için yeniden kullanılabilir. Tüm cDNA kodlama GPCR-Tango yapıları ticari olarak mevcuttur (Malzemeler Tablosubakınız) ve pcDNA3.1 neomisin plazmid klonlanır. PRESTO-Tango GPCR Kiti, her biri 80 GPCR, negatif kontroller olarak boş vektörlü bir çift kuyu ve dopamin reseptörü D2 'yi (DRD2) tutan pozitif kontrol kuyuları ve transfeksiyon verimliliğini izlemek için floresan protein (YFP) kodlayan bir plazmid taşıyan kuyuları içeren dört adet 96 kuyuluk plakadan oluşur. - Çok kanallı bir pipet kullanarak, DNA çözeltisini 96 kuyudan 384 kuyulu DNA kaynak plakasına manuel olarak aktarın ve 384 kuyubaşına 10°L ilave edin. Deneyin her koşulunun dörtlü olarak incelendiğinden emin olmak için, 96 kuyulu DNA plakasının (A-D veya E-H satırları) yarısı, her GPCR'yi iki kadranda (ilk kadranda = - bileşik, ikinci kadranda = + bileşik) dağıtarak tam 384 kuyulu bir plakayı kapsayacaktır, böylece aynı GPCR 384-kuyulu kılavuz (bkz. 2 Şekil) 8 kuyuda çevrilecektir.
- Ürdün ve ark.20:0.1x TE tampon (1 mM Tris-HCl ve 0.1 mM EDTA) tarafından açıklandığı gibi, kalsiyum fosfat yağış yöntemi için gerekli transfeksiyon reaktiflerini bir araya getirin; 2,5 M CaCl2 çözeltisi; 2x Hepes tampon, pH 7.05 (50 mM HEPES, 280 mM NaCl, 1.5 mM Na2HPO4). Tüm çözeltileri filtrasyon ile sterilize edin ve 4 °C'de saklayın. Transfeksiyon günü, reaktifler kullanmadan önce oda sıcaklığına ulaşmak için izin verin.
- 2,5 M CaCl2 stok çözeltisini 0,1x TE (1:8 seyreltme) ile 0,313 M CaCl2 ve girdap son konsantrasyonuna seyreltin. 0,313 M CaCl2'nin 40 μL'sini 384 kuyulu DNA kaynak plakasına aktarın ve elle tutulan çok kanallı pipet veya otomatik tezgah 384 kanallı pipettor ile yukarı ve aşağı borular oluşturarak karıştırın.
- 384 kuyulu DNA kaynak plakasına 50°L 2x Hepes tampon ekleyin, yukarı ve aşağı borular oluşturarak tekrar karıştırın ve 1 dakika bekletin; Her 384-iyi dokuz 384-iyi plakatransfection için DNA / transfection karışımı yeterli miktarda olacak, test edilmesi gereken bileşiklerin sayısına bağlı olarak. 384 kuyudaki DNA kaynak plakasından DNA/transfeksiyon karışımının 10 μL'sini tohumlu HTLA hücrelerine aktarın ve plakaları bir gecede 37 °C'de kuluçkaya yatırın.
3. Birincil tarama: Hücre stimülasyonu
- Yirmi dört saat sonra, 384 kuyulu plakayı yavaşça lavabonun üzerine vurarak veya bir kağıt havlunun üzerine veya aspiratör kafasıyla hafifçe kaydırarak transfected hücre ortamını decantın. Yavaş yavaş 40 μL açlık medya ekleyin (DMEM ile birlikte 1% diyaliz sığır serumu (dFBS) ve 1x antibiyotik / antimikotik), doğrudan hücrelere dokunmaktan kaçınmak için dikkatli olmak.
- Pipet 20 μL 3x konsantrasyonda faiz bileşiğinin (hücre plakasındaki ilacın nihai konsantrasyonu 1x olacaktır) (+) stimülasyonlu alternatif sıralara ve (-) bileşiği olmayan alternatif sıralar için 20 μL araç tamponu. Hücre plakasını %5 CO2'de 37 °C'de döndürün ve en az 16 saat kuluçkaya yatırın.
4. Birincil tarama: Lüminesans okuma
- Baker ve Boyce21'denmodifiye edilmiş Glo reaktifini hazırlayın: 108 mM Tris-HCl; 42 mM Tris-Base, 75 mM NaCl, 3 mM MgCl2, 5 mM Dithiothrei-tol (DTT), 0.2 mM Koenzim A, 0.14 mg/ml D-Luciferin, 1.1 mM ATP, 0.25% v/v Triton X-100, 2 mM Sodyum hidrofit.
NOT: Reaktiflerin stok çözümleri, glo reaktifine toz halinde her zaman taze olarak eklenen D-Luciferin hariç önceden yapılabilir. Siyah plakalar kullanılırsa, D-Luciferin miktarı 0.25 mg/mL'ye kadar arttırılabilir. - 16-24 saat sonra stimülasyon, yavaşça lavabo üzerinde 384-iyi plaka flicking ve bir kağıt havlu üzerine bantlama tarafından transfected hücre medya decant. 20 μL/well Glo reaktif ekleyin ve plakayı oda sıcaklığında 5-20 dakika kuluçkaya yatırın.
5. Birincil tarama: Veri analizi
- Kaydedilen dosyaları lüminesans sayacından elektronik tablo olarak dışa aktarma; sonuçlar bağıl lüminesans birimlerine (RLU) kaydedilir. 384 kuyulu plakanın düzenine bağlı olarak, aşağıdaki formülü kullanarak her reseptörün aktivasyonunu (kat değişimini) hesaplayın:
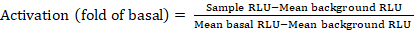
NOT: Burada Örnek RLU uyarılmış (+ bileşik) kadranda dört çoğaltma kuyularının her birinin değerini ifade eder, Ortalama arka plan RLU plaka üzerindeki negatif kontrollerin ortalamasıdır ve Ortalama bazal RLU aynı reseptörün işlenmemiş kadranda ortalamasıanlamına gelir (- bileşik). Ayrıca, sonuçların kalitesini doğrulamak için 4 veri noktasının standart sapmasını hesaplayın. Herhangi bir heteroskedastisite düzeltmek için kıvrım değişiklikleri ortalama bir log2 dönüşüm gerçekleştirmek için tavsiye edilir; log2 tabanı pozitif isabetleri belirlemeye yardımcı olmak için pratik bir seçimdir. Ampirik olarak pozitif isabet eşikleri ayarlayın; bazı reseptörlerin 2 kat artış ve tam agonist olan diğerleri için 40 kata kadar artış kadar düşük olabilir unutulmamalıdır. - Sonuçlara göre, ikincil tarama için potansiyel pozitif isabet olan GPCR'leri seçin.
6. Sekonder tarama: Hücre tohumlama ve transfeksiyonlar
- Alt kültür HTLA hücreleri 100 mm'lik hücrelerde toplam hücre yoğunluğunda 11 mL tam ortam (4,55 x 105/mL) ve 37 °C'de 24 saat boyunca kuluçkaya yatırılatır. Aynı gün transfeksiyon tercih edilirse, 7.5 x 106 hücre yoğunluğundaki tohum hücreleri ve transfeksiyon4 saat sonra gerçekleştirin.
- Oda sıcaklığında kalsiyum fosfat yağışı için gerekli reaktifleri önceden ısıtın. 450 μL 0.1x TE tamponunu 50 μL 2,5 M CaCl2 ile birleştirin ve hızlı bir şekilde girdap; bu miktarlar, sahip olduğu büyüme ortamının hacmine bağlı olarak 100 mm'lik bir çanak için özeldir.
- Bir tüpe, 10 μg GPCR cDNA ve girdap için TE/CaCl2 çözeltisinin 500 μL'sini ekleyin. Tüpe 500°L 2x Hepes tampon çözeltisi ekleyin, şiddetle çalkalayın (girdap yapmayın) ve 1 dakika kuluçkaya yatırın.
NOT: Floresan proteini (örneğin YFP, mCherry, vb.) kodlayan plazmidin 1 μg'ı toplam 10 g için 9 g GPCR cDNA ile eş-transfect olabilir. Floresan protein transfeksiyon verimliliğini izlemek için kullanılır, ve bu minimal miktarda tetkik ile müdahale etmez. - Kısa kuluçkadan hemen sonra, 1 mL çözeltiyi hücrelere damla şeklinde dağıtın. Yavaşça eşit çökelti dağıtmak için plaka ileri geri sallayın, plaka girdap değil dikkat, ve 24 saat için 37 °C'de kuluçka.
- Ertesi gün, floresan hücre görüntüleyici altında floresan protein ekspresyonuna bakarak transfeksiyon verimliliği gözlemlemek; %50'den fazla transfeksiyon idealdir.
- Gerekli 384 kuyulu PLL kaplı plakayı(lar) 37 °C'de kuvözde kuluçkaya yatırArak hücreleri tohumlamadan önce ısıtın. 384 kuyulu PLL kaplı plaka(lar)dan 1x antibiyotik antimikotik depolama çözeltisini lavabonun üzerine sallama ve kuruması için kağıt havlunun üzerine bantlayarak çıkarın.
- Transfected hücreleri Versene çözeltisi (1X PBS, pH 7.4; 0,53 mM EDTA) ile hafifçe durulayın ve 3 mL 0,05 tripsin/0,53 mM EDTA ekleyerek ayırın. Tripsini nötralize etmek için içindekileri en az eşit miktarda tam DMEM içeren bir santrifüj tüpüne aktarın.
- Hücreleri 500 x g'de 3 dk'da döndürün ve aç ortamlarda 0,4 x 106 hücre/mL yoğunlukta hücreleri yeniden askıya alın. 384-iyi PLL kaplı plaka (lar) içine tohum hücreleri 25.000 hücre / iyi son yoğunluğu nda bir elektronik çok kanallı pipet kullanarak hücre süspansiyon 45 μL dağıtarak. Plakaları en az 4 saat boyunca 37 °C'ye geri döndürün ve uyarıma geçmeden önce hücrelerin kuyulara düzgün bir şekilde bağlanmasını bekleyin.
7. Sekonder tarama: 16 noktalı (yarım günlük) doz eğrisi için ilaç plakası hazırlama
- 96-iyi bir plaka, 1XHBSS ilaç tampon (1x Hank's Balanced Salt Solution [HBSS], 20 mM HEPES pH 7.4, 1x antibiyotik-antimikotik) hariç, 270 μL eklemek plaka nın son satır (satır H) hariç, Şekil 4 gösterildiği gibi .
NOT: Peptidler, kolloidal moleküller ve suda çözünen kötü bileşikler için %0.1-1 BSA eklenmesi önerilmektedir. İlaç oksidasyonunu önlemek için %0,01'e kadar askorbik asit de eklenebilir. - Uyuşturucu stokundan, son 3x konsantrasyonu hesaplayarak bir ilaç çözeltisi ("Yüksek" konsantrasyonu olarak anılacaktır) hazırlayın (hücre plakasındaki ilacın son konsantrasyonu 1x olacaktır). Örnek olarak, en yüksek konsantrasyonolarak 10 μM'lik bir doz-yanıt eğrisi için 30 μM'de "Yüksek" konsantrasyonu hazırlayın. Pipet 300 μL "Yüksek" konsantrasyonu H satırındaki kuyulara.
- Başka bir tüpte, 3,16 (yarım günlük) ile bölünmüş "Yüksek" konsantrasyonu temsil eden "Düşük" konsantrasyonu hazırlayın. Önceki örneğe göre ,"Düşük" konsantrasyonu 9,49 μM olacaktır. Pipet 300 μL "Düşük" konsantrasyonu H satırındaki kuyulara, "Yüksek" kuyulara bitişik.
NOT: H satırında ihtiyaç duyulan toplam 96 kuyu sayısı hücre sayısına ve stimülasyon koşullarına bağlıdır. Dört kuyu (iki "Yüksek" ve iki "Düşük") bütün bir 384 iyi plaka uyarmak için yeterli ilaç çözeltisi olacak. - "Yüksek" ve "Düşük" h satırının "Yüksek" ve "Düşük" kuyularından bir önceki satıra (G sırası) kadar 30°L uyuşturucu çözeltisini pipetleyerek seri seyreltme gerçekleştirin ve "Pipet ve Mix" işlevine sahip elektronik çok kanallı bir pipet kullanarak el ile yukarı ve aşağı boru lar kullanarak veya tavsiye edilen şekilde karıştırın. Seyreltmeler arasındaki ipuçlarını atarken, ilk ve en seyreltilmiş satıra (A satırı) kadar bu adımı tekrarlayın.
NOT: İstenirse, seri seyreltmeler a satırından önce durdurulabilir ve ilaç sızbir iç kontrolü, başka bir deyişle "gerçek sıfır"ı temsil edebilir. - Şekil 4'ü referans olarak kullanarak, 96 kuyulu plakadan "Düşük" sütun seyreltmelerinin 20 μL'ini daha önce tohumlanmış 384 kuyuplakanın A-O satırlarına ve "Yüksek" sütun seyreltmelerinin 20 μL'sini B-P kuyularına 37 °C'de en az 16 saat kuluçkaya yatırarak transfected hücreleri uyarın.
8. Sekonder tarama: Lüminesans okuma ve veri analizi
- 16-24 saat sonra stimülasyon, yavaşça lavabo üzerinde 384-iyi plaka flicking ve bir kağıt havlu üzerine bantlama tarafından transfected hücre medya decant. 20 μL/well Glo reaktif ekleyin ve plakayı oda sıcaklığında 5-20 dakika kuluçkaya yatırın.
- Kaydedilen dosyaları lüminesans sayacından elektronik tablo olarak dışa aktarma; sonuçlar bağıl lüminesans birimlerine (RLU) kaydedilir. Doğrusal olmayan regresyon eğrisi sığması için yerleşik XY analizini kullanarak sonuçları analiz etmek için 384 kuyulu plakanın verilerini bir istatistik yazılımına aktarın. Dahili 3-parametre doz-yanıt stimülasyon fonksiyonu "Log(agonist) vs yanıt (üç parametre)" seçin,

NOT: Burada Üst ve Alt y ekseninin birimlerinde platolar, sırasıyla maksimal tepki ve bazal seviye, EC50 Üst ve Alt arasında% 50 yanıt üreten agonist konsantrasyonu ve X agonist günlük konsantrasyonu anlamına gelir. Bu model doz-yanıt eğrisi 1 standart bir Hill eğim olduğunu varsayar.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Burada sunulan PRESTO-Tango protokolü kullanılarak, bir kromofin granül (CG) ekstresi 168 koku vermeyen GPCR hedeflerine karşı tarandı ve çoğunluğu yetim reseptörleri. Barnea ve ark.18 tarafından tasarlanan ilkeye göre seçilen reseptörlerde β-arrestin2 mobilizasyonu incelenerek bu özün profillenmesi gerçekleştirilmiştir (Şekil 1). İlgi çekici GPCR'lerin plazmid cDNA'sı PRESTO-Tango GPCR Kiti'nden alınmış ve istenilen düzende iki adet 96 iyi plaka halinde monte edilmiştir. Toplamda, HTLA hücreleri ile tohumlanmış dört 384 kuyulu plaka, 96 kuyulu DNA plakalarının her yarısı tam 384 kuyulu bir plakaya dönüştürülerek her reseptörün iki kadranda (sekiz 384 kuyu toplam) transfece edilmesiyle sonuçlandı. İki kadrandan biri CG ekstresi ile uyarıldı; farklı koymak, alternatif satırlar C-D, G-H, K–L ve O-P (+) stimülasyon temsil(Şekil 2). Birincil taramada sorgulanan 168 GPCR'den sadece iki reseptör potansiyel aktif hedef olarak rakipti, özellikle dopamin reseptörü D3 (DRD3) ve opsin 5 (OPN5). DRD3 4.70 önemli bir log2kat değişiklik üretti, OPN5 2.39 biraz daha düşük bir yanıt üretti, her ikisi de log2 kat değişim >2 eşik kesme toplantı. Buna karşılık, primer ekranın pozitif kontrolü, bu reseptörün seçici bir agoniti olan quinpirole uyarılmış DRD2 idi ve 4.58'lik log2 kat değişimi üretti(Şekil 3). Bu sinyal pencerelerini çoğaltmak ve yanlış pozitif isabet olasılığını ortadan kaldırmak için, yukarıda belirtilen reseptörler ile ikincil bir ekran yapılmıştır. DRD3 olmayan bir yetim reseptör olduğu göz önüne alındığında, CG ekstresi test yanı sıra, başka bir durum pozitif bir kontrol olarak hazırlandı, quinpirole ile özellikle stimülasyon, onun seçici agonistlerden biri. Öte yandan, OPN5 bir yetim reseptörü ve bu nedenle, hiçbir referans agonist olumlu bir kontrol olarak CG ekstresi yanında test edilebilir; yalnızca arabellek negatif denetim olarak test edildi. Bu iki GPCR'nin daha fazla farmakolojik karakterizasyonu, 10-5 M ile 10-12,5 M arasında değişen 16 noktalı doz eğrileri hazırlanarak gerçekleştirildi, 10 mM'deki CG ekstresi ve quinpirole stok çözeltileri 30 μM ve 9,49 μM'ye seyreltildi, 96 kuyunun alt satırındaki "Yüksek" ve "Düşük" konsantrasyonları (H sırası) ile seyreltildi; bu formülasyonlar, her 384 kuyuiçinde toplam 60 μL olmak üzere, aç orta 40 μL'lik transfected hücrelere dağıtıldıktan sonra 10-5 M ve 10-5,5 M olacaktır. Daha önce de açıklandığı gibi, seri seyreltmeler 10-12 M ve 10-12,5 M için en seyreltik ilaç oluşumları üst satırda (Sıra A)(Şekil 4)olan en seyreltik ilaç oluşumları yapıldı. İkincil taramadan doz-yanıt eğrileri ligand potens ve etkinliğini değerlendirmek için GraphPad Prizma kullanılarak oluşturuldu. Quinpirole ile karşılaştırıldığında, CG ekstresi benzer sinyal pencereleri ve EC50 değerleri üreterek DRD3'te aktif bir vuruş olarak geçerliliğini doğrular. Ancak OPN5 için negatif kontrole benzer düz bir doz eğrisi üretildi ve CG ekstresi için olası bir hedef olarak ele verildi (Şekil 5).

Şekil 1: TANGO yapılarının modüler tasarımı (A) ve β-arrestin (Tango) işe alım testinin (B) genel şeması. (A) GPCR Tango aşağıdaki sırada çeşitli modül elemanları oluşur: bir HA sinyal / FLAG etiketi, GPCR CDS, Bir Vasopressin reseptör 2 C-terminal kuyruk, TEV proteaz dekolte sitesi, ve bir tTA transkripsiyon faktörü. (B) Tango testinin prensibi, HTLA hücrelerinde GPCR Tango plazmidlerinin geçici olarak transfecting içerir, HEK293T hücreleri bir β-arrestin2-TEV proteaz füzyon proteini ve ekspresyonu tTA tarafından aktive edilmiş bir luciferase muhabiri geni ni heceler. GPCR'nin aktivasyonu sonunda β-arrestin2-TEV'in reseptöre seferber edilmesiyle sonuçlanacak ve proteazı dekolte bölgesine yakın bir yerde getirecektir. Sonuç olarak, tTA GPCR kuyruğundan ayrılır, transkripsiyon faktörü nükleus içine translocate ve luciferase ifadesini etkinleştirmek için serbest. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: PRESTO-TANGO primer taramasında transfeksiyon ve stimülasyon için 96 kuyulu cDNA plakası ve 384-kuyu hücre plakasının düzenleri. Transfeksiyon için 384 kuyulu bir cDNA kaynak plakasının hazırlanmasını betimleyen GPCR Tango yapıları ilk olarak 96 kuyulu bir plakanın yarısından tam 384 kuyulu bir plakaya aktarılır ve her reseptör sekizlicate ile geçirilir. Bu ortamda, (+) ve olmadan hücrelerin stimülasyonu (-) ilgi ilaç (lar) her bir reseptör için dört katına meydana gelecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PRESTO-Tango primer taramasından isabet tanımlamasının grafikgösterimleri. Kavram kanıtı olarak, GPCRome üzerinde bir kromatin granül (CG) ekstresinin biyolojik aktivitesi analiz edildi. HTLA hücreleri 168 GPCR Tango yapıları ile 384 iyi plakalar transfected edildi, ve ya CG ekstresi ile uyarılır (+ bileşik) veya araç tampon (- bileşik). pcDNA3.1 negatif kontrol olarak, kinirol ile uyarılan DRD2 reseptörü pozitif kontrol olarak kullanıldı. Sinyal pencereleri (A) ve log2 kat değişimi(B)reseptör aktivasyonunda CG ekstresinin yokluğunda veya varlığında kuyular arasında hesaplanmıştır. Tüm hata çubukları SD'yi temsil eder (n = dört ölçüm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: İkincil taramada stimülasyon için 96 kuyulu ilaç plakası hazırlama düzeni. Hücre stimülasyonu için 96 kuyulu bir ilaç plakasının hazırlanmasını gösteren, 16 noktalı doz eğrisi aralığı için seri seyreltmeler H sırasına göre 10-5 M 'den başlar, her nokta arasında 10-12,5 M satırA kadar yarım günlük aralıklarla Başlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Bileşik profilleme ve ikincil taramada KPCR'lere β-arrestin2 işe alımının gösterilmesi için doz eğrisi yanıtları. HTLA hücreleri drd3 (A) ve OPN5 (B) reseptörleri ile geçici olarak transfeced edildi. Her iki transfected koşulları yarım günlük artışlarla bir CG ekstresi ile uyarılmış, hem de olumlu bir kontrol olarak DRD3 spesifik agonist quinpirole, ve negatif kontrol olarak OPN5 için araç tampon. Tüm hata çubukları SD'yi temsil eder (n = üç ölçüm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Konformasyonel dinamik GPCR sinyal iletiminin güç merkezleridir. Bu heptahelical reseptörlerin bağlayıcı ceplerinin fizyokimyasal özellikleri ve fizyolojik önemi GPCR ligand tarama araçlarına duyulan ihtiyacın altını çizer. Yukarıda sunulduğu gibi, PRESTO-Tango testi hızlı, hassas ve kullanıcı dostudur ve kendini uyuşturucu gelişimine ödünç vetir. Sadece bu taht agonist kaynaklı aktivasyon ölçmek yok, ama aynı zamanda antagonistlerve allosteric modülatörlerin etkinliğini ölçmek için kullanılabilir19. Fonksiyonel seçicilik ışığında, farklı ilaç yapılarının tek bir reseptörde farklı reseptör sinyalleri ortaya çıkarabileceğini öne süren bir kavram, G-protein bağımlı tahlilleri kullanarak G-protein yolunun aktivasyonunu PRESTO-Tango kullanarak β-arrestin işe alımı ile karşılaştırarak azaltılmış negatif yan etkilere sahip kurşun bileşiklerinin tasarlanması için ipuçları sağlayabilir. Özellikle, G-protein kaplin tespit bağımsızlığı daha önce G-protein bağımlı tahliller tarafından tespit edilmiş olmazdı yetim GPCRs için kaplin ortakları belirlemenize yardımcı olur.
PRESTO-Tango ekranlarının tutarlılığını ve sağlamlığını sağlamak için protokolün tüm adımlarında dikkatli olunmalıdır, çünkü bu platformun yapısı gereği ortaya konan tedirginlikler büyütülecektir. Tabii ki, tüm HTS ekranları için ortak olan ve aynı lot/formülasyondaki reaktiflerin kullanılması, aynı stabilite ve biyolojik aktivitenin sağlanması gibi genel önlemler inyanık üzere, hts sistemindeki koşulları hücre tohumlama yoğunluğu ve ilaç kuluçka süresi gibi tutarlı tutmak gibi genel önlemler de vardır. PRESTO-Tango'nun minyatürleştirilmiş biçimi birkaç kritik noktaya dikkat gerektirir: hücre tohumlama yoğunluğundaki değişim ve bunların kuyular arasındaki homojen dağılımı (tek hücreli süspansiyona karşı kümelenme), düşük transfasyon verimliliği ve kötü bileşik stimülasyon ve teslimat günlük ve plakadan tabağa tekrarlanabilirliği önleyecektir. Bu nedenle, çözeltiyi tohumlamadan önce homojenize etmek ve transfeksiyondan önce %50-70 hücre birleşimini sağlamak için HTLA hücre süspansiyonuna triturate olun. Bileşiklerin teslimi için araç doğrulanmalıdır, dimetil sülfoksit en yaygın taşıyıcı olmak. Tipik olarak, bizim doz eğrileri en yüksek konsantrasyonu 10 μM, ancak bu bileşik doğası ve gücüne bağlı olarak değişebilir; hücresel tolerans ve toksisite çıkarmak için çeşitli konsantrasyonlarda test etmek önemlidir.
Bazı GPCR yüksek kurucu aktiviteye sahip olduğu göz önüne alındığında, tarama sırasında ortaya çıkabilecek bir sorun azaltılmış bir dinamik aralık ve beklenenden daha yüksek bir arka plan sinyali. Serum açlığı %1 dFBS ile desteklenen DMEM ortamı ile gerçekleştirilmesini sağlayarak bu durum biraz hafifletilebilir. Lüminesans çıkışı yeterince yüksekse, yine de bitişik kuyulara kanama olabileceği göz önünde bulundurulmalıdır, bu da hatalı bir şekilde hesaplanan kat değişikliklerine neden olabilir. Saptanamayan veya düşük sinyaller (bir yanıt bekleniyor varsayarak) çeşitli şekillerde açıklanabilir, yani GPCR(ler) HTLA hücrelerinde kötü ifade, bileşik biyolojik aktivitesi verimsiz hale kaybolur, ya da söz konusu reseptör (ler) özünde β-arrestinişe yok2. Sırasıyla transfected plazmid reseptör DNA'sının miktarı ve kalitesinin değerlendirilmesi, söz konusu verimsiz bileşiğin diğer preparatlarının/çok sayıdanın test edilmesi ve BRET/FRET veya co-immünoprepite gibi ortolog protein-protein etkileşim tekniklerinin gerçekleştirilmesi bu soruna önerilen bazı çözümlerdir. Buna ek olarak, reseptör ekspresyonu da lentiviral vektörler içine ilgi Tango reseptör (ler) subcloning ve HTLA hücreleri transducing, bir HTLA-GPCR kararlı hücre hattı oluşturarak geliştirilebilir. İkincil tarama sırasında bir agonistin beklenen potensindeki bir değişiklik, bir yanıtı uyarmak için gereken bileşik zaman ve/veya konsantrasyonun un yetersiz olduğu veya ilaç plakaseri seyreltmelerinin yanlış şekilde hazırlandığı anlamına gelebilir. Uyuşturucu seri seyreltmeoluştururken arasında ipuçlarını değiştirmeden elektronik çok kanallı pipet veya otomatik pipettor sistemi kullanımı yapışkan bileşiklerle çalışırken sorun olabilir.
Barnea ve ark.18 tarafından geliştirilen orijinal Tango tsay ve PRESTO-Tango platformu arasındaki önemli farklar modüler bir biçimde reseptör tasarımı içerir, kodon-optimize dizileri oluşan, hangi memeli hücrelerinde reseptör ekspresyonu geliştirir, söz konusu ifade doğrulamak için epitop etiketleri, ve kısıtlama siteleri hangi kLANGR, V2 kuyruk ve TEVcs-tTA, parçaların eksizyon ve subclon sağlayan. En önemlisi, PRESTO-Tango tarama gücü ve deneysel tasarım açısından Tango teşlyonunu aşar. Transfeksiyon verimliliğini izlemek için negatif arka plan kontrolleri ve pozitif kontroller hesaba katarken, sadece 8 384 kuyuluk plakada yaklaşık 300 GPCR'lik dörtlü numune testi gerçekleştirilir. PRESTO-Tango, GPCR-ome'nin tek bir ilgi bileşimi ile taranması için uygun olmakla birlikte, havuzlu veya dizili küçük molekül bileşik kütüphaneleri veya çeşitli kimyasal varlıkların karışımlarından oluşan biyolojik numuneler gibi kaynakların daha yüksek maliyetle ve kullanımında da olsa, birden fazla ligand la sorgulama da yapılabilir. Bu sorun, söz konusu bileşik kütüphanelerin kimyasal benzerlik ve çeşitlilik analizleri yaparak sorgulanacak bileşik sayısını azaltarak azaltılabilir. PRESTO-Tango platformu birincil tarama amaçları için daha uygulanabilir ken, ikincil profilleme ligand stimülasyonun fonksiyonel sonuçlarını doğrulamak için daha küçük ölçekte, orta veya düşük işlem biçimlerinde yapılabilir. Ancak, diğer tüm GPCR tahlillerinde olduğu gibi, Tango testi ile ikincil tarama sırasında yetim reseptörleri için uygun pozitif kontroller olmadığı kabul edilmelidir. Bununla birlikte, çıktı verileri bir sigmoidal doz-yanıt eğrisi, bir bilgisayarlı sinyal penceresi ve EC50 değeri ile monte edilebilir eğer potansiyel pozitif isabet tespit edilebilir. Ayrıca, yetim veya yetim olmayan reseptörler için ligand aktivite mekanizmasının paralel tahliller çalıştırmadan aydınlatılamayacağını da belirtmek önemlidir.
PRESTO-Tango'nun HTLA hücre hattı ve GPCR Tango yapıları da dahil olmak üzere tüm bileşenleri optimize edilmiş olduğundan, ilaç stimülasyonu için kullanılacak bileşik formülasyon(lar) seçimi dışında modifikasyon için çok az yer gereklidir. İstenirse, bir reseptörü ifade eden bir HTLA hücre hattı, önerilen pIRESbleo3 vektörü (Clonetech) içinde GPCR-Tango reseptörü klonlanması ve zeocin kullanılarak klonlar seçilmesi ile kolayca oluşturulabilir. pcDNA3.1'den pIRESbleo3'e takas ile ilgili olarak, NotI ve XbaI ile GPCR Tango yapısını sindirin ve noti ve NheI kısıtlama bölgelerindeki hedef vektöre yerleştirin. Buna rağmen, bu teknolojiyi uyarlamanın ve optimize etmenin yolları vardır. Bu teknolojinin temel direklerinden biri HTLA hücreleri, bir HEK293T hücre hattı, 2-TEV füzyon geni ve tTA'ya bağımlı luciferase muhabiri, Richard Axel'in laboratuvarından nazikçe tedarik edilen bir β-arrestin2-TEV füzyon genini ifade eder. PRESTO-Tango'nun önemli bir bileşeni olmakla birlikte, şu anda hücre hattı kökeni veya ifade ettikleri genler açısından başka bir alternatif bulunmamaktadır. Ayrıca, gelecekteki mühendislik hücre hatları β-arrestin2 yanı sıra diğer proteinleri izlemek için diğer TEV füzyon genleri ifade etmek için oluşturulabilir, özellikle daha önce etkileşim ya da GPCR ikamet bulunan gösterilmiştir, gibi 14-3-322, SAP9723, ve β-arrestin1, vertebratlardagörsel olmayan arrestinlerin daha yaygın izoform. Bu sadece tetO7 organizatörü tarafından kontrol luciferase muhabiri içeren ebeveyn HTL hücreleri kullanılarak elde edilebilir. PRESTO-Tango için bir sınırlama muhabir organizatörü non-spesifik aktivasyon olduğunu. Tetrasiklin bağımlı düzenleyici sisteme (tet sistemi) dayanan tetrasiklin duyarlı öğe (TRE) aşağı luciferase muhabirinin ifadesini kontrol eder. Ancak, önceki çalışmalarda endojen transkripsiyon faktörleri nedeniyle luciferase "sızdıran" ifade göstermiştir25,26. Sonuç olarak, bazı bileşikler β-arrestin2 işe alma veya GPCR aktivasyonu bağımsız olarak muhabiri etkinleştirmek olabilir, yanlış pozitif sayısını artırarak. Ortaya çıkan bir diğer konu, diğer HTS yöntemleri de yaygın, "sık hitters", çeşitli hedefler de önemli tepkiler teşvik promiscuous bileşiklervardır 27. Bununla birlikte, PRESTO-Tango'nun paralel tarama kurulumu bu eserlerin tanımlanmasını kolaylaştırır, bu da luciferase aktivitesi üzerindeki etkilerini doğrulamak için daha fazla test edilebilir. PRESTO-Tango, PCCr'lere işe alımda ve daha büyük uyuşturucu keşfi planında, utile GPCR ligand eleme ve yetimleşme aracı olarak tutuklanma çalışmaları için sağlam temeller sağlamıştır.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Authours hiçbir rakip çıkarları ilan.
Acknowledgments
Bu çalışma Kanada Sağlık Araştırmaları Enstitüleri (CIHR hibe #MOP142219) tarafından desteklenmiştir.
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).