Summary
Dette er en metode til at generere "arløse" rekombinant vaccinia virus ved hjælp af værtsområde udvælgelse og visuel identifikation af rekombinant virus.
Abstract
Vaccinia virus (VACV) var medvirkende til at udrydde variola virus (VARV), det agens af kopper, fra naturen. Siden den første anvendelse som vaccine er VACV udviklet som vektor for terapeutiske vacciner og som onkolytisk virus. Disse applikationer udnytter VACV's let manipulerede genom og brede værtsområde som en fremragende platform til at generere rekombinant virus med en række terapeutiske anvendelser. Der er udviklet flere metoder til at generere rekombinant VACV, herunder markørudvælgelsesmetoder og forbigående dominerende udvælgelse. Her præsenterer vi en forfinelse af en værtsområde udvælgelsesmetode kombineret med visuel identifikation af rekombinant virus. Vores metode udnytter selektivt tryk genereret af værten antiviralprotein kinase R (PKR) kombineret med en fluorescerende fusion gen udtrykker mCherry-tagged E3L, en af to VACV PKR antagonister. Kassetten, herunder det pågældende gen og mCherry-E3L-fusionnen, er flankeret af sekvenser, der er afledt af VACV-genomet. Mellem det gen af interesse og mCherry-E3L er en mindre region, der er identisk med de første ~ 150 nukleotider af 3 'arm, at fremme homolog rekombination og tab af mCherry-E3L genet efter udvælgelse. Vi viser, at denne metode muliggør effektiv, problemfri generering af rVACV i en række forskellige celletyper uden at kræve udvælgelse af lægemidler eller omfattende screening for mutantvirus.
Introduction
Vacciniavirus (VACV) var medvirkende til den første vellykkede udryddelse af et humant patogen, variolavirus (VARV), fra naturen. Lige siden udryddelsen af variolavirus har poxvirus, herunder VACV, fortsat nyttige terapeutiske vira til både human- og dyremedicin. F.eks. har en VACV-baseret rabiesvirusvaccine været meget effektiv til at forhindre overførsel af sylvatisk rabies i Europa1 og USA2. For nylig, rekombinant poxvirus udtrykke en række anti-tumor molekyler (f.eks enkeltkædede antistoffer eller menneskelige erythropoietin) har set opmuntrende succes som oncolytic agenter3,4,5. VACV er særligt attraktiv som vektor, fordi det er let modtagelige for genetisk manipulation, har en bred vært rækkevidde, og det er stabilt under en række betingelser, så nem transport og vaccine levedygtighed i marken6,7. Mens flere teknikker er blevet udviklet til at generere rekombinant VACV til laboratorieforsøg og vaccine generation, nuværende strategier til at generere disse vira har bemærkelsesværdige begrænsninger.
På grund af nytten af VACV, flere strategier til at generere rekombinant virus er blevet udviklet. Den første strategi anvender homolog rekombination for at indføre en kassette, herunder transgene og et valgbart markørgen som f.eks. Kassetten er flankeret af to ~ 500 nukleotider (nt) eller større arme dirigere genet til et bestemt sted i det virale genom, som derefter stabilt integreret af dobbelt crossover begivenheder8,9,10. Denne strategi er hurtig og effektiv. det resulterer dog i ekstra genetisk materiale i form af markørgenet, som kan give uventede virkninger. Desuden er der en praktisk øvre grænse for antallet af transgener, der kan indføres begrænset af antallet af unikke valgbare markører til rådighed. Forbigående dominerende udvælgelsesstrategier (TDS) har behandlet dette problem ved at lette genereringen af "arløse" rekombinantvirus11. Ved hjælp af denne strategi integreres en plasmid indeholdende et mutant VACV-gen og et valgbart markørgen i det virale genom, men uden yderligere flankerende VACV DNA. Denne fremgangsmåde resulterer i forbigående integration af hele plasmid og duplikering af VACV-genet som følge af integration ved en enkelt crossover-hændelse. Dette mellemprodukt er stabilt, så længe det holdes under markeringstryk, hvilket gør det muligt at berige denne konstruktion. Når udvælgelsen fjernes, giver VACV-duplikeringen en anden crossover-hændelse, der resulterer i fjernelse af plasmider og efterfølgende dannelse af enten vildtypen (wt) eller rekombinant virus i et omtrentligt 50:50-forhold. Mens TDS genererer rekombinant virus uden at kræve en stabil indførelse af udenlandsk DNA, flere virus kloner skal screenes for den forventede mutation ved sekventering analyse, et potentielt tidskrævende og dyrt skridt.
Her præsenterer vi en tilgang til at generere rekombinant poxviruses kombinere de bedste aspekter af hver af disse tilgange, svarende til en tilgang, der er blevet beskrevet for replikation inkompetente modificeret vaccinia Ankara12,13,14. Denne strategi kombinerer visuel og værtsområde udvælgelse til hurtigt at generere rekombinant virus ved dobbelt crossover begivenheder, og efterfølgende fjerne den valgbare markør genet ved homolog rekombination. Denne tilgang gør det muligt for den hurtige generation af mutanter medieret af homolog rekombination, med den "arløse" karakter af TDS tilgange, uden at kræve en efterfølgende screening skridt til at skelne vilde type og mutant virus. Vores metode bruger også værtsområde udvælgelse i stedet for antibiotika udvælgelse, fjerne risikoen for kemisk induceret fænotypiske ændringer i cellelinjen. Til denne tilgang har vi valgt at bruge værten antiviralprotein kinase R (PKR) som selektiv agent til at generere rekombinant VACV. PKR udtrykkes som et inaktivt monomer i de fleste celletyper15. Ved binding af dobbeltstrenget RNA (dsRNA) på N-terminal dsRNA-bindingsdomæner, dæmper PKR og16er autophosphat16 . Denne aktive form af PKR fosforylater alfaunderenheden af den eukaryote initieringsfaktor 2 (eIF2), hvilket i sidste ende hæmmer leveringen af initiatormethionyl-tRNA til ribosomet, hvilket forhindrer intracellulær oversættelse og hæmmer i det store og hele replikationen af mange virusfamilier17,18.
Som reaktion på den brede og potente antivirale aktivitet af PKR, mange vira har udviklet mindst én strategi for at forhindre PKR aktivering. De fleste poxvira udtrykke to PKR antagonister, kodet af E3L og K3L gener i VACV, som antagonisere PKR gennem to forskellige mekanismer19. E3 forhindrer PKR homodimerisering ved at binde dobbeltstrenget RNA20,21, mens K3 fungerer som pseudosubstrathæmmer ved at binde direkte til aktiveret PKR og dermed hæmme samspillet med dets substrat eIF2α22. Det er vigtigt, at disse to PKR-antagonister ikke nødvendigvis hæmmer PKR fra alle arter. F.eks. hæmmede K3-homologen fra fårepoxvirus stærkt PKR fra får, mens fårpox E3-homologen ikke viste betydelig PKR-hæmning23,24. I denne undersøgelse præsenterer vi en metode til at bruge PKR-medieret selektivt tryk kombineret med fluorescensudvælgelse til at generere et VACV rekombinant, der er slettet for E3L og K3L (VC-R4), som ikke kan replikere i PKR kompetente celler fra forskellige arter. Denne rekombinant virus giver en fremragende baggrund for hurtig generation af rekombinant virus udtrykke gener under kontrol af den indfødte E3L promotor.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Generering af rekombinationsvektoren
- Design primere til at generere udvælgelsen kassette. Design hver enkelt amplicon med overlappende sekvenser med tilstødende amplicons og vektoren for at lette isotermisk enzymatisk samling af DNA-molekyler, også kaldet Gibson forsamling, ved hjælp af en af flere online primer design værktøjer.
BEMÆRK: Denne protokol kan også udfyldes ved hjælp af traditionelle begrænsning endonuclease-baserede kloning metoder. I så fald skal primere udformes med de relevante begrænsningssteder i stedet for med overlappende sekvenser. - Ved hjælp af de primere, der er konstrueret i trin 1.1, forstærker PCR følgende elementer i rækkefølge fra 5' til 3' (Figur 1):~500 nukleotider i VACV genomisk region 5' af E3L (5' arm), EGFP eller det interessegen, ~150 nukleotider fra VACV genomregionen straks 3' af E3L (kort 3' arm), en syntetisk tidlig/sen poxviruspromotor25,fusionsgenet mCherry-E3L og ~500 nukleotider fra VACV-regionen 3' af E3L, herunder den korte 3' arm (lang 3' arm).
- I et PCR-rør tilsættes reagenserne i følgende rækkefølge for hver amplicon: 17 μL DNase frit vand, 1,2 μL af hver primer (indledende koncentration = 10 μM, endelig koncentration = 0,5 μM), 5 μL 5x PCR-reaktionsbuffer, skabelon-DNA (10 ng for amplicons forstærket af plasmider: EGFP og E/L promotor-mCherry-E3L kassette; 100 ng for amplicons forstærket af viralgenomisk DNA: 5' og 3' arme) og 0,5 μL DNA-polymerase. Den tilsatte vandmængde justeres for et endeligt reaktionsvolumen på 50 μL.
BEMÆRK: Koncentrationen af skabelon-DNA skal bestemmes empirisk, men vi starter generelt med 10 ng/reaktion. - Røret(erne) anbringes i en termocycler, og DNA'et smeltes ved 98 °C i 30 s, og der anvendes derefter 25 runder af en tretrins-PCR-protokol: 98 °C for 5 s, 55 °C i 10 s og 72 °C i 1 min.
BEMÆRK: Bestem smeltetemperaturen baseret på producentens foreslåede Tm for hvert primersæt. Bestem den korrekte forlængelsestid baseret på længden af hver amplicon (1 minut/kb).
- I et PCR-rør tilsættes reagenserne i følgende rækkefølge for hver amplicon: 17 μL DNase frit vand, 1,2 μL af hver primer (indledende koncentration = 10 μM, endelig koncentration = 0,5 μM), 5 μL 5x PCR-reaktionsbuffer, skabelon-DNA (10 ng for amplicons forstærket af plasmider: EGFP og E/L promotor-mCherry-E3L kassette; 100 ng for amplicons forstærket af viralgenomisk DNA: 5' og 3' arme) og 0,5 μL DNA-polymerase. Den tilsatte vandmængde justeres for et endeligt reaktionsvolumen på 50 μL.
- Visualiser forstærkningsprodukterne på en 1% agarose gel. Der tilsættes 10 μL af hvert DNA-produkt og 2 μL belastningsbuffer til hver brønd, og der køres ved 8 V/cm i 1 time.
- Gel rense hver amplicon ved hjælp af en DNA gel ekstraktion kit og producentens protokol. Elute amplicons fra kolonnen ved at tilføje 50 μL DNase frit vand og straks centrifugering.
- Lineariser pUC19 kloning vektor ved hjælp af EcoRI endonuclease fordøjelse. Til et rør tilsættes 1 μg pUC19, vand til et volumen på 17 μL, 2 L reaktionsbuffer og 1 μL (20 enheder) EcoRI. Inkuber ved 37 °C i 1 time.
- Forstærkningsprodukterne på en 1% agarosegel, der køres ved 8 V/cm i 1 time. Punktafgifter båndet fra gelen, og rens produktet ved hjælp af DNA-gelekstraktionssættet som beskrevet i trin 1.4.
- Ligate alle de enkelte, gel renset ampelikoner og lineariseret vektor ved hjælp af en master mix kit.
- Til en PCR rør, tilsættes 0,2 pmol af lineariseret pUC19 og hver amplicon (5' arm, EGFP, kort 3 'arm, E / L promotor-mCherry-E3L kassette, 3'arm). Der tilsættes DNase frit vand til et endeligt rumfang på 10 μL, og der tilsættes derefter 10 μL DNA-samlemestermix. Inkuberprøver ved 50 °C i 1 time.
- Omdannelse af kemisk kompetent E. coli med 2 μL af det samlede produkt fra trin 1.6 som tidligere beskrevet26,27. Plade 100 μL af de transformerede celler på LB agaroseplader indeholdende 100 μg/ml ampicillin. Pladerne inkuberes natten over ved 37 °C.
- Der plukkes godt isolerede kolonier, og individuelle kolonier overføres til rør, der indeholder Luria bouillon med 100 μg/ml ampicillin. Rørene inkuberes natten over ved 37 °C under omrystning ved 225 omdrejninger i minuttet.
- Isoler plasmider fra natten kultur ved hjælp af en plasmid miniprep kit. Kontroller dna'ets koncentration og renhed ved hjælp af et spektrofotometer. Et A260/A280-forhold mellem 1,8 og 2,0 er acceptabelt.
- Send plasmider for Sanger-sekvensering for at afgøre, om det ønskede kloningsprodukt er korrekt. Opbevar DNA'et ved -20 °C.
2. Generering af rekombinant virus
- Det sammenflydende monolayer af egnede celler med virus, der skal rekombineres ved en multiplikitet af infektion på 1,0 (MOI = 1,0) i en 6-brøndsplade. Inkuber de inficerede celler ved 37 °C og 5% CO2 i 1 time. Derefter aspirat mediet og erstatte det med frisk DMEM. Inkuber de inficerede celler ved 37 °C og 5 % CO2.
BEMÆRK: For replikationskompetente vira såsom vacciniavirus, der mangler K3L22,er en cellelinje som #CCL f.eks. Men for replikering mangelfuld virus, såsom virus, der er beskrevet i dette papir mangler både PKR antagonister E3L og K3L, en komplementerende celle linje udtrykke disse to gener i trans eller PKR knock-down eller knock-out celler er påkrævet. - Transfect de inficerede celler med 500 ng af vektoren genereret og valideret i trin 1.10 ved hjælp af en kommercielt tilgængelig transfektionreagens efter producentens protokol. Cellerne inkuberes ved 37 °C og 5% CO2 i 48 timer.
BEMÆRK: Hvis der anvendes en vacciniavirus, der mangler både E3L og K3L, vil PKR-medieret selektivt tryk drive udvælgelsen af nykombinerede vira og bevare ekspressionen af mCherry-E3L-fusionsproteinet i disse celler. Hvis det ønskes, bør det også være muligt at PCR forstærke kun indsatsen til brug for transfection i stedet for hele plasmid. - 48 timer efter infektion, høste den inficerede monolayer. I nogle tilfælde kan cellerne høstes ved pipettering, men hvis de stadig er stramt overholdt, høste dem med en celle skraber. Frys-tø cellerne tre gange, og derefter sonikere lysates for 15 s ved 50% amplitude. Dette lysat opbevares ved -80 °C, indtil den er klar til brug.
- Serielt 10-fold fortyndes lysatet, der er høstet i trin 2.3 fra 10-1 til 10-6, ved at tilsætte 120 μL lysat til 1080 μL DMEM (10-1), og derefter tilføje 120 μL af denne fortynding til 1080 μL DMEM (10-2), og derefter gentage denne proces fire gange mere. Der tilsættes 1 ml af hver fortynding til en individuel, sammenflydende brønd af en PKR kompetent cellelinje, i dette tilfælde RK13-celler.
- Inkuber de inficerede celler ved 37 °C og 5% CO2 i 1 time. Derefter aspirat mediet og erstatte det med frisk DMEM Inkubere de inficerede celler ved 37 °C og 5% CO2.
- 24 til 48 timer efter infektion, identificere rekombinant virus ved fluorescens mikroskopi. Plaques fra rekombinant virus udtrykker rød fluorescens på grund af integration af mCherry-E3L fusion gen (Figur 2). Hvis en virus uden PKR-hæmmere blev brugt i første omgang, vil alle plaques indeholde rekombinant virus.
- Plaque renser rekombinant virus tre gange på RK13 celler. Efter den sidste runde af plaque rensning, bør alle plaques udtrykke rød fluorescens.
- Inficere en confluent 6-brøndplade af RK13 celler, der udtrykker VACV PKR-hæmmerne E3L og K3L (RK13+E3L+K3L-celler28) med plaque-renset rød fluorescerende virus fra trin 2.6. Målet for ca 50-100 plaques per brønd.
BEMÆRK: Disse celler giver VACV PKR antagonister i trans og lindre PKR-medieret selektivt pres for at opretholde mCherry-E3L fusion genet, og dermed fremme "scarless" generation af rekombinant virus. - Identificer skjulte vira ved fluorescensmikroskop ved hjælp af et EVOS2-mikroskop og en GFP-filterkube (Excitation: 470/22, Emission: 525/50) og en RFP-filterkube (Excitation: 531/40, Emission: 593/40).
BEMÆRK: Den hyppighed, hvormed mCherry-E3L-fusionsgenet går tabt, er ca. 2,5 % (tabel 2). Hvis EGFP ikke er inkluderet som et markørgen, vil plaques fra mutantvirus, der har mistet mCherry-E3L-fusionsgenet, være farveløse. - Plaque renser kun grøn (VC-R4) eller farveløse plaques (E3L) tre gange på RK13+E3L+K3L-celler. Sørg for, at ingen plaques fluorescerer rødt.
- Bekræft tabet af mCherry-E3L og tilstedeværelsen af den forventede mutation ved PCR og Sanger sekventering.
BEMÆRK: Hvis det pågældende gen eller mutation ikke har PKR-hæmmende aktivitet, skal rekombinant virus dyrkes på RK13+E3L+K3L-celler eller en tilsvarende PKR-hæmmet eller PKR-mangelfuld cellelinje (figur 3).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vi brugte procedurediagrammet i figur 1 til at generere en VACV, der mangler både PKR-antagonister E3L og K3L, ved at erstatte E3L med EGFP i en virus, der allerede er slettet for K3L (vP872). Figur 2 viser røde fluorescerende plaques i PKR kompetente RK13 celler, der indikerer viralt udtryk for mCherry-E3L, samt EGFP udtrykt i RK13+E3L+K3L celler, der bekræfter tabet af E3L og kollaps af valget af mCherry-E3L-markør. Figur 3 bekræfter, at denne rekombinantvirus, VC-R4, der mangler begge PKR-antagonister, ikke kan replikere i PKR kompetente RK13-celler, mens den forældervirus, vP872, der udtrykker E3L, er replikationskompetent. For at bekræfte, at denne manglende evne til at replikere i RK13-celler kun skyldtes tabet af E3L, erstattede vi EGFP i VC-R4 med E3L for at generere en revertantvirus ved hjælp af den samme udvælgelsesprotokol. Figur 3 validerer også, at denne revertantvirus replikerer lige så effektivt som vP872 i RK13-celler. Interessant, farveløse plaques i overensstemmelse med sammenbrud af mCherry-E3L udvælgelse markør blev identificeret før udvælgelsen i RK13 + E3 + K3 celler, der generelt er forpligtet til at vælge "arløse" rekombinanter, sandsynligvis på grund af den udvidede sekvens identitet mellem mCherry-E3L rekombination kassette og E3L genet indsættes i VC-R4. Derfor, at bestemme effektiviteten af rekombination og hastigheden af sammenbrud vi valgt at producere virus, der udtrykker poxvirus PKR antagonist K3L at undgå problemet med tidlig sammenbrud23. Figur 4 angiver udseendet af farveløse plaques (pilespidser) efter infektion af RK13+E3L+K3L-celler. Tabel 1 viser resultaterne af tre uafhængige forsøg, hvor i gennemsnit 12,6 % af afkommet virioner havde gennemgået en rekombination med den transfected plasmid , svarende til tidligere rapporterede frekvenser29,30,31. Tabel 2 beskriver hyppigheden af farveløse plaques i forhold til de samlede plaques i RK13+E3L+K3L-celler, hvilket viser, at mCherry-E3L-markeringsmarkøren forekom med en hyppighed på ca. 1,8 %.
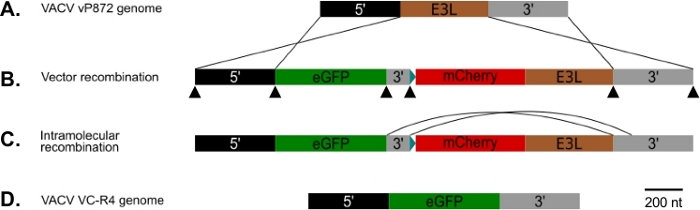
Figur 1: Diagram over p837-GOI-mCherry-E3L samt værtsområde- og synskombinationsstrategien. (A) 5' arm (sort) og 3' arm (grå) flankerer E3L locus (brun) i VACV. (B)I p837-GOI-mCherry-E3L flankerer disse arme en kassette indeholdende det pågældende gen( i dette tilfælde EGFP, (grøn) adskilt fra et mCherry-E3L (rødt) fusionsgen under kontrol af den syntetiske tidlige/sene poxviruspromotor25 blå) med en kort 3' arm (grå). Disse eksterne arme drev homolog rekombination mellem VACV og p837-GOI-mCherry-E3L. Sorte pilespidser angiver de steder af de overlappende primere, der anvendes til at generere denne plasmid af Gibson kloning. (C) Når PKR selektivt tryk fjernes, kan vira, der har gennemgået intramolekylær rekombination mellem de korte og lange 3' arme, vælges. (D) Resulterer i en virus (VC-R4), der kun indeholder det gen, der er interesseret i E3L locus. Klik her for at se en større version af dette tal.

Figur 2: Fluorescerende mikrografer af (øverst) en rekombinant virusplaque 24 timer efter rekombination med p837-GOI-mCherry-E3L, der udtrykker både mCherry (venstre) og EGFP (til højre) i RK13-celler. (Nederst) Mikrograf af en rekombinant virusplaque 48 timer efter pkr-medieret selektivt tryk er blevet fjernet i RK13++-celler, der udtrykker EGFP (højre), men ikke mCherry (venstre). Skalalinjen angiver 650 μm for alle paneler. Klik her for at se en større version af dette tal.
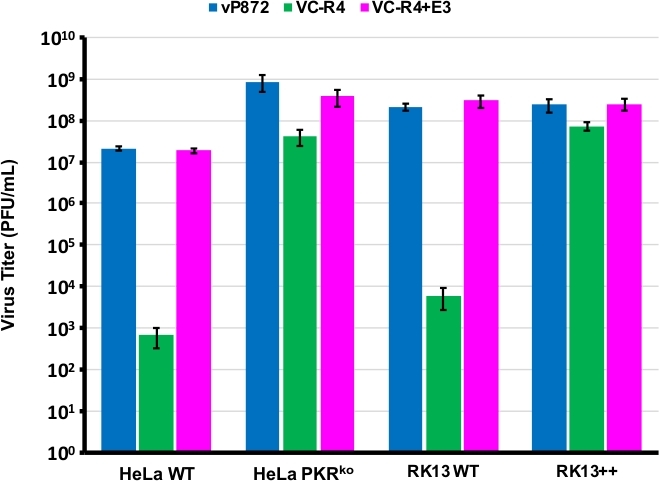
Figur 3: VC-R4 kan ikke replikere i PKR kompetente celler. De angivne cellelinjer blev inficeret med vP872 (blå), VC-R4 (grøn) eller VC-R4+E3L (magenta) ved MOI = 0,1. 48 timer efter infektion blev de inficerede celler høstet og titreret ved seriefortynding på RK13+E3L+K3L-celler. Titers er rapporteret i PFU / ml, fejl barer repræsenterer standardafvigelsen af tre replikat eksperimenter. Klik her for at se en større version af dette tal.

Figur 4: Tab af mCherry-E3L-udtryk i RK13+E3L+K3L-celler. Overlejring af fluorescerende og fasekontrastmikrografer af VC-R4+K3L-mCherry-E3L-inficerede RK13+E3L+K3L-celler. Tre plaques ikke længere udtrykke mCherry (cirkler) på grund af sammenbrud af udvælgelsen kassette giver VC-R4 +K3L. Klik her for at se en større version af dette tal.
| Eksperiment 1 | Eksperiment 2 | Eksperiment 3 | |
| Røde plaques (RK13) | 30 | 11 | 18 |
| Samlet antal plaques (RK13+E3L+K3L) | 225 | 64 | 249 |
| Sats for genkombination | 13.30% | 17.20% | 7.20% |
Tabel 1: Vacv's rekombinationsfrekvens med p837-K3L-mCherry-E3L plasmid.
| Eksperiment 1 | Eksperiment 2 | Eksperiment 3 | |
| Samlet antal plaques (RK13+E3L+K3L) | 115 | 44 | 210 |
| Farveløse plaques (RK13+E3L+K3L) | 3 | 1 | 1 |
| Sats for genkombination | 2.60% | 2.30% | 0.50% |
Tabel 2: Hyppigheden af mCherry-E3L tab fra VC-R4+K3L-mCherry-E3L i RK13+E3+K3 celler.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Her præsenterer vi en variation af en forbigående markør udvælgelsesstrategi 32 til at generere rekombinant vaccinia virus uden at bevare udenlandsk DNA i den endelige rekombinant virus. Vores strategi bruger selektivt pres medieret af værten antivirale protein PKR snarere end andre former for selektivt pres såsom antibiotika. Brugen af vært antivirale gener eliminerer muligheden for kemisk inducerede fænotypiske ændringer i cellerne, eller øget risiko for mutation på grund af udvælgelse narkotika. Desuden, i modsætning til lægemiddeludvælgelse, er der ingen forsinkelsesfase for vores tilgang, fordi PKR udtrykkes konstituerende i alle celler. Sekundær visuel udvælgelse baseret på mCherry udtryk forbedrer også specificiteten af denne metode ved at sikre, at kun plaques udtrykke transgene er plukket i den første fase, og er lige så effektiv som en negativ selektiv markør, mens du vælger modne rekombinant virus, der har mistet mCherry-E3L genet.
De mest kritiske skridt for denne rekombinationsstrategi er genereringen af den relevante rekombinationsvektor og passende plaquerensning for at sikre, at den valgte virus er klonal. I dette papir foreslår vi "Gibson samling" for at generere rekombination vektor. Denne strategi er yderst effektiv og giver mulighed for samling af alle de fragmenter, der omfatter rekombinationsvektoren på en enkelt dag. Men fordi den korte 3' arm og den lange 3' arm deler identiske sekvenser, har disse fragmenter potentiale til at blive samlet under kloningsreaktionen, og nogle vektorer må ikke indeholde mCherry-E3L kassette. Det er vores erfaring, at dette er sjældent, men at bekræfte vektorens struktur efter kloning er nødvendig. Vi har også genereret rekombinationsvektorer til denne strategi ved hjælp af traditionelle endonuclease og ligase metoder. Denne strategi undgår det problem, der er beskrevet ovenfor, men kan være mere arbejdskrævende. Plaque rensning er generelt ligetil og er primært afhængig af at bruge passende eftergivende celler til den indledende rekombination, PKR-kompetente celler til indledende plaque rensning for at sikre, at kun rekombinant virus kan replikere, og derefter eftergivende celler igen for at lette intramolekylær rekombination og tab af den valgbare markør. Det er derfor afgørende for en vellykket og effektiv anvendelse af denne strategi, at der er stor fokus på cellelinjer.
I denne undersøgelse demonstrerer vi brugen af denne metode til at generere en VACV rekombinant, der slettes for både PKR-antagonister E3L og K3L, og udtrykker EGFP under E3L-promotors kontrol. Fremadrettet, denne virus vil tjene som en effektiv baggrund for fremtidige rekombinant virus, da det er ude af stand til at replikere i PKR kompetente celler. Derfor vil der være et stærkt PKR-medieret selektivt tryk for at drive mCherry-E3L rekombinationskassette til afkomvirioner, samtidig med at det væsentlige forhindrer replikering af ikke-rekombinant virus. Desuden er tabet af EGFP ved optagelse af rekombinationskassette en nyttig sekundær markering for at sikre, at plukkede plaques ikke er co-inficeret med en ikke-rekombinant virus. Vi observerede rekombinationsrater i overensstemmelse med tidligere rapporterede rater for VACV, men de visuelle fluorescerende markører øger effektiviteten af at generere rekombinantvirus ved at sikre, at det øger sandsynligheden for, at de relevante rekombinantvirus vælges. Vores observation af farveløse plaques efter to runder af udvælgelse på PKR-kompetente celler, formentlig på grund af den øgede længde af identiske sekvens mellem E3L og mCherry-E3L markør genet, tyder på, at hastigheden af mCherry-E3L tab kan være "tunet" ved at øge eller reducere længden af de 3 'korte arm. Den primære begrænsning af denne teknik er brugen af PKR som selektivt tryk for rekombinanter. Den mest effektive brug af denne rekombination strategi er at generere disse vira i en baggrund mangler PKR antagonister. Men den kolorimetriske udvælgelse markør tillader denne rekombination strategi, der skal anvendes, selv uden udvælgelsen medieret af PKR, blot ved plaque rensende mCherry-udtrykke plaques. Mens manglen på PKR-medieret selektivt tryk vil reducere effektiviteten af den første screening skridt, procentdelen af mCherry udtrykke plaques er stadig høj nok til, at farvebaseret udvælgelse er levedygtig. Således kan denne metode bruges til at indsætte næsten ethvert gen i poxvirus genomet.
Som det fremgår af indsættelsen af EGFP, kan ethvert gen med denne tilgang hurtigt indsættes i Den Oprindelige Promotors E3L locus under kontrol, forudsat at PKR null-celler eller komplimenterende cellelinjer anvendes til downstream-forsøg, hvis transgenet ikke er en PKR-antagonist. Denne strategi, kombineret med VC-R4 virus, som vi rapporterer her, tilføjer en ny og potent metode til hurtigt og pålideligt generere rekombinant vaccinia virus ved hjælp af vært-medieret selektivt tryk og visuel identifikation af rekombinanter tidligt i processen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen konkurrerende finansielle interesser.
Acknowledgments
Dette projekt blev finansieret af National Institutes of Health (AI114851) til SR.
Materials
| Name | Company | Catalog Number | Comments |
| 2X-Q5 Master Mix | NEB | M0492L | High-fidelity polymerase used in PCR |
| Ampicillin | ThermoFisher Scientific | 11593027 | Bacterial selective agent |
| Disposable Cell Scrapers | ThermoFisher Scientific | 08-100-242 | Cell scraper to harvest infected cells |
| EVOS FL Auto 2 Cell imaging system | ThermoFisher Scientific | AMAFD2000 | Fluorescent microscope |
| EVOS Light Cube, GFP | ThermoFisher | AMEP4651 | GFP Cube |
| EVOS Light Cube, RFP | ThermoFisher | AMEP4652 | RFP Cube |
| GenJet | SignaGen Laboratories | SL100489 | Transfection reagent |
| Luria Bertani (LB) Broth | Gibco | 10855021 | Bacterial growth medium |
| Monarch DNA gel extraction kit | NEB | T1020L | Gel purification kit used to purify amplicons and linearized vectors |
| Monarch Plasmid Miniprep kit | NEB | T1010L | Miniprep kit ussed to purify plasmids |
| NanoDrop One | ThermoFisher Scientific | ND-ONE-W | Spectrophotometer used to measure RNA and DNA concentration |
| NEBuilder Master Mix | NEB | E2621L | Isothermal enzymatic assembly kit used to generate the recombination vector |
| Q500 Sonicator | Qsonica | Q500-110 | Sonicator for virus lysates |
| RK13 cells | ATCC | CCL-37 | Rabbit kidney cells |
| VWR Multiwell Cell Culture plates | VWR | 10062-892 | Cell culture plates |
References
- Brochier, B., et al. Large-scale eradication of rabies using recombinant vaccinia-rabies vaccine. Nature. 354 (6354), 520-522 (1991).
- Pastoret, P. P., Brochier, B. The development and use of a vaccinia-rabies recombinant oral vaccine for the control of wildlife rabies; a link between Jenner and Pasteur. Epidemiology and Infection. 116 (3), 235-240 (1996).
- Chan, W. M., McFadden, G. Oncolytic Poxviruses. Annual review of virology. 1 (1), 119-141 (2014).
- Nguyen, D. H., et al. Vaccinia virus-mediated expression of human erythropoietin in tumors enhances virotherapy and alleviates cancer-related anemia in mice. Molecular Therapy. 21 (11), 2054-2062 (2013).
- Frentzen, A., et al. Anti-VEGF single-chain antibody GLAF-1 encoded by oncolytic vaccinia virus significantly enhances antitumor therapy. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12915-12920 (2009).
- Pastoret, P. P., Vanderplasschen, A. Poxviruses as vaccine vectors. Comparative Immunology, Microbiology and Infectious Diseases. 26 (5-6), 343-355 (2003).
- COLLIER, L. H. The development of a stable smallpox vaccine. The Journal of Hygiene. 53 (1), 76-101 (1955).
- Weir, J. P., Bajszár, G., Moss, B. Mapping of the vaccinia virus thymidine kinase gene by marker rescue and by cell-free translation of selected mRNA. Proceedings of the National Academy of Sciences of the United States of America. 79 (4), 1210-1214 (1982).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus: a selectable eukaryotic cloning and expression vector. Proceedings of the National Academy of Sciences of the United States of America. 79 (23), 7415-7419 (1982).
- Nakano, E., Panicali, D., Paoletti, E. Molecular genetics of vaccinia virus: demonstration of marker rescue. Proceedings of the National Academy of Sciences of the United States of America. 79 (5), 1593-1596 (1982).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. Journal of Virology. 64 (6), 3108-3111 (1990).
- Staib, C., Drexler, I., Ohlmann, M., Wintersperger, S., Erfle, V., Sutter, G. Transient Host Range Selection for Genetic Engineering of Modified Vaccinia Virus Ankara. BioTechniques. 28 (6), 1137-1148 (2000).
- Staib, C., Drexler, I., Sutter, G. Construction and Isolation of Recombinant MVA. Vaccinia Virus and Poxvirology. , 77-99 (2004).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Pfaller, C. K., Li, Z., George, C. X., Samuel, C. E. Protein kinase PKR and RNA adenosine deaminase ADAR1: New roles for old players as modulators of the interferon response. Current Opinion in Immunology. 23 (5), 573-582 (2011).
- Bevilacqua, P. C., George, C. X., Samuel, C. E., Cech, T. R. Binding of the protein kinase PKR to RNAs with secondary structure defects: Role of the tandem A - G mismatch and noncontigous helixes. Biochemistry. 37 (18), 6303-6316 (1998).
- Krishnamoorthy, T., Pavitt, G. D., Zhang, F., Dever, T. E., Hinnebusch, A. G. Tight Binding of the Phosphorylated Subunit of Initiation Factor 2 (eIF2) to the Regulatory Subunits of Guanine Nucleotide Exchange Factor eIF2B Is Required for Inhibition of Translation Initiation. Molecular and Cellular Biology. 21 (15), 5018-5030 (2001).
- Rothenburg, S., Georgiadis, M. M., Wek, R. C. Evolution of eIF2α kinases: Adapting translational control to diverse stresses. Evolution of the Protein Synthesis Machinery and Its Regulation. , 235-260 (2016).
- Bratke, K. A., McLysaght, A., Rothenburg, S. A survey of host range genes in poxvirus genomes. Infection, Genetics and Evolution. 14, 406-425 (2013).
- Chang, H. W., Watson, J. C., Jacobs, B. L. The E3L gene of vaccinia virus encodes an inhibitor of the interferon-induced, double-stranded RNA-dependent protein kinase. Proceedings of the National Academy of Sciences. 89 (11), 4825-4829 (1992).
- Romano, P. R., et al. Inhibition of double-stranded RNA-dependent protein kinase PKR by vaccinia virus E3: role of complex formation and the E3 N-terminal domain. Molecular and Cellular Biology. 18 (12), 7304-7316 (1998).
- Beattie, E., Tartaglia, J., Paoletti, E. Vaccinia virus-encoded eIF-2 alpha homolog abrogates the antiviral effect of interferon. Virology. 183 (1), 419-422 (1991).
- Park, C., Peng, C., Brennan, G., Rothenburg, S. Species-specific inhibition of antiviral protein kinase R by capripoxviruses and vaccinia virus. Annals of the New York Academy of Sciences. 1438 (1), 18-29 (2019).
- Rothenburg, S., Brennan, G. Species-Specific Host-Virus Interactions: Implications for Viral Host Range and Virulence. Trends in Microbiology. , (2019).
- Chakrabarti, S., Sisler, J. R., Moss, B. Compact, synthetic, vaccinia virus early/late promoter for protein expression. BioTechniques. 23 (6), 1094-1097 (1997).
- Chung, C. T., Niemela, S. L., Miller, R. H. One-step preparation of competent Escherichia coli: Transformation and storage of bacterial cells in the same solution (recombinant DNA). Biochemistry. 86, 2172-2175 (1989).
- Chung, C. T., Miller, R. H. Preparation and storage of competent Escherichia coli cells. Methods in Enzymology. 218, 621-627 (1993).
- Rahman, M. M., Liu, J., Chan, W. M., Rothenburg, S., McFadden, G. Myxoma Virus Protein M029 Is a Dual Function Immunomodulator that Inhibits PKR and Also Conscripts RHA/DHX9 to Promote Expanded Host Tropism and Viral Replication. PLOS Pathogens. 9 (7), 1003465 (2013).
- Evans, D. H., Stuart, D., McFadden, G. High levels of genetic recombination among cotransfected plasmid DNAs in poxvirus-infected mammalian cells. Journal of Virology. 62 (2), 367-375 (1988).
- Ball, L. A. High-frequency homologous recombination in vaccinia virus DNA. Journal of Virology. 61 (6), 1788-1795 (1987).
- Spyropoulos, D. D., Roberts, B. E., Panicali, D. L., Cohen, L. K. Delineation of the viral products of recombination in vaccinia virus-infected cells. Journal of Virology. 62 (3), 1046-1054 (1988).
- Liu, L., et al. Transient dominant host-range selection using Chinese hamster ovary cells to generate marker-free recombinant viral vectors from vaccinia virus. BioTechniques. 62 (4), 183-187 (2017).



