Summary
Это метод для создания "безшрамов" рекомбинантных вирусов vaccinia с использованием выбора хоста и визуальной идентификации рекомбинантных вирусов.
Abstract
Вирус Вакцинии (VACV) сыграл важную роль в искоренении вируса вариолы (VARV), возбудителя оспы, от природы. С момента своего первого использования в качестве вакцины, VACV был разработан в качестве переносчика терапевтических вакцин и в качестве онколитического вируса. Эти приложения используют легко управляемый геном VACV и широкий диапазон хост в качестве выдающейся платформы для создания рекомбинантных вирусов с различными терапевтическими приложениями. Для создания рекомбинантного VACV было разработано несколько методов, включая методы выбора маркеров и переходный доминирующий выбор. Здесь мы представляем уточнение метода выбора диапазона хоста в сочетании с визуальной идентификацией рекомбинантных вирусов. Наш метод использует селективное давление, генерируемое принимающей противовирусной протеиной киназы R (PKR) в сочетании с флуоресцентным геном синтеза, выражающим mCherry-tagged E3L, один из двух антагонистов VACV PKR. Кассета, включая интересуемый ген и слияние mCherry-E3L, окружена последовательностями, полученными из генома VACV. Между геном интереса и mCherry-E3L находится меньшая область, идентичная первым нуклеотидам 3' руки, чтобы способствовать гомологионной рекомбинации и потере гена mCherry-E3L после отбора. Мы демонстрируем, что этот метод позволяет эффективное, бесшовное генерации rVACV в различных типах клеток, не требуя отбора лекарств или тщательного скрининга на вирусы-мутанты.
Introduction
Вирус Ваккиния (VACV) сыграл важную роль в первом успешном искоренении патогена человека, вируса вариолы (VARV), от природы. С момента уничтожения вируса вариолы, поксвирусы, включая VACV, продолжают быть полезными терапевтическими вирусами как для медицины человека, так и для животных. Например, вакцина против бешенства на основе VACV была очень эффективной в предотвращении передачи сильватического бешенства в Европе1 и Соединенных Штатах2. Совсем недавно, рекомбинантные поксвирусы, выражающие различные противоопухолевые молекулы (например, одноцепные антитела или человеческий эритропоэтин) видели обнадеживающий успех, как онколитические агенты3,4,5. VACV особенно привлекателен в качестве вектора, потому что он легко поддается генетическим манипуляциям, обладает широким диапазоном хостов, и он стабилен в различных условиях, что позволяет легко транспортировать и жизнеспособность вакцины в поле6,7. Хотя было разработано несколько методов для создания рекомбинантных VACV для лабораторных экспериментов и создания вакцин, нынешние стратегии создания этих вирусов имеют заметные ограничения.
Из-за полезности VACV, несколько стратегий для создания рекомбинантных вирусов были разработаны. Первая стратегия использует гомологию рекомбинации для введения кассеты, включая трансген и выбираемый ген маркера, такой как ген устойчивости к антибиотикам. Кассета окружена двумя нуклеотидами (nt) или более крупными руками, направляющими ген к определенному участку в вирусном геноме, который затем прочно интегрируется двойными событиями кроссовера8,,9,,10. Эта стратегия является быстрой и эффективной; однако, это приводит к дополнительному генетическому материалу в виде гена маркера, который может привести к неожиданным эффектам. Кроме того, существует практический верхний предел числа трансгенов, который может быть введен ограниченным числом уникальных доступных маркеров. Переходный доминирующий выбор (TDS) стратегии рассмотрели этот вопрос путем облегчения генерации "безшрамов" рекомбинантных вирусов11. Используя эту стратегию, плазмида, содержащая мутантный ген VACV и выбираемый ген маркера, интегрирована в вирусный геном, но без дополнительного флангового ДНК VACV. Такой подход приводит к переходной интеграции всей плазмиды и дублированию гена VACV в результате интеграции одним событием кроссовера. Этот промежуточный является стабильным до тех пор, пока он поддерживается под давлением отбора, что позволяет обогащать эту конструкцию. При удалении выбора дублирование VACV позволяет второе событие кроссовера, что приводит к удалению плазмиды и последующему образованию либо дикого типа (WT) или рекомбинантного вируса в приблизительном соотношении 50:50. В то время как TDS генерирует рекомбинантные вирусы, не требуя стабильного внедрения чужеродных ДНК, несколько клонов вирусов должны быть проверены на ожидаемую мутацию путем секвенирования анализа, потенциально отнимающего много времени и дорогостоящий шаг.
Здесь мы представляем подход к генерации рекомбинантных поксвирусов, сочетающих лучшие аспекты каждого из этих подходов, похожий на подход, который был описан для репликации некомпетентных модифицированных vaccinia Анкара12,13,14. Эта стратегия сочетает в себе визуальный выбор диапазона и диапазона хоста для быстрого генерации рекомбинантных вирусов путем двойного кроссовера событий, а затем устранить выбираемый ген маркера гомологической рекомбинации. Такой подход позволяет быстрое поколение мутантов, опосредованное гомологичным рекомбинацией, с "безшрамным" характером подходов TDS, не требуя при этом последующего этапа скрининга для различения вирусов дикого типа и мутантов. Наш метод также использует выбор диапазона хоста вместо выбора антибиотиков, устраняя риск химически индуцированных фенотипических изменений в клеточной линии. Для этого подхода мы решили использовать противовирусную протеину киназы R (PKR) в качестве селективного агента для создания рекомбинантного VACV. PKR выражается как неактивный мономер в большинстве типов клеток15. При связывании двухцепочечной РНК (dsRNA) в N-терминалd dsRNA-связывающих доменов, PKR димеризирует и аутофосфорилируется16. Эта активная форма PKR фосфорилаты альфа-субъединицу эукариотического фактора инициации 2 (eIF2), в конечном счете, препятствуя доставке инициатора метионил-ТРНА к рибосоме, тем самым предотвращая внутриклеточный перевод и широко препятствуя репликации многих вирусных семейст. 17,18.
В ответ на широкую и мощную противовирусную активность PKR, многие вирусы разработали по крайней мере одну стратегию для предотвращения активации PKR. Большинство поксвирусов выражают два антагониста PKR, кодируемого генами E3L и K3L в VACV, которые антагонизируют PKR через два различных механизма19. E3 предотвращает гомемеризацию PKR путем связывания двухцепочечной РНК20,21, в то время как K3 действует как ингибитор псевдосубстрата, связывая непосредственно с активированным PKR и тем самым препятствуя взаимодействию с его субстратом eIF2 '22. Важно отметить, что эти два антагонистов PKR не обязательно подавляют PKR от всех видов. Например, Гомолог K3 от вируса овцеводческой оспы сильно ингибирует PKR от овец, в то время как овчарка E3 омолог не показал значительного торможения PKR23,24. В этом исследовании мы представляем метод использования PKR-опосредованного селективного давления в сочетании с выбором флуоресценции для создания рекомбинантного VACV, удаленного для E3L и K3L (VC-R4), который не может реплицироваться в компетентных клетках PKR, полученных из различных видов. Этот рекомбинантный вирус обеспечивает отличный фон для быстрого поколения рекомбинантных вирусов, выражающих гены под контролем родного E3L-промоутера.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Создание вектор рекомбинации
- Дизайн грунтовки для создания выбора кассеты. Дизайн каждого отдельного амплекона с перекрывающимися последовательностями с соседними амплеонами и вектором для облегчения изетермальной ферментативной сборки молекул ДНК, также называемой гибсон сборки, используя любой из нескольких онлайн грунтовые инструменты дизайна.
ПРИМЕЧАНИЕ: Этот протокол также может быть завершен с использованием традиционных методов клонирования на основе ограничения. В этом случае проектные праймеры с соответствующими местами ограничения, а не с перекрывающимися последовательностями. - Используя грунтовки, разработанные в шаге 1.1, ПЦР усиливают следующие элементы в порядке от 5' до 3'(Рисунок 1):500 нуклеотидов геномной области VACV 5' E3L (5' рука), EGFP или ген интереса, 150 нуклеотидов из геномной области VACV сразу 3' E3L (короткая 3' рука), синтетический ранний/поздний предостереженный промоутер25, ген синтеза mCherry-E3L и 500 нуклеотидов из геномной области VACV 3' E3L, включая короткую 3' руку (длинная 3' рука).
- В трубке ПЦР добавьте реагенты в следующем порядке для каждого ампликона: 17 л свободной воды DNase, 1,2 л каждой грунтовки (начальная концентрация - 10 мкм, окончательная концентрация 0,5 мкм), 5 л 5-x пЦР-буфера реакции, шаблон ДНК (10 нг для амплидонов, усиленных плазмидами: EGFP и E/L промоутер-mCherry-E3L кассета; 100 нг для ампликонов, усиленных из вирусной геномной ДНК: 5' и 3'рукоятки) и 0,5 л ДНК полимера. Отрегулируйте объем добавленной воды для окончательного объема реакции 50 Зл.
ПРИМЕЧАНИЕ: Концентрация ДНК шаблона должна быть эмпирически определена, но мы обычно начинаем с 10 нг/реакции. - Поместите трубку (ы) в термоциклер, и растопить ДНК на 98 градусов по Цельсию в течение 30 с, а затем использовать 25 раундов трехступенчатого протокола ПЦР: 98 градусов по Цельсию для 5 с, 55 градусов по Цельсию для 10 с, и 72 C в течение 1 мин.
ПРИМЕЧАНИЕ: Определите температуру плавления на основе предложенного производителем ТМ для каждого набора грунтовки. Определить соответствующее время продления на основе длины каждого амблона (1 минута/кб).
- В трубке ПЦР добавьте реагенты в следующем порядке для каждого ампликона: 17 л свободной воды DNase, 1,2 л каждой грунтовки (начальная концентрация - 10 мкм, окончательная концентрация 0,5 мкм), 5 л 5-x пЦР-буфера реакции, шаблон ДНК (10 нг для амплидонов, усиленных плазмидами: EGFP и E/L промоутер-mCherry-E3L кассета; 100 нг для ампликонов, усиленных из вирусной геномной ДНК: 5' и 3'рукоятки) и 0,5 л ДНК полимера. Отрегулируйте объем добавленной воды для окончательного объема реакции 50 Зл.
- Визуализируйте продукты усиления на 1% агарозный гель. Добавьте 10 кЛ каждого продукта ДНК и 2 л погрузочного буфера к каждой скважине, и бегите на уровне 8 В/см в течение 1 ч.
- Гель очищает каждый ампромсон с помощью комплекта для извлечения геля ДНК и протокола производителя. Выясните ампликоны из колонны, добавив 50 зл DNase свободной воды и сразу же центрифугирования.
- Линейная линия pUC19 клонирования вектор с помощью EcoRI эндонуклеазы пищеварения. В трубку добавьте 1 мкг pUC19, воды в объеме 17 Л, 2 л реакционного буфера и 1 кЛ (20 единиц) EcoRI. Инкубировать при 37 градусах по Цельсию на 1 ч.
- Визуализируйте продукты усиления на 1% агарозный гель работать на 8 V/cm в течение 1 ч. Акциз полосы из геля, и очистить продукт с помощью комплекта экстракта геля ДНК, как описано в шаге 1.4.
- Ligate все отдельные, гель очищенных ампликонов и линейный вектор с помощью комплекта мастер смеси.
- К трубке ПЦР добавьте 0,2 моль линейного pUC19 и каждый ампликон (5' рука, EGFP, короткая 3' рука, E/L промоутер-mCherry-E3L кассета, 3'рука). Добавьте воду dNase free в окончательный объем в 10 зл, а затем добавьте 10 кЛ мастер-микса сборки ДНК. Инкубировать образцы при 50 градусах по Цельсию на 1 ч.
- Преобразуйте химически компетентную кишечную палочку с 2 зл и собранным продуктом со ступени 1.6, как уже говорилосьранее, 26,,27. Плита 100 л transformed клеток на пластинах агарозы LB, содержащей 100 мкг/мл ампициллин. Инкубировать тарелки на ночь при 37 градусах Цельсия.
- Выберите хорошо изолированные колонии и перенесите отдельные колонии в трубки, содержащие бульон Лурии с 100 мкг/мл ампициллин. Инкубировать трубки на ночь при 37 градусах Цельсия при встряхивании при 225 об/мин.
- Изолировать плазмиды от ночной культуры с помощью плазмидного мини-комплекта. Проверьте концентрацию и чистоту ДНК с помощью спектрофотометра. Соотношение A260/A280 между 1,8 и 2,0 приемлемо.
- Отправить плазмиды для секвенирования Сэнгера, чтобы определить, является ли желаемый продукт клонирования правильным. Храните ДНК при -20 градусах Цельсия.
2. Генерация рекомбинантного вируса
- Заразить сопливый монослой подходящих клеток с вирусом, который будет рекомбинированным при многообразии инфекции 1,0 (MOI No 1.0) в 6-хорошей пластине. Инкубировать инфицированные клетки при 37 градусах Цельсия и 5% CO2 на 1 ч. Затем аспирируйте среду и заменить его свежим DMEM. Инкубировать инфицированные клетки при 37 градусах Цельсия и 5% CO2.
ПРИМЕЧАНИЕ: Для репликации компетентных вирусов, таких как вирус вакцины, который не хватает K3L22, клеточной линии, такие как европейская линия клеток кролика почки RK13 (ATCC #CCL-37) или BSC-40 является целесообразным. Однако для репликации дефицитных вирусов, таких как вирус, описанный в этой работе, не хватает как PKR антагонистов E3L и K3L, дополняющая клеточная линия, выражающая эти два гена в транс или PKR нокдаун или нокаут клетки не требуется. - Трансфект инфицированных клеток с 500 нг вектора, генерируемых и проверенных в шаге 1.10 с использованием коммерчески доступного трансфекционного реагента в соответствии с протоколом производителя. Инкубировать клетки при 37 градусах Цельсия и 5% CO2 на 48 ч.
ПРИМЕЧАНИЕ: При использовании вируса вакциноза не хватает как E3L и K3L, PKR-опосредованного селективного давления будет стимулировать выбор рекомбинированных вирусов и поддерживать экспрессию белка синтеза mCherry-E3L в этих клетках. При желании, она также должна быть возможность ПЦР усилить только вставку для использования для трансфекции вместо всей плазмиды. - 48 часов после инфекции, урожай инфицированных монослой. В некоторых случаях, клетки могут быть собраны путем pipetting, но если они по-прежнему плотно придерживаются, урожай их с помощью клеточного скребок. Заморозить-оттепель клетки три раза, а затем sonicate lysates в течение 15 с при 50% амплитуды. Храните этот лизат при -80 градусов до готовности к использованию.
- Последовательно 10 раз разбавить лисат, собранный в шаге 2,3 от 10-1 до 10-6, добавив 120 л лисата до 1080 л DMEM (10-1), а затем добавить 120 л этого разбавления до 1080 л DMEM (10-2), и повторение этого в четыре раза. Добавьте 1 мл каждого разбавления к отдельному, сольствуя хорошо PKR компетентной клеточной линии, в данном случае клетки RK13.
- Инкубировать инфицированные клетки при 37 градусах Цельсия и 5% CO2 на 1 ч. Затем аспирировать среду и заменить его свежим DMEM инкубировать инфицированных клеток при 37 градусах Цельсия и 5% CO2.
- От 24 до 48 часов после инфекции, выявление рекомбинантных вирусов с помощью флуоресценционной микроскопии. Таблички от рекомбинантных вирусов выражают красную флуоресценцию из-за интеграции гена синтеза mCherry-E3L(рисунок 2). Если вирус, лишенный ингибиторов PKR был использован первоначально, все бляшки будут содержать рекомбинантный вирус.
- Бляшки очищают рекомбинантные вирусы три раза на клетках RK13. После заключительного раунда очистки бляшек, все бляшки должны выразить красную флуоресценцию.
- Заразите конное 6-ну хорошо пластины КЛЕТОк RK13, выражающие ингибиторы VACV PKR E3L и K3L (RK13-E3L-K3L клетки28) с зубной налет-очищенный красный флуоресценции вируса от шага 2.6. Цель для примерно 50-100 бляшек на скважину.
ПРИМЕЧАНИЕ: Эти клетки обеспечивают ANtagonists VACV PKR в транс и облегчить PKR-опосредованного селективного давления для поддержания мЧерри-E3L синтеза гена, тем самым способствуя "безшрамов" поколения рекомбинантного вируса. - Определите разрушаемые вирусы с помощью флуоресценции с помощью микроскопа EVOS2 и кубика фильтра GFP (Excitation: 470/22, Излучение: 525/50) и кубик фильтра RFP (Возбуждение: 531/40, Выброс: 593/40).
ПРИМЕЧАНИЕ: Частота, с которой теряется ген синтеза mCherry-E3L, составляет примерно 2,5%(таблица 2). Если EGFP не включен в качестве гена маркера, бляшки от мутантных вирусов, которые потеряли ген синтеза mCherry-E3L, будут бесцветными. - Табличка очищает только зеленый (VC-R4) или бесцветные бляшки (E3L) три раза на клетках RK13-E3L-K3L. Убедитесь, что никакие бляшки не флуоресцирует красный цвет.
- Подтвердите потерю mCherry-E3L и наличие ожидаемой мутации пЦР и секвенированием Sanger.
ПРИМЕЧАНИЕ: Если ген или мутация интереса не имеет PKR ингибирующей активности, рекомбинантные вирусы должны быть выращены на RK13'E3L-K3L клеток или эквивалентНых PKR-ингибируется или PKR недостаточной клеточной линии (Рисунок 3).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Мы использовали процедуру диаграммы на рисунке 1 для создания VACV не хватает как PKR антагонистов E3L и K3L, заменив E3L с EGFP в вирус, уже удалены для K3L (vP872). На рисунке 2 показаны красные флуоресцентные бляшки в компетентных клетках PKR RK13, свидетельствующая о вирусной экспрессии mCherry-E3L, а также EGFP, выраженной в клетках RK13-E3L-K3L, подтверждающих потерю E3L и коллапс маркера отбора mCherry-E3L. Рисунок 3 подтверждает, что этот рекомбинантный вирус, VC-R4, не хватает обоих антагонистов PKR не может реплицировать в PKR компетентных клеток RK13, в то время как родительский вирус, vP872, выражающий E3L, является репликации компетентным. Чтобы подтвердить, что эта неспособность размножаться в клетках RK13 была только из-за потери E3L, мы заменили EGFP в VC-R4 на E3L, чтобы создать ревертантный вирус с помощью того же протокола отбора. Рисунок 3 также подтверждает, что этот ревертантный вирус реплицируется так же эффективно, как vP872 в клетках RK13. Интересно, что бесцветные бляшки, согласующиеся с коллапсом маркера выбора mCherry-E3L, были выявлены до отбора в клетках RK13-E3-K3, которые, как правило, необходимы для выбора "безшрамов" рекомбинантов, вероятно, из-за расширенной последовательности между кассетой рекомбинации mCherry-E3L и геном E3L, вставленным в VC-R4. Таким образом, чтобы определить эффективность рекомбинации и скорость коллапса мы решили производить вирусы, выражающие освирус PKR антагонист K3L, чтобы избежать проблемы раннего краха23. Рисунок 4 указывает на появление бесцветных бляшек (наконечников стрел) после заражения клетками RK13-E3L-K3L. Таблица 1 показывает результаты трех независимых экспериментов, где в среднем 12,6% потомственных вирионов подверглись рекомбинации с трансинфицированной плазмидой, аналогичноранее ранее заявленным частотам29,,30,31. В таблице 2 подробно описана частота бесцветных бляшек по отношению к общим бляшкам в клетках RK13-E3L-K3L, демонстрирующая скорость коллапса и потери маркера отбора mCherry-E3L, произошедших с частотой около 1,8%.
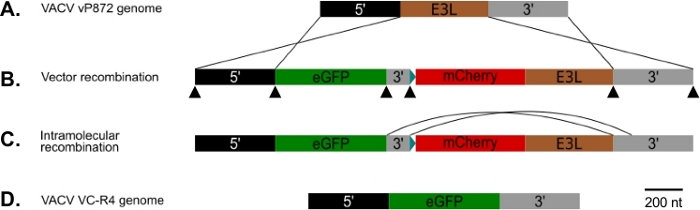
Рисунок 1: Диаграмма p837-GOI-mCherry-E3L, а также стратегия рекомбинации хоста и визуальной рекомбинации. (A)рука 5' (черная) и 3' рука (серый) фланг E3L локус (коричневый) в VACV. (B) В p837-GOI-mCherry-E3L, эти руки фланг кассеты, содержащей ген интереса (GOI), в данном случае EGFP, (зеленый) отделены от mCherry-E3L (красный) синтез ген под контролем синтетического раннего / латого поксвируса промоутер25 синий) на короткий 3 ' руку (серый). Эти внешние руки диск гомологичные рекомбинации между VACV и p837-GOI-mCherry-E3L. Черные наконечники стрел указывают на места перекрывающихся грунтовок, используемых для создания этой плазмиды клонированием Гибсона. (C) Когда PKR селективное давление удаляется, вирусы, которые подверглись внутримолекулярной рекомбинации между короткими и длинными 3 ' руки могут быть выбраны. (D) В результате вирус (VC-R4), содержащий только ген интереса в локусЕ E3L. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Флуоресцентные микрографы (вверху) рекомбинантного вируса бляшки через 24 часа после рекомбинации с p837-GOI-mCherry-E3L, выражающие как mCherry (слева), так и EGFP (справа) в клетках RK13. (Внизу) Я не против. Микрограф рекомбинантного вируса налета через 48 часов после того, как при посредничестве ПКР селективное давление было удалено в клетках RK13, выражая EGFP (справа), но не mCherry (слева). Панель масштаба указывает 650 мкм для всех панелей. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
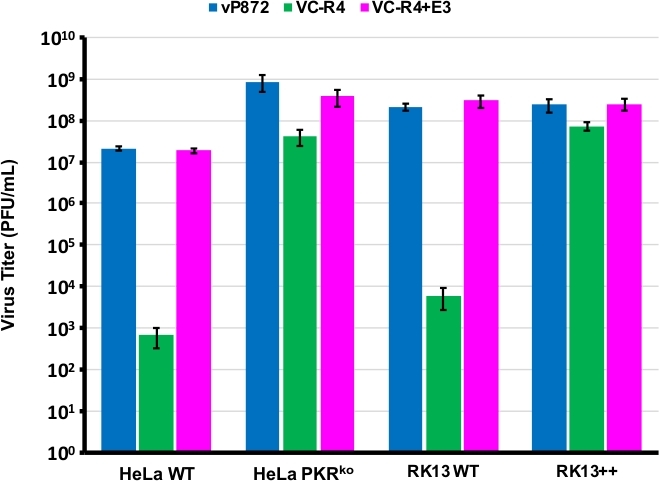
Рисунок 3: VC-R4 не может реплицироваться в компетентных камерах PKR. Указанные клеточные линии были заражены vP872 (синий), VC-R4 (зеленый), или VC-R4-E3L (магента) в МВД 0,1. 48 часов после инфицирования инфицированные клетки были собраны и тизерированы путем последовательного разбавления на клетках RK13-E3L-K3L. Титеры регистрируются в PFU/mL, бары ошибок представляют собой стандартное отклонение трех повторных экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Потеря экспрессии mCherry-E3L в клетках RK13-E3L-K3L. Наложение флуоресцентных и фазовых контрастных микрографов VC-R4-K3L-mCherry-E3L заразило клетки РК13-E3L-K3L. Три таблички больше не выражают mCherry (круги) из-за коллапса кассы выбора, уступающей VC-R4-K3L. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Эксперимент 1 | Эксперимент 2 | Эксперимент 3 | |
| Красные таблички (RK13) | 30 | 11 | 18 |
| Всего бляшек (RK13-E3L-K3L) | 225 | 64 | 249 |
| Коэффициент рекомбинации | 13.30% | 17.20% | 7.20% |
Таблица 1: Частота рекомбинации VACV с плазмидом p837-K3L-mCherry-E3L.
| Эксперимент 1 | Эксперимент 2 | Эксперимент 3 | |
| Всего бляшек (RK13-E3L-K3L) | 115 | 44 | 210 |
| Бесцветные бляшки (RK13-E3L-K3L) | 3 | 1 | 1 |
| Коэффициент рекомбинации | 2.60% | 2.30% | 0.50% |
Таблица 2: Частота потери mCherry-E3L от VC-R4-K3L-mCherry-E3L в rk13-E3-K3 ячеек.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Здесь мы представляем вариации переходного маркера стратегии выбора 32 для создания рекомбинантных вирусов vaccinia без сохранения чужеродных ДНК в окончательном рекомбинантный вирус. Наша стратегия использует селективное давление при посредничестве принимающей противовирусный белок PKR, а не другие формы селективного давления, такие как антибиотики. Использование противовирусных генов хозяина исключает возможность химически индуцированных фенотипических изменений в клетках или повышенного риска мутации из-за отбора препаратов. Кроме того, в отличие от отбора лекарств, нет фазы отставания для нашего подхода, потому что PKR выражается составно во всех клетках. Вторичный визуальный отбор на основе экспрессии mCherry также улучшает специфичность этого метода, гарантируя, что только бляшки, выражающие трансген, выбираются на первом этапе, и одинаково эффективны в качестве отрицательного селективного маркера при выборе зрелых рекомбинантных вирусов, которые потеряли ген mCherry-E3L.
Наиболее важными шагами для этой стратегии рекомбинации являются генерация соответствующего вектора рекомбинации и соответствующее очищение бляшек для обеспечения того, чтобы выбранный вирус был клональным. В этой статье мы предлагаем "Гибсон сборки" для создания рекомбинации вектор. Эта стратегия чрезвычайно эффективна и позволяет сборку всех фрагментов, включающих вектор рекомбинации в течение одного дня. Однако, поскольку короткая 3' рука и длинная 3' рука имеют одинаковые последовательности, эти фрагменты имеют потенциал, чтобы быть объединены во время реакции клонирования, и некоторые векторы не могут содержать кассету mCherry-E3L. По нашему опыту это редко, но подтверждение структуры вектора после клонирования необходимо. Мы также создали рекомбинации векторов для этой стратегии, используя традиционные методы эндонуклеазы и лигаза. Эта стратегия позволяет избежать проблемы, описанной выше, но может быть более трудоемким. Очистка бляшек, как правило, проста и в первую очередь зависит от использования соответствующих разрешительных клеток для первоначальной рекомбинации, PKR-компетентных клеток для первоначальной очистки бляшек, чтобы гарантировать, что только рекомбинантные вирусы могут размножаться, а затем разрешительные клетки снова для облегчения внутримолекулярной рекомбинации и потери выбора маркера. Поэтому для успешного и эффективного применения этой стратегии крайне важно уделять пристальное внимание клеточным линиям.
В этом исследовании мы демонстрируем использование этого метода для создания рекомбинантного VACV, удаленного как для антагонистов PKR E3L и K3L, так и выражающих EGFP под контролем промоутера E3L. В дальнейшем, этот вирус будет служить эффективным фоном для будущих рекомбинантных вирусов, так как он не способен размножаться в PKR компетентных клеток. Таким образом, будет сильное PKR-опосредованного селективного давления, чтобы диск mCherry-E3L рекомбинации кассеты в потомство virions в то же время существенно предотвращения репликации нерекомбинантного вируса. Кроме того, потеря EGFP путем поглощения рекомбинации кассеты является полезным вторичным маркером отбора для обеспечения выбрали бляшки не совместно инфицированы нерекомбинантным вирусом. Мы наблюдали темпы рекомбинации в соответствии с ранее сообщалось ставки для VACV, но визуальные флуоресцентные маркеры повысить эффективность генерации рекомбинантных вирусов, гарантируя, что увеличение вероятности того, что соответствующие рекомбинантные вирусы выбраны. Наше наблюдение бесцветных бляшек после двух раундов отбора на PKR-компетентных клеток, предположительно из-за увеличения длины идентичной последовательности между E3L и мЧерри-E3L маркер гена, предполагает, что скорость потери mCherry-E3L может быть "настроена" за счет увеличения или уменьшения длины 3' короткой руки. Основным ограничением этого метода является использование PKR в качестве селективного давления для рекомбинантов. Наиболее эффективное использование этой стратегии рекомбинации является генерация этих вирусов в фоновом режиме не хватает антагонистов PKR. Тем не менее, маркер колористового отбора позволяет использовать эту стратегию рекомбинации даже без выбора, опосредованного PKR, просто налетом, очищающим mCherry-выражения бляшек. В то время как отсутствие PKR-опосредованного селективного давления снизит эффективность первого шага скрининга, процент mCherry выражая бляшки все еще достаточно высок, что цвет основе отбора является жизнеспособным. Таким образом, этот метод может быть использован для вставки практически любого гена в геном поксвируса.
Как показано на вставке EGFP, с этим подходом, любой ген может быть быстро вставлен в локус E3L под контролем родного промоутера, при условии, что PKR нулевые клетки или комплименты клеточных линий используются для экспериментов вниз по течению, если трансген не является антагонистом PKR. Эта стратегия, в сочетании с вирусом VC-R4, о который мы сообщаем здесь, добавляет новый и мощный метод для быстрого и надежного генерации рекомбинантных вирусов vaccinia с использованием при посредничестве хозяина селективного давления и визуальной идентификации рекомбинантов в начале процесса.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не заявляют о каких-либо конкурирующих финансовых интересах.
Acknowledgments
Этот проект был профинансирован Национальными институтами здравоохранения (AI114851) в СР.
Materials
| Name | Company | Catalog Number | Comments |
| 2X-Q5 Master Mix | NEB | M0492L | High-fidelity polymerase used in PCR |
| Ampicillin | ThermoFisher Scientific | 11593027 | Bacterial selective agent |
| Disposable Cell Scrapers | ThermoFisher Scientific | 08-100-242 | Cell scraper to harvest infected cells |
| EVOS FL Auto 2 Cell imaging system | ThermoFisher Scientific | AMAFD2000 | Fluorescent microscope |
| EVOS Light Cube, GFP | ThermoFisher | AMEP4651 | GFP Cube |
| EVOS Light Cube, RFP | ThermoFisher | AMEP4652 | RFP Cube |
| GenJet | SignaGen Laboratories | SL100489 | Transfection reagent |
| Luria Bertani (LB) Broth | Gibco | 10855021 | Bacterial growth medium |
| Monarch DNA gel extraction kit | NEB | T1020L | Gel purification kit used to purify amplicons and linearized vectors |
| Monarch Plasmid Miniprep kit | NEB | T1010L | Miniprep kit ussed to purify plasmids |
| NanoDrop One | ThermoFisher Scientific | ND-ONE-W | Spectrophotometer used to measure RNA and DNA concentration |
| NEBuilder Master Mix | NEB | E2621L | Isothermal enzymatic assembly kit used to generate the recombination vector |
| Q500 Sonicator | Qsonica | Q500-110 | Sonicator for virus lysates |
| RK13 cells | ATCC | CCL-37 | Rabbit kidney cells |
| VWR Multiwell Cell Culture plates | VWR | 10062-892 | Cell culture plates |
References
- Brochier, B., et al. Large-scale eradication of rabies using recombinant vaccinia-rabies vaccine. Nature. 354 (6354), 520-522 (1991).
- Pastoret, P. P., Brochier, B. The development and use of a vaccinia-rabies recombinant oral vaccine for the control of wildlife rabies; a link between Jenner and Pasteur. Epidemiology and Infection. 116 (3), 235-240 (1996).
- Chan, W. M., McFadden, G. Oncolytic Poxviruses. Annual review of virology. 1 (1), 119-141 (2014).
- Nguyen, D. H., et al. Vaccinia virus-mediated expression of human erythropoietin in tumors enhances virotherapy and alleviates cancer-related anemia in mice. Molecular Therapy. 21 (11), 2054-2062 (2013).
- Frentzen, A., et al. Anti-VEGF single-chain antibody GLAF-1 encoded by oncolytic vaccinia virus significantly enhances antitumor therapy. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12915-12920 (2009).
- Pastoret, P. P., Vanderplasschen, A. Poxviruses as vaccine vectors. Comparative Immunology, Microbiology and Infectious Diseases. 26 (5-6), 343-355 (2003).
- COLLIER, L. H. The development of a stable smallpox vaccine. The Journal of Hygiene. 53 (1), 76-101 (1955).
- Weir, J. P., Bajszár, G., Moss, B. Mapping of the vaccinia virus thymidine kinase gene by marker rescue and by cell-free translation of selected mRNA. Proceedings of the National Academy of Sciences of the United States of America. 79 (4), 1210-1214 (1982).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus: a selectable eukaryotic cloning and expression vector. Proceedings of the National Academy of Sciences of the United States of America. 79 (23), 7415-7419 (1982).
- Nakano, E., Panicali, D., Paoletti, E. Molecular genetics of vaccinia virus: demonstration of marker rescue. Proceedings of the National Academy of Sciences of the United States of America. 79 (5), 1593-1596 (1982).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. Journal of Virology. 64 (6), 3108-3111 (1990).
- Staib, C., Drexler, I., Ohlmann, M., Wintersperger, S., Erfle, V., Sutter, G. Transient Host Range Selection for Genetic Engineering of Modified Vaccinia Virus Ankara. BioTechniques. 28 (6), 1137-1148 (2000).
- Staib, C., Drexler, I., Sutter, G. Construction and Isolation of Recombinant MVA. Vaccinia Virus and Poxvirology. , 77-99 (2004).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Pfaller, C. K., Li, Z., George, C. X., Samuel, C. E. Protein kinase PKR and RNA adenosine deaminase ADAR1: New roles for old players as modulators of the interferon response. Current Opinion in Immunology. 23 (5), 573-582 (2011).
- Bevilacqua, P. C., George, C. X., Samuel, C. E., Cech, T. R. Binding of the protein kinase PKR to RNAs with secondary structure defects: Role of the tandem A - G mismatch and noncontigous helixes. Biochemistry. 37 (18), 6303-6316 (1998).
- Krishnamoorthy, T., Pavitt, G. D., Zhang, F., Dever, T. E., Hinnebusch, A. G. Tight Binding of the Phosphorylated Subunit of Initiation Factor 2 (eIF2) to the Regulatory Subunits of Guanine Nucleotide Exchange Factor eIF2B Is Required for Inhibition of Translation Initiation. Molecular and Cellular Biology. 21 (15), 5018-5030 (2001).
- Rothenburg, S., Georgiadis, M. M., Wek, R. C. Evolution of eIF2α kinases: Adapting translational control to diverse stresses. Evolution of the Protein Synthesis Machinery and Its Regulation. , 235-260 (2016).
- Bratke, K. A., McLysaght, A., Rothenburg, S. A survey of host range genes in poxvirus genomes. Infection, Genetics and Evolution. 14, 406-425 (2013).
- Chang, H. W., Watson, J. C., Jacobs, B. L. The E3L gene of vaccinia virus encodes an inhibitor of the interferon-induced, double-stranded RNA-dependent protein kinase. Proceedings of the National Academy of Sciences. 89 (11), 4825-4829 (1992).
- Romano, P. R., et al. Inhibition of double-stranded RNA-dependent protein kinase PKR by vaccinia virus E3: role of complex formation and the E3 N-terminal domain. Molecular and Cellular Biology. 18 (12), 7304-7316 (1998).
- Beattie, E., Tartaglia, J., Paoletti, E. Vaccinia virus-encoded eIF-2 alpha homolog abrogates the antiviral effect of interferon. Virology. 183 (1), 419-422 (1991).
- Park, C., Peng, C., Brennan, G., Rothenburg, S. Species-specific inhibition of antiviral protein kinase R by capripoxviruses and vaccinia virus. Annals of the New York Academy of Sciences. 1438 (1), 18-29 (2019).
- Rothenburg, S., Brennan, G. Species-Specific Host-Virus Interactions: Implications for Viral Host Range and Virulence. Trends in Microbiology. , (2019).
- Chakrabarti, S., Sisler, J. R., Moss, B. Compact, synthetic, vaccinia virus early/late promoter for protein expression. BioTechniques. 23 (6), 1094-1097 (1997).
- Chung, C. T., Niemela, S. L., Miller, R. H. One-step preparation of competent Escherichia coli: Transformation and storage of bacterial cells in the same solution (recombinant DNA). Biochemistry. 86, 2172-2175 (1989).
- Chung, C. T., Miller, R. H. Preparation and storage of competent Escherichia coli cells. Methods in Enzymology. 218, 621-627 (1993).
- Rahman, M. M., Liu, J., Chan, W. M., Rothenburg, S., McFadden, G. Myxoma Virus Protein M029 Is a Dual Function Immunomodulator that Inhibits PKR and Also Conscripts RHA/DHX9 to Promote Expanded Host Tropism and Viral Replication. PLOS Pathogens. 9 (7), 1003465 (2013).
- Evans, D. H., Stuart, D., McFadden, G. High levels of genetic recombination among cotransfected plasmid DNAs in poxvirus-infected mammalian cells. Journal of Virology. 62 (2), 367-375 (1988).
- Ball, L. A. High-frequency homologous recombination in vaccinia virus DNA. Journal of Virology. 61 (6), 1788-1795 (1987).
- Spyropoulos, D. D., Roberts, B. E., Panicali, D. L., Cohen, L. K. Delineation of the viral products of recombination in vaccinia virus-infected cells. Journal of Virology. 62 (3), 1046-1054 (1988).
- Liu, L., et al. Transient dominant host-range selection using Chinese hamster ovary cells to generate marker-free recombinant viral vectors from vaccinia virus. BioTechniques. 62 (4), 183-187 (2017).



