Summary
Detta är en metod för att generera "scarless" rekombinanta vaccinia virus med värd-range urval och visuell identifiering av rekombinanta virus.
Abstract
Vacciniavirus (VACV) bidrog till att utrota variolavirus (VARV), orsaksmedlet för smittkoppor, från naturen. Sedan den första användningen som vaccin har VACV utvecklats som en vektor för terapeutiska vacciner och som ett onkolytiskt virus. Dessa applikationer dra nytta av VACV: s lätt manipulerade arvsmassa och breda värdsortiment som en enastående plattform för att generera rekombinanta virus med en mängd olika terapeutiska tillämpningar. Flera metoder har utvecklats för att generera rekombinant VACV, inklusive markörvalsmetoder och övergående dominerande urval. Här presenterar vi en förfining av en värd intervall urvalsmetod tillsammans med visuell identifiering av rekombinanta virus. Vår metod drar nytta av selektivt tryck som genereras av värdantivirala proteinkinas R (PKR) tillsammans med en fluorescerande fusion gen som uttrycker mCherry-märktA E3L, en av två VACV PKR antagonister. Kassetten, inklusive genen av intresse och mCherry-E3L fusion flankeras av sekvenser som härrör från VACV-genomet. Mellan genen av intresse och mCherry-E3L är en mindre region som är identisk med de första ~150 nukleotider av 3' arm, för att främja homolog rekombination och förlust av mCherry-E3L genen efter urval. Vi visar att denna metod tillåter effektiv, sömlös generering av rVACV i en mängd olika celltyper utan att kräva läkemedelsval eller omfattande screening för muterade virus.
Introduction
Vaccinia virus (VACV) var avgörande för den första framgångsrika utrotningen av en mänsklig patogen, variola virus (VARV), från naturen. Ända sedan utrotningen av variolavirus har poxvirus inklusive VACV fortsatt att vara användbara terapeutiska virus för både human- och djurmedicin. Ett VACV-baserat rabiesvirusvaccin har till exempel varit mycket effektivt för att förhindra överföring av sylvatiska rabies i Europa1 ochUSA 2. På senare tid har rekombinanta poxvirus som uttrycker en mängd olika antitumörmolekyler (t.ex. enarmade antikroppar eller humana erytropoietin) sett uppmuntrande framgång som onkolytiska medel3,4,5. VACV är särskilt attraktiv som en vektor eftersom det är lätt mottagliga för genetisk manipulation, har ett brett värdområde, och det är stabilt under en mängd olika förhållanden, vilket möjliggör enkel transport och vaccin lönsamhet i fält6,7. Medan flera tekniker har utvecklats för att generera rekombinanta VACV för laboratorieexperiment och vaccin generation, nuvarande strategier för att generera dessa virus har anmärkningsvärda begränsningar.
På grund av nyttan av VACV, flera strategier för att generera rekombinanta virus har utvecklats. Den första strategin använder homolog rekombination för att införa en kassett inklusive transgen och en valbar markör gen som en antibiotikaresistens gen. Kassetten flankeras av två ~500 nukleotider (nt) eller större armar som leder genen till en specifik plats i det virala genomet, som sedan är stabilt integrerad av dubbla crossover händelser8,9,10. Denna strategi är snabb och effektiv. Det resulterar dock i extra genetiskt material i form av markörgenen som kan ge oväntade effekter. Dessutom finns det en praktisk övre gräns för antalet transgener som kan införas begränsas av antalet unika valbara markörer tillgängliga. Övergående dominerande urval (TDS) strategier har tagit upp denna fråga genom att underlätta uppkomsten av "ärrlösa" rekombinanta virus11. Med hjälp av denna strategi integreras en plasmid som innehåller en mutant VACV-gen och en valbar markörgen i virusgenomet, men utan ytterligare flankerande VACV DNA. Detta tillvägagångssätt resulterar i övergående integration av hela plasmid och dubblering av VACV genen som ett resultat av integration av en enda crossover händelse. Denna mellanprodukt är stabil så länge den bibehålls under urvalstryck, vilket möjliggör anrikning av denna konstruktion. När markeringen tas bort möjliggör VACV-dubbelarbete en andra crossover-händelse som resulterar i att plasmid och efterföljande bildning av antingen vildtyp (wt) eller rekombinant virus tas bort i ett ungefärligt 50:50-förhållande. Medan TDS genererar rekombinanta virus utan att kräva en stabil introduktion av främmande DNA, multipel virus kloner måste screenas för den förväntade mutationen genom sekvensering analys, en potentiellt tidskrävande och kostsamma steg.
Här presenterar vi en metod för att generera rekombinanta poxvirus som kombinerar de bästa aspekterna av var och en av dessa metoder, liknande en metod som har beskrivits för replikering inkompetenta modifierade vaccinia Ankara12,13,14. Denna strategi kombinerar visuella och värd intervall urval för att snabbt generera rekombinanta virus genom dubbel crossover händelser, och därefter eliminera valbara markör genen genom homolog rekombination. Detta tillvägagångssätt möjliggör snabb generation av mutanter medierad av homolog rekombination, med "scarless" karaktär TDS metoder, utan att kräva en efterföljande screening steg för att skilja vild typ och mutantvirus. Vår metod använder också värdområde urval i stället för antibiotika urval, vilket eliminerar risken för kemiskt inducerad fenotypiska förändringar i cellinjen. För detta tillvägagångssätt har vi valt att använda värdantivirala proteinkinas R (PKR) som selektivt medel för att generera rekombinant VACV. PKR uttrycks som inaktiv monomer i de flesta celltyper15. Vid bindning av dubbelsträngat RNA (dsRNA) vid N-terminal dsRNA-bindningsdomänerna, dimerizes PKR och är autofosforylerad16. Denna aktiva form av PKR fosforylerar alfa underenheten i eukaryota initieringsfaktor 2 (eIF2), slutligen hämma leverans av initiator metionyl-tRNA till ribosomen, vilket förhindrar intracellulär översättning och i stort sett hämmar replikationen av många virusfamiljer17,18.
Som svar på den breda och potenta antivirala aktiviteten hos PKR har många virus utvecklats med minst en strategi för att förhindra PKR-aktivering. De flesta poxviruses uttrycker två PKR-antagonister, kodade av E3L- och K3L-generna i VACV, som retar upp PKR genom två olika mekanismer19. E3 förhindrar PKR-homodimerisering genom att binda dubbelsträngad RNA20,21, medan K3 fungerar som en pseudosubstratehämmare genom att binda direkt till aktiverad PKR och därigenom hämma interaktionen med dess substrat eIF2α22. Viktigt är att dessa två PKR-antagonister inte nödvändigtvis hämmar PKR från alla arter. Till exempel hämmade K3-homologen från fårkoppsviruset PKR starkt från får, medan fårkopps-E3-homologen inte visade någon större PKR-hämning23,24. I denna studie presenterar vi en metod för att använda PKR-medierat selektivt tryck kombinerat med fluorescensval för att generera en VACV-rekombinant som tagits bort för E3L och K3L (VC-R4), som inte kan replikeras i PKR kompetenta celler som härrör från olika arter. Detta rekombinanta virus ger en utmärkt bakgrund för snabb generation av rekombinanta virus som uttrycker gener under kontroll av den infödda E3L promotorn.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Generera rekombinationsvektorn
- Designa primers för att generera valkassetten. Design varje enskild amplicon med överlappande sekvenser med angränsande amplicons och vektorn för att underlätta isotermisk enzymatisk montering av DNA-molekyler, även kallad Gibson församling, med hjälp av någon av flera online primer designverktyg.
Obs: Detta protokoll kan också fyllas i med traditionella begränsning endonuclease-baserade kloningsmetoder. I så fall utforma primers med lämpliga begränsning platser snarare än med överlappande sekvenser. - Med hjälp av de grundfärger som utformats i steg 1.1 förstärker PCR följande element för att från 5' till 3' (figur 1): ~500 nukleotider i VACV-genomiska regionen 5' i E3L (5' arm), EGFP eller den gen av intresse, ~150 nukleotider från VACV genomiska regionen omedelbart 3' av E3L (kort 3' arm), en syntetisk tidig/sen poxvirus promotor25, mCherry-E3L fusion gen, och ~ 500 nukleotider från VACVic regionen 3 'av E3L inklusive den korta 3' armen (lång 3' arm).
- Tillsätt reagenserna i följande ordning för varje amplicon i ett PCR-rör: 17 μl DNase fritt vatten, 1,2 μl av varje grundfärg (initial koncentration = 10 μM, Slutlig koncentration = 0,5 μM), 5 μL 5x PCR-reaktionsbuffert, mall-DNA (10 ng för amplicons som förstärks från plasmider: EGFP och E/L promotorn-mCherry-E3L kassett; 100 ng för ampliconer som förstärks av viralgenomiskt DNA: 5' och 3' armar) och 0,5 μL DNA-polymeras. Justera den tillsatta vattenvolymen för en slutlig reaktionsvolym på 50 μL.
OBS: Koncentrationen av mall DNA bör empiriskt fastställas, men vi börjar i allmänhet med 10 ng/reaktion. - Placera rören i en termocyklar och smält DNA:t vid 98 °C i 30 s och använd sedan 25 omgångar av ett pcr-protokoll i tre steg: 98 °C för 5 s, 55 °C i 10 s och 72 °C i 1 min.
OBS: Bestäm smälttemperaturen baserat på tillverkarens föreslagna Tm för varje primeruppsättning. Bestäm lämplig förlängningstid baserat på längden på varje amplicon (1 minut/kb).
- Tillsätt reagenserna i följande ordning för varje amplicon i ett PCR-rör: 17 μl DNase fritt vatten, 1,2 μl av varje grundfärg (initial koncentration = 10 μM, Slutlig koncentration = 0,5 μM), 5 μL 5x PCR-reaktionsbuffert, mall-DNA (10 ng för amplicons som förstärks från plasmider: EGFP och E/L promotorn-mCherry-E3L kassett; 100 ng för ampliconer som förstärks av viralgenomiskt DNA: 5' och 3' armar) och 0,5 μL DNA-polymeras. Justera den tillsatta vattenvolymen för en slutlig reaktionsvolym på 50 μL.
- Visualisera förstärkningsprodukterna på en 1% agarosgel. Tillsätt 10 μl av varje DNA-produkt och 2 μl lastbuffert till varje brunn och kör vid 8 V/cm i 1 h.
- Gel rena varje amplicon med hjälp av en DNA gel extraktionssats och tillverkarens protokoll. Äckla ampliconsna från kolonnen, genom att tillfoga 50 μL av DNase fritt bevattnar och omgående centrifuging.
- Linjärisera pUC19 kloning vektor med EcoRI endonuclease matsmältningen. Tillsätt 1 μg pUC19 till ett rör, vatten till en volym av 17 μL, 2 L reaktionsbuffert och 1 μL (20 enheter) EcoRI. Inkubera vid 37 °C i 1 h.
- Visualisera amplifieringsprodukterna på en 1% agarosgel som körs vid 8 V/cm i 1 h. Punktskatter på bandet från gelen och rena produkten med hjälp av DNA-gelextraktionssatsen enligt beskrivningen i steg 1.4.
- Ligate alla enskilda, gel renade amplicons och den linjära vektorn med hjälp av en master mix kit.
- Tillsätt 0,2 pmol linjär pUC19 och varje amplicon (5' arm, EGFP, kort 3'-arm, E/L-promotor-mCherry-E3L kassett, 3'arm) i ett PCR-rör. Tillsätt DNase fritt vatten till en slutvolym på 10 μL och tillsätt sedan 10 μL DNA-monteringsmasterblandning. Inkubera prover vid 50 °C i 1 h.
- Omvandla kemiskt kompetent E. coli med 2 μL av den monterade produkten från steg 1.6 enligt tidigare beskrivna26,,27. Platta 100 μL av de transformerade cellerna på LB-agarosplattor som innehåller 100 μg/ml ampicillin. Inkubera plattorna över natten vid 37 °C.
- Välj välisolerade kolonier och överför enskilda kolonier till rör som innehåller Luria buljong med 100 μg/ml ampicillin. Inkubera rören över natten vid 37 °C medan du skakar vid 225 varv/min.
- Isolera plasmiderna från natten kulturen med hjälp av en plasmid miniprep kit. Kontrollera DNA:s koncentration och renhet med hjälp av en spektrofotometer. Ett A260/A280-förhållande mellan 1,8 och 2,0 är godtagbart.
- Skicka plasmider för Sanger sekvensering för att avgöra om den önskade kloningsprodukten är korrekt. Förvara DNA:t vid -20 °C.
2. Generera det rekombinanta viruset
- Infektera en konfluent monolayer av lämpliga celler med det virus som ska recombined vid en multiplicity av infektion av 1.0 (MOI = 1.0) i en 6-brunnsplatta. Inkubera de infekterade cellerna vid 37 °C och 5% CO2 för 1 h. Sug sedan på mediet och byt ut det mot färsk DMEM. Inkubera de infekterade cellerna vid 37 °C och 5 % CO2.
OBS: För replikationsfunktionsvirus som vacciniavirus som saknar K3L22är en cellinje som europeisk kaninjurecelllinje RK13 (ATCC #CCL-37) eller BSC-40 lämplig. Men för replikering bristfälliga virus, såsom det virus som beskrivs i detta dokument saknar både PKR antagonister E3L och K3L, en kompletterande cellinje som uttrycker dessa två gener i trans eller PKR knock-down eller knock-out celler krävs. - Transfektera de infekterade cellerna med 500 ng av vektorn som genereras och valideras i steg 1.10 med hjälp av en kommersiellt tillgänglig transfsektionsreagens enligt tillverkarens protokoll. Inkubera cellerna vid 37 °C och 5% CO2 för 48 timmar.
OBS: Om du använder ett vacciniavirus som saknar både E3L och K3L, kommer PKR-medierat selektivt tryck att driva val av rekombinerade virus och bibehålla uttrycket av fusionsproteinet mCherry-E3L i dessa celler. Om så önskas bör det också vara möjligt att PCR förstärka endast insatsen att använda för transfection istället för hela plasmid. - 48 timmar efter infektion, skörda den infekterade monolayer. I vissa fall kan cellerna skördas genom pipettering, men om de fortfarande är tätt vidhäftade, skörda dem med en cellskrapa. Frys-tina cellerna tre gånger, och sedan sonicate lysates för 15 s vid 50% amplitud. Förvara denna lysate på -80 °C tills den är klar att användas.
- Seriellt 10-faldig späd lysate skördas i steg 2.3 från 10-1 till 10-6 genom att lägga till 120 μL av lysate till 1080 μ 10-1 ML av DMEM (10-1 ) och sedan tillsätta 120 μL av denna utspädning till 1080 μl DMEM (10-2) och upprepa denna process fyra gånger till.-1 Tillsätt 1 ml av varje utspädning till en enskild, konfluent brunn av en PKR behörig cellinje, i detta fall RK13 celler.
- Inkubera de infekterade cellerna vid 37 °C och 5% CO2 för 1 h. Sug sedan på mediet och byt ut det mot färska DMEM Inkubera de infekterade cellerna vid 37 °C och 5% CO2.
- 24 till 48 timmar efter infektion, identifiera rekombinanta virus genom fluorescensmikroskopi. Plack från rekombinanta virus uttrycker röd fluorescens på grund av integration av fusiongenen mCherry-E3L (figur 2). Om ett virus som saknar PKR-hämmare användes initialt, kommer alla plack innehålla rekombinant virus.
- Plaketten renar rekombinanta virus tre gånger på RK13-celler. Efter den sista omgången av plackrening bör alla plack uttrycka röd fluorescens.
- Infektera en konfluent 6-brunnsplatta med RK13-celler som uttrycker VACV PKR-hämmarna E3L och K3L (RK13+E3L+K3L-celler28) med det plackrenade röda fluorescerande viruset från steg 2.6. Sikta på ca 50-100 plack per brunn.
OBS: Dessa celler ger VACV PKR antagonister i trans och lindra PKR-medierad selektivt tryck för att upprätthålla mCherry-E3L fusion genen, vilket främjar "ärrfri" generation av rekombinant virus. - Identifiera kollapsade virus genom fluorescensmikroskopi med hjälp av ett EVOS2-mikroskop och en GFP-filterkub (Excitering: 470/22, Emission: 525/50) och en RFP-filterkub (Excitation: 531/40, Emission: 593/40).
OBS: Den frekvens med vilken fusionsgenen mCherry-E3L går förlorad är cirka 2,5 % (tabell 2). Om EGFP inte ingår som en markör gen, plack från muterade virus som har förlorat mCherry-E3L fusion genen kommer att vara färglös. - Plaketten renar endast grön (VC-R4) eller färglösa plack (E3L) tre gånger på RK13+E3L+K3L-celler. Se till att inga plack fluorescerar rött.
- Bekräfta förlusten av mCherry-E3L och förekomsten av den förväntade mutationen av PCR och Sanger sekvensering.
OBS: Om den gener eller mutation av intresse inte har PKR-hämmande aktivitet, måste rekombinanta virus odlas på RK13+E3L+K3L-celler eller en likvärdig PKR-hämmad eller PKR-brist cellinje (figur 3).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vi använde förfarandet diagram i figur 1 för att generera en VACV saknar både PKR antagonister E3L och K3L, genom att ersätta E3L med EGFP i ett virus som redan tagits ut för K3L (vP872). Figur 2 visar röda fluorescerande plack i PKR-behöriga RK13-celler som tyder på viralt uttryck för mCherry-E3L, samt EGFP uttryckt i RK13+E3L+K3L-celler som bekräftar förlusten av E3L och kollaps av urvalsmarkören mCherry-E3L. Figur 3 bekräftar att detta rekombinanta virus, VC-R4, som saknar båda PKR-antagonisterna inte kan replikeras i PKR-behöriga RK13-celler, medan det överordnade viruset, vP872 som uttrycker E3L, är replikerings behörig. För att bekräfta att denna oförmåga att replikera i RK13 celler berodde endast på förlust av E3L, ersatte vi EGFP i VC-R4 med E3L, att generera en revertant virus med samma urvalsprotokoll. Figur 3 bekräftar också att detta återåtata virus replikerar lika effektivt som vP872 i RK13-celler. Intressant nog identifierades färglösa plack som överensstämmer med kollapsen av valet mCherry-E3L före valet i RK13+E3+K3-celler som i allmänhet krävs för att välja "ärrlösa" rekombinanter, sannolikt på grund av den utökade sekvensidentiteten mellan mCherry-E3L-rekombinationskassetten och E3L-genen som sätts in i VC-R4. Därför, för att bestämma effektiviteten av rekombination och graden av kollaps vi valt att producera virus som uttrycker poxvirus PKR antagonist K3L för att undvika problemet med tidig kollaps23. Figur 4 anger utseendet på färglösa plack (pilspetsar) efter infektion av RK13+E3L+K3L-celler. Tabell 1 visar resultaten av tre oberoende experiment, där i genomsnitt 12,6 % av avkomman hade genomgått rekombination med den transfected plasmid, liknande tidigare rapporterade frekvenser29,,30,31. Tabell 2 beskriver frekvensen av färglösa plack i förhållande till totala plack i RK13+E3L+K3L celler, visar graden av kollaps och förlust av mCherry-E3L urvalsmarkör inträffade med en frekvens av cirka 1,8%.
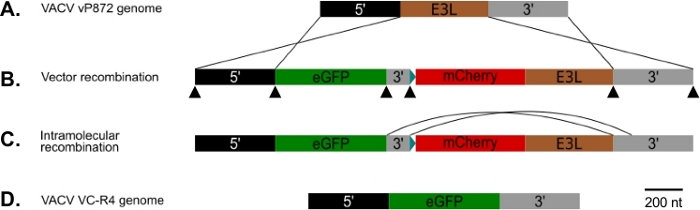
Figur 1: Diagram över p837-GOI-mCherry-E3L samt host-range och visuell rekombination strategi. (A)5' arm (svart) och 3' arm (grå) flank E3L locus (brun) i VACV. (B)I p837-GOI-mCherry-E3L flankerar dessa armar en kassett som innehåller den gen av intresse (GOI), i detta fall EGFP, (grön) separerad från en mCherry-E3L (röd) fusionsgen under kontroll av den syntetiska tidiga/sena poxviruspromotorn25 blå) med en kort 3-arm (grå). Dessa yttre armar kör homolog rekombination mellan VACV och p837-GOI-mCherry-E3L. Svarta pilspetsar anger platserna för de överlappande grundfärger som används för att generera denna plasmid av Gibson kloning. (C)När PKR selektivt tryck avlägsnas kan virus som har genomgått intramolekylär rekombination mellan de korta och långa 3'-armarna väljas. (D)Resulterar i ett virus (VC-R4) som endast innehåller den gen som är av intresse för E3L locus. Klicka här för att se en större version av denna siffra.

Figur 2: Fluorescerande mikrografer av (överst) en rekombinant virusplack 24 timmar efter rekombination med p837-GOI-mCherry-E3L som uttrycker både mCherry (vänster) och EGFP (höger) i RK13-celler. -Jag vet inte vad du ska ta dig till. Micrograph av en rekombinant virusplack 48 timmar efter PKR-medierad selektivt tryck har tagits bort i RK13 ++ celler, uttrycker EGFP (höger) men inte mCherry (vänster). Skallisten anger 650 μm för alla paneler. Klicka här för att se en större version av denna siffra.
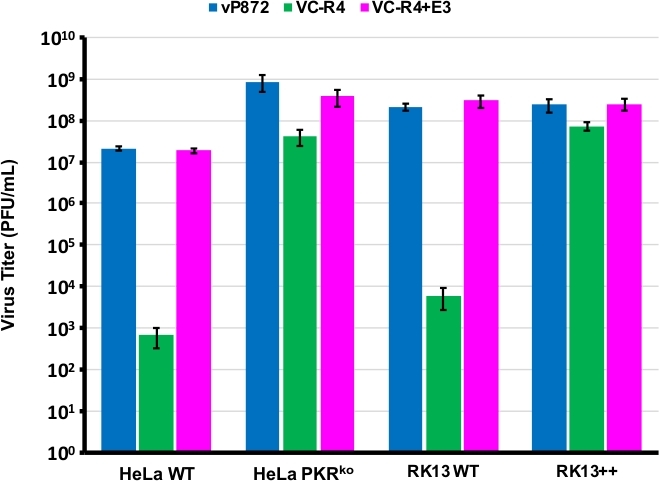
Figur 3: VC-R4 kan inte replikeras i PKR-behöriga celler. De angivna cellinjerna var infekterade med vP872 (blå), VC-R4 (grön) eller VC-R4+E3L (magenta) vid MOI = 0,1. 48 timmar efter infektion de infekterade cellerna skördades och titered av seriell utspädning på RK13+E3L+K3L celler. Titrar rapporteras i PFU/mL, felstaplar representerar standardavvikelsen för tre replikerade experiment. Klicka här för att se en större version av denna siffra.

Figur 4: Förlust av mCherry-E3L-uttryck i RK13+E3L+K3L-celler. Överlagring av fluorescerande och faskontrastmikrografer av VC-R4+K3L-mCherry-E3L infekterade RK13+E3L+K3L-celler. Tre plaketter uttrycker inte längre mCherry (cirklar) på grund av kollaps av valet kassetten ger VC-R4 + K3L. Klicka här för att se en större version av denna siffra.
| Experiment 1 | Experiment 2 | Experiment 3 | |
| Röda plack (RK13) | 30 | 11 | 18 |
| Totalt plack (RK13+E3L+K3L) | 225 | 64 | 249 |
| Rekombinationshastighet | 13.30% | 17.20% | 7.20% |
Tabell 1: Rekombinationsfrekvens för VACV med p837-K3L-mCherry-E3L plasmid.
| Experiment 1 | Experiment 2 | Experiment 3 | |
| Totalt plack (RK13+E3L+K3L) | 115 | 44 | 210 |
| Färglösa plack (RK13+E3L+K3L) | 3 | 1 | 1 |
| Rekombinationshastighet | 2.60% | 2.30% | 0.50% |
Tabell 2: Frekvens av mCherry-E3L förlust från VC-R4+K3L-mCherry-E3L i RK13+E3+K3 celler.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Här presenterar vi en variant av en övergående markör urvalsstrategi 32 för att generera rekombinanta vaccinia virus utan att behålla utländska DNA i den slutliga rekombinanta virus. Vår strategi använder selektivt tryck medierat av värdantivirala proteinet PKR snarare än andra former av selektivt tryck som antibiotika. Användningen av hostantivirala gener eliminerar risken för kemiskt inducerade fenotypiska förändringar i cellerna, eller ökad risk för mutation på grund av urvalsläkemedel. Dessutom, till skillnad från med läkemedelsval, finns det ingen fördröjningsfas för vår strategi, eftersom PKR uttrycks konstituerande i alla celler. Sekundärt visuellt urval baserat på mCherry-uttryck förbättrar också specificiteten hos denna metod genom att se till att endast plack som uttrycker transgenen plockas under den första fasen, och är lika effektiv som en negativ selektiv markör samtidigt som man väljer mogna rekombinanta virus som har förlorat genen mCherry-E3L.
De mest kritiska stegen för denna rekombinationsstrategi är genereringen av lämplig rekombinationsvektor och lämplig plackrening för att säkerställa att det valda viruset är klonalt. I detta dokument föreslår vi "Gibson församling" för att generera rekombination vektor. Denna strategi är extremt effektiv och möjliggör montering av alla fragment som består av rekombinationsvektorn på en enda dag. Men eftersom den korta 3" armen och den långa 3" arm delar identiska sekvenser, dessa fragment har potential att förenas under kloning reaktion, och vissa vektorer får inte innehålla mCherry-E3L kassett. Enligt vår erfarenhet är detta sällsynt, men bekräftar strukturen hos vektorn efter kloning är nödvändigt. Vi har också genererat rekombinationsvektorer för denna strategi med traditionella endonuclease- och ligasemetoder. Denna strategi undviker problemet som beskrivs ovan men kan vara mer arbetsintensiva. Plackrening är i allmänhet enkel och är i första hand beroende av att använda lämpliga tillåtande celler för den initiala rekombinationen, PKR-kompetenta celler för initial plackrening för att säkerställa att endast rekombinanta virus kan replikera, och sedan tillåtande celler igen för att underlätta intramolekylär rekombination och förlust av den valbara markören. Stor uppmärksamhet på cellinjer är därför avgörande för en framgångsrik och effektiv tillämpning av denna strategi.
I denna studie visar vi användningen av denna metod för att generera en VACV rekombinant bort för både PKR antagonister E3L och K3L och uttrycka EGFP under kontroll av E3L promotorn. Framöver kommer detta virus att fungera som en effektiv bakgrund för framtida rekombinanta virus, eftersom det är oförmöget att replikera i PKR kompetenta celler. Därför kommer det att finnas starka PKR-medierad selektivt tryck för att driva mCherry-E3L rekombination kassett i avkomma vinrions samtidigt i huvudsak förhindra replikering av icke-rekombinanta virus. Dessutom är förlusten av EGFP genom upptag av rekombinationskassetten en användbar sekundär valmarkör för att säkerställa att plockade plack inte är samtidiga infekterade med ett icke-rekombinant virus. Vi observerade frekvenser av rekombination överensstämmer med tidigare rapporterade priser för VACV, men de visuella fluorescerande markörer öka effektiviteten i att generera rekombinanta virus genom att säkerställa att öka sannolikheten för att lämpliga rekombinanta virus väljs. Vår observation av färglösa plack efter två omgångar av urval på PKR-kompetenta celler, förmodligen på grund av den ökade längden på identiska sekvens mellan E3L och mCherry-E3L markör genen, tyder på att graden av mCherry-E3L förlust kan "trimmas" genom att öka eller minska längden på 3 korta arm. Den primära begränsningen av denna teknik är användningen av PKR som selektivt tryck för rekombinanter. Den mest effektiva användningen av denna rekombinationsstrategi genererar dessa virus i en bakgrund som saknar PKR-antagonister. Men den kolorimetriska urvalsmarkören gör att denna rekombinationsstrategi kan användas även utan valet medierad av PKR, helt enkelt genom plackrening mCherry-uttryckande plack. Även om bristen på PKR-medierad selektivt tryck kommer att minska effektiviteten i det första screeningsteget, är andelen mCherry som uttrycker plack fortfarande tillräckligt hög för att färgbaserat urval är lönsamt. Således kan denna metod användas för att infoga nästan vilken gen som helst i poxvirusgenomet.
Som framgår av införandet av EGFP, med detta tillvägagångssätt, kan varje gen snabbt införas i E3L locus under kontroll av den inhemska promotorn, förutsatt att PKR null-celler eller komplimang cellinjer används för nedströms experiment om transgenen inte är en PKR antagonist. Denna strategi, i kombination med VC-R4 virus som vi rapporterar här, lägger till en ny och potent metod för att snabbt och tillförlitligt generera rekombinanta vaccinia virus med hjälp av värd-medierad selektivt tryck och visuell identifiering av rekombinanter tidigt i processen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar inga konkurrerande ekonomiska intressen.
Acknowledgments
Detta projekt finansierades av National Institutes of Health (AI114851) till SR.
Materials
| Name | Company | Catalog Number | Comments |
| 2X-Q5 Master Mix | NEB | M0492L | High-fidelity polymerase used in PCR |
| Ampicillin | ThermoFisher Scientific | 11593027 | Bacterial selective agent |
| Disposable Cell Scrapers | ThermoFisher Scientific | 08-100-242 | Cell scraper to harvest infected cells |
| EVOS FL Auto 2 Cell imaging system | ThermoFisher Scientific | AMAFD2000 | Fluorescent microscope |
| EVOS Light Cube, GFP | ThermoFisher | AMEP4651 | GFP Cube |
| EVOS Light Cube, RFP | ThermoFisher | AMEP4652 | RFP Cube |
| GenJet | SignaGen Laboratories | SL100489 | Transfection reagent |
| Luria Bertani (LB) Broth | Gibco | 10855021 | Bacterial growth medium |
| Monarch DNA gel extraction kit | NEB | T1020L | Gel purification kit used to purify amplicons and linearized vectors |
| Monarch Plasmid Miniprep kit | NEB | T1010L | Miniprep kit ussed to purify plasmids |
| NanoDrop One | ThermoFisher Scientific | ND-ONE-W | Spectrophotometer used to measure RNA and DNA concentration |
| NEBuilder Master Mix | NEB | E2621L | Isothermal enzymatic assembly kit used to generate the recombination vector |
| Q500 Sonicator | Qsonica | Q500-110 | Sonicator for virus lysates |
| RK13 cells | ATCC | CCL-37 | Rabbit kidney cells |
| VWR Multiwell Cell Culture plates | VWR | 10062-892 | Cell culture plates |
References
- Brochier, B., et al. Large-scale eradication of rabies using recombinant vaccinia-rabies vaccine. Nature. 354 (6354), 520-522 (1991).
- Pastoret, P. P., Brochier, B. The development and use of a vaccinia-rabies recombinant oral vaccine for the control of wildlife rabies; a link between Jenner and Pasteur. Epidemiology and Infection. 116 (3), 235-240 (1996).
- Chan, W. M., McFadden, G. Oncolytic Poxviruses. Annual review of virology. 1 (1), 119-141 (2014).
- Nguyen, D. H., et al. Vaccinia virus-mediated expression of human erythropoietin in tumors enhances virotherapy and alleviates cancer-related anemia in mice. Molecular Therapy. 21 (11), 2054-2062 (2013).
- Frentzen, A., et al. Anti-VEGF single-chain antibody GLAF-1 encoded by oncolytic vaccinia virus significantly enhances antitumor therapy. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12915-12920 (2009).
- Pastoret, P. P., Vanderplasschen, A. Poxviruses as vaccine vectors. Comparative Immunology, Microbiology and Infectious Diseases. 26 (5-6), 343-355 (2003).
- COLLIER, L. H. The development of a stable smallpox vaccine. The Journal of Hygiene. 53 (1), 76-101 (1955).
- Weir, J. P., Bajszár, G., Moss, B. Mapping of the vaccinia virus thymidine kinase gene by marker rescue and by cell-free translation of selected mRNA. Proceedings of the National Academy of Sciences of the United States of America. 79 (4), 1210-1214 (1982).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus: a selectable eukaryotic cloning and expression vector. Proceedings of the National Academy of Sciences of the United States of America. 79 (23), 7415-7419 (1982).
- Nakano, E., Panicali, D., Paoletti, E. Molecular genetics of vaccinia virus: demonstration of marker rescue. Proceedings of the National Academy of Sciences of the United States of America. 79 (5), 1593-1596 (1982).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. Journal of Virology. 64 (6), 3108-3111 (1990).
- Staib, C., Drexler, I., Ohlmann, M., Wintersperger, S., Erfle, V., Sutter, G. Transient Host Range Selection for Genetic Engineering of Modified Vaccinia Virus Ankara. BioTechniques. 28 (6), 1137-1148 (2000).
- Staib, C., Drexler, I., Sutter, G. Construction and Isolation of Recombinant MVA. Vaccinia Virus and Poxvirology. , 77-99 (2004).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Pfaller, C. K., Li, Z., George, C. X., Samuel, C. E. Protein kinase PKR and RNA adenosine deaminase ADAR1: New roles for old players as modulators of the interferon response. Current Opinion in Immunology. 23 (5), 573-582 (2011).
- Bevilacqua, P. C., George, C. X., Samuel, C. E., Cech, T. R. Binding of the protein kinase PKR to RNAs with secondary structure defects: Role of the tandem A - G mismatch and noncontigous helixes. Biochemistry. 37 (18), 6303-6316 (1998).
- Krishnamoorthy, T., Pavitt, G. D., Zhang, F., Dever, T. E., Hinnebusch, A. G. Tight Binding of the Phosphorylated Subunit of Initiation Factor 2 (eIF2) to the Regulatory Subunits of Guanine Nucleotide Exchange Factor eIF2B Is Required for Inhibition of Translation Initiation. Molecular and Cellular Biology. 21 (15), 5018-5030 (2001).
- Rothenburg, S., Georgiadis, M. M., Wek, R. C. Evolution of eIF2α kinases: Adapting translational control to diverse stresses. Evolution of the Protein Synthesis Machinery and Its Regulation. , 235-260 (2016).
- Bratke, K. A., McLysaght, A., Rothenburg, S. A survey of host range genes in poxvirus genomes. Infection, Genetics and Evolution. 14, 406-425 (2013).
- Chang, H. W., Watson, J. C., Jacobs, B. L. The E3L gene of vaccinia virus encodes an inhibitor of the interferon-induced, double-stranded RNA-dependent protein kinase. Proceedings of the National Academy of Sciences. 89 (11), 4825-4829 (1992).
- Romano, P. R., et al. Inhibition of double-stranded RNA-dependent protein kinase PKR by vaccinia virus E3: role of complex formation and the E3 N-terminal domain. Molecular and Cellular Biology. 18 (12), 7304-7316 (1998).
- Beattie, E., Tartaglia, J., Paoletti, E. Vaccinia virus-encoded eIF-2 alpha homolog abrogates the antiviral effect of interferon. Virology. 183 (1), 419-422 (1991).
- Park, C., Peng, C., Brennan, G., Rothenburg, S. Species-specific inhibition of antiviral protein kinase R by capripoxviruses and vaccinia virus. Annals of the New York Academy of Sciences. 1438 (1), 18-29 (2019).
- Rothenburg, S., Brennan, G. Species-Specific Host-Virus Interactions: Implications for Viral Host Range and Virulence. Trends in Microbiology. , (2019).
- Chakrabarti, S., Sisler, J. R., Moss, B. Compact, synthetic, vaccinia virus early/late promoter for protein expression. BioTechniques. 23 (6), 1094-1097 (1997).
- Chung, C. T., Niemela, S. L., Miller, R. H. One-step preparation of competent Escherichia coli: Transformation and storage of bacterial cells in the same solution (recombinant DNA). Biochemistry. 86, 2172-2175 (1989).
- Chung, C. T., Miller, R. H. Preparation and storage of competent Escherichia coli cells. Methods in Enzymology. 218, 621-627 (1993).
- Rahman, M. M., Liu, J., Chan, W. M., Rothenburg, S., McFadden, G. Myxoma Virus Protein M029 Is a Dual Function Immunomodulator that Inhibits PKR and Also Conscripts RHA/DHX9 to Promote Expanded Host Tropism and Viral Replication. PLOS Pathogens. 9 (7), 1003465 (2013).
- Evans, D. H., Stuart, D., McFadden, G. High levels of genetic recombination among cotransfected plasmid DNAs in poxvirus-infected mammalian cells. Journal of Virology. 62 (2), 367-375 (1988).
- Ball, L. A. High-frequency homologous recombination in vaccinia virus DNA. Journal of Virology. 61 (6), 1788-1795 (1987).
- Spyropoulos, D. D., Roberts, B. E., Panicali, D. L., Cohen, L. K. Delineation of the viral products of recombination in vaccinia virus-infected cells. Journal of Virology. 62 (3), 1046-1054 (1988).
- Liu, L., et al. Transient dominant host-range selection using Chinese hamster ovary cells to generate marker-free recombinant viral vectors from vaccinia virus. BioTechniques. 62 (4), 183-187 (2017).



