Summary
גישות קיימות לבניית אלקטרודות שרוול עצב היקפי מושתלים באופן כרוני לשימוש מכרסמים קטנים דורשים לעתים קרובות ציוד מיוחד ו/או כוח אדם מיומן. בפרוטוקול זה אנו מדגימים גישה פשוטה בעלות נמוכה לזיוף אלקטרודות שרוול מושתלות כרונית, ולהפגין את יעילותם לגירוי עצבי vagus (VNS) בחולדות.
Abstract
אלקטרודות שרוול עצב היקפי שימשו זמן רב במדעי המוח ובתחומים הקשורים לגירוי של, למשל, vagus או עצבים ירך. מספר מחקרים שנעשו לאחרונה הראו את היעילות של VNS כרוני בשיפור פלסטיות מערכת העצבים המרכזית כדי לשפר את השיקום המוטורי, למידה הכחדה, ואפליה חושית. בניית מכשירים מושתלים כרונית לשימוש במחקרים כאלה היא מאתגרת בשל גודלם הקטן של חולדות, פרוטוקולים טיפוסיים דורשים הכשרה נרחבת של כוח אדם ושיטות microfabrication גוזל זמן. לחלופין, אלקטרודות שרוול מושתלים זמינים מסחרית ניתן לרכוש בעלות גבוהה יותר באופן משמעותי. בפרוטוקול זה, אנו מציגים שיטה פשוטה בעלות נמוכה לבניית אלקטרודות קטנות, מושתלות באופן כרוני לשרוול ים היקפי לשימוש בחולדות. אנו מאמתים את האמינות לטווח הקצר והארוך של אלקטרודות השרוולים שלנו על ידי הדגמה כי VNS בחולדות מרדימים קטמין / xylazine מייצר ירידה בקצב הנשימה עולה בקנה אחד עם ההפעלה של רפלקס הינג-ברויר, הן בזמן ההשתלה ועד 10 שבועות לאחר השתלת המכשיר. אנו מדגימים עוד את התאמת אלקטרודות השרוול לשימוש במחקרי גירוי כרוני על ידי זיווג VNS עם ביצועי מכבש מנוף מיומנים כדי לגרום פלסטיות מפה קליפתית המנוע.
Introduction
לאחרונה, הביקוש אלקטרודות שרוול מושתלים כרונית לגירוי של עצבים היקפיים גדל, כמו מחקרים יותר ויותר להדגים את התועלת הקדם קלינית של טכניקה זו לטיפול במחלות דלקתיות רבות1,,2,,3 והפרעות נוירולוגיות4,,5,,6,7,,68,,9,,10,,11,,12,,13,,14,,15. VNS כרוני, למשל, כבר הראה כדי לשפר את הפלסטיות neocortical במגוון רחב של הקשרי למידה, שיפורשיקום מוטורי 4, 5,6,,7, 8,6,הכחדהלמידה 10,,11,12,13,,14, ואפליהחושית 15. אלקטרודות שרוול עצב היקפי זמין מסחרית קשורים לעתים קרובות עם זמנים ממושכים עבור מילוי הזמנה ועלויות גבוהות יחסית, אשר יכול להגביל את הנגישות שלהם. לחלופין, פרוטוקולים עבור "בתוך הבית" ייצור של אלקטרודות שרוול מושתלים כרונית נשארים מוגבלים, ואנטומיה מכרסמים מציג אתגרים מסוימים בשל גודלם הקטן. הפרוטוקולים הנוכחיים לבניית אלקטרודות שרוול לניסויים כרוניים מכרסמים לעתים קרובות דורשים שימוש בציוד וטכניקות מורכבים, כמו גם כוח אדם מאומן בהרחבה. בפרוטוקול זה, אנו מדגימים גישה פשוטה לזיוף אלקטרודה שרוול מבוסס על שיטות שפורסמו בעבר בשימושנרחב 16,,17. אנו מאמתים את הפונקציונליות של האלקטרודות המושתלות באופן כרוני שלנו בחולדות על ידי הדגמה שבזמן השתלת השרוול סביב עצב התועה של צוואר הרחם השמאלי, גירוי שהוחל על אלקטרודות השרוולים יצר בהצלחה הפסקת נשימה וירידה ב-SpO2. גירוי של סיבי vagal קולטן ריאתי א-פרנטי ידוע לעסוק רפלקס הינג-ברויר, שבו עיכוב של גרעינים נשימתיים מספר בגזע המוח גורמת השראהדיכוי 18. לכן, הפסקת הנשימה עולה בקנה אחד עם רפלקס הינג-ברויר, ואת הירידה שנוצרה ב SpO2, לספק בדיקה פשוטה עבור השתלת אלקטרודה נכונה ותפקוד השרוול בחולדות מרדים. כדי לאמת את הפונקציונליות ארוכת הטווח של אלקטרודות שרוול מושתלות כרונית, תגובות רפלקס נמדדו בזמן ההשתלה בהשוואה לתגובות שהתקבלו באותם בעלי חיים שישה שבועות לאחר ההשתלה. קבוצה שנייה של חולדות הושתלה עם אלקטרודות שרוול VNS לאחר אימון התנהגותי במשימת לחיצה על ידית. בחולדות אלה, VNS בשילוב עם ביצועי המשימה הנכונים הפיק ארגון מחדש של מפת המנוע הקליפתי, עולה בקנה אחד עם מחקריםשפורסמו בעבר 19,20,21,22. בזמן מיפוי קליפתי מוטורי תחת הרדמה, אשר התרחש 5-10 שבועות לאחר השתלת המכשיר, אנו עוד יותר מאומתים פונקציית השרוול בבעלי חיים שטופלו VNS על ידי אישור כי VNS בהצלחה גרם הפסקת נשימה וירידה של יותר מ 5% SpO2.
הפרוטוקולים שפורסמו לאחרונה מ Childs et al.17 ו Rios ואח '.16 לספק נקודת התחלה מאומתת היטב עבור גישת ייצור אלקטרודה שרוול פשוטה, כמו שיטה פופולרית זו נוצלה על ידי מעבדות מרובות ביצוע מחקרי VNSכרוניים מכרסמים 1,2,,,3,,4,,5,6,,7,,8,,9,,10,11., השיטה המקורית כוללת מספר שלבים מדויקים למניפולציה של המיקרו-חוטים העדינים, כך שזיוף האלקטרודה של השרוולים לוקח יותר משעה להשלמתו, והכשרה מקיפה לביצועים אמינים. הגישה המפשטת המתוארת כאן דורשת פחות חומרים וכלים באופן משמעותי ותוכל להשלים אותה מתוך פחות משעה על ידי כוח אדם מיומן מינימלי.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
כל ההליכים המתוארים בפרוטוקול זה מתבצעים בהתאם למדריך NIH לטיפול ולשימוש בחיות מעבדה ואושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים ושימוש של אוניברסיטת טקסס בדאלאס.
1. ייצור אלקטרודה חפתית מגרה
- הכן את צינורות האזיקים.
- בעזרת סכין גילוח, חותכים חתיכת צינורות פולימר באורך 2.5 מ"מ. הכנס טיפים מקצות או מהדק נייר דרך הצינורות והשתמש בלהב כדי להפוך חתך לאורך דרך הקיר של הצינורות בצד אחד השרוול.
- הסר את המקצות מהצינורות והכנס מחט תפירה גדולה דרך קו האמצע של השרוול, בניצב לציר הארוך. הכנס את המחט דרך החתוך (למעלה) ולתוך מרכז הצינורות ממול (למטה). מניחים את המחט בלוח הקצף כדי להצמיד את השרוול למקומו במהלך שלבי ההרכבה הנותרים.
- מניחים תפר לאבטחת סגירת חפתים במהלך ההשתלה.
- הכנס את מחט התפירה הקטנה דרך קיר השרוול, בקו האמצע, כ- 0.5 מ"מ מהחתריץ העליון בצד אחד. הכנס את המחט מבפנים החוצה כדי למנוע פגיעה בצינורות השרוולים. הכנס 2 ס"מ אורך של 6/0 תפר דרך העין של המחט ולמשוך את המחט דרך הקיר של הצינורות כדי להשחיל את התפר לתוך השרוול.
- השארת החוט במקום, להסיר את המחט לנקב חור שני דרך קיר הצינורות כ 0.5 מ"מ מתחת לחור הראשון, לאורך קו האמצע של השרוול. הכנס את התפר דרך העין של המחט ולמשוך את המחט דרך קיר הצינורות כדי להשחיל שוב את התפר דרך השרוול.
- שני הקצוות של חוט התפר צריך להיות עכשיו בצד החיצוני של השרוול. כוונן את התפר כך ש- 1.5 ס"מ מ"מ משתרע מהחור העליון, ו- 0.5 מ"מ מ"מ משתרע מהחור התחתון.
- למרוח כמות קטנה של דבק תרופה UV על הקצה הקצר של התפר המשתרע מהחור התחתון ולמשוך את קצה התפר הארוך יותר עד הזנב התחתון הוא כמעט סומק עם הקיר החיצוני של הצינורות. השתמש בשרביט UV כדי לרפא את הדבק ולהחזיק את התפר בחוזקה במקום.
- חזור על שלבים 1.2.1 עד 1.2.3 בצד השני של השרוול.
- מקם את פלטינום:אירידיום (Pt:Ir) חוט מוביל.
- השתמש במחט התפירה הקטנה כדי לעשות 4 חורים בקיר השרוול. כל זוג חורים צריך להיות ממוקם כ 0.5-0.8 מ"מ מן קו האמצע ניצב, עם חור כ 0.5-0.8 מ"מ מהדגץ העליון משני צידי השרוול.
התראה: למיקום העקבי והמדויק ביותר של הלידים, הכנס את המחט מבפנים החוצה כדי לבצע את כל החורים, תוך שימוש במיקום התפר כמדריך. - הכנס את מחט התפירה שוב, הפעם עובד מבחוץ לפנים, דרך חור עופרת 1. הכנס כ 0.5 ס"מ של 7.5 ס"מ אורך של חוט Pt:Ir דרך העין של המחט ולמשוך את המחט דרך הצינורות כדי להשחיל את העופרת חוט דרך קיר השרוול. כוונון החוט כך ~ 4.5 ס"מ משתרע בצד החיצוני של השרוול (איור 1A).
- הכנס את המחט דרך חור עופרת 1 שוב, שוב עובד מבחוץ אל פנים, ובנוסף להכניס את המחט דרך חור עופרת 2 ישירות מול חור עופרת 1. הכנס ~ 0.5 ס"מ של הקצה הקצר (פנים) של חוט Pt:Ir דרך העין של המחט ולמשוך את המחט דרך הצינורות כדי להשחיל את חוט החוט דרך קירות השרוול.
הערה: שני הקצוות של חוט Pt:Ir צריך להיות עכשיו בצד החיצוני של השרוול, ולולאת חוט נוצרת סביב הקצה החריץ ודרך חור עופרת 1(איור 1B). - חזור על שלבים 1.3.1 עד 1.3.3 כדי למקם חוט Pt:Ir דרך חורי עופרת 3 ו- 4.
- בעזרת מצית בוטאן, הסר בזהירות את הבידוד מאורך 5-6 מ"מ בסוף חוטי Pt:Ir המשתרעים מחור עופרת 2 וחור עופרת 4.
התראה: בודד את קצות הלידים משאר מכלול השרוולים בזהירות כדי למנוע פגיעה בשרוול. השתמש בכלים כדי להחזיק את החוטים כדי למנוע פציעה. - ליישר את החוט החשוף בתוך השרוול כדי למקם את הלידים במיקומם הסופי. כך, משוך בעדינות את קצה חוט Pt:Ir המשתרע מחור 1 עד שהחלק הלא מבודד של החוט סומק עם חור 1. חזור על הפעולה עם ההובלה השנייה כדי ליישר את הקצה הלא מבודד של החוט החוטחל דרך חורי עופרת 3 ו- 4.
- החל כמות קטנה של דבק תרופה UV על לולאות התיל בצד החיצוני של השרוול בחורי עופרת 1 ו 3. השתמש בשרביט UV כדי לרפא את הדבק ולאבטח את הלידים במקום.
- השתמש בקצה פיפטה קטן כדי לדחוף את חוט Pt:Ir לא מבודד מוביל אל הקיר הפנימי של השרוול. ברגע הלידים נמצאים במקום, לחתוך את הקצוות של החוטים המשתרעים מחורי עופרת 2 ו 4 כך כ 1 מ"מ של חוט משתרע מעבר החיצוני של קיר השרוול.
- מקפלים את הזנבות 1 מ"מ של התיל שטוח על פני השטח החיצוני של השרוול, דואג לא לקצר אותם יחד. למרוח כמות קטנה של דבק תרופה UV רק לכסות את שני הזנבות ולרפא את הדבק כדי להבטיח את מיקום עופרת ולספק בידוד חשמלי.
התראה: חשוב לכסות באופן מלא את משטחי Pt:Ir החשופים מבחוץ עם דבק כדי לבודד את החוטים ולהימנע מגירוי מחוץ ליעד.
- השתמש במחט התפירה הקטנה כדי לעשות 4 חורים בקיר השרוול. כל זוג חורים צריך להיות ממוקם כ 0.5-0.8 מ"מ מן קו האמצע ניצב, עם חור כ 0.5-0.8 מ"מ מהדגץ העליון משני צידי השרוול.
- אבטחו את חוט ה-Pt:Ir במקום עם אבטחת תפר.
- הסר את המחט הגדולה עם מכלול השרוולים מלוח הקצף. הכנס 3 ס"מ אורך של תפר 6/0 דרך העין של המחט ולמשוך את המחט דרך הצינורות כדי להשחיל את התפר דרך החלק התחתון של השרוול בנקודת האמצע.
- עבור למחט התפירה הקטנה כדי להשלים את השחלת התפר עבור אבטחת עופרת Pt:Ir. הכנס את המחט דרך אותו חור קו אמצע, עובד שוב מבפנים אל חוץ כדי למנוע עיוות של הצינורות ואת החוט מוביל. הכנס את הזנב החיצוני של התפר דרך העין של המחט ולמשוך את המחט דרך קיר השרוול כדי ליצור לולאה של תפר סביב קצההשרוול (איור 1C).
הערה: השתמש במכריחים ועבוד מתחת למיקרוסקופ כדי להבטיח שהתפר יהיה מונחה לאורך הציר הארוך של השרוול ושוכב שטוח כנגד הצינורות. שלב זה מבטיח את הלידים להישאר מופרדים בצד הפנימי של השרוול מוחזקים במקום לחוץ לקו האמצע השרוול. - ליצור לולאה שנייה סביב הקצה הנגדי של השרוול על ידי קשירת הקצוות של התפר בחצי קשר, בצד החיצוני של השרוול. ודא שהתפר זורם לאורך הציר הארוך של השרוול ושוכב שטוח על הצינורות. בעוד מחזיק את הקשר חזק כך שהוא שוכב שטוח נגד הצינורות, להחיל כמות קטנה של דבק תרופה UV על חצי קשר ולרפא להחזיק במקום.
- בזהירות לחתוך את הקצוות של חוט התפר קרוב ככל האפשר לקשר. במידת הצורך, השתמש בכמות קטנה של דבק תרופת UV נוסף כדי להדביק את הקצוות הקצרים של תפר כך שהם שוכבים שטוח נגדהצינורות (איור 1D).
- פיני מחבר הלחמה להפניות החוט Pt:Ir.
- באמצעות מצית בוטאן, הסר את הבידוד מ- ~ 3 מ"מ בסוף כל אחד מהפניות חוט Pt:Ir. הלחמה בצד הספל של סיכת זהב (ראה טבלת חומרים)לקצה הלא מבודד של כל הפניה.
- בדוק את המכשול של המכשיר המורכב.
- חבר את סיכות הזהב לכניסות של מודול בדיקת מד LCR או אלקטרודה והגדר את תדר הבדיקה ל- 1 kHz. לשקוע את צינורות השרוולים (וPt:Ir גירוי מגעים פנים לשרוול) בחתם קטנה מלאה תמיסת מלח, דואג לשמור על סיכות עופרת זהב ומחברי בדיקה יבשים. ודא כי השרוול המורכב יש מכשול ב 1 kHz של פחות מ 2 kΩ לפני ממשיך עם השתלה.
הערה: מכשול גבוה מצביע לעתים קרובות על שטח פנים Pt:Ir לקוי חשוף, אשר יכול להתעורר בשל גורמים כגון הסרה לא מספקת של בידוד, יישום מקרי של דבק בפנים השרוול, חוט שבור גדילים, וכו '. יש גם לבדוק את האזיקים עבור קווצות תיל שבורות או ממוקמות בצורה גרועה, דבר שיכול לגרום למגעים קצרים עם שימוש ארוך טווח.
- חבר את סיכות הזהב לכניסות של מודול בדיקת מד LCR או אלקטרודה והגדר את תדר הבדיקה ל- 1 kHz. לשקוע את צינורות השרוולים (וPt:Ir גירוי מגעים פנים לשרוול) בחתם קטנה מלאה תמיסת מלח, דואג לשמור על סיכות עופרת זהב ומחברי בדיקה יבשים. ודא כי השרוול המורכב יש מכשול ב 1 kHz של פחות מ 2 kΩ לפני ממשיך עם השתלה.
2. בניית כובע ראש
הערה: הליכי הרכבת כיסוי ראש דומים לאלה שפורסמו בעבר (צ'יסילדס ואח',17),ומסוכמים כאן בנוחות.
-
להרכיב את כיסוי הראש17
- חותכים שתי חתיכות קטנות של 30 עטיפת חוט AWG, אחת ~ 13 מ"מ אורך ואחד ~ 10 מ"מ אורך. להסיר ~ 1.5 מ"מ של בידוד מכל קצה של שני החוטים. הלחמה בצד הסיכה של סיכת זהב לקצה אחד של כל חוט, קרוב ככל האפשר לספל. השתמשו בחותך תיל כדי לחתוך את אורך הסיכה העודף מעבר למפרק ההלחמה.
- הלחמה את הקצוות האחרים של חוטי AWG לשתי כוסות ההלחמה המרכזיות של מחבר מיקרו-פסים בן 4 פינים.
- כופפו את כיסוי הראש של החוט כלפי המחבר והנחו את סיכות הזהב שטוחות כנגד המחבר, במקביל זה לזה, כפי המוצג באות 2A. יש מיקום את הסיכה המחוברת לחוט הקצר יותר מתחת לחוט המחובר לחוט הארוך יותר. השתמש אצילי ציפורניים, מלט שיניים, או דבק תרופת UV כדי לאבטח את מוביל כיסוי הראש במקום.
3. שימוש בהתקן
- להשתיל את אלקטרודות השרוול לגירוי עצבי תותוק כרוני.
הערה: יש לבצע את כל ההליכים הכירורגיים באמצעות טכניקה סטרילית או אספטית תחת הרדמה מתאימה, בהתאם להנחיות NIH לטיפול ולשימוש בבעלי חיים במעבדה ובאישור IACUC מקומי. ההליכים הבאים נועדו להמחיש שימוש מייצג בהתקן ולא נועדו להיות מקיפים.- מניחים את החולדה במסגרת סטריאוטקסית ומקציצים את עצמות העורף והקודקודית כדי לחשוף את משטח הגולגולת להשתלת ראש/מחבר. בזהירות לקדוח 4 חורים בגולגולת ולמקם ברגים של תכשיטן. השתמש אקריליק שיניים כדי לאבטח את כיסוי הראש לגולגולת וברגים.
- הסר את העכברוש מהמסגרת הסטריאו-קסית ושכב בצד ימין. לעשות חתך אנכי בעור בצד שמאל של הצוואר, ולחתוך בזהירות את עצב התועה השמאלית מהעורק הראשי, ממוקם בין שרירי החזה ו sternohyoid ומתחת לשריר omohyoid.
- מנהרה השרוול מוביל תת עורית לכיוון הגולגולת. חבר את הלידים לכיפה באמצעות סיכות הזהב.
- מניחים את עצב התועה בתוך השרוול ואבטחו את המכשיר סגור על ידי קשירת קשר כפול בתפרים השרוולים. הקפד להימנע מפגיעה בעצב במהלך ההשתלה על ידי מניפולציה של העצב עם ווים קהים, לא מוליכים או על ידי תפיסת רקמת חיבור המקיפה את העצב.
- בדוק את השתל על ידי החלת גירוי על המכשיר (10 s רכבת של 0.8 mA, 30 הרץ, 100 μs פולסים biphasic). השתלה נכונה תגרום להפסקת נשימה וירידה ב-SpO2 מתוך 5% או יותר.
- מכסים את סיכות הזהב ואת הלידים החשופים באקריליק דנטלי, פצעים קרובים בתפרים, ונקה את אתרי החיתוך בתמיסת מלח, אלכוהול ויוד פובידון.
- ספק נוזלים חלופיים, משכך כאבים וטיפול לאחר הניתוח בהתאם להנחיות NIH ואישור IACUC.
- לעורר את עצב התועה במהלך התנהגות ערה.
הערה: אספקת VNS כאשר בעלי חיים מבצעים משימות מוטוריות ספציפיות הוצגה בעבר כדי להרחיב את ייצוג המפה המוטורית של שרירים רלוונטיים למשימה. אנו משתמשים בפרדיגמה מאומתת זו כדי לספק דוגמה מייצגת לשימוש במכשיר, אך פרדיגמות התנהגותיות רבות אחרות ו/או פרמטרי גירוי עשויים להיות רלוונטיים ליישומים חלופיים. חולדות אומנו למיומנות במשימת לחיצת הידית ששימשה כאן לפני השתלת המכשיר. לאחר הניתוח, ביצועים טובים אומתו שוב לפני מסירת VNS: חולדות ביצעו לפחות 100 ניסויים מוצלחים בשני 30 דקות אימונים ביום. VNS זווג עם מכבשי ידית נכונה במהלך 10 אימונים עוקבים על פני 5 ימים.- חבר את העכברוש למחולל גירוי באמצעות מכסה ראש מושתל והתאם את עצמו להגדרות הגירוי המתאימות. עבור ארגון מחדש המושרה VNS של המפה הקליפתית המנוע, לשייך כל לחיצת מנוף נכונה עם רכבת אחת של 15 פולסים biphasic, כל אחד עם רוחב של 100 μs ומשרעת של 800 μA, נמסר בתדירות של 30 הרץ.
- רכבת גירוי מועברת מיד לאחר זיהוי של כל מכבש מנוף מוצלח לאורך עשרה 30 דקות אימונים. במהלך מסירת VNS, השתמש oscilloscope כדי לפקח על מסירה מוצלחת של גירוי נוכחי.
- אמת פונקציית שרוול מושתלת כרונית.
- בתוך 24 שעות של האימון האחרון VNS מזווג, להשתמש גירוי תוך גולגולתי (ICMS) כדי לכמת את המפה somatotopic פונקציונלי בקליפת המוחהמוטורית 19,,20,21,22.
- לאחר אינדוקציה של הרדמה עבור מיפוי ICMS של קליפת המוח המוטורית, לאמת את תפקוד השרוול שוב על ידי החלת רכבת 10 s של 30 הרץ, גירוי זרם 0.8 mA (100 μs פולסים biphasic), אשר אמור לגרום להפסקת נשימה וצמצום SpO2 רמות של לפחות 5%, עולה בקנה אחד עם רפלקס הינג-ברויר.
הערה: בהתאם ליישום, פונקציית השרוול עשוי להיחשב מקובלת אםטיפה אמינה SpO 2 של פחות מ 5% נצפתה, או אם משרעת זרם גבוה יותר (עד 1.6 mA) באופן מהימן לייצר לפחות 5% הפחתה SpO2. אי התבוננות בהפסקת נשימה ו/או ירידה אמינה ב-SpO2 מעידה על כשל בשתל.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
אלקטרודות וכיפתות ראש של שרוולי עצב Vagus הושתלו באופן כרוני בחולדות על פיניתוחים שפורסמו בעבר 17,19,20,21,22. לפני ההשתלה, מכשול ב 1 kHz נמדד על פני השרוול מוביל עם צינורות השרוול שקוע בתמיסת מלח (מכשול = 1.2 ± 0.17 kΩ [ממוצע ± std]; N = 9). רק אזיקים עם מכשולים פחות מ 2 kΩ בתמיסת מלח הושתלו; כל האזיקים עמדו בקריטריון זה (0/9 אזיקים לא נכללו). במהלך ניתוחי ההשתלה, אימות פונקציונלי של כל האזיקים בוצע על ידי בדיקות להפסקה קצרה של נשימה כתוצאה מגירוי וירידה נוספת ברווית חמצן בדם המיוחסת רפלקס הינג-ברויר. כדי לעורר תגובה זו, רכבת 10 s של 30 הרץ, גירוי זרם 0.8 mA (100 μs פולסים biphasic) נמסר על פני הלידים השרוול. עבור 9/9 מושתלים אזיקים, הבחנו בהפסקת נשימה המושרה על-ידי VNS למשך 10 שניות, אשר לוותה בירידה ב-SpO2 של לפחות 5% (% שינוי ב-SpO2 = -10.3 ± 3.2%, ממוצע ± std; טווח = -5.7 עד -14.5%), המאשר תפקוד השרוול וההשתלה התקינה. במהלך ההשתלה הראשונית, מצאנו מתאם משמעותי בין קריאות SpOראשוניות 2 ואת השינוי אחוזים SpO2 עורר על ידי VNS (איור 2B; R2 = 0.60, p = 0.0083, המתאם ליניארי של פירסון), עולה בקנה אחד עם ספרות שפורסמה המוכיחה כי עומק ההרדמה משפיע על סדר הגודל של רפלקס הינג-ברויר23,,24. כדי לבדוק את הפונקציונליות לטווח ארוך של האזיקים המושתלים באופן כרוני, חולדות היו מותאמות שוב 6 שבועות לאחר השתלת המכשיר VNS הוחל לעורר את תגובת רפלקס הינג-ברויר. עבור 7 של 9 מכשירים, הבחנו ירידה גדולה מ 5% SpO2 באמצעות 10 s רכבות של 0.8 mA, 30 הרץ גירוי(איור 2C). במכשירים האלה, סדר הגודל של שינוי מעורר גירוי ב-SpO2 לא היה שונה מזה שנצפה בהשתלה הראשונית, מה שמצביע עלביצועים מתמשכים מצוינים של המכשירים המושתלים באופן כרוני (שינוי ראשוני % ב-SpO2 = -9.7 ± 3.4%, שינוי % סופי ב-SpO 2 = -15.8 ± 6.5%, כלומר ± std; p = 0.08, מזווג t-test). ב 2 המכשירים הנותרים, הגדלת משרעת גירוי 1.6 mA היה מספיק כדי לעורר הפחתה אמינה SpO2 של לפחות 5%, מה שמרמז כי התקנים אלה המשיכו לתפקד, אבל שינויים במכשול, נזק עצבי, או כיוון שרוול לאורך זמן אולי הביא לביצועים מופחתים.
כדי לבדוק עוד יותר את הפונקציונליות ארוכת הטווח של אלקטרודות מגרה מושתלים כרונית שלנו, קבוצה שנייה של חולדות הוכשרה על גרסה פשוטה יותר של משימה מיומן להגיע מנוף העיתונות שפותחה על ידי הייז ואח '. כדי להעריך באופן כמותי ביצועי מנוע forelimb25. מחקרים רבים הראו כי זיווג VNS עם ביצועים מוטוריים נכונים על משימה זו גורמת להרחבת ייצוג ה-forelimb proximal בקליפת המוח המוטורית העיקרית19,20,21,22. בגרסה פשוטה שלנו של המשימה, חולדות נדרשו להגיע 2 ס"מ מחוץ לתא האימונים כדי לדכא את הידית באופן מלא, ולאחר מכן לשחרר אותו בתוך 2 s על מנת לקבל פרס מזון(איור 2D). בעלי חיים קיבלו שני אימונים של 30 דקות ביום עד שהשיגו מיומנות יציבה במשימה (>65% נכון, >100 ניסויים/מפגש, לפחות 8/10 מפגשים רצופים). חולדות עברו לאחר מכן ניתוח להשתיל אלקטרודה שרוול מגרה סביב עצב התועה השמאלי שלהם. לאחר התאוששות מניתוח, התאקלמות לכבלים מגרה, ולחזור לביצועים התנהגותיים מיומנים, חולדות קיבלו 10 אימונים נוספים שבהם VNS (0.5 s רכבת של 0.8 mA, 30 Hz פולסים; 100 μs רוחב דופק biphasic), או גירוי מזויף (ללא גירוי), נמסר בזמן שחרור נכון של ידית. בתוך 24 שעות לאחר האימון האחרון VNS-לזווג, חולדות היו מרדים עם קטמין / xylazine (80/10 מ"ג/ ק"ג, i.p.), פונקציית אלקטרודה שרוול נבדק, מיפוי מוטורי קליפתי בוצע על פיהליכים שפורסמו 22. עולה בקנה אחד עם מחקרים קודמים המוכיחים כי VNS מניע הרחבה של מצגים מפת מוטורית רלוונטית למשימה, VNS טיפל חולדות (N = 3) הציגו ייצוגים פרוקסימליים (PFL) גדול באופן משמעותי מאשר חולדות שטופלו בלוף (N = 4) במחקר שלנו (איור 2D; PFL % של אזור המפה הכולל, ממוצע + SEM: sham = 15.6 ± 6.7%, VNS = 38.3 ± 1.0%; p = 0.035, 2-מדגם t-מבחן, כוח בדיקה = 0.8). בכל בעלי החיים שטופלו ב-VNS, פונקציית השרוול אומתה לאחר אינדוקציה של הרדמה בזמן המיפוי, 5-10 שבועות לאחר השתל, על ידי אישור שינוי גדול מ-5% ב-SpO2 התרחש בתגובה ל-VNS (רכבת של 0.8 מ"ר, 30 פולסים של הרץ; 100 μs רוחב פולס biphasic).
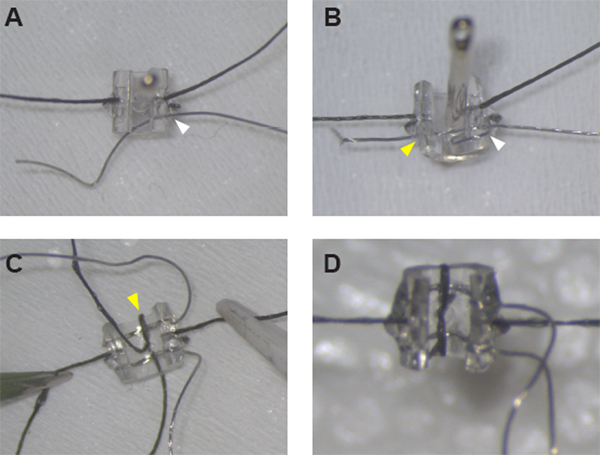
איור 1: הרכבה של אלקטרודות השרוול המגרה. (א)לאחר אבטחת התפרים משני צדי השרוול, חוט Pt:Ir יכול להיות משוחל דרך קיר השרוול ב hole #1 (ראש חץ לבן) באמצעות מחט תפירה. (ב)חוט Pt:Ir הוא משורשר כראוי ומוכן לde-בידוד לאחר יצירת לולאת חוט סביב קצה השרוול ושחלת החוט שוב דרך חור #1 (ראש חץ לבן) ועל פני השרוול דרך חור #2 (ראש חץ צהוב). (ג)ברגע ששני הכיוונים נמצאים במקום, לאבטח את היתרון הראשון על ידי השחלת תפר דרך חור קו האמצע וסביב קצה החפת (ראש חץ צהוב). (D)סגור את הלולאה סביב ההובלה השנייה עם חצי קשר ודבק במקום כדי להשלים את מכלול השרוולים. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 2: שימוש במכשיר לגירוי עצבי תותק כרוני בחולדות ערות ומתנהגות. (א)מכלול כיסוי ראש. (ב)במהלך השתלת המכשיר, הפחתות PNS-עורר ב SpO2 היו בקורלציה עם קריאות SpO2 הראשוניות (R2 = 0.602, p = 0.008, המתאם ליניארי של פירסון). (ג)השוואה של VNS-עורר SpO2 טיפות שהושגו בהשתלת מכשיר לעומת בסיום ניסויי גירוי 6 שבועות מאוחר יותר. הקווים מציינים זוגות מדידות עבור חולדות בודדות. גירוי בלוחות B ו-C כלל רכבת אחת של 10 μs של פולסים דו-פאזיים של 100 μsDשנמסרה ב-0.8 mA ו-30 הרץ. (E) VNS (0.5 s רכבת של 0.8 mA, 30 הרץ, 100 μs פולסים דו-פאזיים) יחד עם ביצועים נכונה מנוף לחץ הרחיב את ייצוג המפה של שרירים רלוונטיים למשימה בקליפת המוח המוטורית. חולדות שקיבלו VNS בשילוב עם ביצועי מכבש מנוף נכון (N = 3) הציג אחוז גדול יותר באופן משמעותי של שטח המפה המוטורית מוקדש לייצוג proximal forelimb (PFL) בהשוואה לחולדות שקיבלו גירוי שאם (N = 4). נקודות מציגות ייצוגי PFL עבור נושאים בודדים; קווי שגיאה מצביעים על SEM. טיפול VNS ואחריו מיפוי קליפתי מוטורי בוצע 5-10 שבועות לאחר ההשתלה. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כאן אנו מתארים גישה פשוטה בעלות נמוכה להרכבה של אלקטרודות שרוול מגרה כרונית לשימוש מכרסמים, הקלה על חקירות פרה-קוליות של טיפול זה המתעוררים. שיטה פשוטה זו לא דורשת הכשרה או ציוד מיוחדים, ומשתמשת במספר קטן של כלים ואספקה הנגישים בקלות לרוב מעבדות המחקר, מה שמפחית הן את עלויות העבודה הכספיות והן את עלויות העבודה של ייצור המכשירים בהשוואהלגישות אחרות 16,26,27,28. טיפול נדרש לאורך כל ההרכבה כדי למנוע יישום מוגזם של דבק תרופה UV תוך הבטחת יציבות מכנית נאותה של התפרים וPt:Ir מוביל לפונקציית שרוול לטווח ארוך. דבק מוגזם מסבך את השתלת המכשיר עלול לגרות את הרקמה שמסביב לאחר הניתוח, בעוד דבק לא מספיק מגביר את ההסתברות כי לאורך זמן הלידים לא יכולים לשמור על קשר טוב עם העצב, וכתוצאה מכך ירידה בביצועי המכשיר או כישלון. מיקום עקבי של חוטי Pt:Ir מבודדים בתוך לומן השרוול הוא גם קריטי להשגת מכשולים נמוכים וביצועי מכשיר טובים. יש לנקוט משנה כדי ליישר כראוי את החוט המבודד כך שהמשטח המרבי האפשרי של חוט חשוף יושב בתוך השרוול, בעוד שאין חוט חשוף קיים חיצונית.
יש לנו מאומת כי הגישה שלנו מייצרת אזיקים בגודל ואמינות דומים לאלה שנמצאים כיום בשימוש נפוץ על ידי מספר מעבדות עבור משלוח VNS כרוניבחולדות 4,,5,6, 7,,,8,,7,9,,10,,11,,12,,13,,14,15,,19,,20,,21,,22., מחקרים שנעשו לאחרונה מצביעים על כך סיבי עצב היקפיים מגויסים באופן דומה באמצעות מגוון רחב של גדלים וכיווןיות מגע אלקטרודה16,29, המצביעים על כך פרוטוקול זה יכול להיות מותאם לניסויים רבים הדורשים גירוי עצבי היקפי, כי וריאציות קטנות במרווח עופרת או שטח פני השטח הנובעים מהרכבת אזיקים ביד לא ישפיעו באופן קריטי על רוב התוצאות הניסיוניות. במהלך כל מפגש גירוי, עקבנו אחר המתח על פני הלידים השרוול באמצעות oscilloscope כדי להבטיח כי הלידים לא היו קצרים או שבורים, אבל אנחנו לא לעקוב אחר שינויים במכשול עבור מכשירים מושתלים ספציפיים למשך 5-10 שבועות לאחר השתל. מחקר אחד של מכשיר מושתל דומה דיווח כי המכשול גדל באופן משמעותי במהלך 4 השבועות הראשונים לאחר השתלה כירורגית, ככל הנראה כמו הפציעה חריפה מתייצב30. במחקר זה, עם זאת, שינויים במכשול המכשיר לא היו מתואמים עם ביצועי המכשיר על פני 8 שבועות של השתלה כרונית: המחברים דיווחו על שום שינוי משמעותי ביחסים בין עוצמת VNS משרעת פוטנציאלית פעולה מורכבת על פני מספר שבועות לאחר השתל. כאן, הצלחנו באופן דומה לאמת פונקציונלית את ביצועי השרוול לאחר 5-10 שבועות של השתלה על ידי (i) אימות כי VNS עדיין יכול לעורר הפסקת נשימה וטיפה ב SpO2 עולה בקנה אחד עם רפלקס הינג-ברויר, ו (ii) שכפול עבודה מוקדמת מדגים VNS המושרה מפה מוטורית ארגון מחדש. בעבודה שלנו, מצאנו אינדוקציה של רפלקס הינג-ברויר להיות הדרך האמינה ביותר כדי לאמת פונקציונליות לטווח ארוך של חפתים VNS מושתלים, אשר עשוי להפגין ביצועי מכשיר מופחת או כישלון בשל מספר גורמים שאינם קשורים להרכבת חפתים; אלה כוללים סיבוכים כירורגיים, נזק עצבי, ו / או נזק מכני לשרוול או כיסוי הראש. טכניקה כירורגית מעולה ואימות ספציפי ליישום של פונקציונליות המכשיר הוא חיוני לשימוש יציב ומוצלח של אלקטרודות שרוול מושתל כרונית מגרה.
תיארנו גישה פשוטה וזולה להרכבה של אלקטרודות שרוול עצב היקפי להשתלה כרונית בבעלי חיים קטנים והדגנו את התועלת שלה לאספקת VNS במהלך ניסויים התנהגותיים של חולדה. VNS נמצאת יותר ויותר תחת חקירה עבור מגוון רחב של אינדיקציות קליניות, כולל מחלות דלקתיות כגון דלקת מפרקים שגרונית1,,2 ומחלת קרוהן,31, כמו גם הפרעות נוירולוגיותכגון שבץ 5,6,,7, 8,8 ו PTSD10,11. שיטה נגישה זו להכנת אלקטרודות שרוול מגרה צריך להקל על השימוש במודלים מכרסמים פרה-קליניים במגוון מחקרים תרגום לתוך המנגנונים והיעילות של VNS. הפרוטוקול ניתן להתאמה בקלות, להגדיל עוד יותר את הרב-תכליתיות של הגישה. לדוגמה, ניתן לשנות את הקוטר ו/או האורך של צינורות הפוליאורטן כדי להתאים לניסווני גירוי כרוניים מינים אחרים או באתרי עצבים היקפיים אחרים (לדוגמה, גירוי, פרנית או עצבי קודש). לחלופין, תצורות עם הפניות נוספות עלולות לאפשר גירוי באתרים מרובים לאורך העצב, או להכיל הקלטה בו-זמנית של פוטנציאל פעולה מורכבת העורר גירוי.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgments
עבודה זו מומנה על ידי אוניברסיטת טקסס בדאלאס ומועצת המנהלים של UT. אנו מודים לסולומון גולדינג, בייאל חסן, מרגי ג'אני וצ'ינג-צו-צנג על הסיוע הטכני.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



