Summary
Bestaande benaderingen voor de bouw van chronisch implanteerbare perifere zenuwboektroden voor gebruik bij kleine knaagdieren vereisen vaak gespecialiseerde apparatuur en/of hoog opgeleid personeel. In dit protocol demonstreren we een eenvoudige, goedkope aanpak voor het fabriceren van chronisch implanteerbare manchetelektrodes en tonen we hun effectiviteit voor nervusstimulatie (VNS) bij ratten.
Abstract
Perifere zenuwboekelektrodes worden al lang gebruikt in de neurowetenschappen en aanverwante gebieden voor stimulatie van bijvoorbeeld vagus- of heupzenuwen. Verschillende recente studies hebben aangetoond dat de effectiviteit van chronische VNS in het verbeteren van het centrale zenuwstelsel plasticiteit om motorische revalidatie, uitsterven leren, en zintuiglijke discriminatie te verbeteren. De bouw van chronisch implanteerbare apparaten voor gebruik in dergelijke studies is een uitdaging vanwege de kleine omvang van ratten, en typische protocollen vereisen uitgebreide training van personeel en tijdrovende microfabricagemethoden. Als alternatief kunnen commercieel verkrijgbare implanteerbare manchetelektrodes tegen aanzienlijk hogere kosten worden aangeschaft. In dit protocol presenteren we een eenvoudige, goedkope methode voor de bouw van kleine, chronisch implanteerbare perifere zenuwboektroden voor gebruik bij ratten. We valideren de korte en lange termijn betrouwbaarheid van onze manchetelektroden door aan te tonen dat VNS in ketamine/xylazine verdoofde ratten een afname van de ademhaling produceert in overeenstemming met de activering van de Hering-Breuer reflex, zowel op het moment van implantatie als tot 10 weken na implantatie van het apparaat. Verder tonen we de geschiktheid van de manchetelektroden voor gebruik in chronische stimulatiestudies aan door VNS te koppelen aan ervaren hefboompersprestaties om motorische kaartplasticiteit te induceren.
Introduction
Onlangs is de vraag naar chronisch implanteerbare manchetelektrode voor stimulatie van perifere zenuwen toegenomen, omdat studies steeds vaker het preklinische nut van deze techniek voor de behandeling van talrijke ontstekingsziektenaantonen 1,2,3 en neurologische aandoeningen4,5,6,7,8,9,10,11,12,13,14,15. Zo is aangetoond dat chronische VNS de neocorticale plasticiteit in verschillende leercontexten verbetert, de motorische revalidatieverbetert 4,5,6,7,8,extinction learning10,11,12,13,14en sensorische discriminatie15. Commercieel beschikbare perifere zenuw manchetelektrodes worden vaak geassocieerd met langere tijden voor orderafhandeling en relatief hoge kosten, die hun toegankelijkheid kunnen beperken. Als alternatief blijven protocollen voor "in-house" fabricage van chronisch implanteerbare manchetelektrodes beperkt en de anatomie van knaagdieren stelt bijzondere uitdagingen voor vanwege hun kleine omvang. De huidige protocollen voor de bouw van manchetelektrodegen voor chronische knaagdierexperimenten vereisen vaak het gebruik van complexe apparatuur en technieken, evenals uitgebreid opgeleid personeel. In dit protocol demonstreren we een vereenvoudigde benadering van manchetelelektrodefabricage op basis van eerder gepubliceerde en veelgebruikte methoden16,17. We valideren de functionaliteit van onze chronisch geïmplanteerde elektroden bij ratten door aan te tonen dat, op het moment van manchetimplantatie rond de linker cervicale vaguszenuw, stimulatie toegepast op de manchetelektroden met succes een stopzetting van de ademhaling en daling van SpO2 veroorzaakte. Stimulatie van afferent longreceptor vagalvezels is bekend dat de Hering-Breuer reflex, waarbij de remming van verschillende ademhalingskernen in de hersenstam resulteert in de onderdrukking inspiratie18. Zo, stopzetting van de ademhaling in overeenstemming met de Hering-Breuer reflex, en de resulterende daling van SpO2, bieden een eenvoudige test voor een goede elektrode implantatie en manchet functie bij verdoofde ratten. Om de langetermijnfunctionaliteit van chronisch geïmplanteerde manchetelektrodes te valideren, werden reflexreacties gemeten op het moment van implantatie en vergeleken met de reacties die bij dezelfde dieren zes weken na de implantatie werden verkregen. Een tweede groep ratten werd geïmplanteerd met VNS manchetelektrodes na gedragstraining op een hefboom drukkende taak. Bij deze ratten produceerde VNS in combinatie met de juiste taakprestaties een reorganisatie van de corticale motorkaart , in overeenstemming met eerder gepubliceerde studies19,20,21,22. Op het moment van motorische corticale mapping onder narcose, die 5-10 weken na implantatie van het apparaat plaatsvond, hebben we de manchetfunctie bij met VNS behandelde dieren verder gevalideerd door te bevestigen dat VNS met succes een stopzetting van de ademhaling en een daling van meer dan 5% in SpO2veroorzaakte.
De onlangs gepubliceerde protocollen van Childs et al.17 en Rios et al.16 bieden een goed gevalideerd uitgangspunt voor een vereenvoudigde manchetelelektrodefabricatiebenadering, aangezien deze populaire methode is gebruikt door meerdere laboratoria die chronische VNS-onderzoeken uitvoeren bij knaagdieren1,2,3,4,5,6,7,8,99,10,11. De oorspronkelijke methode omvat verschillende hoge precisie stappen voor het manipuleren van de fijne microdraden zodanig dat manchetelelektrode fabricage duurt meer dan een uur in beslag, en uitgebreide training om betrouwbaar uit te voeren. De hier beschreven vereenvoudigde aanpak vereist aanzienlijk minder materialen en gereedschappen en kan in minder dan een uur worden voltooid door minimaal opgeleid personeel.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle in dit protocol beschreven procedures worden uitgevoerd in overeenstemming met de NIH Guide for the Care and Use of Laboratory Animals en zijn goedgekeurd door het Institutional Animal Care and Use Committee van de University of Texas in Dallas.
1. Stimulerende manchetelektatieffabricage
- Bereid de manchetslang voor.
- Snijd met een scheermesje een stuk polymeerbuizen van 2,5 mm lang. Steek tang tips of een paperclip door de slang en gebruik het blad om een spleet in de lengte door de wand van de slang aan de ene kant de manchet.
- Verwijder de tangen uit de slang en steek een grote naainaald door de middellijn van de manchet, loodrecht op de lange as. Steek de naald door de spleet (boven) en in het midden van de slang tegenover (onder). Plaats de naald in het schuimbord om de manchet op zijn plaats te spelden tijdens de resterende montagestappen.
- Plaats hechting voor het vastzetten van de manchetsluiting tijdens de implantatie.
- Steek de kleine naainaald door de wand van de manchet, op de middellijn, ongeveer 0,5 mm van de bovenste spleet aan de ene kant. Steek de naald van binnen naar buiten om beschadiging van de manchetslang te voorkomen. Steek een lengte van 2 cm van 6/0 hecht door het oog van de naald en trek de naald door de wand van de slang om de hechting in de manchet te rijgen.
- Laat de draad op zijn plaats, verwijder de naald en prik een tweede gat door de buizenwand ongeveer 0,5 mm onder het eerste gat, langs de middellijn van de manchet. Steek de hechting door het oog van de naald en trek de naald door de slangwand om de hechting opnieuw door de manchet te rijgen.
- Beide uiteinden van de hechtdraad moeten nu aan de buitenkant van de manchet liggen. Stel de hechting zo aan dat ~1,5 cm zich uitstrekt van het bovenste gat, en ~ 0,5 mm strekt zich uit van het onderste gat.
- Breng een kleine hoeveelheid UV-kuur lijm aan het korte uiteinde van de hechting uit te breiden van het onderste gat en trek de langere hechting einde totdat de onderste staart is bijna gelijk met de buitenwand van de slang. Gebruik de UV-toverstok om de lijm te genezen en houd de hechting stevig op zijn plaats.
- Herhaal stap 1.2.1 tot en met 1.2.3 aan de andere kant van de manchet.
- Plaats de Platinum:Iridium (Pt:Ir) draad leidt.
- Gebruik de kleine naainaald om 4 gaten in de manchetwand te maken. Elk paar gaten moet ongeveer 0,5–0,8 mm van de loodrechte middellijn worden geplaatst, met een gat van ongeveer 0,5–0,8 mm van de bovenste spleet aan weerszijden van de manchet.
LET OP: Voor de meest consistente en nauwkeurige plaatsing van de leads, steek de naald van binnen naar buiten om alle gaten te maken, met behulp van de hechting plaatsing als een gids. - Steek de naainaald opnieuw, dit keer werken van buiten naar binnen, door middel van lood gat 1. Steek ongeveer 0,5 cm van een lengte van 7,5 cm van Pt:Ir draad door het oog van de naald en trek de naald door de slang om de draad lood draad door de manchetwand. Stel de draad zo aan dat ~4,5 cm zich uitstrekt aan de buitenzijde van de manchet(figuur 1A).
- Steek de naald opnieuw door loodgat 1, werkt opnieuw van buiten naar binnen en steek de naald bovendien door loodgat 2 direct tegenover loodgat 1. Steek ~0,5 cm van het kortere (interieur) uiteinde van de Pt:Ir draad door het oog van de naald en trek de naald door de slang om de draad lood draad door de manchetwanden.
OPMERKING: Beide uiteinden van de Pt:Ir-draad moeten nu aan de buitenzijde van de manchet liggen en er wordt een draadlus gevormd rond de spleetrand en door loodgat 1(figuur 1B). - Herhaal stappen 1.3.1 tot en met 1.3.3 om Pt:Ir-draad door loodgaten 3 en 4 te plaatsen.
- Verwijder met behulp van een butaanaansteker voorzichtig de isolatie van een lengte van 5-6 mm aan het einde van Pt:Ir-draden die zich uitstrekken van loodgat 2 en loodgat 4.
LET OP: Isoleer de uiteinden van de leidingen van de rest van de manchetmontage zorgvuldig om beschadiging van de manchet te voorkomen. Gebruik gereedschap om de draden vast te houden om letsel te voorkomen. - Lijn de kale draad in de manchet om de leads in hun uiteindelijke locaties te plaatsen. Om dit te doen, trek voorzichtig aan het einde van de Pt:Ir draad uit te breiden van gat 1 tot de niet-geïsoleerde gedeelte van draad is gelijk met gat 1. Herhaal met de andere leiden om het niet-geïtuleerde uiteinde van de draad schroefdraad uit te lijnen door loodgaten 3 en 4.
- Breng een kleine hoeveelheid UV-kuur lijm aan de draad lussen aan de buitenkant van de manchet op loden gaten 1 en 3. Gebruik de UV-toverstok om de lijm te genezen en de leidingen op zijn plaats te beveiligen.
- Gebruik een kleine pipet tip om de ongeïnreguleerde Pt: Ir draad leidt tegen de binnenwand van de manchet te duwen. Zodra de leads op hun plaats zijn, snijd de uiteinden van de draden uit te breiden van loodgaten 2 en 4, zodat ongeveer 1 mm draad strekt zich uit tot voorbij de buitenkant van de manchetwand.
- Vouw de 1 mm staarten van de draad plat tegen het buitenoppervlak van de manchet, waarbij u ervoor zorgt dat ze niet kortsluiting aan elkaar. Breng een kleine hoeveelheid UV-kuur lijm om gewoon betrekking hebben op de twee staarten en genezen van de lijm om lood plaatsing te beveiligen en elektrische isolatie te bieden.
LET OP: Het is belangrijk om de extern blootgestelde Pt:Ir oppervlakken volledig te bedekken met lijm om de draden te isoleren en stimulatie buiten het doel te voorkomen.
- Gebruik de kleine naainaald om 4 gaten in de manchetwand te maken. Elk paar gaten moet ongeveer 0,5–0,8 mm van de loodrechte middellijn worden geplaatst, met een gat van ongeveer 0,5–0,8 mm van de bovenste spleet aan weerszijden van de manchet.
- Beveilig de Pt:Ir draad leidt op zijn plaats met hechting securement.
- Verwijder de grote naald met de manchetmontage van het schuimbord. Steek een lengte van 3 cm van 6/0 hecht door het oog van de naald en trek de naald door de slang om de hechting door de onderkant van de manchet in het midden te rijgen.
- Schakel over naar de kleine naainaald om hechtingsdraden voor Pt:Ir-loodzekering te voltooien. Steek de naald door hetzelfde middellijngat en werk weer van binnen naar buiten om vervorming van de slang en de draadleidingen te voorkomen. Steek de buitenstaart van de hechting door het oog van de naald en trek de naald door de manchetwand om een lus van hechting rond de rand van de manchet te creëren(figuur 1C).
OPMERKING: Gebruik tangen en werk onder de microscoop om ervoor te zorgen dat de hechting is gericht langs de lange as van de manchet en ligt plat tegen de slang. Deze stap zorgt ervoor dat de leads gescheiden blijven aan de binnenzijde van de manchet en worden zijdelings op zijn plaats gehouden aan de manchet middellijn. - Maak een tweede lus rond het andere uiteinde van de manchet door de uiteinden van de hechting in een halve knoop te binden, aan de buitenkant van de manchet. Zorg ervoor dat de hechting langs de lange as van de manchet loopt en plat tegen de slang ligt. Terwijl het houden van de knoop strak, zodat het plat tegen de slang legt, breng een kleine hoeveelheid UV-kuur lijm aan de halve knoop en genezen om op zijn plaats te houden.
- Snijd de uiteinden van de hechtdraad voorzichtig zo dicht mogelijk bij de knoop. Gebruik indien nodig een kleine hoeveelheid extra UV-kuurlijm om de korte uiteinden van hechting te lijmen, zodat ze plat tegen de slang leggen(figuur 1D).
- Soldeer connector pinnen aan de Pt: Ir draad leidt.
- Met behulp van een butaanaansteker, verwijder de isolatie van ~ 3 mm aan het einde van elk van de Pt:Ir draad leidt. Soldeer de bekerzijde van een gouden speld (zie Tabel van Materialen) aan het niet-geïtulen einde van elk lood.
- Test de impedantie van het gemonteerde apparaat.
- Sluit de gouden pinnen aan op de ingangen van een LCR-meter of elektrode impedantiecontrolemodule en stel de testfrequentie in op 1 kHz. Dompel de manchetbuis (en Pt:Ir stimulatie contacten interieur aan de manchet) in een klein bekerglas gevuld met zoutoplossing, zorg ervoor dat de gouden loden pinnen en sonde connectoren droog te houden. Controleer of de gemonteerde manchet een impedantie heeft op 1 kHz van minder dan 2 kΩ alvorens verder te gaan met implantatie.
OPMERKING: Hoge impedantie duidt vaak op onvoldoende Pt:Ir oppervlakte blootgesteld, die kan ontstaan als gevolg van factoren zoals onvoldoende verwijdering van isolatie, toevallige toepassing van lijm in het manchetinterieur, gebroken draadstrengen, enz. Manchetten moeten ook worden geïnspecteerd op gebroken of slecht geplaatste draadstrengen die kunnen leiden tot kortsluitingen bij langdurig gebruik.
- Sluit de gouden pinnen aan op de ingangen van een LCR-meter of elektrode impedantiecontrolemodule en stel de testfrequentie in op 1 kHz. Dompel de manchetbuis (en Pt:Ir stimulatie contacten interieur aan de manchet) in een klein bekerglas gevuld met zoutoplossing, zorg ervoor dat de gouden loden pinnen en sonde connectoren droog te houden. Controleer of de gemonteerde manchet een impedantie heeft op 1 kHz van minder dan 2 kΩ alvorens verder te gaan met implantatie.
2. Head-cap constructie
OPMERKING: Headcap assemblage procedures zijn vergelijkbaar met die eerder gepubliceerd (Childs et al.17), en worden hier samengevat voor het gemak.
-
Monteer de hoofdkap17
- Snijd twee kleine stukjes 30 AWG draadwrap, één ~13 mm lang en één ~10 mm lang. Strip de ~1,5 mm isolatie van elk uiteinde van beide draden. Soldeer de pin kant van een gouden pin aan het ene uiteinde van elke draad, zo dicht mogelijk bij de beker mogelijk. Gebruik draadsnijders af te snijden overtollige lengte van pin dan de soldeerverbinding.
- Soldeer de andere uiteinden van de AWG draden aan de twee centrale soldeerbekers van een 4-pins microstrip connector.
- Buig de draadhoofdblad leidt naar de connector en plaats de gouden pinnen plat tegen de connector, parallel aan elkaar, zoals weergegeven in figuur 2A. De pin die op de kortere draad is aangesloten, moet onder de pin worden geplaatst die op de langere draad is aangesloten. Gebruik nagel acryl, tandcement, of UV-kuur lijm om de hoofddoppen lood op zijn plaats te beveiligen.
3. Apparaatgebruik
- Implanteer de manchetelektrodes voor chronische nervussulatie van vagus.
OPMERKING: Alle chirurgische ingrepen moeten worden uitgevoerd met behulp van steriele of aseptische techniek onder passende anesthesie, in overeenstemming met nih-richtlijnen voor de verzorging en het gebruik van proefdieren en met lokale IACUC-goedkeuring. De volgende procedures zijn bedoeld om een representatief gebruik van het apparaat te illustreren en zijn niet bedoeld om volledig te zijn.- Plaats de rat in een stereotaxic frame en maak een sagittale incisie over de pariëtale en occipital botten om het schedeloppervlak te onthullen voor implantatie van de hoofdkas / connector. Boor voorzichtig 4 gaten in de schedel en plaats de schroeven van de juwelier. Gebruik gebits acryl om de hoofddoppen vast te zetten aan de schedel en schroeven.
- Haal de rat uit het stereotaxic frame en leg aan de rechterkant. Maak een verticale incisie in de huid aan de linkerkant van de nek, en zorgvuldig ontleden de linker vagus zenuw uit de halsslagader, gelegen tussen de sternomastoïde en sternohyoid spieren en onder de omohyoid spier.
- Tunnel de manchet leidt onderhuids naar de schedel. Sluit de leads aan op de hoofdkas met behulp van de gouden pinnen.
- Plaats de nervus vagus in de manchet en zet het apparaat gesloten door het binden van een dubbele knoop in de manchet hechtingen. Wees voorzichtig om te voorkomen dat de zenuw beschadiging tijdens de implantatie door het manipuleren van de zenuw met botte, niet-geleidende haken of door het grijpen van bindweefsel rond de zenuw.
- Test het implantaat door stimulatie op het apparaat toe te passen (10 s trein van 0,8 mA, 30 Hz, 100 μs biphasische pulsen). Een goede implantatie zal resulteren in stopzetting van de ademhaling en een daling van spo2 van 5% of meer.
- Bedek de gouden pinnen en blootgestelde leads met tandheelkundige acryl, nauwe wonden met hechtingen, en reinig de incisie sites met zout, alcohol, en povidone jodium oplossing.
- Zorg voor vervangende vloeistoffen, pijnstillers en postoperatieve zorg in overeenstemming met nih-richtlijnen en IACUC-goedkeuring.
- Stimuleer de nervus vagus tijdens wakker gedrag.
OPMERKING: Levering van VNS als dieren uitvoeren van specifieke motorische taken is eerder aangetoond dat de motor kaart vertegenwoordiging van taak-relevante spieren uit te breiden. We gebruiken dit gevalideerde paradigma om een representatief voorbeeld van apparaatgebruik te geven, maar veel andere gedragsparadigma's en/of stimulatieparameters kunnen relevant zijn voor alternatieve toepassingen. Ratten werden getraind om te reageren op de hefboom pers taak die hier wordt gebruikt voorafgaand aan de implantatie van het apparaat. Na de operatie werden de goede prestaties opnieuw gecontroleerd voorafgaand aan de VNS-bevalling: ratten voerden minstens 100 succesvolle proeven uit in twee trainingen van 30 minuten per dag. VNS werd gekoppeld aan de juiste hendelpersen tijdens 10 volgende trainingen gedurende 5 dagen.- Sluit de rat aan op een stimulusgenerator via geïmplanteerde hoofdkap en pas aan de juiste stimulatie-instellingen aan. Voor door VNS geïnduceerde reorganisatie van de motorcorticale kaart, koppel elke juiste hendelpers met een enkele trein van 15 bifasische pulsen, elk met een breedte van 100 μs en amplitude van 800 μA, geleverd op een frequentie van 30 Hz.
- Een stimulatie trein wordt geleverd onmiddellijk na detectie van elke succesvolle hendel druk gedurende tien 30 minuten trainingen. Gebruik tijdens VNS-levering een oscilloscoop om een succesvolle levering van de huidige stimulatie te monitoren.
- Valideer chronisch geïmplanteerde manchetfunctie.
- Binnen 24 uur van de laatste VNS-gekoppelde trainingssessie gebruikt u intracraniale microstimulatie (ICMS) om de functionele somatototopkaart in de motorische cortex19,20,,21,22te kwantificeren .
- Na inductie van anesthesie voor ICMS mapping van de motorische cortex, valideer de manchetfunctie opnieuw door een 10 s trein van 30 Hz, 0,8 mA stroomstimulatie (100 μs bifasische pulsen) toe te passen, wat moet resulteren in een stopzetting van de ademhaling en vermindering van SpO2 niveaus van ten minste 5%, in overeenstemming met de Hering-Breuer reflex.
OPMERKING: Afhankelijk van de toepassing kan de manchetfunctie als aanvaardbaar worden beschouwd als een betrouwbare SpO2-daling van minder dan 5% wordt waargenomen, of als hogere huidige amplitudes (tot 1,6 mA) op betrouwbare wijze ten minste een vermindering van 5% in SpO2opleveren. Het niet waarnemen van een stopzetting van de ademhaling en/of een betrouwbare afname van SpO2 is indicatief voor implantaatfalen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vagus zenuwboektroden en hoofddoppen werden chronisch geïmplanteerd bij ratten volgens eerder gepubliceerde chirurgische ingrepen17,19,20,21,22. Voorafgaand aan de implantatie werd impedantie op 1 kHz over de manchetleiden gemeten met de manchetslang ondergedompeld in zout (impedantie = 1,2 ± 0,17 kΩ [gemiddelde ± std]; N = 9). Alleen manchetten met impedantie van minder dan 2 kΩ in zout werden geïmplanteerd; alle manchetten voldeden aan dit criterium (0/9 manchetten uitgesloten). Tijdens implantatieoperaties werd de functionele validatie van alle manchetten uitgevoerd door te testen op een stimulatie-geïnduceerde korte stopzetting van de ademhaling en de daaropvolgende daling van de zuurstofverzadiging in het bloed toegeschreven aan de Hering-Breuer reflex. Om deze respons op te roepen, werd een 10 s trein van 30 Hz, 0,8 mA stroomstimulatie (100 μs biphasische pulsen) geleverd over de boeien. Voor 9/9 geïmplanteerde manchetten, we zagen een door VNS geïnduceerde stopzetting van de ademhaling voor de duur van de stimulatie van 10 seconden, die gepaard ging met een daling van SpO2 van ten minste 5% (% verandering in SpO2 = -10,3 ± 3,2%, gemiddelde ± std; bereik = -5,7 tot -14,5%), bevestiging van de manchetfunctie en de juiste implantatie. Tijdens de eerste implantatie vonden we een significante correlatie tussen de eerste SpO2-metingen en de procentuele verandering in SpO2 die door VNS wordt opgeroepen (figuur 2B; R2 = 0,60, p = 0,0083, pearson's lineaire correlatie), in overeenstemming met gepubliceerde literatuur waaruit blijkt dat anesthesiediepte de omvang van de Hering-Breuer reflex23,24beïnvloedt . Om de functionaliteit op lange termijn van de chronisch geïmplanteerde manchetten te testen, werden ratten 6 weken na implantatie van het apparaat opnieuw verdoofd en werd VNS toegepast om de Hering-Breuer reflexrespons op te roepen. Voor 7 van de 9 apparaten, merkten we een meer dan 5% daling van De SpO2 met behulp van 10 s treinen van 0,8 mA, 30 Hz stimulatie (Figuur 2C). In deze apparaten verschilde de omvang van de stimulatie-opgeroepen verandering in SpO2 niet van die waargenomen bij de eerste implantatie, wat wijst op uitstekende voortgezette prestaties van de chronisch geïmplanteerde apparaten (initiële % verandering in SpO2 = -9,7 ± 3,4%, laatste % verandering in SpO2 = -15,8 ± 6,5%, gemiddelde ± std; p = 0,08, paired t-test). In de overige 2 apparaten was het verhogen van de stimulatieamplitude tot 1,6 mA voldoende om een betrouwbare vermindering van SpO2 van ten minste 5% op te roepen, wat suggereert dat deze apparaten bleven functioneren, maar dat veranderingen in impedantie, zenuwschade of manchetoriëntatie na verloop van tijd kunnen hebben geleid tot verminderde prestaties.
Om de functionaliteit op lange termijn van onze chronisch geïmplanteerde stimulerende elektroden verder te testen, werd een tweede groep ratten getraind op een vereenvoudigde versie van een vakkundige hefboomdruktaak ontwikkeld door Hays et al. om de prestaties van forelimbmotoren kwantitatief te beoordelen25. Meerdere studies hebben aangetoond dat het koppelen van VNS met de juiste motorische prestaties op deze taak resulteert in de uitbreiding van de proximale voorpoot representatie in primaire motorische cortex19,20,21,22. In onze vereenvoudigde versie van de taak moesten ratten 2 cm buiten de trainingscabine komen om een hendel volledig te indrukken en deze vervolgens binnen 2 s los te laten om een voedselbeloning te ontvangen(figuur 2D). Dieren kregen twee trainingen van 30 minuten per dag totdat ze een stabiele vaardigheid op de taak bereikten (>65% correct, >100 proeven/sessie, voor ten minste 8/10 opeenvolgende sessies). Ratten ondergingen toen een operatie om een stimulerende manchetelektrode rond hun linker nervus vagus te implanteren. Na herstel van een operatie, acclimatisatie aan stimulerende kabels, en terug te keren naar bedreven gedragsprestaties, ratten kregen een extra 10 trainingen waarin VNS (0,5 s trein van 0,8 mA, 30 Hz pulsen; 100 μs biphasic puls breedte), of schijnstimulatie (geen stimulatie), werd geleverd op het moment van de juiste hendel release. Binnen 24 uur na de laatste VNS-gekoppelde trainingssessie werden ratten verdoofd met ketamine/xylazine (80/10 mg/kg, i.p.), werd de manchetelektrodefunctie getest en werd corticale motormapping uitgevoerd volgens gepubliceerde procedures22. In overeenstemming met eerdere studies waaruit blijkt dat VNS de uitbreiding van taakrelevante motorkaartrepresentaties stimuleert, vertoonde VNS behandelde ratten (N = 3) aanzienlijk grotere proximale voorpoot (PFL) voorstellingen dan schijnbehandelde ratten (N = 4) in onze studie(figuur 2D; PFL % van het totale kaartgebied, gemiddelde + SEM: sham = 15,6 ± 6,7%, VNS = 38,3 ± 1,0%; p = 0,035, 2-monster t-test, testvermogen = 0,8). Bij alle met VNS behandelde dieren werd de manchetfunctie gevalideerd na inductie van anesthesie op het moment van in kaart brengen, 5-10 weken na het implantaat, door te bevestigen dat er een verandering van meer dan 5% in SpO2 plaatsvond in reactie op VNS (10 s trein van 0,8 mA, 30 Hz pulsen; 100 μs bifasische pulsbreedte).
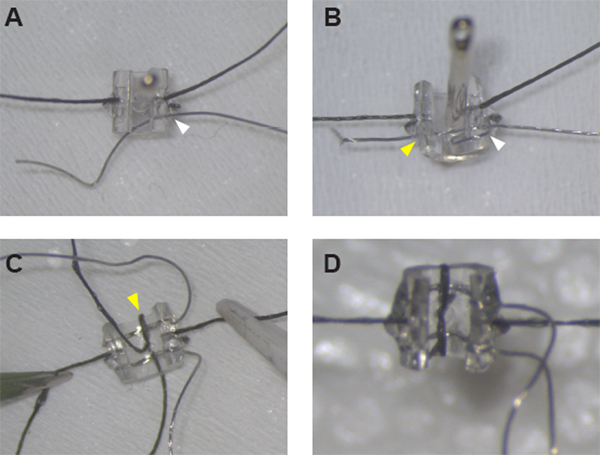
Figuur 1: Montage van de stimulerende manchetelektrode. (A) Na het vastzetten van de hechtingen aan weerszijden van de manchet, Pt:Ir draad kan worden schroefdraad door de manchet muur op gat #1 (witte pijlpunt) met behulp van een naainaald. (B) Pt: Ir draad is goed schroefdraad en klaar voor de-isolatie na het creëren van een draad lus rond de manchetrand en schroefdraad de draad weer door gat #1 (witte pijlpunt) en over de manchet door gat #2 (gele pijlpunt). (C) Zodra beide leads op hun plaats zijn, veilig de eerste lood door threading hechting door de middellijn gat en rond de manchet rand (gele pijlpunt). (D) Sluit de lus rond het tweede lood met een halve knoop en lijm op zijn plaats om de manchetassemblage te voltooien. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2: Apparaatgebruik voor chronische nervusstimulatie van vagus bij wakker gedragende ratten. (A) Hoofdkapassemblage. (B) Tijdens de implantatie van apparaten werden door DE VNS opgeroepen reducties in SpO2 gecorreleerd met de initiële SpO2-metingen (R2 = 0,602, p = 0,008, de lineaire correlatie van Pearson). (C) Vergelijking van VNS-opgeroepen SpO2 druppels verkregen bij implantatie van het apparaat versus bij de beëindiging van stimulatie-experimenten 6 weken later. Lijnen geven paren van metingen voor individuele ratten. Stimulatie in panelen B en C bestond uit een enkele 10 s trein van 100 μs bifasische pulsen geleverd op 0,8 mA en 30 Hz. (D) Rat met chronisch geïmplanteerde VNS cuff elektroden het uitvoeren van de hendel-press taak. (E) VNS (0,5 s trein van 0,8 mA, 30 Hz, 100 μs bifasische pulsen) in combinatie met de juiste lever-press prestaties uitgebreid de kaart vertegenwoordiging van taak-relevante spierstelsel in de motorische cortex. Ratten die VNS ontvangen in combinatie met de juiste hefboom persprestaties (N = 3) tentoongesteld een aanzienlijk groter percentage van de motor kaart gebied gewijd aan proximale voorpoot (PFL) vertegenwoordiging in vergelijking met ratten die Sham stimulatie ontvangen (N = 4). De punten tonen PFL vertegenwoordiging voor individuele onderwerpen; foutstaven geven SEM. VNS behandeling aan, gevolgd door motorcorticale mapping, die 5-10 weken na de implantatie werd uitgevoerd. Klik hier om een grotere versie van dit cijfer te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Hier beschrijven we een eenvoudige, goedkope aanpak voor de assemblage van chronisch implanteerbare stimulerende manchetelektrodes voor gebruik bij knaagdieren, waardoor preklinische onderzoeken van deze opkomende therapie worden vergemakkelijkt. Deze vereenvoudigde methode vereist geen gespecialiseerde opleiding of apparatuur, en maakt gebruik van een klein aantal tools en benodigdheden die gemakkelijk toegankelijk zijn voor de meeste onderzoekslaboratoria, waardoor zowel de monetaire als de arbeidskosten van de productie van apparaten worden verminderd in vergelijking met andere benaderingen16,26,27,28. Zorg is vereist tijdens de montage om overmatige toepassing van UV-kuur lijm te voorkomen, terwijl nog steeds zorgen voor voldoende mechanische stabiliteit van de hechtingen en Pt: Ir leidt voor lange termijn manchetfunctie. Overmatige lijm bemoeilijkt de implantatie van het apparaat en kan het omringende weefsel na de operatie irriteren, terwijl onvoldoende lijm de kans vergroot dat de leads na verloop van tijd geen goed contact met de zenuw kunnen onderhouden, wat resulteert in verminderde prestaties van het apparaat of falen. Consistente plaatsing van de de-geïsoleerde Pt:Ir draden in de manchet lumen is ook van cruciaal belang voor het bereiken van lage impedantie en goede prestaties van het apparaat. Er moet voor worden gezorgd dat de ont geïsoleerde draad goed wordt uitgelijnd, zodat het maximaal mogelijke oppervlak van de blootgestelde draad in de manchet zit, terwijl er geen blootgestelde draad extern bestaat.
We hebben gevalideerd dat onze aanpak manchetten van vergelijkbare omvang en betrouwbaarheid produceert als die welke momenteel gebruikelijk zijn in verschillende laboratoria voor chronische VNS-levering bij ratten4,5,6,7,8,9,10,11,12,13,14,15,19,20,21,22.6 Recente studies geven aan dat perifere zenuwvezels op dezelfde manier worden aangeworven met behulp van een breed scala van elektrode contact maten en oriëntaties16,29, wat suggereert dat dit protocol kan worden aangepast voor vele experimenten die perifere zenuwstimulatie, en dat kleine variaties in loodafstand of oppervlakte die voortvloeien uit de montage van manchetten met de hand zal niet kritisch invloed hebben op de meeste experimentele resultaten. Tijdens elke stimulatiesessie hebben we de spanning over de manchetleidingen gecontroleerd met behulp van een oscilloscoop om ervoor te zorgen dat de leads niet werden kortt of gebroken, maar we hebben geen veranderingen in impedantie voor specifieke geïmplanteerde apparaten bijgehouden voor de duur van het 5-10 weken na het implantaat. Een studie van een soortgelijk geïmplanteerd apparaat gemeld dat impedantie doet aanzienlijk toenemen tijdens de eerste 4 weken na chirurgische implantatie, vermoedelijk als de acute schade stabiliseert30. In deze studie, echter, veranderingen in apparaat impedantie werden niet gecorreleerd met de prestaties van het apparaat meer dan 8 weken van chronische implantatie: de auteurs meldden geen significante verandering in de relatie tussen VNS intensiteit en samengestelde actie potentiële amplitude gedurende enkele weken na het implantaat. Hier konden we ook de manchetprestaties functioneel valideren na 5-10 weken implantatie door (i) te controleren of VNS nog steeds een stopzetting van de ademhaling en daling van spo2 kon oproepen in overeenstemming met de Hering-Breuer reflex, en (ii) het repliceren van voorafgaand werk waaruit vns-geïnduceerde motorkaartreorganisatie blijkt. In ons eigen werk hebben we gevonden inductie van de Hering-Breuer reflex om de meest betrouwbare manier om de lange termijn functionaliteit van geïmplanteerde VNS manchetten te valideren, die kunnen vertonen verminderde prestaties van het apparaat of falen als gevolg van een aantal factoren die geen verband houden met manchet montage; deze omvatten chirurgische complicaties, schade aan de zenuwen, en / of mechanische schade aan de manchet of hoofdkas. Uitstekende chirurgische techniek en toepassingsspecifieke validatie van apparaatfunctionaliteit is cruciaal voor een stabiel en succesvol gebruik van chronisch geïmplanteerde stimulerende manchetelektroden.
We hebben een eenvoudige, goedkope aanpak beschreven voor de assemblage van perifere zenuwboektroden voor chronische implantatie bij kleine dieren en hebben het nut ervan aangetoond voor VNS-levering tijdens gedragsexperimenten van ratten. VNS wordt steeds vaker onderzocht op een breed scala aan klinische indicaties, waaronder ontstekingsziekten zoals reumatoïde artritis1,,2 en de ziekte van Crohn,31 evenals neurologische aandoeningen zoals beroerte5,6,,7,8 en PTSS10,11. Deze toegankelijke methode voor het maken van stimulerende manchetelektrode moet het gebruik van preklinische knaagdiermodellen vergemakkelijken in verschillende translationele onderzoeken naar de mechanismen en werkzaamheid van VNS. Het protocol is eenvoudig aan te passen, waardoor de veelzijdigheid van de aanpak verder toeneemt. Zo kan bijvoorbeeld de diameter en/of lengte van de polyurethaanbuizen worden aangepast om chronische stimulatie-experimenten bij andere soorten of op andere perifere zenuwlocaties (bijvoorbeeld heup-, phrenic- of sacrale zenuwen) mogelijk te maken. Als alternatief kunnen configuraties met extra leads stimulatie mogelijk maken op meerdere locaties langs de zenuw, of kunnen gelijktijdige registratie van een stimulatie-opgeroepen samengestelde actiepotentieel mogelijk zijn.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Dit werk werd gefinancierd door de Universiteit van Texas in Dallas en de UT Board of Regents. Wij danken Solomon Golding, Bilaal Hassan, Marghi Jani en Ching-Tzu Tseng voor technische bijstand.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



