Summary
Küçük kemirgenlerde kullanılmak üzere kronik implante edilebilir periferik sinir manşet elektrotları oluşturmak için mevcut yaklaşımlar genellikle özel ekipman ve / veya yüksek eğitimli personel gerektirir. Bu protokolde kronik olarak implante edilebilen manşet elektrotlar imal etmek için basit, düşük maliyetli bir yaklaşım göstermekte ve sıçanlarda vagus sinir stimülasyonu (VNS) için etkinliğini gösteriyoruz.
Abstract
Periferik sinir manşet elektrotlar uzun nörolojik ve ilgili alanlarda stimülasyon için kullanılmıştır, örneğin, vagus veya siyatik sinirler. Birkaç yeni çalışmalar motor rehabilitasyon geliştirmek için merkezi sinir sistemi plastisite artırılması kronik VNS etkinliğini göstermiştir, yok olma öğrenme, ve duyusal ayrımcılık. Bu tür çalışmalarda kullanılmak üzere kronik implante edilebilir cihazların inşası farelerin küçük boyutları nedeniyle zordur ve tipik protokoller personel ve zaman alan mikrofabrikasyon yöntemlerinin kapsamlı bir şekilde eğitilmesini gerektirir. Alternatif olarak, ticari olarak kullanılabilir implante edilebilir manşet elektrotlar önemli ölçüde daha yüksek bir maliyetle satın alınabilir. Bu protokolde, sıçanlarda kullanılmak üzere küçük, kronik implante edilebilir periferik sinir manşet elektrotlarının yapımı için basit, düşük maliyetli bir yöntem salıyoruz. Ketamin/ksilazin anestezili sıçanlarda VNS'nin hem implantasyon sırasında hem de cihaz implantasyonundan 10 hafta sonrasına kadar Hering-Breuer refleksinin aktivasyonuile tutarlı solunum hızında düşüşler ürettiğini göstererek manşet elektrotlarımızın kısa ve uzun vadeli güvenilirliğini doğrularız. Ayrıca, vns'yi motor kortikal harita plastisitesini teşvik etmek için yetenekli kol pres performansıyla eşleştirerek manşet elektrotlarının kronik stimülasyon çalışmalarında kullanıma uygunluğunu gösteriyoruz.
Introduction
Son zamanlarda, periferik sinirlerin uyarılması için kronik implante edilebilir manşet elektrotlar için talep büyüdü, çalışmalar giderek çok sayıda inflamatuar hastalıkların tedavisinde bu tekniğin preklinik yararlılığını göstermek gibi1,2,3 ve nörolojik bozukluklar4,5,6,7,8,9,10,11,12,13,14,15. Kronik VNS, örneğin, öğrenme bağlamları çeşitli neokortikal plastisite geliştirmek için gösterilmiştir, motor rehabilitasyon iyileştirilmesi4,5,6,7,8, yok olma öğrenme 10,1111,12,13,14, ve duyusal ayrımcılık15. Ticari olarak mevcut periferik sinir manşet elektrotlar genellikle sipariş yerine getirilmesi ve nispeten yüksek maliyetler için uzun süre ile ilişkilidir, hangi erişilebilirlik sınırlayabilir. Alternatif olarak, kronik implante edilebilir manşet elektrotların "şirket içi" imalatı için protokoller sınırlı kalır ve kemirgen anatomisi küçük boyutları nedeniyle belirli zorluklar sunar. Kronik kemirgen deneyleri için manşet elektrotlar oluşturmak için mevcut protokoller genellikle karmaşık ekipman ve tekniklerin yanı sıra kapsamlı eğitimli personel kullanımını gerektirir. Bu protokolde, daha önce yayınlanmış ve yaygın olarak kullanılan yöntemlere dayalı manşet elektrot imalatı için basitleştirilmiş bir yaklaşım göstermek16,17. Kronik implante edilmiş elektrotlarımızın farelerdeki işlevselliğini, sol servikal vagus sinirinin etrafına manşet implantasyonu sırasında, manşet elektrotlarına uygulanan stimülasyonun SpO2'de nefes alma ve düşmenin başarılı bir şekilde kesilmesine neden olduğunu göstererek doğrulmaktayız. Afferent pulmoner reseptör vagal liflerin stimülasyonu Hering-Breuer refleks meşgul bilinmektedir, hangi beyin sapında çeşitli solunum çekirdeğiin inhibisyonu bastırma ilhamsonuçları 18. Böylece, Hering-Breuer refleksi ile tutarlı nefes kesilmesi, ve SpO2 ortaya çıkan düşüş, anestezili sıçanlarda uygun elektrot implantasyonu ve manşet fonksiyonu için basit bir test sağlar. Kronik implante edilmiş manşet elektrotların uzun süreli işlevselliğini doğrulamak için, implantasyon sırasında refleks yanıtları ölçüldü ve implantasyondan altı hafta sonra aynı hayvanlarda elde edilen yanıtlarla karşılaştırıldı. İkinci bir grup sıçana, bir kol presleme görevinde davranış eğitimi nden sonra VNS manşet elektrotları yerleştirildi. Bu sıçanlarda, VNS doğru görev performansı ile eşleştirilmiş kortikal motor harita yeniden düzenlenmesi üretilen, daha önce yayınlanan çalışmalar ile tutarlı19,20,21,22. Cihaz implantasyonundan 5-10 hafta sonra meydana gelen anestezi altında motor kortikal haritalama sırasında, VNS'nin nefes almanın kesilmesini ve SpO2'de%5'ten fazla düşüşe yol açtığını doğrulayarak VNS ile tedavi edilen hayvanlarda manşet fonksiyonunu daha da doğruladık.
Childs et al.17 ve Rios et al.16'dan yakın zamanda yayınlanan protokoller, basitleştirilmiş manşet elektrot üretim yaklaşımı için iyi onaylanmış bir başlangıç noktası sağlar, çünkü bu popüler yöntem kemirgenlerde kronik VNS çalışmaları yürüten birden fazla laboratuvar tarafından kullanılmıştır1,2,3,4,5,6,7,8,9,10,11. Orijinal yöntem, manşet elektrot imalatının tamamlanması bir saatten fazla sürer ve güvenilir bir şekilde gerçekleştirmek için kapsamlı bir eğitim gerektiren ince mikrotelleri manipüle etmek için birkaç yüksek hassasiyetli adım içerir. Burada açıklanan basitleştirilmiş yaklaşım önemli ölçüde daha az malzeme ve araç gerektirir ve en az eğitimli personel tarafından bir saatten az bir sürede tamamlanabilir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Bu protokolde açıklanan tüm prosedürler, NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak yürütülmektedir ve Dallas'taki Texas Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır.
1. Uyarıcı manşet elektrot imalatı
- Manşet borularını hazırlayın.
- Bir jilet kullanarak, 2,5 mm uzunluğunda polimer boru bir parça kesti. Borunun içine bir ataş veya forceps yerleştirin ve bir tarafta manşet boru duvarından uzunlamasına bir yarık yapmak için bıçağı kullanın.
- Büşeleri borudan çıkarın ve uzun eksene dik olan manşetin orta çizgisinden büyük bir dikiş iğnesi yerleştirin. İğneyi yarıktan (üstten) ve karşıdaki tüpün ortasına (alt) yerleştirin. Kalan montaj adımları sırasında yerine manşet pin için köpük tahta içine iğne yerleştirin.
- İmplantasyon sırasında manşet kapatmayı güvence altına almak için dikiş yerleştirin.
- Küçük dikiş iğnesini manşet duvarından, orta hatta, bir tarafta üst yarıktan yaklaşık 0,5 mm'ye yerleştirin. Manşet borularına zarar vermemek için iğneyi içten dışa yerleştirin. İğnegözüne 2 cm uzunluğunda 6/0 dikiş yerleştirin ve sütün ucunu manşete sokmak için iğneyi boru duvarından çekin.
- İpliği yerinde bırakarak, iğneyi çıkarın ve manşetin orta hattı boyunca ilk deliğin yaklaşık 0,5 mm altında, boru duvarından ikinci bir delik sapla. Sütürü iğnenin gözüne yerleştirin ve iğneyi boru duvarından geçirerek sütü manşetten tekrar geçirin.
- Dikiş ipliği her iki ucu şimdi manşet dış tarafında olmalıdır. Sütürü üst delikten ~1,5 cm, alt delikten ~0,5 mm uzatır.
- Alt delikten uzanan dikişkısa ucuna UV kürü yapıştırıcı küçük bir miktar uygulayın ve alt kuyruk neredeyse boru dış duvar ile floş kadar uzun dikiş ucunu çekin. Yapıştırıcıyı tedavi etmek için UV değnekkullanın ve sütürü sıkıca yerinde tutun.
- Manşetin karşı tarafında 1.2.1 ile 1.2.3 adımlarını tekrarlayın.
- Platin:İridyum (Pt:Ir) tel kablolarını yerleştirin.
- Manşet duvarında 4 delik yapmak için küçük dikiş iğnesi kullanın. Her bir delik, manşetin her iki tarafındaki üst yarıktan yaklaşık 0,5-0,8 mm uzaklıkta, dik orta hattan yaklaşık 0,5-0,8 mm uzaklıkta olmalıdır.
DİkKAT: İpuçlarının en tutarlı ve doğru yerleştirilmesi için, dikiş yerleşimini kılavuz olarak kullanarak, tüm delikleri açmak için iğneyi içten dışa yerleştirin. - Dikiş iğnesini tekrar takın, bu kez dıştan içe, kurşun deliğinden 1. İğnenin gözüne 7,5 cm uzunluğunda pt:Ir telinin yaklaşık 0,5 cm'sini yerleştirin ve borunun içinden geçirerek tel inip manşet duvarından geçirin. Teli manşetin dış tarafına ~4,5 cm kadar uzamış olacak şekilde ayarlayın(Şekil 1A).
- İğneyi tekrar kurşun deliğinden geçirin, yine dıştan içe çalışır ve ayrıca iğneyi kurşun deliğinden doğrudan kurşun deliğinden 2'ye yerleştirin 1. Pt:Ir telinin kısa (iç) ucunun ~0,5 cm'sini iğnenin gözüne takın ve borudan geçirerek tel kurşunu manşet duvarlarından geçirin.
NOT: Pt:Ir telinin her iki ucu artık manşetin dış tarafında olmalı ve yarık kenarının etrafında ve kurşun deliğinden 1(Şekil 1B)bir tel halkası oluşur. - Pt:Ir kablosunun 3 ve 4'ün kurşun deliklerinden geçmesi için 1.3.1'den 1.3.3'e kadar adımları tekrarlayın.
- Bir bütan çakmak kullanarak, pt:Ir tellerin ucundaki 5-6 mm uzunluktaki yalıtımı kurşun deliği 2 ve kurşun deliği 4'ten dikkatlice çıkarın.
DİkKAT: Manşetin ters kalanına zarar vermemek için uçları manşet in geri kalanından dikkatlice izole edin. Yaralanmayı önlemek için kabloları tutmak için araçları kullanın. - Kabloları son konumlarına yerleştirmek için çıplak kabloyu manşetin içine hizala. Bunu yapmak için, pt:Ir telinin ucunu, 1 no'lu delikten, telin yalıtımsız kısmı delik 1 ile temize çıkana kadar uzanan ucunu yavaşça çekin. 3 ve 4 kurşun delikleri ile dişli tel inyalıtımsız ucunu hizalamak için diğer kurşun ile tekrarlayın.
- Kurşun delikleri 1 ve 3 manşetin dış tarafındaki tel halkalara az miktarda UV kürü yapıştırıcısı uygulayın. Yapışkanı tedavi etmek ve müşteri adaylarını yerinde sabitlemek için UV değnekini kullanın.
- Yalıtımsız Pt:Ir tel ibarelerini manşetin iç duvarına itmek için küçük bir pipet ucu kullanın. İpuçları yerleştirildikten sonra, 2 ve 4 arasındaki kurşun deliklerinden uzanan tellerin uçlarını keserek yaklaşık 1 mm'lik telin manşet duvarının dışına uzanıp uzandığını belirtin.
- Telin 1 mm kuyruklarını manşetin dış yüzeyine doğru katlayın ve onları birbirine kısaltmamaya özen inin. Sadece iki kuyrukları kapsayacak şekilde UV kürü yapıştırıcı küçük bir miktar uygulayın ve kurşun yerleşimi güvenli ve elektrik yalıtımı sağlamak için yapıştırıcı tedavi.
DİkKAT: Kabloları izole etmek ve hedef dışı uyarılmayı önlemek için dışa maruz kalan Pt:Ir yüzeylerini yapıştırıcı ile tam olarak kapsaymak önemlidir.
- Manşet duvarında 4 delik yapmak için küçük dikiş iğnesi kullanın. Her bir delik, manşetin her iki tarafındaki üst yarıktan yaklaşık 0,5-0,8 mm uzaklıkta, dik orta hattan yaklaşık 0,5-0,8 mm uzaklıkta olmalıdır.
- Pt:Ir tel ilerlüne dikiş emniyeti ile sabit.
- Köpük tahtadan manşet montaj ile büyük iğne çıkarın. İğnegözüne 3 cm uzunluğunda 6/0 dikiş takın ve orta noktada manşetin alt kısmından dikiş çıkarmak için iğneyi borudan çekin.
- Pt:Ir kurşun emniyeti için dikiş ipliğini tamamlamak için küçük dikiş iğnesine geçin. İğneyi aynı orta hat deliğinden geçirin, borunun ve telin deformasyonundan kaçınmak için içten dışa doğru tekrar çalışın. Sütürün dış kuyruğunu iğnegözüne yerleştirin ve manşetin kenarına dikiş halkası oluşturmak için iğneyi manşet duvarından çekin(Şekil 1C).
NOT: Dikişin manşetin uzun ekseni boyunca yöneltilmesini ve boruya karşı düz yatmasını sağlamak için pratisyen hekimler kullanın ve mikroskop altında çalışın. Bu adım, kurşunların manşetin iç tarafında ayrı kalmasını ve manşet orta hattına yanal olarak yerleştirilmesini sağlar. - Manşetin dış tarafında, sütür uçları yarım düğüm halinde bağlayarak manşetin diğer ucu etrafında ikinci bir döngü oluşturun. Dikişin manşetin uzun ekseni boyunca çalıştığından ve boruya karşı düz olduğundan emin olun. Düğüm sıkı tutarken bu boru karşı düz yatıyor, uv kürü yapıştırıcı küçük bir miktar uygulayın yarım düğüm ve yerinde tutmak için tedavi.
- Dikiş ipliğin uçlarını mümkün olduğunca düğüme yakın dikkatlice kesin. Gerekirse, dikişkısa uçları yapıştırmak için ek UV kürü yapıştırıcı sıyrık küçük bir miktar kullanın, böylece tüp karşı düz yatıyordu(Şekil 1D).
- Lehim konektörü pt:Ir tel kablolarına bağlanır.
- Bir bütan çakmak kullanarak, Pt:Ir tel kablolarının her birinin sonundaki ~3 mm'lik yalıtımı çıkarın. Bir altın iğnenin fincan tarafını lehimle (Bkz. Malzemeler Tablosu)her kurşunun yalıtımsız ucuna kadar.
- Monte edilen cihazın empedansını test edin.
- Altın pimleri bir LCR metre veya elektrot empedans kontrol modülü girişlerine bağlayın ve test frekansını 1 kHz'e ayarlayın. Altın kurşun pimleri ve prob konektörleri kuru tutmaya özen, tuzlu dolu küçük bir kabın içinde manşet boru (ve Pt:Ir stimülasyon temasları iç manşet) batırın. Monte edilmiş manşetin implantasyona geçmeden önce 1 kHz'de 2 kΩ'den daha az bir empedansa sahip olduğunu doğrulayın.
NOT: Yüksek empedans genellikle yetersiz Pt:Ir yüzey alanı maruz gösterir, yalıtım yetersiz kaldırma gibi faktörler nedeniyle ortaya çıkabilir, manşet iç yapıştırıcı kazara uygulama, kırık tel iplikçikleri, vb. Manşetler ayrıca, uzun süreli kullanımda kısa temaslara neden olabilecek kırık veya kötü yerleştirilmiş tel iplikçikler için de kontrol edilmelidir.
- Altın pimleri bir LCR metre veya elektrot empedans kontrol modülü girişlerine bağlayın ve test frekansını 1 kHz'e ayarlayın. Altın kurşun pimleri ve prob konektörleri kuru tutmaya özen, tuzlu dolu küçük bir kabın içinde manşet boru (ve Pt:Ir stimülasyon temasları iç manşet) batırın. Monte edilmiş manşetin implantasyona geçmeden önce 1 kHz'de 2 kΩ'den daha az bir empedansa sahip olduğunu doğrulayın.
2. Baş-kapak yapımı
NOT: Headcap montaj prosedürleri daha önce yayınlananlara benzer (Childs ve ark.17), ve burada kolaylık sağlamak için özetlenmiştir.
-
Başlık17 montajı
- 30 AWG tel sargı, bir ~13 mm uzunluğunda ve bir ~10 mm uzunluğunda iki küçük parça kesin. Her iki kablonun her iki ucundaki ~1,5 mm'lik yalıtımı sökün. Her telin bir ucuna altın bir iğnenin pim tarafını, bardağa mümkün olduğunca yakın şekilde lehimle. Lehim eklemi ötesinde pin fazla uzunlukta kesmek için tel kesiciler kullanın.
- 4 iğneli mikro şerit konektörün iki merkezi lehim kaplarına AWG kablolarının diğer uçlarını lehimleme.
- Tel başlığı bükmek konektöre doğru yol açar ve şekil 2A'dagösterildiği gibi altın pimleri birbirine paralel olarak konektöre karşı düz bir yere yerleştirin. Kısa kabloya bağlı pim, uzun kabloya bağlı pimin altına yerleştirilmelidir. Yerine headcap yol güvenliğini sağlamak için tırnak akrilik, diş çimentosu veya UV kür yapıştırıcı kullanın.
3. Cihaz kullanımı
- Kronik vagus sinir stimülasyonu için manşet elektrotlarını yerleştirin.
NOT: Tüm cerrahi işlemler steril veya aseptik teknik kullanılarak uygun anestezi altında, NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Rehberine uygun olarak ve lokal IACUC onayı ile yapılmalıdır. Aşağıdaki yordamlar aygıtın temsili kullanımını göstermek içindir ve kapsamlı olması amaçlanmamıştır.- Bir stereotaksik çerçeve içinde sıçan yerleştirin ve headcap / konektör implantasyonu için kafatası yüzeyini ortaya çıkarmak için parietal ve oksipital kemikler üzerinde sagital kesi yapmak. Dikkatle kafatası 4 delik matkap ve kuyumcu vidaları yerleştirin. Kafatası ve vidalar için headcap güvenli diş akrilik kullanın.
- Stereotaksik çerçeve den sıçan çıkarın ve sağ tarafında yatıyordu. Boynun sol tarafında deride dikey bir kesi yapın ve sterilomastoid ve sternohyoid kaslar arasında ve omohyoid kas altında bulunan karotis arter, sol vagus sinirini dikkatlice inceleyin.
- Manşetin tüneli deri altında kafatasına doğru gidiyor. Altın pimleri kullanarak müşteri adaylarını başlık başına bağlayın.
- Vagus sinirini manşetin içine yerleştirin ve kelepçe dikişlerine çift düğüm atarak cihazı kapatın. Künt, iletken olmayan kancalar ile sinir manipüle ederek veya sinir çevreleyen bağ dokusu kavrayarak implantasyon sırasında sinir zarar önlemek için dikkatli olun.
- Cihaza stimülasyon uygulayarak implantı test edin (10 s tren 0.8 mA, 30 Hz, 100 μs bifhasic darbeler). Uygun implantasyon nefes kesilmesi ve SpO2%5 veya daha fazla bir düşüş ile sonuçlanacaktır.
- Kapak altın iğneler ve diş akrilik ile maruz yol açar, dikiş ile yakın yaralar, ve tuzlu kesi siteleri temizlemek, alkol, ve povidon iyot çözeltisi.
- NIH yönergeleri ve IACUC onayı doğrultusunda replasman sıvıları, analjezikler ve postoperatif bakım sağlayın.
- Uyanık davranış sırasında vagus siniri uyarmak.
NOT: Hayvanlar belirli motor görevleri yerine getirirken VNS'nin teslimi daha önce görevle ilgili kasların motor haritası gösterimini genişletmek için gösterilmiştir. Bu doğrulanmış paradigmayı cihaz kullanımının temsili bir örneğini sağlamak için kullanırız, ancak diğer birçok davranışsal paradigma ve/veya stimülasyon parametreleri alternatif uygulamalarla ilgili olabilir. Sıçanlar cihaz implantasyonu ndan önce burada kullanılan kol pres görevi üzerinde yeterlilik için eğitildi. Ameliyat sonrası, iyi performans vns doğum dan önce tekrar doğrulandı: sıçanlar günde iki 30 dakika eğitim seanslarında en az 100 başarılı deneme yaptı. VNS, 5 gün boyunca sonraki 10 eğitim seansında doğru kol presleri ile eşleştirilmişti.- Sıçanı implante edilmiş baş kapağı aracılığıyla bir uyarıcı jeneratöre bağlayın ve uygun stimülasyon ayarlarına ayarlayın. Motor kortikal haritanın VNS kaynaklı yeniden düzenlenmesi için, her doğru kol presini, her biri 100 μ'lik genişliğe ve 800°A genliğe sahip 15 biphasik darbeden oluşan tek bir trenle eşleştirin.
- Bir stimülasyon treni, on 30 dk eğitim seansları boyunca her başarılı kolu prestespit hemen sonra teslim edilir. VNS-teslimat sırasında, akım stimülasyonunun başarılı bir şekilde teslimini izlemek için bir osiloskop kullanın.
- Kronik implante manşet fonksiyonunu doğrulayın.
- Son VNS eşleştirilmiş eğitim oturumu24 saat içinde, motor korteks19fonksiyonel somatotopik harita ölçmek için intrakranial mikrostimülasyon (ICMS) kullanın,20,21,22.
- Motor korteksin ICMS haritalaması için anestezi indüksiyonundan sonra, Hering-Breuer refleksi ile uyumlu, SpO2 seviyelerinde nefes alma ve azaltmanın kesilmesine neden olacak 30 Hz, 0.8 mA akım stimülasyon (100 μs biphasic darbeler) 10 s tren uygulayarak manşet fonksiyonunu tekrar doğrulayın.
NOT: Uygulamaya bağlı olarak, güvenilir bir SpO2 damlası %5'ten az gözlenirse veya daha yüksek akım genlikleri (1,6 mA'ye kadar) güvenilir bir şekilde SpO2'deen az %5 azalma üretirse, manşet işlevi kabul edilebilir. SpO2'de solunumun kesilmesi ve/veya güvenilir bir düşüşün gözlemlenmemesi implant yetmezliğinin göstergesidir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vagus sinir manşet elektrotlar ve headcaps kronik sıçanlarda daha önce yayınlanan cerrahi işlemlere göre implante edildi17,19,20,21,22. İmplantasyondan önce, 1 kHz'de empedans manşet kurşunları arasında ölçüldü ve manşet borusu saline batırıldı (empedans = 1.2 ± 0.17 kΩ [ortalama ± std]; N = 9). Sadece salinde 2 kΩ'den az empedanslı manşetler yerleştirildi; tüm manşetler bu kriteri karşıladı (0/9 manşet hariç). İmplantasyon ameliyatları sırasında, tüm manşetlerin fonksiyonel doğrulaması, Hering-Breuer refleksine atfedilen stimülasyona bağlı kısa süreli solunumun kesilmesi ve ardından gelen kan oksijen doygunluğu düşüşü için yapılan testlerle gerçekleştirildi. Bu yanıtı uyandırmak için, manşet kurşunları arasında 30 Hz, 0.8 mA akım stimülasyon (100 μs bifhasic bakliyat) 10 s tren teslim edildi. 9/9 implante edilmiş manşetlerde, 10 sn stimülasyon süresince VNS'ye bağlı solunumun kesilmesi gözlendi, spO2'de en az %5'lik bir düşüş eşlik etti (% SpO2 = -10.3 ± %3.2, ortalama ± std; aralık = -5.7 ila -14.5%), manşet fonksiyonu ve uygun implantasyon onaylandı. İlk implantasyon sırasında, ilk SpO2 okumaları ile VNS tarafından uyarılanınca SpO2'deki yüzde değişim arasında anlamlı bir korelasyon bulduk(Şekil 2B; R2 = 0.60, p = 0.0083, Pearson'ın lineer korelasyon), anestezi derinliğinin Hering-Breuer refleksinin büyüklüğünü etkilediğini gösteren yayınlanmış literatürile tutarlı23,24. Kronik implante edilmiş manşetlerin uzun süreli işlevselliğini test etmek için, sıçanlar cihaz implantasyonundan 6 hafta sonra tekrar anestezi edildi ve Hering-Breuer refleks yanıtını uyandırmak için VNS uygulandı. 9 cihazın 7'sinde, 0,8 mA, 30 Hz stimülasyon(Şekil 2C)olmak üzere 10 tren kullanarak SpO2'de %5'ten fazla bir düşüş gözlemledik. Bu cihazlarda, SpO2'deki stimülasyon uyarılmış değişimin büyüklüğü ilk implantasyonda gözlenenden farklı değildi, kronik implante edilmiş cihazların mükemmel sürekli performansı (SpO2 = -9.7 ± %3.4' de ilk % değişimi, SpO2 'de son % değişim = -15.8 ± %6.5, ortalama ± std; p = 0.08, eşleştirilmiş t-testi). Geri kalan 2 cihazda, stimülasyon genliğini 1,6 mA'ya çıkarmak, spO2'de en az %5'lik güvenilir bir azalma uyandırmak için yeterliydi, bu da bu cihazların çalışmaya devam ettiğini düşündürdü, ancak zaman içinde empedans, sinir hasarı veya manşet oryantasyonundaki değişiklikler performansın düşmesine yol açmış olabilir.
Daha fazla bizim kronik implante uyarıcı elektrotlar uzun vadeli işlevselliğini test etmek için, sıçanların ikinci bir grup usta bir erişim kolu-basın görev Hays ve ark tarafından geliştirilen basitleştirilmiş bir versiyonu üzerinde eğitildi kantitatif forelimb motor performansı değerlendirmek için25. Birden fazla çalışma, bu görev üzerinde doğru motor performansı ile VNS eşleştirme primer motor korteks19proksimal forelimb gösterimi genişlemesi sonuçları göstermiştir,20,21,22. Görevin basitleştirilmiş versiyonunda, farelerin bir kolu tamamen bastırmak için eğitim kabininin dışında 2 cm'ye ulaşması ve daha sonra bir gıda ödülü almak için 2 s içinde serbest bırakmaları gerekiyordu(Şekil 2D). Hayvanlar, görevde istikrarlı bir yeterlilik elde edene kadar günde iki adet 30 dakika eğitim seansı aldılar (>%65 doğru, >100 deneme/seans, en az 8/10 ardışık seans için). Sıçanlar daha sonra sol vagus siniretrafında uyarıcı bir manşet elektrot implante ameliyat oldu. Ameliyattan sonra, uyarıcı kablolara alışma ve yeterli davranışsal performansa geri dönen sıçanlara, vns (0,5 s tren 0.8 mA, 30 Hz bakliyat; 100 μs biphasic nabız genişliği) veya sahte stimülasyon (stimülasyon yok) gibi ek 10 eğitim seansları verildi. Son VNS eşleştirilmiş eğitim seansından sonra 24 saat içinde sıçanlar ketamin/ksilazin (80/10 mg/kg, i.p.), manşet elektrot fonksiyonu test edildi ve yayınlanan prosedürlere göre kortikal motor haritalama yapıldı22. VNS'nin görevle ilgili motor harita gösterimlerinin genişlemesini tetiklediğini gösteren önceki çalışmalarla tutarlı olarak, VNS tedavi edilmiş sıçanlar (N = 3) çalışmamızda sahte tedavi edilmiş sıçanlara (N = 4) göre önemli ölçüde daha büyük proksimal forelimb (PFL) temsilleri sergilenmiştir(Şekil 2D; Toplam harita alanının PFL % ortalaması + SEM: sham = 15.6 ± %6.7, VNS = %38.3 ± %1.0; p = 0.035, 2-örnek t-testi, test gücü = 0.8). VNS ile tedavi edilen tüm hayvanlarda, vns(10 mA, 30 Hz bakliyat 100 s tren; 100 μs bifhasik darbe genişliği) yanıt olarak SpO2'de %5'ten fazla bir değişiklik meydana geldiğini doğrulayarak, haritalama sırasında anestezi indüksiyonundan sonra manşet işlevi doğrulandı.
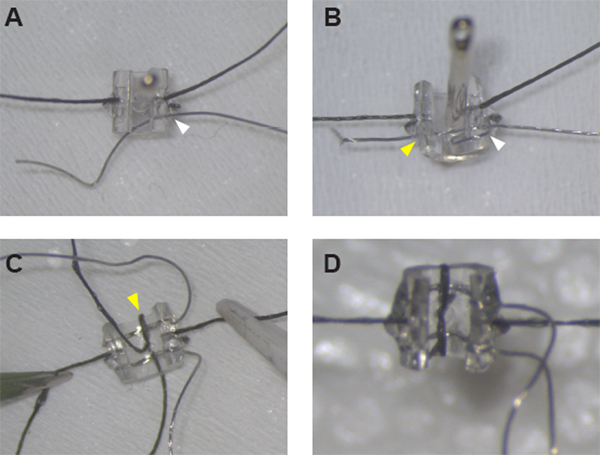
Şekil 1: Uyarıcı manşet elektrotlarının montajı. (A) Manşetin her iki tarafındaki dikişleri emniyete aldıktan sonra Pt:Ir teli, dikiş iğnesi kullanılarak #1 (beyaz ok başı) deliğe kelepçe duvarından geçirilebilir. (B) Pt:Ir tel düzgün dişli ve manşet kenarı etrafında bir tel döngü oluşturduktan sonra de-yalıtım için hazır ve delik #1 (beyaz ok başı) ve delik #2 (sarı ok başı) ile manşet üzerinden tel tekrar iplik. (C) Her iki ipucu da yerleştirildikten sonra, ilk kurşunu orta çizgi deliğinden ve manşet kenarına (sarı ok ucu) geçirerek sabitle. (D) Manşet montajını tamamlamak için ikinci kurşunun etrafındaki halkayı yarım düğüm ve tutkalla kapatın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Uyanık farelerde kronik vagus sinir stimülasyonu için cihaz kullanımı. (A) Headcap montajı. (B) Cihaz implantasyonu sırasında, SpO2'deki VNS uyarılmış azalmalar ilk SpO2 okumaları ile korelasyon (R2 = 0.602, p = 0.008, Pearson'ın lineer korelasyon). (C) Cihaz implantasyonunda elde edilen VNS uyarılmış SpO2 damlasının karşılaştırılması, 6 hafta sonra stimülasyon deneylerinin sonlandırılması ile karşılaştırılır. Çizgiler, tek tek sıçanlar için ölçüm çiftlerini gösterir. B ve C panellerinde stimülasyon, 0,8 mA'da teslim edilen 100 μs bifhasik darbeli tek bir 10 s trenve 30 Hz.(D) Kronik implante edilmiş VNS manşet elektrotlarla birlikte, kol presi görevini yerine getiren tek bir 10 s trenden oluşuyordu. (E) VNS (0.5 s tren 0.8 mA, 30 Hz, 100 μs bifhasic bakliyat) doğru kol-basın performansı ile eşleştirilmiş motor kortekste görev ile ilgili kas harita gösterimi genişletti. VNS alan sıçanlar, doğru kol pres performansı (N = 3) ile eşleştirilmiş olarak, Şam stimülasyonunu alan sıçanlara göre proksimal forelimb (PFL) temsiline ayrılmış çok daha büyük bir motor harita alanı yüzdesi sergilemiştir (N = 4). Nokta bireysel konular için PFL gösterimleri gösterir; hata çubukları SEM. VNS tedavisinin ardından motor kortikal haritalamanın implantasyon sonrası 5-10 hafta sonra yapıldığını göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Burada kemirgenlerde kullanılmak üzere kronik olarak implante edilebilen uyarıcı manşet elektrotlarının montajı için basit, düşük maliyetli bir yaklaşım tanımlıyoruz ve bu yeni ortaya çıkan tedavinin klinik öncesi araştırmalarını kolaylaştırıyoruz. Bu basitleştirilmiş yöntem hiçbir özel eğitim veya ekipman gerektirir ve diğer yaklaşımlar16,26,,27,28ile karşılaştırıldığında cihaz üretiminin hem parasal hem de işçilik maliyetlerini azaltarak, çoğu araştırma laboratuvarları için kolayca erişilebilir araç ve malzeme az sayıda kullanır. Dikişlerin yeterli mekanik stabilitesini sağlarken UV kürü yapıştırıcısının aşırı uygulanmasını önlemek için montaj boyunca bakım gereklidir ve Pt:Ir uzun süreli manşet fonksiyonu için yol açar. Aşırı yapışkan cihaz implantasyonu karmaşıklaştırır ve ameliyat sonrası çevre doku tahriş edebilir, yetersiz yapıştırıcı zaman içinde yol sinir ile iyi temas olmayabilir olasılığını artırır, azalmış cihaz performansı veya başarısızlık ile sonuçlanan. İzole lümeni içinde yalıtımsız Pt:Ir tellerin tutarlı yerleşimi, düşük empedanslar ve iyi cihaz performansı elde etmek için de önemlidir. Yalıtımsız teli, açıkta kalan telin mümkün olan maksimum yüzeyinin manşetin içinde yer alması, dıştan açıkta tel bulunmaması için düzgün bir şekilde hizaya alınmasına özen dilmelidir.
Biz yaklaşımımızsıçanlardakronik VNS teslimat için çeşitli laboratuvarlar tarafından şu anda ortak kullanımda olanlar olarak benzer boyut ve güvenilirlik manşet üretir doğruladı 4,5,6,7,8,9,10,11,12,13,14,15,19,20,21,22. Son çalışmalar, periferik sinir liflerinin benzer şekilde elektrot temas boyutları ve oryantasyonları geniş bir yelpazede kullanılarak işe olduğunu göstermektedir16,29, Bu protokol periferik sinir stimülasyonu gerektiren birçok deney için adapte edilebilir düşündüren, ve kurşun aralığı veya elle manşet montajı kaynaklanan yüzey alanında küçük varyasyonlar kritik en deneysel sonuçları etkilemez. Her stimülasyon seansı sırasında, kurşunların kısaltılmadığından veya kırılmadığından emin olmak için bir osiloskop kullanarak manşet yollarında voltajı izledik, ancak implant sonrası 5-10 hafta boyunca belirli implante edilmiş cihazlariçin empedans taki değişiklikleri izlemedik. Benzer bir implante cihazın bir çalışmada empedans önemli ölçüde cerrahi implantasyon sonrası ilk 4 hafta içinde artış yok bildirdi, muhtemelen akut yaralanma stabilize olarak30. Bu çalışmada, ancak, cihaz empedans değişiklikleri kronik implantasyon 8 hafta boyunca cihaz performansı ile ilişkili değildi: yazarlar vns yoğunluğu ve bileşik eylem potansiyeli genliği arasındaki ilişkide birkaç hafta sonrası implant arasında anlamlı bir değişiklik rapor. Burada, benzer şekilde 5-10 haftalık implantasyondan sonra (i) VNS'nin hering-Breuer refleksi ile tutarlı spO2'de nefes alma ve düşmenin kesilmesini uyandırabileceğini doğrulayarak ve (ii) VNS'nin bağlı motor haritası yeniden yapılanmasını gösteren önceki çalışmaları çoğaltmak gibi işlevsel olarak manşet performansını doğrulayabildik. Kendi çalışmamızda, Hering-Breuer refleksinin implante edilmiş VNS manşetlerin uzun süreli işlevselliğini doğrulamanın en güvenilir yolu olduğunu gördük, bu da manşet montajıyla ilgisi olmayan bir dizi faktöre bağlı olarak cihaz performansında veya arızada azalma gösterebilir; bunlar arasında cerrahi komplikasyonlar, sinir hasarı ve/veya manşet veya baş kapağının mekanik hasarı sayılabilir. Mükemmel cerrahi teknik ve cihaz işlevselliğinin uygulamaya özgü doğrulaması, kronik implante edilmiş uyarıcı manşet elektrotların istikrarlı ve başarılı kullanımı için çok önemlidir.
Biz küçük hayvanlarda kronik implantasyon için periferik sinir manşet elektrotların montajı için basit, ucuz bir yaklaşım tarif ve sıçan davranış deneyleri sırasında VNS teslim için yararlılığını gösterdi. VNS giderek romatoid artrit 1,1,2 ve Crohn hastalığı,31 gibi nörolojik hastalıkların yanı sıra inme5gibi nörolojik bozukluklar dahil olmak üzere klinik endikasyonları geniş bir yelpazede için soruşturma altında 5,6,7,8 ve TSSB10,11. Uyarıcı manşet elektrotlar yapmak için bu erişilebilir yöntem mekanizmaları ve VNS etkinliği içine çeviri araştırma çalışmaları çeşitli preklinik kemirgen modellerinin kullanımını kolaylaştırmak gerekir. Protokol kolayca uyarlanabilir ve yaklaşımın çok yönlülüğünü daha da artırır. Örneğin, poliüretan tüpün çapı ve/veya uzunluğu, diğer türlerde veya diğer periferik sinir bölgelerinde (örn. siyatik, frenik veya sakral sinirler) kronik stimülasyon deneylerine uyum sağlayacak şekilde değiştirilebilir. Alternatif olarak, ek yol ile yapılandırmaları sinir boyunca birden fazla sitede stimülasyon etkinleştirebilir, ya da bir uyarım uyarılmış bileşik eylem potansiyelinin eşzamanlı kayıt barındırabilir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarların açıklayacak bir şeyi yok.
Acknowledgments
Bu çalışma Dallas'taki Texas Üniversitesi ve UT Vekiller Kurulu tarafından finanse edilmiştir. Teknik yardım için Solomon Golding, Bilaal Hassan, Marghi Jani ve Ching-Tzu Tseng'e teşekkür ederiz.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



