ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
ここでは、フルオロフォアのナノからミクロモル濃度で単分子イメージングのための金属張りのガラス顕微鏡カバースリップにおけるナノパーチャーの配列であるゼロモードの導波管の平行作製のためのナノスフィアリソグラフィー法を説明する。この方法は、コロイド結晶自己集合を利用して導波管テンプレートを作成します。
Abstract
単一分子蛍光エンミノロジーでは、溶液中の標識基質からのバックグラウンド蛍光は、多くの生理学的リガンド濃度よりも数桁少ない数桁のピコからナノモルの範囲に蛍光を制限することが多い。アルミニウムや金などの薄い導電金属で作られた直径100~200nmの直径開口であるゼロモード導波管(ZMWs)と呼ばれる光学ナノ構造は、可視光励起をゼプトリットル有効体積に限定することで、蛍光色素のマイクロモル濃度で個々の分子をイメージングすることができます。しかし、高価で特殊なナノファブリケーション装置の必要性は、ZMWsの広範な使用を妨げている。典型的には、ZMWsのようなナノ構造は、逐次的かつ遅い電子ビームリソグラフィを用いて直接書くことによって得られる。ここで、コロイド、またはナノスフィアは、導波路製作のためのナノメートルスケールマスクを作成する代替戦略として用いられる。このレポートでは、各フェーズの実際的な考慮事項と共に、アプローチについて詳しく説明します。この方法により、数千のアルミニウムまたはゴールドのZMWを並列に作成でき、最終的な導波管の直径と深さは100〜200nmです。金属蒸着用の一般的なラボ機器と熱蒸発器のみが必要です。生化学的コミュニティにZMWsをよりアクセスしやすくすることで、この方法は細胞の濃度と速度での分子プロセスの研究を容易にすることができます。
Introduction
単一分子蛍光共鳴エネルギー伝達(smFRET)や単分子蛍光相関分光(FCS)などの単一分子技術は、分子生物物理学のための強力なツールであり、転写1、2、3、翻訳4、6などのプロセスにおける個々の生体分子の動的動き、立体構造、相互作用の研究を可能にする7。smFRETの場合、多くのテザード分子が経つ場合があり、TIRによって発生するエバネッセント波はカバースリップ8に隣接する100-200 nm領域に制限されるため、全内部反射蛍光(TIRF)顕微鏡は一般的な方法である。しかし、励起体積に関するこの制限があっても、背景蛍光9を超える単一分子シグナルを検出するためには、関心のある蛍光体をpMまたはnM範囲に希釈する必要がある。細胞酵素のミカエル-メンテン定数は、典型的にはμMからmM範囲10であるため、単一分子研究における生化学的反応は、通常、細胞内の反応よりもはるかに遅い。例えば、タンパク質合成は大腸菌11,12において1秒当たり15~20アミノ酸で起こり、smFRET実験における原核生物リボソームの大部分は、毎秒0.1~1アミノ酸で翻訳される。タンパク質合成において、失速リボソーム上の結晶構造およびsmFRETは、tRNA-mRNA転座ステップ14,15の前に「ハイブリッド」状態と「古典的」状態の間でRNA(tRNA)の転移が変動することを示した。しかし、転座GTPase因子の生理的濃度が、EF−G、存在した場合、異なる立体構造、ハイブリッド状態と古典状態との中間体が、smFRET6で観察された。細胞内と同様の速度と濃度で動的分子プロセスを研究することは重要ですが、技術的な課題は残っています。
蛍光基質濃度を高める戦略は、ゼロモード導波ガイド(ZMWs)と呼ばれる金属ベースのサブ可視波長開口を用いて、開口16内に局在する生体分子を選択的に励起する限定励起場を生成することである(図1)。開口部は通常、直径 100~200 nm、深さ17で 100~150 nm です。ウェルの大きさと形状に関連するカットオフ波長(λc≈、水を有する円形導管の直径の2.3倍の誘電媒体18)、導波路では伝播モードが認められません。しかし、振動電磁場は、エバネッセント波と呼ば、指数関数的に強度が減衰し、依然として導波管18,19に短い距離をトンネルする。TIRエバネッセント波と同様に、ZMWエバネッセント波は減衰定数が短く、導波路内で10〜30nm有効な励起領域を生じます。蛍光標識リガンドのマイクロモル濃度では、励起領域内に同時に存在する分子は1個または数個に過ぎない。この励起体積の制限とそれに伴うバックグラウンド蛍光の減少により、生物学的に関連する濃度で単一分子の蛍光イメージングが可能になります。これは、多くのシステム20に適用されているが、単一タンパク質拡散21のFCS測定、低親和性リガンドタンパク質22およびタンパク質タンパク質相互作用23の単一分子FRET測定、および単一分子ターンオーバーイベント24の分光電気化学的測定を含む。
ZMWsは、イオンビームミリング25、26または電子ビームリソグラフィ(EBL)を用いて金属層を直接パターン化し、続いてプラズマエッチング16、27を生成した。これらのマスクレスリソグラフィ法は、一連の導波ガイドを作成し、通常、ZMW技術の普及を防ぐために、特殊なナノファブリケーション施設へのアクセスを必要とします。もう一つの方法は、紫外線ナノインプリントリソグラフィーリフトオフ28、切手のようなレジストフィルムに逆ZMWテンプレートを押し込むために石英スライド型を使用する。この方法はより合理化されていますが、石英金型の製造にはEBLが必要です。本稿では、EBLやイオンビームミリングを必要とせず、リソグラフィマスクを形成するためにナノスフィアの密閉に基づく、シンプルで安価なテンプレート化された製造方法のプロトコルを紹介します。
1982年にDeckmanとDunsmuir29,30によって最初に提案されたナノスフィアまたは「天然」リソグラフィーは、数十ナノメートルから数十マイクロメートル31までの単分散コロイド粒子の自己集合体を使用して、エッチングおよび/または材料の堆積を介した表面パターニングのテンプレートを作成します。2次元(2D)または3次元(3D)コロイド粒子の拡張周期配列は、コロイド結晶と呼ばれ、散乱および回折32からの明るい虹彩を特徴とする。電子ビームやフォトリソグラフィよりも広く使用されていないが、このマスキング方法論は、シンプルで低コストで、100nm以下の特徴サイズを作成するために簡単に縮小されます。
コロイド粒子の自己集合性を導き、表面パターニング用のマスクとしてコロイド結晶を使用することの成功を決定します。粒子の大きさと形状が均質であれば、コロイド粒子は、六角形のパッキングで容易に自己組み立てすることができ、エントロピー枯渇33によって駆動される。滴下後の水蒸発はコロイド粒子を沈降させる有効な経路であるが、他の方法としては、ディップコート34、スピンコート35、電気泳動堆積36、空気水界面37での定着が挙げられる。以下に示すプロトコルは、最も簡単に実装された蒸発堆積物法に基づいています。密梱されたポリスチレンビーズ間の三角形の間間に、犠牲金属をプレートする開口部を形成し、ポストを形成する(図2 および 補足図1)。このステップの前にビーズの短いアニーリングは、これらのポストの形状と直径を調整します。ビーズが除去され、最終的な金属層がポストの周りに堆積し、ポストが削除されます。コロイドナノマスクへの2つの金属蒸着ステップ、中間ポストの除去、およびパッシベーションおよびテザリングのための表面化学修飾の後、ZMWアレイは単一分子イメージングに使用する準備ができています。製造後のZMW光学特性のより広範な特性は、添付の記事38で見つけることができます。金属の蒸着のための熱蒸発器のほかに、特別な用具は要求されない。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注: すべての手順は、一般的なラボスペースで完了できます。
1. ガラスカバースリップクリーニング
- コロイド粒子の蒸発堆積のためのきれいな表面を提供するために、24 x 30 mmの光学ホウケイ酸ガラスカバーリップ(0.16-0.19 mm厚さ)を、コプリンガラス染色瓶の溝付きインサート内に配置して洗浄します。
注: クリーニングプロセス中にすべての表面がはっきりと露出するように、カバーリップが直立し、十分に分離されていることを確認してください。 - 染色瓶に十分なアセトンを注ぎ、カバーを覆い、カバーを置き、40°Cで10分間超音波処理します。
- アセトンを注ぎ、染色した瓶に蒸留したH2Oを充填し、水を注いでカバーリップをすすいだ。さらに2回繰り返します。
- アセトン超音波処理(ステップ1.2と1.3)をもう一度繰り返します。
- 40°Cで20分間カバーリップと超音波処理をカバーするのに十分な200 mM KOHを瓶に注ぎます。
注:KOHはガラスを少しエッチングします。 - 蒸留したH2Oを6回でカバーリップをすすいでください。
- カバーリップを覆うエタノールを加え、蓋を加え、40°Cで10分間超音波処理します。
- 蒸留したH2Oを3回でカバーリップをすすいでください。
- 穏やかな鉗子を使用して端の各カバースリップを拾い、N2 ガスでカバースリップを乾燥させる。カバースリップの端だけをタッチします。乾燥した洗浄されたカバーリップをそれぞれ、個々のきれいなペトリ皿に入れます。
2. ポリスチレンビーズの蒸発蒸着
- ZMWアレイ用のコロイド結晶マスクを作成するために、直径1μmの遠心分離機50μL、非機能化ポリスチレンビーズ(水中2.5%w/v)を15,000xg、25°Cで5分間作成した。
注:ビーズをピペットする前に、ビーズがボトルの底に落ち着いた場合に備えて、ストック液を短時間渦に入れる必要があります。 - 上清を捨て、残りの水はできるだけ少なくします。
注:残留水はエタノール再懸濁液39の蒸発特性を変化させることができるので、すべての水を除去するために少量のビーズを除去することは許容される。 - ステップ2.2からビーズを50 μLの1:400 TritonX-100:エタノール溶媒で再懸濁します。ピペットを数回上下にして、ビーズと溶媒を完全に混合します。
注:TritonX-100:エタノール溶媒は、使用後パラフィンフィルムで密封し、月に一度新鮮に調製する必要があります。ビーズは、マイクロ遠心チューブなどのプラスチック容器の側面に付着する傾向があるため、側面に沿ってピペットがすべてのビーズを再懸濁するようにします。 - 堆積のための湿度室を設置するには、蓋がわずかにアジャールを残したラインのベンチに、それぞれ1つのカバースリップを備えた6ペトリ皿を置きます。各皿で、次のステップで湿度が上がったときにカバーリップが環境にさらされるように、カバースリップを開いた領域に移動させます。
- ペトリ皿の後ろに湿度計と小さな扇風機を置きます。
- 開始相対湿度 (RH) をラボに記録します。200 mL ビーカーに約75°Cの水150~200 mLを充填し、ファンの後ろに置きます。
- ファンの電源を入れ、ペトリ皿、ファン、ビーカー、湿度計を覆い、透明なプラスチック製の収納容器(66cm x 46 cm x 38 cm)で覆います。
- チャンバー内のRHを70-75%に上昇させ、通常は5-10分かかります。
注:アンビエントラボRHが低い(〜50%未満)場合は、チャンバーが高いRHに到達しますが、堆積中の湿度の損失を補うために80%以下にします(下記参照)。 - RHが70-75%に達したら、RHを記録し、プラスチック製の貯蔵容器をわずかに持ち上げて、カバーをペトリ皿に素早く置き、カバースリップの過度の濡れを防ぎます。
注: チャンバー内の温度は、加湿の結果として室温(通常は25-26 °C)よりもわずかに暖かくなります。カバーリップに水分が見える場合は、ガラス表面が濡れ過ぎる。商用グローブボックスは、プロトコルのこの部分を簡素化する可能性があります。 - チャンバー内のRHは85%まで上昇し続けます。その時点で、湿度チャンバにRHを記録し、各カバースリップの中央にビーズサスペンションのピペット5μLを記録します。
- 湿度の損失を最小限に抑えるために、各堆積物の後にチャンバーとペトリ皿を閉じます。2分以内に6つの堆積物をすべて仕上げるようにしてください。
- 堆積後のチャンバーにRHを記録します。
注: 堆積後の RH は、周囲の実験室の条件に依存する堆積中にどのくらいの速さで湿度が失われたかを測定するのに役立ちます。典型的な成功した走行のために、チャンバは堆積の前に85%RHで始まり、堆積後70-75%RHで終わる。 - ビーズの液滴を広げて5分間乾燥させます。
注:コロイド結晶が多くの穴や多層領域を持っている場合、チャンバーはそれぞれ湿度が高すぎたか乾燥している可能性があります。ペトリ皿を閉じる相対湿度を調整し、堆積を開始します(最適化の詳細については、結果セクションを参照)。
3. コロイド結晶テンプレートで毛穴のサイズを小さくするためのビーズアニーリング
- ビーズ間のインタースティックスを狭め、インタースティックスのコーナーを丸めるポリスチレンビーズのアニーリングのための均一な温度表面を提供するために、標準的なセラミックホットプレートの上に平らな、粉砕されたアルミニウム板を置きます。
- ホットプレートの温度を107°Cに設定し、ポリスチレン40のガラス転移温度に設定する。
注: 安定した正確な温度を得るために、熱電対プローブは幅2~3mm、アルミニウム板の深さ4~5mmの穴に保持されています。 - ホットアルミプレートにビーズテンプレートを含むカバースリップを20sのアニールに置きます(融解時間の説明については、説明セクションを参照)。
- 加熱後、カバースリップをアルミニウム板から取り出し、速やかに別の室温アルミニウム表面に置いて冷却します。
注:カバーリップのピックアップを容易にするために、カバーリップがプレートの端に少し掛かっているか、またはプレートに浅いチャネル(付属のビデオを参照)を持っている方が便利です。
4. コロイド結晶テンプレートを用いたアルミニウムゼロモードの導波管のナノファブリケーション
- 熱または電子ビーム蒸発堆積を使用して、300nmの銅をコロイド結晶テンプレート上に2Å/sに堆積させ、ビーズ間補間にポストを生成します。
- テープで表面を軽く押して、ビーズの上に余分な金属を取り除きます。テープをゆっくりと剥がして金属を引き離します。
注:テーププル後に反射過剰な金属の小さなパッチが残ることがあり、これらはしばしばN2 ガスの流れによって除去することができます。テーププル後に反射過剰金属の相当なパッチが残っている場合は、ポリスチレンビーズを部分的に溶解させるために2時間トルエンにテンプレートを浸してみてください。カバーリップを蒸留水で洗い、N2で乾かしてからテープを引き抜きます。追加の浸漬は、ビーズがテーププル中の損傷からポストを保護するのに役立つため、ビーズを完全に溶解しないでください。 - ポリスチレンビーズを溶解するには、ビーズテンプレートをトルエンに入れ、一晩浸します。
注意:トルエン煙は有毒である可能性があります。換気の良いフードの下でトルエンを使用し、手袋、安全メガネ、ラボコートなどの個人用保護具を着用してください。トルエンは、可燃性液体用に指定された換気キャビネットに保管する必要があります。 - トルエンインキュベーション後、テンプレートをクロロホルムで1回、エタノールで2回リンスします。繊細な200-300 nmの高さの金属の柱が露出しているので、この時点で慎重にカバーリップを扱います。テンプレートをN2 で乾燥させ、酸素プラズマクリーナーの残留ポリマーと汚染物質を30分間除去します。
注意:クロロホルムの煙は有毒である可能性があります。換気の良いフードの下でクロロホルムを使用し、手袋、安全メガネ、ラボコートなどの個人用保護具を着用してください。クロロホルムは、他の可燃性溶剤から離れた換気キャビネットに保管する必要があります。 - 熱または電子ビーム蒸着を使用して、チタン付着層の3nmを1Å/sに堆積させ、その後、銅ポストの周りと上に4Å/ sで100-150 nmのアルミニウムを堆積させます。
注:より厚いクラッディングを使用して、より深いガイドを取得し、バックグラウンド蛍光をより良く減衰させることができますが、これはまた、次のステップで投稿を公開して溶解した後の収量を減少させます(説明セクションを参照)。 - 金属ポストを溶解するには、カバーリップを銅エッチャント(クエン酸ベース)に浸します。 資料一覧)2時間。
注意:金属エッチャントは皮膚の火傷を引き起こす可能性があります。換気の良いフードの下でエッチャントを使用し、保護具を着用してください。取扱い後は手を十分に洗ってください。金属エッチャントは、腐食性液体用に指定された換気されたキャビネットに保管する必要があります。 - カバーリップを蒸留水でリンスし、N2で乾燥させ、レンズペーパーで金属クラッディングの表面を軽くバフして、クラッディングで覆われているポストを露出させます。カバースリップを別の2時間銅エッチャントに戻し、蒸留水で再びすすいでN2で乾燥させます。
注:ZMWのスライドは、汚染物質を含まないそれらを保つために、覆われた、きれいなペトリ皿に保存する必要があります。
5. コロイド結晶テンプレートを用いた金ゼロモードの導波管のナノファブリケーション
注: アルミニウム ZMWs を製造するためのプロトコルを反映したゴールド ZMW (補足図 1)を製造する方法は、このセクションで提供されています。
- 熱または電子ビーム蒸発堆積を使用して、チタン付着層の3nmを1Å/sに堆積させ、その後4Å/sで300nmのアルミニウムを堆積させます。
- テープで表面を軽く押して、ビーズの上に余分な金属を取り除きます。テープをゆっくりと剥がして金属を引き離します。
- ポリスチレンビーズを溶解するには、ビーズテンプレートをトルエンに入れ、一晩浸します。
- トルエンインキュベーション後、テンプレートをクロロホルムで1回、エタノールで2回リンスします。テンプレートをN2 で乾燥させ、酸素プラズマクリーナーの残留ポリマー汚染物質を30分間除去します。
- 熱ビームまたは電子ビーム蒸発堆積を使用して、アルミニウムポストの周りおよび上に5 Å /sで金の100-150 nmを堆積させます。
- 金属ポストを溶解するには、カバーリップをアルミニウムエッチャント(リン酸ベース)に浸します。 資料一覧)1時間。
- カバーリップを蒸留水でリンスし、N2で乾燥させ、レンズペーパーで金属クラッディングの表面を軽くバフして、クラッディングで覆われているポストを露出させます。カバースリップをアルミニウムエチャントに1時間戻し、蒸留水で再びすすいでN2で乾燥させます。
注:ZMWのスライドは、覆われた、きれいなペトリ皿に格納する必要があります。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
蒸発沈着によるポリスチレンコロイド粒子の自己集合性(ステップ2.1−2.13)は、溶媒蒸発速度の制御を必要とするため、さまざまな結果を生み出すことができます。ただし、堆積は速いため(ラウンドあたり10〜15分)、手順は異なる環境実験室の条件に対して迅速に最適化することができます。 図3A は、蒸着および蒸発後の整形コロイドテンプレートを示す。マクロ的には、ビーズの領域は円形で、ボーダーは透明で多層のビーズのリングで定義されています。半透明では、画像内の白色の領域は望ましい単層領域です。 図3B は、過度に湿度の高い環境(ペトリ皿が閉じられた時の80%RH)に詰め込まれたコロイドテンプレートを示しています。これらのテンプレートは、円形の境界がクリーンではなく、多層テンドルが外側に伸びる傾向があります。堆積は許容可能であり、その後の段階で使用することができますが、ラティスの穴は単一分子イメージングに使用できるZMWアレイ領域の数を減らします。 図3C は、過度に乾燥した環境(ペトリ皿が閉じられた時に65%RH)に詰め込まれたコロイドテンプレートを示しています。これらのテンプレートは、通常、理想的な、よく広がるテンプレートに比べて直径が小さいです。堆積物は使用できますが、内側に筋を付ける多層白色領域は、イメージングに使用できる領域を減少させます。したがって、チャンバーが開閉されるにつれて、プロセスの終わりに向かって堆積物が低湿度で発生するため、一度に6つ以上の堆積物を行うことはお勧めしません。 図3D は、ポリスチレン結晶からの反射光の回折によって生成される虹パターンを示す。このパターンは、結晶パッキングの成功と品質を目で確認するために使用できます。 図 3E,F は、十分にパックされたコロイド テンプレートの原子間力顕微鏡(AFM)画像を示しています。穀物間の欠陥は、蒸発沈込41の間に詰まりから生じ、そして10倍の目的で明確な穀物が見られる。したがって、低電力光顕微鏡でコロイド堆積物を調べることも、パッキングの評価に使用することができる。
アニールコロイドテンプレートに銅を蒸着させた後(ステップ4.1)、ビーズの上部を反射金属コーティングすることによって虹回折パターンがまだ見え、強化されるべきである(図4A,B)。テンプレートは、余分な銅を取り除くスコッチテーププル(ステップ4.2)後の反射虹回折パターンを失います(図4C)。図4D,Eは、金属蒸着後の銅柱の典型的なフィールドのAFM画像を示す。図3Eのコロイド結晶粒の間の欠陥は、銅の大きな領域として銅ポスト画像に見える。AFM画像の分析は、銅蒸着厚さ300nmの場合、最終的な銅柱の高さ255nm(図4F)、直径121nmの平均を示す(図4G)。
ビーズが銅柱の上にあったアルミニウムクラッディング(ステップ4.5)の堆積と、その後のポストの溶解(ステップ4.6および4.7)は、図5A-Cに示すアルミニウムZMWになります。コロイド結晶粒の間の欠陥は、大きな開口部として見える(図5B)。図5CのZMW中心間の平均距離は559nmで、1μmビーズの六角形の閉じたパッキング形状によって設定された間隔と一致します  (20の間にアニールされたポリスチレンテンプレートを使用すると、直径平均118nmの導波管(図5D,E)がポスト直径と一致し、可視光の伝播を遮断するのに十分に小さくなります。図5Dからの導波路の高さプロファイルは、深さ約120nmであることを示している。
(20の間にアニールされたポリスチレンテンプレートを使用すると、直径平均118nmの導波管(図5D,E)がポスト直径と一致し、可視光の伝播を遮断するのに十分に小さくなります。図5Dからの導波路の高さプロファイルは、深さ約120nmであることを示している。
ZMWsで単一分子FRETを実行し、機能性をテストしました(図6A)。図6Bでは、画像撮影用ZMWsの一般的なフィールドを示しており、40 x 80 μmの視野に>3000の導波線が含まれています。ZMWs は、前述の42, 43のプロトコルを使用して最初にパッシベーションを行いました。簡単に言えば、アルミニウムZMWはポリ(ビニルホスホン酸)でパッシベーションされ、アルミニウムクラッディングをコーティングし、続いてメトキシ終端ポリエチレングリコール(PEG)にビオチン終端PEGをドープしてZMWsのガラス底をコーティングした。流動チャンバは、〜20μLの体積、そして単一分子イメージング44のために構築された。DNA二重鎖の単一分子FRETイメージングは、前述の38のように行った。簡単に言えば、シアニン-3/シアニン-5(Cy3/Cy5)の100pM-1 nM、ビオチン化DNA二重鎖(33塩基対長)を、ストレプトアビジン(5分インキュベーション、0.5mg/mL溶液)で機能する流路で10分間インキュベートした。標識された高分子の濃度は、1分子での導波管の約20%の負荷を達成するために滴定することができ、ポアソン分散負荷に基づいて、複数の分子を積んだ<5%の導波管(ほとんどの導波導管、〜75%、分子を持たない)45。アンバウンドDNAはヌクレアーゼフリーデュプレックスバッファーで洗い流され、続いて照明バッファー(0.3%[w/v]グルコース、300 μg/mLグルコースオキシダーゼ、120 μg/mLカタラーゼ、1.5 mMトロロックス[6-ヒドロキシ-2、5、7、8-テトラメチルクロマン-2-カルボリック]が続いた。非ビオチン化されたCy5標識DNA二重鎖(33塩基対長)は、溶液中の背景フルオロフォアとして0、50、100、および500nMの照明バッファーに存在した。固定化されたCy3/Cy5二重DNA分子からの単一分子FRETの微量は、エピ蛍光条件に合わせて調整されたカスタム構築のTIRF顕微鏡で記録された。映画は、532 nmおよび640 nm励起(100 ms露光)を交互に行い、デュアルビュースペクトルスプリッターを使用して1.48個の数値開口(NA)100x油浸出目的で記録し、電子乗算電荷結合デバイス(EMCCD)カメラでCy3とCy5の放出を同時に記録します。Cy5チャネル内の単一ステップ漂白剤を有する単一分子FRETトレースは、試験された周囲Cy5のすべての濃度で検出可能であった(図6C−F)。それに比べて、単一分子は、pM〜低nM溶液フルオロフォア濃度46のTIRF照明でのみ検出可能であろう。

図1:ゼロモードの導波ガイドの概略図。右側に単一のZMWの拡張断面図を持つZMWアレイの図。目的の単一の蛍光タグ付き酵素(蛍光色素を表す赤い円を有する茶色のリボソーム)は、ZMWsのガラス底部(典型的にはビオチン化PEGで機能化される)に化学的に固定化され(典型的にはビオチン化PEGで機能する)、典型的なレーザーベースの蛍光顕微鏡設定で画像化することができる。532 nmの励起光(緑色の矢印)は、開口部の小さなサイズ(直径100-200 nm)のためにガラス-金属境界に反射されますが、強度が指数関数的に減衰する非伝播エバネッセント波がZMW内に存在します。これにより、10~30 nm の有効な照度(開口部の緑のシェーディング)が得られます。nM~μM濃度で個々の蛍光リガンド(蛍光タグとして緑色の円を有する青色tRNA)を添加する。絞りに拡散し、酵素と相互作用する個々のリガンドは、蛍光を起点にする外見的な背景を持たずに画像化されます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:アルミニウムZMWアレイを製造するために開発されたコロイドテンプレート法の概略図。 ポリスチレンビーズは、直径1μmで、プロトコルのセクション2に記載されているように、洗浄されたガラスカバースリップに堆積し、自己組み立てられます。次いで、ビーズをアニールして細孔サイズ(セクション3)を減少させ、続いてトルエン中に銅析出およびビーズ溶解を行う。アルミニウムは銅の支柱の周りと上に堆積し、その後、選択的にエッチングされ、ナノアパーチャーの六角形の配列を残します(セクション4)。最後の 3 つの手順では、図ビューの右側に断面ビューが表示され、銅線の支柱とアルミニウム ZMW の幅と高さを表示 します。

図3:コロイドの蒸発堆積から代表的な結果. (A) 最適なコロイド蒸着の例。 (B) 条件が理想的よりも湿度が高い(80%RH)であった許容コロイド堆積物の例。結晶単層の穴が明らかである。 (C) 条件が最適よりも乾燥した状態(65%RH)で許容可能なコロイド蒸着の例。単層領域はやや半透明で、多層領域は白と不透明(境界と内側の筋)です。 (D) 白色光で照らされたコロイド結晶で、結晶からの虹回折を強調する。 (E)AFM 画像(空気中のプローブAFMをタップ)は、コロイド堆積に成功した六角形に詰まったポリスチレンビーズの単層の(スケールバー=10μm)。(F) パックされたビーズの拡大されたAFMイメージ(スケールバー= 2 μm)。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:銅析出後のZMWテンプレートのマクロコピック画像および顕微鏡画像。(A)ビーズテンプレートの上に銅を物理的に蒸発した後のスライドの画像。(B)銅析出後のビーズテンプレートからの虹回折パターン。(C)テープを引っ張って余分な銅とテープを取り除いた後のテンプレートの画像(右)。(D)テーププル後の銅ポストのAFM画像、およびポリスチレンビーズの完全溶解(スケールバー=5μm)。(E)パネルDの高倍率AFM画像(スケールバー=2μm)。(F)銅のポスト高さのヒストグラム(各ポスト内の最大高さ測定として定義)、n = 534。(G)銅ポストフェレット径のヒストグラム、 n = 201.フェレット直径は、ポスト境界に接する2本の平行線間の最大距離です(ImageJ47で定量化)。分析用の粒子を同定するために、クラッディングの上部と底部ガラス表面の中間の閾値を使用した。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:アルミニウムZMWsのマクロスコピック画像および顕微鏡画像。(A)銅のポストの周りと上に150 nmのアルミニウムの物理的蒸発堆積後のスライドの画像。(B)溶解後のアルミニウムZMWのAFM画像(スケールバー=5μm)。(C)パネルB(スケールバー=0.2 μm)の高倍率画像。(D)パネルC.から個々のZMWの典型的な深さプロファイルは、パネルCで描かれた緑色の線から取り出されたプロファイルを有する(E)ZMWフェレット径のヒストグラム、n=240。フェレット径は図4のように測定した。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:ZMWsにおける単一分子FRETイメージング。(A)Cy3の単一分子FRETイメージングの概略(スケールしない)、Cy5標識された二重鎖を背景にCy5標識された二重鎖を有するZMWsにおけるCy5標識DNA二重鎖。(B)白色光照明下のZMWsの例(スケールバー=10μm)。(C-F)0(C)、50(D)、100(E)、および500 nM(F)Cy5標識二重鎖の存在下でZMWsに固定化されたDNA二重鎖の単一分子FRET記録。 各濃度について、上部パネルは532 nmレーザー照明(FRETイメージング)下のCy3(緑色)およびCy5(赤色)蛍光強度を示し、中央パネルは640nmレーザー照明下のCy5蛍光強度(直接受け入れ励起)を示し、最も低いパネルは  生のCy3(ID)およびCy5(A)の蛍光強度から算出されたFRET効率()を示す。イメージング中、励起波長は100 msごとに532〜640 nmの間で交互に行われます。
生のCy3(ID)およびCy5(A)の蛍光強度から算出されたFRET効率()を示す。イメージング中、励起波長は100 msごとに532〜640 nmの間で交互に行われます。
補足図1:金のZMWアレイを作製するために開発されたコロイド性テンプレートの模式図。 金のZMWアレイを製造するプロトコルは、アルミニウムZMWアレイを製造するプロトコルに似ています(図2)。代わりに、ポリスチレンビーズの上に銅を堆積させる、アルミニウムが堆積する。トルエンにビーズを溶解した後、金はポストの上にアルミニウムの代わりに堆積する。アルミニウムポストは、その後、選択して金のZMWアレイを残すためにエッチングされます。最後の3つのステップでは、断面ビューは、アルミニウムポストと金のZMWsの幅と高さを示すために、プランビューの右側 に提供されています。
補足図2:ZMWsにおける電磁界伝搬の有限要素モデリング(A-D)アニールテンプレート(A,C)とアニールテンプレート(B,D)から作られた導波管を介して時間平均Poyntingベクトル(W/m2)の大きさの断面。図中に示された波長(400nmまたは1,000nm)の直線偏波電磁界波(スライドの面積に1W分布)を下面に投影し、最も低い波数を持つ最も低い(基本)モードは、マクスウェルの方程式と適切な境界条件を解決するための有限要素法を用いてモデリングソフトウェア(材料表)を使用して計算した。導波導車の境界は、アルミニウムまたは金の壁によってよく近似される完全な電気伝導体であると仮定した。アンネル導波路テンプレートからの断面は直径1μmの円の六角形のパッキングによって決定され、得られた三角形形状からの3つの先端は、現実的な物理的な開口部をモデル化するために〜60nm幅にクリップされた。アニールテンプレートからの断面は、直径130nmの円として近似した。両方の導波ガイドは、製造後のクラッディング深さに似た130nmの深さを持っていました。(E,F)400nmと1,000nmの励起波長に加えて、 モデルは400nmと1,000 nmの間で等間隔の100の励起波長で解かれて、有効モード指数  (kzは、横断面の制限のために減少する導波路の波番、kは真空中の励起光波数)と三角形(E)および円形(F波導管)の励起波長に対してプロットされた。短波長の場合、高いモードが励起され、有効モードインデックスが増加します(最大実効モードインデックスは1で、これは電磁界波が横次元で境界を越えて移動する場合の制限です)。導波ガイドの有効なカットオフ波長は、有効モード指数が0に低下する波長と推定された。なお、有限要素モデリング(F)からの円弧λカットオフ=221nmは、円形導波管のカットオフ波長(λカットオフ、分析=1.7d=221nm、dは導波管径)の理論予測と一致する。 このファイルをダウンロードするには、ここをクリックしてください。
(kzは、横断面の制限のために減少する導波路の波番、kは真空中の励起光波数)と三角形(E)および円形(F波導管)の励起波長に対してプロットされた。短波長の場合、高いモードが励起され、有効モードインデックスが増加します(最大実効モードインデックスは1で、これは電磁界波が横次元で境界を越えて移動する場合の制限です)。導波ガイドの有効なカットオフ波長は、有効モード指数が0に低下する波長と推定された。なお、有限要素モデリング(F)からの円弧λカットオフ=221nmは、円形導波管のカットオフ波長(λカットオフ、分析=1.7d=221nm、dは導波管径)の理論予測と一致する。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:Au ZMW製造の代表的な結果。(A)金のZMWアレイのマクロスコピー画像。(B-D)アニールされなかったビーズテンプレートからのアルミニウムポストのAFM画像(B)、107°Cで20s(C)でアニールされたテンプレート、および25s(D)のために107°Cでアニールされたテンプレート。 アルミニウムポストの溶解後の金ZMWsのAFM画像。(F)パネルEの高倍率AFM画像(G)金ZMWの典型的な深さプロファイル。パネルFで描かれた緑色の線から撮影されたプロファイル(スケールバー= B、C、D、およびF;Eの5μm) このファイルをダウンロードするには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
コロイド自己集合(プロトコルセクション2)では、懸濁溶媒として水ではなくエタノールを使用すると、以前の方法48,49のように、テンプレートが1−2時間ではなく、堆積後2〜3分で準備ができるように、蒸発プロセスを高速化する。ここで提示される蒸発沈積分プロトコルは、サスペンション49、50、51以上の表面傾斜、温度、および空気量を制御する必要がある以前の堆積物プロトコルよりも簡単である。このプロトコルで使用される粒子体積分率は2.4%であり、以前の沈降法48で使用されていた0.2-0.5%よりも高く、水グリセロール混合物中のコロイドを再懸濁して、はるかに長いセトリングタイムスケールを行う。しかし、堆積物の品質は粒子体積分率の変化に強く、過去の研究では2-10%49、50、51の間で変化させることができることが分かりました。このプロトコルから正常に堆積して得られたコロイド結晶の粒径は、20-30μmで、以前の堆積方法(通常は数百ナノメートル)48,49の粒子よりも大きい。マクロ的には、コロイド単層の直径約2cmの領域も、前の方法49によって生成された1cmの領域に匹敵する。この方法で作られるコロイド結晶テンプレートの大きいサイズはまた3-5分離された流れの部屋44、各ZMWのスライドで作られるのは、それぞれ約3-4 mm幅を可能にする。これにより、複数の独立した単一分子実験を各スライドに対して行うことができる。
自己組立後にコロイドビーズテンプレート(プロトコルセクション3)をアニーリングすることは簡単ですが、ZMWsで背景蛍光を十分に低減するための重要なステップです。 補足図2 が示すように、アンネル化されていないテンプレートからの三角断面を有する導波管の有効カットオフ波長は894nmである。これに対して、アニールテンプレートから130nm径の円波導路に対する有効カットオフ波長は221nmであり、分析的に(ガイド18の直径の1.7倍)と数値的に決定される。堆積のために小さなビーズを使用すると、テンプレートの孔のサイズを小さくすることもできますが、導波ガイドは、可視光の回折限界の周りにある200 nmよりも近くに間隔を置きます。さらに、導波管は断面の三角形のままで、導波路を通して非対称の電力伝達を導く(補足図2A−D)。アニーリングステップの欠点の1つは、融解時間の変動が導波管径の変動を引き起こす可能性があるため、正確なタイミングがバッチ間の変動を最小限に抑えるのに役立ちます。インタースティスは25sよりも長いアニーリング時間で閉じ始め、ポスト直径は20-25 sの間であまり減少しません(補足図3B-D)。インタースティスクロージャーの簡単なテストは、アニールされたテンプレートが光で照らされ、斜めで見たときに虹回折パターンを生成するかどうかを確認することです。そうでなければ、インタースティックの大部分が閉じている可能性が高いです。アニーリング時間と典型的な孔径の関係は、38以前に提示されています。
アニーリングステップ中に所望の孔サイズを達成した後、銅は、マスクの影を作成するためにテンプレート上に(ステップ4.1)堆積されます。金属ができるだけ垂直にテンプレートに近づくと、視線堆積を使用することが重要です。したがって、サンプルと金属源との距離を長くすると、テンプレートを保持するプレートが回転しないように、いくつかの蒸気堆積機で自動的に行われるように、ポリスチレン基板上の金属の横面堆積を最小限に抑える際に役立ちます。しかし、いくつかの横方向の堆積は避けられず、これは間質孔のサイズを小さくし、したがって、より多くの金属が52に堆積するにつれてポスト断面を減少させる。この結果、プリズムのような構造の方がピラミッド型の金属ポストが 52になります。
銅の柱はプリズムの形ではなくピラミッド状である可能性が高いため、ポストの上にアルミニウム堆積(ステップ4.5)も傾斜した側面の一部をカバーし、一部のポストの銅エッチャントのアクセシビリティをブロックします。したがって、レンズ用紙のバフ処理ステップ(ステップ4.7または5.7)をエッチャントに最初に浸した後に添加し、アルミニウムで覆われた銅のポストを機械的に破壊した。より高いポストを作成するためにより多くの銅を堆積させることはまた、レンズ用紙のバフリング中に機械的な混乱の影響を受けやすいポストを作る。しかし、500nm以上の銅は、堆積の目標は、1μmビーズの500 nmの正中線に間質穴を投影することであるため、堆積すべきではありません。
もう 1 つの潜在的な難点は、レンズ用紙のバフリング中に意図しないアルミニウムクラッディングの除去です (ステップ 4.7 または 5.7)。また、アニール工程を加えた後に、焼鈍工程の添加によりアルミニウムクラッディングの損失がより頻繁に発生し、ポリスチレン残基の増加により、ガラスへのアルミニウム付着を妨げる可能性があることがわかった(プロトコルセクション3)。しかし、テーププル後の一晩トルエンの浸漬(ステップ4.3または5.3)は、この問題を解決しました。 図4EのAFM画像では、ポスト間にポリスチレンの残留リングが見えますが、アルミニウムクラッディングはステップ4.7で複数のバフに抵抗しました。アルミニウムクラッディングの損失が一晩トルエン浸漬後に問題のままである場合、RCA-1(標準クリーン-1)洗浄、ピラニア洗浄、またはさらなる酸素プラズマ洗浄をステップ4.4または5.4に添加することができる。これらの洗浄ステップは、ZMWsをさらに洗浄するために、最終エッチングステップ(ステップ4.7または5.7)の後、およびパッシベーション前に追加することもできます。
単一分子FRET実験におけるZMWsの性能は、EBLで製造されたZMWsの性能と同様であった。Cy3標識DNAヘリカーゼローダータンパク質を溶液に標識した単一鎖DNAに対して単一分子FRETを行う以前の研究では(図6Aと同じドナーアクセプター配列)、FRETイベントは100 nM Cy5バックグラウンドで明確に識別可能で、1μMでは識別不可能であった(低いアクセプター微量シグナル)我々は、商業ZMWsを用いた以前の研究では、バックグラウンド濃度が1mM54の高い単分子FRETアクセプターシグナルが、我々および社内で製造されたZMWsを有する他の以前の研究42,53よりも高いと報告された。ZMWs間の信号からバックグラウンドへのパフォーマンスに関するさらなる議論は、ジャミオルコフスキら38.ZMW表面53と蛍光サンプルの非特異的相互作用は、特に溶液中の拡散蛍光種が大きな高分子である場合に、より高い濃度へのアクセスを制限する一般的な課題である。翻訳などの複雑な生化学的システムに関するZMWsの研究は、通常、100-250nM 55、56、57、58に無料蛍光基質濃度を制限している。ZMWsの意図された適用に関係なく、高濃度で許容可能なノイズ信号を維持するために、異なるシステムのためのパッシベーション方法の最適化が必要になる可能性があります。
全体的に見て、ここで提示される方法は、特殊なスキルや機器を必要としない、一度に多くのテンプレートの並列製作を可能にし、異なる金属でZMWsを製造するために適応することができます。本研究では、銅とアルミニウムをそれぞれアルミニウムと金で置換し、金のZMWsを製造した(補足図3)。これはアルミニウムではなく金のパッシベーション方法を使用する実験室にとって有利である。また、金ZMWは可視スペクトルの赤色領域で吸収する蛍光体の発光を増強することが示されているが、アルミニウムZMWは緑色領域59で吸収する蛍光色素の発光を増強する。今後、この方法で作製されたZMWsからの蛍光シグナル強度は、HF16,26,60を用いてZMW金属クラッディングの下のガラスにエッチングすることで増強される可能性がある。これは、フルオロフォア61をクエンチすることができる金属壁から遠く離れて固定化された生体分子をもたらします。さらに、開口の入り口下の励起照明強度には最大があり、これは単一分子発光を26,60に増強するために以前に利用されてきた。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者らは開示するものは何もない。
Acknowledgments
この研究は、NIH助成金R01GM080376、R35GM118139、NSFメカノバイオロジーCMMI:15-48571からY.E.G.、およびNIAIDの博士前NRSAフェローシップF30AI114187によってサポートされました.M
Materials
| Name | Company | Catalog Number | Comments |
| 1. Glass Coverslip Cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coplin glass staining jar | Fisher Scientific | 08-817 | Staining jar with 8 grooves and molded glass cover |
| Coverslips | VWR | 48404-467 | 24 mm x 30 mm (No.1½, Rectangular) |
| Ethanol | Sigma | E7023 | 1 L |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Petri dishes | Fisher Scientific | R80115TS | 100 mm diameter, 15 mm deep |
| Sonicator | Branson | Z245143 | Tabletop ultrasonic cleaner, 5510 |
| 2. Evaporative Deposition of Polystyrene Beads | |||
| Clear storage container | Fisher Scientific | 50-110-8222 | 26 x 18 x 15 in. |
| Desk fan | O2Cool | FD05001A | Any small desk (~5 in.) fan will work |
| Glass beaker | Fisher Scientific | 02-555-25B | 250 mL |
| Humidity meter | Fisher Scientific | 11-661-19 | |
| Microcentrifuge tubes | Fisher Scientific | 21-402-903 | 1.5 mL |
| Polystyrene microspheres | Polysciences | 18602-15 | 1.00 µm diameter, non-functionalized |
| Triton X-100 deturgent | Sigma | X100 | 100 mL |
| 3. Bead Annealing for Reducing Pore Size in the Colloidal Crystal Template | |||
| Aluminum plate | Fisher Scientific | AA11062RY | Customized in-house to 14 cm x 14 cm |
| Ceramic hotplate | Fisher Scientific | HP88857100 | 13 x 8.2 x 3.8 in. |
| Temperature controller | McMaster-Carr | 38615K71 | Read temperature with thermocouple probe |
| Thermocouple probe | McMaster-Carr | 9251T93 | Type K, surface probe |
| 4/5. Nanofabrication of Zero Mode Waveguides Using the Colloidal Crystal Template | |||
| Aluminum etchant | Transene | Type A | |
| Aluminum pellets | Kurt J. Lesker | EVMAL40QXHB | For electron beam evaporation |
| Chloroform | Sigma | 288306 | 1 L |
| Copper etchant | Transene | 49-1 | |
| Copper pellets | Kurt J. Lesker | EVMCU40QXQA | For electron beam evaporation |
| Gold pellets | Kurt J. Lesker | EVMAUXX40G | For electron beam evaporation |
| Lens paper | Thorlabs | MC-5 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Scotch tape | Staples | MMM119 | |
| Thin film deposition system | Kurt J. Lesker | PVD-75 | Tabletop thermal evaporation system will also work |
| Titanium pellets | Kurt J. Lesker | EVMTI45QXQA | For electron beam evaporation |
| Toluene | Sigma | 244511 | 1 L |
| Representative Results | |||
| COMSOL Multiphysics Modeling Software | COMSOL, Inc. | ||
| Dual View spectral splitter | Photometrics, Inc. |
References
- Kapanidis, A. N., et al. Initial transcription by RNA polymerase proceeds through a DNA-scrunching mechanism. Science. 314 (5802), 1144-1147 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 715-720 (2010).
- Herbert, K. M., Greenleaf, W. J., Block, S. M. Single-molecule studies of RNA polymerase: motoring along. Annual Review of Biochemistry. 77, 149-176 (2008).
- Chen, C., et al. Dynamics of translation by single ribosomes through mRNA secondary structures. Nature Structural & Molecular Biology. 20 (5), 582-588 (2013).
- Chen, C., et al. Single-molecule fluorescence measurements of ribosomal translocation dynamics. Molecular Cell. 42 (3), 367-377 (2011).
- Jamiolkowski, R. M., Chen, C., Cooperman, B. S., Goldman, Y. E. tRNA Fluctuations Observed on Stalled Ribosomes Are Suppressed during Ongoing Protein Synthesis. Biophysical Journal. 113 (11), 2326-2335 (2017).
- Myong, S., Stevens, B. C., Ha, T. Bridging Conformational Dynamics and Function Using Single-Molecule Spectroscopy. Structure. 14 (4), 633-643 (2006).
- Martin-Fernandez, M. L., Tynan, C. J., Webb, S. E. A 'pocket guide' to total internal reflection fluorescence. Journal of Microscopy. 252 (1), 16-22 (2013).
- Holzmeister, P., Acuna, G. P., Grohmann, D., Tinnefeld, P. Breaking the concentration limit of optical single-molecule detection. Chemical Society Reviews. 43 (4), 1014-1028 (2014).
- Scheer, M., et al. BRENDA, the enzyme information system in 2011. Nucleic Acids Research. 39, 670-676 (2011).
- Kudva, R., et al. Protein translocation across the inner membrane of Gram-negative bacteria: the Sec and Tat dependent protein transport pathways. Research in Microbiology. 164 (6), 505-534 (2013).
- Talkad, V., Schneider, E., Kennell, D. Evidence for variable rates of ribosome movement in Escherichia coli. Journal of Molecular Biology. 104 (1), 299-303 (1976).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12893-12898 (2004).
- Dunkle, J. A., et al. Structures of the bacterial ribosome in classical and hybrid states of tRNA binding. Science. 332 (6032), 981-984 (2011).
- Kim, H. D., Puglisi, J. D., Chu, S. Fluctuations of transfer RNAs between classical and hybrid states. Biophysical Journal. 93 (10), 3575-3582 (2007).
- Levene, M. J., et al. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Zhu, P., Craighead, H. G. Zero-mode waveguides for single-molecule analysis. Annual Review of Biophysics. 41, 269-293 (2012).
- Pollack, G. L., Stump, D. R. Electromagnetism. , Addison-Wesley. Boston, MA. (2002).
- Jackson, J. D. Classical electrodynamics. Third edition. , Wiley. New York, NY. (1999).
- Crouch, G. M., Han, D., Bohn, P. W. Zero-mode waveguide nanophotonic structures for single molecule characterization. Journal of Physics D: Applied Physics. 51 (19), 193001 (2018).
- Wenger, J., et al. Dual-color fluorescence cross-correlation spectroscopy in a single nanoaperture: towards rapid multicomponent screening at high concentrations. Optics Express. 14 (25), 12206-12216 (2006).
- Goldschen-Ohm, M. P., et al. Structure and dynamics underlying elementary ligand binding events in human pacemaking channels. eLife. 5, 20797 (2016).
- Miyake, T., et al. Real-Time Imaging of Single-Molecule Fluorescence with a Zero-Mode Waveguide for the Analysis of Protein-Protein Interaction. Analytical Chemistry. 80 (15), 6018-6022 (2008).
- Zhao, J., Branagan, S. P., Bohn, P. W. Single-Molecule Enzyme Dynamics of Monomeric Sarcosine Oxidase in a Gold-Based Zero-Mode Waveguide. Applied Spectroscopy. 66 (2), 163-169 (2012).
- Fore, S., Yuen, Y., Hesselink, L., Huser, T. Pulsed-interleaved excitation FRET measurements on single duplex DNA molecules inside C-shaped nanoapertures. Nano Letters. 7 (6), 1749-1756 (2007).
- Rigneault, H., et al. Enhancement of single-molecule fluorescence detection in subwavelength apertures. Physical Review Letters. 95 (11), 117401 (2005).
- Foquet, M., et al. Improved fabrication of zero-mode waveguides for single-molecule detection. Journal of Applied Physics. 103 (3), 034301 (2008).
- Wada, J., et al. Fabrication of Zero-Mode Waveguide by Ultraviolet Nanoimprint Lithography Lift-Off Process. Japanese Journal of Applied Physics. 50 (6), 06 (2011).
- Fischer, U. C., Zingsheim, H. P. Submicroscopic pattern replication with visible light. Journal of Vacuum Science and Technology. 19 (4), 881-885 (1981).
- Deckman, H. W., Dunsmuir, J. H. Natural lithography. Applied Physics Letters. 41 (4), 377-379 (1982).
- Li, B., Zhou, D., Han, Y. Assembly and phase transitions of colloidal crystals. Nature Reviews Materials. 1 (2), 15011 (2016).
- Bohn, J. J., Tikhonov, A., Asher, S. A. Colloidal crystal growth monitored by Bragg diffraction interference fringes. Journal of Colloid and Interface Science. 350 (2), 381-386 (2010).
- Dimitrov, A. S., Nagayama, K. Continuous Convective Assembling of Fine Particles into Two-Dimensional Arrays on Solid Surfaces. Langmuir. 12 (5), 1303-1311 (1996).
- Pisco, M., et al. Nanosphere lithography for optical fiber tip nanoprobes. Light: Science & Applications. 6 (5), 16229 (2017).
- Chandramohan, A., et al. Model for large-area monolayer coverage of polystyrene nanospheres by spin coating. Scientific Reports. 7, 40888 (2017).
- Besra, L., Liu, M. A review on fundamentals and applications of electrophoretic deposition (EPD). Progress in Materials Science. 52 (1), 1-61 (2007).
- Yu, J., et al. Preparation of High-Quality Colloidal Mask for Nanosphere Lithography by a Combination of Air/Water Interface Self-Assembly and Solvent Vapor Annealing. Langmuir. 28 (34), 12681-12689 (2012).
- Jamiolkowski, R. M., et al. Nanoaperture fabrication via colloidal lithography for single molecule fluorescence analysis. PLoS ONE. 14 (10), 0222964 (2019).
- Innocenzi, P., et al. Evaporation of Ethanol and Ethanol-Water Mixtures Studied by Time-Resolved Infrared Spectroscopy. The Journal of Physical Chemistry A. 112 (29), 6512-6516 (2008).
- Rieger, J. The glass transition temperature of polystyrene. Journal of Thermal Analysis. 46 (3), 965-972 (1996).
- Donev, A., Torquato, S., Stillinger, F. H., Connelly, R. Jamming in hard sphere and disk packings. Journal of Applied Physics. 95 (3), 989-999 (2004).
- Kinz-Thompson, C. D., et al. Robustly Passivated, Gold Nanoaperture Arrays for Single-Molecule Fluorescence Microscopy. ACS Nano. 7 (9), 8158-8166 (2013).
- Korlach, J., et al. Selective aluminum passivation for targeted immobilization of single DNA polymerase molecules in zero-mode waveguide nanostructures. Proceedings of the National Academy of Sciences of the United States of America. 105 (4), 1176-1181 (2008).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Plénat, T., Yoshizawa, S., Fourmy, D. DNA-Guided Delivery of Single Molecules into Zero-Mode Waveguides. ACS Applied Materials & Interfaces. 9 (36), 30561-30566 (2017).
- Kudalkar, E. M., Davis, T. N., Asbury, C. L. Single-Molecule Total Internal Reflection Fluorescence Microscopy. Cold Spring Harbor protocols. 2016 (5), 077800 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hoogenboom, J. P., Derks, D., Vergeer, P., Blaaderen, A. v Stacking faults in colloidal crystals grown by sedimentation. The Journal of Chemical Physics. 117 (24), 11320-11328 (2002).
- Micheletto, R., Fukuda, H., Ohtsu, M. A Simple Method for the Production of a Two-Dimensional, Ordered Array of Small Latex Particles. Langmuir. 11 (9), 3333-3336 (1995).
- Denkov, N., et al. Mechanism of formation of two-dimensional crystals from latex particles on substrates. Langmuir. 8 (12), 3183-3190 (1992).
- Okubo, T. Convectional, sedimentation and drying dissipative patterns of colloidal crystals of poly(methyl methacrylate) spheres on a watch glass. Colloid and Polymer Science. 286 (11), 1307-1315 (2008).
- Ye, S., Routzahn, A. L., Carroll, R. L. Fabrication of 3D Metal Dot Arrays by Geometrically Structured Dynamic Shadowing Lithography. Langmuir. 27 (22), 13806-13812 (2011).
- Zhao, Y., et al. Dark-Field Illumination on Zero-Mode Waveguide/Microfluidic Hybrid Chip Reveals T4 Replisomal Protein Interactions. Nano Letters. 14 (4), 1952-1960 (2014).
- Goldschen-Ohm, M. P., White, D. S., Klenchin, V. A., Chanda, B., Goldsmith, R. H. Observing Single-Molecule Dynamics at Millimolar Concentrations. Angewandte Chemie International Edition. 56 (9), 2399-2402 (2017).
- Noriega, T. R., Chen, J., Walter, P., Puglisi, J. D. Real-time observation of signal recognition particle binding to actively translating ribosomes. eLife. 3, 04418 (2014).
- Uemura, S., et al. Real-time tRNA transit on single translating ribosomes at codon resolution. Nature. 464 (7291), 1012-1017 (2010).
- Choi, J., Puglisi, J. D. Three tRNAs on the ribosome slow translation elongation. Proceedings of the National Academy of Sciences of the United States of America. 114 (52), 13691-13696 (2017).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323 (5910), 133-138 (2009).
- Martin, W. E., Srijanto, B. R., Collier, C. P., Vosch, T., Richards, C. I. A Comparison of Single-Molecule Emission in Aluminum and Gold Zero-Mode Waveguides. The Journal of Physical Chemistry A. 120 (34), 6719-6727 (2016).
- Wenger, J., et al. Single molecule fluorescence in rectangular nano-apertures. Optics Express. 13 (18), 7035-7044 (2005).
- Pineda, A. C., Ronis, D. Fluorescence quenching in molecules near rough metal surfaces. The Journal of Chemical Physics. 83 (10), 5330-5337 (1985).
Tags
バイオエンジニアリング、問題159、ゼロモードの導波、ナノ開口、単一分子蛍光、ナノスフィアリソグラフィ、コロイド結晶、自己集合Erratum
Formal Correction: Erratum: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy
Posted by JoVE Editors on 08/10/2021.
Citeable Link.
An erratum was issued for: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy. A figure was updated.
Figure 3 was updated from:
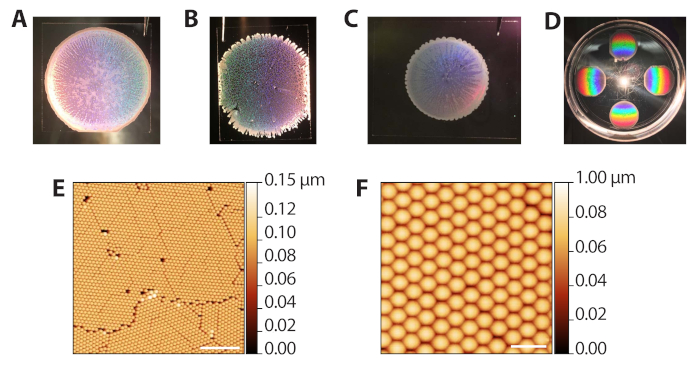
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.
to:
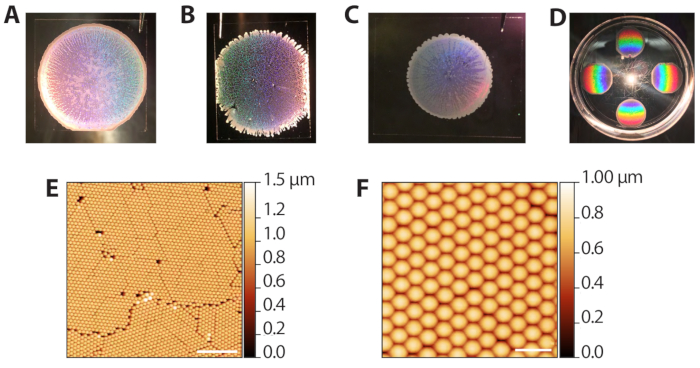
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.



