ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
A expansão clonal é uma característica fundamental da resposta celular T específica do antígeno. No entanto, o ciclo celular das células T que respondem antígeno tem sido pouco investigado, em parte devido a limitações técnicas. Descrevemos um método citométrico de fluxo para analisar células CD8 T específicas de antígeno em baço e linfonodos de camundongos vacinados.
Abstract
O ciclo celular de células T específicas de antígeno in vivo foi examinado usando alguns métodos, todos os quais possuem algumas limitações. Bromodeoxyuridina (BrdU) marca células que estão na fase S ou recentemente concluída, e carboxyfluorescein succinimidyl éster (CFSE) detecta células filhas após a divisão. No entanto, esses corantes não permitem a identificação da fase do ciclo celular no momento da análise. Uma abordagem alternativa é explorar o Ki67, um marcador que é altamente expresso pelas células em todas as fases do ciclo celular, exceto na fase quiescente G0. Infelizmente, o Ki67 não permite maior diferenciação, pois não separa células em fase S que estão comprometidas com mitose daquelas do G1 que podem permanecer nestafase, proceder ao ciclismo ou passar para OG 0.
Aqui, descrevemos um método citométrico de fluxo para capturar um "instantâneo" de células T em diferentes fases de ciclo celular em órgãos linfoides secundários do camundongo. O método combina a coloração de Ki67 e DNA com a coloração do complexo histocompatibilidade (MHC)-peptídeo-multimer e uma estratégia inovadora de gating, permitindo-nos diferenciar com sucesso entre células CD8 T específicas de antígeno em G0, em G1 e nas fases S-G2/M do ciclo celular no baço e drenagem de linfonodos de camundongos após a vacinação com vetores virais carregando a mordaça de antígeno modelo do vírus da imunodeficiência humana (HIV)-1.
As etapas críticas do método foram a escolha do corante de DNA e a estratégia de gating para aumentar a sensibilidade ao ensaio e incluir células T altamente ativadas/proliferantes específicas de antígeno que teriam sido perdidas pelos critérios atuais de análise. O corante de DNA, Hoechst 33342, nos permitiu obter uma discriminação de alta qualidade dos picos de DNA G0/G1 e G2/M, preservando a membrana e a coloração intracelular. O método tem grande potencial para aumentar o conhecimento sobre a resposta de células T in vivo e melhorar a análise de imunomonitoramento.
Introduction
As células T ingênuas sofrem expansão clonal e diferenciação em relação à preparação de antígenos. Células T diferenciadas exibem funções de efeitos que são essenciais para o desembaraço do antígeno e para a manutenção da memória específica de antígeno, que é fundamental para uma proteção de longa duração. Durante os primeiros passos da resposta primária, a interação ingênua das células T com células que apresentam antígenos (APCs) dentro de nichos especializados em órgãos linfoides é fundamental para induzir a enorme proliferação de células T que caracteriza a fase de expansão clonal1,2,3. A interação célula T-APC é finamente regulada pela concentração e persistência de antígeno, sinais co-estimulantes e fatores solúveis (citocinas e quimiocinas) que influenciam a quantidade e a qualidade da prole clonal da célula T4,5,6,7.
Apesar dos estudos intensivos de expansão clonal de células T, ainda não se sabe se as células T preparadas por antígeno completam todo o seu ciclo celular no local do reconhecimento de antígenos, ou se migram para outros órgãos durante a progressão do ciclo celular. Essa falta de conhecimento se deve às propriedades das ferramentas disponíveis para análise do ciclo celular. Estes incluem anticorpos monoclonais (mAbs) específicos para o marcador nuclear, Ki67, e corantes celulares que identificam células que foram submetidas à fase S do ciclo celular (por exemplo, Bromodeoxyuridina (BrdU)) ou discriminam entre células filhas e seus ancestrais (por exemplo, carboxyfluorescein succinimidyl ester (CFSE)).
No entanto, os corantes de rotulagem celular, como CFSE e BrdU, não permitem a determinação se as células encontradas em um determinado órgão proliferaram localmente ou melhor migraram para este local após a divisão8,9. Além disso, a proteína intranuclear, Ki67, só é capaz de distinguir células em G0 (células Ki67-negativas) daquelas em qualquer outra fase de ciclo celular (células Ki67 positivas). Assim, a análise de Ki67 não distingue células em proliferação ativa (ou seja, em S, G2ou M) daquelas no G1, que podem progredir rapidamente para a divisão ou permanecer por longos períodos no G1 ou reverter para quiescência10,11.
Aqui, descrevemos um novo método citométrico de fluxo para análise do ciclo celular das células CD8 T específicas de antígeno12 do baço e linfonodos (LNs) de camundongos vacinados(Figura 1). O método explora uma combinação de Ki67 e coloração de DNA que foi usada anteriormente para analisar o ciclo celular das células hematopoiéticas da medula óssea do camundongo (MM)13,14. Aqui, aplicamos com sucesso o Ki67 mais a coloração de DNA, juntamente com a recém-publicada estratégia inovadora de gating12,à análise da expansão clonal de células CD8 T. Pudemos discriminar claramente entre células CD8 T específicas de antígeno em G0, no G1, e nas fases S-G2/Mno baço e drenagem de LNs de camundongos vacinados.
Protocol
Os camundongos foram alojados no Plaisant Animal Facility, e o trabalho foi realizado sob a autorização do Ministério da Saúde italiano nº 1065/2015-PR. O protocolo seguiu as diretrizes de cuidados com animais de acordo com as leis e políticas nacionais e internacionais (Portaria UE 2010/63/UE; Decreto Legislativo Italiano 26/2014).
1. Preparação de solução média e de coloração
- Prepare o Meio Completo: Roswell Park Memorial Institute (RPMI) médio com glutamina de 2 mM, penicilina/estreptomicina de 100 U/mL, 50 μM beta-mercaptoetanol e 10% de volume/volume (v/v) de soro bovino fetal (FBS)
- Prepare o tampão de coloração: soro fisiológico tampão-de-fosfato sem Ca2+/Mg2+ (PBS) com 1% de peso/volume (w/v) albumina de soro bovino (BSA) e 2 mM de sal de dissódico de ácido livre (EDTA)
2. Tratamento do rato
- Camundongos Balb/c fêmeas de 7-8 semanas de idade por injeção intramuscular (i.m.) nos quadríceps do vírus da imunodeficiência humana (HIV)-1-gag-expressing-chimpanzé-vetor adenoviral (ChAd3-gag) com uma dose de 107 partículas virais.
- Em 1-4 meses após a preparação, impulsione uma vez que os camundongos por i.m. injeção de hiv-1-gag-expressing vírus modificado vaccinia Ankara (MVA-gag) com uma dose de 106 unidades formadoras de placa.
- No 3º dia pós-boost, sacrifique os ratos impulsionados por deslocamento cervical, e analise-os em paralelo com ratos não tratados.
- Colhe as LNs drenando os quadríceps (ilílico, popliteal e inguinal) e os baços de ratos impulsionados e não tratados. Além disso, colete o BM das duas patas traseiras de camundongos não tratados e use este BM para ajustes de citômetro de fluxo e como controle positivo para análise do ciclo celular(Figura 2).
NOTA: Gerar vetores de mordaça chAd3 e MVA como descrito anteriormente12,15,16,17.
3. Isolamento da drenagem de células LN, baço e BM
- Isolamento de células de baço e LN
- Coloque 5 mL de meio completo em cada um dos dois tubos de 15 mL, e mantenha-os no gelo, prontos para a coleta de órgãos.
- Sacrifique um rato adulto por luxação cervical.
- Coloque o mouse nas costas e esterilize a superfície da pele com 70% de v/v de etanol.
- Para coletar LNs inguinais, faça uma incisão longitudinal de ~1 cm no abdômen com uma tesoura e estique a incisão com os fórceps.
- Visualize LNs inguinais na superfície interna da pele, e colham-nas com os fórceps. Coloque as LNs inguinais em um dos dois tubos de 15 mL preparados na etapa 3.1.1.
- Para coletar o baço, faça uma incisão peritoneal com uma tesoura e remova o baço. Depois de cortar o tecido conjuntivo circundante, coloque o baço no segundo tubo de 15 mL preparado na etapa 3.1.1.
- Para coletar LNs ilícitos, mova as entranhas de lado e visualize lNs ilícíais perto da cava vena inferior, e depois colete-as usando os fórceps. Coloque as LNs ilícías no mesmo tubo que contenha as LNs inguinais.
NOTA: Para obter células LN suficientes para coloração (ver seção 4), muitas vezes é necessário agrupar LNs popliteal, inguinal e ilímlica de um rato. Essas LNs estão todos drenando o quadríceps (local de i.m. vacinação). Este protocolo usa apenas um tubo de 15 mL de LNs agrupadas. - Para coletar LNs popliteal, segure a pele das patas traseiras e puxe-a suavemente para baixo para descobrir os músculos. Em seguida, insira os fórceps entre os músculos sob a articulação do joelho, e colete as LNs popliteal. Coloque as LNs popliteal no mesmo tubo contendo LNs inguinais e ilílicas.
NOTA: Veja nota após 3.1.7. - Coloque o baço em um coador de células de 70 μm dentro de um prato de cultura de 60 mm cheio de 5 mL de meio completo. Usando um êmbolo de seringa de 5 mL, amasse suavemente o órgão até sua completa desagregação.
- Remova o coador e transfira a suspensão da célula para um tubo limpo de 15 mL.
- Adicione 5 mL de meio completo ao prato de cultura, e lave cuidadosamente o prato e o coador para garantir que todas as células tenham sido recuperadas. Piscina com o resto da suspensão da célula do baço no tubo de 15 mL.
- Para as LNs inguinais, ilílicas e popliteais agrupadas, prepare uma única suspensão celular seguindo um procedimento semelhante ao usado nas etapas 3.1.9 a 3.1.11 para o baço.
- Centrífugas a 400 × g por 10 min a 4 °C. Descarte o supernatante e resuspenque as pelotas de células em PBS.
- Conte as células com uma câmara de Neubauer usando tampão de lise de glóbulos vermelhos e 0,04% v/v trypan azul na PBS.
- Isolamento das células BM
- Coloque 5 mL médio completo em um tubo de 15 mL, e mantenha-o no gelo, pronto para a coleção de patas traseiras.
- Sacrifique um rato adulto por luxação cervical.
- Esterilize a superfície da pele com 70% de v/v de etanol.
- Faça uma incisão transversal de ~1 cm na pele ventral com uma tesoura, segure firmemente a pele em ambos os lados do corte e puxe suavemente para baixo para descobrir os músculos das patas traseiras.
- Para eliminar a pele da parte de trás das patas traseiras, mantendo o rato em uma posição supina, coloque o grampo sob o joelho e puxe para cima para expor os músculos.
- Corte os ossos nas duas extremidades de uma perna traseira: a articulação pélvica/quadril e o tornozelo.
- Transfira ambas as pernas traseiras para o tubo de 15 mL preparado na etapa 3.2.1. Mantenha o tubo no gelo.
- Pegue as patas traseiras do tubo de 15 mL e transfira-as para papel de tecido. Corte as pernas traseiras logo abaixo da articulação do joelho para remover a tíbia. Disseque o fêmur e a tíbia dos músculos circundantes, remova o excesso de tecido usando uma tesoura e molhe o papel de tecido.
- Corte as pontas ósseas com uma tesoura para expor o eixo interior da medula. Insira a tíbia e o fêmur no tubo de extração de BM (ver preparação em 3.2.9.1-3.2.9.218),com a extremidade mais larga na parte inferior.
- Corte uma ponta de pipeta de 200 μL na linha logo acima da ponta e na linha de 100 μL.
- Coloque a parte do meio na parte superior, maior da ponta, e coloque-a em um tubo de microfuça de 1,5 mL.
- Gire o tubo de extração de BM a 800 × g por 1 min.
- Descarte o osso e ressumem vigorosamente a pelota em 1 mL de meio completo para remover quaisquer aglomerados. Filtre a suspensão da célula através de um filtro de 70 μm colocado na parte superior de um tubo de 15 mL.
- Lave o tubo de extração de BM duas vezes com 1 mL de meio completo cada vez. Filtre através de um filtro de 70 μm e acumule o volume com o resto da suspensão celular obtida na etapa 3.2.11.
NOTA: Um único tubo de 15 mL conterá células de ambas as patas traseiras de um rato. - Centrífugas a 400 × g por 10 min a 4 °C. Descarte o supernatante e resuspenque a pelota de célula em PBS.
- Conte as células com uma câmara de Neubauer usando tampão de lise de glóbulos vermelhos e 0,04% v/v trypan azul na PBS.
4. Coloração de células de baço, LN e BM
- Divida amostras de células a serem manchadas em 3 subgrupos: amostras de células para compensação, incluindo células de BM de camundongos não tratados para serem manchadas apenas com Hoechst 33342 (a partir de agora referido como Hoechst) e células de baço de camundongos não tratados para serem usadas para preparar uma mistura de células mortas/vivas para compensação de corantes de células mortas; controle positivo para análise do ciclo celular,consistindo em uma amostra de BM de camundongos não tratados; e amostras experimentais contendo amostras de baço e LN de camundongos não tratados e vacinados.
NOTA: Certifique-se de que há baço suficiente e células LN para análise de números suficientes de células CD8 T específicas da mordaça. Muitas vezes é necessário usar células de baço agrupadas e células LN agrupadas de 3 camundongos vacinados e manchar duas ou mais amostras idênticas de células agrupadas, cada uma contendo 3 × 106 células. Mescle amostras idênticas na etapa da coloração de Hoechst. Da mesma forma, as células de baço agrupadas de manchas e células LN de 3 camundongos não tratados, e mesclam amostras idênticas no final. Reserve uma amostra não manchada de células de baço de um mouse não tratado para ser usada para configuração de instrumentos e compensação. - Prepare a mistura de células mortas/vivas para compensação de corante de células mortas (esta mistura de células será manchada apenas com o corante celular morto).
- Aqueça um banho de água a 65 °C.
- Tome uma alíquota de células de baço (~3 × 106).
- Transfira a suspensão celular para um tubo de microfuge, coloque-a no banho de água a 65 °C por 5 min e, em seguida, coloque-a imediatamente no gelo por 10 minutos.
- Misture as células mortas pelo calor com células de baço vivo (~3 × 106) em uma proporção de 1:1, e transfira metade da mistura para uma placa inferior bem redonda (~3 × 106 células/bem para o controle de manchas de células mortas).
- Coloração de células mortas de amostras experimentais, controle positivo para análise de ciclo celular e mistura de células mortas/vivas
- Transfira o baço, LN, células BM (3 × 106 células/bem), e a mistura de células mortas/vivas (seção 4.2) em placa de fundo redondo de 96 poços, de acordo com o esquema de coloração (etapa 4.1), e centrífuga a 400 × g por 3 min a 4 °C.
- Resuspend cada pelota de célula em 50 μL de corante de célula morta diluído em PBS, e resuspend por pipetação para cima e para baixo 3 vezes imediatamente.
- Incubar por 30 min a 4 °C, protegido contra a luz.
- Lavar células 2 vezes com tampão de coloração; a primeira vez com 200 μL e a segunda vez com 250 μL. Para cada lavagem centrifuugar a placa a 400 × g por 3 min a 4 °C.
- Descarte o supernatante e resuspenque a pelota de célula em 20 μL de PBS.
- Coloração de células de membrana com grandes multimers complexos de histocompatibilidade (MHC)-peptídeos e mAbs.
- Levando em conta os volumes necessários de acordo com o esquema de coloração (Configurações do citômetro de fluxo, Tabela 1), prepare os seguintes reagentes:
- Diluir mAb 2.4G2 no tampão de coloração de acordo com a diluição apropriada (ver Tabela de Materiais); para que cada amostra seja manchada, use 10 μL desta diluição.
NOTA: 2,4G2 mAb bloqueia a ligação não específica de antígeno de imunoglobulinas aos receptores FcγIII e FcγII. - Diluir o tetramer de alofilia H-2k(d) AMQMLKETI (APC)-rotulado (Tetr-gag) no tampão de coloração para obter a diluição apropriada (ver Tabela de Materiais); para que cada amostra seja manchada, use 20 μL desta diluição.
- Prepare a mistura de anticorpos diluindo mAbs no tampão de coloração de acordo com a diluição apropriada (ver Tabela de Materiais) que foi previamente determinada em experimentos de titulação; para que cada amostra seja manchada, use 20 μL desta mistura de anticorpos.
NOTA: Aqui, foram utilizadas proteína de clorofila anti-CD3e peridinin (PerCP-Cy5.5) (clone 145-2C11), ultravioleta brilhante anti-CD8a (BUV805) (clone 53-6.7) e anti-CD62L phycoerythrin ciane7 (PECy7) (clone MEL-14).
- Diluir mAb 2.4G2 no tampão de coloração de acordo com a diluição apropriada (ver Tabela de Materiais); para que cada amostra seja manchada, use 10 μL desta diluição.
- Adicione 10 μL dos 2,4G2 mAb previamente diluídos (etapa 4.4.1.1), e incubar por 10 min a 4 °C, protegido da luz.
- Adicione 20 μL do pentamer de ficoerytra tetr-gag (PE) anteriormente diluído (passo 4.4.1.2) e 10 μL de H-2k(d) AMQMLKETI phycoerythrin (PE) pentato (pent-gag). Incubar por 15 min a 4 °C, protegido contra a luz.
- Adicione 20 μL da mistura de anticorpos previamente preparada (etapa 4.4.1.3) e incubar 15 min a 4 °C, protegido da luz.
NOTA: Portanto, o volume final é de 80 μL por poço (etapa 4.3.5, passos 4.4.2 para 4.4.4). - Lave as células com 200 μL de tampão de coloração. Centrifugar a 400 × g por 5 min a 4 °C.
- Resuspenda a pelota celular em 250 μL de tampão de coloração, e transfira a suspensão celular para tubos de 5 mL. Adicione 1 mL de tampão de coloração ao tubo e centrífuga a 400 × g por 5 min a 4 °C.
- Pegue a alíquota das células BM (3 × 106 células) (ver lista de amostras de células, seção 4.1) a ser usada para compensar o canal Hoechst (Hoechst 33342 está animado por um laser ultravioleta (ajustes de citómetro de fluxo (Tabela 2)), e transferir a suspensão celular para um tubo de 5 mL. Adicione 1 mL de tampão de coloração ao tubo e centrífugas 400 × g por 5 min a 4 °C.
- Levando em conta os volumes necessários de acordo com o esquema de coloração (Configurações do citômetro de fluxo, Tabela 1), prepare os seguintes reagentes:
5. Fixação/permeabilização
- Prepare o novo buffer de fixação/permeabilização diluindo 1 parte do concentrado de fixação/permeabilização com 3 partes de diluente de fixação/permeabilização, de acordo com as instruções do fabricante.
- Descarte o supernatante e o vórtice de pulso das amostras para desagregar completamente a pelota.
- Adicione 1 mL do buffer de fixação/permeabilização recém-preparado a cada tubo, incluindo um tubo com células de baço não manchadas (3 x 106, ver lista de amostras de células, seção 4.1) e vórtice.
- Incubar por 16 h a 4 °C.
NOTA: O protocolo pode ser pausado aqui.
6. Coloração intracelular
- Mancha ki67
- Prepare o tampão de permeabilização fresco 1x diluindo o tampão de permeabilização 10x com água destilada, de acordo com as instruções do fabricante. Antes do uso, o buffer de permeabilização 1x deve ser filtrado através de um filtro de 0,45 μm para eliminar agregados.
- Diluir mAb Ki67 isothiocyanato de fluoresceína (FITC) (clone SolA15) no buffer de permeabilização 1x (ver Tabela de Materiais),conforme determinado anteriormente em experimentos de titulação (volume final de 100 μL por amostra).
- Adicione 3 mL de tampão de permeabilização 1x a cada tubo e centrífuga a 400 × g por 5 min a temperatura ambiente (RT).
- Descarte o supernatante e repita o passo 6.1.3.
- Descarte o supernasciente e resuspenque a pelota celular em 100 μL de mAb Ki67 FITC previamente diluído (passo 6.1.2).
- Incubar por 30 min na RT, protegido da luz.
- Lave as células 2 vezes com 4 mL de tampão de permeabilização 1x. Para cada centrífuga de lavagem a 400 × g por 5 min no RT.
- Resuspend a pelota celular em PBS considerando os seguintes volumes: 350 μL de PBS para que as amostras sejam adquiridas diretamente no cítmetro de fluxo; 250 μL de PBS para que as amostras sejam incubadas com Hoechst pouco antes da citometria de fluxo (seção 6.2).
- Coloração de DNA
- Adicione 250 μL de 4 μg/mL Hoechst em PBS a cada amostra (concentração final de Hoechst é de 2 μg/mL).
NOTA: No caso de duas ou mais amostras idênticas de 250 μL em PBS foram preparadas, mesclá-las nesta etapa e adicionar volume igual de 4 μg/mL hoechst solução em PBS (concentração final de Hoechst é de 2 μg/mL). O número de células influencia muito a etapa de coloração de DNA. Use o mesmo número de célula em cada amostra. Esteja ciente de que mesmo um número celular ligeiramente reduzido (por exemplo, devido à perda de células em etapas anteriores de lavagem) resulta em maior ligação hoechst ao DNA e maior intensidade de Hoechst. - Incubar por 15 min na RT, protegido da luz.
- Centrifugar as amostras a 400 × g por 5 min na RT.
- Resuspense a pelota de célula em 350 μL de PBS.
- Adicione 250 μL de 4 μg/mL Hoechst em PBS a cada amostra (concentração final de Hoechst é de 2 μg/mL).
7. Preparação de amostras de contas de compensação
- Prepare 5 μL do anticorpo diluindo mAb no tampão de coloração adequadamente.
NOTA: Para cada mAb conjugado fluorocromo utilizado no experimento, prepare sua amostra de contas de compensação correspondente. - Vortex Negative Control e Anti-Rat/Hamster Ig,κ Comp Beads antes de usar.
- Para cada amostra, introduza uma gota (~20 μL) de CompBeads de Controle Negativo e uma gota de Anti-Rat/Hamster Ig,k CompBeads.
- Adicione 5 μL do anticorpo pré-ludo (passo 7.1) ao tubo e encosto para cima e para baixo.
- Incubar por 15 min a 4 °C, protegido contra a luz.
- Lave amostras com 2 mL de tampão de coloração. Centrifugar a 400 × g por 5 min a 4 °C.
- Descarte o supernatante e resuspenque a pelota adicionando 500 μL de PBS a cada tubo e vórtice.
8. Configuração de instrumentos e compensação e aquisição experimental de amostras no citômetro de fluxo
NOTA: Consulte as configurações do címetro de fluxo(Tabela 2) para a configuração do cítômetro.
- Configuração geral de instrumentos e compensações
- Abra o software para aquisição de amostras (ver Tabela de Materiais),e crie um novo experimento clicando em Novo Experimento na seção fita do espaço de trabalho e selecionando Novo Experimento em Branco.
- Clique duas vezes no experimento criado para abri-lo.
- Na janela Configurações do Citômetro, clique em Parâmetros e selecione todos os canais (por exemplo, PE, APC, etc.) usados no painel de coloração, incluindo os parâmetros De dispersão frontal (FSC) e Dispersão Lateral (SSC).
- Selecione a escala linear como parâmetro Hoechst desmarcando a escala de log e verifique a largura (W) do pulso de tensão para FCS, SSC e Hoechst.
NOTA: Todos os parâmetros são mostrados por padrão na escala logarítmica (log), exceto para FSC e SSC que estão em escala linear. Todos os parâmetros são analisados pela Área (A) e pela Altura (H) do pulso de tensão. - Na Planilha Global,crie um gráfico de pontos com FSC-A no eixo x e SSC-A no eixo y.
- Execute a amostra de baço não manchada clicando em Adquirir Dados no Painel de Aquisição.
- Defina as configurações apropriadas de FSC e SSC para visualizar as células modificando os valores de tensão na seção Parâmetros e crie um portão para selecionar todas as células exibidas no gráfico de pontos FSC-A/SSC-A clicando no Portão de Polígono na barra de ferramentas do espaço de trabalho da planilhaglobal .
- Exibir as células fechadas em histogramas com cada parâmetro de fluorescência no eixo x.
- Execute amostras de baço não manchadas e totalmente manchadas para ajustar o detector de fluorescência (TPM) para ter uma separação clara entre sinais negativos e positivos das células manchadas para cada parâmetro de fluorescência.
- Para executar a configuração de compensação, clique em Experimentar na fita do espaço de trabalho e na seção Configuração de compensação, selecione Criar controles de compensação. Desmarcar incluir tubo de controle não manchado/bem e clique em OK.
NOTA: Esta operação resultará na criação de uma amostra chamada Controles de Compensação e uma Planilha Normal contendo várias folhas correspondentes a cada parâmetro selecionado. - Executar uma amostra de contas de compensação (ver seção 7); definir as configurações FSC e SSC apropriadas para visualizar as contas modificando os valores de tensão e o limiar de aquisição de 5.000 nos parâmetros FSC na janela Cytometer.
- Ajuste o portão P1 na população de contas e verifique se os picos positivos e negativos são visíveis no eixo x. Repita esta operação para cada amostra de contas de compensação e, finalmente, regisse cada arquivo amostral clicando em registrar dados no painel de aquisição (registrar pelo menos 5.000 eventos para cada amostra).
- Para cada amostra de contas registrada, coloque os portões P2 e P3 nos picos positivos e negativos, respectivamente.
- Execute as amostras de células para compensação (ver etapas 4.2 e 4.4.7, e seções 5 e 6). Modifique as tensões FSC e SSC e o valor do limiar para visualizar as células, ajustar o portão P1 e, finalmente, registrar cada arquivo de amostra (registos mínimos de 10.000 eventos). Coloque os portões P2 e P3 nos picos positivos e negativos, respectivamente.
NOTA: Para a compensação do canal Hoechst, use o G0/G1 como o pico negativo (P3) e o G2/Mcomo o positivo (P2). - Clique em Experimentar na seção fita do espaço de trabalho e na seção Configuração de compensação, selecione Calcular compensação.
- Nomeie a configuração de compensação criada, link e salve-a no experimento atual.
- Aquisição experimental de amostras
- Abra um espécime clicando em Novo Espécime na barra de ferramentas do navegador e crie a estratégia de gating na Planilha Global.
NOTA: A estratégia de gating de aquisição de amostras é semelhante à da análise amostral, descrita na Figura 3 e na seção 9. - Exibir toda a população de Eventos em um histograma com CD3-A no eixo x. Crie um Intervalo de Portão para selecionar apenas as células CD3+ .
- No Painel de Aquisição,selecione o portão de armazenamento como Todos os Eventos para amostras de LN e todas as células De Eventos ou CD3+ para amostras de baço.
- Execute as amostras experimentais em baixa velocidade, e finalmente grave todos os arquivos certificando-se de coletar pelo menos 100-200 células CD8 T específicas de antígeno para cada amostra dos camundongos vacinados.
NOTA: O tamanho do arquivo de amostras experimentais é geralmente grande (30-120 MB), especialmente quando a frequência de células CD8 T específicas de antígeno é baixa. Assim, um alto número de eventos (> 1 × 106) devem ser coletados para registrar pelo menos 100-200 células CD8 T específicas de antígeno. Arquivos grandes podem retardar o processo subsequente de análise de dados. A aquisição de apenas células CD3+ em amostras de baço (ver passo 8.2.2 acima) é útil para manter o tamanho do arquivo menor. - Execute e registre o controle positivo para análise de ciclo celular, ou seja, amostra de BM de camundongos não tratados.
- Abra um espécime clicando em Novo Espécime na barra de ferramentas do navegador e crie a estratégia de gating na Planilha Global.
9. Análise de dados
- Abra o software (ver Tabela de Materiais),e crie diferentes grupos correspondentes aos diferentes órgãos a serem analisados clicando em Criar Grupo na seção fita do espaço de trabalho (ou seja, criar grupo "a-LNs"; "b-baço"; "c-BM").
NOTA: Grupos recém-criados aparecerão na lista de grupos, enquanto o grupo "Compensação" é gerado automaticamente pelo software. - Abra a janela Modificar grupo clicando duas vezes no nome do grupo e verifique se os grupos recém-criados estão sincronizados. Se não, insira uma marca de verificação na função Sincronizada.
- Arraste cada arquivo .fcs em seu grupo correspondente.
- Crie a estratégia de gating começando com o grupo "A-LNs".
- Clique duas vezes na amostra totalmente manchada no grupo para abrir a janela de gráfico; x-e-y-axis são rotulados como nos arquivos fcs (ver configurações de citômetro de fluxo, Tabela 2).
- Exibir os eventos totais adquiridos para esta amostra em um gráfico de pontos com DNA-A no eixo x e DNA-W no eixo y.
- Selecione apenas a população de células únicas clicando em Retângulo na seção de ferramenta gating da janela de gráfico.
NOTA: As células únicas possuem valores de DNA-A da seguinte forma: 2N (baixo): entre 2N e 4N (intermediário), ou igual a 4N (alto), enquanto os valores de DNA-W são idênticos para todos eles (passo 1 da Figura 3). - Clique duas vezes no centro do portão retangular para exibir células únicas em um gráfico de pontos com parâmetro FSC-A no eixo x e corante de célula morta no eixo y.
- Selecione apenas a população de células vivas clicando em Polígono na seção de ferramenta gating da janela de gráfico. As células vivas são negativas para o corante de célula morta (passo 2 da Figura 3).
- Clique duas vezes no centro do portão poligonal para exibir as células em um gráfico de pontos com parâmetro FSC-A no eixo x e parâmetro SSC-A no eixo y.
- Clique em Retânguloe crie um portão "relaxado" para incluir todas as células ao vivo únicas nesse gráfico12 (etapa 3 da Figura 3).
- Clique duas vezes no centro do portão "relaxado" para exibir as células em um gráfico de pontos com CD3 no eixo x e CD8 no eixo y.
- Selecione as células CD3+CD8+ clicando em Polygon (etapa 4 da Figura 3).
- Clique duas vezes no centro do portão CD3+CD8+ para exibir as células em um gráfico de pontos com tetr-gag no eixo x e pent-gag no eixo y.
- Selecione as células CD8 T específicas do antígeno (positiva para tetr-gag e pent-gag) clicando em Polygon (passo 5 da Figura 3).
- Clique duas vezes no centro do portão específico da mordaça para exibir as células em uma trama de pontos com DNA-A no eixo x e Ki67 no eixo y(Figura 4).
- Selecione as células nas diferentes fases do ciclo celular clicando em Quad na seção de ferramentas de gating da janela de gráfico.
NOTA: Células na fase G0 são células baixas Ki67neg-DNA (quadrante inferior esquerdo); as células no G1 são Ki67pos-DNA baixo (quadrante superior esquerdo); as células em S-G2/M são Ki67pos-DNA intermediário/alto (quadrante superior direito)(Figura 4). - Copie a estratégia de gating criada em uma amostra para o grupo correspondente para aplicar os portões a todas as amostras do grupo.
- Repetir passos de 9,5 a 9,18 para o "grupo A-LN".
- Verifique se todos os portões são apropriados para cada amostra do grupo "baço b". Para analisar o ciclo celular entre as células BM (controle positivo), clique no centro do portão "relaxado" para exibir as células em um gráfico de pontos com DNA-A no eixo x e Ki67 no eixo y.
- Verifique se todos os portões são apropriados para cada amostra dos 3 grupos (ou seja, para células do baço, LN e BM).
NOTA: O portão populacional de célula única (etapa 9.7) e o portão quad para ciclo celular (etapa 9.17) podem ter diferentes coordenadas de portão em diferentes amostras, principalmente devido às possíveis pequenas diferenças da intensidade de corante hoechst entre as amostras (seção 6.2). Por essa razão, pode ser necessário modificar o portão da população de células únicas e os portões quad para o ciclo celular em cada amostra. Isso será feito da seguinte forma: clique duas vezes no nome do grupo e remova a sincronização das propriedades do grupo. Esta operação permite a modificação dos portões em uma amostra sem modificar os mesmos portões em todas as outras amostras do grupo. Após a remoção da sincronização, modifique os portões quando necessário. - Para visualizar os resultados obtidos por esta análise, clique em Layout Editor na seção fita do espaço de trabalho para abri-lo. Arraste cada portão da estratégia de gating no painel de amostra para o editor de layout, e coloque as parcelas de acordo com a sequência da estratégia de gating. Se necessário, altere o tipo de gráfico clicando duas vezes no plot correspondente no layout e selecionando o tipo apropriado na janela Definição de gráfico.
- Clique no Grupo e iterar por funções na fita de layout para visualizar os resultados obtidos em cada órgão e comparar amostras diferentes.
Representative Results
As fases do ciclo celular das células do baço, LNs e BM de camundongos Balb/c foram analisadas utilizando o corante de DNA fluorescente, Hoechst, e um anti-Ki67 mAb, de acordo com o protocolo resumido na Figura 1. Essa coloração permitiu a diferenciação de células nas seguintes fases do ciclo celular: G0 (Ki67neg, com 2N de DNA definido como DNAlow), G1 (Ki67pos, DNAlow) e S-G2/M (Ki67pos, com conteúdo de DNA composto entre 2N e 4N, ou igual a 4N de DNA definido como DNAmediainterte/alto).
Primeiro realizamos a análise do ciclo celular das células BM para reproduzir resultados publicados anteriormente13,14 e depois analisamos as células de interesse, ou seja, células CD8 T. A Figura 2 mostra um exemplo típico de análise do ciclo celular das células BM(Figura 2A). O protocolo rendeu um baixo coeficiente de variação (CV) dos picos de DNA G0/G1 e G2/M,indicando a excelente qualidade da coloração de DNA (Figura 2B,mostrando um exemplo com CV < 2,5; CV sempre foi < 5 em todos os experimentos).
Aplicamos então o mesmo protocolo às células CD8 T específicas de antígenos de camundongos vacinados. Os camundongos BALB/c foram vacinados contra a mordaça de antígeno do HIV-1 usando mordaça chad3 para priming e mva-gag para impulsionar, ambos projetados para transportar mordaça HIV-1. No dia (d) 3 pós-boost, analisamos a frequência de células CD8 T específicas da mordaça do baço e drenando LNs. Aproveitamos a estratégia de gating recém-definida para células T na fase inicial da resposta imune, que em contraste com a estratégia convencional, é apropriada para detectar células CD8 T altamente ativadas que respondem antígeno12. Executamos a nova estratégia em cinco etapas subsequentes. Na etapa 1, excluímos doublets ou agregados pelo portão DNA-A/ -W, e na etapa 2, identificamos células vivas por exclusão de marcadores de células mortas. Na etapa 3, identificamos a população de interesse usando um portão FSC-A/ SSC-A não convencional(Figura 3A)em vez do portão de linfócitos estreitos canônicos12. Após a gating em células CD3+CD8+ (etapa 4 da Figura 3A), identificamos células CD8 T específicas da mordaça usando dois multimers MHC diferentes, ou seja, pent-gag e Tetr-gag (passo 5 da Figura 3A). Utilizamos dois multimers em vez de um para melhorar a sensibilidade da detecção de células CD8 T específicas da mordaça em camundongos vacinados, sem aumentar o fundo de coloração em camundongos não tratados(Figura 3B e C, passo 5). Assim, distinguimos com sucesso camundongos não tratados (células CD8 T específicas de antígeno de 0,00% e 0,00% em LNs e baço, respectivamente) de camundongos vacinados (0,46% e 0,29% células CD8 T específicas de antígeno em LNs e baço, respectivamente, Figura 3B e C).
Notavelmente, o protocolo nos permitiu ter um fundo extremamente baixo no portão celular CD8 T específico de antígeno de LNs e baço de camundongos não tratados (geralmente 0,00% e no máximo 0,02%). A comparação de gráficos FSC-A/ SSC-A específicos da mordaça mostrou que as células específicas da mordaça tinham SSC-A e FSC-A elevados (Figura 3D),confirmando a necessidade de usar um portão FSC-A/ SSC-A "relaxado" para capturar essas células. Em seguida, avaliamos os percentuais de células CD8 T específicas da mordaça em diferentes fases do ciclo celular(Figura 4A). Descobrimos que as células CD8 T específicas da mordaça no baço e ainda mais nas LNs drenantes continham uma alta proporção de células nas fases S-G2/Mno dia 3 pós-boost (18,60% e 33,52%, respectivamente).
Além disso, descobrimos que as células CD8 T específicas da mordaça nas fases S-G2/M tinham FSC-A e SSC-A elevados, quando sobrepostas ao total de células CD8 T do mesmo órgão(Figura 4B). A expressão CD62L por células CD8 T específicas da mordaça foi baixa, como esperado para células T ativadas, com exceção de algumas células em G0 nas LNs(Figura 4C). Ao todo, esses resultados confirmaram que o portão "relaxado" (etapa 3 da Figura 3A, B e C) foi necessário para incluir todas as células CD8 T específicas de antígenosproliferando 12. O protocolo foi extremamente valioso para uma avaliação "instantânea" das fases de ciclo celular de células CD8 T específicas de antígeno no momento da análise e da expressão CD62L por células em diferentes fases do ciclo celular.

Figura 1: Esquema do protocolo para análise do ciclo celular de células CD8 T específicas de antígeno. Clique aqui para ver uma versão maior desta figura.

Figura 2: Análise do ciclo celular das células BM. As células BM de camundongos Balb/c não tratados foram manchadas e analisadas por citometria de fluxo. (A) Exemplo de estratégia de gating. Nós emomos em células únicas na trama DNA-A/-W (esquerda) e, posteriormente, em células vivas por exclusão de corante de célula morta (meio). Em seguida, um portão FSC-A/SSC-A "relaxado" foi usado para todas as células BM (à direita). (B) Exemplo de análise do ciclo celular das células BM (esquerda). Utilizamos uma combinação de Ki67 e coloração de DNA para identificar células nas seguintes fases do ciclo celular: G0 (quadrante inferior esquerdo, células Ki67neg-DNAlow), G1 (quadrante superior esquerdo, Ki67pos-DNAlow), S-G2/M (quadrante superior direito, Ki67pos-DNAmediate/high). Fluorescência Menos Um (FMO) controle de Ki67 mAb (médio) e histograma de DNA (direita) são mostrados. Na trama do histograma de DNA, os portões esquerdo e direito correspondem ao G0/G1 e ao pico de DNA G2/M, respectivamente, e os números representam os coeficientes de variação (CV) de cada pico. Em todas as outras parcelas, os números representam porcentagens celulares nos portões indicados. O número mostra 1 experimento representativo de 5. Em cada experimento, analisamos células BM agrupadas de 3 camundongos. Clique aqui para ver uma versão maior desta figura.

Figura 3: Análise de células CD8 T específicas de antígeno de LNs e baço. Os ratos balb/c foram preparados intramuscularmente (i.m.) com chad3-gag e impulsionado i.m. com MVA-gag. No 3º dia, células de LN e baço de camundongos de controle vacinados e não tratados foram manchadas e analisadas por citometria de fluxo. (A) Esquema da estratégia de gating em cinco etapas para identificar células únicas (Passo 1); células vivas (Passo 2); linfócitos (Passo 3); Células CD8 T (Passo 4); e células específicas da mordaça (Passo 5). (B-C) Exemplo de plots: análise de células de (B) LNs e (C) baço de camundongos não tratados (superior) e vacinados (inferior). Identificamos células únicas na trama de DNA-A/ -W no passo 1. Então, no passo 2, selecionamos células vivas por exclusão de corante de célula morta. No passo 3, usamos um portão não canônico "relaxado" para linfócitos. No Passo 4, identificamos células CD8 T por sua dupla expressão de CD3 e CD8. Em seguida, identificamos células específicas da mordaça e não específicas da mordaça no Passo 5, com base em sua capacidade de vincular h-2kd-gag-Pentamer (Pent-gag) e H-2kd-gag-Tetramer (Tetr-gag), ou não, respectivamente. (D) Perfis FSC-A/SSC-A de células específicas de mordaça (azul) e não específicas de mordaça (cinza) após gating conforme descrito acima. Os números representam percentagens de células nos portões indicados. O número mostra 1 experimento representativo de 5. Em cada experimento, analisamos o baço agrupado e as células LN agrupadas de 3 camundongos vacinados e 3 camundongos não tratados. Clique aqui para ver uma versão maior desta figura.

Figura 4: Análise do ciclo celular de células CD8 T específicas de antígeno. Os camundongos foram vacinados como na Figura 3 e a análise do ciclo celular de células específicas da mordaça foi realizada no 3º dia pós-impulso, após o gating em 5 passos como na Figura 3. (A) Exemplo de análise do ciclo celular de células CD8 T específicas da mordaça de LNs (topo) e baço (inferior) de camundongos vacinados. As fases do ciclo celular foram identificadas como na Figura 2B. Os painéis representam células em G0, em G1, e no controle S-G2/M (esquerda) e Fluorescência Minus One (FMO) de Ki67 mAb (direita). Os números representam percentagens de células nos portões indicados. (B) Gráficos de pontos FSC-A/SSC-A que mostram células CD8 T específicas da mordaça nas fases S-G2/M (em vermelho) sobrepostas em células CD3+CD8+ T totais (em cinza) de LNs (topo) e baço (inferior) de camundongos vacinados. (C) Compense os histogramas mostrando a expressão CD62L por células CD8 T específicas da mordaça em G0 (verde), em G1 (azul) e em S-G2/M (vermelho) de LNs (topo) e baço (fundo) de camundongos vacinados. Os y-axes indicam um número normalizado de eventos. O número mostra 1 exemplo representativo de 5 experimentos independentes com um total de 15 camundongos. Clique aqui para ver uma versão maior desta figura.
Material suplementar: Ajustes de citômetro de fluxo. Clique aqui para baixar este arquivo.
Discussion
Embora a expansão clonal de células T tenha sido intensamente estudada, alguns aspectos permanecem desconhecidos, principalmente porque as ferramentas disponíveis para investigá-la são poucas e têm suas próprias desvantagens. Nessa perspectiva, criamos um método citométrico de fluxo altamente sensível para analisar o ciclo celular de células CD8 T específicas de antígeno em momentos iniciais após a vacinação em um modelo de camundongo. O protocolo é baseado em uma combinação de Ki67 e coloração de DNA, que foi anteriormente usada para analisar o ciclo celular de células hematopoiéticas BM em camundongos13,14. Para adaptar o protocolo às células CD8 T específicas do antígeno, tivemos que considerar algumas questões críticas, incluindo a escolha do corante de DNA, as condições apropriadas para obter coloração de DNA comparável em diferentes amostras e a estratégia de gating para análise de dados.
Muitos corantes estão disponíveis para coloração de DNA, incluindo iodeto de propidium e 7-aminoactinomicina D; escolhemos Hoechst porque era compatível com a coloração da membrana e o protocolo de fixação/permeabilização leve necessário para a coloração de Ki67. Ao mesmo tempo, a coloração com Hoechst nos permitiu obter um histograma de DNA de excelente qualidade, ou seja, os picos de DNA G0/G1 e G2/M tinham um coeficiente de variação muito menor (CV) do que os picos de DNA normalmente obtidos com outros corantes de DNA, por exemplo, DRAQ519. De fato, Hoechst pode manchar DNA mesmo em células vivas20.
Algumas estratégias foram utilizadas para evitar a flutuação da intensidade hoechst em diferentes amostras do mesmo experimento. A coloração de hoechst foi realizada pouco antes da aquisição da amostra no citômetro de fluxo para minimizar o declínio da intensidade do corante durante o tempo. Para os interessados em reproduzir o protocolo em grandes experimentos com inúmeras amostras, recomendamos realizar a coloração de Hoechst em algumas amostras de cada vez. Outra desvantagem é que a intensidade de Hoechst pode ser fortemente influenciada pelo número de célula durante a incubação com o corante. Por essa razão, recomendamos sempre o uso do mesmo número de células e o mesmo volume por amostra para coloração de DNA. Se um alto número de células for necessário para aquisição no citômetro de fluxo, recomendamos preparar duas ou mais amostras idênticas e, em seguida, fundi-las pouco antes da etapa de coloração hoechst.
Um ponto-chave do protocolo é a estratégia de gating para análise de dados. Recentemente publicamos uma nova estratégia para análise de células T nos primeiros momentos da resposta imune, o que nos permitiu aumentar a sensibilidade da detecção de células T específicas de antígeno12. Aplicamos essa estratégia aos dados aqui apresentados. Primeiro, excluímos agregados celulares na trama de DNA-A/W. Em segundo lugar, depois de gating fora células mortas, usamos um portão de linfócito bastante grande no lote FSC/SSC ("portão relaxado"). Por essa estratégia, conseguimos incluir células CD8 T altamente ativadas específicas de antígeno em S-G2/M que geralmente são perdidas pelas estratégias atuais de gating, já que essas células têm FSC-A e SSC-A elevados. Em resumo, a análise dos dados representa uma parte crítica do método, essencial para obter uma detecção sensível de células T ativadas/proliferadoras específicas de antígenos.
O método previne a possibilidade de faltar dados críticos de células T em fases iniciais da resposta imune e abre novas perspectivas para o imunomonitoramento de células T. Uma melhoria futura pode incluir a coloração para fosfo-histona 3 que permitiria diferenciação entre G2 e M21. Uma limitação atual é que as células devem ser fixadas e permeabilizadas para manchar para o marcador nuclear, Ki67. Assim, as células não podem ser utilizadas para outros tipos de análise, como classificação e análise funcional subsequente. Além disso, corantes de DNA, incluindo Hoechst, geralmente interferem na análise genômica do DNA e não são adequados para este tipo de avaliação. A identificação de marcadores de membrana que se correlacionam com diferentes fases do ciclo celular e que podem ser manchadas em células vivas poderia superar essa limitação. Em conclusão, o método tem grande potencial para a avaliação de células T ativadas/proliferantes em diversos contextos como vacinação, infecção, doenças imuno medianas e imunoterapia.
Disclosures
A. Folgori e S. Capone são funcionários da Reithera Srl. A. Nicosia é nomeada inventora no pedido de patente WO 2005071093 (A3) "Portadores de vacina contra o adenovírus chimpanzé". Os outros autores não têm nada a revelar.
Acknowledgments
Este trabalho foi apoiado pela Reithera, pelo projeto MIUR 2017K55HLC_006, e por 5 × 1000 do Bolsa Associazione Italiana Ricerca sul Cancro (AIRC). O seguinte tetramer foi obtido através da Instalação NIH Tetramer: H-2K (d) HIV conjugado a APC (d) hiv gag 197-205 AMQMLKETI.
Materials
| Name | Company | Catalog Number | Comments |
| 1-200 μL universal fit bulk packed pipet tips | Corning | CLS4866-1000EA | |
| 2.4G2 anti-FcγR mAb | BD | 553141 | 10 μg/ml final concentration |
| 5 ml syringe plunger | BD Emerald | 307733 | |
| 15 ml conical tubes | MercK Millipore | SBHA025SB | |
| 60 mm TC-treated Cell Culture Dish | Falcon | 353002 | |
| 70 μm cell strainer | Falcon | 352097 | |
| 96-well Clear Round Bottom TC-treated Culture Microplate | Falcon | 353077 | |
| Anti-Rat/Hamster Ig,k/Negative Control Compensation Particles | BD- Bioscience | 552845 | |
| Beta-mercaptoethanol | Sigma | M3148 | |
| Bovine Serum Albumin | Sigma | A07030 | |
| BUV805 Rat Anti-Mouse CD8a | BD- Bioscience | 564920 | 4 μg/ml final concentration |
| Dulbecco's Phosphate Buffer Saline w/o Calcium w/o Magnesium | Euroclone | ECB4004L | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120159 | |
| Ethanol | Sigma | 34852-1L-M | |
| Ethylenediaminetetraacetic Acid Disodium Salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum | Corning | 35-079-CV | |
| Filcon, Sterile, Syringe-Type 70 μm | Falcon | 352350 | |
| Fixable Viability Dye eFluor 780 | eBioscience | 65-0865-14 | 1:1000 final concentration |
| Foxp3 / Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | This Set contains fixation/permeabilization concentrate and diluent, and permeabilization buffer 10x |
| H-2k(d) AMQMLKETI allophycocyanin (APC)-labelled tetramer | provided by NIH Tetramer Core Facility | 6 μg/ml final concentration | |
| H-2k(d) AMQMLKETI phycoerythrine (PE) labelled pentamer | Proimmune | F176-2A-E - 176 | 10 μL / sample |
| Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water | ThermoFisher | H3570 | |
| Ki-67 Monoclonal Antibody (SolA15), FITC | eBioscience | 11-5698-82 | 5 μg/ml final concentration |
| L-Glutamine 100X (200 mM) | Euroclone | ECB3000D | |
| Millex-HA Filters 0,45 µm | BD | 340606 | |
| Penicillin/Streptomycin 100X | Euroclone | ECB3001D | |
| PE/Cyanine7 anti-mouse CD62L Antibody | Biolegend | 104418 | 0.2 μg/ml final concentration |
| PerCP-Cy™5.5 Hamster Anti-Mouse CD3e | BD- Bioscience | 551163 | 4.4 μg/ml final concentration |
| Red Blood Cell Lysis Buffer | Sigma | R7757 | |
| Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352058 | |
| RPMI 1640 Medium without L-Glutamine with Phenol Red | Euroclone | ECB9006L | |
| Software package for analyzing flow cytometry data | FlowJo | v.10 | |
| Software for acquisition of samples at flowcytometer | BD FACSDiva | v 6.2 | |
| Trypan Blue Solution | Euroclone | ECM0990D |
References
- Castellino, F., et al. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440 (7086), 890-895 (2006).
- Zhang, N., Bevan, M. J. CD8(+) T cells: foot soldiers of the immune system. Immunity. 35 (2), 161-168 (2011).
- Bajénoff, M., et al. Highways, byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunology. 28 (8), 346-352 (2007).
- Bevan, M. J., Fink, P. J. The CD8 response on autopilot. Nature Immunology. 2 (5), 381-382 (2001).
- Van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs require a single brief period of antigenic stimulation for clonal expansion and differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Kaech, S. M., Wherry, E. J., Ahmed, R. Effector and memory T-cell differentiation: implications for vaccine development. Nature Review Immunology. 2 (4), 251-262 (2002).
- Beverley, P. C. Primer: making sense of T-cell memory. Nature Clinical Practice Rheumatology. 4 (1), 43-49 (2008).
- Parretta, E., et al. CD8 cell division maintaining cytotoxic memory occurs predominantly in the bone marrow. Journal of Immunology. 174 (12), 7654-7664 (2005).
- Di Rosa, F. Maintenance of memory T cells in the bone marrow: survival or homeostatic proliferation. Nature Review Immunology. 16 (4), 271 (2016).
- Di Rosa, F. Two niches in the bone marrow: a hypothesis on life-long T cell memory. Trends in Immunology. 37 (8), 503-512 (2016).
- Di Rosa, F. Commentary: Memory CD8(+) T cells colocalize with IL-7(+) stromal cells in bone marrow and rest in terms of proliferation and transcription. Frontiers in Immunology. 7, 102 (2016).
- Simonetti, S., et al. Antigen-specific CD8 T cells in cell cycle circulate in the blood after vaccination. Scandinavian Journal of Immunology. 89 (2), 12735 (2019).
- Wilson, A., et al. c-Myc controls the balance between hematopoietic stem cell self-renewal and differentiation. Genes & Development. 18 (22), 2747-2763 (2004).
- Hirche, C., et al. Systemic virus infections differentially modulate cell cycle state and functionality of long-term hematopoietic stem cells in vivo. Cell Report. 19 (11), 2345-2356 (2017).
- Colloca, S., et al. Vaccine vectors derived from a large collection of simian adenoviruses induce potent cellular immunity across multiple species. Science Translational Medicine. 4 (115), (2012).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Di Lullo, G., et al. The combination of marker gene swapping and fluorescence-activated cell sorting improves the efficiency of recombinant modified vaccinia virus Ankara vaccine production for human use. Journal of Virological Methods. 163 (2), 195-204 (2010).
- Mouse phenotype. , Available from: https://www.mousephenotype.org/data/secondaryproject/3i (2020).
- Yoon, H., Kim, T. S., Braciale, T. J. The cell cycle time of CD8+ T cells responding in vivo is controlled by the type of antigenic stimulus. PLoS One. 5 (11), 15423 (2010).
- Pauklin, S., Vallier, L. The cell-cycle state of stem cells determines cell fate propensity. Cell. 155 (1), 135-147 (2013).
- Vignon, C., et al. Flow cytometric quantification of all phases of the cell cycle and apoptosis in a two-color fluorescence plot. PLoS One. 8 (7), 68425 (2013).
Tags
Imunologia e Infecção Problema 167 células CD8 T específicas de antígeno ciclo celular Ki67 corante de DNA citometria de fluxo baço linfonodos mouseErratum
Formal Correction: Erratum: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice
Posted by JoVE Editors on 11/03/2021.
Citeable Link.
An erratum was issued for: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice. The Authors section and a figure were updated.
The authors section was updated from:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
* These authors contributed equally
To:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2,6, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
6IRCCS, Neuromed
* These authors contributed equally
Figure 1 was updated from:
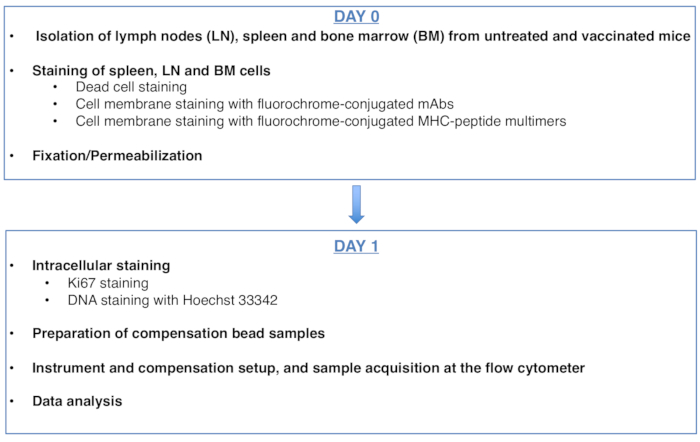
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
To:
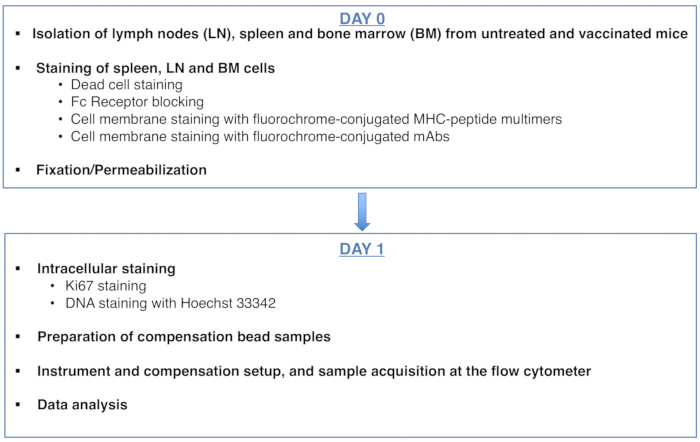
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.



